Luxnid 2/400 Mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADILUXNID 2/400 mcg inhalasyon için toz içeren kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler:Karmoterol hidroklorür*2,2 mcg 400 mcgSiklesonid*2 mcg Karmoterol'e eşdeğerYardımcı madde:Laktoz12,5978 mgYardımcı maddeler için 6.1'e bakınız.3. FARMASÖTİK FORMİnhalasyon için toz içeren kapsül.Kapak: Şeffaf Gövde: Natural transparan renk kapsül içerisinde beyaz toz.4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir.Orta ve ağır KOAH olgularında semptomları ve atak sıklığını azaltır.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:LUXN1D, yalnızca oral inhalasyon yoluyla kullanılmak içindir.İnhalasyon her gün, aynı saatte inhalasyon cihazı kullanılarak yapılmalıdır.LUXN1D akut astım ve KOAH ataklarında kullanılmaz. Akut ataklar meydana geldiğinde kısa etkili bir beta2LUXNID dozu hastanın kişisel ihtiyacına göre ayarlanmalı ve terapötik amaca ulaşılmasını sağlayan en düşük dozda uygulanmalıdır.AstımAstım hastalarında önerilen doz günde bir kez bir veya iki LUXNİD kapsül içeriğinin inhale edilmesidir.Hastalık semptomları LUXN1D ile tedaviye başlandıktan sonraki ilk 24 saat içinde düzelmeye başlar. Astım kontrol altına alındıktan sonra LUXN1D'in dozu hastanın bireysel durumuna göre şekillendirilir ve hastalığın iyi bir şekilde kontrol edilebileceği minimum idame dozu tercih edilir.Astım yakınmaları şiddetli olan hastalarda akut atak riski mevcut olup bu hastaların akciğer fonksiyon testleri de dahil olmak üzere muayenelerini düzenli şekilde sürdürmeleri gerekir. Astım semptomlarını gidermeye yönelik kısa etkili bronkodilatör kullanımının artışı hastalığın kontrolünde bozulma olduğuna işaret eder. Kısa etkili bronkodilatör kullanımının hastaya sağladığı rahatlama azalmış ise ya da eskisinden daha fazla sayıda inhalasyona ihtiyacı söz konusu olmaya başladıysa hekime başvurulması zorunludur.Bu durumda hastanın antienflamatuvar tedavinin arttırılması yönündeki ihtiyacı göz önünde bulundurularak tekrar değerlendirilmesi gerekir (örn. LUXNİD dozunun arttırılması ya da oral kortikosteroid tedavisine geçilmesi). Ciddi astım alevlenmeleri olağan şekilde tedavi edilmelidir.KOAHKOAH hastalarında önerilen doz günde bir kez bir veya iki LUXNİD kapsül içeriğinin inhale edilmesidir.Uygulama şekli:LUXN1D, sadece oral inhalasyon içindir.LUXN1D inhalasyon tozu kapsülleri yalnızca kutudan çıkan cihaz ile tatbik edilmelidir. İnhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir.Olası bir kandida enfeksiyonu riskini azaltmak için her doz uygulamasından sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir. Ayrıca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskinin azaltılmasına muhtemelen yardımcı olabilir.İlacın akciğerlerdeki hedef bölgelere ulaşabilmesi ve uygun şekilde kullanıldığından emin olunması için doktor veya bir başka sağlık personeli kullanım talimatına uygun olarak cihazın nasıl kullanılacağını hastalara öğretmeli ve göstermeli, kapsüllerin sadece cihaz aracılığıyla inhalasyon yolu ile uygulanması gerektiği ve yutulmaması konusunda hastayı uyarmalıdır.Hastaların jelatin kapsülün parçalanabileceğim ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.Kapsüller blister ambalajından kullanımdan hemen önce çıkarılmalıdır.Kullanıma ilişkin detaylı bilgi kullanma talimatında mevcuttur. İnhalasyon cihazının doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz.Inhalasyon cihazı kullanım talimatları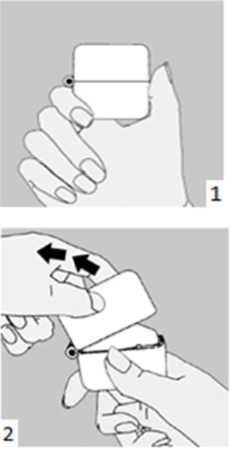 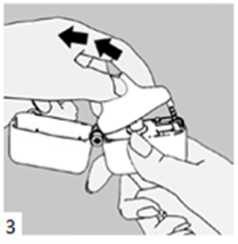
1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.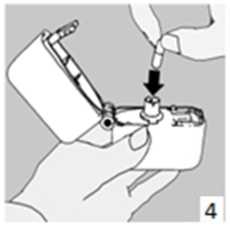
4. Blister ambalajından bir LUXNİD inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.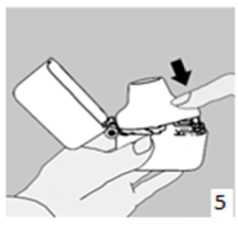
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.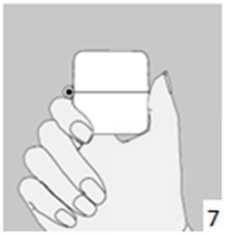 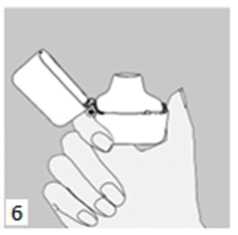
6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır.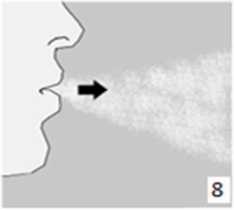
8. Nefesinizi tam olarak veriniz.Önemli: Hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz.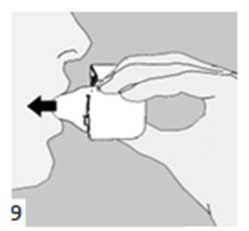
9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz. Basamak 8 ve 9'u bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır.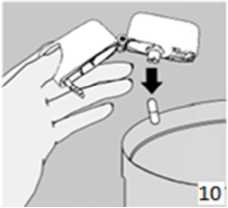
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldırınız.inhalasyon cihazını temizleme işlemiİnhalasyon cihazını ayda bir kez yıkayınız. Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan arındırınız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerinde kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. Kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:LUXN1D'in içeriğindeki karmoterolün böbrek veya karaciğer yetmezliği olan hastalarda kullanımına yönelik veri mevcut değildir. LUXN1D'in içeriğindeki siklesonid için karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez. Ancak, ağır karaciğer yetmezliği ve böbrek yetmezliğinde ilaç dozuna ilişkin yeterli veri bulunmamaktadır.Pediyatrik popülasyon:Pediyatrik popülasyonda (18 yaş altı) karmoterol kullanımına yönelik veri mevcut değildir. Bu nedenle LUXN1D'in pediyatrik popülasyonda kullanılmaması önerilir.Geriyatrik popülasyon:LUXN1D'in içeriğindeki siklesonid için geriyatrik popülasyonda doz ayarlanması gerekmemekle birlikte karmoterolün bu yaş grubunda kullanımına yönelik veri mevcut değildir.4.3. KontrendikasyonlarLUXN1D karmoterole, siklesonide ve/veya ürünün içindeki yardımcı madde laktoza karşı aşırı duyarlılığı olan hastalarda kontrendikedir.LUXN1D inhale bir kortikosteroid olan siklesonid içermektedir. Diğer tüm inhale kortikosteroid içeren ilaçlarda olduğu gibi LUXN1D de, aktif veya semptomsuz akciğer tüberkülozu olan ya da fungal, virütik veya bakteriyel enfeksiyonu bulunan hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriKarmoterol hidroklorürKarmoterol; astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.LUXNlD'in içeriğindeki karmoterol, uzun etkili beta2LUXN1D başka bir uzun etkili beta2LUXN1D, astımda ilk tedavi seçeneği olarak kullanılmamalıdır. LUXN1D, hafif astım hastalığının başlangıç tedavisi olarak önerilmez.Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır.Antienflamatuvar tedavi:Astım hastalarını tedavi ederken uzun etkili bir betaagonist (LABA) olan karmoterol, tek başına bir inhale kortikosteroid ile yeterli düzeyde kontrol edilemeyen ya da hastalığının şiddeti bir LABA ve inhale kortikosteroidin her ikisi ile tedavinin başlatılmasını kesin olarak gerektiren hastalarda bir inhale kortikosteroide ilave tedavi olarak kullanılmalıdır.Günlük LUXN1D dozu, önerilen maksimum dozu aşmamalıdır.Astım semptomları kontrol altına alındıktan sonra, karmoterol dozunun kademeli olarak azaltılması düşünülmelidir. Tedavinin azaltılması sırasında hastalar yakından izlenmeli ve en düşük dozda karmoterol içeren etkin LUXN1D dozu kullanılmalıdır.Hastalığın kötüleşmesi:LUXNİD, akut bronkospazm epizodlarının tedavisi için (yani kurtarma tedavisi olarak) endike değildir. LUXNİD tedavisi sırasında KOAH'ta kötüleşme görülürse hastanın ve KOAH tedavi rejiminin tekrar değerlendirilmesi gerekir.Astım atakları:Semptomlar devam ettiği takdirde, doktorlar böyle bir gelişmenin genellikle altta yatan durumun kötüleştiğini gösteriyor olması nedeniyle kullanılan astım tedavisini yeniden değerlendirmelidir.Astım alevlenmesi esnasında LUXNİD tedavisine başlanmamalı ya da doz arttırılmamalıdır. Hastalar alevlenme döneminde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır.LUXNİD, akut astım semptomlarının rahatlatılması için kullanılmamalıdır. Akut ataklarda kısa etkili bir beta2Kardiyovasküler etkiler ve eşlik eden şartlar:LUXNİD kullanan hastalarda aşağıdaki durumların varlığında, özellikle doz sınırları konusunda olmak üzere, özel dikkat ve denetleme gereklidir: İskemik kalp hastalığı, kardiyak aritmiler (özellikle üçüncü derece atriyoventriküler blok), şiddetli kardiyak dekompansasyon, idiyopatik subvalvüler aortik stenoz, şiddetli hipertansiyon, anevrizma, feokromositoma, hipertrofik obstrüktif kardiyomiyopati, tirotoksikoz, QT aralığında bilinen veya şüphe edilen uzama (QTc >0.44 saniye; Bkz. Bölüm 4.5). Bu tür etkiler olursa tedavinin kesilmesi gerekebilir.Daha önceden kardiyak problemleri bulunan ve teofilin ile karmoterolü bir arada kullanan hastalarda dikkatli olunmalıdır.Hiperglisemi:LUXNID, beta2 uyarıcı olan karmoterol içermektedir. Beta2Hipokalemi:LUXN1D, beta2Paradoksal bronkospazm:Diğer inhalasyon tedavilerinde olduğu gibi yaşamı tehdit edebilen paradoksal bronkospazm ihtimali akılda tutulmalıdır. Böyle bir durum görüldüğünde, LUXN1D tedavisi derhal kesilmeli ve alternatif tedavi başlatılmalıdır.Karmoterol gibi uzun etkili beta2-agonistler kullanılırken, özellikle astım ile ilgili advers olaylar bakımından, bu ilaç başlandıktan sonra ilk üç ay hastalar yakından takip edilmelidir.SiklesonidDiğer tüm inhale kortikosteroid içeren ilaçlarda olduğu gibi, LUXN1D de, status astmatikus ve diğer yoğun bakım gerektiren acil durumların tedavisinde endike değildir.Diğer tüm inhale kortikosteroid içeren ilaçlarda olduğu gibi, LUXN1D de, inhale kısa etkili bir bronkodilatörün gerekli olduğu akut astım semptomlarının giderilmesi amacıyla kullanılamaz. Hastalara bu gibi acil durumlara uygun ilaçları hazır bulundurmaları gerektiği konusunda bilgi verilmelidir.İnhale kortikosteroidlerin özellikle yüksek dozda ve uzun süreli kullanımlarında sistemik etkileri ortaya çıkabilmektedir. Ancak, oral yoldan kullanılan kortikosteroidlere kıyasla bu gibi durumların meydana gelme ihtimali çok daha azdır. Olası sistemik etkilerin arasında böbrek üstü bezi salgısında azalma, çocuk ve genç ergenlerde büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt ve glokom gibi durumlar yer almaktadır. Bu yüzden LUXN1D dozunun, astım kontrolünü sağlayabilen en düşük dozda siklesonid içeren etkin LUXN1D dozuna ayarlanmış olması önem taşımaktadır.Herhangi bir girişim öncesinde inhale kortikosteroidleri özellikle yüksek dozda ve uzun süreli kullanan hastaların böbrek üstü bezi yetersizliği açısından uzman gözetimine alınması gerekebilir. Böbrek üstü bezindeki bozulmanın kalıntıları olabileceği göz önüne alınarak tıbbi ya da cerrahi aciller veya stres oluşturan planlı girişimler söz konusu olduğunda bu hastalara uygun kortikosteroid tedavisine başlanmalıdır.Oral kortikosteroid kullanan hastalarda inhale siklesonid içeren LUXN1D tedavisine geçilmesi hakkında:Oral steroid bağımlı hastaların LUXN1D tedavisine geçilmesi ve bu hastaların daha sonraki tedavileri özel bakım gerektirir; çünkü uzun süren sistemik kortikosteroid kullanımı nedeniyle böbrek üstü bezi fonksiyonlarındaki bozukluğun iyileşmesi uzun zaman alabilir.Uzun süredir ya da yüksek dozda sistemik steroid kullanmış olan hastaların böbrek üstü bezi fonksiyonları baskılanmış olabilir. Bu hastaların böbrek üstü bezi fonksiyonları düzenli olarak kontrol edilerek, kullandıkları sistemik steroid dozu dikkatle azaltılmalıdır.Sistemik steroidin kademeli bir şekilde bırakılması amacıyla mevcut doz her hafta 1 mg prednizolon veya diğer türevlerin buna eşdeğer olacak miktarı şeklinde hesaplanarak azaltma süreci başlatılır. Prednizolon idame dozunun günlük 10 mg'ı aştığı olgularda daha büyük dilimler halinde haftalık azalışlar da uygun olabilir.Bazı hastalar bu kademeli bırakma aşamalarında solunum fonksiyonları değişmediği ve hatta düzeldiği halde kendilerini bir şekilde kötü hissetmektedir. Bu gibi hastaları eğer böbrek üstü bezi yetmezliğine ait objektif bulguları yoksa, LUXN1D kullanmaya ve de sistemik steroid tedavisini bırakmaya azimle devam etmeleri konusunda cesaretlendirmek gerekir.Böbrek üstü fonksiyonları hala düzelmemiş olan oral steroid tedaviden LUXN1D tedavisine geçilmiş hastaların stres dönemlerinde (örn. astım ataklarının sıklaşması, torakal enfeksiyonlar, araya giren ciddi hastalık, cerrahi girişim, travma, vb.) ilave sistemik steroid kullanmalarının gerekli olduğunu belgeleyen uyarı/bilgi kartlarını taşımaları gerekir.Sistemik steroid tedavinin yerine inhale tedavinin başlatılması bazen alerjik rinit ya da egzama gibi evvelce sistemik ilaç ile kontrol edilmiş bulunan alerjileri açığa çıkarabilir.İnhale kortikosteroid uygulamasının hemen ardından artan hırıltılı solunum gibi paradoksal bronkospazm ve bronkospazmın diğer semptomları genellikle hızlı şifa sağlayan inhale kısa etkili bronkodilatör ile tedavi edilmelidir. Hasta muayene edilip değerlendirilmeli ve LUXNİD tedavisi ancak beklenen faydanın olası riski aşması halinde sürdürülmelidir. Astım tablosunun ciddiyeti ile akut bronşiyal reaksiyonların sebep olduğu genel hassasiyet artışı arasındaki ilinti göz önünde bulundurulmalıdır (Bkz. Bölüm 4.8).Laktoz uyarısıLUXNİD yardımcı madde olarak laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKarmoterol hidroklorürDiğer beta-agonistleri gibi karmoterol de; kinidin, disopiramid, prokainamid, fenotiyazinler, antihistaminikler, makrolidler, monoamin oksidaz inhibitörleri ve trisiklik antidepresanlar gibi ilaçlarla veya QTc aralığını uzattığı bilinen herhangi bir ilaçla birlikte dikkatli kullanılmalıdır. Çünkü bu ilaçlar, adrenerjik agonistlerin kardiyovasküler sistem üzerindeki etkilerini güçlendirebilir. QTc aralığını uzattığı bilinen ilaçlara ventriküler aritmi eşlik etme riski artar (Bkz. Bölüm 4.4).Diğer sempatomimetik maddelerin birlikte verilmesi, LUXNID'in istenmeyen etkilerini güçlendirebilir. Atomoksetin karmoterolden kaynaklanan taşikardiyi arttırabilir.Ksantin türevleri (örn, teofilin), steroidler (örn, prednizolon) veya diüretikler ile birlikte tedavi beta2Halojenli hidrokarbonlarla eşzamanlı anestezi alan hastalarda aritmi riski artmaktadır.Beta-adrenerjik blokörler (örn, propranolol) LUXNID'in etkisini zayıflatabilirler veya antagonize edebilirler. Bu yüzden LUXNID, zorunlu olmadıkça, beta-adrenerjik blokörler (timolol içeren göz damlaları dahil) ile birlikte verilmemelidir.Karmoterol, beta-blokörlerin (beta1Antikolinerjik ilaçlar karmoterolün bronkodilatör etkisini arttırabilir.SiklesonidCYP3A4,in vitroverilere göre, siklesonidin aktif metaboliti olan Ml'in metabolizmasından sorumlu en önemli enzimdir.Siklesonid ve aktif metaboliti olan M1'in serum düzeyleri düşüktür. Ancak, CYP3A4 sisteminin güçlü inhibitörlerinin (örneğin itrakonazol, ritonavir ya da nelfinovir) eş zamanlı olarak kullanımı, siklesonid/M1 düzeylerinde artmaya neden olabilir. Klinik açıdan önemli olabilecek istenmeyen etki riski gözardı edilmemelidir.Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yürütülmemiştir.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınların tedavi süresince etkin doğum kontrol (kontrasepsiyon) yöntemleri uygulaması önerilmektedir.Gebelik dönemiLUXNID'in içeriğindeki karmoterol ve siklesonid ile hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.Hayvan çalışmalarında glukokortikoidlerin malformasyonlara sebep olduğu gösterilmiştir (Bkz. Bölüm 5.3). Ancak, bu sonuçların insanlara önerilen dozlarda oluşabilmesi mümkün görünmemektedir.Gebeliği sırasında kortikosteroid kullanmış olan annelerin bebekleri, hipoadrenalizm açısından dikkatle izlenmelidir.Diğer glukokortikoidler gibi siklesonidi de gebelik sırasında ancak fetüs için olan potansiyel riskinin anneye sağladığı potansiyel fayda tarafından karşılanması durumunda kullanmak gerekir. Yeterli astım kontrolünü sağlayabilen en düşük dozda siklesonid içeren etkin LUXNID dozu kullanılmalıdır.LUXNID gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Laktasyon dönemiLUXNID'in içeriğindeki karmoterol ve siklesonidin anne sütüne geçişi hakkında bilgi mevcut değildir. Emzirmenin durdurulup durdurulmayacağına ya da LUXNID tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve LUXNİD tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği/FertiliteLUXNlD'in üreme yeteneği/fertilite üzerindeki etkileri ile ilgili veri mevcut değildir.4.7. Araç ve makine kullanımı üzerindeki etkilerLUXNlD'in araç ve makine kullanımı üzerindeki etkileri bilinmemektedir. LUXNİD kullanımı sırasında baş dönmesi veya buna benzer yan etkiler gelişen hastalara araç veya makine kullanmamaları önerilmelidir.4.8. İstenmeyen etkilerKarmoterol hidroklorürPersistan astım hastalarıyla gerçekleştirilen randomize, çift-kör, 3 kollu paralel grup çalışmasında HFA pMDI (itici gaz içeren basınçlı doz inhaleri) ile sabahları günde bir kez uygulanan 2 mcg (2x1 mcg ölçülü doz) karmoterol ile gözlenen istenmeyen etkiler; baş ağrısı ve tremor olmuştur. Vital bulgular, serum potasyum seviyelerindeki değişimler ve QTc aralığı üzerindeki etkiler plasebodan anlamlı oranda farklı olmamıştır.278 KOAH hastasında üç farklı karmoterol dozunun (1, 2 ve 4 mcg) etkinliğinin araştırıldığı 2 haftalık bir çalışmada daha düşük dozlara göre 4 mcg karmoterol dozu sinir sisteminde daha fazla advers olay (baş ağrısı ve tremor bildirmiştir) ile ilişkili olmuştur. Daha düşük karmoterol dozları öksürük ve dispne ile ilişkili olmuştur. EKG bulguları, kan basıncı, serum potasyumu veya glukoz seviyelerinde plasebo ile kıyaslandığında anlamlı değişime yol açmamıştır.Bununla birlikte karmoterol içeren LUXNID inhalasyonu ile diğer beta2Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Enfeksiyonlar ve enfestasyonlarBilinmiyor: Nazofarenjit, üst solunum yolu enfeksiyonu, sinüzit Bağışıklık sistemi hastalıklarıBilinmiyor: Aşırı duyarlılık (hipotansiyon, ürtiker, anjiyonörotik ödem, kaşıntı, egzantem dahil) Psikiyatrik hastalıklarBilinmiyor: Ajitasyon, anksiyete, asabiyet, uykusuzluk, baş dönmesi, tat alma duyusu bozukluklarıSinir sistemi hastalıklarıBilinmiyor: Baş ağrısı, titreme, parestezi, vertigoKardiyak hastalıklarBilinmiyor: Palpitasyonlar, iskemik kalp hastalığı, taşikardi, elektrokardiyogramda QT uzaması, anjina pektoris, atriyal fibrilasyon gibi kardiyak aritmiler, ventriküler ekstrasistol, taşiaritmiSolunum, göğüs bozuklukları ve mediastinal hastalıklarBilinmiyor: Öksürük, orofaringeal ağrı, rinore, solunum yolu konjesyonu, paradoksal bronkospazm dahil bronkospazm, boğaz irritasyonu, akut astım alevlenmesi, dispneGastrointestinal hastalıklarBilinmiyor: Ağız kuruluğu, bulantıKas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıBilinmiyor: Kas spazmı, miyalji, kas-iskelet ağrısı, kas kramplarıMetabolizma ve beslenme hastalıklarıBilinmiyor: Hipokalemi, diyabet ve hiperglisemiDeri ve deri altı doku hastalıklarıBilinmiyor: Deri döküntüsüGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarBilinmiyor: Periferik ödem, göğüs ağrısı, kalple bağlantılı olmayan göğüs ağrısıAraştırmalarBilinmiyor: Kan basıncında artış (hipertansiyon dahil)SiklesonidSiklesonidin ve siklesonid ile tedavi edilen hastalarda bildirilen reaksiyonları içeren istenmeyen etkilerin sıklığı aşağıda listelenmiştir. Siklesonid ile gözlemlenen etkiler genellikle doz veya konsantrasyona bağlıdır.İstenmeyen etkiler aşağıdaki kategorilere göre listelenmiştir:Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Oral mantar enfeksiyonları*Psikiyatrik hastalıklarBilinmiyor: Psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon, agresyon, davranış değişiklikleri (özellikle çocuklarda)Bağışıklık sistemi hastalıklarıSeyrek : Anjiyoödem, hipersensitiviteSinir sistemi hastalıklarıYaygın olmayan: Baş ağrısı*Kardiyak hastalıklarSeyrek: Palpitasyonlar**Vasküler hastalıklarSeyrek: HipertansiyonSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Paradoksal bronkospazm*, inhalasyon sonrası öksürük*, disfoniGastrointestinal hastalıklarYaygın olmayan: Bulantı*, kusma*, kötü tat Seyrek: Karın ağrısı*, dispepsi*Deri ve deri altı doku hastalıklarıYaygın olmayan: Egzama, döküntüGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan: Uygulama bölgesinde reaksiyon ve kuruluk(*) Plasebo ile karşılaştırıldığında benzer veya daha düşük insidans(**) Klinik çalışmalarda, çoğunlukla bilinen kardiyak etkileri olan ilaçlarla (örn: teofilin veya salbutamol) birlikte kullanıldığı durumlarda, hangisinden kaynaklandığı belli olmayan palpitasyonlar meydana gelmiştir.Uygulamadan hemen sonra, tüm inhale ilaçlarda olan non-spesifik akut bir reaksiyon olarak, etkin madde veya yardımcı maddeden kaynaklanabilen paradoksal bronkospazm meydana gelebilir. Ciddi durumlarda LUXN1D tedavisinin durdurulması düşünülmelidir.İnhale kortikosteroidlere bağlı sistemik etkiler özellikle yüksek dozda ve uzun süreli kullanım söz konusu olduğunda oluşabilmektedir. Olası sistemik etkiler arasında Cushing sendromu, cushingoid özellikler, adrenal supresyon, çocuklar ve adolesanlarda büyümede gecikme, kemik mineral yoğunluğunda azalma, katarakt, glokom sayılabilir (Bkz. Bölüm 4.4.).4.9. Doz aşımı ve tedavisiKarmoterol hidroklorür Belirtiler:Karmoterolün aşırı dozuna bağlı olarak beta-adrenerjik uyarıcıların tipik etkilerinin görülmesi beklenir: bulantı, kusma, baş ağrısı, tremor, sedasyon, palpitasyonlar, taşikardi, ventriküler aritmiler, metabolik asidoz, hipokalemi, hiperglisemi, hipertansiyon.Tedavi:Destekleyici ve semptomatik tedavi uygulanır. Ciddi vakalarda hastalar hastaneye yatırılmalıdır.Kardiyoselektif beta-blokörlerin kullanılması düşünülebilir, fakat beta-adrenerjik blokör kullanımı bronkospazma neden olabileceğinden bu tedavi yalnızca doktor gözetimi altında ve çok dikkatli uygulanmalıdır.SiklesonidAkut:Tek doz halinde 2880 mikrogram siklesonid inhale etmiş sağlıklı gönüllüler tarafından oldukça iyi tolere edilmiştir.İnhale siklesonid aşırı dozunu takiben oluşabilecek akut toksik etki potansiyeli düşüktür. Akut doz aşımı söz konusu olduğunda hastaya özgün bir tedavi uygulamak gerekli değildir.Kronik:Siklesonidin 1280 mikrogram dozundaki uzun süreli kullanımında böbrek üstü bezinin baskılanması ile ilişkili klinik bulgulara rastlanmamıştır. Bununla birlikte, önerilen dozun aşıldığı uzun süreli kullanımlarda böbrek üstü bezinin bir miktar baskılanma ihtimali dışlanamaz. Bu durumda hastadaki böbrek üstü bezi rezervinin denetlenmesi gerekebilir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Obstrüktif Solunum Yolu Hastalıklarında Kullanılan İlaçlar (Selektif Beta--Adrenoreseptör Agonisti [Karmoterol], Glukokortikoidler [Siklesonid])ATC kodu:Karmoterol R03ACSiklesonid R03BA08Karmoterol hidroklorürKarmoterol çok uzun etkili yeni bir beta2 agonisttir. Çok uzun etkili beta2 agonistlerinin inhale kullanımı (örneğin karmoterol) bronkokonstriksiyonda yer alan mast hücrelerinin solunum yolu lümenine yakın olmasından dolayı oral kullanımına tercih edilmektedir. Karmoterol, beta2-reseptörü için oldukça güçlü ve seçici bir beta2 agonisttir (Karmoterol, beta2-reseptörüne beta1-reseptörüne göre 53 kat daha fazla afinite göstermektedir). Amino yan zincirinde p-metoksifenil grubu ve karbostiril aromatik halkasında 8-hidroksil grubu bulunan, nonkatekol beta2-adrenoseptör agonisti olan, hem formoterol hem de prokaterolden yapısal elemanlar taşıyan karmoterol, beta2in vitrohem dein vivodeneysel koşullarda hızlı etki başlangıcı ve uzun süreli etki göstermektedir. Hayvanlarla gerçekleştirilen çalışmalarda karmoterolün formoterolden ve salmeterolden daha güçlü bir etkiye sahip olduğu ve kalp kasına göre bronşiyal kaslara 100 kat daha fazla seçicilik gösterdiği belirtilmiştir.SiklesonidSiklesonidin vücuttaki glukokortikoid reseptörlerine bağlanma afinitesi düşüktür. Ağızdan inhalasyon yoluyla uygulanan siklesonid akciğer dokusuna ulaştıktan sonra enzim aracılığı ile esas metaboliti olan C21-des-metilpropionil-siklesonide (M1) dönüşür. Siklesonidin aktif metaboliti olan C21-des-metilpropionil-siklesonid güçlü lokal antienflamatuar etkinliğe sahiptir.Klinik etkinlikYapılan klinik çalışmalarda siklesonidin, yetişkinlerde 640 mikrogram dozlarda maksimal etkilerin gözlendiği aşırı duyarlı hastalardaki adenozin monofosfat ve metakoline bağlı hava yolu duyarlılığını azalttığı gösterilmiştir. Farklı bir çalışmada ise 7 gün süreyle siklesonid uygulanıp ardından inhale alerjen verilen grubun erken ve geç dönem hava yolu reaksiyonlarında anlamlı azalma sağlandığı saptanmıştır. İnhale siklesonid tedavisinin hastaların akciğer sekresyonlarındaki enflamatuar hücre (total eozinofil) ve enflamatuar mediyatör artışını azalttığı da gösterilmiştir.26 erişkin astımlı hastada yapılan kontrollü çalışmada 7 gün süreyle siklesonid tedavisinden sonraki plazma kortizol EAA (konsantrasyon-zaman eğrisi altındaki alan) değerlerinin 24 saatlik takipleri yapılmıştır. Plasebo ile kıyaslamalı olan bu çalışmada siklesonidin 320, 640 ve 1280 mikrogram/gün gibi muhtelif dozları plazma kortizol düzeyinin 24 saatlik ortalamalarında istatistiksel açıdan anlamlı düşüşe sebep olmadığı gibi, doza bağımlı bir etki de gözlenmemiştir.164 adet erişkin erkek ve kadın astımlı hastanın katıldığı bir klinik çalışmada siklesonid 12 hafta süreyle 320 ya da 640 mikrogram/gün dozunda uygulanmıştır. 12. haftanın sonunda hastalara 1 ya da 250 mikrogram kosintropin uygulanmış ve plasebo kullanan gruba kıyasla plazma kortizol düzeylerinde anlamlı değişiklik gözlenmemiştir.Erişkin, ergen ve çocuklarda, 12 hafta süren, çift kör ve plasebo kontrollü birçok çalışmada siklesonid ile tedavinin hastaların akciğer fonksiyonlarında sağladığı düzelme ölçülen FEV1 ve doruk ekspiryum akım hızı değerleri ile gösterilmiş olup astım semptomlarının kontrolündeki gelişmenin yanı sıra hastaların inhale beta-2Daha önce günde 500-1000 mikrogram flutikazon propiyonat veya eşdeğeri verilen 680 şiddetli, 12 yaş ve üzeri astım hastası ile yapılan 12 haftalık bir çalışmada, 160 veya 640 mikrogram siklesonid tedavisi sırasında hastaların sırasıyla %87,3 ve %93,3'ünde alevlenme görülmemiştir. 12 haftalık çalışmanın sonuçları, ilk günden sonra, 160 mikrogram/gün ve 640 mikrogram/gün siklesonid doz uygulamaları arasında alevlenme açısından istatistiksel olarak belirgin bir fark göstermiştir: 160 mikrogram/gün verilen 339 hastanın 43'ünde (%12,7) ve 640 mikrogram/gün verilen 341 hastanın 23'ünde (%6,7) alevlenme görülmüştür (Risk oranı: 0,523; p: 0,0134). Her iki doz, 12 hafta boyunca FEV15.2. Farmakokinetik özellikler Genel özelliklerEmilim:Karmoterol hidroklorürKarmoterolün tekrarlayan tedavi dozlarının ardından nonlineer birikiminin ihmal edilebilir olduğuna dair kanıt sağlanmıştır. İlginç şekilde hidrofloroalkan püskürtücü kullanılarak karmoterolün akciğerde birikimi nominal dozunun %41'ine ulaşılabilir. Hidrofloroalkan basınçlı dozimetre inhaler aerosolün partikül boyutunun küçük olması nedeniyle (0.8 p,m) karmoterolün akciğerde birikiminde sağlıklı bireyler, astımlı ve KOAH hastaları arasında anlamlı farklılıklar olduğu gösterilmemiştir.SiklesonidFarmakokinetik karakterizasyon çoğunlukla M1 üzerinden yapılmıştır.Radyoizotop ile işaretlenmiş siklesonid kullanarak yapılan oral ve intravenöz uygulamalarda oral emiliminin az olduğu (%24.5) gösterilmiştir. Siklesonid ve aktif metabolitinin oral biyoyararlanımları ihmal edilebilir düzeydedir (siklesonid <%0.5; metabolit <%1). y-sintigrafi yöntemi ile yapılan bir ölçüm ile sağlıklı gönüllülerin akciğer dokusundaki birikiminin, alınan dozun %52'si oranında olduğu gösterilmiştir. Siklesonidin ölçülü doz inhalasyon uygulaması sonrasında aktif metabolitin sistemik biyoyararlanımı %50'nin üzerindedir. Aktif metabolitin oral biyoyararlanımının %1'in altında olması nedeniyle inhale edilen siklesonidin ağızdan yutulan kısmının sistemik emilime herhangi bir katkısı yoktur.Dağılım:Karmoterol hidroklorür Veri mevcut değildir.SiklesonidSağlıklı gönüllülere intravenöz yoldan uygulanan siklesonidin başlangıç dağılım aşamasının hızlı olduğu saptanmıştır; bu durum, ilacın yüksek lipofilik özelliğiyle de uyumludur. Dağılım hacminin ortalama değeri 2.9 L/kg'dir. Siklesonidin total serum klerensi ilacın hepatik ekstraksiyonunun yüksek olduğuna işaret etmektedir (ortalama 2.0 L/sa/kg). Siklesonid ve aktif metaboliti neredeyse tamamen plazma proteinlerine bağlanmaktadır (%98-99).Biyotransformasyon:Karmoterol hidroklorürGerçekleştirilen çalışmalarda karmoterolün başlıca biyotransformasyon yolunun glukuronidasyon olduğu gösterilmiştir. Çalışmalar hem insan hem de sıçan akciğer ve karaciğer mikrozomlarında karmoterolün glukuronide dönüşümünün gerçekleştiğini ancak esas glukuronidasyonun karaciğerde meydana geldiğini göstermiştir. Mikrozom örneklerinde ve A549 hücrelerinde karmoterolün 2 ayrı glukuronidi saptanmıştır: fenolik ve benzilik glukuronid. İnsan karaciğer ve akciğer dokusunda bu detoksifikasyon yolunun ana metaboliti fenolik glukuroniddir. Farklı rekombinant insan UGT süperzomları ile karmoterolünin vitroinkübasyonu tüm esas UGT enzimlerinin karmoterolün glukuronide dönüşümünü sağlayabildiğini ve tüm izoformların benzilik glukuronid ile karşılaştırıldığında karmoterolü başlıca fenolik glukuronide metabolize ettiğini göstermiştir. UGT1A1, 1A6 ve 1A9 bu metabolik yolda en büyük role sahiptir.SiklesonidSiklesonid, akciğer dokusunda esteraz enzimleri aracılığıyla hidrolize edilerek biyolojik aktif metabolitine dönüştürülür. İnsan karaciğer mikrozomlarında uğradığı daha ileri metabolizma aşamaları enzimolojik olarak incelendiğinde, bu bileşiğin de daha sonra CYP3A4 tarafından katalizlenen inaktif hidroksillenmiş metabolitlere dönüştüğü saptanmıştır. Akciğerde ayrıca aktif metabolite ait reversibl lipofilik yağ asidi ester bileşiklerinin varlığı da saptanmıştır.Eliminasyon:Karmoterol hidroklorür Veri mevcut değildir.SiklesonidOral ve intravenöz uygulama sonrasında siklesonidin vücuttan esasen dışkı ile (%67) atıldığı ve atılımdaki esas yolun safra sistemi olduğu gösterilmiştir.Doğrusallık/doğrusal olmayan durum:Karmoterol hidroklorürSağlıklı gönüllüler ve astımlı hastalardan elde edilen bulgular karmoterol farmakokinetiğinin doz ile orantılı olduğunu göstermiştir.SiklesonidFarmakokinetiği lineerdir. Önerilen tedavi dozlarında; sistemik maruziyeti dozla orantılı artış gösterir.Hastalardaki karakteristik özelliklerKarmoterol hidroklorür Veri mevcut değildir.SiklesonidBöbrek yetmezliği:İlk ruhsat tarihi: 08.02.2014 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriLuxnid 2/400 Mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Karmoterol Hidroklorür/siklesonid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.