Xeplion 150mg/1,5ml IM Enjeksiyon İçin Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır Enjeksiyon Kısa Ürün BilgisiSinir Sistemi » Psikoleptikler (Psikolojik İlaçlar) » Antipsikotikler » Diğer İlaçlar » Paliperidon KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIXEPLION 150 mg/1.50 mİ I,M. enjeksiyon İçin uzun .salımh süspansiyon içeren kullanıma hazır enjektör2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her kullanıma hazır dolu enjektörün 1,50 mİ'sinde;Pahperidon paimilat 234 mg (150 mg pahperidona eşdeğer) Yardımcı maddeler:Her 1 ml'de;Anhidr disodyum hidrojen fosfat: 5 mg Sodyum dihidrojen fosfat monohidrat; 2,5 mg Sodyum hidroksit: 2,84 mg Diğer yardımcı maddeler için 6,1 'e bakınız. 3. FARMASÖTİK FORMKullanıma hazır enjektör İçinde uzun sahmiı süspansiyon Beyaz ile grimsi beyaz arası renkte süspansiyon.4. KLİNİK ÖZELLİKLER4.L Terapöük endikasyonlarXEPL[ON şizofreni tedavisi ve şizofreni semplomlarmın tekrarının önlenmesinde endikedir.4.2. Fozoloji ve uygulama şekli Pozoloji:Bugüne kadar paliperidon ya da risperidon kullanmamış hastalar için XEPLİON ile tedaviye başlanmadan önce, orai paliperidon veya orai rİsperidonun iolerabİiitesİnin kanıtlanması önerilir.XEPLION'un önerilen başlangıç dozu, terapölik konsantrasyonlara hızia ulaşılması amacıyla tedavinin birinci gününde !50 mg ve bir hafta sonra (8. gün) 100 mg'dır (her ikisi de deltoid kas içine uygiilann') (Bkz, Bölüm 5.2). Önerilen aylık idame dozu 75 mg'dır. Önerilen 25 mg iia 150 mg'Iık doz aralığında hastanın bireysel (olerabilitesine ve/veya elkiİilige göre bazı hastalar daha düşük ya da daha yüksek dozlardan yarar görebilir, ikinci dozu takiben aylık idame dozları deltoid veya gluieal kas içine uygulanabilir. Uygulama .sıklığı ve süresi:İdame dozunun ayarlanması ayda bir yapılabilir. XEPL10N'un uzatılmış salım Özelliği doz ayarlaması yaparken göz önüne almmahdır (Bkz. Bölüm 5,2); çünkü idame dozlarının tam etkisi birkaç ay ortaya çıkmayabilir.Uygulama şekli:XEPL10N, sadece intramüsküler kullanım için hazırlanmıştır. Kas içine yavaş ve derin olarak enjekce edilmelidir. Kan daman içine yanlışlıkla enjeksiyondan kaçmmak için dikkat edilmelidir. Her enjeksiyon bir sağlık uzmanı tarafından uygulanmalıdır. Uygulama lek bir enjeksiyon şeklinde yapılmalıdır. Doz, ayrı enjeksiyonlar şeklinde uygulanmamalsdır. (ntravasküler veya subkütan enjeksiyon uygulanmamalı d ir.XEPL10N'un deltoid kas içine uygulanması için önerilen iğne boyutu hastanın vücut ağırlığı ile belirlenir, 90 kg veya daha ağır olan hastalarda merkezi gri renkli (I 'Mnch 22 G {38. i mm X 0,72 liun)) güvenlik iğnesi önenlir, 90 kg'dan hafif olan hastalarda merkezi mavi renkli (1 inch 23 G (2^,4 HMii X 0.64 rriHii) güvenlik iğnesi önerilir. Deltoid enjeksiyonlar iki deltoid kas arasında değiştirilmelidir. XEPLION'tm gluteal kas içine uygulanması içİn önerilen iğne merkezi gri renkli (i inch 22 G (38.1 ınn) X 0,72 rnrn)) güvenlik iğnesidir. Uygulama gluteal bölgenin üst dış kadranı içine yapılmalıdır. Gluteal enjeksiyonlar, ikİ gluteal kas arasında değiştirilmelidir. Oral veya intnımüsküier ohırak ıjygulantın risperidon, değişen dcreceierde palipcridona metuboüze edilmektedir, Risperidon ya d:ı orai piiliperidon XEPLION ile eşzamanlı olarak kutlanılacaksa dikkatli olunmalıdır. Atlanan dozlar Dozların atlanmasının önlenmesi; XEPLION'un ikinci başlangıç dozunun İlk dozdan bir hafta sonra verilmesi önerilir. Doz atlanraasmı Önlemek için ikinci doz, bir lıaftahk (8. gün) zaman noktasından iki gün önce veya sonra verilebilir. Benzer şekilde, başlangıç rejiminden sonra üçüncü enjeksiyonun ve sonraki enjeksiyonların ayda bir verilmesi önerilir. Aylık dozun atlanmamasf için enjeksiyon, ayhk zaman noktasından yedi gün önce veya sonra verilebilir. İkinci XEPLION enjeksiyonu İçin hedef tarih (gün 8 ± 2 gün) atlanırsa, Önerilen yeniden başlangıç zamanı hastaya ilk enjeksiyonun uygulanmasmdan itibaren geçen süreye bağlıdır. Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra <4 hafta): İlk enjeksiyondan sonra 4 haftadan daha kısa bİr süre geçmişse, deltoid kas içine mümkün olan en kısa sürede 100 mg'hk ikinci enjeksiyon uygulanmalıdır, 75 mg'lık üçüncü XEPLION enjeksiyonu, ilk enjeksiyondan 5 hafta sonra deltoid ya da gluleal kas içine uygulanmalıdır (ikinci enjeksiyonun zamanlamasından bağımsız olarak). Daha sonra hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25mg ila 150 mg aralığındaki dehoİd ya da gluleal dozun normal aylık enjeksiyon siklusu takip edilmelidir.Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra 4-7 hafta): İlk XEPLION enjeksiyonundan sonra 4 ila 7 haftalık bİr süre geçmişse, doz uygulamasına aşağıdaki şekilde 100 mg'lık iki enjeksiyonla devam edilmelidir: 1. Mümkün olan en kısa sürede deltoid kas içine bİr enjeksiyon, 2. Bir hafta sonra bir kez daha deltoid kas içİne bir enjeksiyon, 3. Hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da giuteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi. Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra >7 hafta): ilk XEPLION enjeksiyonunun üzerinden yedi haftadan daha uzun bir süre geçmişse, doz uygulaması yukarıda Pozoloji bölümünde tarif edildiği şekilde başlatılır. Atlanan aylık idame dozu (1 ay - 6 hafta): Tedaviye başlandıktan sonra XEPLİON'un ayda bir enjeksiyon siklusu önerilir. Son enjeksiyondan sonra altı haftadan daha kısa bir süre geçmişse, daha önce stabilize olmuş doz, miimkütı o!an en erken mamanda uygulanmaiı ve bunu takiben ayda bir enjeksiyon yapilmaltdır. Atlanan ayiık idame dozu {>6 hafta - 6 ay): Son XEFLION enjeksiyonunun üzerinden altı haftadan daha uzun bir süre geçmişse Öneriler şu şekildedir: 25 mg ila 100 mg arasındaki dozlarla stabilize olan hastahır için: i. Mümkün olan en kısa .sürede hastanın daha önce stabilize olduğu ttynı dozda deltoid kas içine bir enjeksiyon, 2. Bir hafta sonra (8. gün) bir kez daha deltoid kas içine bir enjeksiyon (aynı doz), 3. Hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siki usunun sürdürülmesi, 150 mg ile stabilize olan hastalar için: 1. Mümkün olan en kısa sürede 100 mg dozda deltoid kas içine bir enjeksiyon, 2.Bir hafta sonra (8. gün) 100 mg dozda bir kez daha deltoid kas içine bir enjeksiyon,3. Hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25mg ila 150 mg arahğındakideltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi. Atlanan aylık idame dozu (>6 ay): XEPL10N'un son enjeksiyonunun Üzerinden altı aydan daha uzun bir süre geçmişse, yukarıda XEPLION'un önerilen başlangıç tedavisi için iarif edildiği şekilde doz uygulaması başlatılır. Diğer aniipsikotik ilaçlardan KEPLlON'a geçiş: Hastaların diğer antipsikotik ilaçlardan XEPLION'a geçişini ele alan veya XEPLION'un diğer antipsikotiklerle birlikte eşzamanlı kullanılması ile ilgili sistematik olarak toplanmış veri bulunmamaktadır. Bugüne kadar paliperidon ya da risperidon kullanmamış hastalar için XEPLION ile tedaviye başlanmadan önce, oral paliperidon veya oral risperidonun tolerabilitesi kanıtlanmalıdır. Oral antipsikotik ilaçlardan XEPLION'a geçiş: XEPL10N tedavisi başlanacağı zaman daha önce kullanılan oral antipsikotikler kesilebilir. KEPLION, yukarıda Bölüm 4.2'nİn başlangıcında tarif edildiği şekilde başlatılmalıdır. Uzun etkili enjektabl antipsikotik ilaçlardan XEPLION'a geçiş: Stabil hastalar uzun elkiii enjeklahi iinlipsikoEİk ilaçlardan XEPLION'a geçerken, XEPLİON tedavisi bir sonraki programlanmış enjeksiyon zamanmda başlanimalıdır. XEPLION bundan sonra ayda bir aralıklarla devam edilmeitdir. Yukarıda Bölüm 4,2'nin başlangıcında tarif edilen bir haftalık doz uygulaması başlatma rejimi gerekli değildir, RİSPERDAL^ CONSTA® İntramüsküler enjeksiyon için uzatılmış sahmlı süspansiyonun farklı dozlarında daha önce stabilize olmuş hastalar, ayda bir verilen dozlarla aşağıda tarif edildiği şekilde XEPLION ile idame tedavisi sırasında benzer paliperidon kararlı durum maruziyetine ulaşabilirler: Kararlı durumda benzer paliperidon maruziyetine ulaşmak için gerekli RİSPERDAL*^
Özel popülasyoniara ilişkin ek bilgiler:Böbrek yetmezliği: XEPL10N, böbrek yetmezliği olan hastalarda sistematik olarak İncelenmemiştir (Bkz. Bölüm 5.2). Hafif böbrek yetmezliği olan hastalarda (kreatinin klerensi >50 -- <80 ml/dak.), XEPLION'un önerilen başlangıç dozu, tedavinin birinci gününde 100 mg ve bir hafta sonra 75 mg'dır (her ikisi de deltoid kas içine uygulanır). Daha sonra deİloid veya giuteal kas içine hastanın bireysel toierabiliiesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığında ayda bir 50 mg uygulanır. Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPL10N önerilmez. Karacİğcr yetnıczliğiı XEPL10N, karaciğer yetmezliği olan hastalarda incelenmemiştir, Oral palipericİon ile yapılan çalışmaya göre hafif veya orta derece karaciğer yetmezliği olan hastalarda, doz ayarlamast gerekli değildir. Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir (Bkz, Bölüm 5.2), Bu hLisüiİLiRİLj dikkatli i)lui;!iKshdü'. Pedİyatrik popülasyon:XEPLION'un çocuklarda ve 18 yaşın altındaki hastalarda güvenliiiği ve etkinliği incelenmemiştir,Geriyatrik popülasyon:XbPLK.)N'iU5 eşkiüligi ve gişvenifilig! 65 yaş ibUs hasuilarda kaiiıthHinKMrnyiır,Genel olarak, böbrek fonksiyonu normal olan yaşlı hastalarda, XEPUON'un Önerilen dozu, böbrek fonksiyonu norma! olan genç erişkin hastalarda önerilen dozla aynıdır. Yaşlı hastalarda böbrek fonksiyonları azalabileceğinden, böbrek fonksiyonunun durumuna göre doz ayarlaması gerekebilir (Bkz. Bölüm 4,2). XEPLION, inme için risk faktörüne sahip demansii yaşlı hastalarda dikkatli kullanıimaiıdır (Bkz, Bölüm 4.4). DiğerXEPLION için cinsiyet, ırk veya sigara kullanımına bağlı olarak doz ayarlaması yapılması önerilmez {Gebe kadınlar ve emziren anneler için Bkz. Bölüm 4,6),4.3. KontrendİkasyonlarPaliperidon palmitat veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.Paliperidon, risperidonun aktif bir metabolili olduğu için XEPLION risperidona karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir. 4,4. Özel kullanım uyanları ve önlemleriQT AralığıDiğer antipsikotiklerle olduğu gibi, bilinen kartüyovaskiiler hastalığı olan veya ailesinde QT uzama öyküsü olan hastalarda ve QT aralığını uzattığı düşünülen diğer ilaçlar ite birlikte kullanılacağı durumlarda, XEPL10N reçetelenirkcn dikkatli olunmalıdır. Nönjlepıik nudign sendromHipertermi, kas rijiditesi, otonomik instabilite, bilinç değişikliği ve serum kreatinin fosfokinaz seviyelerinde yükselme ile karakterize olan nöroleptik malign sendrom'un (NMS), paliperidon da dahil; antipsikotik ilaçlar ile oluştuğu bildirilmiştir. Ek klinik belirtiler arasmda miyoglobülinüri (rabdomiyoliz) ve akut böbrek yetmezliği de bulunabilir. Eğer bir hastada NMS işaret eden bulgu ve semptomlar gelişirse, XEPLION da dahi! olmak üzere tüm antipsikotik ilaçlar kesilmelidir. Tardif DiskineziDopamin reseptör antagonisti özelliğine sahip ilaçlar, özellikle dil ve/veya yüzde, ritmik, istem dtşı hareketlerle karakterize olan tardif diskinezinin indüksiyonu ile İlişkili bulunmuştur. Eğer tardif diskinezinin bulgu ve semptomları ortaya çıkarsa, XEPL10N da dahil olmak üzere tüm antipsikotik ilaçların kesilmesi değerlendirilmelidir, HiperglisemiX.EI'I.J()N ile vaj;?Han klinik ç;shşnıalarüa seyş'ek olarak ghikoz;i bağh aclvers oiayhn', önı., kafi giukoz düzeyinde adış büdirinnişlir, l)iger ik>clarks okioğii giİ^L if^ysibcy ol:u5 ve dİLibejcs nıeİ[İ!lB gelişmesi açisüidan rrnk faktörleri nışıyan haskihırdn, uyguii klinik izleıne önerihr. Hiperprınakiirıenıi ¦Doku kültürt^ çalışn^alan rnenıe iiHiKklerinde hıicre hüyürnesinin prokiktiıı lararindan stimule edilebiŞeeeğİni İjelirtnıekledir, Kfinık ve epukniiyoNijik çahşıııaiarda anüpsikoıik kullanır»! ile ilişkisi işÇik bir şckikİe gösterilcn^e^niş da, iigili ubhj öyküsü oku? ha.slaSı?rda dikk;^üs okınaıas^ öncrünıekledir. Paliperidon pa[rni!;ı( olası prokıkniie bağh lüıiiöni oksn [lasialarda dikkıUİi kunanşhııaNdn': Kilo Atma Atipik antipsikotik kullanımıyla birlikte kilo ahmı gözlenmiştir. Kilonun klinik olarak izlenmesi tavsiye edilmekledir. Ortostatik hipotansiyonPal i peridon, alfa*blokör akti vitesinden dolayı bazt hastalarda ortostatik hipütans iyonu indükleyebilir. Ora! paliperidotı {INVEGA 3 mg, 6 mg, 9 mg ve 12 nıg) ile yapılan plasebo kontrollü, 6 haftalık, sabit dozlu üç çahşmanm birleştinlmiş verilerine göre, plasebo ile tedavi edilen deneklerin %0,8'ine karşılık oral paliperidon ile tedavi edilen deneklerin %2,5'inde ortostatik hipotansiyon bildirilmiştir. XEPLİON, bilinen kardiyovasküler hastalığı olan hastalarda (örn.; kalp yetmezliği, miyokart infarklüsü veya iskemi, ileti anormallikleri), serebrovasküler hastalığı veya hipotansiyona neden olabilecek durumlarda (Örn,; dehİdratasyon, hipovolemi ve antihipertansif ilaçlarla tedavi) dikkatli kullanılmahdır. NöbetlerXEPL10N, diğer antipsikotik ilaçlarda olduğu gibi nöbet öyküsü olan hastalarda veya nöbet eşiğini potansiyel olarak düşüren diğer koşulların bulunduğu hastalarda dikkatli kullanılmalıdır. Böbrek yeHıtezliğiPaliperidonun plazma konsantrasyonu, böbrek yetmezliği olan hastalarda artmıştır ve bu nedenle hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmektedir. Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreminin klerensi <50 ml/dak.) XEPLION önerilmez (Bkz. Bölüm 4,2 ve Bölüm 5.2). Karaciğer yetnıezliğiPaliperidon, ağır karaciğer yetmezliği olan hastalarda (Child-Pugh Smıf C) incelenmemiştir. Paliperidon, bu tür hastalarda kullanılıyorsa dikkatli olunması önerilir. Demansj olanItaslalarKonvaıısiyonül ve atipİk antipsikotik ilaçlar dcmansa bağlı psikozu olan yaşlı hastaların tedavisinde kutlunıldığında ölüm riskinde artışa neden olmaktadır.XBPLK)N O!;MI Y:IŞH HLTSTALARDA ÇAİIŞÜRNARVUŞUR, HıNIıJ IÇIN RISK I';YIİÖI1Ü DCıııANS?yaşli İKiskslarda dıkkaıH kul^HMhnahdsr.Genel moriülile17 kontrollü klinik çalışmanın mela-analizinde, risperidon, aripiprazol, olanzapin ve ketiapin dahil olmak üzere diğer atipik antipsikotik İlaçlarla tedavi edilen ve demansı olan yaşlı hastalarda, morSalite riski plaseboya kıyasla artmıştır. Risperidon ile tedavi edilen hastalarda, plasebo için %3.1 otan mortalite %4olmuştur.Serehrovaskiiler advers olaylarRandomtze pitısebo kontroilü klinik çalışmalarda, risperidon, aripiprazol ve olanzapİn gibi bazı atipik antipsikolik ilaçlarla tedavi edilen demanslı yaşlı hastalarda serebrovasküier advers olaylarda yaklaşık 3 kat artmış risk görül m üştür. Bu artmış riskin mekanizması bilinmemektedir. XEPL10N, İnme açısından risk faktörleri taşıyan demanslı yaşlı hastalarda dikkatli kunanılmalıdır. Lökopeni, NötropeniAgraniilositozXEPLION dahil olmak üzere, antipsikotik ajanlarla lökopenİ, nötropeni ve agranülosİtoz olayları bildirilmiştir. Pazariama sonrası denetim sırasmda agranülositoz çok nadiren {<1/10.000 hasta) bildirilmiştir. Klinik olarak anlamlı düzeyde düşük beyaz kan hücresi (WBC) sayımı veya ilaçla tetiklenmiş iökopeni/nötropeni öyküsüne sahip hastalar tedavinin ilk birkaç ayı boyunca izlenmeli ve ortada başka nedensel faktörler yokken WBC'de klinik olarak anlamlı bir düşüşe yönelik ilk belirtide XEPLION kullanımına son verilmesi düşünülmelidir. Klinik olarak anlamlı nötropenisi olan hastalar ateş veya diğer enfeksiyon semptomları veya belirtileri açısından dikkatle izlenmeli ve bu tür semptomlar veya belirtilerin ortaya çıkması halinde derhal tedavi edilmelidir. Şiddetli nötropenisi olan hastalar (mutlak nötrofil sayımı <1 X 10'^/L) XEPLION kullanımına son vermeli ve iyileşene kadar \VBC düzeylerini takip ettirmelidir. Venöz tromhoeıjıbaljk olayAntipsikotik ilaçlaria venöz tromboemboHk olaylar (VTE) bildirilmiştir. Antipsikotik ilaç tedavisi gören hastalarda çoğunlukla kazanılmış VTE risk faktörieri bulunduğu için, VTE için tüm olası risk faktörleri, XEPLION ile tedaviden önce ve tedavi süresince tanımlanmalı ve koruyucu önlemler aimmahdır, Parkhuon Hashtİıği ve Le\py Cisinıciklİ DemansParkinson hastalığı veya Lewy c i sime i kİ i demanslı hastalara XEPLION da dahil olmak üzere antipsikotik ilaçlar reçete edilirken doktorlar yarar risk değeriendirmesi yapmalıdır; çünkü her iki hasta grubunda da, antipsikotik ilaçlara karşı duyarlılığın artmış olması ile birlikte Nöroleptık Malign Sendrom riski artmış olabilir. Bu artmış duyariilığın belirtileri, ekstrapiramidal semptomlara ek olarak konfüzyon, obtundasyon, sık düşmeler ile biriikte postural instabilite olabilir. PriapizmAlfa-adrenerjik biokor etkileri oUm antipsikotik ilaçların (risperidon dahil), priapizmi indükledigi bildirilmiştir. Pazarlama sonrası gözetim esnasında paliperidon ile priapizm bildirilmiştir. Hastalar, priapizmtn 3-4 saat içinde düzelmemesi dunımunda acil tıbbi yardım almaları konusunda bilgilendirilmelidir (Bkz, Bölüm 4.8). Vücut ısısınuı kontrolüVücudun iç vücut ısısını düşürme yeteneğinin bozulması, antipsikotik ilaçlara bağlanmıştır. Aşırı egzersiz yapmak, aşırı sıcağa maruziyet, antikolinerjik aktivitesi olan ilaçların eş zamanlı uygulanması veya dehidratasyon bulunma.sı gibi iç vücut ısısında yükselmeye katkıda bulunabilecek koşulları olan hastalara XEPLION reçete edilirken dikkatli olunması önerilir. Aııtiemelifc etkiPaliperidon ile yapılan klinik öncesi çalışmalarda, antiemetik etki gözlenmiştir. Bu etki, eğer insanlarda oluşursa, bağırsak tıkanması. Reye sendromu ve beyin tümörü gibi durumları veya belli ilaçların aşın doz bulgu ve semptomlarını maskeleyebilir. UygulamaXEPLION'un kan daman içine kaza ile enjekte edilmesinin önlenmesi için dikkatli olunmalıdır. XEPLION her ml'sinde I mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. Sodyuma bağlı herhangi bir etki gözlenmez, 4.5, Diğer tıbbi ürünler İle etkileşimler ve diğer etkileşim şekilleriXEPLION'un QT aniliğini uzattığı bilinen ilaçlar, örn,; sınıf lA antiaritmikler (örn,; kinİdin, disopramid) ve sınıf III antiaritmikler (örn,; amiodaron, sotalol), bazı antihistaminikler, bazı diğer antipsikotik ilaçlar ve bazı antimaiaryalier (öm,; meflokin) ile birlikte reçete ederken dikkatli olunması önerilir,Paliperidon palmiiat, palipcridona hidroliz olduğu için (Bkz, Bölüm 5,2), ilaç-ilaç etkileşim potansiyeli değerlendirilirken oral paliperidon ile yapılan çalışmaların bulguları göz önünde bulundurulmalıdır. XEPL10N'un diğer ilaçları etkileme potansiyeli Paliperidonım, sitokrom P-430 izoenzitnleri ile metabolizc olan ilaçlar ile klinik açıdan önemli farmakokinetik etkileşimlere neden olması beklenmemektedir. İnsan karaciğer mikrozomlarmda yapılan in viiroçalışmalar, paliperi donun, CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2Eİ, CYP3A4 ve CYP3A5 de dahi! olmak üzere sitokrom P450 izoenzİmleri tarafından metabolize edilen ilaçların metabolizmasını önemli derecede baskılamadığını göstermiştir. Bu nedenle, paliperidoııun, bu metabolik yolaklarla metabolize edilen ilaçların klerensini klinik açıdan belirgin bir biçimde baskdaması beklenmemekledir. Paliperidonun, ayrıca enzim indükleyici özelliklerinin olması beklenmemektedir.Faliperidon, yüksek konsantrasyonlarda P-glikoproteinin (P-gp) zayıf bir inhibitörüdür. In vivoveri mevcut değildir ve klinik açıdan ilişki bilinmemekledir.Paliperidonun santral sinir sistemi üzerindeki primer etkileri ele alındığında (Bkz. Bölüm 4.8), XEPLION diğer santral etkili ilaçlar, örn.; anksiyolitikler, antipsikotİklerin çoğu, hipnotikler, opiaıiar, vb, veya alkol ile birlikte dikkatli kullanılmalıdır, Paliperidon, levodopa ve diğer dopamin agonistlerinin etkilerini antagonize edebilir. Bu kombinasyonun gerekli olduğuna karar verilirse, özellikle .son evre Parkinson hastalığında her bir tedaviye ilişkin en düşük etkili doz reçete edilmelidir. Ortoslatik hipotansiyonu indükleme potansiyeli nedeni ile (Bkz. Bölüm 4.4), XEPLION bu potansiyele .sahİp olan dİğer terapöiik ilaçlar, örn.; diğer antipsikotik ilaçlar, trisiklikler ile biriikte uygulandığı zaman aditif etki gözlenebilir. Paliperidon nöbet eşiğini düşürdüğü bilinen diğer ilaçlar ile biriikte kombine edilirse dikkatli olunması önerilir (yani fenotiyazinler veya butirofenonlar, trisiklikler veya SSRI'lar, tramadol, mellokin, vb.). Kararlı durumdaki oral uzatılmış .salimli paliperidon tabletlerin (günde bir kez 12 mg) uzatılmsş salimli divalproeks sodyum labletlerie (günde bir kez 500 mg ila 2000 mg) eşzamanlı olarak uygulanması, valproaün kararlı durum farmakokinetiğini etkilememişdr. XEPL10N ve lityum arasmda farmakokİnetik etkileşim olası değildir. Diğer İlaçların XEPLION'u etkileme potansiyelleri Paliperidon, CYP1A2, CYP2A6, CYP2C9, CYP2C19 ve CYP3A5'in bir substratı değildir. Bu durum, bu izoenzimlerin inhİbitörleri veya indükleyicileri ile bir etkileşimin olası olmadığını düşündürmektedir, In vitmin vüroin vivoIn vitroçalışmalar, paliperidonun bir P*gp substralı olduğunu göstermiştir.Paliperidon, CYP2D6 ile kısıtlı derecede metabolize edilir (Bkz, Bölüm 5.2). Sağlıklı gönüllülerde yapılan bir etkileşme çalışmasında, onıl palıperidonun güçlü bir CYP2D6 inhibitürü olan paraksetinle birlikte uygulanması sonucu paliperidonun farmakokİnetiği üzerinde klinik açıdan belirgin bir etki gözlenmemiştir. Günde bİr kere uygulanan uzııtılmış salimli oral paliperidonun günde ikİ kere 200 mg karbamazeptn ile birlikte uygulanması, paliperidonun ortalama kararlı durum ve EAA değerlerinde yaklaşık olarak %37 oranmda bir düşüşe netlen olmuştur. Bu düşüş, büyük ölçüde, karbamazepİn tarafından renal P-gp'nin indüklenmesinin bir sonucu olarak paliperidonun renal klerensinde %35oranında artışa bağlıdır. Karbamazepinin eş zamanlı olarak uygulanması esnasında, idrarla değişmeden atılan ilaç miktarında minör bir azalma, paliperidonun CYP metabolizması veya biyoyararlanımı üzerinde düşük derecede etki olduğunu düşündürmektedir. Karbamazepİn kullammma başlandığında XEPLION dozu yeniden değerlendirilmeli ve gerekirse arttırdmalıdır. Bu durumun tersine, karbamazepİn kullanımı kesildiğinde XEPL10N dozu yeniden değerlendirilmeli ve gerekirse azaltılmalıdır.Fizyolojik pH koşullarında bir katyon olan paliperidon, yaklaşık olarak yarısı filirasyon, yarısı aktif sekresyon yolu ile primer olarak değişmeden böbreklerden atılır. Böbrekte katyonİk ilaçların aktif taşınmasını baskıladığı bilinen bir ilaç olan trimetroprimin eş zamanlı olarak uygulanması, paliperidonun farnıakokİnetiğini etkilememiştir. 12 mg oral uzatılmış salimli paliperidon tabletin tekli bir dozunun, uzatılmış salimli divalproeks sodyum tabletlerle (günde bir kez ikİ 500 mg'lık tablet) eşzamanlı olarak uygulanması muhtemelen artmış ora! absorpsiyonun bir sonucu olarak paliperidonun C,.,ax ve EAA'smda yaklaşık %50'lİk bir artışla sonuçlanmıştır. Sislemik klerenste herhangi bir etki gözlenmediğinden, uzatılmış salimli divalproeks .sodyum tabletler ve XEPLION'un intramü.sküler enjeksiyonu arasında klinik olarak anlamlı bir etkileşim beklenmemekledir. Bu etkileşim XEPLION ile çalışılmamıştır, XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir, XEPLION'un Ri.speridon ile birlikte kullanımı XEPLION'un ri.speridon ile birlikte kullanımı incelenmemiştir. Paliperidon, ri.speridonun aktif bir metaboliti olduğu için risperidon XEPLION ile birlikle kullanılacaksa, aditif paliperidon maruziyeti göz önüne alınmalıdır. 4.6, Gebelik ve İaktasyoiı Genel tavsiye Gebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir. (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebelik dönemi XEPLION'un gebe kadınlarda ku!lanımına ilişkin yeterli veri mevcut değildir, XEPL10N, kesin gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Yüksek doz ora! paliperidon ile tedavi edÜen laboratuar hayvanlarında fetal ölümlerde hafif bir artış görülmüştür. İntramüsküler enjeksiyonla paliperidon palmitat uygulanan sıçanlarda, gebelik parametreleri etkilenmemiştir. Yük.sek dozlar, anneler için toksik olmuştur. Maksimum insan maruziyetinin 20-22 katı daha yüksek olan oral dozlar veya maksimum insan maruziyetinin 6 katı daha yüksek intramüsküler dozlar, fetüsü etkilememiştir. XEPLION'un insanda doğum sancısı ve doğum üzerindeki etkisi bilinmemektedir. Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (paliperidon da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti değişebilen, anormal kas harekeden (eksErapiramidal işaretler/ekstrapiramidal semptomlar) ve/veya ilaç kesilme semptomları açısından risk altındadıriar. Bu semptomlar, ajitasyon, hipertoni, hipotoni, tremor, somnolans, respiraiuar distres veya beslenme bozukluklarmı içermektedir. Laktasyon dönemi Paliperidon anne süsü ile atılmaktadır (süte geçmektedir). XEPL10N emzirme döneminde kullanılmamalıdır. Üreme yeteneği/Fertilite Oral paliperidon tedavisi, prolaktin- ve santra! sinir sistemi- aractİ! etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların feriilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo sayısında çok az bir düşüş göstermiştir. 4.7. Araç ve makine kullanınıı üzerindeki etkilerXEPLION, zihin :ıçıklıgı gerektiren :ıktivitelere engel olabilir ve scdasyon,s.oınnoh.ms..st'jıkofi ve hEs]:Kuk görme gşbi görsel etkilere neden olabilir (Bkz, Bölüm 4.8), Bu nedenle hastalar, XEPLION'a karşı bireysel duyariilıkkırı bilinene kadar anıç veya makine kullanmamaları konusunda uyarılmalıdır.4.8. İstenmeyen etkilerKlinik çalışmalarda en sık bildirilen advers ilaç reaksiyonları (ADR'ler) insomnia, baş ağrısı, kilo alımı, enjeksiyon bölgesi reaksiyonları, ajitasyon, somnoİans, akatİzi, bulantı, konstipasyon, sersemlik, tremor, kusma, üst solum yolu enfeksiyonu, diyare ve taşikardidir. Bu advers ilaç reaksiyonları arasından akatizi dozla ilişkili olarak ortaya çıkmaktadır.Aşağıda verilen tüm ADR'ler klinik çalışmalarda XEPLION ile tedavi edilen hastalardan bildirilen reaksiyonlardır. Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10); yaygın (>i/l00 ile <1/10); yaygın olmayan (>1/1000 ile <1/100); seyrek (>1/10.000 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
paliperidon ile biidirlletı ek advers ilaç reaksiyonları
perüiaıal hası.ahkian BoKinı 4.6)Üre[!?e skleitii ve jı^erne Seyrek: Meme angorinşanE, iiıesnc ağni,L nıenıe ha?,üihkl:yı hass;.LHİyen, reirognid ej;ikükEsyon Bilnyııiyor: Priapiznı_Gene[ bo/ukluklar ve uygoiaıı^a Yaygın olmayan: Perii'eral ödem böleeNİne ilişkin huslaliklar ^ i i Uzun dönemde niiksü önieme çalışmasmın 33 hatUiiık açık etiketli geçiş/idame dönemi esnasında, XEPL10N ile tedavi edilen deneklerin %12'si bu kritere uymuştur (çift-kör fazından son noktaya kadar >%7 kilo artışı); açık etiketli başlangıca göre ortalama {SD) ağırlık değişikliği +Ü.7 (4.79) kg olmuştur. Laboratuar testleri Serum prolaktin: XEPL10N alan deneklerde her iki cinsiyette de, serum prolaktın düzeyinde ortalama artışlar gözlenmiştir. 13 haftalık, çift kör, plasebo kontrollü üç çalışmadan eide edilen verilere göre, prolaktin düzeylerinde artışı düşündürebitecek advers olaylar (öm.; amenore, gaiaktore, jinckomasii) genelde deneklerin %Tinden azında bildirilmiştir.Smıf etkileri Antipsikotik ilaçların kullanılması sonucunda QT uzaması, ventriküler aritmiler (ventriküler fibrilasyon, ventriküler taşikardi), ani beklenmedik öiüm, kardiyak arre.st ve Torsades de pointes görülebilir. Pulmoner embolizm ve derin ven trombozu vakaları da dahil olmak üzere, antipsikotik İlaçlarla venöz tromboembolik olay bildirilmiştir (Sıklık bilinmemektedir), 4.9. Doz aşımı ve tedavisiXEPL10N'un, sağlık personeli tarafından uygulanması gerektiğinden hastalarm aşırı doz alma potansiyeli düşüktür.BelİnilcrGenellikle, beklenen bulgu ve semptomlar paliperidonun bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, uyuşukluk ve sedusyon, taşikardi ve hipotansiyon, QT uzaması ve ekstrapiramidal semptomlardır, Torsade de pointes ve ventriküler fibrilasyon, oral paliperidon ile doz aşımı ayarında rapor edilmiştir. Akut doz aşımı durumunda, birden fazla ilaç ihtimali düşünülmelidir. TedaviTedavi gereksinimleri ve iyileşme değerlendirilirken KEPLION'un uzatılmış salım özelliği ve paliperidonun uzun yanlanma ömrü göz önünde tutulmalıdır. Paliperidonun spesifik bir antidotu yoktur. Genel destekleyici önlemler uygulanmalıdır. Hava yolu açık tutulmalı, korunmalı ve yeterli oksijenasyon, ventİlasyon sağlanmalıdır. Kardiyovasküler izlemeye hemen başlanmalı ve olası aritmiler için sürekli elektrokardiyografik izleme yapılmalıdır. Sayfa 18/34 Hipotansiyon ve dolaştın kollapsı, intravenöz sıvı ve/veya sempatomimetik ilaçlar gibi uygun önlemlerle tedavi edilmelidir. Ciddi ekstrapiramidal semptomlarm varligmda antikolinerjik ibçlar uygulanmalıdır. Hasta iyiİeşene kadar yakın denetim ve göziem sürdürülmelidir, 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinanıik özelliklerFarmakolerapötik grup: Diğer antipsikotikler ATC kodu: N05AXI3XEPLION paiiperidonun (+)- ve (-)- rasemik karışımını içerir. Etki mekanizması: Paliperidon palmitat, paliperidona hidrolize olur (Bkz. Bölüm 5.3). Paliperidon, daha çok serotonerjik S-HT^a antagonistik aktivitesi olan merkezi etkili dopamin Di antagonistidir. Paliperidon, aynı zamanda aIfa-1 ve alfa-2 adrenerjik reseptörlerin ve Hj histaminerjik reseptörlerin antagonisti olarak etkİ eder. Paiiperidonun kotinerjik muskarinik veya 6|- ve 6ı-adrenerjik reseptörlere afinitesi yoktur, (+)- ve (-)' paliperidon enantiyomerleriniıı farmakolojik aktivitesi, kalitatif ve kantitatif olarak benzerdir. Şizofrenide etkili olan diğer ilaçlarda olduğu gibi paiiperidonun etki mekanizması bilinmemektedir. Ancak, ilacın şizofrenideki terapötik aktivitesinin, dopamin Tip 2 (Di) ve serotonin Tip 2 (5HTia) reseptör antagonizmasmın kombinasyonu ile kontrol edildiği öne sürülmüştür. D: ve SHTia dışındaki diğer reseptörlerdeki aniagonizma, paiiperidonun diğer etkilerinin bazılarını açıklayabilir. Elektro fizyoloji Oral paiiperidonun QT aralığı üzerindeki etkileri, şizofreni ve şizoafektif bozukluğu olan erişkinlerde yapılan İki ran d om İze, çift* kör, çok merkezli, faz 1 çalışmasında ve şizofrenili erişkinlerde yapılan aktif kontrollü, 6 haftalık, sabit dozlu etkinlik çalışmalarmda değerlendirilmiştir. İlk faz 1 çalışmasında (n=:14l), denekler 7 gün süre ile günde bir kere hızlı salimli oral paliperidon {4 mg'dan 8 mg'a titre edilerek) veya tek doz moksifloksasin (400 mg) almak üzere randomize olarak ayrılmışlardır. Günde tek doz 8 mg hızlı salimli oral paliperidon (n=50, C,viax 113 ng/mi) ile elde edilen ortalama kararlı durum maksimum plaztna konsantrasyonu, dekoid kas içine uygulanan önerilen maksimum 150 mg'lık XEPLION dozu Sayfa 19/34 ile gözlenen 2 kat daha yüksek nıaruziyete göre tİLiha yüksek bulunmuştur (öngörülen ortalama C,as ss = 50 ng/ml). Model-ayarlı, gün-ortalamalı iineer'dertveli QT düzeltmesinde (QTcLD), XEPLION tedavi grubunda (n=50) 5.5 milisaniyeiik (ms) ortalama artış saptanmıştır (%90 CI: 3.66; 7.25). İkinci faz t çatışmasında (n=109) denekler; plasebo, maksimum önerilen oral uzatılmış salimli paliperidon dozu (günde bir kere 12 mg) ve bunu takiben Önerilen aralığın üzerinde bir doza titrasyoiı (günde bir kere 18 mg) veya aynı farmakolojik ilaç smıfmdan bİr ilacı (günde iki kez 400 mg ketiapin) aktif kontrol olarak alacak şekilde rastgele ayrılmışlardır. Bu 10 günlük eşit etkinlik çalışmasında, birincil karşılaştırma 12 mg uzatılmış salimli paliperidon İle ketiapin arasında yapılmıştır. Her bireyin saptanan t,,,^ değerinde QTcLD'de başlangıca göre en düşük kareler ortalamasının değişikliği, 12 mg uzatılmış salimli paliperidon için (ortalama 34 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama 1183 ng/ml) 5.1 m.s daha düşük bulunmuştur {%90CI; -9.2; -0.9), Bu değer önceden belirlenmiş 10 ms olan eşil etkinlik kriterine uygundur. Her bireyin saptanan t,;,ıs değerinde QTcLD'de başlangıca göre ortalama değişiklik, 18 mg uzatılmış salimli paliperidon için (ortalama C,ıax 53 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama Cox 1183 ng/ml) 2,3 ms daha düşük bulunmuştur (%90 CI; -6.8; 2,3),Her bireyin saptanan değerinde QTeLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca t,a^ değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 12 mg uzatılmış salimli paliperidon için 1.5 ms daha yüksek (%90 CI: -3.3; 6.2) ve günde iki kez 400 mg ketiapin için 8.0 ms daha yüksek (%90 CI: 3.1; 12.9) bulunmuştur. Her bireyin saptanan tmax değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tm değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 18 mg uzatılmış salimli paliperidon için 4.9 ms daha yük.sek (%90 CI: "0.5; 10.3) ve günde iki kez 400 mg ketiapin için 7.5 ms daha yüksek (%90 Ci: 2.5; 12,3) bulunmuştur. Bu çalışmaların hiçbirisinde herhangi bir zamanda deneklerde, başlangıca göre 60 mili.saniyeyi geçen bir değişiklik veya 500 milisaniyeyi geçen bir QTcLD görülmemiştir. Oral uzatılmış .salimli paliperidonla ilgili sabit dozlu Uç etkinlik çalışmasında, standardize edilmiş bir yöntem kullanılarak beliriİ günlerde (beklenen Cmasürelerini içeren) 15 zaman noktasında, kap,samlı elektrokardiyografi (BCG) ölçümleri alınmışiır. Uzatılmış salimli paliperidon ile tedavi edilen 836 denek, olanzapin ile tedavi edilen 357 denek ve piasebo ile tedavi edilen 350 deneğin toplu verilerine göre herhangi bir zaman noktasında, herhangi birSayfa 20 / 34 tedavi grubunda ortalama QTcLD artışı 5 mÜisaniyeyi geçmeiiiiştir. Bu çalışmalar esnasında, uzatılmış salimli 12 mg paliperidon ve olanzapin gruplarının her birisinde bir denekte bir zaman noktasmda 60 milisaniyeyi geçen değişiklik olmuştur (sırası İle 62 ve 110 milisaniye artışları). XEPL10N'un dört sabit dozlu etkinlik çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamış ve herhangi bir zaman noktasında 500 milisaniyeden fazla QTcLD değeri görülmemiştir. Uzun süreli nüksü önleme çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamıştır ve bir denekle 507 milİsaniyelik QTeLD değeri saptanmıştır (Bazett düzeltilmiş QT aralığı [QTcB] 483 milisaniye). Bu hastada ayrıca kaip hızı 45 atım/dakika bulunmuştur. Klinik Etkinlik XEPLION'un şizofreninin akut tedavisinde etkililiği, şizofreni için DSM-IV kriterlerini karşılayan akut nüks gelişmiş yatan erişkin hastalarda yapılan kısa süreli {biri 9 haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabit dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda I XEPLION'un sabit dozları, 9 haftalık çalışmada I. , 8. ve 3ö, günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir (ilk iki doz için bir haftalık aralıklarla ve daha sonra idame içİn 4 haftada bir). Etkinlik, Pozitif ve Negatif Sendrom Ölçekleri (PANSS) kullanılarak değerlendirilmiştir. PANSS, pozitif semptomları, negatif .semptomları, dağınık düşünceleri, kontrol edilemeyen saldırganlık/heyecanı ve anksiyete/depre.syonu değerlendirmek için beş faktörden oluşan valide edilmiş çok maddeli bİr ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararlı aktivite alanlarında kişi.sel ve .so.syal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir ölçektir: iş ve çalışma, kişisel ve sosyal ilişkiler, kendi kendine bakım ve rahatsız edici ve agresif davranışlar. Sosyal, kişisel ve kendi kendine bakım alanlarında disfonksiyonun şiddeti, bu aktiviteleri başkalarının yardımı ile ve başkalarının yardımı olmaksızın uygulamada zorluk derecesi (yok, hafif, aşikar, belirgin, şiddetli) İle Ölçülür. Benzer şekilde, agresif davranışlarda disfonksiyonun şiddeti, agresif davranışların varlığı veya yokluğu (kabalık, başkalarına toplum içinde hakaret etmek, nesneleri kırmak, sözlü tehditler, fiziksel saldırı) ve bu davranışların sıklığı ile ölçülür. XEPLION'un üç sabit dozunu (başlangıçta 150 mg'lık deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, 100 mg/4 hafta veya 150 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLION'un üç dozu da, PANSS toplam Sayfa 21 / 34puanım düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 100 mg/4 hafta hem de 150 mg/4 haftalık tedavi grupları PSP puanı açısından pkıseboya göre İstaEİstiksei olarak anlamh üstünlük göstermişken,25mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca etkiliüği ve PANSS'de düzehneyi desteklemektedir ve dördüncü gün kadar erken dönemde gözlenmiştir. Sekizinci günde ise 25 mg ve 150 mg'ltk XEPLION gmplarmda plaseboya göre anlamlı farklılık gözlenmiştir,XEPLION'un üç sabit dozunu (50 mg/4 hafta, 10ü mg/4 hafta ve 150 mg/4 hafta) plasebo ile karşılaştıran diğer bir 13 haftalık çalışmada (n=349), sadece 100 mg/4 haftalık XEPL10N grubu, PANSS toplam puanında düzeime açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 50 mg/4 hafta, hem de 100 mg/4 hafta dozları, PSP puanını düzeltmek açısından plaseboya üstün bıılımmuştur. Bu çalışmaya 150 mg'ltk bir doz dahil edilmesine rağmen, bu dozu alan gönüllü sayjsı, bu dozun etkililiği İle ilgili kesin sonuçlara varmak için yeterli değildir, XEPLION'un üç sabit dozunu (25 mg/4 hafta, 50 mg/4 hafta ve 100 mg/4 hafta) plasebo İie karşılaştıran üçüncü 13 haftalık çahşmada (n=513), XEPL10N'un üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, paliperidon doz grupların tamamında, PSP puanı açısından plaseboya göre istatistiksel olarak anlamlılık saptanmamıştır. XEPLION'un iki sabit dozunu (50 mg/4 hafta ve lÜO mg/4 hafta) plasebo ile karşılaştıran 9 haftalık çalışmada (n=197), XEPLION'un ikİ dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. XEPLION'un şizofrenide semptom atik kontrolü idame etmek ve şizofrenide relapsı geciktirme açısından etkililiği, şizofreni için DSM-IV kriterlerini karşılayan 849 yaşlı olmayan erişkin gönüllüleri içeren uzun süreli çift-kör, plasebo kontrollü, esnek dozlu bir çalışmada belirlenmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabilizasyon fazı, randomize, plasebo kontrollü bir faz {nüks açısından gözlem yapmak üzere) vc 52 haftalık açık etiketli uzatma dönemini içermiştir. Bu çalışmada, XEPL10N dozları ayda bir defa uygulanan 25, 50, 75 ve 100 mg dozlarım içermiştir; 75 mg dozuna yalnızca 52 haftalık açık etiketli uzatmada izin verilmiştir. Hastalar, başlangıçta 9 haftalık bir geçiş dönemi sırasında esnek dozlarda (25-100 mg) XEPL10N almıştır. 24 haftalık koruma dönemine girmek için hastaların PANSS skorunun <75 olması gerekmiştir. Dozlama ayarlamalarına yalnızca koruma döneminin ilk 12 haftasında izin verilmiştir. Değişken uzunlukla çift-kör faz esnasında, hastalar stabilizasyon fazında aldıkları aynı XEPLION'un doz grubuna (ortanca Sayfa 22/34 süre 171 gün [liralıklar 1 gün-407 gün]) veya plu-sebo grubunu (ortalama süre 105 gün [aralıklar 8 gün-441 gün] rantİomize olarak ayrılmıştir. Toplam 410 stabilize hasta, şizofreni semptomlarında nüks oluşuna kadar, XEPL10N veya plasebo gruplarına randomize olarak ayrılmıştır. Nüks, aşagıdakilerdetı birinin veya daha fazlasınm ilk olarak ortaya çıkma zamanı olarak lammlanmıştır. Bunlar; psikiyatrik hospitalizasyon, iki ardışık değerlendirmede toplam PANSS puanında >%25 artış (başlangıç puanı >40 ise) veya 10 puanlık artış (başlangıç puanı <40 ise), kasıtlı olarak kendi kendini yaralamak, saldırgan davranış, intihar/öldürmeye eğilimli düşünceler veya PANSS maddelerinin P1 (Delüzyonlar), P2 (kavramsal disorganizasyon), P3 (Halüsinasyonla ilgili davranış), P6 (Şüphecilik/perseküsyon), P7 (Düşmanlık) veya G8 (işbirliği yapamama) ardışık iki değerlendirmesinde puanın >5 (tnaksirnıım başlangıç puanı <3 ise) veya >6 (maksimum başlangıç puanı 4 ise) olmasıdır. Primer etkinlik değişkeni, nükse kadar geçen süre olmuştur. Daha önceden planlanmış bir ara analiz (68 nüks olayı yaşandıktan sonra), nükse kadar geçen sürenin, XEPLION ile tedavi edilen hastalarda, plaseboya kıyasla anlamlı derecede daha uzun olduğunu göstermiştir (Şekil I) ve etkililiğin devam ettiği gösterildiğinden çalışma erken sonlandınlmıştır. Şekil 1. Zamana karşı niiksü kıyaslayan Kaplan Meicr Grafiği - Ara Anaii/i {Tedaviyi amaçlayan analiz seli)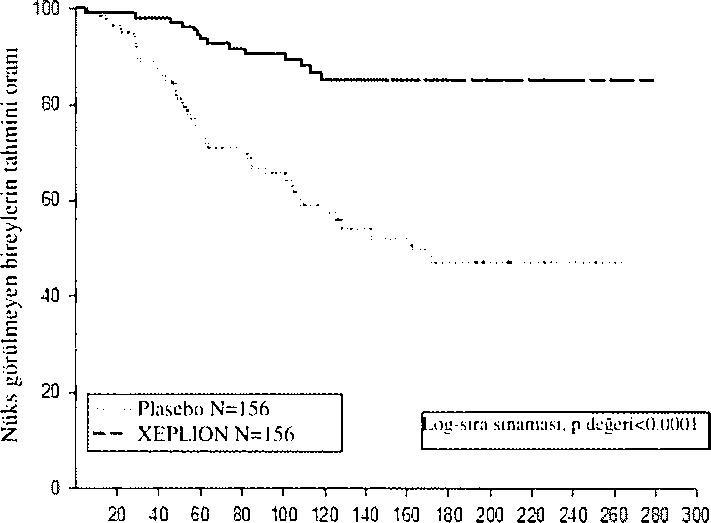 Randıımizasyondan beri geçen süre (gün)
Randıımizasyondan beri geçen süre (gün)Çalışmanın sonlandınldığı tarihe kadar tüm verileri içeren nİhai verilere dayanılarak yapılan analizin sonucu, ara verilere dayalı birincil etkililik analizinin sonucu İle tutarlıdır. Popüiasyon utl grupkırınm incelenmesi, cinsiyet, yaş veya ırk lemci ulmarak tedaviye yanıt ?çısmdan klinik olarak anlamlı fark göstermemiştir. 5.2. Farmakokinetik özeiliklcr Genel ÖzuUiklerEmilim:Sudaki çözünürlüğünün aşırı düşük olmasına bağlı olarak paiiperidon palmitat, intramüsküler enjeksiyondan sonra paliperidona hidroliz olmadan Önce yavaşça çözünür ve sistemik dolaşıma absorbe olur. Tek bir intramüsküler enjeksiyonu takiben paİiperidonun plazma konsantrasyonları, 13 günlük ortalama tjax süresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlarına yükselir, İlacın salmması, birinci gün kadar erken bir zamanda başlar ve 126 gün kadar sürer. Deltoid kas içine tek doz intramüsküler enjeksiyonunu takiben (25 mg-150 mg), gluteal kas içine enjeksiyonla karşılaştırıldığında ortalama olarak %28 daha yüksek birCusas gözlenmiştir. 1. günde 150 mg ve 8. günde 100 mg'ın iki başlangıç deltoid intramüsküler enjeksiyonu, terapötİk konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLION'un salım profili ve doz rejimi, terapötik konsantrasyonların devam etmesini sağlamaktadır. lÜÛ nıg'lık XEPLION dozu için ortalama kararlı durum doruk noktası; iki dalga arasındaki çukur oram, gluteal uygulamayı takiben 1.8 ve deltoid uygulamayı takiben 2,2 olmuştur, 25 mg-150 mg'lık doz aralığında XEPLION uygulamasını takiben paİiperidonun görünen ortalama yarılanma ömrü 25 ile 49 gün arasında değişmiştir. Paiiperidon palmitat uygulamasını takiben paİiperidonun {+) ve {-) enantiyomerleri birbirine dönüşür ve yaklaşık olarak 1,6-1,8'lik bir EAA (+)/(-) oranına ulaşır. Daüılım:Popülasyon analizine güre paİiperidonun görünen dağdım hacmi 391 litredir, Rasemik paiiperidon plazma proteinine %74 oranında bağlanır. Bİvotransformasvon:1 mg hızlı salimli *'^C-paiiperidonun tek bir orai dozunun uygulanmasından 1 hafta sonra, dozun %59'u idrarla değişmeden atılmıştır. Bu durum, paİiperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6,5'inden fazlasını kapsamayan in vivodört metabolik yolak tanımlanmıştır; dealkilasyon, hidroksilasyon,Sayfa 24 / 34dehidrojetiasyon ve benzisoks£izolün bölünmesi.Itı vitroİn vivoin vitroçalışmalar, paliperidonun, CYPl A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5M içeren sitokrom P450 izoenzimleri tarafından melabolize edilen ilaçlann metabolizmasını büyük ölçüde inhibe etmediğini göstermiştir.Iıı vifrovivoveriler yoktur ve klinik ilişki bilinmemektedir,Eliminasyon:1 mg hızlı salimli ^'^C-paliperidonun tek bir oral doz uygulanması ile verilen radyoaktivitenin yaklaşık %80'İ idrarda ve %I l'i feçeste bulunmuştur. Do^msalhk/Doürusal olmayan durum:XEPLION uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-I50 rng'hk doz araiığmın üzerinde dozla oıanlılı olmuştur ve 50 mg'ı aşan dozlarda için dozla-oranEıdan düşüktür. Uzun etkili paliperidon pahııitat enjeksiyonıı ile oral nzanlmti' salmılt pcıliperidonun kanplaşiınlnıasıXEPLION, paiiperidonu ayda bir uygulamak üzere ta.sarhmmıştır. Uzatılmış salimli oral paliperidon ise günde bir kere uygulanır. Şekil 2, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış sahmit tablet (6 nıg veya 12 mg) uygulaması İle karşılaştırmalı olarak siinmaktadır. XEPLION'un başlangıç rejimi (1. gün/8. günde deİEoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızm başlatırken kararlı durum paliperidon konsantrasyonlarına hızla ulaşmak üzere tasarlanmıştır. G0"00rul 6 mg paüpcridon ¦""¦Oral 12 mg paliperido!! Q-^--aXEPLİON Hesaplüiıan or;ıi 6 mg kanırh durum Htisaplaıiatı ora! İ2 mg kararli dumm 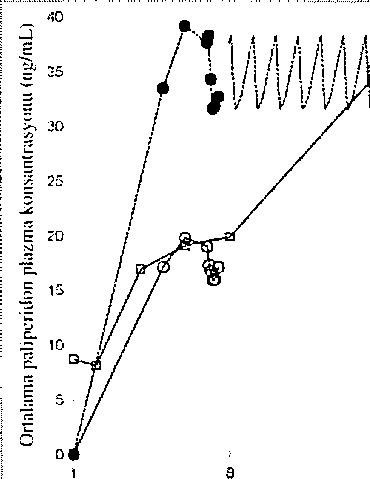 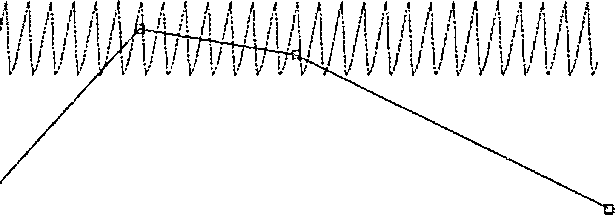 WVWV\AAAMAAAMMAMAMAM
WVWV\AAAMAAAMMAMAMAM1£ 22 Zaman (jiİİii) 29
32 Şekil 2.Oral uzauİmış salsmiı tabletin (6 mg veya (2 mg) güniük uygulaması iie karşslaştınnalı olarak Önerilen b;tşlang!<; rejimi kuliansİarak (Lgün/8,günde ılelloiıl kas içine İ50 mg/H)() mg paliperidona eşdeğer paliperiüon palmital ile başlangıç) XEPLION'un uygulaınasmı takiben 5 hafta süre ile paliperidon için ortalama farmakokinetik prollllcrini takiben orialama plazma konsaııirasyonu-zaman proll İleri.Genel olarak, XEPL!ON ile gözlenen genel başlangıç plazma düzeyleri, 6 mg-12 mg uzatılmış salımh oral paliperidon ile gözlenen maruziyet sınırlan içinde bulunmuştur. XEPLION başlangıç rejiminin kullamimast, en düşük değerlerin görüldüğü doz öncesi günlerde bile (8. gün ve 36. gün) hastaların, 6 mg-12 mg uzatılmış salımit oral paliperidonun bu maruziyet penceresinde kalmalarım sağlamıştır. XEPLION uygulamastm takiben paliperidon farmakokinetiği içİn gönüllüler arasında değişkenlik, uzatılmış salimli oral paliperidon tabletlerinde belirlenen değişkenliğe göre daha az bukınmuşiur. !ki ürün aıasmdaki ortanca farmakokinetik pro fi İlerin deki fark nedeni ile farmakokinetik özelliklerini direkt olarak karşılaştsnlırketı dikkatli olmak gerekir. Hastalardaki karakteristik özelliklerKaraciğer yetmezliSi:Paliperidon, karaciğerde yaygın şekilde metabolize edilmemektedir. XEPL10N, karaciğer yetmezliği olan hastalarda incelenmemiş olmasına nığmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Orta derecede karaciğer yetmezliği Sayfa 26 / 34 olan (Chiid-Pugh sınıf B) luıstalarda ora! paliperidon iie yapılan bir çalışmada, serbest paliperidonun plazma konsantrasyonu, sağlıklı deneklerle benzerdir, Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir. Böbrek yetmezliği:Hatif böbrek yetmezliği olan hastalarda XEPL10N dozu azaltılmalıdır. XEPLION'un, orta veya ağır böbrek yetmezliği olan hastalarda kuliatıılmast önerilmez (Bkz, Bölüm 4.2). Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzatılmış salimli tablet paliperidon dozunun dağılımı incelenmiştir. Paliperidon eliminasyonu, azalan kreatinin klerensi ile birlikte azalmıştır, Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan hastalar arasında hafif böbrek yetmezliğinde (CrCI =50 - <80 ml/dak) ortalama %32, orta böbrek yetmezliğinde (CrCl= 30 - <50 ml/dak) ortalama %64ve ağır böbrek yetmezliğinde (CrCI=10 - <30 ml/dak) ortalama %7I azalmıştır. Bu durum sağlıklı deneklerle karşılaştırıldığında, maruziyette (EAAif) sırası ile 1.5, 2.6 ve 4,8 kal ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPL10N ile sınırlı sayıda gözleme ve farmakokinetik simüiasyonlara göre, hafif böbrek yetmezliği olan hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde İÛO mg'lık doz ve bir hafta sonra 75 mg'dır (her ikisi de deltoid kas içine uygulanır); daha sonra ayda bir (4 haftada bir) deltoid veya gluteal kas içine hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 50 mg'lık enjeksiyonlarla devam edilir (Bkz. Bölüm 4.2).Yaslılarda:Sadece yaşa bağlı dozaj ayarlaması önerilmez. Ancak, kreatinin klerensinde yaşla ilgili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz. Bölüm 5.2 ve Bolüm 4.2). İrk: Oral paliperidon ile yapılan çalışmaların popülasyon farnıakokinetiği analiz verileri, XEPUON uygulamasını takiben paliperidonun farmakokinetiğinde ırka bağlı farkiılıkiarm kanıtım göstermemiştir. Cinsiyet:Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir. Sigara kullanım durumu:İnsan karaciğer enzimleri kullanılan in viuoviırobtılgukırlii uyumlu olarak poptihusyotı f'armakokinetik değerlendirmesi, sig:ıra kuliananhır ile kullanmayanlar anısmda herhangi bir fark ortaya koymam s ştır.5.3. Klinik önccsi güveniiiik verileriToksİkolojİOral uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagontze eden diğer ilaçlarda olduğu gibİ intramüsküler olarak uygulanan paliperidon palmitat tekrarlanan-doz toksisitesi çalışmalarında serum prolakiin düzeylerini yükseltmiştir. Atİolesunlar için mg/m2 bazmda Önerilen günde 12 mg'hk maksimum insan oral dozunun 0,12, 0,5 ve 1,8 katı olan günde 0,16, 0,63 ve 2,5 mg/kg'lık oral paliperidon dozlarıyla sıçanlarda yapılan 7 haftahk juvenil toksisitesi çalışmasında gelişim, cinsel olgunlaşma ve üreme performansı üzerinde hiçbir etkisi gözlenmemiştir. Günde 2,5 mg/kg'a kadar olan oral dozlar, 2,5 mg/kg/gün ile tedavi edilen dişi sıçanlarda öğrenme ve hafıza üzerine etkiler dışında erkek ve dişilerde nörodavnınışsal gelişimi olumsuz etkilememiştir. Bu etki tedavi bırakıldıktan sonra gözlemlenmemiştir. Günde 0,31, 1,25 ve 5 mg/kg dozlarında oral risperidonla (geniş ölçüde paüperidona dönüştürülmüştür) tedavi edilen juvenil köpeklerie yapılan 40 haftalık bir çalışmada cinsel olgunlaşma günde 0,31 ve 1,25 mg/kg dozlarında olumsuz olarak etkilenmemiştir. Uzun kemik gelişimi günde 0,31 mg/kg dozunda etkilenmemiştir; etkiler günde 1,25 ve 5 mg/kg dozlarında gözlenmiştir. Karsinojenisite İntramüsküler olarak enjekte edilen paliperidon palmİtatm karsinojenik potansiyeli sıçanlarda değerlendirilmiştir. 10, 30 ve 60 mg/kg/ay'lık dozlardti dişi sıçanlarda meme bezi adenokar.sinomlarmda istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLION'un mg/kg esas almarak 150 mg'lık maksimum önerilen insan dozunun 1.2 ve 2.2 kail olan 30 ve 60 mg/kg/ay'ltk dozlarda meme bezi aüenomian ve karsinomlarmda istatistiksel olarak anlamlı bir artış görülmüştür. Rİsperİdonun aktif bir metaboliti olan oral paliperidonun karsinojenik potansiyeli, farelerde ve sıçanlarda yürütülen risperidon çalışmalarına göre değeriendirilmiştir. Risperidon, farelere 18 ay süre ile ve sıçanlara 25 ay süre ile 10 mg/kg/gün şeklinde uygulanmıştır. Hipofiz bezi adenomiarK endokrin pankreas adcnomlan ve meme bezİ adenokarsinomİarmda istatistiksel olarak anlamlı artışlar olmuştur. Diğer antipsikotik ilaçların kronik olarak uygulanmasmdan sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saplanmış ve bii artışın uzatılmış dopamin Di antagonizmasma baglt olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularının İnsan riski iie ilişkisi bilinmenıekledir. Mutajenİsıte Ames iers mutasyon testinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu saptanmamıştır, Paliperidon palmitat, Ames ters mutasyon testinde veya fare ienfoma tayininde genotoksik özellikler göstermemiştir. Fertilitede bozukluk Ora! paliperidon tedavisi, prolaktin- ve santral sinir sistemi- aracılı etkiler iic sonuçlanmış olmasına rağmen, erkek ve dişi sıçanlann fertiliiesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo .sayısında hafif bir düşüş göstermiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddtlcrin üstesiPolisorbat 20Polietilen glikol 4Û00 Sitrik asil monohidrat Anliidr di sodyum hidrojen fosfat Sodyum dihidrojen fosfat monohidrat Sodyum hidroksit Enjeksiyonluk su 6.2. GeçİmsizlikierGeçimlilik ile ilgili çalışma yapılmadığından, bu tıbbi ürün başka tıbbi ürün veya seyreltici ile karıştırılmamalı, inlramüsküler uygulama direk olarak kit içindeki enjektörden yapsimalidır.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özci ledbirler25''C altındaki oda sıcaklığında sakhıyınız,6.5. Ambalajın niteliği ve içeriği 150 mg (1,50 mi) palİperidon (234 mg paliperidon palmilata eşdeğer) süspansiyonu ilekııilanıma hazır pision ttpalı ve uç başlıklı (bronnobutil lastik) bir enjektör (sikiik-olefin-kopolimeri), merkezi mavi renkli bir güvenlik iğnesi ve merkezi gri renkli bir güvenlik iğnesi içeren kit 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve dİğcr özel önlemlerKııllanılmamiş olan ürünler ya da alık materyaller Tıbbi Ahklarm Kontrolü Yönetmeliği ve"Ambalaj Atıklarının Kontrolü Yönetnıeliklerine uygun olarak imha edilmelidir. Kit, intramüsküler enjeksiyon için kullanıma hazır enjektör ve 2 güvenlik İğnesi içerir. KuJİj;ijıua hn/ır
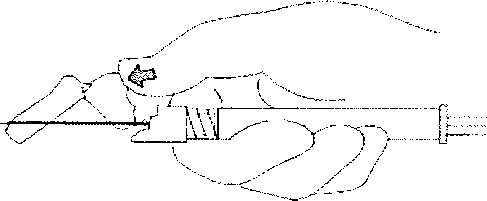
Homojen bir süspansiyon sağlamak için enjektörü en az 10 saniye kuvvelii bir şekilde çalkalayınız. 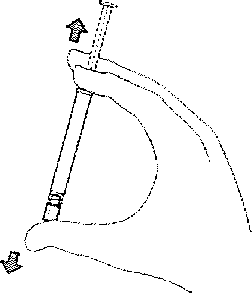 2, Uygun iğneyi seçiniz,
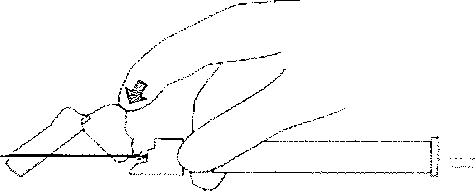
2, Uygun iğneyi seçiniz,DELTOİD enjeksiyon için hasta 9ü kg'dan hafif ise merkezi mavi renkli iğne; hasta 90 kg veya daha ağır i.se merkezi gri renkli iğne seçilir, GLUTEAL enjeksiyon için merkezi gri olan iğne kullanınız. 3. Enjektörü dik olarak tutarken lastik uç başlığını saat yönünde çevirerek çıkarınız. /W/f- N4. Güvenlik iğnesinin kabmı yarıya kadar sıyırnıız. Plasük ssysrma kabını kullanarak iğne kılıfını kavrayınız. Güvenlik iğnesini enjektörün cam şırınga bağlantısına saat yönünde çevirerek takınız.iltâr 5. İğnenin kıhfını düz bir şekilde çekerek iğneden ayırmız. İğne gevşeyerek enjektörden çıkabileceği için kılıfı bükmeyiniz. W.m:N'-¦h>6. Hiivasını gidermek için, takiimiş olan iğne İle birlikte enjektörü dik pozisyona geliriniz. Piston çubuğun» dikkatli bir şekilde ileri iterek enjektörün havasını gideriniz. 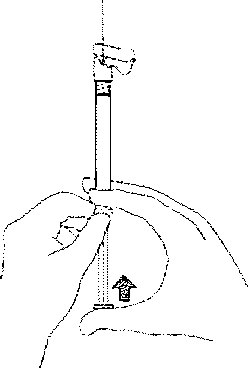
1.İntravaskÜIcr veya subkutan olarak uygulamayınız.
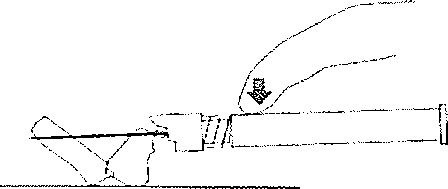
8. Enjeksiyon Eamanılandıktan sonra iğne koruma sistemini etkinleştirmek için baş parmağmızı veya bir parmağınızı (8a, 8b) veya düz bir yüzeyi kullanınız. 'Klik' sesi duyulduğu zaman iğne koruma sistemi tam olarak etkinleşmiştir. İğne ile birlikte enjektörü uygun şekilde atınız. |
İlaç BilgileriXeplion 150mg/1,5ml IM Enjeksiyon İçin Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır EnjeksiyonEtken Maddesi: Paliperidon palmitat Atc Kodu: N05AX13 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.