Xeplion 100mg/1ml IM Enjeksiyon İçin Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır Enjeksiyon Kısa Ürün BilgisiSinir Sistemi » Psikoleptikler (Psikolojik İlaçlar) » Antipsikotikler » Diğer İlaçlar » Paliperidon KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ÂDİXEPLION 100 mg/1 mİ I,M. enjeksiyon için uzun salımh süspansiyon İçeren kuilitnıma hazır enjektör2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her kullanıma hazır dolu enjektörün i mi'sinde;Paliperidon palmilat 156 mg (100 mg palİperidona eşdeğer)Yardımcı maddeler:Her t ml'de;Anhidr disodyum hidrojen fosfat; 5 mgSodyum dihidrojen fosfat monohidrat: 2,5 mgSodyum hidroksit: 2,84 mgDiğer yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTİK FORMKullanıma hazır enjektör içinde uzun salimli süspansiyon Beyaz ile grimsi beyaz arası renkte süspansiyon,4. KLİNİK ÖZELLİKLER4.L Tcrapöiik endikasyonlarXEPLION şizofreni tedavisi ve şizofreni semptomlarının iekrarmm önlenmesinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji:Bugüne kadar paliperidon ya da risperidon kulianmamış hasuUar için XEPL10N ile leduviye başlanmadan önce, oral paliperidon veya oral risperidonun toierabilitesinin kanıtlanması önerilir.XEPLION'un önerilen başhıngiç dozu, ierapötik konsantrasyonlara hızla ulaşdması amacıyla tedavinin birinci gününde 150 mg ve bir hafta sonra (8. gün) i 00 mg'dır (her ikisi de deltoid kas içine uygulanır) (Bkz. Bölüm 5.2). Önerilen ayhk idame dozu 75 mg'dir. Önerilen 25 mg ila 15ü mg'lık doz arahğında hastanın bireyse! tolerabilitesine ve/veya etkililiğe göre bazi hastalar daha düşük ya da dahii yüksek dozkırdan yarar görebilir. İkinci dozu takiben aylık idame dozları deltoid veya gluteal kas içine uygulanabilir.Uygulama sıklığı ve süresi:İdame dozunun ayarlanması ayda bir yapılabilir. XEPLİON'un uzatılmış salım özelliği doz ayarlaması yaparken güz önüne ahnmalıdır {Bkz. Bölüm 5.2); çünkü idame dozlarının tam etkİ.si birkaç ay ortaya çıkmayabilir.Uygulama şekli:XEPL10N, sadece intramüsküler kullanım için hazırlanmıştır. Kas içine yavaş ve derin olarak enjekte edilmelidir. Kan damarı içine yanlışlıkla enjeksiyondan kaçınmak için dikkat edilmelidir. Her enjeksiyon bir sağlık uzmanı tarafından uygulanmalıdır. Uygulama tek bir enjeksiyon şeklinde yapılmalıdır. Doz, ayrı enjeksiyonlar şeklinde uygulanmamalıdır. Intravasküler veya sııbkütan enjeksiyon uygulanmamalıdır.XEPL10N'un deltoid kas içine uygulanması için önerilen iğne boyutu hastanın vücut ağırlığı ile belirlenir. 90 kg veya daha agır olan hastalarda merkezi gri renkli {1 İnch 22 G (38,1 X 0,72 iorn)) güvenlik İğnesi önerilir, 90 kg'dan hafif olan hastalarda merkezi mavi renkli (1 inch 23 G (25.4 nıni x i).64 ıiiinl) güvenlik iğnesi önerilir. Deltoid enjeksiyonlar iki deltoid kas arasında değiştirilmelidir,XEPLION'un gluteal kas içine uygulanma.sı için önerilen iğne merkezi gri renkli (i inch 22 G (38.1 h 0,72 iihis)) güvenlik iğnesidir. Uygulama gluteal bölgenin üst dış kadranı içine yapılmalıdır, Gluteal enjeksiyonlar, iki gluteal kas arasında değiştirilmelidir.Oral veya intramüsküier olarak uygulanan risperidon, değişen derecelerde paiiperidona metaboiize edilmektedir. Risperidon ya da orai paiiperidon XEPLION ile eşzamanlı olarak kuliamlacaksa dikkatli olunmahdır.Atlanan dozlarDozların atianmastnm Ünlenmesi: XEPLION'un ikinci başlangıç dozunun ilk dozdan bir hafta sonra verilmesi önerilir. Doz atlanmasmı önlemek için ikinci doz, bir haftalık (8, gün) zaman noktasından iki gün önce veya sonra verilebilir. Benzer şekilde, başlangıç rejiminden sonra üçüncü enjeksiyonun ve sonraki enjeksiyonların ayda bir verilmesi önerilir. Aylık dozun atlanmaması için enjeksiyon, aylık zaman noktasından yedi gün önce veya sonra verilebilir.İkinci XEPLION enjeksiyonu için hedef tarih (gün 8 ± 2 gün) atlanırsa, önerilen yeniden başlangıç zamanı hastaya ilk enjeksiyonun uygulanmasından itibaren geçen süreye bağlıdır.Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra <4 hafta); İlk enjeksiyondan sonra 4 haftadan daha kısa bir süre geçmişse, deltoid kas içine mümkün olan en kısa sürede fOO mg'hk ikinci enjeksiyon uygulanmalıdır. 75 mg'lık üçüncü XEPLION enjeksiyonu, ilk enjeksiyondan 5 hafta sonra deltoid ya da glnteal kas içine uygulanmalıdır (ikinci enjeksiyonun zamanlamasından bağımsız olarak). Daha sonra hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki delioid ya da gluteal dozun normal aylık enjeksiyon siklusu takip edilmelidir.Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra 4-7 hafta); İlk XEPLION enjeksiyonundan sonra 4 İla 7 haftalık bir süre geçmişse, doz uygulamasına aşağıdaki şekilde 100 mg'hk iki enjeksiyonla devam edilmelidir:1. Mümkün oian en kı.sa sürede deltoid kas İçine bir enjeksiyon,2.Bir hafta .sonra bir kez daha deltoid kas içine bir enjeksiyon,
3. Hastanm bireysel tolerabiiitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi.Atlanan aylık idame dozu (>6 ay): XEPLION'un son enjeksiyonunun üzerinden altı aydan daha uzun bir süre geçmişse, yukarıda XEPLÍON'un önerilen başlangıç tedavisi için tarif edildiği şekilde doz uygulaması başlatılır.Diğer antipsikolik ilaçlardan XEPLION'a geçiş:Hastaların diğer antipsikotik ilaçlardan XEPLION'a geçişini ele alan veya XEPLÍON'un diğer antipsikotiklerie birlikte eşzamanlı kullanılması ile ilgili sistematik olarak toplanmış veri bulunmamaktadır. Bugüne kadar paliperidon ya da risperidon kullanmamış hastalar için XEPLION ile tedaviye başlanmadan önce, oral paliperidon veya oral risperİdonun tolerabilİtesi kanıtlanmalıdır.Oral antipsikotik ilaçlardan XEPLlON'a geçiş;XEPLION tedavisi başlanacağı zaman daha önce kullanılan oral antipsikotİkler kesilebilir. XEPLION, yukarıda Bölüm 4.2'nin başlangıcında tarif edildiği şekilde başlatılmahdır.Uzun etkili cnjektabl antipsikotik İlaçlardan XEPLION'a geçiş;Stabil hastalar uzun etkili enjektabİ antipsikotik ikıçlardan KEPLION'ıı geçerken, XEPLİON tedavisi bir sonraki programlanmış enjeksiyon zamanında başlatılmalıdır. XEPLION bundan sonra ayda bir aralıklarla devam edilmelidir. Yukarıda Bölüm 4.2'nin başlangıcında iarif edilen bir haftalık doz uygulaması başlatma rejimi gerekli değildir,RİSPERDAL® CONSTA*' intramüsküier enjeksiyon için uzatılmış .salimli süspansiyonun farklı dozlarında daha önce stabilize olmuş hastalar, ayda bir verilen dozlarla aşağıda tarif edildiği şekilde XEPL10N İle idame tedavisi sırasında benzer paliperidon kararlı durum marnziyetine ulaşabilirler:Kararlı durumda benzer paliperidon maruziyetine ulaşmak için gerekli RİSPERDAL^ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CONSTA^ ve XEPLION dozları | |
Daha önceki RİSPERDAL® CONSTA® Dozu |
XEPLİON Enjeksiyonu |
2 haftada bir 25 mg |
Ayda bir 50 mg |
2 haftada bir 37.5 mg |
Ayda bir 75 mg |
2 haftada bir 50 mg |
Ayda bir 100 mg |
Önceki antipsikotik ilaçların sonlandınlması, doğru reçeteleme bilgileri ile uyumlu olarak yapılmalıdır. XEPLION kullanımı sonlandırılacaksa, uzatılmış salım özelliği göz önüne alınmalıdır. Diğer antipsikotik ilaçların kullanımında önerildiği gibi devam eden ekstrapiramidal semptomlar (EPS) içİn ilaç gereksinimi periyodik olarak yeniden değerlendirilmelidir.
Özel popÜlasyonlara ilişkin ck bilgiler:
Böbrek yetmezliği:
XEPLION, böbrek yetmezliği olan hastalarda sistematik olarak incelenmemiştir (Bkz. Bölüm 5.2). Hafif böbrek yetmezliği olan hastalarda (kreatinin klerensi >50 - <80 ml/dak,), XEPLÍON'un önerilen başlangıç dozu, tedavinin birinci gününde 100 mg ve bir hafta sonra 75 mg'dır (her ikisi de deltoid kas içine uygulanır). Daha sonra deltoid veya gluteal kas içine hastanın bireysel tolerabiiitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığında ayda bir 50 mg uygulanır.
Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPLION önerilmez.
Karaciğer j'etnıezlİği:
XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiştir. Oral paliperidon ile yapılan çahşmaya göre hafif veya orta derece karaciğer yetmezliği olan hastalarda, doz ayarlamas! gerekli değildir,
Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir (Bkz. Bölüm 5,2). Bu hífslíílarda dikkasli ohınjnalkhr,
Pcdİyatrik popülasyon:
XEPLION'un çocukiarda ve 18 yaşm altındaki hastalarda güvenliliği ve etkinliği incelenmemiştir,
Giiriyatrik popülasyon:
XBPLIONHÍÍ! ETKILIHÖI VE GIIVENYIIIĞI 65 YAŞ ÜSÜI H;SHT;ıHU'DA K;INIÜ[INNıAMİ;JLIR.
Genel olarak, böbrek fonksiyonu normal olan yaşlı hastalarda, XEPLION'un önerilen dozu, böbrek fonksiyonu normal olan genç erişkin hastalarda önerilen dozla aynıdır. Yaşlı hastalarda böbrek fonksiyonları azalabil ece ğinden, böbrek fonksiyonunun durumuna göre doz ayarlaması gerekebilir (Bkz, Bölüm 4.2).
XEPLION, inme için risk faktörüne sahip demansh yaşlı hastalarda dikkatli kullanılmahdir (Bkz. Bölüm 4.4),
Diğer
XEPL10N için cinsiyet, ırk veya sigara kullanımına bağlı olarak doz ayarianıası yapılması önerilmez (Gebe kadınlar ve emziren anneler için Bkz, Bolüm 4.6),
4.3. Konirendikasyonlar
Paliperidon palmitat veya yardımcı maddelerden herhangi birine karşı aşın duyariilığı olduğu bilinen hastalarda kontrendikedir,
Paliperidon, risperidonun aktif bir melaboliti olduğu için XEPLION risperidona karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. özel kuHanını uyanları ve önlemleri
QT Aralığı: :
Diger anlipsikotikİerle olduğu gibi, bilinen kiirdiyovasküler lıastalığı olan veya ailesinde QT uzama öyküsü olan hastalarda ve QT arahgını uzattığı düşünülen diğer İlaçlar ile birlikte kullanılacagi durumlarda, XEPLION reçete I en irken dikkatli olunmalıdır.
Nöroleptik malign senârom
Hiperiermi, kas rijiditesi, otonomik instabilité, bilinç değişikliği ve serum kreatinin fosfokinaz seviyelerinde yükselme ile karakterize olan nöroleptik malign sendrom'un (NMS), paiiperidon da dahil; antipsikotik ilaçlar İle oluştuğu bildirilmiştir. Ek klinik belirtiler arasında nıiyoglobülinüri (rabdomiyoliz) ve akut böbrek yetmezliği de bulunabilir. Eğer bir hastada NMS işaret eden bulgu ve semptomlar gelişirse, XEPLION da dahil olmak üzere lüm antipsikotik ilaçlar kesilmelidir.
Tardif Diskinezi
Dopamin reseptör antagonisti özelliğine sahip ilaçlar, özellikle dil ve/veya yüzde, ritmik, istem dişt hareketlerle karakterize olan tardif diskinezinin indüksiyonu ile ilişkili bulunmuştur. Eğer tardif diskinezinin bulgu ve semptomları ortaya çıkarsa, XEPLÏON da dahil olmak üzere tüm antipsikotik ilaçların kesilmesi değerlendirilmelidir.
Hİperı^lisemi
XEPLÍON'ÚCyapiias'i kHnik caiışnıalardij seyrek olanak giırko/if bağİL iKİvcrs okivhy, öro.; kan glüka;^ düzeyinde artiş bıkfniirnişiir. Diğer anüpHÏkotik ilaçhirla oldnğü gibi, diyabeyolmve diabeies n^eHiius ri^k İakförleri ü^Şiyan İKiHlularÜLS, uygını kiioik
izleme önerHir, . ^ . .
Hspefpr^Hakiineini ■■ . . . . ■ . ■ ■ . . . . ■
Doku ktlhürii Císhsniakin ineme iürııörlerbıde hücre bíjyüí??esinín prolakijn laniinKİan stirvıok edilebiieceğini btiİHinıekicdir. KHnik ve epíden?iyoio*ík tahsniLihLrdLs aïMİiiSfkoiik kiíilaoímí dii ilişkisi acík bir şekikJe göKlciileınenıiş oİsa d;i, ílgíH übbi övkösü ohnı haslaiarda dikkiHli olunoiasï önerilmektedir, Paiiperidon palinïiai ohíss prokjktine bağh tüiiıörü olan basialarda dikkiUH ksdiandfiKihdn",
Kilo Alma
Atipik antipsikotik kullanımıyla birlikte kilo alımı gözlenmiştir. Kilonun klinik olarak izlenmesi tavsiye edilmektedir.
Ortosíütik hipotansiyon
Paliperidon, alfa-btokör aktivitesinden dobyı baz! hastalarda ortostatik hipotansiyonu indükleyebiiir, Oral paliperidon (INVEGA 3 mg, 6 mg, 9 rag ve 12 mg) ile yapılan plasebo kontrollü, 6 haftalık, sabit dozlu üç çalışmanın birleştirilmiş verilerine göre, plasebo ile tedavi edilen deneklerin %0,8'ine karşılık oral paliperidon iie tedavi edilen deneklerin %2,5'inde oriostatik hipotansiyon biidirilmiştir. XEPLION, bilinen kartliyovasküler hastalığı olan hastalarda (örn.; kalp yetmezliği, miyokart infarktüsü veya iskemi, ileti anormallikleri), serebrovasküler hastalığı veya hipotansiyona neden oktbilecek durumlarda (örn.; dehidratasyon, hipovolemi ve antihipertansif ilaçlarla tedavi) dikkatli kullanılmalıdır.
Nöbetler
XEPLION, diğer antipsikotik ilaçlarda olduğu gibi nöbet öyküsü olan hastalarda veya nöbet eşiğini potan.siyel olarak düşüren diğer koşulların bulunduğu hastalarda dikkatli kullanılmalıdır.
Böbrek yetmezliği
Paliperidonun plazma konsantrasyonu, böbrek yetmezliği olan ha.stalarda artmıştır ve bu nedenle hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmektedir. Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ınl/dak.) XEPLION önerilmez (Bkz, Bölüm 4.2 ve Bölüm 5.2),
Karaciğer yetmezliği
Paliperidon, ağır karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) incelenmemiştir. Paliperidon, bu tür hastalarda kullanılıyorsa dikkatli olunması önerilir.
Demcmxi olan yaÿlt hastalar
Konvamiyünol ve aüptk antipsikotik İlaçlar demansa bağiı p.sİkozu olan yaşlı hastaların tedavisinde kullanıldığında ölüm riskinde artışa neden olmaktadır.
XEíPLíON demaiisi ohiii yaşh hashyarua çaiiÿdnmniï^ür. İrince için ii^ik farkíorlij deınanH! olan yaşh lıasliihirdis dikkaiii kunaiHhıushdy,
Genel mortalité
17 kontrollü klinik çalışmanın meta-analizinde, risperidon, aripiprazol, olanzapin ve ketiapin dahil olmak üzere diğer atipik antipsikotik ilaçlarla tedavi edilen ve demansı olan yaşh hastalarda, mortalité riski plaseboya kıyasla artmıştır. Risperidon ile tedavi edilen hastalarda, plasebo için %3.1 olan mortalité %4 olmuştur.
SerehrovasküU'f advers olaylar
Randomize plasebo kontrollü klinik çalışmalarda, risperidon, aripiprazol ve olanzapin gibi bazı atipik antipsikotik ilaçlarla tedavi edilen demanslı yaşlı hastalarda serebrovasküler advers olaylarda yaklaşık 3 kat artmış risk görülmüştür. Bu artmış riskin mekanizması bilinmemektedir. XEPLION, inme açı.smdan risk faktörieri taşıyan demanslı yaşlı hastalarda dikkatli kullanılmalıdır,
lJ)kopeıu, Nötropenivé'Agraııiilositoz
XEPLION dahil olmak üzere, antipsikotik ajanlarla lökopeni, nötropeni ve agranülositoz olayları bildirilmiştir. Pazariama sonrası denetim sırasında agranülosiloz çok nadiren (<1/10.000 hasta) biidirilmiştir.
Klinik olarak anlamlı düzeyde düşük beyaz kan hücresi (WBC) sayımı veya ilaçla tetiklenmiş lökopeni/nötropeni öyküsüne sahip hastalar tedavinin ilk birkaç ayı boyunca izlenmeli ve ortada başka nedensel faktörler yokken WBC'de klinik olarak anlamlı bİr düşüşe yönelik ilk belirtide XEPLION kullanımına son verilmesi düşünülmelidir.
Klinik olarak anlamlı nötropenisi olan hastalar ateş veya diğer enfeksiyon semptomları veya belirtileri açısından dikkatle izlenmeli ve bu tür semptomlar veya belirtilerin ortaya çıkma,sı halinde derhal tedavi edilmelidir. Şiddetli nötropenisi olan hastalar (mutlak nötrofil sayımı <1 X IO'VL) XEPLION kullanımına son vermeli ve iyileşene kadar WBC düzeylerini takip ettirmelidir.
Venöz tromhaemholik olay
Antipsikotik ilaçlarla venÖz tromboembolik olaylar (VTE) bildirilmiştir. Antipsikotik ilaç tedavisi gören ha,stalarda çoğunlukla kazanılmış VTE risk faktörleri bulunduğu için, VTE için tüm olası risk faktörleri, XEPLION ile tedaviden önce ve tedavi süresince tanımlanmalı ve koruyucu önlemler alınmalıdır.
Parkinson Hastalığı ve Le\vy Cisimcikli Denuıns
Parkinson hastalığı veya Lewy cisimcikli demanslı hastalara XEPLION da dahil olmak üzere antipsikotik ilaçlar reçete edilirken doktoriar yarar risk değerlendirmesi yapmalıdır; çünkü her iki hasta grubunda da, antipsikotik ilaçlara karşı duyarlılığın artmış olması ile birlikle Nöroleptik Malign Sendrom riski artmış olabilir. Bu artmış duyarlılığın belirtileri, ekstrapiramidal semptomlara ek olarak konfüzyon, obtundasyon, sık düşmeler ile birlikte postural instabilité olabilir.
Priapizm
Alfa-üdrenerjik blokör etkileri oltın antipsikotik ilaçların {risperidon dahil), priapİzmi indiikledigi bildirilmiştir. Pazarlama sonrası gözetim esnasında paiiperidon ile priapizm bildirilmiştir. Hastalar, priapizmin 3-4 saat içinde düzelmemesi durumunda aciİ tıbbi yardım almaları konusunda bilgilendirilmelidir (Bkz, Bölüm 4.8).
Vücut isixinm kontrolü
Vücudun iç vücut ısısını düşürme yeteneğinin bozulması, antipsikotik ilaçlara bağlanmıştır. Aşırı egzersiz yapmak, aşın sıeağa maruziyet, antikolinerjik aktivitesi olan ilaçların eş zamanlı uygulanması veya dehidratasyon bulunması gibi iç vücut ısısında yükselmeye katkıda bulunabilecek koşullun olan hastalara XEPLION reçete edilirken dikkatli olunması önerilir,
Aniiemeiik eikİ
Paiiperidon ile yapılan klinik öncesi çalışmalarda, aniiemetik etki gözlenmiştir. Bu etki, eğer insanlarda oluşursa, bağırsak tıkanması. Reye sendromu ve beyin tümörü gibİ durumları veya belli ilaçların aşırı doz bulgu ve semptomlarını maskeleyebilir.
Uygulama
XEPLION'un kan damarı içine kaza ile enjekte edilmesinin önlenmesi için dikkatli olunmalıdır,
XEPLION her mi'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. Sodyuma bağlı herhangi bir etki gözlenmez.
4.5. Diğer Ubbi ürünler ile eikilcşimlcr ve diğer etkileşim şekilleri
XEPLION'un QT aralığını uzattığı bilinen ilaçlar, örn.; sınıf lA aniiarilmikler (örn.; kinidin, disopraniid) ve sınıf III antiaritınikler (örn.; amioüaron, solalol), bazı antihistaminikler, bazı diğer anlipsikotik ilaçlar ve bazı antimalaryaller (örn.; meflokin) ile birlikte reçete ederken dikkatli olunması önerilir.
Paiiperidon palmitat, paliperidona hidroliz olduğu için (Bkz. Bolüm 5.2), ilaç-ilaç etkileşim potansiyeli değerlendirilirken oral paiiperidon ile yapılan çalışmaların bulguları göz ününde bulundurulmalıdır.
XEPLION'un diğer ilaçları etkileme potansiyeli
Paliperidonun, sitokrom P-450 izoenzimleri ile metaboiize olan ilaçlar ile klinik açıdan önemli farmakokinetik etkileşimlere neden olma.sı beklenmemektedir. İnsan karaciğer mikrozomlannda yapılanitt viiroçatışmalar, paliperidonun, CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5 de dahil olmak üzere silokrom P450 izoenzİmleri tarañndan metabolize edilen ilaçların metabolizmasını önemli derecede baskılamadığım göstermiştir. Bu nedenle, paliperidonun, bu metabolik yolaklarla metabolize edilen ilaçların klerensini klinik açıdan belirgin bir biçimde baskılaması beklenmemektedir. Paliperidonun, ayrıca enzİm indükleyici özelliklerinin olması beklenmemekledir.
Paliperidon, yüksek konsantrasyonlarda P-glikoproEeinin (P-gp) zayıf bir inhibitörüdür.Jni'/vo veri mevcut değildir ve klinik açıdan ilişki bilinmemektedir.
Paliperidonun santral sinir sistemi üzerindeki primer etkileri ele alındığında (Bkz. Bölüm 4.8), XEPLION diğer santral eikili ilaçlar, örn.; anksiyolilikler, antİpsikotiklerin çoğu, hİpnotikler, opiatlar, vb. veya alkol ile birlikte dikkatli kullanılmalıdır.
Paliperidon, levodopa ve diğer dopamin agonistlerinin etkilerini antagonİze edebilir. Bu kombinasyonun gerekli olduğuna kanır verilirse, özellikle son evre Parkinson hastalığında her bir tedaviye ilişkin en düşük etkili doz reçete edilmelidir.
Ortostatİk hipotansiyonu indükleme potansiyeli nedeni ile (Bkz. Bolüm 4.4), XEPLION bu potansiyele sahip olun diğer terapötik ilaçlar, örn.; diğer antipsikotik ilaçlar, irisiklikler iie birlikle uygulandığı zaman adilif etki gözlenebilir.
Paliperidon nöbet eşiğini düşürdüğü bilinen diğer ilaçlar ile birlikle kombine edilirse dikkatli olunması önerilir (yani fenotiyazinler veya butirofenonlar, trisiklikler veya SSRI'lar, tranıadol, meilokin, vb.).
Kararlı durumdaki oral uzatılmış salimli paliperidon tabletlerin (günde bir kez 12 mg) uzatılmış salimli divaiproeks sodyum tabletlerle (günde bir kez 500 mg ila 2000 mg) eşzamanlı olarak uygulanması, valproatm kararlı durum Tarmakokinetiğini etkilememiştir.
XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir.
Diğer ilaçların XEPLION'u etkileme potansiyelleri
Paliperidon, CYPIA2, CYP2A6, CYP2C9, CYP2Cİ9 ve CYP3A5'in bir substratt değildir. Bu durum, bu izoenzimlerin inhibilürleri veya İndükleyicileri ile bir etkileşimin olası olmadığını düşündürmektedir.In vitmçalışmalar, CYP2D6 ve CYP3A4'ün paliperidon metabolizmasında minimal olarak görev aldığım gösterse de, bu izoenzimlerin, paliperidon metabolizmasında önemli bir rol oynadığına ilişkinin vitroveyain vivobulgular yoktur.In vitroçalışmalar, paliperidonun bir P-gp substratı olduğunu göstermiştir.
Püliperidon, CYP2D6 ile kısıtlı derecede metabolize edilir (Bkz. Bölüm 5.2), Sağlıklı gönıillülerde yapılan bir etkileşme çalışmasında, oral paliperidonun güçlü bir CYP2D6 İnhibitörü olan paroksetinle birlikte uygulanması sonucu paliperidonun farmukokinetiği üzerinde klinik açıdan belirgin bir etki gözlenmemiştir.
Günde bir kere uygulanan uzatılmış salimli oral paliperidonun günde iki kere 200 mg karbamazepin İle biriikle uygulanması, paliperidonun ortalama kararlı durum Cmax ve EAA değerlerinde yaklaşık olarak %37 oranında bir düşüşe neden olmuştur. Bu düşüş, büyük ölçüde, karbamazepin tarafından renal P-gp'nin indüklenmesinin bir sonucu olarak paliperidonun renal klerensinde %35 oranmda artışa bağlıdır, Karbamazepİnin eş zamanlı olarak uygulanması esna.sında, idrarla değişmeden atdan ilaç miktarmda minör bir azalma, paliperidonun CYP metabolizması veya biyoyarariammı üzerinde düşük derecede etki olduğunu düşündürmektedir, Karbamazepin kullanımına başlandığında XEPLION dozu yeniden değerlendirilmeli ve gerekirse arttırılmalıdır. Bu durumun tersine, karbamazepin kullanımı kesildiğinde XEPL10N dozu yeniden değeri endi ril mel i ve gerekirse azaltılmalıdır.
Fizyolojik pH koşullannda bir katyon olan paliperidon, yaklaşık olarak yansı filtrasyon, yansı aktif sekresyon yolu ile primer olarak değişmeden böbreklerden atılır. Böbrekte katyonik ilaçların aktif taşınmasını baskıladığı bilinen bir iiaç olan trimetroprimin eş zamanlı olarak uygulanması, paliperidonun farmakokinetiğini etküemeıniştir.
12 mg oral uzatılmış salimli paliperidon tabletin tekli bir dozunun, uzatılmış salimli divalproeks sodyum tabletlerle (günde bir kez iki 500 mg'lık tablet) eşzamanlı olarak uygulanması muhtemelen artmış oral absorpsiyonun bir sonucu olarak paliperidonun C,rux ve EAA'sında yaklaşık %50'lİk bir artışla sonuçlanmıştır. Sistemik klerenste herhangi bir elki gözlenmediğinden, uzatılmış salimli divalproeks sodyum tabletler ve XEPL10N'un intramüsküier enjeksiyonu arasında klinik olarak anlamlı bir etkileşim beklenmemekledir. Bu etkileşim XEPLION ile çalışılmamıştır.
XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir.
XEPLION'un Risperidon ile birlikle kullanımı
XEPLION'un risperidon ile biriikte kullammı incelenmemiştir. Paliperidon, risperidonun aktif bir metabolili olduğu için risperidon XEPLION ile biriikte kullanılacaksa, aditif paliperidon maruziyeti göz önüne alınmalıdır.
4.6. Gebelik ve laklasyon Genel tavsiyeGebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan katImlar/Doğum kontrolü (Kontrasepsiyon)
Hayviinlar üzerinde yapılan araştırniitbr Üreme toksisitesinin bulunduğunu göstermiştir.
(Bkz. Bölüm 5.3), tn.sanlara yönelik potansiyel ılsk bilinmemektedir.
Gebelik dönemi
XEPLION'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. XEPLION, ke.sin gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Yüksek doz oral paiiperidon ile tedavi edilen laboratuar hayvanlarında fetal ölümlerde hafif bir artış görülmüştür, intramüsküler enjeksiyonla paiiperidon palmitat uygulanan sıçanlarda, gebelik parametreleri etkilenmemiştir. Yüksek dozlar, anneler için tok,sik olmuştur. Maksimum insan maruziyetinin 20-22 katı daha yüksek olan oral dozlar veya maksimum insan maruziyetinin 6 katı daha yüksek intramüsküler dozlar, fetüsü etkilememiştir. XEPLÍON'un insanda dogiım sancısı ve doğum üzerindeki etkisi bilinmemektedir.
Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (paiiperidon da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti değişebilen, anormal kas hareketleri (ekstrapiramidal işaretleı7ek,strapiramidal semptomlar) ve/veya ilaç kesilme semptomları açısından risk altmdadırlar. Bu semptomlar, ajiiasyon, hipertoni, hipotoni, tremor, somnolans, respiratuar distres veya beslenme bozukluklarım içermektedir.
Laktasyon dönemi
Paiiperidon anne .sütü ile atılmaktadır (süte geçmektedir). XEPLÍON emzirme döneminde kullanılniiimalıdtr.
Üreme yeleneği/Fertilite
Oral paiiperidon tedavisi, prolakiin- ve santral sinir sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo sayısında çok az bir düşüş gösiermiştir.
4.7. Araç ve makine kullanımı Üzerindeki etkiler
XEPL10N, zihin açıkhği gerektiren aktivitelere engel olabilir ve ^edasyon. senkop ve bülaruk gÖıii?e gibi görsel etkilere neden olabilir (Bkz, Bolüm 4.8). Bu nedenle hastalar, XEPLION'a karşı bireyse! dııyarlıiıkhırı bilinene kadar araç veya makine kullanmamaları konusunda uyartimahdır.
4.8. İstenmeyen etkiler
Klinik çalışmalarda en sık bildirilen adver.s ilaç reaksiyonları (ADR'ier) insomnia, baş ağrısı, kilo alımı, enjeksiyon bölgesi reaksiyonları, ajitasyon, somnolans, akatizi, bulantı, konstipasyon, sersemlik, tremor, kusma, üst solum yolu enfeksiyonu, diyare ve taşikardidir. Bu advers ilaç reaksiyonları arasından akatizi dozla ilişkili olarak onaya çıkmaktadır.
Aşağıda verilen tüm ADR'1er klinik çalışmalarda XEPLION ile tedavi edilen hastalardan bildirilen reaksiyonlardır. Şu terimler ve sıklık dereceleri kullanılmıştır:
Çok yaygın (>t/10); yaygın (>1/IÜ0 ile <1/10); yaygın olmayan (>1/1OÛO ile <1/100); seyrek (>1/10.000 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Doku ktlhürii Císhsniakin ineme iürııörlerbıde hücre bíjyüí??esinín prolakijn laniinKİan stirvıok edilebiieceğini btiİHinıekicdir. KHnik ve epíden?iyoio*ík tahsniLihLrdLs aïMİiiSfkoiik kiíilaoímí dii ilişkisi acík bir şekikJe göKlciileınenıiş oİsa d;i, ílgíH übbi övkösü ohnı haslaiarda dikkiHli olunoiasï önerilmektedir, Paiiperidon palinïiai ohíss prokjktine bağh tüiiıörü olan basialarda dikkiUH ksdiandfiKihdn",
Kilo Alma
Atipik antipsikotik kullanımıyla birlikte kilo alımı gözlenmiştir. Kilonun klinik olarak izlenmesi tavsiye edilmektedir.
Ortosíütik hipotansiyon
Paliperidon, alfa-btokör aktivitesinden dobyı baz! hastalarda ortostatik hipotansiyonu indükleyebiiir, Oral paliperidon (INVEGA 3 mg, 6 mg, 9 rag ve 12 mg) ile yapılan plasebo kontrollü, 6 haftalık, sabit dozlu üç çalışmanın birleştirilmiş verilerine göre, plasebo ile tedavi edilen deneklerin %0,8'ine karşılık oral paliperidon iie tedavi edilen deneklerin %2,5'inde oriostatik hipotansiyon biidirilmiştir. XEPLION, bilinen kartliyovasküler hastalığı olan hastalarda (örn.; kalp yetmezliği, miyokart infarktüsü veya iskemi, ileti anormallikleri), serebrovasküler hastalığı veya hipotansiyona neden oktbilecek durumlarda (örn.; dehidratasyon, hipovolemi ve antihipertansif ilaçlarla tedavi) dikkatli kullanılmalıdır.
Nöbetler
XEPLION, diğer antipsikotik ilaçlarda olduğu gibi nöbet öyküsü olan hastalarda veya nöbet eşiğini potan.siyel olarak düşüren diğer koşulların bulunduğu hastalarda dikkatli kullanılmalıdır.
Böbrek yetmezliği
Paliperidonun plazma konsantrasyonu, böbrek yetmezliği olan ha.stalarda artmıştır ve bu nedenle hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmektedir. Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ınl/dak.) XEPLION önerilmez (Bkz, Bölüm 4.2 ve Bölüm 5.2),
Karaciğer yetmezliği
Paliperidon, ağır karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) incelenmemiştir. Paliperidon, bu tür hastalarda kullanılıyorsa dikkatli olunması önerilir.
Demcmxi olan yaÿlt hastalar
Konvamiyünol ve aüptk antipsikotik İlaçlar demansa bağiı p.sİkozu olan yaşlı hastaların tedavisinde kullanıldığında ölüm riskinde artışa neden olmaktadır.
XEíPLíON demaiisi ohiii yaşh hashyarua çaiiÿdnmniï^ür. İrince için ii^ik farkíorlij deınanH! olan yaşh lıasliihirdis dikkaiii kunaiHhıushdy,
Genel mortalité
17 kontrollü klinik çalışmanın meta-analizinde, risperidon, aripiprazol, olanzapin ve ketiapin dahil olmak üzere diğer atipik antipsikotik ilaçlarla tedavi edilen ve demansı olan yaşh hastalarda, mortalité riski plaseboya kıyasla artmıştır. Risperidon ile tedavi edilen hastalarda, plasebo için %3.1 olan mortalité %4 olmuştur.
SerehrovasküU'f advers olaylar
Randomize plasebo kontrollü klinik çalışmalarda, risperidon, aripiprazol ve olanzapin gibi bazı atipik antipsikotik ilaçlarla tedavi edilen demanslı yaşlı hastalarda serebrovasküler advers olaylarda yaklaşık 3 kat artmış risk görülmüştür. Bu artmış riskin mekanizması bilinmemektedir. XEPLION, inme açı.smdan risk faktörieri taşıyan demanslı yaşlı hastalarda dikkatli kullanılmalıdır,
lJ)kopeıu, Nötropenivé'Agraııiilositoz
XEPLION dahil olmak üzere, antipsikotik ajanlarla lökopeni, nötropeni ve agranülositoz olayları bildirilmiştir. Pazariama sonrası denetim sırasında agranülosiloz çok nadiren (<1/10.000 hasta) biidirilmiştir.
Klinik olarak anlamlı düzeyde düşük beyaz kan hücresi (WBC) sayımı veya ilaçla tetiklenmiş lökopeni/nötropeni öyküsüne sahip hastalar tedavinin ilk birkaç ayı boyunca izlenmeli ve ortada başka nedensel faktörler yokken WBC'de klinik olarak anlamlı bİr düşüşe yönelik ilk belirtide XEPLION kullanımına son verilmesi düşünülmelidir.
Klinik olarak anlamlı nötropenisi olan hastalar ateş veya diğer enfeksiyon semptomları veya belirtileri açısından dikkatle izlenmeli ve bu tür semptomlar veya belirtilerin ortaya çıkma,sı halinde derhal tedavi edilmelidir. Şiddetli nötropenisi olan hastalar (mutlak nötrofil sayımı <1 X IO'VL) XEPLION kullanımına son vermeli ve iyileşene kadar WBC düzeylerini takip ettirmelidir.
Venöz tromhaemholik olay
Antipsikotik ilaçlarla venÖz tromboembolik olaylar (VTE) bildirilmiştir. Antipsikotik ilaç tedavisi gören ha,stalarda çoğunlukla kazanılmış VTE risk faktörleri bulunduğu için, VTE için tüm olası risk faktörleri, XEPLION ile tedaviden önce ve tedavi süresince tanımlanmalı ve koruyucu önlemler alınmalıdır.
Parkinson Hastalığı ve Le\vy Cisimcikli Denuıns
Parkinson hastalığı veya Lewy cisimcikli demanslı hastalara XEPLION da dahil olmak üzere antipsikotik ilaçlar reçete edilirken doktoriar yarar risk değerlendirmesi yapmalıdır; çünkü her iki hasta grubunda da, antipsikotik ilaçlara karşı duyarlılığın artmış olması ile birlikle Nöroleptik Malign Sendrom riski artmış olabilir. Bu artmış duyarlılığın belirtileri, ekstrapiramidal semptomlara ek olarak konfüzyon, obtundasyon, sık düşmeler ile birlikte postural instabilité olabilir.
Priapizm
Alfa-üdrenerjik blokör etkileri oltın antipsikotik ilaçların {risperidon dahil), priapİzmi indiikledigi bildirilmiştir. Pazarlama sonrası gözetim esnasında paiiperidon ile priapizm bildirilmiştir. Hastalar, priapizmin 3-4 saat içinde düzelmemesi durumunda aciİ tıbbi yardım almaları konusunda bilgilendirilmelidir (Bkz, Bölüm 4.8).
Vücut isixinm kontrolü
Vücudun iç vücut ısısını düşürme yeteneğinin bozulması, antipsikotik ilaçlara bağlanmıştır. Aşırı egzersiz yapmak, aşın sıeağa maruziyet, antikolinerjik aktivitesi olan ilaçların eş zamanlı uygulanması veya dehidratasyon bulunması gibi iç vücut ısısında yükselmeye katkıda bulunabilecek koşullun olan hastalara XEPLION reçete edilirken dikkatli olunması önerilir,
Aniiemeiik eikİ
Paiiperidon ile yapılan klinik öncesi çalışmalarda, aniiemetik etki gözlenmiştir. Bu etki, eğer insanlarda oluşursa, bağırsak tıkanması. Reye sendromu ve beyin tümörü gibİ durumları veya belli ilaçların aşırı doz bulgu ve semptomlarını maskeleyebilir.
Uygulama
XEPLION'un kan damarı içine kaza ile enjekte edilmesinin önlenmesi için dikkatli olunmalıdır,
XEPLION her mi'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. Sodyuma bağlı herhangi bir etki gözlenmez.
4.5. Diğer Ubbi ürünler ile eikilcşimlcr ve diğer etkileşim şekilleri
XEPLION'un QT aralığını uzattığı bilinen ilaçlar, örn.; sınıf lA aniiarilmikler (örn.; kinidin, disopraniid) ve sınıf III antiaritınikler (örn.; amioüaron, solalol), bazı antihistaminikler, bazı diğer anlipsikotik ilaçlar ve bazı antimalaryaller (örn.; meflokin) ile birlikte reçete ederken dikkatli olunması önerilir.
Paiiperidon palmitat, paliperidona hidroliz olduğu için (Bkz. Bolüm 5.2), ilaç-ilaç etkileşim potansiyeli değerlendirilirken oral paiiperidon ile yapılan çalışmaların bulguları göz ününde bulundurulmalıdır.
XEPLION'un diğer ilaçları etkileme potansiyeli
Paliperidonun, sitokrom P-450 izoenzimleri ile metaboiize olan ilaçlar ile klinik açıdan önemli farmakokinetik etkileşimlere neden olma.sı beklenmemektedir. İnsan karaciğer mikrozomlannda yapılanitt viiroçatışmalar, paliperidonun, CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5 de dahil olmak üzere silokrom P450 izoenzİmleri tarañndan metabolize edilen ilaçların metabolizmasını önemli derecede baskılamadığım göstermiştir. Bu nedenle, paliperidonun, bu metabolik yolaklarla metabolize edilen ilaçların klerensini klinik açıdan belirgin bir biçimde baskılaması beklenmemektedir. Paliperidonun, ayrıca enzİm indükleyici özelliklerinin olması beklenmemekledir.
Paliperidon, yüksek konsantrasyonlarda P-glikoproEeinin (P-gp) zayıf bir inhibitörüdür.Jni'/vo veri mevcut değildir ve klinik açıdan ilişki bilinmemektedir.
Paliperidonun santral sinir sistemi üzerindeki primer etkileri ele alındığında (Bkz. Bölüm 4.8), XEPLION diğer santral eikili ilaçlar, örn.; anksiyolilikler, antİpsikotiklerin çoğu, hİpnotikler, opiatlar, vb. veya alkol ile birlikte dikkatli kullanılmalıdır.
Paliperidon, levodopa ve diğer dopamin agonistlerinin etkilerini antagonİze edebilir. Bu kombinasyonun gerekli olduğuna kanır verilirse, özellikle son evre Parkinson hastalığında her bir tedaviye ilişkin en düşük etkili doz reçete edilmelidir.
Ortostatİk hipotansiyonu indükleme potansiyeli nedeni ile (Bkz. Bolüm 4.4), XEPLION bu potansiyele sahip olun diğer terapötik ilaçlar, örn.; diğer antipsikotik ilaçlar, irisiklikler iie birlikle uygulandığı zaman adilif etki gözlenebilir.
Paliperidon nöbet eşiğini düşürdüğü bilinen diğer ilaçlar ile birlikle kombine edilirse dikkatli olunması önerilir (yani fenotiyazinler veya butirofenonlar, trisiklikler veya SSRI'lar, tranıadol, meilokin, vb.).
Kararlı durumdaki oral uzatılmış salimli paliperidon tabletlerin (günde bir kez 12 mg) uzatılmış salimli divaiproeks sodyum tabletlerle (günde bir kez 500 mg ila 2000 mg) eşzamanlı olarak uygulanması, valproatm kararlı durum Tarmakokinetiğini etkilememiştir.
XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir.
Diğer ilaçların XEPLION'u etkileme potansiyelleri
Paliperidon, CYPIA2, CYP2A6, CYP2C9, CYP2Cİ9 ve CYP3A5'in bir substratt değildir. Bu durum, bu izoenzimlerin inhibilürleri veya İndükleyicileri ile bir etkileşimin olası olmadığını düşündürmektedir.In vitmçalışmalar, CYP2D6 ve CYP3A4'ün paliperidon metabolizmasında minimal olarak görev aldığım gösterse de, bu izoenzimlerin, paliperidon metabolizmasında önemli bir rol oynadığına ilişkinin vitroveyain vivobulgular yoktur.In vitroçalışmalar, paliperidonun bir P-gp substratı olduğunu göstermiştir.
Püliperidon, CYP2D6 ile kısıtlı derecede metabolize edilir (Bkz. Bölüm 5.2), Sağlıklı gönıillülerde yapılan bir etkileşme çalışmasında, oral paliperidonun güçlü bir CYP2D6 İnhibitörü olan paroksetinle birlikte uygulanması sonucu paliperidonun farmukokinetiği üzerinde klinik açıdan belirgin bir etki gözlenmemiştir.
Günde bir kere uygulanan uzatılmış salimli oral paliperidonun günde iki kere 200 mg karbamazepin İle biriikle uygulanması, paliperidonun ortalama kararlı durum Cmax ve EAA değerlerinde yaklaşık olarak %37 oranında bir düşüşe neden olmuştur. Bu düşüş, büyük ölçüde, karbamazepin tarafından renal P-gp'nin indüklenmesinin bir sonucu olarak paliperidonun renal klerensinde %35 oranmda artışa bağlıdır, Karbamazepİnin eş zamanlı olarak uygulanması esna.sında, idrarla değişmeden atdan ilaç miktarmda minör bir azalma, paliperidonun CYP metabolizması veya biyoyarariammı üzerinde düşük derecede etki olduğunu düşündürmektedir, Karbamazepin kullanımına başlandığında XEPLION dozu yeniden değerlendirilmeli ve gerekirse arttırılmalıdır. Bu durumun tersine, karbamazepin kullanımı kesildiğinde XEPL10N dozu yeniden değeri endi ril mel i ve gerekirse azaltılmalıdır.
Fizyolojik pH koşullannda bir katyon olan paliperidon, yaklaşık olarak yansı filtrasyon, yansı aktif sekresyon yolu ile primer olarak değişmeden böbreklerden atılır. Böbrekte katyonik ilaçların aktif taşınmasını baskıladığı bilinen bir iiaç olan trimetroprimin eş zamanlı olarak uygulanması, paliperidonun farmakokinetiğini etküemeıniştir.
12 mg oral uzatılmış salimli paliperidon tabletin tekli bir dozunun, uzatılmış salimli divalproeks sodyum tabletlerle (günde bir kez iki 500 mg'lık tablet) eşzamanlı olarak uygulanması muhtemelen artmış oral absorpsiyonun bir sonucu olarak paliperidonun C,rux ve EAA'sında yaklaşık %50'lİk bir artışla sonuçlanmıştır. Sistemik klerenste herhangi bir elki gözlenmediğinden, uzatılmış salimli divalproeks sodyum tabletler ve XEPL10N'un intramüsküier enjeksiyonu arasında klinik olarak anlamlı bir etkileşim beklenmemekledir. Bu etkileşim XEPLION ile çalışılmamıştır.
XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir.
XEPLION'un Risperidon ile birlikle kullanımı
XEPLION'un risperidon ile biriikte kullammı incelenmemiştir. Paliperidon, risperidonun aktif bir metabolili olduğu için risperidon XEPLION ile biriikte kullanılacaksa, aditif paliperidon maruziyeti göz önüne alınmalıdır.
4.6. Gebelik ve laklasyon Genel tavsiyeGebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan katImlar/Doğum kontrolü (Kontrasepsiyon)
Hayviinlar üzerinde yapılan araştırniitbr Üreme toksisitesinin bulunduğunu göstermiştir.
(Bkz. Bölüm 5.3), tn.sanlara yönelik potansiyel ılsk bilinmemektedir.
Gebelik dönemi
XEPLION'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. XEPLION, ke.sin gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Yüksek doz oral paiiperidon ile tedavi edilen laboratuar hayvanlarında fetal ölümlerde hafif bir artış görülmüştür, intramüsküler enjeksiyonla paiiperidon palmitat uygulanan sıçanlarda, gebelik parametreleri etkilenmemiştir. Yüksek dozlar, anneler için tok,sik olmuştur. Maksimum insan maruziyetinin 20-22 katı daha yüksek olan oral dozlar veya maksimum insan maruziyetinin 6 katı daha yüksek intramüsküler dozlar, fetüsü etkilememiştir. XEPLÍON'un insanda dogiım sancısı ve doğum üzerindeki etkisi bilinmemektedir.
Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (paiiperidon da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti değişebilen, anormal kas hareketleri (ekstrapiramidal işaretleı7ek,strapiramidal semptomlar) ve/veya ilaç kesilme semptomları açısından risk altmdadırlar. Bu semptomlar, ajiiasyon, hipertoni, hipotoni, tremor, somnolans, respiratuar distres veya beslenme bozukluklarım içermektedir.
Laktasyon dönemi
Paiiperidon anne .sütü ile atılmaktadır (süte geçmektedir). XEPLÍON emzirme döneminde kullanılniiimalıdtr.
Üreme yeleneği/Fertilite
Oral paiiperidon tedavisi, prolakiin- ve santral sinir sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo sayısında çok az bir düşüş gösiermiştir.
4.7. Araç ve makine kullanımı Üzerindeki etkiler
XEPL10N, zihin açıkhği gerektiren aktivitelere engel olabilir ve ^edasyon. senkop ve bülaruk gÖıii?e gibi görsel etkilere neden olabilir (Bkz, Bolüm 4.8). Bu nedenle hastalar, XEPLION'a karşı bireyse! dııyarlıiıkhırı bilinene kadar araç veya makine kullanmamaları konusunda uyartimahdır.
4.8. İstenmeyen etkiler
Klinik çalışmalarda en sık bildirilen adver.s ilaç reaksiyonları (ADR'ier) insomnia, baş ağrısı, kilo alımı, enjeksiyon bölgesi reaksiyonları, ajitasyon, somnolans, akatizi, bulantı, konstipasyon, sersemlik, tremor, kusma, üst solum yolu enfeksiyonu, diyare ve taşikardidir. Bu advers ilaç reaksiyonları arasından akatizi dozla ilişkili olarak onaya çıkmaktadır.
Aşağıda verilen tüm ADR'1er klinik çalışmalarda XEPLION ile tedavi edilen hastalardan bildirilen reaksiyonlardır. Şu terimler ve sıklık dereceleri kullanılmıştır:
Çok yaygın (>t/10); yaygın (>1/IÜ0 ile <1/10); yaygın olmayan (>1/1OÛO ile <1/100); seyrek (>1/10.000 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
SistóHi Orgao Simit |
Advers İlaç Rcíikssyoaían | |||
■ ■ ■ Sıklık ■ | ||||
Ç«k |
Yaygın |
Yiiy^Hi OlıiiayısH |
Seyrek | |
En iekHİyoniar enİesiLisvoRİar |
|
Üsi sofunuiHViJİtlciii'eksiy'jnü |
|
|
BiigiiiklikHislenıihíísiahkíarí |
|
|
llipersensinviie |
|
EndokriniıasUih!-,lan |
|
|
Hiperprolaldincrni |
|
Mcüiboli/mLL vebeslcEinıeiíLíHíahkhü'í |
|
KHo :ihniL kLing»lik07düzeyinde yilkSLilniL% k:ijı irigliserit düzey i ¡ide vükselnıe |
Hipcrglİseıni, hipL'rniHülinenii, arijşf, iştah ;iz:jhıiiss], kan kolesteroi dilzeyinde yukselnic |
|
Psíkíyaiiikhaíítahklar |
hısoiTHiia |
Ajitiisyoii |
Kabus |
|
Sinir sisteiTİİ hasushkiaii |
liaş ;!gns! |
Disiorii,parkbiHory/HLakaüzi.diskiiie/Lekstrapiraiiılda!bozukfukfar.irenvjf,serseoılik.soüijıohıns |
Scfikc-p, knnvulsiyon, iurdiİ iJiskİ!ie/i, disarni, psikornolor hiperakliviio. postüral sersenıHk, leiarji |
Nöroiepliknndigiisendnin?,serebmVLiskiderOİLİV |
Go7.hLiSiuhkliirı |
|
|
Biikiiiib görme |
Citk. kayn^aSL göz lıarekei. bo/ökjiigi! |
Kulak ve iç kufak "iiasiahkian |
|
|
Ver!sgo |
|
Kiirdi yak rKLs^iihklar |
|
TaşikLirıll |
Sinüs iaşikardisi, kOiidöksiyoEi öOziiklüğu, birinci derecealrirfventrikiiler hiok, hradikardi, postural oriosiatik laşikardi r-;endrrfiıiü, palpilasyonksr, elekiTokardiyograiTida QT üzamusL normal ohiKsviineleklsr>kardivöi:raıii |
|
Vaskük;!'hai^Uıhklar |
|
¡■lipeiiansrvon |
Oriosıairkhipolansiyon |
|
G:$slroıniCHiin;iliKish'ihklar |
|
Kilis ma, abdoinin:-.sİ ranui?i?7.hk/iisl abdoıninal agrs, diyare, bohiRlı, konsûpasyoo, diş L.İÛİ1Sİ |
Agi/: ktirııiıyğu |
|
[)eri vt; deri ;iln dokyiuiSi^Lİikliirş |
|
Dökiinüi |
tis'tiker, jenemiize kaŞHllL kaŞHH! |
İlaç eriipsiyonü |
Kas'iskelel bozükiukiar, bLiö di)ko ve kernİk Inıslahkluri |
|
Sın agrjHLek^lremüedcagrj |
Miyayi, eklem senliği |
|
İfrenıc sisfenıs ve rneEnc |
|
|
Jinekorna^ü, ereklii disfonksivoo, seksüel |
Merne akiiiüSi |
hiisiahkhMi |
|
|
dİHİ'oiiksiyoiLgaliikkire, amenore,düzeiisiznıe»strih!sy{;>rLiiıenslriici bozííkíuk,gecikiiiişmerisiruasvijiı |
|
Genelbozukh-iklar ve »jygulanKs i^ö^gesine Hişkifi iıasiahk!;.tr |
|
Asiei^İ,cııji:*kh;iyonbölgesinüL'seşl'leşnic.yorgunluk,enjeksiyonbölgesinde agr^ |
Eiijeksiyop bölgesinde kaşintj |
Uyg^danKLböigesbKİe ağiLenjeksiyonbölgesireaksiycsnlan,enjekMİyoribölgesindenodüi |
Aşağıda şizofreni tedavisinde orai paiiperidon ile bildirilen ek advers ilaç reaksiyonları sıralanmıştır:
Enfeksİyoıihir ve enfei-lasyoniar |
Yaygin: Nazo!'arai\jiiYaygin ohnayan: İdrar yolo erdeksiyonu, vinit |
liaü!s?kiik sisıend iıasudıklari |
Seyrek: Anaİikskiik reaksbviHi |
Psikivatrik İKiSlabkkir |
Yaygsn (ilınayan: Uyko bo/okhmy |
Sifbr sislcrıd hasşahkkifi |
Seyrek: Geçici Kkendk afak. grandmal bijinadsiyon |
Kiirdiyak iuiKUilık^ar |
Yaygin olrnayaii: Sinüs ariüıdsi Seyrek: Soi d;d bıogu |
Va^ikyler hastabkkM' |
Yaygii? ohı^ayaır I HpolaBsiyoss Sevrek: iskeoii |
Si:;hiBynK göğüs bo/ukluklan ve |
Yaygın: Öksüriik, İaringobirlrıgca^ ağrı, nurun |
nK'dbfsbna^ haslalilibır |
nkardkhg]Bdinrniyor: Aspkasyon pnöınonisi |
Gasiroiniesünal iıı^slaifkkır |
YitygiB: f)ispepsi Yayguı oIrnayaiK Ha/.HViSi/hk Seyrek: hıee bağırsak nkanıkhği Billoodyrsr: i,)Hde şişme |
Deri ve deri ıdu diiku i^asEalıklari |
Seyrek: Aniioödenı. papüler döküntü |
Kasdskelei boz.yklifkiar, bağ doko |
Yaygüi: Ariraljl |
ve kenbk hastahkkuı |
Yaygiii iibnayan: Kasdskeiei ağnsi |
Bribrek ve idrar lıaslaiıklari |
Yaygin olmayan: Uıiner i'etansiyon Seyrek: Üririer inkoniinaps |
Gebelik, pi.a'periyuin duruinkiii ve Bilhiiiıiyor: NeoiKMal iiisç kesHme si*mpioirsh.iri {Bkz,
perin;Ual iıasıahklari_BöUhn 4.6) ■_■ ■ ■ ._BöUhn 4.6) ■
_
■ ■ ■ .
_
İIrefTie ve ıneme . ■ Seyrek: Meme angorjmaiii, nıenıe ;igrısi, meine
hasiahklajı hassaHİyeıi. reırograd eiakülasyoii
______[llliiiiTuyur: Priapj/iii_
Genel hozuklüklar ve uygıılaiiKi Yaygın obnayan: Penienıf ikiern ' ' '
nöiaesirie ilişkin hasiahkhşr .
=" ' Sevrek: (.klcn^ ■
Pazarlama Sonrası Veriler
Paliperidon ile iik olurak pazarlama sonrası deneyimde spontan bildirimlere dayanan bir sskltk kategorisi ile verilen advers ilaç reaksiyonları aşağıdaki tabloda yer almaktadır. Aşağıdaki terimler ve .sıklık dereceleri kullanılmıştır;
Çok yaygın {>1/10); yaygın (>1/100 ile <İ/10); yaygın olmayan {>1/1000 ile <l/jOO); seyrek (>1/10.000 ile <1/1000); çok seyrek (<1/10.0(X)), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Spontan bildirimlere dayanan bir sıklık kategorisi ile paliperidon pazariama sonrası deneyiminde tanımlanmış olan advers olaylar :
Çok seyrek: Neonatal ilaç yoksunluk ,sendromu
Bu sınıfa özgü olaylar
Enjeksiyon bölgesi reaksiyonları: En sık bildirilen yan etki ağrıdır. Bu reaksiyonların çoğu hafif ila orta şiddettedir. Bütün faz 2 ve faz 3 klinik çalışmalarında, enjeksiyon bölgesi ağrısmın bireysel algısı zamanla sıklık ve yoğunluğu azaltmayı amaçlayan görsel analog skalada değerlendirmiştir, Deltoid enjeksiyonlar gluteal enjeksiyonlara oranla biraz daha fazla ağrılı olarak algılanmıştır. Diğer enjeksiyon bölgesi reaksiyonları çoğunlukla hafif yoğunluktadır ve enjeksiyon bölgesinde sertleşme (yaygın), kaşıntı (yaygın olmayan) ve nodülicr (seyrek) olarak tanımlanmıştır.
Kilo alma: 130 mg'hk başlangıç dozunun kullanıldığı 13 haftalık çalışmada, vücut agıriıgının %7'si ve daha fazla kilo alma kriterini karşılayan bireylerin oranlan, XEPLION gruplarında plasebo grubuna göre daha yüksek orandadır.%1ve daha fazla anormal kilo alımı olan denek oranı, dozla ilişkili bir eğilim göstermiştir ve insidans oranı plasebo grubunda %5 iken; XEPLION 25 mg, 100 mg ve 150 mg gruplarında plasebo ile karşılaştırmalı olarak sırasıyla '^6, ve % 13 bulunmuştur, :
Uzun dönemde nüksü önleme çalışmasınm 33 haftiiİık açık etiketli geçiş/idame dönemi esnasında, XEPLION ite tedavi edilen deneklerin %12'si bu kritere uymuştur (çift-kör fazından son noktaya kadar >%7 kilo artışı); açık etiketli başlangıca göre ortaklına (SD) ağırlık değişikliği +0,7 (4,79) kg olmuştur.
Laboratuar testleri
Serum prolaktin; XEPLION alan deneklerde her iki cinsiyette de, serum prolaktin düzeyinde ortalama artışlar gözlenmiştir,\3haftalık, çift kör, plasebo kontrollü üç çalışmadan elde edüen verÜere göre, prolaktin düzeylerinde artışı düşündürebilecek advers olaylar (örn.; amenore, galaktore, jinekonıasti) genelde deneklerin % Finden azında bildirilmiştir.
Sınıf etkileri
Antipsikotik İlaçların kullanılması sonucunda QT uzaması, ventriküler aritmiler (ventriküler fibrilasyon, ventriküler taşikardi), ani beklenmedik ölüm, kardiyak arrest ve Torsades de pointes görülebilir,
Pulmoner embolizm ve derin ven trombozu vakaları da dahil olmak üzere, antipsikotik ilaçlarla venöz tromboembolik olay bildirilmiştir (Sıklık bilinmemektedir).
4.9. Doz aşımı ve tedavisi
XEPLION'un, sağlık personeli tarafından uygulanması gerektiğinden hastaların aşırı doz alma potansiyeli düşüktür.
Belirtiler
Genellikle, beklenen bulgu ve semptomlar paliperidonun bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, uyuşuktuk ve sedasyon, taşikardi ve hipotansiyon, QT uzaması ve ekstrapiramidal semptomlardır. Torsade de pointe,s ve ventriküler fibrilasyon, oral paliperidon ile doz aşımı ayarında rapor edilmiştir. Akut doz aşımı durumunda, birden fazla ilaç ihtimali düşünülmelidir.
Tedavi
Tedavi gereksinimleri ve İyileşme değerlendirilirken XEPL10N'un uzatılmış salım özelliği ve
paliperidonun uzun yarılanma Ömrü göz önünde tutulmalıdır. Paliperidonun spesifik bir
antidotu yoktur. Genel destekleyici önlemler uygulanmalıdır. Hava yolu açık tutulmalı,
korunmalı ve yeterli oksijenasyon, ventilasyon sağlanmalıdır. Kardiyovasküler izlemeye
hemen başlanmalı ve olası aritmiler için sürekli elektrokardiyografik izleme yapılmalıdır.
Sayfa18/34
Hipotansiyon ve dolaşım kollapst, intravenbz sıvı ve/veya sempatomimetik ilaçlar gibi uygun öniemlerie tedavi ediimelidir. Ciddi ekstrapiramidal semptomların varlığında antikolinerjik ilaçlar uygulanmalıdır. Hasta iyileşene kadar yakın denetim vc gözlem stirdiirülmelidir.
5, FARMAKOLOJİK ÖZELLİKLER
5.L Farmakodinamik özelliklur
Farmakoterapötik grup: Dİğer antipsikotikler
ATCkodu:N05AXi3 ^
XEPLION paliperidonun (+)- ve {-)- rasemik karışımını içerir.
Elki mekanizması:
Paiiperidon palmitat, paliperidona hidrolize olur (Bkz. Bölüm 5.3). Paiiperidon, daha çok serotonerjik 5'HT:a antagonİslik akiivitesi olan merkezi etkili dopamin Dı antagonistidir. Paiiperidon, aynı zamanda alfa-l ve aifa-2 adrenerjik reseptörlerin ve Hı histaminerjik reseptörlerin anlagoni,stİ olarak etki eder. Paliperidonun kolinerjik muskarinik veya Br ve B:-adrenerjik re.septöriere afinitesi yoktur. (+)- ve {-)- paiiperidon enantiyomerierinin farmakolojik aktivitesi, kalitatif ve kantitatif olarak benzerdir.
Şizofrenide etkili olan diğer ilaçlarda olduğu gibi paliperidonun etki mekanizması bilinmemektedir. Ancak, ilacın şizofrenideki terapöük aktivilesinin, dopamin Tİp 2 (D^) ve serotonin Tip 2 (SHTia) reseptör antagonizmasınm kombinasyonu ile kontrol edildiği öne sürülmüştür. Di ve 5Hİ2a dışındaki diğer reseptörlerdeki antagonizma, paliperidonun diğer etkilerinin bazılarını açıklayabilir.
Elektrofİzyoloji
Oral paliperidonun QT aralığı üzerindeki etkileri, şizofreni ve şizoafektif bozukluğu olan erişkinlerde yapılan iki randomize, çift-kör, çok merkezli, faz 1 çalışmasında ve şizofrenili erişkinlerde yapılan aktif kontrollü, 6 haftalık, sabit dozlu etkinlik çalışmalarında değerlendirilmiştir.
İlk faz 1 çalışmasında (n=14l), denekler 7 gün .süre ile günde bir kere hızlı salimli orai
paiiperidon (4 mg'dan 8 mg'a titre edilerek) veya iek doz moksifloksa.sin (400 mg) almak
üzere randomize olarak ayrılmışlardır. Günde iek doz 8 mg hızlı sahmlı oral paiiperidon
(n=50, Cttu^ ss 113 ng/mi) ile elde edilen ortalama kararlı durum maksimum plazma
konsantrasyonu, deltoid kas İçine uygulanan önerilen maksimum 150 mg'hk XEPLION dozu
Sayfa 19 / 34
ile gözlenen 2 kat daha yüksek maruziyete göre daha yüksek bulunmuştur (öngörülen ortalama ss = 50 ng/m!). Model-ayarh, gün~ortalamalı lineer-derivelİ QT düzeltmesinde {QTcLD), XEPLION tedavi grubunda (n=50) 5.5 milisaniyelik (ms) ortalama artış saptanmıştır (%90 CI: 3.66; 7.25).
İkinci faz 1 çalışmasında (n=109) denekler; plasebo, maksimum önerilen oral uzatılmış salimli paliperidon dozu (günde bir kere 12 mg) ve bunu takiben Önerilen aralığın üzerinde bir doza titrasyon (günde bir kere 18 mg) veya aynı farmakolojik ilaç sınıfından bir ilacı (günde iki kez 400 mg ketİapin) aktif kontrol olarak alacak şekilde rastgele ayrılmışlardır. Bu 10 günlük eşit etkinlik çalışmasında, birincil karşılaştırma 12 mg uzatılmış salimli paliperidon ile ketiapin arasında yapılmıştır. Her bireyin saptanan değerinde QTcLD'de başlangıca göre en düşük kareler ortalamasının değişikliği, 12 mg uzatılmış salimli paliperidon için (ortalama Cn,ix 34 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama 1183 ng/ml) 5.1 ms daha düşük bulunmuştur (%90 CI: -9.2; -0.9). Bu değer önceden belirlenmiş 10 ms olan eşit etkinlik kriterine uygundur. Her bireyin saptanan değerinde QTcLD'de başlangıca göre ortalama değişiklik, 18 nıg uzaSilmış salimli paliperidon içİn (ortalama 33 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama Cıa>L 1183 ng/ml) 2.3 ms daha düşük bulunmuştur (%90 CI; -6.8; 2.3).
Her bireyin saplanan tıas değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaşiırıldığında, 12 mg uzatılmış salimli paliperidon için 1.5 ms daha yüksek (7r90 CI: -3.3; 6.2) ve günde iki kez 400 mg ketiapin için 8.0 ms daha yüksek (%90 CI; 3.1; 12.9) bulunmuştur. Her bireyin saplanan t^^^ değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tma^ değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 18 mg uzatılmış salimli paliperidon için 4.9 ms daha yüksek (%9Ü CI: -0.3; 10.3) ve günde iki kez 400 mg ketiapin için 7.5 m s daha yüksek (%90 CI: 2,5; 12.5) bulunmuştur.
Bu çalışmaların hiçbirisinde herhangi bir zamanda deneklerde, başlangıca göre 60 milisaniyeyi geçen bir değişiklik veya 500 milisaniyeyi geçen bir QTcLD görülmemiştir.
Oral uzatılmış salimli paliperidonla ilgili sabit dozlu üç etkinlik çalışmasında, standardize edilmiş bİr yöntem kullanılarak belirli günlerde (beklenen C,v,as sürelerini içeren) 15 zaman noktasında, kapsamlı elektrokardiyografi (ECO) ölçümleri alınmıştır. Uzatılmış salimli paliperidon ile tedavi edilen 836 denek, olanzapin ile tedavi edilen 357 denek ve plasebo ile tedavi edilen 350 deneğin toplu verilerine göre herhangi bir zaman noktasında, herhangi bir
Sayfa 20 / 34
ledavi grubunda ortalama QTcLD arhşı 5 milisaniyeyi geçmemiştir. Bu çalışmalar esnasında, uzatılmış salimli 12 mg paliperidon ve olanzapin gruplanntn her birisinde bir denekte bir zaman noktasmda 60 milisaniyeyi geçen değişiklik olmuştur (sırası ile 62 ve 110 milisaniye artışları).
XEPLION'un dört .sabit dozlu etkinlik çahşmasmda, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamış ve herhangi bir zaman noktasında 500 milisaniyeden fazla QTcLD değeri görülmemiştir. Uzun süreli nüksü önleme çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamıştır ve bir denekte 507 milisaniyelik QTcLD değeri saptanmıştır (Bazett düzeltilmiş QT aralığı [QTcB] 483 tiiİli.saniye). Bu hastada aynca kalp hızı 45 atım/dakika bulunmuştur.
Klinik Etkinlik
XEPLION'un şizofreninin akut tedavisinde etkililiği, şizofreni için DSM-IV kriterierini karşılayan akut nüks gelişmiş yatan erişkin hastalarda yapılan kısa süreli (biri 9 haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabit dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda I XEPLION'un sabit dozları, 9 haftalık çalışmada I. , 8. ve 36. günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir (ilk iki doz için bir haftalık aralıklaria ve daha sonra idame için 4 haftada bir).
Etkinlik, Pozitif ve Negatif Sendrom Ölçekleri (PANSS) kullanılarak değerlendirilmiştir. PANSS, pozitif semptomları, negadf semptomları, dağınık düşünceleri, kontrol edilemeyen saldırganlık/heyecanı ve anksİyete/depre,syonu değerlendirmek için beş faktörden oluşan valide edilmiş çok maddeli bir ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararii aktivite alanlarında kişisel ve sosyal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir ölçektir: iş ve çalışma, kişisel ve sosyal ilişkiler, kendi kendine bakım ve rahatsız ediei ve agresif davranışlar. Sosyal, kişisel ve kendi kendine bakım alanlarında disfonksiyonun şiddeti, bu aktivİtelerİ başkalarının yardımı İle ve başkalarının yardımı olmaksızın uygulamada zorluk derecesi (yok, hafif, aşikar, belirgin, şiddetli) ile Ölçülür, Benzer şekilde, agresif davranışlarda disfonksiyonun şiddeti, agresif davranışların varlığı veya yokluğu (kabalık, başkalarına toplum içinde hakaret etmek, nesneleri kırmak, sözlü tehditler, fiziksel saldırı) ve bu davranışların sıklığı ile ölçülür.
XEPLION"un üç sabit dozunu (başlangıçta 150 mg1ık deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, İÛO mg/4 hafta veya 150 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLION'un üç dozu da, PANSS toplam puanmı düzeltmek açısmdan pİaseboya göre üstün bulunmuştur. Bu çalışmada, hem 100 mg/4 hafta hem de 150 mg/4 haftalık tedavi gruplan PSP puam açfsmdan pİaseboya göre istatistiksel olarak anlamlı üstünlük göstermişken, 25 mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca etkililiği ve PANSS'de düzelmeyi desteklemektedir ve dördüncü gün kadar erken dönemde gözlenmiştir. Sekizinci günde ise 25 mg ve 150 mg'lık XEPLION gruplarında plaseboya göre anlamlı farklılık gözlenmiştir.
XEPLÍON'un üç sabit dozunu (50 mg/4 hafta, 100 mg/4 hafta ve 150 mg/4 hafta) plasebo ile karşılaştıran diğer bir 13 haftalık çalışmada (n=349), sadece 100 mg/4 haftalık XEPLION grubu, PANSS toplam puanında düzelme açısmdan plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 50 mg/4 hafta, hem de 100 mg/4 hafta dozlan, PSP puanını düzeltmek açısmdan plaseboya üstün bulunmuştur. Bu çalışmaya 150 rng'lık bir doz dahil edilmesine rağmen, bu dozu alan gönüllü sayısı, bu dozun etkililiği ile ilgili kesin sonuçlara varmak için yeterli değildir.
XEPLlON'un üç sabit dozunu (25 mg/4 hafta, 50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran üçüncü 13 haftalık çalışmada (n=513), XEPLlON'un üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, paiiperidon doz gruplann tamamında, PSP puanı açısmdan plaseboya göre istatistiksel olarak anlamlılık saptanmamıştır.
XEPLION'un iki sabit dozunu (50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran 9 haftalık çalışmada (n=197), XEPLÍON'un iki dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre iistün bulunmuştur.
XEPLlON'un şizofrenide semptomatik kontrolü idame etmek ve şizofrenide relapsı geciktirme açısından etkililiği, şizofreni İçin DSM-IV kriterlerini karşılayan 849 yaşlı olmayan erişkin gönüllüleri içeren uzun süreli çift-kör, plasebo kontrollü, esnek dozlu bir çalışmada belirienmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabİlİzasyon fazı, randomize, plasebo kontrollü bir faz (nüks açısından gözlem yapmak üzere) ve 52 haftalık açık etiketli uzatma dönemini içermiştir. Bu çalışmada, XEPLION dozlan ayda bir defa uygulanan 25, 50, 75 ve 100 mg dozlanm içermiştir;15mg dozuna yalnızca 52 haftalık açık etiketli uzatmada izin verilmiştir. Hastalar, başlangıçta 9 haftalık bir geçiş dönemi sırasında esnek dozlarda (25-100 mg) XEPLION almıştır, 24 haftalık koruma dönemine girmek için hastaların PANSS skorunun <75 olması gerekmiştir. Dozlama ayarlamalarına yalnızca koruma döneminin ilk 12 haftasında izin verilmiştir. Değişken uzunlukta çift-kör faz esnasında, hastalar stabilizasyon fazında atdıklan aynı XEPLlON'un doz grubuna (onanca
Sayfa 22/34
süre İ71 gün [anılıklar 1 gün-407 gün]) veya plusebo grubuna (ortalama süre 105 gün [aralıklar 8 gün-441 gün] ran dom ize olarak ayrılmıştır. Toplam 410 stabilize hasta, şizofreni semptomlarında nüks oluşana katlar, XEPLION veya plasebo gruplarına randomize olarak ayrılmıştır, Nüks, aşağıdakilerden birinin veya daha fıızlasınm ilk olarak ortaya çıkma zamanı olarak mnımlanmıştır. Bunlar; psikiyatrik hospitalizasyon, iki ardışık değerlendirmede toplam PANSS puanında >%25 artış (başlangıç puanı >40 ise) veya 10 puanlık ariiş (başlangıç puanı <40 ise), kasıllı olarak kendi kendini yaralamak, saldırgan davranış, intihar/öldÜrmeye eğilimli düşünceler veya PANSS maddelerinin P1 (Delüzyonlar), P2 (kavramsal disorganizasyon), P3 (HalÜsinasyonla İlgili davranış), P6 (Şüphecilik/perseküsyon), P7 (Düşmanlık) veya G8 (işbirliği yapamama) ardışık iki değeriendirmesinde puanın >5 (maksimum başlangıç puanı <3 i.se) veya >6 (maksimum başlangıç puanı 4 ise) olmasıdır. Primer etkinlik değişkeni, nükse kadar geçen süre olmuştur. Daha önceden planlanmış bir ara analiz (68 nüks olayı yaşandıktan sonra), nükse kadar geçen sürenin, XEPLION ile tedavi edilen hastalarda, plaseboya kıyasla anlamlı derecede daha uzun olduğunu göstermiştir (Şekil I) ve etkililiğin devam ettiği gösterildiğinden çalışma erken sonlandınlmıştır.
Şükii 1. Zanıanıı karşı nüksü kıyaslayan Kiiplan-Nkitr Gral'igi - Arn Analizi (Tedaviyi ama(,'iaya» analiz stti)
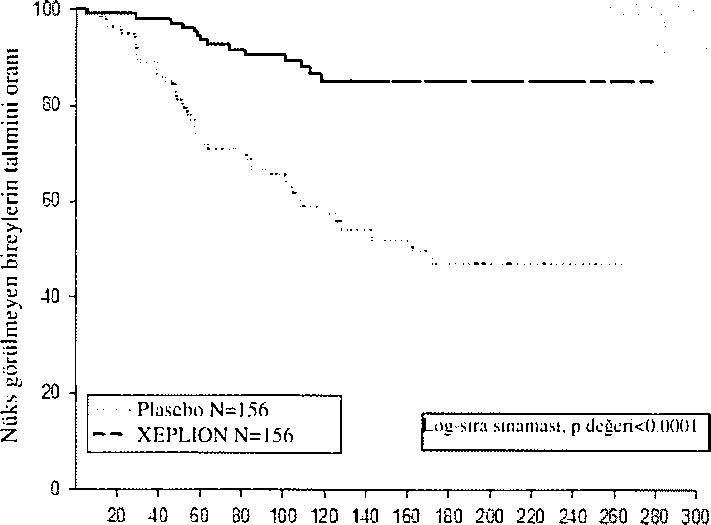
Raıııİomizasyoııtlan beri geçen süre (gün)
Çalışmanın sonlandırıldığı tarihe kadar tüm verileri içeren nihai verilere dayanılarak yapılan analizin sonucu, ara verilere dayalı birincil etkililik analizinin sonucu ile tutariidır.
Popühısyon atı gruptannın İncelenmesi, cinsiyet, yaş veya ırk temel alınarak ietiaviye yanıl açısından klinik olarak anlamlı fark göslermemiştir.
5.2. Farmakokinetik özellikler Genel Özellikler
Emiliın:
Sudaki çözünürlüğünün aşırı düşük olmasına bağlı olarak paliperidon palmitat, intramüskiiler enjeksiyondan sonra palipertdona hidroliz olmadan önce yavaşça çözünür ve sislemik dolaşıma absorbe olur. Tek bir intramüsküler enjeksiyonu takiben paliperidonun plazma konsantrasyonları, 13 günlük ortalama süresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlarına yükselir. İlacın salınması, birinci gün kadar erken bir zamanda başlar ve 126 gün kadar sürer.
Deltoid kas içine tek doz intramüsküler enjeksiyonunu takiben (25 mg-150 mg), gluteal kas içine enjeksiyonla karşılaştırıidıgında ortalama olarak%2Sdaha yüksek bir C,nax gözlenmiştin
I. günde 150 mg ve 8. günde 100 mg'ın iki başlangıç deltoid intramüsküler enjeksiyonu, terapötik konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLlON'un salım profili ve doz rejimi, lerapötik konsantrasyonların devam etmesini sağlamaktadır, 100 mg'lık XEPLION dozu için ortalama kararlı durum doruk noktası; iki dalga arasındaki çukur oranı, gluteal uygulamayı takiben 1.8 ve deltoid uygulamayı takiben 2.2 olmuştur, 25 mg-150 mg'iık doz aralığında XEPLION uygulamasını takiben paliperidonun görünen ortalama yanlanma ömrü 25 ile 49 gün arasında değişmiştir,
Paliperidon palmitat uygulamasmı takiben paliperidonun (+) ve {-) enantiyomerleri birbirine dönüşür ve yaklaşık olarak l.6-l,81ik bİr EAA (+)/{-) oranına ulaşır.
Dauılım:
Popülasyon analizine göre paliperidonun görünen dağılım hacmi 391 litredir. Rascmik paliperidon plazma proteinine %74 oranında bağlanır.
Bivotransformasvon:
I mg hızh salimli ^'*C-paliperidonun lek bir oral dozunun uygulanmasından 1 hafta sonra, dozun %59'u İdrarla değişmeden atılmıştır. Bu durum, paliperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6,5'inden fazlasını kapsamayanin vivodön metabolik yolak tanımlanmıştır; dealkilasyon, hidroksilasyon,
Sayfa 24 / 34
dehidrojenasyon ve benzisoksazolün bölünmesi,In vİ!mçalışmalar, paiiperidon metabolizmasmda CYP2D6 ve CYP3A4'ün rol oynadığını göstermesine rağmen, paliperidonun metabolizmasmdain vivoolarak bu izoenzimlerin önemü bir rol oynadığına dair bir kanıt yoktur. Popüla,syon farmakokinetik analizieri, oral paliperidonun uygulanmasından sonra paliperidonun görünen klerensinde CYP2D6 substrallanmn hızlı metaboiize edicileri ile yavaş metaboiize edicileri arasında ayırt edilebilir fark göstermemiştir. İnsan karaciğer mikrozomlannda yapılanin vitroçalışmalar, paliperidonun, CYPIA2, CYP2A6, CYP2C8/9/I0, CYP2D6, CYP2Eİ, CYP3A4 ve CYP3A5'i içeren sitokrom P450 izoenzimleri tarafından metaboiize edilen İlaçların metabolizmasını büyük ölçüde inhibe etmediğini göstermiştir.
In viiroçalışmalar, paliperidonun bir P-gp substratı olduğunu ve yüksek konsantrasyonlarda P-gp'nin zayıf bir inhibilörii olduğunu göstermiştir.In vivoveriler yoktur ve klinik ilişki bilinmemektedir.
Eliminasvon:
1 mg hızlı sahmlı '^C-paliperidonun tek bir oral doz uygulanma.sı ile verilen radyoaktivitenin yaklaşık %80'i İdrarda ve %1 ri feçestc bulunmuştur, :
Doilrxisallık/Po5r«sal olmayan durum:
XEPLION uygulamasını takiben toplam paiiperidon maruziyeti, 25 mg-150 mg'lık doz aralığının üzerinde dozla orantılı olmuştur ve 50 mg'ı aşan dozlarda CmcK için dozla-orantıdan düşüktür.
Uzun etkili paiiperidon palmitat enjeksiyonu İle {>ral uzatıJnuş salimli paliperidonun kar^iUiftirdmaxt
XEPLION, paiiperidonu ayda bir uygulamak üzere tasarianmıştır. Uzatılmış salimli oral paiiperidon ise günde bir kere uygulanır. Şekil 2, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış salimli tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLlON'un başlangıç rejimi {L gün/8, günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paiiperidon konsantrasyonlarına hızla ulaşmak üzere tasarlanmıştır.
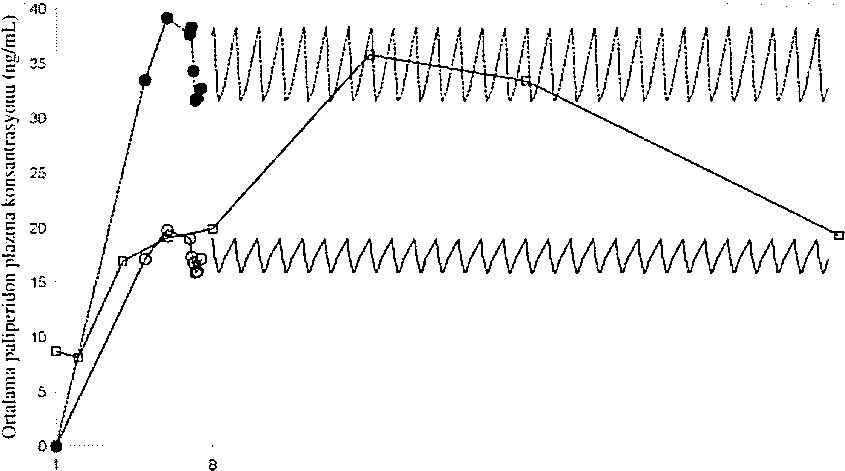
0-0^00ral 6 mg pal i peridon ■"""Oral 12 mg paliperidon
&-^3-E]XEPL10N
Mesapliinan ora! 6 mg kararlı durıını Hesaplanaiioral 12 mg kararİ! durum
■15' 22■ ■
Zaman {gün)
Şekil 2. Oral uzatılmış salimli tabletin (6 mg veya 12 mg) günlük uyguiamass iie karşıiaşiırmalı olarak önerilen başlangtç rejimi kuMamlarak (l.gün/S.günde deltoid kas içine 150 mg/H)() mg paiipcridona eşdeğer paliperidon palmilat ile başlangıç) XEPLION'un uygulamasını lakİbcn 5 bal'ia süre ile paliperidon içİn ortalama rarmakokinelik profıİlerİnİ takiben orialama plazma konsantrasyonu-?-aman pronilcri.
Genel o!:ınık, XEPLION ile gözlenen genel buşiiingıç plazma düzeyleri, 6 mg-12 mg uzatılmış salimli oral paliperidon ile gözlenen maruziyet sınırlan içinde bulunmuştur. XEPLION başlangıç rejiminin kullandıtıası, en düşük değerlerin görüldüğü doz öncesi günlerde bİle (8. gün ve 36, gün) hastaların, 6 mg-12 mg uzahlmış salimli oral paliperidonun bu maruziyet penceresinde kalmalannı sağlamıştır, XEPLION uygulamasını takiben paliperidon farmakokinetİği için gönüllüler arasmda değişkenlik, uzatılmış salimli oral paliperidon tabletlerinde belirlenen değişkenliğe göre daha az bulunmuştur. İkİ ürün ara.sındakİ ortanca farmakokinetik profillerindeki fark nedeni İle farmakokinetik özelliklerini direkt olarak karşılaştınlirken dikkatli olmak gerekir.
Hastalardaki karakteristik özellikler
Karaciğer vetmezli£i:
Paliperidon, karaciğerde yaygın şekilde meiabolize edilmemekledir. XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiş olmasma rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarianıası gerekli değildir. Ona derecede karaciğer yetmezliği
Sayfa26134
o!an (Child-Pugh sınıf B) hiisinhırda oral paliperidon ile yapılan bir çalışmada, serbest paliperidonun plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir.
Böbrek vetmeziitıi:
Hafıl' böbrek yetmezliği olan hastalarda XEPLION dozu azaltılmalıdır. XEPLlON'un, orta veya ağır böbrek yetmezliği olan hastalarda kullanılması önerilmez (Bkz, Bölüm 4,2). Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzatılmış salimli tablet paliperidon dozunun dağılımı incelenmiştir. Paliperidon eliminasyonu, azalan kreatinin klerensi ile birlikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan bastalar arasında hafif böbrek yetmezliğinde (CrCI =50 - <80 mi/dak) ortalama %32, orta böbrek yetmezliğinde (CrCI= 30 - <50 mt/dak) ortalama %64 ve ağır böbrek yetmezliğinde (CrCI=10 - <30 mt/dak) ortalama %71 azalmıştır. Bu durum sağlıklı deneklerie karşılaşiınldığında, maruziyette (EAAif) .sırası ile 1.5, 2.6 ve 4.8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simiilasyonlara göre, hafif böbrek yetmezliği olan hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde 100 mg'lık doz ve bir hafta sonra 75 mg'dır {her ikisi de deltoid kas içine uygulanır); daha sonra ayda bir (4 haftada bir) deltoid veya gluteal kas içine hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 50 mg'lık enjeksiyonlarla devam edilir (Bkz. Bölüm 4.2).
Yaslılarda:
Sadece yaşa bağlı dozaj ayarlaması önerilmez. Ancak, kreatinin klerensinde yaşla ilgili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz. Bölüm 5.2 ve Bölüm 4.2).
İrk:
Oral paliperidon ile yapılan çalışmaların popüla.syon farmakokİnelİğİ analiz verileri, XEPLION uygulamasını takiben paliperidonun farmakokinetiğinde trka bağlı farklılıkların kanıtım göstermemiştir.
Cinsi vet:
Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir. :
Sigara kullanım durumu:
İnsan karaciğer enzimleri kullanılan mvitroçalışmalar temel alınarak, paliperidon CYPt A2 için bir subsErat değildir; dolayısıyla sigara kullanımının paliperidon farmakokinetiğine bir etkisi oİmamalıdır. Buin vitrobulgularla uyumlu olarak popülıısyon farmakokinetik değerlendirmesi, sigara kullimanhır ile kullanmayanlar arasmda herhangi bir fark ortaya koymamışnr,
5,3. Klinik öncesi güvenlilik verileri
Toksikoloji
Orai uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi intramüsküler olarak uygulanan paiiperidon palmitat tekrarlanan-doz toksisitesi çalişmalarmda serum prolaktin düzeylerini yükseltmiştir,
Adolesanlar için mg/m2 bazmda önerilen günde 12 mg'hk maksimum insan orai dozunun 0,12, 0,5 ve 1,8 katı olan günde 0,16, 0,63ve2,5 mg/kgMık orai paiiperidon dozlarıyla sıçanlarda yapılan 7 haftahk juveniİ toksisitesi çalışmasmda gelişim, cinsel olgunlaşma ve üreme performansı Üzerinde hiçbir etkisi gözlenmemiştir. Günde 2,5 mg/kg'a kadar olan orai dozlar, 2,5 mg/kg/gün ile tedavi edilen dişi sıçanlarda Öğrenme ve hafıza üzerine etkiler dışında erkek ve dişilerde nörodavramşsal gelişimi olumsuz etkilememiştir. Bu etkİ tedavi bırakıldıktan sonra gözlemlenmemiştir.
Günde 0,31, 1,25 ve 5 mg/kg dozlarında orai risperidonla (geniş ölçüde paliperidona dönüştürülmüştür) tedavi edilen juvenil kopeklerle yapılan 40 haftalık bir çalışmada cinsel olgunlaşma günde 0,31 ve 1,25 mg/kg dozlarında olumsuz olarak etkilenmemiştir. Uzun kemik gelişimi günde 0,31 mg/kg dozunda etkilenmemiştir; etkiler günde 1,25 ve 5 mg/kg dozlarında gözlenmiştir.
Karsinojenisite
İntramüsküler olarak enjekte edilen paiiperidon palmitatın karsinojenik potansiyeli sıçanlarda değerlendirilmiştir. 10, 30 ve 60 mg/kg/ayMık dozlarda dişi sıçanlarda meme bezi adeuokarsinomlannda istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLION'un mg/kg esas alınarak 150 mg'lık maksimum önerilen insan dozunun L2 ve 2.2 katı olan 30 ve 60 mg/kg/ay'lık dozlarda meme bezi adenomları ve karsinomlarmda islatistiksei olarak anlamlı bir artış görülmüştür.
Risperidonun aktif bir metaboliti olan orai paliperidonun karsinojenik potansiyeli, farelerde ve sıçanlarda yürütülen risperidon çalışmalarına göre değerlendirilmiştir. Risperidon, farelere
18 ay süre ile ve sıçanlara 25 ay süre ile 10 mg/kg/gün şeklinde uygulanmıştır, i-iipofiz bezi ndetıomları, endokrin pankreas adenomiiin ve meme bezi adenokarsinomlannda istatistikse! olarak anlamlı iiriışlur olmuştur. Dİğer antipsikotik ilaçların kronik olarak uygulanmasından sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saptanmış ve bu artışın uzatılmış dopamin Dt antagonizmasına bağlı olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularnıın insan riski ile ilişkisi bilinmemektedir.
Mutajenisİte
Ames ters mutasyon testinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu saptanmamıştır. Paliperidon palmitat, Ames ters mutasyon testinde veya fare lenfoma tayininde genotoksik özellikler göstermemiştir. :
Fertilİtcde bozukluk
Oral paliperidon tedavisi, prolaktin- ve santral sinir .sistemi- aracılı etkiler İie sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak loksik bir dozda, dişi sıçanların canlı embriyo sayısında hafif bir düşüş göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardmıcı maddelerin listesi
Polisorbat 20 Polietilen glikol 4000
Sitrik asit monohidrat :
Anhidr disodyum hidrojen fosfat Sodyum dihidrojen fosfat monohidrat Sodyum hidroksit Enjeksiyon luk su
6.2. Geçimsizlikler
Geçimlilik ile ilgili çalışına yapılmaıiiğmdan, bu tıbbi ürün başka tıbbi ürün veya seyreltici İle karıştırılmamalı, intramüsküier uygulama direk olarak kit içindeki enjektörden yapılmalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yöndik özel tedbirler
25°CüUmdakİ oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve İçeriği
100 mg (1 m!) paliperidon (156 nıg paliperidon palmİtala eşdeğer) sijspansiyonu iie
kuliamma hazır piston tıpalı ve uç başlıklı (bromobutil lastik) bir enjektör (siklik-olefin-kopolimeri), merkezi mavi renkli bir güvenlik İğnesi ve merkezi gri renkli bir güvenlik iğnesi içeren kit
6.6. Beşeri tıbbİ üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kııllanılmamiş olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği ve
Ambalaj Atıklarının Kontrolü Yöneimeliklerine uygun olarak imha edilmelidir.
Kit, intramüsküler enjeksiyon için kullanıma hazır enjektör ve 2 güvenlik iğnesi içerir.
Ku£Sıs]]]iıı:ı luı-'.if
'nİL'blıii
Eliminasvon:
1 mg hızlı sahmlı '^C-paliperidonun tek bir oral doz uygulanma.sı ile verilen radyoaktivitenin yaklaşık %80'i İdrarda ve %1 ri feçestc bulunmuştur, :
Doilrxisallık/Po5r«sal olmayan durum:
XEPLION uygulamasını takiben toplam paiiperidon maruziyeti, 25 mg-150 mg'lık doz aralığının üzerinde dozla orantılı olmuştur ve 50 mg'ı aşan dozlarda CmcK için dozla-orantıdan düşüktür.
Uzun etkili paiiperidon palmitat enjeksiyonu İle {>ral uzatıJnuş salimli paliperidonun kar^iUiftirdmaxt
XEPLION, paiiperidonu ayda bir uygulamak üzere tasarianmıştır. Uzatılmış salimli oral paiiperidon ise günde bir kere uygulanır. Şekil 2, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış salimli tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLlON'un başlangıç rejimi {L gün/8, günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paiiperidon konsantrasyonlarına hızla ulaşmak üzere tasarlanmıştır.

0-0^00ral 6 mg pal i peridon ■"""Oral 12 mg paliperidon
&-^3-E]XEPL10N
Mesapliinan ora! 6 mg kararlı durıını Hesaplanaiioral 12 mg kararİ! durum
■15' 22■ ■
Zaman {gün)
Şekil 2. Oral uzatılmış salimli tabletin (6 mg veya 12 mg) günlük uyguiamass iie karşıiaşiırmalı olarak önerilen başlangtç rejimi kuMamlarak (l.gün/S.günde deltoid kas içine 150 mg/H)() mg paiipcridona eşdeğer paliperidon palmilat ile başlangıç) XEPLION'un uygulamasını lakİbcn 5 bal'ia süre ile paliperidon içİn ortalama rarmakokinelik profıİlerİnİ takiben orialama plazma konsantrasyonu-?-aman pronilcri.
Genel o!:ınık, XEPLION ile gözlenen genel buşiiingıç plazma düzeyleri, 6 mg-12 mg uzatılmış salimli oral paliperidon ile gözlenen maruziyet sınırlan içinde bulunmuştur. XEPLION başlangıç rejiminin kullandıtıası, en düşük değerlerin görüldüğü doz öncesi günlerde bİle (8. gün ve 36, gün) hastaların, 6 mg-12 mg uzahlmış salimli oral paliperidonun bu maruziyet penceresinde kalmalannı sağlamıştır, XEPLION uygulamasını takiben paliperidon farmakokinetİği için gönüllüler arasmda değişkenlik, uzatılmış salimli oral paliperidon tabletlerinde belirlenen değişkenliğe göre daha az bulunmuştur. İkİ ürün ara.sındakİ ortanca farmakokinetik profillerindeki fark nedeni İle farmakokinetik özelliklerini direkt olarak karşılaştınlirken dikkatli olmak gerekir.
Hastalardaki karakteristik özellikler
Karaciğer vetmezli£i:
Paliperidon, karaciğerde yaygın şekilde meiabolize edilmemekledir. XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiş olmasma rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarianıası gerekli değildir. Ona derecede karaciğer yetmezliği
Sayfa26134
o!an (Child-Pugh sınıf B) hiisinhırda oral paliperidon ile yapılan bir çalışmada, serbest paliperidonun plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir.
Böbrek vetmeziitıi:
Hafıl' böbrek yetmezliği olan hastalarda XEPLION dozu azaltılmalıdır. XEPLlON'un, orta veya ağır böbrek yetmezliği olan hastalarda kullanılması önerilmez (Bkz, Bölüm 4,2). Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzatılmış salimli tablet paliperidon dozunun dağılımı incelenmiştir. Paliperidon eliminasyonu, azalan kreatinin klerensi ile birlikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan bastalar arasında hafif böbrek yetmezliğinde (CrCI =50 - <80 mi/dak) ortalama %32, orta böbrek yetmezliğinde (CrCI= 30 - <50 mt/dak) ortalama %64 ve ağır böbrek yetmezliğinde (CrCI=10 - <30 mt/dak) ortalama %71 azalmıştır. Bu durum sağlıklı deneklerie karşılaşiınldığında, maruziyette (EAAif) .sırası ile 1.5, 2.6 ve 4.8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simiilasyonlara göre, hafif böbrek yetmezliği olan hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde 100 mg'lık doz ve bir hafta sonra 75 mg'dır {her ikisi de deltoid kas içine uygulanır); daha sonra ayda bir (4 haftada bir) deltoid veya gluteal kas içine hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 50 mg'lık enjeksiyonlarla devam edilir (Bkz. Bölüm 4.2).
Yaslılarda:
Sadece yaşa bağlı dozaj ayarlaması önerilmez. Ancak, kreatinin klerensinde yaşla ilgili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz. Bölüm 5.2 ve Bölüm 4.2).
İrk:
Oral paliperidon ile yapılan çalışmaların popüla.syon farmakokİnelİğİ analiz verileri, XEPLION uygulamasını takiben paliperidonun farmakokinetiğinde trka bağlı farklılıkların kanıtım göstermemiştir.
Cinsi vet:
Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir. :
Sigara kullanım durumu:
İnsan karaciğer enzimleri kullanılan mvitroçalışmalar temel alınarak, paliperidon CYPt A2 için bir subsErat değildir; dolayısıyla sigara kullanımının paliperidon farmakokinetiğine bir etkisi oİmamalıdır. Buin vitrobulgularla uyumlu olarak popülıısyon farmakokinetik değerlendirmesi, sigara kullimanhır ile kullanmayanlar arasmda herhangi bir fark ortaya koymamışnr,
5,3. Klinik öncesi güvenlilik verileri
Toksikoloji
Orai uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi intramüsküler olarak uygulanan paiiperidon palmitat tekrarlanan-doz toksisitesi çalişmalarmda serum prolaktin düzeylerini yükseltmiştir,
Adolesanlar için mg/m2 bazmda önerilen günde 12 mg'hk maksimum insan orai dozunun 0,12, 0,5 ve 1,8 katı olan günde 0,16, 0,63ve2,5 mg/kgMık orai paiiperidon dozlarıyla sıçanlarda yapılan 7 haftahk juveniİ toksisitesi çalışmasmda gelişim, cinsel olgunlaşma ve üreme performansı Üzerinde hiçbir etkisi gözlenmemiştir. Günde 2,5 mg/kg'a kadar olan orai dozlar, 2,5 mg/kg/gün ile tedavi edilen dişi sıçanlarda Öğrenme ve hafıza üzerine etkiler dışında erkek ve dişilerde nörodavramşsal gelişimi olumsuz etkilememiştir. Bu etkİ tedavi bırakıldıktan sonra gözlemlenmemiştir.
Günde 0,31, 1,25 ve 5 mg/kg dozlarında orai risperidonla (geniş ölçüde paliperidona dönüştürülmüştür) tedavi edilen juvenil kopeklerle yapılan 40 haftalık bir çalışmada cinsel olgunlaşma günde 0,31 ve 1,25 mg/kg dozlarında olumsuz olarak etkilenmemiştir. Uzun kemik gelişimi günde 0,31 mg/kg dozunda etkilenmemiştir; etkiler günde 1,25 ve 5 mg/kg dozlarında gözlenmiştir.
Karsinojenisite
İntramüsküler olarak enjekte edilen paiiperidon palmitatın karsinojenik potansiyeli sıçanlarda değerlendirilmiştir. 10, 30 ve 60 mg/kg/ayMık dozlarda dişi sıçanlarda meme bezi adeuokarsinomlannda istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLION'un mg/kg esas alınarak 150 mg'lık maksimum önerilen insan dozunun L2 ve 2.2 katı olan 30 ve 60 mg/kg/ay'lık dozlarda meme bezi adenomları ve karsinomlarmda islatistiksei olarak anlamlı bir artış görülmüştür.
Risperidonun aktif bir metaboliti olan orai paliperidonun karsinojenik potansiyeli, farelerde ve sıçanlarda yürütülen risperidon çalışmalarına göre değerlendirilmiştir. Risperidon, farelere
18 ay süre ile ve sıçanlara 25 ay süre ile 10 mg/kg/gün şeklinde uygulanmıştır, i-iipofiz bezi ndetıomları, endokrin pankreas adenomiiin ve meme bezi adenokarsinomlannda istatistikse! olarak anlamlı iiriışlur olmuştur. Dİğer antipsikotik ilaçların kronik olarak uygulanmasından sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saptanmış ve bu artışın uzatılmış dopamin Dt antagonizmasına bağlı olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularnıın insan riski ile ilişkisi bilinmemektedir.
Mutajenisİte
Ames ters mutasyon testinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu saptanmamıştır. Paliperidon palmitat, Ames ters mutasyon testinde veya fare lenfoma tayininde genotoksik özellikler göstermemiştir. :
Fertilİtcde bozukluk
Oral paliperidon tedavisi, prolaktin- ve santral sinir .sistemi- aracılı etkiler İie sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak loksik bir dozda, dişi sıçanların canlı embriyo sayısında hafif bir düşüş göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardmıcı maddelerin listesi
Polisorbat 20 Polietilen glikol 4000
Sitrik asit monohidrat :
Anhidr disodyum hidrojen fosfat Sodyum dihidrojen fosfat monohidrat Sodyum hidroksit Enjeksiyon luk su
6.2. Geçimsizlikler
Geçimlilik ile ilgili çalışına yapılmaıiiğmdan, bu tıbbi ürün başka tıbbi ürün veya seyreltici İle karıştırılmamalı, intramüsküier uygulama direk olarak kit içindeki enjektörden yapılmalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yöndik özel tedbirler
25°CüUmdakİ oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve İçeriği
100 mg (1 m!) paliperidon (156 nıg paliperidon palmİtala eşdeğer) sijspansiyonu iie
kuliamma hazır piston tıpalı ve uç başlıklı (bromobutil lastik) bir enjektör (siklik-olefin-kopolimeri), merkezi mavi renkli bir güvenlik İğnesi ve merkezi gri renkli bir güvenlik iğnesi içeren kit
6.6. Beşeri tıbbİ üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kııllanılmamiş olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği ve
Ambalaj Atıklarının Kontrolü Yöneimeliklerine uygun olarak imha edilmelidir.
Kit, intramüsküler enjeksiyon için kullanıma hazır enjektör ve 2 güvenlik iğnesi içerir.
Ku£Sıs]]]iıı:ı luı-'.if
'nİL'blıii


12i)xlı.i " |
|
2M'r:ir |
İtri iıiL'ili'i: |
|
MJ'. İ II'SCRKÍÍ |
i
XEPLION sadece tek kullanım içindir.
Homojen bir süspansiyon sağlamak için enjektörü en az 10 saniye kuvvetli bir şekilde çiitkaiaymız.
2, Uygun iğneyi seçiniz.
DELTOİD enjeksiyon için hasta 9ü kg'dan hafif ise merkezi mavi renkli iğne; isasta 90 kg veya daha ağır ise merkezi gri renkli İğne seçilir.
GLUTEAL enjeksiyon için merkezi gri ohm iğne kulianmız.
3. Enjektörü dik olarak tutarken lastik uç başlığını saat yönünde çevirerek çıkanmz,
/
( rr-
ı<9
4. Güvenlik iğnesinin kabını yarıya kadar sıyırınız. Plastik sıyırma kabım kullanarak iğne kılıfım kavrayınız. Güvenlik iğnesini enjektörün cam şırınga bağhıntısma saat yönünde çevirerek takınız.
n"
■JU
Ji
"V
5
5. İğnenin kiiıfıni düz bir şekilde çekerek iğneden iiyırıniz. İğne gevşeyerek enjektörden çıkabileceği için kılıfı bükmeyiniz.
'İ12V
---fl
A51-
&
6. Havasını gidermek için, takılmış olan iğne iie birlikte enjektörü dİk pozisyona getiriniz. Piston çubuğunıı dikkatli bir şekilde ileri iterek enjektörün havasını gideriniz.
7. Enjektör içeriğinin iamanımı hastanın seçİien deltoid veya gluteal kası içine intramüsküler olarak enjekle ediniz. İniravasküler veya subkutan olarak uygulamayınız.
8. Enjeksiyon tamamlandıktan sonra iğne koruma sistemini etkinleştirmek için baş parmağınızı veya bir parmağınızı (8a, 8b) veya düz bir yüzeyi kullanınız. 'Klik' sesi duyulduğu zaman iğne koruma sistemi tam olarak eikinleşmiştir. İğne ile birlikte enjektörü uygun şekilde aSınız.
8a
8b

8c
7. RUHSAT SAHİBİ
Johnson and Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti.,
Kavacık Mahallesi Ertürk Sokak Keçeli Plaza No; 13 Kavacık, Beykoz-İstanbul Tel :02165382000 Faks : O 216 538 23 69
8. RUHSAT NUMARASI
131/91
9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsal tarihi; 11.08.20İ1 Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
İlaç Bilgileri
Xeplion 100mg/1ml IM Enjeksiyon İçin Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır Enjeksiyon
Etken Maddesi: Paliperidon palmitat
Atc Kodu: N05AX13
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.