Tisseel LYO 2ml Trombin Çözeltisi ve 2ml Fibrinojen Çözeltisi İçeren İki Bileşenli Fibrin Yapıştırıcı Kısa Ürün BilgisiÇeşitli İlaçlar » Diğer Tüm Terapötik İlaçlar » Diğer Tüm İlaçlar KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADITISSEEL LYO, 2mL Trombin Çözeltisi ve 2mL Fibrinojen Çözeltisi tçeren İki Bileşenli Fibrin Yapıştıncı2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler:2 mL yapıştıncı protein çözeltisi (Flakon 1 ve 2);- insan fibrinojeni (pıhtılaşabilir protein) 72-110 mg^'VmL - Aprotinin (sentetik) 3000 KIU^^VmL 2 mL trombin çözeltisi (Flakon 3 ve 4): - insan trombini 500 lU^^/mL (45-55 mg/mL total protein içinde) - Kalsiyum klorür 40 mikromol/mL Her TISSEEL LYO kutusunda, ikisi liyofilize kuru toz (Flakon 1 ve 3), ikisi çözücü (Flakon 2 ve 4) içeren dört flakon bulunur. Flakon 1: Liyofilize edilmiş, buharla ısıtılmış, sclvent/deteıjan uygulanmış, insan kaynaklı yapıştıncı protein konsantresi Flakon 2: 3000 KIU(l)/mL liyofilize sentetik aprotinin içeren aprotinin çözeltisi (yapıştıncı protein konsantresi için çözücü) Flakon 3: Liyofilize edilmiş buharla ısıtılmış, solvent/deteıjan uygulanmış insan trombini. Flakon 4: Kalsiyum klorür çözeltisi (trombin çözeltisi oluşturmak için çözücü) Yardımcı maddeler:2 mL yapıştıncı protein çözeltisi (Flakon 1 ve 2):- Sodyıım sitrat dihidrat: 7.25 (4.8 - 9.7) mg/mL 2 mL trombin çözeltisi (Flakon 3 ve 4): - Sodyum klorür: 4.5 (3.5-5.5) mg/mL Diğer yardımcı maddeler için, bkz. 6.1. 3. FARMASÖTİK FORMYapıştıncı çözelti hazırlamak için kuru toz ve renksiz ya da soluk san renkli ve berrak ya da hafif opalesan çözeltiler' 96-125 mg/mL toplam protein içinde ^ 1 EPU (Avrupa Fannakope Ünitesi), 1800 KJU (Kallidinogenaz Inaktivatör Ünite si)'ne kaışılık gelir. ^ Trombin aktivitesi, trombin için geçerli WHO Uluslararası Standardı kullanılarak hesaplanmıştır. 4. KLtNtK ÖZELLİKLER4.1. Terapötik endikasy onlarStandart cerrahi tekniklerin yetersiz kaldığı şu durumların destekleyici tedavisinde endikedir (Bkz. Bölüm 5.1):- Daha iyi bir hemostaz sağlanmasında - Doku yapıştıncı olarak damar cerrahisi, gastrointestinal anastomozlar ile serebrospinal sıvı veya duramater ile temas oluşabilen beyin cerrahisi ve diğer cerrahi girişimlerde (örn. KBB, göz ve spinal cerrahi) yara iyileşmesi veya sütür desteği için. - Aynimış dokulann (örn. doku flepleri, greftler, split skin greftler [mesh greftler]) yapıştırma/sızdırmazhğı güçlendirmek için. Tam heparinize hastalarda etkinliği kamtlanmıştır. 4.2. Pozoloji ve uygulama şekliTISSEEL LYO yalnızca bu konuda deneyimli hekimler tarafindan kullamimalıdır.Pozoloji / Uygulama sıklığı ve süresiUygulanacak TISSEEL LYO miktan ve uygulama sıklığı hastanın klinik gereksinimine göre belirlenmelidir.Uygulanacak dozu, cerrahi girişimin şekli, etkilenen alanm büyüklüğü, uygulamanın nasıl yapılacağı ve uygulama sayısı belirler. Ürünün uygulanma dozu tedaviyi uygulayan hekim tarafindan bireysel olarak belirlenmelidir. Klinik çalışmalarda bireysel dozlar 4 ile 20 mL arasında değişmektedir. Bazı prosedürler daha yüksek hacimler gerektirebilir. Başlangıç uygulamasının yapışma sağlanması istenen anatomik bölge ya da hedeflenen yüzeyi kaplayacak miktarlarda ürün kullanılarak yapılması önerilir. Gerekirse uygulama tekrarlanabilir. Yapıştınlacak yüzeyler için bir rehber olmak üzere 1 kutu TISSEEL LYO, 2mL Trombin Çözeltisi ve 2mL Fibrinojen Çözeltisi İçeren İki Bİleşenli Fibrin Yapıştırıcı (2 mL yapıştırıcı protein çözeltisi + 2mL trombin çözeltisi) en az 20 cm^ lik bir alan için yeterli olacaktır. TISSEEL LYO sprevleme yöntemi ile uvgulandı£ında.cok daha eenis yüzeyler içinyeterli olacaktır.Aşın granülasyon dokusunun oluşumunun önlenmesi ve katılaşmış fibrin yapıştmcının dereceli absorpsiyonun sağlanması için TISSEEL LYO sadece İnce bir tabaka halinde uygulanmalıdır. Uygulama şekli:Yalmzca epilezyonel kullanım içindir.Çözeltiyi bölüm 6.6'da tarif edildiği şekilde hazırlayınız. Uygulamadan önce, uygulanacak yüzey mümkün olduğunca kuru olmalıdır. Minimal hacimde fibrin doku yapıştıncı kullanımı gerektiren cerrahi girişimlerde ürünün ilk bir kaç damlasmm kullanılmayıp atılması önerilmektedir. Spreyleme yöntemi ile uygulama hakkında bilgiTISSEEL LYO spreyleme yöntemi ile uygulandığında ince bir tabaka halinde uygulanmalıdır. Oluşan pıhtının aşın kaim olması ürünün etkinliğini ve yara iyileşme sürecini olumsuz etkileyebilir. TISSEEL LYO'nun uygulanması için basınç regülatörü içeren spreyleme cihazlanmn kullanımıyla yaşamı tehdit edebilecek şekilde hava ya da gaz embolisi, doku yırtılması ya da sıkışmayla gaz hapsedilmesi görülmüştür. Bu olaylann spreyleme cihazmm doku yüzeyine yakın olarak ve önerilenden daha yüksek basınçla kullanımıyla ilişkili olduğu düşünülmektedir.TISSEEL LYO spreyleme yöntemi ile uygulandığında, uygulamayı yapan cerrahın işlemi spreyleme cihazının üreticisi tarafından önerilen basınç aralığında gerçekleştirmesi önemlidir. Spesifik bir basmç önerisinin olmadığı durumlarda 1.4 - 1.7 bar basınçtan yüksek basınçlarla uygulamaktan kaçmılmahdır. Spreyleme cihazının üreticisi tarafindan önerilenden daha yakın mesafeden spreylemekten kaçımimalıdır. Spesifik bir önerinin olmadığı durumlarda doku yüzeyine 10-15 cm'den daha yakın mesafeden uygulamaktan kaçınılmalıdır. Hava ya da gaz embolisi oluşabileceğinden TISSEEL LYO spreyleme yöntemi ile uygulanırken kan basıncı, nabız, oksijen satürasyonu ve end-tidal CO2 düzeyleri izlenmelidir. Kardiyopulmoner cerrahide kullanımTISSEEL LYO'nun kardiyovasküler baypass cerrahisinde kullammmda, yanlışlıkla damar içerisine uygulanması riskini önlemek için dikkatli olunmalıdır.Beyin cerrahisi işlemlerinde kullanımTISSEEL LYO'nun tek başma ya da biyouyumlu taşıyıcılarla beyin cerrahisi işlemlerinde ya da kapalı alanlarda gerçekleştirilen işlemlerde güvenliliği ve etkinliği değerlendirilmemiştir ve bu koşullarda kullanımı onaylanmamıştır.Aynntılı kullamm talimatlan için bölüm 6,6'ya bakınız. Özel popfilasyonlara ilişkin ek bilgiler Böbrek/karaciğer yetmezliği:Böbrek/karaciğer yetmezliğinde kullanımındaki pozoloji ve uygulama şekliyle ilgili özel bir bilgi bulunmamaktadır.Pediyatrik popülasyon:Pediyatrik yaş grubunda kullanımındaki pozoloji ve uygulama şekliyle ilgili özel bir bilgi bulunmamaktadır.Geriyatrik popülasyon:Yaşh hastalarda kullanımındaki pozoloji ve uygulama şekliyle ilgili özel bir bilgi bulunmamaktadır.4.3. KontrendikasyonlarTISSEEL LYO konvansiyonel cerrahi tekniklerle kontrol altına alınamayan aktif ya da masif arteriyel kanamalar ile venöz kanamalarda tek başına endike değildir.TISSEEL LYO intravasküler olarak uygulanmamalıdır. İntravasküler uygulama yaşamı tehdit edebilecek boyutta tromboembolik olaylarla sonuçlanabilir. TISSEEL LYO aprotinin dahil içeriğindeki aktif veya yardımcı maddelerden herhangi birisine karşı aşın duyarlılık durumunda kontrendikedir. TISSEEL LYO cerrahi yaranın kapatılması amacıyla kullanılan deri sütürlerinin yerine kullanım için endike değildir. 4.4. Özel kullanım uyanları ve dnlemleriTISSEEL LYO insan plazmasından üretilmektedir. İnsan kanmdan ya da plazmasından elde edilen ürünler, virüsler gibi, hastalığa neden olabilecek enfeksiyon etkenlerini içerebilir. Bu ürünlerin bir enfeksiyon etkenini bulaştırma riskini azaltmak için, donör plazmaları bazı virüslerle daha önce karşılaşmış olmaya veya mevcut virüs enfeksiyonlanna karşı taranır ve inaktivasyon / uzaklaştırma işlemleri uygulanır. Bu önlemlere rağmen, bazı ürünler hastalık bulaştırabilir. Bu ürünlerde henüz bilinmeyen hastalık etkenlerinin bulunma olasılığı da mevcuttur, [ör, virüsler ve teorik olarak Creutzfeld-Jacobs hastalığı (CJD) etkeni].HIV, HBV ve HCV gibi zarflı virüslere, HAV gibi zarfsız virüslere karşı alınan önlemler etkili olarak kabul edilir.Parvovirüs B19 gibi bazı küçük zarfsız virüsleri uzaklaştırmak ya da inaktive etmek için alman önlemlerin etkisi ise kısıtlıdır. Parvovinıs B19 virüsü en ciddi olarak gebe kadınlan (fetusda enfeksiyona neden olabilmektedir), immün yetmezlikli hastalan veya artmış eritropoezi olan hastalan (öm. hemolitik anemi durumu) etkilemektedir. Hekim bu preparatm risklerini ve yararlarını hastayla tartışmalıdır. B19 virüsü enfeksiyonu belirtilerinin görülmesi halinde (ateş, sersemlik hali, titreme, burun akıntısı ve bunlan takiben yaklaşık 2 hafta sonra beliren ciltte döküntü ve eklem ağnsı), hastalar hekime danışmalan konusunda bilgilendirilmelidir.Sadece epilezyonel kullanım içindir. TISSEEL LYO'nun yumuşak dokuya enjeksiyonu anafilaktoid reaksiyon ve/veya lokal doku haşan riski içermektedir.Minimal hacimde fibrin doku yapıştırıcı kullanımı gerektiren cerrahi girişimlerde (Ömek pteıjiyum cerrahisi) yapıştıncı protein ve trombin çözeltilerinin yeterli derecede kanşmalannı sağlamak için ürünün ilk bir kaç damlası kullanılmayıp atılmalıdır. Bu tür girişimlerde ilk birkaç damlanm kullanımı ürünün etkisiz kalmasıyla sonuçlanabilir. intravasküler uygulanmamalıdır. Preparatm istenmeden intravasküler olarak uygulanması yaşamı tehdit edebilecek boyutta tromboembolİk komplikasyonlara neden olabilir. TISSEEL LYO uygulanmasından önce, uygulama istenen alan dışındaki vücut alanının korunarak istenmeyen adezyonlann oluşması önlenmelidir. Herhangi bir protein ürününde olduğu gibi, alerjik tipte aşın duyarlılık reaksiyonları mümkündür. Aşın duyarlılık reaksiyonlannm belirtileri arasında ürtiker, göğüste sıkışma hissi, hınitılı solunum, hipotansiyon ve anafilaksi bulunur. Bu semptomlar ortaya çıkarsa uygulama derhal durdurulmalıdır. Koroner arter bypass cerrahisinde randomize olmayan iki retrospektif çalışmada, fibrin yapıştıncı uygulanan hastalarda istatistiksel olarak anlamlı artmış mortalite riski gözlenmiştir. Her ne kadar bu hasta grubunda belirli bir neden-sonuç ilişkisi gösterilememiş olsa da TISSEEL LYO kullanımı ile artmış risk gözardı edilememektedir. Bu nedenle ürünün kazayla intravasküler uygulanmaması için azami çaba gösterilmelidir. TISSEEL LYO'yu ince bir tabaka oluşturacak şekilde uygulayın. Fazla pıhö kalınlığı ürünün etkinliğim ve yara iyileşme sürecini olumsuz etkileyebilir. TISSEEL LYO uygulaması için basınç regülatörü içeren sprey cihazlanmn kullammı ile meydana gelen, yaşamı tehdit edebilecek olan hava ya da gaz embolisi, doku rüptürü ya da ya da basmçIa gaz sıkışması gibi olaylar, sprey cihazının önerilenden basınçlardan daha yüksek basınçla kullanımı ve doku yüzeyine yakmiığı ile alakalı olarak ortaya çıkmaktadır. TISSEEL LYO'yu sprey cihazı kullanarak uygularken, sprey cihazı üreticisi tarafindan önerilen basmç aralığı dahilindeki basmcı kullandığınıza emin olunuz. Özel bir öneri bulunmaması durumunda 1.4 -1.7 bar'ın üzerinde basınç kullaramından kaçımn. Sprey cihazı üreticisi tarafindan önerilen mesafenin daha yalanından püskürtme yapmayın. Özel bir öneri bulunmaması halinde doku yüzeyine 10 - 15 cm'den daha yakm mesafeden püskürtme yapmaktan kaçmın. TISSEEL LYO'yu spreyle uygularken hava veya gaz embolisi oluşma ihtimali nedeniyle kan basmcındaki değişiklikler, nabız, oksijen satürasyonu ve end-tidal CO2 izlenmelidir. TISSEEL LYO sentetik protein (aprotinin) içermektedir. Aprotinin varlığına bağlı olarak lokal uygulamada dahi anafilaktik reaksiyon riski vardır. Daha önceki uygulamalarda iyi tolere edilmiş olsa bile tekrarlayan uygulamalarda risk daha yüksektir. Bu nedenle aprotinin veya aprotinin içeren ürün uygulamalan hasta kayıtlarına işlenmelidir. Sentetik protinaprotinin yapısal olarak bovin aprotinine benzediği için TISSEEL LYO'nun bovin proteinlerine alleijisi olan hastalarda kullanımı dikkatle d^erlendirilmeltdir.Anafilaksi ya da şiddetli aşın duyarlılık durumunda uygulama hemen sonlandınlarak standart şok tedavi önlemleri alınmalıdır. TISSEEL LYO uygulanan her hastada, kullanıldığı her durumda ürünün parti numarasının hasta dosyasma kaydedilmesi şiddetle tavsiye edilmektedir. Bu tıbbi ürün toplam 14.5 mg (9.6 - 19.4 mg) sodyum sitrat dihidrat ve 9 mg (7.0 - 1 l.O mg) sodyum klorür ihtiva eder (Bkz. Bölüm 2. KALİTATİF VE KANTİTATİF BİLEŞİM, Yardıma maddeler). TISSEEL LYO'nun kullanım yolu nedeniyle kontrollü sodyum diyetinde olan hastalar için herhangi bir uyan gerekmemektedir. Arteria ophtalmica bölgesinde tromboembolik komplikasyonlar oluşabileceğinden TISSEEL'in nazal mukozaya enjeksiyonundan kaçımimalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTISSEEL LYO ile etkileşim çalışmalan yapılmamıştır. Yapıştıncı protein ve trombin çözeltileri alkolle, iyotla ya da ağır metal iyonlanyla denatüre olabilir. Yara bölgesini temizlemekte bunlardan herhangi birisi kullanıldıysa, TISSEEL LYO uygulamasından önce bölge bu tür maddelerden iyice temizlenmelidir.özel popfilasyonlara ilişkin ek bilgilerPediyatrik popüiasyonPediyatrik yaş grubunda TISSEEL LYO ile herhangi bir etkileşim çalışması yapılmamıştır.4.6. Gebelik ve laktasyon Genel tavsiye Gebelik Kategorisi CMir.Çocuk doğurma potansiyeli bulunan kaduilar/Doğum kontrolü (Kontrasepsiyon)TISSEEL LYO'nun çocuk doğurma potansiyeli bulunan kadınlarda kullanıldığında üreme kapasitesini etkileyip etkilemediği bilinmemektedir. Bu nedenle çocuk doğurma potansiyeli bulunan kadmlarda kullanıp kullanmama karan ilacın olası yararlan ve riskleri karşılaştınlarak hekim tarafından verilmelidir.Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar gebelik/embriyonal/fötal gelişim/doğum ya da doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz, kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Bu nedenle hamilelerde kullanıp kullanmama karan ilacm olası yararlan ve riskleri karşılaştınlarak hekim tarafindan verilmelidir.Parvovirüs B19 enfeksiyonu hakkmda bilgi için bölüm 4.4'e bakınız. Laktasyon dönemiYapıştıncı protein çözeltisi ve trombin çözeltisinin insan ya da hayvan sütü ile atılmasına ilişkin yetersiz/sınırii bilgi mevcuttur. Memedeki çocuk açısından bir risk olduğu göz ardı edilemez. Emzirmenin durdurulup durdurulmayacağına ya da TISSEEL LYO tedavisinin durdurulup durdurulmayac^na/tedaviden kaçınılıp kaçmılmayacağma ilişkin karar verilirken emzirmenin çocuk açısmdan faydası ve TISSEEL LYO tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği/FertiliteTISSEEL LYO'nun karsinojenik potansiyelini ya da fertiliteye etkisini değerlendirmek amacıyla uzun süreli hayvan çalışmalan yapılmamıştır.4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makina kullanımı üzerinde bilinen bir etkisi yoktur.4.8. İstenmeyen etkilerFibrin yapıştıncılar/hemostatlarla tedavi edilen hastalarda nadir olgularda hipersensitivite veya aleıjik reaksiyonlar {anjiyoödem, uygulama yerinde yanma ve batma, bradikardi, bronkospazm, titreme, dispne, kızarma, yaygın ürtiker, başağnsı, hipotansiyon, letarji, bulantı, kaşıntı, huzursuzluk, taşikardi, göğüste baskı hissi, kusma, hınitı) ortaya çıkabilir.tzole olgularda bu reaksiyonlar ciddi anafilaksiye kadar ilerlemiştir. Bu reaksiyonlar özellikle preperat ile tekrarlanan uygulamalarda, ya da aprotinine (bölüm 4.4'e bakınız) veya ürünün bileşimdeki diğer maddelerden herhangi birisine karşı aşın duyarlılığının olduğu bilinen hastalara uygulandığmda özellikle görülebilir. TISSEEL LYO ile birden fazla uygulamada iyi tolere edilmiş olsa bile, TISSEEL LYO'nun sonraki uygulanmalan ya da sistemik aprotinin uygulanması ciddi bir anafilaktik reaksiyonla sonuçlanabilir. TISSEEL LYO sentetik protein (aprotinin) içermektedir. Aprotinin varlığına bağlı olarak lokal uygulamada dahi anafilaktik reaksiyon riski vardır. Daha önceki uygulamalarda iyi tolere edilmiş olsa bile tekrarlayan uygulamalarda risk daha yüksektir. Bu nedenle aprotinin veya aprotinin içeren ürün uygulamalan hasta kayıtlanna işlenmelidir. Aşın duyarlılık reaksiyonlan ortaya çıktığmda, uygulama durdurulmalı ve güncel tedavi ile uygun önlemler ahnmahdır. TISSEEL LYO'nun yumuşak dokuya enjeksiyonu anafilaktik reaksiyon ve/veya doku haşan riski taşımaktadır (bölüm 4.4'e bakımz). Nadiren fibrin yapıştıncı/hemostatik ürünlerin antikorlarma karşı reaksiyon gelişebilir. İstemsiz olarak gerçekleşen intravasküler uygulama tromboembolik olaylara neden olabilir. Dahası intravasküler uygulamada anaflaktik reaksiyon riski bulunmaktadu- (bölüm 4.4'e bakımz). Viral bulaş ajanlan ile ilgili güvenirlik için bölüm 4.4'e bakımz. Aşağıda listelenen istenmeyen etkiler TISSEEL ile yürütülen üç klinik çalışmada ve Baxter'in fibrin yapıştıncı ürünleriyle ilgili pazarlama sonrası deneyimlerde bildirilmiştir. Klinik çalışmalarda TISSEEL kardiyak, vasküler ve total kalça replasmam ameliyatlarında hemostaza ek olarak ve aksiller lenf nodu diseksiyonu uygulanan hastalarda lenf damarlannın sızdırmazlığımn güçlendirilmesi için kullamimıştır. Sıklık aşağıdaki kriterlere göre değerlendirilmiştir. Çok yaygın (>>1/10), yaygm (>>1/100 ila <1/10), yaygm olmayan (>>1/1,000 ila <1/100), seyrek (>>1/10,000 ila <1/1,000), çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Postoperatif yara enfeksiyonuKan ve lenf sistemi hastalıklanYaygın: Fibrin D-dimer ve fibrin yıkım ürünleri artışıBağışıklık sistemi hastalıklarıBilinmiyor: Aşın duyarhlık reaksiyonlan*; Anaflaktik reaksiyonlar*; Anaflaktik şok*;Parestezi; Bronkospazm; Hınitılı solunum; Kaşıntı; Eritem Sinir sistemi hastalıklarıYaygın: Duysal bozukluklarKardiyak hastalıklarBilinmiyor: Bradikardi; TaşikardiVasküler hastalıklarYaygın: Aksiller ven trombozu**; HipotansiyonBilinmiyor: Hematoma; Tromboemboli; Serebral arter embolİsİ; Venöz trombotik serebral enfarktüs** Solunum, göğüs hozuklukları ve mediastinal hastalıklarBilinmiyor: DispneGastrointestinal hastahklarYaygın: BulantıBilinmiyor: Barsak tıkamklığı Deri ve deri altı doku hastalıklarıYaygın: DöküntüBilinmiyor; Ürtiker; Yara iyileşmesinde gecikme Kas-iskelet bozuklukları, bağ doku ve iskelet hastalıklarıYaygın: Bir ekstremitede ağnGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Uygulamayla ilişkili ağn; Ağn; Vücut ısısında artışaBilinmiyor: Yüzde ve boyunda kızarma (flushing), ödem Yaralanma ve zehirlenmeÇok yaygm: SeromaBilinmiyor: Anjiyoödem * Anaflaktik reaksiyonlar ve anafilaktik şok fatal sonlanmalan da içermektedir. ** İntravasküler uygulama sonucu Grup etkileriFibrin yapıştıncı/hemostat ürünlerin kullanımıyla ilişkili diğer advers reaksiyonlar arasında hipersensitivite veya aletjik reaksiyonlann görünümleri olan uygulama yerinde iritasyon, göğüste baskı hissi, titreme, ba^ğnsı, letarji, huzursuzluk ve kusma bulunur. 4.9. Doz aşımı ve tedavisiDoz aşımına ilişkin herhangi bir bilgi bulunmamaktadır.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup : Lokal hemostatik, ATC kodu: B02BC.Etki mekanizması:TISSEEL LYO, buharla ısıtılmış, solvent/deteıjan uygulanmış İki bileşenli (Y^jıştıncı Protein ve Trombin çözeltileri) bir fibrin yapıştınadır. Havuzlanmış İnsan plazmasından elde edilir. Bu iki bileşen biraraya geldiğinde, fizyolojik kan pıhtılaşmasımn son basamağını taklit eder.Bileşenlerden birincisi olan Yapıştırıcı protein çözeltisinin içeriğindeki aktif madde fibrinojendir. İçeriğe prematür fibrinolizin önüne geçilebilmesi için, bir fibrinoliz inhibitörü olan aprotinin de eklenmektedir. İkinci bileşen olan Trombin çözeltisinin aktif maddesi ise trombin konsantresidir ve kalsiyum klorür çözeltisiyle sulandınİM^ kullanıma hazır hale getirilir. Fibrin yapıştına sistem fizyolojik pıhtı oluşumunun son fazını başlatır. Fibrinojenin fibrine dönüşümü fibrinojenin fibrin monomerleri ve fibrinopeptidlere aynşmasıyla meydana gelir. Fibrin monomerleri biraraya gelerek fibrin pıhtısını oluştururlar. Faktör XIirdendefibrin çapraz bağlanmn oluşumu için gereklidir.Yara iyileşme süreci ilerledikçe, artmış fibrinolitik aktivite plazmin tarafindan indüklenir ve fibrinin fibrin yıkım ürünlerine dönüşümü başlar. Fibrinin proteolitik degredasyonu antifibrinolitikler tarafindan inhibe edilir. TISSEEL LYO'da bulunan aprotinin de bir antifibrinolitiktir. Klinik etkinlik:TISSEEL LYO'nun kardiyopulmoner cerrahi, karaciğer cerrahisi ve beyin cerrahisinde etkin bir hemostaz sağladığı gösterilmiştir.Yapıştırma/sızdırmazhğı teşvik için doku yapıştırıcı olarak veya sütür desteği için gastrointestinal anastomozlarda ya da serebrospinal sıvı veya duramater ile temas oluşabilen beyin cerrahisi girişimlerindeki etkinliği gösterilmiştir. Hemostazı, iyileşmeyi ve doku yapışmasını gösteren klinik çalışmalar en az 4.076 hastada gerçekleştirilmiştir. Sadece bunlarla sınırlı olmamakla birlikte, bu çalışmalar hemostazı (n=l .300), gastrointestinal anastomozlan (n=l. 114) ve beyin cerrahisini (n=511) içermektedir. ICardiyak cerrahi açısmdan çocuklarda smırlı deneyim mevcuttur (yaş 4-134 aylar arası, n=14). Tam heparinize hastalarda da etkinlik gösterilmiştir. TISSEEL LYO prospektif, paralel olarak dizayn edilmiş, randomize (1:1), çift kör, çok merkezli bir klinik çalışmada, kardiyopulmoner bypass ve medyan stemotomi uygulanması gereken 317 kardiyak cerrahi hastasında, ürünün eski bir formülasyonu olan TISSEEL VH ile kaışılaştınlarak değerlendirilmiştir. Hastalar, yalmzca konvansiyonel yöntemlerle hemostaz sağlanamadığı durumlarda, TISSEEL LYO İle ya da kontrol preparatıyla tedavi edilmiştir. Sonlamm noktası olarak kabul edilen, primer uygulama alanında hemostazm ilk 5 dakika içinde sağlanması ve cerrahi yara kapanana kadar devam etmesi açısından, TISSEEL LYO, daha önceki formülasyona göre daha aşağıda kahnamıştır. Başanlı bir şekilde tedavi edilen deneklerin oranındaki fark, tek taraflı %97.5 güvenlik aralığı kullanılarak ölçülmüştür.
Hastalar cerrahi bitiminde, cerrahi yoldan hemostaz sağlanmasıyla ilgili tüm girişimler yapıldıktan sonra, eğer bir topikal hemostatik kullanılması gerekiyorsa, TISSEEL LYO ya da kontrol hemostatik preparatlara randomize edilerek çalışmaya alınmıştır. Sonlamm zamam olan 5 dakikamn sonunda eğer kanama devam ediyorsa, hastalar çaprazlanarak altematif tedaviye alınmışlardır. 10 merkezde TISSEEL LYO protamin sülfat uygulamasından sonra, bir merkezde ise protamin sülfat uygulamasından önce kullanılmıştır. 489 hastamn 365'i tedavi edilmesi gereken kanama ataklan geçirmiştir. Bu hastalarda, sonlamm noktası olan 5 dakika içerisinde başarılı hemostaz gerçekleşmesi açısmdan, TISSEEL LYO, kontrol topikal hemostatik preparatlara oranla istatistiksel olarak anlamlı şekilde üstün bulunmuştur.
Açık etiketli tek merkezli bir başka çalışmada, TISSEEL LYO'nun eski formülasyonu künt veya penetran travmatik karaciğer veya dalak yaralanması olan ve laparotomi uygulanan hastalarda klasik yöntemlerle karşılaştmlmıştır. TISSEEL LYO kullanımı, klasik hemostatik yöntemlere göre, istatistiksel olarak daha az splenektomi ile sonuçlanmıştır.
Tek bir merkezde yapılan 120 hastalık prospektif, açık-etiketli randomize bir çalışmada, kolonun travmatik yaralanmalanmn tedavisinde geçici kolostomi yerleştirilmesinden sonra elektif kolostomi kapatılması için standart işlem (59 hasta) ve standart işleme ek olarak TISSEEL LYO kullanımı karşılaştmlmıştır (61 hasta). Standart işleme ek olarak TISSEEL LYO'nun eski formülasyonunun kullanımı, sadece standart işlem uygulanmasına göre, anastomoz komplikasyonlan açısından (sızıntı, intra-abdominal abse gelişimi, re-operasyon, septik şok ve ölüm) belirgin olarak üstün bulunmuştur (p=0.0406, Jonckheere-Terpstra testi, iki yönlü). Viral güvenlikTISSEEL LYO'nun üretim işlemleri, viral bulaşma riskini azaltacak uygulamalan içermektedir. Özellikle buharla ısıtma ve solvent/deteıjan uygulaması işlemleri Yapıştırıcı Protein Konsantresi ve Trombinin üretim süreçlerine dahil edilmiştir. İnsan plazması kaynaklı her iki bileşen için de, üretimdeki ara aşamalardan örnekler alınarak validasyon çalışmalan yürütülmüştür. Bu örneklere bilinen titrelerde virüs süspansiyonlan eklenmiş ve sonrasında karşılık gelen üretim aşamalanndakine benzer koşullarda işlenmiştir.Bağımsız üretim basamaklarındaki virüs azaltma faktörleri (logio olarak belirtilmiştir) test edilen her virüs için aşağıdaki tabloda gösterilmiştir.
mv-l:HAV:BVDV:PRV:Pseudorabies virüsü, kılıflı DNA virüsleri ve bunların arasındanHepatit B virüsü için model olarak alınmıştır; MMV: Fare minute virüsü, daha önceden Parvovirüs B19 olarak bilinen B19 virüsü için modet olarak alınmıştır. 5.2. Farmakokinetik özelliklerTISSEEL LYO sadece lokal uygulama için tasarlanmıştır, dolayısıyla insanda intravasküler farmakokinetik çalışmalar yapılmamıştır.Fibrin yapıştıncılar/hemostatlar endojen fibrin ile aynı yolla fibrinolizis ve fagositoz ile metabolize olurlar. 5.3. Klinik dncesi güvenlilik verileriDoğası ve etki mekanizması (sistemik etkisinin ve diğer organ ve dokulara dağılımının olmayıp yerel etkinliği olması) yanmda genellikle tek doz olarak birkaç mİ kullamiması (sadece istisnai vakalarda tekrarlayan uygulama yapılır) nedeniyle TISSEEL LYO'nun kronik toksisitesi, karsinojenitesi, üreme ve gelişimsel toksikolojisi veya immun stimulasyonu hakkında preklinik güvenlik verileri mevcut değildir.Sıçan ve tavşanlarda yapılan tek doz toksisite çalışmalarında TISSEEL ile akut toksisite görülmemiştir. Dahası usulüne uygun olarak gerçekleştirilen in vitroin vitroolarak insan fibroblast kültürlerinde mükemmel hücresel kompatabilite ve non sitotoksisiteyi gösterecek şekilde iyi tolere edilmiştir. Literatürün ayrıntılı olarak gözden geçirilmesine dayanarak, rezidü solvent/deteıjan reaktiflerinin TISSEEL LYO üzerinde herhangi bir negatif etki ya da toksisite oluşturması beklenmez.6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiİnsan albumini L-Histidin Niyasinamid Polisorbat 80 Sodyum sitrat dihidrat Sodyum klorür Enjeksiyonluk Su6.2. GeçimsizliklerOkside selüloz içeren preparatlar, alkol, iyot ve ağır metallerle temasın ardmdan yapıştırıcı protein ve trombin çözeltileri denatüre olabilirler.Bu tıbbi ürün, bölüm 6.6'da belirtilenler dışında başka tıbbi ürünlerle kanştınlmamalıdır. 6.3. Raf ömrü24 ay.6.4. Saklamaya yönelik özel tedbirler2-8 °C arasında saklanmalıdır. Dondurulmasından kaçımimalıdır. Donmuş ürünleri çözüp kullanmayınız.Işıktan korumak için oıjinal ambalajında saklanmalıdır. TISSEEL LYO'nun kimyasal ve fiziksel stabilitesi, bileşenleri kanştınldıktan sonra da oda sıcaklığı ile 37 arasında 4 saat süreyle korunur (kanştınlan çözelti tekrar buzdolabına konmamalıdır). Mikrobiyolojik açıdan, yüzde yüz kontaminasyonu önleyici bir yöntemden emin olunmadığı müddetçe, ürün hemen kullamimalıdır. Hemen kullanılmadığı durumlarda saklama zamanı ve koşullan kullamcımn sorumluluğundadır. 6.5. Ambalajın niteliği ve içeriğiBütün bileşenler Avrupa Farmakopesisi gereksinimlerini karşılayan cam şişelere doldurulmuştur. Yapıştırıcı protein konsantresini içeren flakon içinde dönebilen manyetik bir pervane bulunur.Her TISSEEL LYO kutusu asa&ıdaki bileşenleri içerir:- 1 flakon liyofılize Yapıştıncı Protein Konsantresi (bileşen 1, 91 mg/ml liyofilize insan fibrinojeni) - 1 flakon liyofilize İnsan Trombini (bileşen 2, 500 lU/ml liyofilize insan trombini) - 1 flakon Aprotinin Çözeltisi (bileşen 1 için 3000 KlU/ml sentetik aprotinin içeren çözücü) - 1 flakon Kalsiyum Klorür Çözeltisi (bileşen 2 için 40 ^ımol/ml kalsiyum klorür içeren çözücü) - Rekonstitüsyon ve uygulama için bir kit Rekonstitttsyon ve Uygulama kit içeriğiRekonstitüsyon ve uygulama kiti steril olmayan alanda rekonstitüsyon için bir tek-steril takım-ekipman, steril alanda aplikasyon İçin de bir çift-steril-takım ekipman içerir.Rekonstitüsyon seti 2 adet tek kullanımlık İğne, 1 adet mavi çizgili tek kullammiık enjektör ve 1 adet siyah çizgili tek kullammiık enjektör içerir. Aplikasyon seti 2 tek kullanımlık iğne, 1 adet mavi çizgili tek kullanımlık enjektör, I adet siyah çizgili tek kullanımlık enjektör, 1 adet DUPLOJECT tki-Enjektör Klipsi, 2 birleştirme parçası ve 4 aplikasyon iğnesi içerir. Rekonstitüsyon ve uygulama ayrıntıları için izleyen bölüme bakımz. Sterilizasyon etilen oksit ile sağlanmıştır. Kutular açılmadığı ve zarar görmediği müddetçe steril ve non-pirojendir. Tek kullanımlıktır ve re-steriilze edilemez.6.6. Tıbbi üriinlerden arta kalan maddelerin imhası ve diğer özel önlemler GenelTISSEEL LYO uygulanmasından önce, uygulama istenen alan dışındaki vücut alanımn korunarak istenmeyen adezyonlann oluşması önlenmelidir.TISSEEL LYO'nun eldiven ve aletlere yapışmasını önlemek için buralar serum fizyolojik ile ıslatılmalıdır. Yapıştınlacak yüzeyler için bir rehber olmak üzere 1 kutu TISSEEL LYO, İmL Trombin Çözeltisi ve İmL Fibrinojen Çözeltisi İçeren İki Bileşenli Fibrin Yapıştırıcı (1 mL yapıştıncı protein çözeltisi + İmL trombin çözeltisi) en az 10 cm^ lik bir alan için yeterli olacaktır. Doz yapıştınlacak/sızdırmazlığı sağlanacak alanın genişliğine göre değişir. TISSEEL LYO'nun iki bileşeninin birbirinden ayn olarak ardışık uygulanmasından kaçınılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıklann Kontrol Yönetmeliği ve Ambalaj ve Ambalaj Atıklanmn Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir. Hazırlama ve rekonstitttsyonFibrin yapıştıncımn bileşenlerinin rekonstitüsyonu öncesi bütün flakonlann kauçuk tıpalan temizlenmelidir. Ürünle dezenfektanın direkt temasından kaçmılmalıdır (Bkz. Bölüm 4.5).I - Yapıştıncı Protein Çözeltisinin hazırlanması (birinci bileşen):Yapıştıncı protein çözeltisini oluşturmak için Liyofilize Protein Konsantresi Aprotinin Çözeltisi kullanılarak çözülür. Liyofilize protein çözeltisi FİBRİNOTERM ısıtma ve kanştırma cihazı ile hazırlanır (önerilen metod). Hazırlama için alternatif olarak 33-37 C steril su banyosu da kullamlabilir. FİBRİNOTERM cihazı ile hazırlama:- FİBRİNOTERM cihazı sabit olarak 37 "C ısı sağlar. Aym zamanda her liyofilize yapıştıncı protein konsantresi içeren flakonda bulunan manyetik kanştıncıyı döndürerek çözülme zamanını kısaltır. - Liyofilize protein konsantresi ve aprotinin çözeltisi içeren flakonlan FİBRİNOTERM cihazındaki uygun yerlere yerleştirip 3 dakika kadar ön-ısıtma uygulayımz. - Tek-steril takım içindeki iğne ve mavi çizgili enjektör yardımıyla Aprotinin çözeltisini Liyofilize Yapıştıncı Protein Konsantresi içeren flakona transfer ediniz. Liyofilize Yapıştıncı Protein Konsantresi içeren flakonu FİBRİNOTERM cihazınm kanştıncı gözüne (eğer gerekirse adaptörü kullanarak) yerleştiriniz ve tam çözülme sağlanıncaya kadar kanşmasım sağlayınız. Flakon ışığa karşı tutulduğtında herhangi bir partikül görünmüyorsa rekonstitüsyon tamamlanmış demektir. Eğer halen partiküller varsa tam çözülme sağlanana kadar 37 C'de birkaç dakika daha kanşması için bekleyiniz. Tam çözülme sağlamnca manyetik kanştıncıyı kapatımz. Not: Aşın karıştırma ürünün kalitesini azaltabilir.- Hemen kullanılmayacaksa Yapıştıncı Protein Çözeltisini kanştırmaksızm 37 "C'de bekletin. Homojenitenin devamlılığını sağlamak için yapıştıncı protein çözeltisini çift-steril-takım içindeki mavi çizgili enjektöre çekmeden önce sallamaya devam ediniz.- Steril koşullarda, hazırlanmış olan yapıştıncı protein çözeltisini flakondan çekiniz. - Aynntılı bilgi için FİBRİNOTERM cihazı kullanma kılavuzuna bakınız. Sıcak su banvosu kullanarak hazırlama:- Liyofilize yapıştıncı protein konsantresi ve aprotinin çözeltisi içeren flakonlan 33-37C arasında bir sıcak su banyosunda yaklaşık 3 dakika kadar ısıtınız. - Tek-steril-takım içerisinden çıkan mavi çizgili enjektör ve iğne yardımı ile Aprotinin Çözeltisini Liyofilize Yapıştıncı Protein Konsantresi içeren flakona transfer ediniz. - Liyofilize Yapıştıncı Protein Konsantresini 33-37 °C'de bulunan sıcak su banyosuna yeniden yerleştirerek bir dakika kadar bekletiniz. - Yavaşça kanştınmz ancak aşın hareketlerden kaçınınız. Daha sonra llakonu sıcak su banyosuna döndürerek tam çözünme için periyodik olarak kontrol ediniz. Flakon ışığa tutulduğunda partikül görünmüyorsa rekonstitüsyon tamamlanmış demektir. Eğer halen partikül mevcutsa flakonu 33-37 °C'de birkaç dakika daha, çözülme tamamlanana kadar bekletiniz. - Eğer hemen kullanılmayacaksa Yapıştıncı Protein Çözeltisini 33-37 C'de tutmaya devam ediniz. Homojenliği sağlamak için çözeltiyi mavi çizgili enjektöre çekmeden önce yavaşça sallayımz. - Hazırlanmış yapıştıncı protein çözeltisini steril koşullarda enjektöre çekiniz. Not:rekonstutisyon için FİBRİNOTERM cihazı yerine sıcak su banyosu kullamlıricen, muhtemel kontaminasyonu önlemek için flakonu suya batınrken özel dikkat gerekir.II - Trombin Çözeltisinin hazırlanması (ikinci bileşen)Liyofilize İnsan Trombin Konsantresi, Trombin Çözeltisi oluşturmak üzere Kalsiyum Klorür Çözeltisi ile çözülür. Kalsiyum Klorür Çözeltisi içeren flakonun içeriğini Trombin flakonuna mtransfer ediniz. Tek-steril-kit içinde sağlanmış olan siyah çizgili ikinci iğneyi kullanınız.Liyofilize materyali çözmek için yavaşça sallayınız. Trombin çözeltisini ısıtmak için FtBRİNOTERM cihazı veya sıcak su banyosu kullanılabilir. Kullanılana kadar Trombin çözeltisini 33-37 C'de bekletiniz. Kullanımdan önce trombin çözeltisini flakondan çift-steril kit içinde bulunan ikinci iğne ve siyah çizgili enjektör ile çekiniz. Not:Bileşenlerden birinin rekonstitüsyonu İçin kullanılan iğne ve enjektörleri diğer bileşenin rekonstitüsyonu için kullanmayınız; ikinci bileşen flakon veya enjektör içerisinde katılaşabilir.III - Rekonstitüsvonu yapılmış Fibrin Yapıştıncı Bileşenlerinin kullanımıFibrin yapıştıncı bileşenler hazırlandıktan sonra 6 saat içerisinde kulleınılmalıdır.Uygulama:Yapıştıncı Protein ve Trombin çözeltileri berrak veya çok hafif opak olmalıdır. Partikül içeren veya rengi daha koyu olan çözeltileri kullanmayınız. Hazırlanan ürünler uygulamadan önce görsel olarak partikül ve renk değişikliği açısmdan kontrol edilmelidir.Uygulamadan önce TISSEEL LYO 33-37 C'ye ısıtılmahdır. ^ Uygulama için Yapıştıncı Protein ve Trombin Çözeltisi içeren iki tek kullammiık enjektör DUPLOJECT ikili enjektör yuvasına (klips) sabitlenmeli ve bu oluşturulmuş takım bir aplikasyon iğnesi ve bağlantı parçası ile birleştirilmelidir. DUPLOJECT İkili Enjektör sisteminin ortak pistonu kanşma olmadan önce eşit hacimlerde ürünün enjekte edilmesini sağlar. 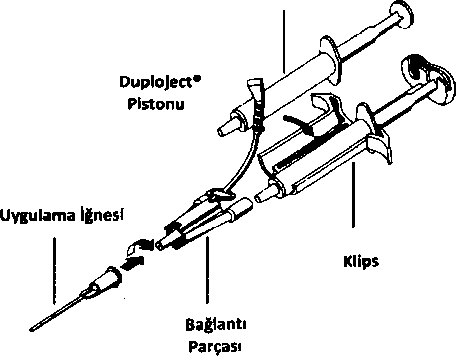 - Yapıştıncı Protein ve Trombin çözeltisi ile dolu iki enjektörü klips içindeki yuvalanna yerleştiriniz. Her iki enjektör de eşit hacimlerde doldurulmuş olmalıdır.
- Yapıştıncı Protein ve Trombin çözeltisi ile dolu iki enjektörü klips içindeki yuvalanna yerleştiriniz. Her iki enjektör de eşit hacimlerde doldurulmuş olmalıdır.- İki enjektörün ucunu da bağlantı parçası ile sıkıca birleştiriniz. Bağlantı şeritini DUPLOJECT ikili enjektör sistemine İliştirerek, birleştirme parçasını sabitleyiniz. Şeritin kopması durumunda yedek birleştirme parçası kullanılır. Yedek parçadaki şeritin de kopması durumunda ürün yine de kullanılabilir ama sızmtı olmaması için bağlantının sağlamlığı iyice kontrol edilmelidir. - Birleştirme parçasına uygulama iğnesini iliştiriniz, İğne deliğinin tıkanmaması için birleştirme parçası ve uygulama İğnesi içindeki havayı uygulamaya başlamadan hemen öncesine kadar çıkarmayınız. - Uygulama yapılacak yüzeye ya da yapıştınlacak parçalann yüzeyine karışmış Yapıştıncı Protein - Trombin Çözeltisini uygulayınız. - TISSEEL LYO'yu sprey cihazı kullanarak uyguladığınızda, sadece sprey cihazımn üreticisi tarafindan önerilen basınç aralığı dahilindeki basıncı kullandığınıza emin olun. TISSEEL LYO'yu spreyle uygularken hava veya gaz embolisi oluşma ihtimali nedeniyle kan basıncındaki değişiklikler, nabız, oksijen satürasyonu ve son tidal CO2 izlenmelidir. Minimal hacimde fibrin doku yapıştıncı kullanımı gerektiren cerrahi girişimlerde TISSEEL LYO'nun ilk bir kaç damlasının kullamimayıp atılması önerilmektedir (Bölüm 4.2 ve 4.4'e bakımz). Fibrin yapıştıncı bileşenlerin uygulanması kesintisiz olmalıdır; kesinti durumunda iğne içinde hızla tıkanıklık oluşur. Bu durumda uygulama iğnesi değiştirilir. Birleştirme parçasında tıkanma olması durumunda ambalajdaki yedek birleştirme parçasını kullanınız. Not:Yüksek Trombin konsantrasyonu (500 lU/mL) nedeniyle yapıştıncı bileşenlerin harmanlanmasından saniyeler sonra fibrin yapıştırıcı oluşmaya başlar.Minimal invazif girişimlerde kullanım için ve büyük ya da uygulamamn zor olduğu yerlere uygulama için BAXTER tarafindan sağlanan diğer aksesuarlarla da uygulama mümkündür. Bu uygulama cihazlanyla uygulanması sırasında, ilgili cihazın Kullanım Talimatı'na uyulmalıdır. tki bileşen uygulandıktan sonra yara dudaklan biraraya getirilir. Fibrin yapıştıncmm çevredeki dokuya sıkıca yapıştığından emin olunması için yapıştınlan parçalar hafifçe baskı uygulanarak, 3-5 dakika süreyle istenen pozisyonda tutulur ya da sabitlenir. Bazı uygulamalarda, taşıyıcı madde olarak ya da sağlamlaştırma için kolajen parçası gibi biyouyumlu materyal kullanılabilir. 7. RUHSAT SAHİBİEczacıbaşı-Baxter Hastane Ürünleri Sanayi ve Ticaret A.Ş.Cendere Yolu, Pırnal Keçeli Bahçesi 34390 Ayazağa-ISTANBUL Tel: (0.212)329 62 00 Faks: (0.212) 289 92 75Web:www.eczacibasi-baxter.com.tr8. RUHSAT NUMARASI(LARI)679. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİilk ruhsat tarihi: 14.03.2011 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ
# |
İlaç BilgileriTisseel LYO 2ml Trombin Çözeltisi ve 2ml Fibrinojen Çözeltisi İçeren İki Bileşenli Fibrin YapıştırıcıEtken Maddesi: İnsan fibrinojeni, aprotinin, insan trombini, kalsiyum klorür Atc Kodu: V03AK Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.