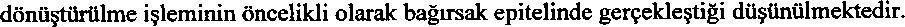Telzir 700mg Film Tablet Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Sistemik Antiviral İlaçlar » Virüslere Karşı Direkt Etkili İlaçlar » Proteaz inhibitörleri » Fosamprenavir KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADITELZİR 700 mg film tablet2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir film tablette;Fosamprenavir (INN)...........700 mg (yaklaşık 600 mg amprenavire eşdeğer fosamprenavir kalsiyum olarak) Yardımcı maddeler:Kroskarmeloz sodyum.......57.0 mgYardımcı maddeler için bölüm 6.1'e bakınız 3. FARMASÖTİK FORMKapsül şeklinde, pembe renkte, bikonveks ve bir yüzünde GXLL7 baskısı olan film kaplı tablet.4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasy onlarTELZİR, diğer antiretroviral ajanlarla kombinasyon halinde kullanılmak üzere İnsan Bağışıklık Yetmezliği Virüsü (HIV) ile enfekte erişkinlerin tedavisinde endikedir.4.2 Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Tedavi, HIV enfeksiyonu tedavisinde deneyimli bir hekim tarafından başlatılmalıdır.Yetişkinler (18 yaş ve üstünde olanlar)Daha Önce Tedavi Görmemiş (Naiv) Hastalar:Günde 1 kez 1400 mg TELZİR+ günde 1 kez 100 mg ya da 200 mg ritonavir Günde 2 kez 700 mg TELZİR + günde 2 kez 100 mg ritonavirProteaz İnhibitörü Almış HastalarGünde 2 kez 700 mg TELZİR + günde 2 kez 100 mg ritonavirTüm rejimlerin diğer antiretroviral ajanlarla birlikte kombinasyon halinde uygulanması gerekmektedir. Uygulama şekli:TELZİR oral yolla uygulanır ve tabletler yemeklerden bağımsız olarak yutulabilir.Özel popfilasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek bozukluğu olan hastalarda doz ayarlaması yapılması gerekli değildir{bkz.Farmakolojik özellikler).Karaciğer yetmezliği:Fosamprenavir insanlarda amprenavire dönüşen bir ön ilaçtır. Amprenavir ve ritonavirin vücuttan temel atılma yolu karaciğer metabolizmasıdır.Hafif karaciğer yetmezliği (Child-Pugh skoru: 5-6) olan erişkinlerde: Fosamprenavir kullanılırken dikkatli olunmalı ve günde iki kez 700 mg fosamprenavir ve günde bir kez düşük doz (100 mg) ritonavir verilmelidir. Orta dereceli karaciğer yetmezliği (Child-Pugh skoru: 7-9) olan erişkinlerde: TELZİR kullanılırken dikkatli olunmalı ve günde iki kez 450 mg TELZİR ve günde bir kez düşük doz (100 mg) ritonavir uygulanmalıdır. Bu fosamprenavir dozunu tablet formülasyonuyla sağlamak mümkün olmadığından, bu hastalar fosamprenavir oral süspansiyonla tedavi edilmelidir. Şiddetli karaciğer yetmezliği (Child-Pugh skoru: 10-15) erişkinlerde : TELZİR kullanılırken dikkatli olunmalı ve günde iki kez 300 mg fosamprenavir ve günde bir kez 100 mg ritonavir şeklindeki düşük doz verilmelidir. Bu fosamprenavir dozunu tablet formülasyonuyla sağlamak mümkün olmadığından, bu hastalar fosamprenavir oral süspansiyonla tedavi edilmelidir. Karaciğer yetmezliği olan çocuklarda (2-12 yaş) ve adolesanlarda (12-17 yaş) bu yaş gruplarında bir klinik çalışma yapılmadığından doz önerisi bulunmamaktadır. Pediyatrik popülasyon ve adolesanlarda kullanım (-6 yaş - 17 yaş)Çocuklarda vücut ağırlığının baz alındığı en doğru dozlama seçeneği olarak fosamprenavir oral süspansiyon önerilmektedir.En az 39 kg olmaları ve tableti bütün halinde yutabilmeleri halinde çocuklarda ve adolesanlarda günde bir kez fosamprenavir 1400 mg + günde bir kez ritonavir 200 mg (proteaz inhibitörü kull anmamışhastalarda) veya günde iki kez TELZİR 700 mg ve günde iki kez ritonavir 100 mg dozları (proteaz inhibitörü kullanmamış veya kullanmış hastalarda) kullanılabilir.cÇocuklar (6 yaştan küçük)Fosamprenavir'in güvenliliği ve etkililiği bu hasta popülasyonunda henüz belirlenmemiştir.Geriyatrik popülasyon:Ritonavir ile kombinasyon halindeki fosamprenavirin farmakokinetiği, 65 yaş üstü hastalarda incelenmemiştir{bkz.Farmakolojik özellikler). Bu nedenle bu hastalarda doz ile ilgili bir öneride bulunulamaz.4.3 KontrendikasyonlarFosamprenavir, amprenavir ve ritonavir ya da bu tıbbi ürünlerin yardımcı maddelerinden herhangi birine karşı aşın duyarlılığı olanlarda kontrendikedir.Ritonavirle kombinasyon halindeki TELZİR, sitokrom P450 3A4 (CYP3A4) substratlan olan, dar terapötik aralığa sahip tıbbi ürünlerle birlikte uygulanmamalıdır. Bu ilaçların birlikte uygulanması bu tıbbi ürünlerin metabolizmasının yarışmalı olarak inhibisyonuna neden olabilir ve plazma konsantrasyonlarında artış için potansiyel yaratarak, örneğin kalp aritmileri (örneğin astemizol, bepridil, terfenadin, sisaprid, pimozid), hipotansiyon (alfuzosin), uzun süreli sedasyon, solunum depresyonu (örneğin triazolam, midazolam), periferik vazospazm ya da iskemi (örneğin ergotamin, dihidroergotamin, ergonovin ve metilergonovin) gibi ciddi ve / veya yaşamı tehdit edici advers olaylara yol açabilir (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Ritonavir aynı zamanda CYP2D6'yı da in vitroin vivo(bkzDiğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri.).Fosamprenavir pulmoner arteriyel hipertansiyon tedavisi amacıyla kullanılan sildenafil veya erektil disfonksiyon tedavisinde kullanılan sildenafil, vandenafil, tadalafıl gibi fosfodiesteraz inhibitörleri ile eşzamanlı kullanılmamalıdır. Sildenafil ile ilişkili ciddi advers olay potansiyeli artmaktadır (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Fosamprenavir ritonavir ile eşzamanlı kullanıldığında, antiaritmik flekainid ve propafenon kullanılması kontrendikedir (bkz.potansiyel ilaç etkileşimleri için ritonavir ürün bilgisine bakınız).Ritonavirle kombinasyon halinde TELZİR, amprenavirin plazma konsantrasyonlarında büyük düşüşler beklenmesi nedeniyle rifampisinle birlikte alınmamalıdır (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).4.4 Özel kullanım uyanları ve önlemleriHastaların fosamprenavir/ ritonavir kombinasyonunun ya da mevcut tüm diğer antiretroviral tedavilerin HIV enfeksiyonunu tedavi etmediği ve hala firsatçı enfeksiyonlar ya da HIV enfeksiyonunun diğer komplikasyonlarının gelişebileceği konusunda uyarılmaları gerekmektedir. Fosamprenavir/ ritonavir kombinasyonları dahil mevcut antiretroviral tedavilerin HlV'in cinsel temas ya da kan yoluyla bulaşma riskini önledikleri kanıtlanmamıştır. Uygun önlemlerin alınmaya devam edilmesi gerekmektedir.Fosamprenavir bir sülfonamid kısmı içermektedir. Sülfonamid sınıfına mensup ilaçlar ile Fosamprenavir arasında çapraz duyarlılık potansiyeli olup olmadığı bilinmemektedir. TELZİR'in temel çalışmalarında sülfonamid alerjisi olan ve olmayan hastalarda TELZİR / ritonavir kombinasyonunun döküntü riskinde artışa neden olması konusunda bir kanıt bulunmamıştır.Yine de TELZİR / ritonavir kombinasyonu, sülfonamid alerjisi öyküsü olan hastalarda dikkatle kullanılmalıdır.TELZİR'in -6 yaşından küçük çocuklarda farmakokinetiği, güvenliliği ve etkililiği henüz tespit edilmemiştir. TELZİR'in ritonavir ile birlikte onaylanan dozlardan daha yüksek dozlarda kullanımı, bazı hastalarda transaminaz seviyelerinde artışa neden olmuştur ve bu şekilde kullanımı tavsiye edilmemektedir. KaraciğerBöbrek fonksiyon bozulduğu:Amprenavir ve ritonavirin her ikisi de temelde karaciğerde metabolize edilmektedir ve bu yüzden fosamprenavir / ritonavir kombinasyonu, hafif, orta dereceli ya da şiddetli karaciğer bozukluğu olan hastalara verilirken dikkatli davramlmalıdır. Hepatit B ya da C enfeksiyonu veya tedavi öncesinde transaminaz düzeyleri yüksek olan hastalarda transaminazlarda artış riski daha fazladır. Tedaviye başlamadan önce ve tedavi sırasında düzenli aralıklarla uygun laboratuvar tetkikleri yapılmalıdır.Tıbbi ürünler - potansiyel etkileşimler:Hem TELZİR'in etkin metaboliti olan amprenavir hem de ritonavir, CYP3A4 enziminin inhibitörleridir. Ritonavirle kombinasyon halinde TELZİR, dar bir terapötik aralığa sahip olan ve CYP3A4'ün substratı olan ilaçların plazma düzeylerini yükseltebileceğinden birlikte verilmemesi gerekmektedir. CYP3A4'ün indükleyicileri, inhibitörleri ya da substratlan olan diğer tıbbi ürünler de ciddi ve/veya yaşamı tehdit edici ilaç etkileşimlerine neden olabilir. Bu nedenle ritonavirle kombinasyon halindeki TELZİR bu tür ürünlerle uygulandığında dikkat edilmelidir (bkz.Kontrendikasyonlar ve Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).TELZİR ve ritonavirin halofantrin konsantrasyonlarım artabileceğinden, halofantrin ile birlikte uygulanması tavsiye edilmez. Bu durum kardiyak aritmi gibi ciddi advers etki riskini artırır (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Hepatit C virüsü (HCVİ proteaz inhibitörleri:HCV proteaz inhibitörleri, HIV proteaz inhibitörleri ile yapısal benzerlikler taşımaktadır ve ortak bir metabolizma yolu paylaştıklarına işaret eden kanıtlar mevcuttur. Fosamprenavirin ritonavir ve telaprevir ile eşzamanlı uygulaması, kararlı durumda gerek amprenavire gerekse telaprevire azalmış maruziyet ile sonuçlanır ve konsantrasyonların terapötik düzeyin altmda olması olasıdır. Fosamprenavir'in, ritonavir ve telaprevir ile eşzamanlı uygulanması önerilmez (bkz. Etkileşimler).Ritonavir ile kombinasyon halinde bazı HIV proteaz inhibitörleri ile boseprevir arasında, HIV proteaz inhibitörleri konsantrasyonlarda düşüş ile sonuçlanan ve bazı durumlarda boseprevir konsantrasyonlarında düşüşe neden olan bir farmakokinetik etkileşim bildirilmiştir. Fosamprenavir ile ritonavir ve boseprevirin eşzamanlı uygulaması incelenmemiş olmakla birlikte benzer bir etkileşim olasıdır ve dolayısıyla eşzamanlı uygulama önerilmez. İmmün rekonstitüsyon durumumda otoimmün bozuklukların (Graves hastalığı, polimiyozit ve Guillain-Barre sendromu gibi) ortaya çıktığı da bildirilmiştir ancak olayın başlangıcına kadar geçen süre farklılık göstermektedir ve tedavinin başlatılmasını takiben aylar sonra görülebilir ve bazı durumlarda atipik bir tablo olabilir. HMG-CoA redüktaz inhibitörleri lovastatin ve simvastatin CYP3A4 metabolizmasına büyük ölçüde bağımlı olduklarından fosamprenavir ve ritonavirin simvastatin ya da lovastatin ile birlikte uygulanması, rabdomiyoliz dahil miyopati riskinin artmasına neden olduğu için tavsiye edilmemektedir. Fosamprenavir ve ritonavir, CYP3A4 tarafından daha küçük ölçüde metabolize edilen atorvastatin ile birlikte uygulandığında da dikkat edilmesi gerekmektedir. Bu durumda atorvastatin dozunun azaltılması düşünülebilir. Eğer bir HMG-CoA redüktaz inhibitörüyle tedavi endikasyonu mevcutsa, pravastatin ya da fluvastatin kullanılması önerilmektedir (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Fosamprenavir'in, ritonavir ve flutikazon propiyonat veya CYP3A4 tarfmdan metabolize edilen diğer glukokortikoidlerle birlikte kullanımı, tedavinin yaran, Cushing sendromu ve sürrenal (adrenal) baskılanması da dahil sistemik kortikosteroid riskinden fazla değilse tavsiye edilmez. Bepridil metabolizmasından sorumlu olan izozim(ler) henüz keşfedilmemiş olmakla birlikte bepridil metabolizmasından öncelikli olarak sorumlu olan metabolik yollara CYP450 enzim sistemi aracılık etmektedir. Amprenavir ve ritonavir, ilaç metabolizmasından en sık sorumlu olan CYP3A4 izoziminin inhibitörleri olduklarından ve plazmanın bepridile maruziyetindeki bir artış yaşamı tehdit edici aritmi riskini artırabileceğinden fosamprenavir ve ritonavir bepridil ile birlikte uygulanırken dikkat edilmelidir. Amprenavir ve amiodaron, lidokain (sistemik), trisiklik antidepresanlar, kinidin ve varfarin arasında ciddi ve / veya yaşamı tehdit edici ilaç etkileşimleri meydana gelebilir. Birlikte kullanıma bağlı potansiyel güvenlilik sorunları riskini asgari düzeye indireceğinden, bu maddelerin konsantrasyonları takip edilmelidir (varfarin - Uluslararası Normalize Edilmiş Oran (INR) takibi). Fosamprenavir /ritonavir kombinasyonu alan hastalara aynı zamanda PDE5 inhibitörlerinin (ör. Sildenafil, vandenafil, tadalafil) de uygulanması tavsiye edilmemektedir, TELZİR ve ritonavirin PDE5 inhibitörleri ile birlikte uygulanması PDE5 inhibitörünün konsantrasyonunun önemli ölçüde artışıyla sonuçlanacaktır ve bu da hipotansiyon, senkop, görmede değişiklikler ve priapizm gibi PDE5 inhibitörleri ile ilişkili advers olaylara neden olabilir {bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Amprenavirin rifabutin ile birlikte verilmesi, rifabutin plazma konsantrasyonlannda (EAA) %200 oranında bir artışa yol açmaktadır. Ritonavir fosamprenavir ile birlikte uygulandığında, rifabutin konsantrasyonlannda daha da büyük bir artış olması beklendiğinden rifabutin için önerilen dozun en az %75 oranında azaltılması tavsiye edilmektedir ve hastalann klinik takip altında tutulması gerekmektedir (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Fosamprenavir/ritonavir kombinasyonu kullanılırken Hypericum perforatumHypericum perforatum'vın{bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Hormon replasman tedavisi olarak, fosamprenavir ve ritonavirin östrojen ve/veya progesteronla birlikte uygulanması ile ilgili veri yoktur. Fosamprenavir ve ritonavirle yapılan bu tedavilerin etkililiği ve güvenliliği tespit edilmemiştir. Döküntü / deri reaksiyonları:{bkz.İstenmeyen etkiler).Hemofilik hastalar:Proteaz inhibitörleriyle tedavi edilen A ve B tipi hemofilik hastalarda, spontan cilt hematomlan ve hemartrozlan dahil artmış kanama raporları bulunmaktadır. Bazı hastalarda faktör VIII uygulanmıştır. Bildirilen vakalann yansından çoğunda proteaz inhibitörleriyle tedaviye devam edilmiş ya da tedavi kesilmişse bile tekrar başlanmıştır. Etki mekanizması keşfedilmemiş olsa da bir sebep-sonuç ilişkisi olduğu düşünülmüştür. Bu nedenden ötürü hemofilik hastalann kanama artışı olasılığı konusunda bilgilendirilmeleri gerekmektedir.Hiperglisemi:Proteaz inhibitörleri dahil antiretroviral tedavi alan hastalarda şeker hastalığı, hiperglisemi başlangıcı ya da mevcut şeker hastalığında alevlenme meydana gelebildiği bildirilmiştir. Bu olayların tedavisi için bazı hastalarda insülin veya oral hipoglisemik ajan uygulamasına başlanması ya da doz ayarlanmasının yapılması gerekebilir. Bazı vakalarda aynı zamanda diyabetik ketoasidoz da görülmüştür. Proteaz inhibitör tedavisi ile bu olaylar arasında nedensel bir ilişki kurulmamıştır.Vücut yağının dağılımında değişiklik:Bir proteaz inhibitörü içeren rejimler dahil kombinasyon antiretroviral tedavi bazı hastalarda vücut yağı dağılımında değişime/birikime neden olmuştur. Nedensel bir ilişki kurulmamıştır.Lipid yükselmesi:Fosamprenavir + ritonavir tedavisi, trigliserit ve kolesterol konsantrasyonlarında artışlara neden olmuştur. Fosamprenavir tedavisine başlamadan önce ve tedavi sırasında da düzenli aralıklarla trigliserit ve kolesterol testleri yapılmalıdır. Lipid bozuklukları klinik olarak gerektiği şekilde tedavi edilmelidir.İmmun Rekonstitüsyon Sendromu:Pneumocystis jiroveci (P. carinii) pneumoniakonu ile ilgili örneklerdir. Herhangi bir yangı belirtisi gecikmeden değerlendirilmeli ve gerektiğinde tedaviye başlanmalıdır. Immün rekonstitüsyon durumumda otoimmün bozuklukların (Graves hastalığı, polimiyozit ve Guillain-Barre sendromu gibi) ortaya çıktığı da bildirilmiştir ancak olayın başlangıcına kadar geçen süre farklılık göstermektedir ve tedavinin başlatılmasını takiben aylar sonra görülebilir ve bazı durumlarda atipik bir tablo olabilir.Osteonekroz:Etiyolojinin çok faktörlü olduğu düşünülmekle birlikte (kortikosteroid kullanımı, alkol tüketimi, şiddetli immün sistem baskılanması, yüksek vücut kitle indeksi gibi), özellikle ilerlemiş HIV hastalığı olan ve/veya kombinasyon antiretroviral tedaviye (CART) uzun süreli maruziyetin söz konusu olduğu hastalarda osteonekroz olguları bildirilmiştir. Eklem ağrıları, eklem tutulması ya da hareket güçlüğü deneyimlemeleri durumunda hastalara, hastaneye başvurmaları önerilmektedir. Bu tıbbi ürün her dozunda 57 mg sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriRitonavir daha güçlü bir CYP3A4 inhibitörü olduğundan, TELZİR ve ritonavir birlikte verildiğinde, ritonavirin metabolik ilaç etkileşim profili baskın çıkabilir. Bu nedenden dolayı TELZİR ve ritonavir tedavisine başlanmadan önce, ritonavirin Kısa Ürün Bilgilerine (KÜB) başvurulmalıdır.Etkileşim çalışmaları yalnızca yetişkinlerle yapılmıştır.CYP3A4'ü içeren etkileşimlerFosamprenavirin etkin metaboliti olan amprenavir ve ritonavir karaciğerde öncelikli olarak CYP3A4 tarafından metabolize edilmektedir. Bundan dolayı bu metabolik yolu paylaşan ya da CYP3A4 aktivitesini modifiye eden ilaçlar, amprenavir ve ritonavir farmakokinetiğinde değişikliğe yol açabilir. Benzer bir şekilde, fosamprenavir'in ritonavirle kombinasyon halinde uygulanması, bu metabolik yolu paylaşan diğer ilaçların farmakokinetiğinde değişikliğe neden olabilir(bkz.Kontrendikasyonlar ve özel kullanım uyanları ve önlemleri).,CYP2D6'yı içeren etkileşimlerRitonavir sitokrom P450 izoform CYP3A'nın güçlü bir inhibitörüdür. Ritonavir aynı zamanda CYP2D6'yı baskılamakta ve CYP3A4, CYP1A2, CYP2C9 ve glukuronozsil tranferazı indüklemektedir. Fosamprenavir ritonavire göre daha zayıf bir CYP3A4 inhibitörüdür.Kontrendikasyonlan içeren etkileşimler(bkz.Kontrendikasyonlar)Ritonavirle kombinasyon halindeki fosamprenavir, sitokrom CYP3A4 enziminin substratlan olan, dar terapötik aralığa sahip tıbbi ürünlerle birlikte uygulanmamalıdır. Bu ilaçların birlikte uygulanması örneğin kalp aritmileri (örneğin astemizol, terfenadin, sisaprid, pimozid), hipotansiyon (örneğin alfa blokör alfuzosin), uzun süreli sedasyon, solunum depresyonu (örneğin triazolam, midazolam), periferik vazospazm ya da iskemi (örneğin ergotamin, dihidroergotamin, ergonovin ve metilergonovin) gibi ciddi ve / veya yaşamı tehdit edici advers olaylara yol açabilir.Ritonavir CYP2D6'mn inhibitörüdür. Ritonavirle kombinasyon halinde fosamprenavir, CYP2D6 flekainid ve propafenon ile eşzamanlı kullanılmamalıdır. Rifampisin, amprenavirin plazma Eğri Altı Alan (EAA) düzeyini yaklaşık %82 oranında düşürmektedir. Diğer proteaz inhibitörlerine ilişkin bilgilere dayanarak TELZİR ve ritonavirin rifampisinle birlikte verilmesinin de amprenavir plazma konsantrasyonlarında büyük artışa yol açması beklenmektedir. Diğer etkileşimler, kullanım için önlemlerAntiretroviral ajanlar:Non-nükleozmd ters transkriptaz inhibitörleri:Efavirenz:efavirenzin (günde bir kez 600 mg), günde bir kez TELZİR ve ritonavir rejimiyle (fosamprenavir günde bir kez 1400 mg ve ritonavir günde bir kez 200 mg) birlikte verilmesi, plazma amprenavir EAA değerini %13 ve Cmi seviyesini %36 oranında azaltmıştır. Ritonavir dozunun günde bir kez 300 mg düzeyine yükseltilmesiyle amprenavir plazma konsantrasyonu korunmuştur. Efavirenz (günde bir kez 600 mg) günde iki kez TELZİR ve ritonavir rejimiyle (fosamprenavir günde iki kez 700 mg ve ritonavir günde iki kez 100 mg), amprenavir plazma konsantrasyonlarında önemli bir değişiklik meydana gelmemiştir.Nevirapin:TELZİR700100m^EAA'Cm1119EAA, Cma14, % 13,TELZİR700TELZİRve ritonavirin günde bir kez verilmesi ile ilgili çalışma yapılmamıştır.TELZİR ile (1400 mg iki hafta boyunca günde iki sefer) birlikte lopinavir / ritonavir (533 mg / 133 mg iki hafta boyunca günde iki sefer) verildiğinde (lopinavir / ritonavir 400 mg /100 mg iki hafta boyunca günde iki sefer uygulandığında gözlenen değerlere kıyasla) lopinavirin Cmaks, EAA ve CininCmaCm%26 ve %42 oranlarında düşüş sergilemiştir. Bu kombinasyonun güvenlilik ve etkililik açısından uygun dozları henüz belirlenmemiştir.indinavir:CmaCmaCmseviyeleri sırasıyla %22, %38 ve %27 oranlannda düşmüştür.Nelfinavir:CmaCmCmaCmseviyeleri sırasıyla %12, %15 ve %14 oranlannda artmıştır.integraz İnhibitörleri:Raltegravir:Sağlıklı gönüllülerde günde 2 kez fosamprenavir 1400 mg ve günde 2 kez raltegravir 400 mg birlikte uygulanması amprenavir (Cmin %33 azalır) ve raltegravirin (Cmin %68 azalır) plazma konsantrasyonlanmn (açlık değerleri) azalması ile sonuçlanmıştır. Fosamprenavirin (ritonavir olmadan) raltegravir ile birlikte uygulanması, olası sub-terapötik amprenavir plazma konsantrasyonları ile sonuçlanabileceği için, önerilmemektedir (Uyanlar ve Önlemlere bakınız).Fosamprenavir/ritonavir 700/10024002Cm19-3 3Cm%36-541400/10014002Cm%17-50Cm%25-41azalma gözlenmiştir. Bu azalmaların klinik önemi bilinmemektedir.CCR5-reseptör antagonistleri:Maravirok:Fosamprenavir 700 mg ve ritonavir 100 mg (günde iki kez), maravirok 300 mg (günde iki kez) ile birlikte uygulandığında amprenavir Ci2h değerinde %36'lık bir düşüş ve fosamprenavir 1400 mg ve ritonavir 100 mg (günde bir kez), maravirok 300 mg (günde bir kez) ile uygulandığında amprenavir C24h değerinde %15'lik bir düşüş gözlenmiştir. Klinik çalışmalar fosamprenavir/ritonavir ile maravirok arasında ve diğer güçlendirilmiş PFlar ile günde iki kez maravirok 150 mg arasında benzer etkililik göstermiştir. Fosamprenavir/ritonavir ile bir arada uygulandığında maravirok maruziyetleri yaklaşık 2 kat artmaktadır. Fosamprenavir/ritonavir, maravirok ile eşzamanlı uygulanacaksa, önerilen maravirok dozu günde iki kez 150 mg'dır. Ritonavir ile bir arada uygulanacak fosamprenavir için doz ayarlaması gerekmez.Anti-hepatit C tıbbi ürünleri:Telaprevir: Fosamprenavir ile ritonavir ve telaprevirin eşzamanlı uygulanması sonucunda gerek amprenavirin gerekse telaprevirin kararlı durum maruziyetinde azalma olur. Etkileşimin mekanizması bilinmemektedir. Fosamprenavir ile ritonavir ve telaprevir eşzamanlı uygulanması önerilmez. Antibiyotikler /AntifungallerKlaritromisin:ritonavir, klaritromisinin plazma konsantrasyonlarım artırmaktadır. Böbrek bozukluğu olan hastalara fosamprenavir ve ritonavirle birlikte verildiğinde klaritromisin dozunda bir azaltma yapılması düşünülmelidir.Eritromisin:ılmamışolmakla birlikte, birlikte uygulanmaları halinde her iki tıbbi ürünün plazma düzeylerinde artış görülebilir.Ketokonazol / itrakonazol:hem amprenavir hem de ritonavir ketokonazolün plazma konsantrasyonlarım artırmaktadır ve itrakonazol konsantrasyonlarını da artırmaları beklenmektedir. Yüksek dozda ketokonazol ve itrakonazol (> 200 mg/gün), risk / fayda oram değerlendirilmeden ve ketokonazol ile itrakonazole bağlı advers olaylara yönelik daha yoğun takip yapılmadan fosamprenavir ve ritonavirle birlikte kullanılmamalıdır.Rifampisin:Cm%92%82{bkz.Kontrendikasyonlar).Rifabutin:{bkz.Özel kullanım uyanları ve önlemleri).Diğer tıbbi ürünlerAntasitler:Cmaseviyeleri sırasıyla %18 ve %35 oranında azalırken Cmin (C12) seviyesi %14 oranında artış göstermiştir. Birlikte uygulanması halinde ilgili tıbbi ürünlerden hiçbiri için doz ayarlaması yapılması gerekli değildir.Amiodaron, kinidin, lidokain (sistemik yoldan), trisiklik antidepresanlar ve varfarin (INR takibi) gibi ciddi ya da yaşamı tehdit edici advers olaylara neden olabilen bazı maddeler için plazma konsantrasyonu takibi yapılabilir. Bu tıbbi ürünler için fosamprenavir ve ritonavirle yapılacak eşzamanlıkullanımdaoluşan güvenlilik sorunu olasılığım konsantrasyon takibiyle azaltmak mümkündür.Aşağıda sıralanan ilaçlar, eşzamanlı kullanılmaları halinde ritonavirle kombinasyon halinde fosamprenavir ile etkileşime girebilecek CYP3A4 substratlanna, inhibitörlerine ya da indükleyicilerine örneklerdir. Bu liste eksiksiz değildir. Bu potansiyel etkileşimlerin klinik açıdan önemi bilinmemektedir ve henüz araştırılmamıştır. Bu nedenle TELZİR ve ritonavirle birlikte kullanılmaları halinde hastaların toksisite yönünden takip edilmeleri gerekmektedir. Antikonvülsan ilaçlar:Enzim indükleyicileri olarak bilinen diğer antikonvülsan ajanların (fenobarbital, karbamazepin) birlikte verilmesi (henüz çahşılmamakla birlikte) amprenavir plazma konsantrasyonlarında azalmaya yol açabilir.Fenitoin:Fosamprenavir (günde iki kez 700 mg) + ritonavir (günde iki kez 100 mg) fenitoinle (günde iki kez 300 mg) eş zamanlı olarak verildiğinde amprenavirin EAA ve Cmüı değeri sırasıyla %20 ve %19 oranında artmış, Cmaks değeri aynı kalmıştır. Fenitoinin EAA, Cmaks Ve Cmm değerleri sırasıyla %22, %20 ve %29 oranında azalmıştır. Dolayısıyla, fosamprenavir + ritonavir fenitoinle birlikte verildiğinde, fosamprenavir + ritonavir dozaj rejiminde herhangi bir değişiklik yapılması gerekmemektedir. Ancak fenitonin plazma konsantrasyonlarının izlenmesi ve fenitoin dozunun gerektiği şekilde artırılması önerilmektedir. Fosamprenavir + ritonavir günde bir kez rejimi incelenmemiştir.Benzodiazepinler:{bkz.Kontrendikasyonlar).Kalsiyum kanal blokörleri:amlodipin, diltiazem, felodipin, isradipin, nikardipin, nifedipin, nimodipin, nisoldipin ve verapamilin serum konsantrasyonlan artabilir ve buna bağlı aktivite ve toksisitelerinde artış görülebilir.Deksametazon:CYP3A4'ü indükleyebilir ve amprenavirin plazma konsantrasyonlarım azaltabilir.Fosfodiesteraz (PDE5) inhibitörleri:(bkz.Özel kullanım uyarılan ve önlemleri).Flutikazon propiyonat (ritonavir ile etkileşim):%86 oranında düşerken flutikazon propiyonatm plazma seviyeleri belirgin olarak artmıştır. Flutikazon propiyonatın ağız yolundan inhalasyon şeklinde verildiğinde daha şiddetli sistemik etki riskinin olması beklenmektedir.Ritonavir ve inhalasyon yoluyla veya intranazal yolla uygulanan flutikazon propiyonat kullanan hastalarda Cushing sendromu ve adrenal süpresyon dahil sistemik kortikosteroid etkileri bildirilmiştir; bu etki P450 3A yolağı aracılığı ile metabolize olan diğer kortikosteroidler için de beklenir (bkz.Özel kullanım uyanlan ve önlemleri).Bu nedenle, hastaya sağladığı yarar kortikosteroidlerin sistemik advers etkilerinden daha önemli değilse flutikazon propiyonat ve ritonavirin birlikte kullanımından kaçınılmalıdır. Halofantrin:(bkz.Özel kullanım uyanlan ve önlemleri).HMG-CoA redüktaz inhibitörleri:lovastatin ve simvastatin gibi metabolizma için CYP3A4'e yüksek düzeyde bağımlı olan HMG-CoA redüktaz inhibitörlerinin, TELZİR ve ritonavirle birlikte verilmeleri durumunda plazma konsantrasyonlannm önemli ölçüde artması beklenmektedir. HMG-CoA redüktaz inhibitörlerinin artmış konsantrasyonlan rabdomiyoliz dahil miyopatiye neden olabileceğinden, bu tıbbi ürünlerin fosamprenavir ve ritonavirle kombine edilmemesi önerilmektedir.Atorvastatin (10 mg 4 gün boyunca günde bir kez) fosamprenavir / ritonavirle (700 mg /100 mg iki hafta boyunca günde iki kez) birlikte verildiğinde atorvastatinin CmaCmCmaCmdüzeylerinde değişim meydana gelmemiştir.Fosamprenavir ve ritonavirle birlikte kullanıldığında 20 mg/günü aşmayan atorvastatin dozlan uygulanmalı ve atorvastatin toksisitesine yönelik dikkatli takip yapılmalıdır. Pravastatin ve fluvastatinin metabolizması CYP3A4'e bağımlı değildir ve proteaz inhibitörleriyle etkileşim göstermesi beklenmemektedir. Bir HMG-CoA redüktaz inhibitörüyle tedavi endikasyonu oluştuğunda pravastatin ya da fluvastatin kullanılması tavsiye edilmektedir (bkz.Özel kullanım uyanlan ve önlemleri).İmmünosüpresanlar:Fosamprenavir ve ritonavirle birlikte uygulandığında siklosporin, rapamisin ve takrolimusun plazma konsantrasyonlannda artış görülebilir. Bu nedenle plazma seviyeleri sabitleşene dek terapötik konsantrasyon takibinin sık yapılması tavsiye edilmektedir.Metadon:14 gün süreyle günde iki kez fosamprenavir 700 mg ve ritonavir 100 mg ile eş zamanlı olarak günde bir kez (< 200 mg) metadon uygulaması aktif (R-) metadon enantiyomeri EAA (0-t) ve Cmaks değerlerini sırasıyla %18 ve %21 oranında azaltmıştır. R-metadonun bağlanmayan fraksiyonu 2 saatte (%8.5'e karşı %12.4) ve 6 saatte (%9.3'e karşı %11.5) ancak plazmaya bağlanmayan R-metadon (aktif) konsantrasyonları 2 ve 6 saat sonra anlamlı şekilde değişiklik göstermemiştir. Önceki karşılaştırmalar baz alındığında, metadonun plazma amprenavir farmakokinetik parametrelerini değiştirmediği görülmektedir. Bu veriler baz alındığında, fosamprenavir + ritonavir metadonla eş zamanlı olarak uygulandığında herhangi bir doz ayarlaması yapılmasına gerek yoktur.Paroksetin:TELZİR ve ritonavir ile birlikte uygulandığında paroksetinin plazma konsantrasyonu belirgin olarak azalabilir. Paroksetinin doz ayarlaması klinik etkiye (tolere edebilme ve etkililik) göre yapılmalıdır.Steroidler:Cma(PK)Cma(bkz.Özel kullanım uyanlan ve önlemleri).St John 's Wort: St John 's Wort (Hypericum perforatum-Sarı kantaron)(bkz.Özel kullanım uyanlan ve önlemleri)Özel popülasyonlara ilişkin ek bilgilerVeri yoktur.Pediyatrik popülasyonVeri yoktur.4.6 Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Gebe kadınlar üzerinde yapılan çalışmalar yetersizdir, buna ilişkin yeterli veri bulunmamaktadır. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fötal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). insanlara yönelik potansiyel risk bilinmemektedir.Fosamprenavir, ritonavir ve oral kontraseptifler birlikte uygulandığında hepatik transaminaz yükselmesi riskinde artış ve hormonal seviyelerde değişiklik olabileceğinden çocuk doğurma potansiyeli olan kadınların hormonal olmayan alternatif doğum kontrol yöntemlerini kullanması tavsiye edilmektedir (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Fosamprenavir kullanmakta olan kadınlar uygun bir kontrasepsiyon (hormonal olmayan) uygulayarak gebelikten korunmalıdır.TELZİR gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Fosamprenavir, ritonavir ve oral kontraseptifler birlikte uygulandığında hepatik transaminaz yükselmesi riskinde artış ve hormonal seviyelerde değişiklik olabileceğinden çocuk doğurma potansiyeli olan kadınların hormonal olmayan alternatif doğum kontrol yöntemlerini kullanması tavsiye edilmektedir (bkz.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Gebelik dönemiGebe sıçanlar ve tavşanlarda embriyo-fötal gelişim üzerine majör etkileri yoktur. TELZİR ile yapılan klinik çalışmalardaki hastaların maruziyetine kıyasla, bu çalışmalarda amprenavirin sistemik plazma maruziyeti (EAA) yakın (sıçanlarda) veya düşüktür (tavşanlarda). Tavşanlardaki düşük maruziyet dikkate alındığında TELZİR'in potansiyel gelişimsel toksisitesi tam olarak tespit edilmemiştir.TELZİR gebelik sırasında ancak potansiyel faydalar, fötusa yönelik olası riskten fazla ise kullanılmalıdır. Laktasyon dönemiHIV virüsünün anne sütüne geçme olasılığı nedeniyle çocukların emzirilmesi kontrendikedir.4.7 Araç ve makine kullanımı Üzerindeki etkilerTek başma ya da ritonavirle kombinasyon halindeki TELZİR'in araba ve makine kullanma üzerindeki etkisine ilişkin herhangi bir çalışma gerçekleştirilmemiştir. Bununla birlikte, TELZİR sersemlik, baş dönmesi ve yorgunluk gibi istenmeyen etkilere neden olabileceğinden beceri gerektiren işler yapılırken dikkatli olunmalıdır.4.8 İstenmeyen etkilerRitonavirle kombinasyon halindeki TELZİR'in güvenliliği, çeşitli başka antiretroviral ilaçlarla kombinasyon halinde, yetişkinler üzerinde (n=534) kontrollü klinik çalışmalarda incelenmiştir. En sık bildirilen istenmeyen etkiler (tedavi edilen yetişkinlerin >%5'inde) gastrointestinal olaylar (bulantı, ishal, karın ağrısı ve kusma) ve baş ağrısıdır. TELZİR / ritonavir kombinasyon tedavilerinde istenmeyen etkilerin çoğu hafif ile orta derece arası şiddete sahip, erken başlangıçlı ve nadiren tedaviyi kısıtlayıcı niteliktedir. Bu olayların çoğunda, bu etkilerin TELZİR / ritonavir kombinasyonuna mı, HIV enfeksiyonunun tedavisinde birlikte kullanılan tedavilere mi, yoksa hastalık sürecine mi bağlı oldukları açık değildir.Advers olaylar MedDRA sistemine, organ sınıfına göre sıralanmıştır. Sıklık sınıflandırması aşağıdaki gibidir: Çok yaygın >1/10, Yaygın >1/100 ve <1/10, Yaygın olmayan >1.000 ve <1/100, Seyrek >1/10.000 ve <1/1.000, Çok seyrek <1/10.000, Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Aşağıda sıralanan istenmeyen etkilerin büyük çoğunluğu erişkinlerle yapılan iki büyük çaplı klinik çalışmadan elde edilmiştir. Çalışma ilaçlarıyla ilişkili olarak en sık görülen, en az orta şiddette olan (derece 2 ve üstü) ve fosamprenavir/ritonavir kombinasyonlarıyla tedavi edilen hastaların en az %2'sinde görülen istenmeyen etkiler dahil edilmiştir. Metabolizma ve beslenme hastalıklarıÇok yaygın: Hiperkolesterolemi Yaygm: HipertrigliseridemiSinir sistemi hastalıklarıYaygm: Baş ağrısı, oral parestezi, sersemlik haliKardiyak hastalıklarıYaygm olmayan: Miyokard enfarktüsüGastrointestinal hastalıktanYaygm: İshal, bulantı, kusmaDeri ve deri altı doku hastalıklarıYaygm: DöküntüSeyrek: Stevens Johnson sendromu Yaygm olmayan: Anjiyoödem Tedavi sırasında pruritle birlikte veya pruritsiz eritematöz veya makülopapular kütanöz erupsiyonlar görülebilir. Genellikle deri döküntüsü fosamprenavir/ritonavir kombinasyonu tedavisinin kesilmesine gerek kalmaksızın spontane olarak iyileşmektedir. Şiddetli deri döküntüsü veya sistemik veya mukozal belirtilerin eşlik ettiği hafif ila orta şiddetli deri döküntüsü halinde Fosamprenavir/ritonavir tedavisine kesinlikle son verilmelidir, (bkz. Özel kullanım uyarılan ve önlemleri) Böbrek ve idrar hastalıklarıYaygm olmayan: Böbrek taşıGenel bozukluklar ve uygulama bölgesine ilişkili hastalıklarıYaygm: Yorgunluk, halsizlikPediyatrik hastalar: Fosamprenavir ile ritonavirin pediyatrik hastalardaki güvenlilik profili, yaşlan 2 ila 18 arasında değişen, fosamprenavir ile ritonavir alan ve daha önce nükleozid revers transkriptaz inhibitör tedavisi görmüş HIV-1 ile enfekte 158 hasta üzerinde gerçekleştirilen iki çalışmadan (APV29005 ve APV20003) elde edilen birleştirilmiş güvenlilik verileri ve 4 hafta ila <2 yaş arasında, fosamprenavir ile ritonavir alan ve daha önce nükleozid revers transkriptaz inhibitör tedavisi görmüş (bunlann 5 tanesi, ritonavir ile birlikte veya ritonavir olmadan, yalmzca tek doz fosamprenavir almıştır) HIV-1 ile enfekte 59 hasta üzerinde gerçekleştirilen üçüncü bir çalışmadan (APV20002) elde edilen güvenlilik verilerine dayanmaktadır (bkz. Klinik çalışmalar). Çocuklarda düşük dozda ritonavir olmadan fosamprenavirin güvenlilik profili, APV29005 çalışmasındaki yaşlan 2 ila 6 sırasında değişen 20 hastayı içeren bir gruba dayanmaktadır. Genel olarak, pediyatrik hastalarda ritonavir ile birlikte veya ritonavir olmadan fosamprenavirin güvenlilik profilinin, erişkinlere ilişkin klinik çalışmalarda gözlemlenen profile benzer olduğu görülmüştür. Başta tek başına fosamprenavir alan hastalarda olmak üzere, pediyatrik hastalar arasında kusma daha sık gözlemlenmiştir. Çoğu vakanın hafif şiddetli olduğu ancak kusmanın az sayıda hastada fosamprenavir tedavisinin kesilmesine neden olduğu görülmüştür. Bazı hastalarda, bir proteaz inhibitörü içeren anti-retroviral rejim ile subkutanöz periferik yağlarda azalmayı da kapsayan yağın yeniden dağılımı, intra-abdominal yağ düzeyinde artış, meme hipertrofisi ve retroservikal yağ (buffalo hörgücü) birikimine ilişkin vakalar bildirilmiştir. Proteaz inhibitörleri içeren rejimlerde hipertrigliseridemi, hiperkolesterolemi, insülin direnci ve hipergliseminin de aralannda bulunduğu bazı metabolik anomaliler de bildirilmiştir, (bkz. Özel kullanım uyarıları ve önlemleri)Antiretroviral proteaz inhibitörleri alan hastalarda yeni başlayan diabetes mellitus, hiperglisemi veya mevcut diabetes mellitus'un alevlenmesi bildirilmiştir, (bkz. Özel kullanım uyarıları ve önlemleri)Özellikle nükleozid analoglan ile ilişkili olarak, proteaz inhibitörleri ile CPK artışı, miyalji, miyozit ve seyrek vakalarda rabdomiyoliz, bildirilmiştir. Antiretroviral proteaz inhibitörleri alan hemofili hastalarında, spontan kanamalarda artış bildirilmiştir, (bkz. Özel kullanım uyarıları ve önlemleri)Genel olarak, fosamprenavir tedavisi ile ilişkili olan, tedavi sırasmda beklenebilecek klinik olarak anlamlı laboratuar anomalileri transaminaz ve lipaz düzeylerinde artış, hipertrigliseridemi ve hiperkolesterolemidir. Antiretroviral proteaz inhibitörleri kullanan hemofilik hastalarda kendiliğinden (spontan) kanama olgularında artış bildirilmiştir (bkz.Özel kullanım uyarlan ve önlemleri).4.9 Doz aşımı ve tedavisiTELZİR için bilinen bir antidot mevcut değildir. Amprenavirin periton diyalizi ya da hemoliz yoluyla uzaklaştınlıp uzaklaştınlamayacağı bilinmemektedir(bkz.(bkz.İstenmeyen etkiler) ve gerekirse standart destek tedavisi uygulanmalıdır.5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Proteaz inhibitörleri ATC kodu: J05A E07Fosamprenavir kalsiyum amprenavirin ön ilacıdır. Amprenavirin fosfat esterinin mono kalsiyum tuzudur ve inorganik fosfat ile bağırsak epitelinden emilen aktif metabolit şekli amprenavire hidrolize olur. Amprenavir HIV proteazmm yarışmalı bir inhibitörüdür. Viral proteazm viral replikasyon için gerekli olan öncü poliproteinlerine bağlanmasını bloke etmektedir. Fosamprenavirin in vitroortamda antiviral aktivitesinin ya da enzim inhibisyon özelliklerinin hiç olmadığı veya olduğu çok az gösterilmiştir. Bu çalışmalarda frosamprenavir ile gözlenen inhibisyon etkisi eser miktardaki amprenavire bağlanmaktadır.Etki mekanizmasıFosamprenavirin aktif kısmı olan amprenaviri oluşturabilmesi için in vivolmasıIn vivoin vitroamprenavir kullanılarak gerçekleştirilir. Amprenavir HIV proteazm yanşmalı inhibitörüdür.Viral proteazın viral replikasyon için gerekli olan öncü poliproteinlere aynlma kabiliyetini bloke eder. Amprenavir in vitroin vitroortamda sineıjik etki gösterdiği gözlenmiştir. Indinavir, ritonavir ve nelfinavir ile kombine edildiğinde aditif etkili olduğu gösterilmiştir.Ritonavirin, TELZİR (fosamprenavir/ritonavir dozu günde 2 kez 700 mg/100 mg veya günde 1 kez 1400 mg/200 mg) ile birlikte uygulandığında fosamprenavir'in (günde 2 kez 1400 mg dozunda) tek başına uygulanmasıyla elde edilen değerlere kıyasla plazma amprenavir EAA değerini yaklaşık 2 kat, plazma CT;ss'yi de 4-6 kat artırır. In vitro dirençYapılan seri pasaj çalışmaları, proteaz mutasyonu I50V'nin in vitroin vitroİn vitroin vitroIn vitroIn vitropasaj çalışmalarından elde edilen son ilave veriler proteaz mutasyonu I54M, V32I ve I47V de amprenavir tarafından seçildiğini göstermiştir.In vivo direnç: daha önce proteaz inhibitörleri almamış olan hastalarKlinik olarak amprenavirle gözlenen direnç profili diğer proteaz inhibitörlerinde gözlenenden farklıdır.in vitroin vitropasaj çalışmalarında, amprenavirin klinik kullanımı sırasında da direnç gelişimi ile sonuçlanan 3 farklı mekanizma gözlenmiştir. Tedavi sırasında amprenavire karşı direnç gelişimi I50V veya I54L/M veya V32I + I47V, daha seyrek olarak da I84V mutasyonlanm kapsayabilir. Genetik örneklerin dördüne de eşlik eden sekonder mutasyonlar olabilir, özellikle M46I/L, ve amprenavire olan duyarlılığı azalmış olan bazılarında ritonavire karşı çapraz direnç olan fakat indinavir, nelfinavir ve sakinavire olan duyarlılığı değişmemiş virüsler oluşturur.Aşağıdaki tablo, amprenavir ile tedavi edilen hastalarda amprenavire karşı gelişen düşük fenotipik duyarlılıkla ilişkili mutasyonlan özetlemektedir. Amprenaviriçeren tedavide edinilen, amprenavire olan fenotipik duyarlılığın azaldığım gösteren proteaz mutasyonlanFosamprenavir ve ritonavirin birlikte uygulanmasını takiben amprenavirin farmakokinetik özellikleri sağlıklı erişkin bireylerde ve HIV-enfeksiyonlu hastalarda değerlendirilmiş ve bu iki grup arasında önemli bir farka rastlanmamıştır. İlacın alimim kolaylaştırmak ve tedavi uyuncuna yardımcı olmak amacıyla, TELZİR oral süspansiyonun çocuklarda ve adolesanlarda yemeklerle birlikte alınması önerilir. Bu popülasyona yönelik doz önerilerinde TELZİR oral süspansiyonun yemeklerle birlikte alındığı pediyatrik çalışmalar esas alınmış, dolayısıyla gözlenen gıda etkisi de dikkate alınmıştır (bkz. Pozoloji ve uygulama şekli).Emilim:Günde bir kez 1400 mg fosamprenavir ve günde bir kez ritonavir 200 mg'm çoklu doz oral uygulamasını takiben amprenavir, doz uygulamasından yaklaşık 2 (0.8-5.0) (tmamaksimum(Cm1.45 (1.16-1.81) mikrogram/ml ve EAA24,SS 69.4 (59.7-80.8) saat.mikrogram/ml olarak bulunmuştur.Günde iki kez fosamprenavir 700 mg ve günde iki kez ritonavir 100 mg'm çoklu doz oral uygulamasını takiben amprenavir, doz uygulamasından yaklaşık 1.5 (0.75-5.0) (tmamaksimumplazma amprenavir konsantrasyonuyla hızlı bir şekilde emilmektedir. Kararlı durum plazma amprenavir çukur konsantrasyonunun geometrik ortalaması (Cmjn) 2.12 (1.77-2.54) mikrogram /mİ ve EAA24,Ss 79.2 (69.0-90.6) saatmikrogram /mİ olarak bulunmuştur.Fosamprenavir tablet ve oral süspansiyon formülasyonlannın her ikisi de aç kanuna verilerek, dengeli plazma amprenavir EAAx> değeri sağlanır ve Fosamprenavir oral süspansiyon formülasyonu, oral tablet formülasyonuna kıyasla % 14 daha fazla plazma amprenavir CmakS'ı sağlar. Fosamprenavirin insanlardaki mutlak biyoyararlanımı belirlenmemiştir. Fosamprenavir oral tablet formunun (1400 mg) açlık durumunda alınmasına kıyasla, yağ oram yüksek bir yiyecekle birlikte alınması plazma amprenavir farmakokinetiğini değiştirmemiştir. TELZİR aç veya tok kamına alınabilir. Dağılım:Fosamprenavir uygulamasını takiben amprenavirin görünür dağılım hacmi yaklaşık 430 litredir (70 kg vücut ağırlığı varsayımıyla 6 l/kg) ve bu da amprenavirin sistemik dolaşımın ötesinde dokulara serbest bir şekilde nüfuz etmesiyle büyük bir dağılım hacmi olduğunu göstermektedir. TELZİR ritonavirle birlikte uygulandığında, büyük bir olasılıkla amprenavir biyoyararlanımındaki artışa bağlı olarak yaklaşık %40 oranında azalmaktadır. Amprenavir yaklaşık %90 oranında proteine bağlanmaktadır. Alfaı asit glikoprotein (AAG) ve albümine bağlanmakla birlikte AAG için daha yüksek bir afiniteye sahiptir. Bivotransformasvon:Fosamprenavir ağızdan alimim takiben bağırsak epitelinden emilirken hızlı bir şekilde ve neredeyse tamamen amprenavir ve organik olmayan fosfata hidrolize olmaktadır. Amprenavir ağırlıklıolarak karaciğer tarafından metabolize edilmekte ve %1'den küçük bir bölümü değişmeden idrar yoluyla atılmaktadır. Öncelikli metabolizma yolu sitokrom P450 3A4 enzimi üzerindendir. Amprenavir metabolizması, CYP3A4'ün baskılanması üzerinden ritonavir tarafından inhibe edilmekte ve bunun neticesinde amprenavirin plazma konsantrasyonlarıartmaktadır. Amprenavir'in yaptığı CYP3A4 inhibisyonu daha zayıftır. Bu nedenden ötürü CYP3A4 indükleyicileri, inhibitörleri ya da substratlan olan ilaçlann, TELZİR ve ritonavirle birlikte uygulandıklannda dikkatli bir şekilde kullanılmaları gerekmektedir (bkz.Kontrendikasyonlar ve Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Eliminasvon:Fosamprenavir'in uygulanmasını takiben amprenavirin yanlanma ömrü 7.7 saattir. Amprenavirin p lazmayanlanma ömrü, ritonavirle birlikte uygulandığında artmaktadır. Amprenavirin öncelikli eliminasyon yolu karaciğer metabolizması üzerindendir ve %1'den az bir kısmı değişmeden idrar yoluyla atılmaktadır. Metabolitler ve değişmemiş amprenavir, uygulanan amprenavir dozunun idrarda yaklaşık %14'ünü ve dışkıda yaklaşık %75'ini teşkil etmektedir.Pediyatrik hastalar APV20002 ve APV29005 sayılı pediyatrik çalışmalara 163 kişi katılmıştır. Doğrulanmış virolojik başansızlık görülen 20 kişinin 5'inde ilaç duyarlılığında tedavi kaynaklı azalma tespit edilmiştir. 5 kişinin tamamı fosamprenavir/ritonavir almıştır ve bunlann 4'ü daha önce tedavi görmüştür. Beş kişinin 3'ünden alınan virüste amprenavire karşı azalan duyarlılık gözlenirken 5 kişinin 2'sinde ise NRTI'lara karşı edinilmiş azalan duyarlılık saptanmıştır. Başlangıçtaki virolojik başansızlıkta, iki kişide amprenavir direnci ile ilişkili viral mutasyonlar görülmüştür. Farmakokinetik EtkiTablo 1. Erişkinlerde geometrik ortalama (%95 Güven Aralığı (CI)) kararlı durum plazma amprenavir farmakokinetik parametreleri |
İlaç BilgileriTelzir 700mg Film TabletEtken Maddesi: Fosamprenavir Atc Kodu: J05AE07 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||
|
Rejim |
Cmaks (mikrogram/ mL) |
Tmaks^ (saat) |
AUC24(mikrogram*sa/mL) |
Cmin (mikrogram/ mL) |
|
Günde iki kez 1400 mg fosamprenavir |
4,82 (4,06-5,72) |
1,3 (0,8-4,0) |
33,0 (27,6-39,2) |
0,35 (0,27-0,46) |
|
Günde bir kez 1400 mg fosamprenavir + günde bir kez 200 mg ritonavir |
7,24 (6,32-8,28) |
2,1 (0,8-5,0) |
69,4 (59,7-80,8) |
1,45 (1,16-1,81) |
|
Günde bir kez 1400 mg fosamprenavir + günde bir kez 100 mg ritonavir |
7,93 (7,25-8,68) |
1,5 (0,75-5,0) |
66,4 (61,1-72,1) |
0,86 (0,74-1,01) |
|
Günde iki kez 700 mg fosamprenavir + günde bir kez 100 mg ritonavir |
6,08 (5,38-6,86) |
1,5 (0,75-5,0) |
79,2 (69,0-90,6) |
2,12 (1,77-2,54) |
|
Gösterilen veriler ortanca değ |
^erlerdir (aralık). | |||
Hastalardaki karakteristik özelikler
Gerivatrik hastalar:
Ritonavirle kombinasyon halinde fosamprenavirin farmakokinetiği 65 yaşın üzerindeki hastalarda
araştırılmamıştır.fonksiyon
bozukluklan, eşzamanlı hastalık ya da başka ilaç tedavileri dikkate alınmalıdır.Böbrek bozukluihı:
Böbrek bozukluğu olan hastalar özel olarak araştırılmamıştır. Amprenavirin ve ritonavirin eliminasyonunda böbrekler öncelikli yol değildir. Ritonavirin de böbrekten eliminasyonu ihmal edilebilir düzeydedir; bu nedenden ötürü böbrek bozukluğunun amprenavir ve ritonavir e
liminas
yonu üzerindeki etkisinin asgari düzeyde olması beklenir, dolayısıyla böbrek bozukluğunda TELZİR / ritonavir kombinasyonu için doz ayarlaması gerekli bulunmamıştır.Karaciğer bozukluğu:
Fosamprenavir insanlarda amprenavire dönüştürülmektedir. Amprenavir ve ritonavirin temel eliminasyon yolu karaciğer metabolizmasıdır.
Plazma amprenavir farmakokinetiği bir tekrarlı doz çalışmasında karaciğer yetmezliği olan ve fosamprenavir ile birlikte ritonavir alan HIV-1 enfeksiyonlu hastalarda normal karaciğer fonksiyonlarına sahip eş kontrol gönüllülerine kıyasla değerlendirilmiştir.
Hafif karaciğer yetmezliği (Child-Pugh skoru 5-6) olan gönüllülerde standart fosamprenavir + ritonavir 700 mg / 100 mg günde iki kez dozunu alan ve karaciğer fonksiyonları normal olan gönüllülere kıyasla daha yüksek plazma amprenavir
Cmaamprenavir
EAA değeri (%22) ve benzer Ct değerleri baz alındığında günde iki kez fosamprenavir 700 mg dozu ve azaltılmış sıklıkla verilen günde bir kez 100 mg ritonavir dozu önerilmektedir.Orta dereceli karaciğer yetmezliği olan (Child-Pugh skoru 7-9) gönüllülerde günde iki kez
Fosamprenavir
450 mg şeklindeki azaltılmış doz ve azaltılmış sıklıkla verilen günde bir kez 100 mg ritonavir dozu önerilmektedir. Her ne kadar fosamprenavir 450 mg günde iki kez + ritonavir 100 mg günde bir kez dozunun %35 daha düşük plazma total amprenavir Ct değerlerine neden olacağı tahmin edilse de, plazmaya bağlanmayan amprenavir Ct değerlerinin standart fosamprenavir + ritonavir 700 mg /100 mg günde iki kez dozunu alan ve karaciğer fonksiyonları normal olan gönüllülerde elde edilen verilere kıyasla yaklaşık %67 daha yüksek olacağı tahmin edilmektedir.Orta derecede karaciğer yetmezliği olan gönüllülerde fosamprenavir 700 mg günde bir kez + ritonavir 100 mg günde bir kez rejimi standart fosamprenavir + ritonavir 700 mg /100 mg günde iki kez dozunu alan ve karaciğer fonksiyonları normal olan gönüllülere kıyasla %24 daha düşük p
lazmaplazmaya bağlanmayan Ct
değerine neden olmuştur. Dolayısıyla orta dereceli karaciğer yetmezliği olan hastalarda fosamprenavir tablet rejimi fosamprenavir + ritonavir 700 mg / 100 mg günde iki kez dozunu alan ve karaciğer fonksiyonları normal olan gönüllülere benzer plazma amprenavir farmakokinetiğinin elde edilmesini sağlayamamıştır.Şiddetli karaciğer yetmezliği olan (Child-Pugh skoru 10-13) gönüllülerde günde iki kez
azaltılmışCmabağlanmamışplazmaCmaCaV
değeri ve %38 daha yüksek ritonavir Ct değeri gözlenmiştir.Alternatif olarak, ağır karaciğer yetmezliği olan erişkinlerde (Child-Pugh skoru: 10-15) fosamprenavir dikkatli şekilde uygulanmalı ve ritonavir olmadan günde iki kez 350 mg'lık düşük fosamprenavir dozu kullanılmalıdır.
Ağır karaciğer yetmezliği olan hastalarda dozun azaltılması için fosamprenavir oral süspansiyon kullanılmalıdır.
Klinik çalışmalar:
Daha önce antiretroviral almamış hastalarda, 48 haftalık çalışmada bir gruba abakavir ve lamivudin içeren rejimin (günde 2 kez) bir bölümü olarak düşük dozda ritonavir ile kombine edilerek günde 1 kez verilen TELZİR, diğer gruba abakavir/lamivudin ile kombine edilerek nelfinavir verilmiş ve benzer etkinlik bulunmuştur. ITT (Rebound veya Kesme = başarısızlık (RD=F)) analizlerinin, 48. haftasında, nelfinavir alan hastaların % 68'ine (her protokol analizi için %91) kıyasla TELZİR/ritonavir alan hastaların %69'unun (protokol başına analizlerin %95) plazma HIV-1 RNA'lan 400 kopya/ml'nin altındadır. Viral yükleri <400 kopya/ml olan
hastalar
ın büyük çoğunluğunun viral yükleri 50 kopya/ml'ye de inmiştir. Bu oran TELZİR /ritonavir alan grubun % 55'ine karşılık nelfinavir alan grupta % 53'tür. Bütün analizlerde, HIV-1 RNA'nın 48. haftada 400 kopya/ml'nin altında olması temel alınırsa fosamprenavir /ritonavir rejimi nelfinavirden aşağı değildir.TELZİR/ritonavir ile tedavi gören gruba (%4) kıyasla, virolojik yanıtsızlık nedeniyle erken safhalarda tedavisi kesilen hastaların sayısı nelfinavir grubunda (%15) belirgin olarak daha fazladır. Daha sonraki grupta bulunan yanıtsız hastalarda amprenavir veya ritonavire karşı direnç gelişimi de dahil primer veya sekonder proteaz direnci mutasyonlannın herhangi birinin varlığının kanıtı yoktur. Bu durum primer veya sekonder proteaz mutasyonu insidansı yüksek (%56) olan nelfinavir grubu ile terstir.
Birlikte uygulanan NRTI'ye (abakavir, lamivudin) karşı gelişen direnç ile ilişkili mutasyonlann edinilme sıklığı TELZİR/ritonavir ile tedavi edilen hastalarda düşüktür ve nelfinavir ile tedavi edilenlerde belirgin olarak daha sıktır (sırasıyla 4/32 (%13) ve 31/54 (%57) (p<0.001)).
Direnç gelişmemesi ve diğer PFlere karşı herhangi bir çapraz direncin olmaması, TELZİR/ritonavir içeren tedaviye yanıtsızlığm PI içeren diğer bir tedavi şeklinin duyarlılığına veya yanıtına etkisi olmadığım göstermektedir.
Daha önce proteaz inhibitörü almış hastalarda günde 1 kez (1400mg/200mg) veya günde 2 kez TELZİR (700mg/100mg) düşük dozlarda ritonavir ile verilmiş ve 24. haftada lopinavir/ritonavirin sabit doz kombinasyonuna (günde 2 kez 400mg/100mg) kıyasla eşit etkinliğe sahip olduğu gösterilmiştir. İki tedavi grubu da aktif ters transkriptaz inhibitörleri almıştır. Bu çalışmadaki tüm
h
astalar önceden proteaz inhibitörü almış ve tedavileri başarısız olmuştur.Her tedavi grubunda viral baskılama izlenmiştir. Bu baskılamada 24 haftalık çalışma dönemi boyunca plazma HIV-1 RNA viral yükü için ortalama eğrinin altında kalan alan eksi başlangıç durumu şeklinde ölçüldü (OEAAEB) ölçüldü. OEAAEB yanıtlarına göre TELZİR/ritonavir rejimlerinin ikisi de lopinavir/ritonavir rejiminden daha aşağı değildir, ortalama değerler günde 1 kez TELZİR/ritonavir için (logıo kopya/ml) -1.48, günde 2 kez TELZİR/ritonavir için -1.50 ve lopinavir/ritonavir için de -1.66'dır.
Pediyatrik hastalar:
Pediatrik hastalarda ritonavirle birlikte fosamprenavirin güvenliliği, ritonavirle birlikte fosamprenavir ve zeminde nükleozid revers transkriptaz inhihibitör tedavisi alan, HIV-1 ile enfekte olmuş, 2 ila 18 yaş arası 158 deneği kapsayan iki çalışmadan (APV29005 [Hafta 24 verileri] ve APV20003 [nihai veriler, Hafta 168]) ve ritonavirle birlikte fosamprenavir ve başlangıç noktasında nükleozid revers transkriptaz inhihibitör tedavisi alan HIV-1 ile enfekte olmuş 4 hafta ila <2 yaş arası 59 deneği ( bunlardan 5'i ritonavir ile ya da ritonavir olmadan yalnızca tek doz fosamprenavir olmışlardır) içeren 3. bir çalışmadan edinilen birleşik güvenlik verilerine
dayanmaktadırhastalık
bir kohorta dayanmaktadır. APV29005 ve APV20002 çalışmalarının 48. hafta verileri yeni güvenlik endişeleri gündeme getirmemiştir.Genelde beraberinde ritonavir olsun ya da olmasın fosamprenavirin pediatrik hastalardaki güvenlik profili erişkinlerde yapılan klinik çalışmalardaki güvenliliği ile karşılaştırılabilir.
Kusma pediatrik hastalarda özellikle de fosamprenaviri tek başma alanlarda daha sık gözlenmiştir. Çoğu olgu hafiftir ancak az sayıda hastada kusma fosamprenavir tedavisinin sonlandınlmasına neden olmaktadır.
5.3 Klinik öncesi gfivenlilik verileri
Uzun dönem karsinojenite çalışmalarında fosamprenavir 104 haftaya kadar, oral yolla 250, 400 veya 600 mg/kg/gün dozunda farelere ve 300, 825 veya 2250 mg/kg/gün dozunda da sıçanlara uygulanmıştır. Bu dozlardaki maruziyet, günde 1 kez 1.400 mg TELZİR + günde 1 kez 200 mg ritonavir verilen insanlarda gözlenen maruziyetin 0.2 - 0.3 katı (fare) ve 0.3 - 0.7 katıdır (sıçan). Bu karsinojenite çalışmalarında maruziyet, günde 2 kez 700 mg TELZİR + günde 2 kez 100 mg ritonavir verilen insanlarda gözlenen maruziyetin 0.1 - 0.3 katı (fare) ve 0.3 - 0.6 katıdır (sıçan). Erkek farelerde tüm dozlarda hepatoselüler adenomlar ve hepatoselüler karsinomlarda artış, erkeksıçanlardaklinikçalışmalardankullanımından
bu bulguların klinik anlam taşıyıp taşımadığını gösteren kanıtlar elde edilememiştir.Yapılan
in vitroin vivo
seri analizlere göre fosamprenavir mutajenik veya genotoksik değildir. Bu analizler, bakteriyel ters mutasyon (Ames), fare lenfoma, sıçan mikronükleus ve insan lenfositlerinde kromozom aberasyon testini içerir.Preklinik toksisite çalışmalarında, fosamprenavir hayvanlarda gastrointestinal intolerans ve karaciğerde de hedef organ toksisitesine yol açar. Köpekte fosamprenavirin tüm tekrar dozları boyunca tükürük salgısı, kusma ve fekal değişim (yumuşak-sulu dışkı) meydana gelirken, birçok hayvanda dehidratasyon ve elektrolit kaybına neden olur. Karaciğer toksisitesi sıçan ve köpeklerin her ikisinde de görülür ve karaciğer ile ilişkili serum enzimlerinde, karaciğer
ağırlığında ve hepatosit nekrozunu içeren mikroskobik bulgulardaki artışa bağlı meydana gelir. Söz konusu karaciğer toksisitesi AST, ALT ve alkalen fosfataz aktivitesi gibi serum kimyasal testleri yapılan hastalarda takip ve tespit edilebilir. Bununla birlikte insanlarda karaciğer etkileri genellikle hastalar aynı zamanda Hepatit B ve/veya C ile koenfeksiyona bağlanmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1 Yardımcı maddelerin listesi
Hipromeloz, titanyum dioksit (El71), triasetin, kırmızı demir oksit (E 172), mikrokristalize selüloz, kroskarmeloz sodyum, povidon K30, magnezyum stearat, kolloidal silikon dioksit.6.2 Geçimsizlikler
Geçerli değildir.6.3 Raf ömrü
36 ay6.4 Saklamaya yönelik özel tedbirler
30 °C'nin altındaki oda sıcaklığında saklanmalıdır.6.5 Ambalajm niteliği ve içeriği
60 x 700 miligram film kaplı tablet, çocuk emniyet kapağı olan, Yüksek Dansiteli Polietilen (HDPE) şişelerde bulunur.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
KullanılmamışAmbalaj
ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ
GlaxoSmithKline İlaçlan San. ve Tic. A.Ş.
Adı:
Adresi:
Tel. no: Fax. no:
Adresi:
Tel. no: Fax. no:
Büyükdere Cad. No.173, l.Levent Plaza B Blok 34394 1.Levent/İstanbul 212-339 44 00 212-339 45 00
8. RUHSAT NUMARASI
11.05.2006-120/039. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
11.05.200610. KÜB'ÜN YENİLENME TARİHİ
23Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.