Nevakson 500 mg i.v. enjektabl toz içeren flakon Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Antibakteriyel (Antibiyotik) İlaçlar » Diğer BetaLaktam Antibakteriyeller » 3. Kuşak Sefalosporinler » Seftriakson KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADINEVAKSON 500 mg i.v. enjektabl toz içeren flakon 2. ^ ^^TİTATİF BİLEŞİM Etkin madde: Her flakon 500 mg seftriaksona eşdeğer sefitriakson sodyum içerir. Yardımcı madde:Yardımcı madde bulunmamaktadır.Yardımcı maddeler için 6.1 'e bakınız. 3. FARMASÖTİK FORM Enjeksiyonluk çözelti tozu Beyaz ila sanmsı renkli, kristalize toz 4. ^^LLİKLER 4.1. Terapötik endikasyonlar NEVAKSON'a duyarii patojenlerin neden olduğu enfeksiyonlar: - Sepsis, - Menenjit, - Dissemine Lyme borreliosis'i (hast^^n erken ve geç evreleri), - Abdominal enfeksiyonlar (peritonit, safra ve gastrointestinal sistem enfeksiyonlan), - Kemik, eklem, yummak doku, cilt ve yara enfeksiyonlan, - İmmün sistem bozukluğuna b^lı enfeksiyonlar, - Böbrek ve idrar yollan enfeksiyonlan, - Solunum yollan enfeksiyonlan, özellikle pnömoni, kulak-burun-b^az enfeksiyonlan, akut bakteriyel komplike olmayan otitis media, - Gonore dahil olmak üzere genital enfeksiyonlar, - Preoperatif enfeksiyon profilaksisi. 4.2. Pozoloji ve uygulama şekli Pozoloji/ ^^^^^^^^ıklığı ve süresi:Doktor tarafından başka şekilde tavsiye edilmed^i takdirde; Standart doz Yet^kinler ve 12 çocuklar: Normal olarak günde tek doz 1-2 g (24 saatte bir) NEVAKSON'dur. ^^alarda veya orta derecede duyarlı organizmalann neden olduğu enfeksiyonlarda günde tek doz, 4 g'a çıkabilir. Tedavi süresi: Tedavi süresi hastalığın seyrine göre değişir. Genellikle bütün antibiyotik tedavilerinde old^^ Ustanın ateşi d^tükten veya bakteriyel eradikasyon sonra en az48-72 saat NEVAKSON tedavisine devam edilmelidir. Kombine tedavi: Deneysel k^ullar, birçok gram^^^^^^^^ ^^rnlere karşı NEVAKSON ile aminoglikozidler arasında sineıji olduğunu göstermektedir. Bu tür kombinasyonlarda aktivite artışı her zaman kesin olmasa da, Pseudomonas aeruginosa gibi patojenlerin neden olduğu ciddi ve hayatı tehdit eden enfeksiyonlarda NEVAKSON ile aminoglikozidler kombine edilebilinir. Ancak bu iki ilaç, aralanndaki fiziksel geçimsizlik nedeniyle önerilen dozlarda ayn ayn uygulanmalıdır. Menenjit: Bebek ve çocuklardaki bakteriyel menenjitte tedaviye günde tek doz 100 mg/kg (4 g ^^^anizmalar belirlenip duyarlılık testleri yapıldıktan sonra, iyi tedavi sonuçlan aş^^^^^ tedavi sürelerinde elde edilm^tir: Neisseria meningitidis: 4 gün Haemophilus influenzae: 6 gün Streptococcus pneumoniae: 7 gün Lyme borreliosis: Çocuk ve yet^kinlerde, 14 gün boyunca günde tek doz olarak 50 mg/kg ile en fazla 2 g arasında uygulanır. Gonore: Gonore (penisilinaz üreten ve üretmeyen s^lar) tedavisinde i.m. olarak 250 mg tek doz NEVAKSON önerilir. Preoperatif profilaksi: Enfeksiyon riskine b^^^^ ^^rasyondan 30-90 dakika önce 1-2 g^^^^ ^ doz NEVAKSON uygulaması önerilir. Kolorektal cerrahide, NEVAKSON'un tek ^midazol gibi ^^inin birlikte (ayrı ayn verilerek) uygulanmasının etkili olduğu kanıtlanmıştır. Uygulama şekli: NEVAKSON çözeltisi kullanılmalıdır. İntravenöz enjeksiyon: IV enjeksiyon için, NEVAKSON 500 mg 5 ml, NEVAKSON 1 g ise 10 ml steril enjeksiyonluk suda çözünür. İntravenöz uygulama 2-4 dakika içinde gerçekl^tirilmelidir. İntravenöz infüzyon: İnfüzyon en az 30 dakika süreyle verilmelidir. İntravenöz infüzyon için, 2 g NEVAKSON çözeltilerden birinde 40 ml'de çözülür: Sodyum klorür %0.9, Sodyum klorür %0.45 + dekstroz %2.5, dekstroz %5, dekstroz %10, dekstran %6, %5 dekstroz içinde, hidroksi etil n^asta %6-10, enjeksiyonluk su. NEVAKSON çözeltileri muhtemel geçimsizliklerden dolayı diğer antimikrobiyal ilaçlan içeren çözeltilerle veya yukanda listenenlerden farklı çözücülerle kanştınimamalıdır. Çökelti ol^abilec^inden; NEVAKSON flakonlan sulandırmak veya sulandmlmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içeren çözücüler kullanmayınız. Aynca, NEVAKSON aynı IV uygulama hattında kalsiyum içeren çözeltilerle kanştmldığmda da seftriakson-kalsiyum çökeltisi meydana gelebilir. NEVAKSON bir Y-bölgesinden parenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmak üzere ^ zamanlı olarak kalsiyum içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak, neonatlar dışındaki hastaliirda, NEVAKSON ve kalsiyum içeren çözeltiler infiiizyonlar arasında infüzyon hatlarmın uygun bir sıvıyla çok iyi yıkanması şartı ile, birbirinin ardından sıralı olarak uygulanabilir. Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karac^er yetmezimi: Sadece böbrek fonksiyon bozukluğu olan, karac^er fonksiyonları normal hastalarda NEVAKSON dozunu azaltmaya gerek yoktur. Ancak preterminal safhada böbrek yetmezl^i olanlarda (kreatinin klerensi <10 ml/dakika) NEVAKSON dozu günde 2 g^^ ^aciğer haşan olan, böbrek fonksiyonlan normal hastalarda NEVAKSON dozunu azaltmaya gerek yoktur. Ciddi böbrek ve karac^^^^ bir arada görüldüğü vakalarda, seftriakson plazma konsantrasyonlan düzenli olarak kontrol edilmeli ve gerekt^inde doz ayarlaması yapılmalıdır. Diyalize alınan hastalara diyaliz sonrasında supleman olarak ilave dozlara gerek yoktur. Ancak bu hastalarda eliminasyon oranı değ^m^ olabilec^inden, doz ayarlamasının gerekli olup olmadığını belirlemek için serum konsantrasyonlan kontrol edilmelidir. Pediyatrik popülasyon: Yenid^an, bebek ve 12 çocukleırda: doz şeması günde tek dozda uygulanır. Yenid^anlar (14 günl^e kadar): Günde tek doz 20-50 mg/kg vücut günlük doz 50 mg/kg'ı aşmamahdır. Prematüre ve matür bebekler için farklı uygulama gerekli d^ildir. Seftriakson ve intravenöz kalsiyum içeren ürünlerin ^ zamanlı olarak yeni doğanlarda ^^^^^^^ontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya bu ürünleri kullanması beklenen) yeni doğanlarda NEVAKSON kullanılmamalıdır (Bkz: 4.3. Kontrendikasyonlar). Bebek ve çocuklar (15 günlükten 12 y^^^^adar): Günde tek doz 20-80 mg/kg. Vücut ^ kg veya üstünde olan normal çocuklarda normal yet^kin dozu kullanıhnahdır. Akut bakteriyel komplike olmayan otitis media tedavisi için 50 mg/kg dozunda (1g^şmamak k^uluyla) tek uygulama önerilmektedir (single-shot therapy). Geriyatrik popülasyon: Geriyatrik hastalarda, yet^^^^^^^ ^^^^n dozlar kullanılır. 4.3. Kontrendikasyonlar NEVAKSON sefalosporin sınıfı antibiyotiklere karşı aşın hassasiyeti olan hastalarda kontrendikedir. Penisiline ka^^^ ^raz aleijik reaksiyonlann görülebilec^i unutulmamahdır. Seftriakson veya ilacın içerdiği d^^^^ herhangi birine karşı aşın duyarlılığı olduğu bilinen hastalarda NEVAKSON kullanımı kontrendikedir. Hiperbilirubinemili yeni d^anlar ve prematüre yeni d^anlar seftriakson ile tedavi edilmemelidir. İn vitro çalışmalar seftriaksonun bilirubini serum albumininden ayırabildiğini ve bu hastalarda bilirubin ensefalopatisi gel^ebilec^ini gösterm^tir. Seftriakson ve intravenöz kalsiyum içeren ürünlerin ^ zamanlı olarak yenid^anlardaiçeren intravenöz ürünleri kullanan (veya bu ürünleri kullanması beklenen) yenidoğanlarda seftriakson kullanılmamalıdır.4.4. Özel kullanım uyarılan ve önlemleriD^er sefalosporinlerde olduğolduğu bilinmeyen ya da daha önceden alerjik reaksiyon geçirmeyen k^ilerde dahi ölümcül olabilen anafilaktik reaksiyonlar bildirilm^tir.NEVAKSON gibi sefalosporin sınıfı antibakteriyel ilaç kullanan çocuk ve yetişanemi olgulan gözlenmiştir.Seftriakson tedavisi sırasında anemi görülürse sefalosporine bağlı anemi tanısı gözbulundurulmalıdır ve hastalığın etyolojisi tespit edilene kadar tedavi durdurulmalıdır.^^^^^^ ^^^e (CDAD)antibakteriyel ajanlann kullanımı ile bildirilmişkolonun normal florasını değ^yol açmaktadır.C.difficile, CDAD gel ^^^^^ ^ ^ Esinlerini meydana getirmektedir.Bu enfeksiyonlar antimikrobiyal tedaviye dirençli old^^^^^ ^^^^omi yapılmasınıgerektirebild^^^an artan morbidite vemortalite^^ Mlanımmm ardından diyare görülen tümhastalarda CDAD^^^^^^biyal maddelerin uygulanmasınınardından iki aya kadar görülebildiğ^^^^^^^^ anamnez önemlidir.^ş^^^anmışoolması durumunda gerekli sıvı ve elektrolit yönetimi, protein desteğyapılmalıdır.Antibiyotik^^^^^membranöz vakaları seftriakson kullanımındabildirilm^^^^^^ ^anlı diyare görüldüğsonlandınimalıdır.Gastrointestinal bir hastalığı olanolunmalıdır. Diğuzun süre kullanılması duyarlı olmayan organizmaların(EnterococcusCandida türleri gibi) gel^mesine yol açabilir. |
|
|
Duyarlı |
Orta derecede duyarlı |
Dirençli |
Enterobacteriaceae,P. aeruginosa ve diğer |
<8 |
16-32 |
>64 |
non-Enterobacteriaceae, Staphylococcus türleri |
Disk: <13 |
Disk: 14 - 20 |
Disk: >21 |
Haemophilustürleri |
<2 Disk: >26 |
- |
- |
Neisseriatürleri |
<0.25 Disk: >35 |
- |
- |
Streptococcus pneumoniae * |
<0.5 |
1 |
>2 |
Diğer Streptococcustürleri.** |
Beta strep (Streptokok farenjiti) <0.5 Disk:>24 Viridansgrubu:<0.5 Disk: >27 |
Viridansgrubu: 1 Disk: 25-26 |
Viridansgrubu: ^ Disk: <24 |
S. Pneumoniae
sınır d^erleri (NCCLS M100-S12), non-menenjit örnekler için <1 (Duyarlı), 2 (Orta derece) ve >4 (Dirençli) olarak ve menenjit örnekleri için >0.5 (Duyarlı), 1 (Orta derece), ve> 2 (Dirençli) olarak belirlenm^tir.** 2002
Streptococcus viridans
grubu sınır değerleri (NCCLS M100-S12) <1 (Duyarlı), 2 (Orta derece), ve >4 (Dirençli) olarak belirlenm^tir.Duyarlılık testleri seftriakson diskleri ile yapılmalıdır, çünkü sefalosporin sınıfı disklerle yapıliin in vitro testlerde dirençli olduğu bilinen salara ka^ seftriaksonun etkili olduğu görülm^^^^ ^^^^ümadığı ülkelerde alternatif olarak DIN, ICS
veya d^er sta^^^ ^^^lılık testleri kullanılabilir.
5.2. Farmakokinetik özellikler Genel özellikler
Emilim:
İntramüsküler, tek doz 1 g'lık uygulamadan sonraki 2-3 saat içinde ul^an maksimum plazma konsantrasyonu 81 mg/litre'dir. Bolus intravenöz enjeksiyondan sonra ortalama pik konsantrasyonlar, 500 mg'lık dozu takiben yaklaşık olarak 120 mg/1 ve 1 gramlık dozu takiben yaklaşık olarak 200 mg/l'dir; 30 dakikalık 2 gramlık infiizyondan sonra ortalama 250mg/riık düzeyler elde edilir, %1.06'lık lidokainde 500 mg seftriaksonun intramüsküler enjeksiyonu, 1 saat içinde 40-70 mg/l'lık ortalama pik plazma konseıntrasyonlan oluşturur. İntramüsküler enjeksiyondan sonra biyoyararlanım %100'dür.D^^ım:
Seftriaksonun hacmi 7-12 litredir. Seftriakson 1-2 g^^^^ ^^^an sonraakc^er, kalp, safra yolu/karac^er, tonsillalar, orta kulak ve nazal mukoza, kemik, serebrospinal, plevra, prostat ve sinovyal sıvılarının da dahil olduğu 60^^^ ^^^de doku ve vücut sıvısında, etken patojenlerin çoğunun minimum inhibisyon konsantrasyonunun üzerinde ve 24 saatten uzun sürelerle mükemmel penetrasyon s^^^^aktadır.
İntravenöz uygulamada, seftriakson interstisyel sıvıya süratle difüze olur ve duyarlı organizmalara ka^^^ konsantrasyonlar sağlanır bakınız).
NEVAKSON'un farmakokinet^i, büyük ölçüde konsantrasyona b^^^^ ^^^ak serum albüminine ^^^n plazmada serbest (bağlı olmayan)
fraksiyonu, terapötik konsantrasyon aralığının çoğu için yakl^^ olarak %5'tir ve 300 mg/l'lik konsantrasyonlarda %15'e yükselir.
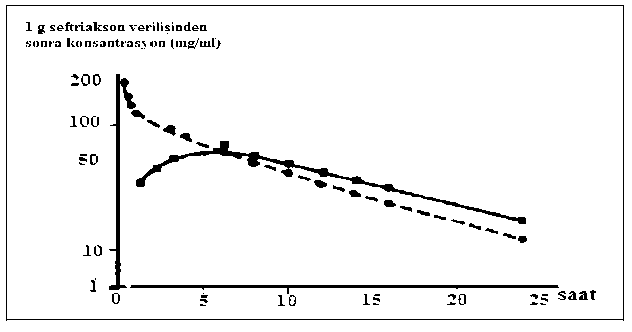 Seftriakson albümine geri dön^ümlü olarak
Seftriakson albümine geri dön^ümlü olarak oranı ilacın kandaki
konsantrasyonu yükseldikçe azalır; örneğkonsantrasyonlannda %95, 300 mg/litre'lik plazma konsantrasyonlarında ise %85^^ak interstisyel sıvıdaki serbest
seftriakson oranı plazmadakine göre daha yüksektir.
Seftriakson, yenid^an, bebek ve çocuklarda enflamasyonlu meninkslere penetre olur. Bebek ve çocuklarda 50-100 mg/kg i.v. seftriakson enjeksiyonunu izleyen 24 saat içinde,serebrospinal sıvıda seftriakson konsantrasyonu 1.4 mg/litre'nin üstündedir.sıvıda ortaİEima 18 mg/1 olan doruk konseıntrasyona i.v. enjeksiyondanşık 4 saatdüzeyleri, bakteriyel menenjitte
plazmakonsantrasyonunım %17'si, aseptik menenjitte ise %4'ü kadardır. Menenjitli50 mg/kg'lık uygulamayla 2^^^ edilen serebrospinal sıvı
konsantrasyonlan, menenjitte en sık rastlanan etken patojenlerin Mİ^
erlerinin birkaç kat üzerindedir.Seftriakson plasentadan geçer ve anne sütünde d^ük konsantrasyonlarda bulunur.
Biyotransformasyon:florası tarafından inaktif metabolitlere dönüş
türülür.Eliminasyon:^ftriaksonun %50ı
d^^^ olarak idrarla (tamamına yakını glomerüler filtrasyon ile), %40^^^^^^^^^M'la atılır.
Seftriaksonun total plazma klerensi 10^^^ Renal klerens 5^^^ ^^^akikadır.
otomasyon yantoür, doz, uygulama yolu
veya tekrarlanan uygulamalardan büyük ölçüde etkilenmez.
Doğrusallık/ doğrusal olmayan durum:Toplam ilaç konsantrasyonu bazmda eliminasyon yan-ömrü hariç, tüm temel farmakokinetik parametreler doza b^^^ıdır.
Hastalardaki karekteristik özellikler:
Y^^^^^talzır:^^leıma eliminasyon yarı ömrü genç
yet^kinlerle genellikle 2
-3 kez daha uzundur. Tüm sefalosporinlerde
olduğ^^^^^^^^mıdaki azalma, yan ömürde uzama
ya yol
açabilir. Ancak, seftriaksonla ilgili bugüne kadar toplanan bulgular, doz rejiminde
olmadığmı göstermektedir.
Yeni d^anlar:^^^ın80'i idrarla atılır. Sekiz
günlükten küçük bebekle^^^ diminasyon yaniş
kinlerle
ka^^^^^^^^^^ğında 2
-3 kez daha uzundur.
Böbrek ve karacmer yetmezlmi olan hastalar:eliminasyon yan ömrü hafif düzeyde uzar. Tek başına böbrek fonksiyonlannda bozukluk varsa seftriaksonun safra yoluyla atılımı ve tek başına karaciğer fonksiyonlannda bozukluk varsa böbrek yoluyla atılımı artar.
Beyin omurilik sıvısı:zamanlı plazma konsantrasyonunun %4
-17'si düzeyinde bir konsantrasyona ul^).
5.3. Klinik öncesi güvenlilik verileri
İnsanlarda üreme çalışmalan embriyotoksisite, fetotoksisite, teratojenisite ve
ya d^umda, perinatal ve postnatal gel^imde erkek veya d^i fertilitesinde olumsuz etkiler göstermem^tir. Primatlarda embriyotoksisite veya teratojenisite gözlenmem^tir.
6. FARMASÖTK ÖZELUKLER
6.1. Yardımcı maddelerin listesi
NEVAKSON 500 mg i.v. enjektabl toz içeren flakon herhangi bir yardımcı madde
içermemektedir.
6.2. Geçimsizlikler
NEVAKSON içeren çözeltiler d^^^^ ^^tınlmamalı veya diğ
er ajanlara
eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örn^in Ringer çözeltisi veya Hartman çözeltisi) seftriakson flakonlarmı rekonstitüe etmek için veya rekonstitüeş bir flakonu IV uygulama için daha fazla seyreltmek için kullamlmamalıdu',
çünkü çökelti
içeren çözeltiler kanştınimamalı vaynı anda
uyguleınmamalıdır.
Literatürlerde seftriaksonun amsakrin, vankomisin, flukonazol, aminoglikozidler ve labetalol ile geçimsiz olduğ
u bildirilm^tir.
6.3. Raf ömrü
24 ay.
6.4. Saklamaya yönelik özel tedbirler
25^^^^^^ sıcaklığında saklayınız. Işıktan korumak için flakonu dış
kartonun
içerisinde tutunuz.
6.5. Ambalajın niteliğ
i ve içerdi
NEVAKSON 500 mg i.v. flakon, 1 adet + 5 ml steril enjeksiyonluk su içen ampul, 1 adet.
6.6. ^an maddelerin imhası
ve d^er özel önlemler
'TıbbiAtıklarının Kontrolü
Yönetmeliklerine uygun olarak imha edilmelidir.
Kural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmahdır.
Çözeltilerin renkleri, konsantrasyon ve saklanma sürelerine b^^^^ ^k san ile bal
rengi arasında değd^toleransını etkilemez.
Intramüsküler enjeksiyon: Intramüsküler enjeksiyon için 500 mg NEVAKSON 2 ml %1'lik lidokain çözeltisinde çözülür ve derin intragluteal enjeksiyon şeklinde uygulanır.^^^^^^^^sla i.v. uygulanmamalıdır.
7. RUHSAT SAfflm Mustafa Nevzat İlaç Sanayii A.Ş.
Prof. Dr. Bülent Tarcan Sok., Pak İş Merkezi No: 5/1 34349 Gayrettepe/İstanbul
Tel: 0 (212) 337 38 00 Fax: 0 (212) 337 38 01
8. RUHSAT NUMARASI
178/53
9. İLK RUHSAT TAMffl/RUHSAT YEMLEME TAMffl
İlk ruhsat tarihi: 07.06.1996 Ruhsat yenileme tarihi: 27.06.2005
10. KÜB'ÜN YEMLENME TAMffl
Hastalardaki karekteristik özellikler:
Y^^^^^talzır:^^leıma eliminasyon yarı ömrü genç
yet^kinlerle genellikle 2
-3 kez daha uzundur. Tüm sefalosporinlerde
olduğ^^^^^^^^mıdaki azalma, yan ömürde uzama
ya yol
açabilir. Ancak, seftriaksonla ilgili bugüne kadar toplanan bulgular, doz rejiminde
olmadığmı göstermektedir.
Yeni d^anlar:^^^ın80'i idrarla atılır. Sekiz
günlükten küçük bebekle^^^ diminasyon yaniş
kinlerle
ka^^^^^^^^^^ğında 2
-3 kez daha uzundur.
Böbrek ve karacmer yetmezlmi olan hastalar:eliminasyon yan ömrü hafif düzeyde uzar. Tek başına böbrek fonksiyonlannda bozukluk varsa seftriaksonun safra yoluyla atılımı ve tek başına karaciğer fonksiyonlannda bozukluk varsa böbrek yoluyla atılımı artar.
Beyin omurilik sıvısı:zamanlı plazma konsantrasyonunun %4
-17'si düzeyinde bir konsantrasyona ul^).
5.3. Klinik öncesi güvenlilik verileri
İnsanlarda üreme çalışmalan embriyotoksisite, fetotoksisite, teratojenisite ve
ya d^umda, perinatal ve postnatal gel^imde erkek veya d^i fertilitesinde olumsuz etkiler göstermem^tir. Primatlarda embriyotoksisite veya teratojenisite gözlenmem^tir.
6. FARMASÖTK ÖZELUKLER
6.1. Yardımcı maddelerin listesi
NEVAKSON 500 mg i.v. enjektabl toz içeren flakon herhangi bir yardımcı madde
içermemektedir.
6.2. Geçimsizlikler
NEVAKSON içeren çözeltiler d^^^^ ^^tınlmamalı veya diğ
er ajanlara
eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örn^in Ringer çözeltisi veya Hartman çözeltisi) seftriakson flakonlarmı rekonstitüe etmek için veya rekonstitüeş bir flakonu IV uygulama için daha fazla seyreltmek için kullamlmamalıdu',
çünkü çökelti
içeren çözeltiler kanştınimamalı vaynı anda
uyguleınmamalıdır.
Literatürlerde seftriaksonun amsakrin, vankomisin, flukonazol, aminoglikozidler ve labetalol ile geçimsiz olduğ
u bildirilm^tir.
6.3. Raf ömrü
24 ay.
6.4. Saklamaya yönelik özel tedbirler
25^^^^^^ sıcaklığında saklayınız. Işıktan korumak için flakonu dış
kartonun
içerisinde tutunuz.
6.5. Ambalajın niteliğ
i ve içerdi
NEVAKSON 500 mg i.v. flakon, 1 adet + 5 ml steril enjeksiyonluk su içen ampul, 1 adet.
6.6. ^an maddelerin imhası
ve d^er özel önlemler
'TıbbiAtıklarının Kontrolü
Yönetmeliklerine uygun olarak imha edilmelidir.
Kural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmahdır.
Çözeltilerin renkleri, konsantrasyon ve saklanma sürelerine b^^^^ ^k san ile bal
rengi arasında değd^toleransını etkilemez.
Intramüsküler enjeksiyon: Intramüsküler enjeksiyon için 500 mg NEVAKSON 2 ml %1'lik lidokain çözeltisinde çözülür ve derin intragluteal enjeksiyon şeklinde uygulanır.^^^^^^^^sla i.v. uygulanmamalıdır.
7. RUHSAT SAfflm Mustafa Nevzat İlaç Sanayii A.Ş.
Prof. Dr. Bülent Tarcan Sok., Pak İş Merkezi No: 5/1 34349 Gayrettepe/İstanbul
Tel: 0 (212) 337 38 00 Fax: 0 (212) 337 38 01
8. RUHSAT NUMARASI
178/53
9. İLK RUHSAT TAMffl/RUHSAT YEMLEME TAMffl
İlk ruhsat tarihi: 07.06.1996 Ruhsat yenileme tarihi: 27.06.2005
10. KÜB'ÜN YEMLENME TAMffl
diminasyon yaniş
kinlerleka
^^^^^^^^^^ğında 2
-3 kez daha uzundur.Böbrek ve karacmer yetmezlmi olan hastalar:eliminasyon yan ömrü hafif düzeyde uzar. Tek başına böbrek fonksiyonlannda bozukluk varsa seftriaksonun safra yoluyla atılımı ve tek başına karaciğer fonksiyonlannda bozukluk varsa böbrek yoluyla atılımı artar.
Beyin omurilik sıvısı:zamanlı plazma konsantrasyonunun %4
-17'si düzeyinde bir konsantrasyona ul^).
5.3. Klinik öncesi güvenlilik verileri
İnsanlarda üreme çalışmalan embriyotoksisite, fetotoksisite, teratojenisite ve
ya d^umda, perinatal ve postnatal gel^imde erkek veya d^i fertilitesinde olumsuz etkiler göstermem^tir. Primatlarda embriyotoksisite veya teratojenisite gözlenmem^tir.
6. FARMASÖTK ÖZELUKLER
6.1. Yardımcı maddelerin listesi
NEVAKSON 500 mg i.v. enjektabl toz içeren flakon herhangi bir yardımcı madde
içermemektedir.
6.2. Geçimsizlikler
NEVAKSON içeren çözeltiler d^^^^ ^^tınlmamalı veya diğ
er ajanlara
eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örn^in Ringer çözeltisi veya Hartman çözeltisi) seftriakson flakonlarmı rekonstitüe etmek için veya rekonstitüeş bir flakonu IV uygulama için daha fazla seyreltmek için kullamlmamalıdu',
çünkü çökelti
içeren çözeltiler kanştınimamalı vaynı anda
uyguleınmamalıdır.
Literatürlerde seftriaksonun amsakrin, vankomisin, flukonazol, aminoglikozidler ve labetalol ile geçimsiz olduğ
u bildirilm^tir.
6.3. Raf ömrü
24 ay.
6.4. Saklamaya yönelik özel tedbirler
25^^^^^^ sıcaklığında saklayınız. Işıktan korumak için flakonu dış
kartonun
içerisinde tutunuz.
6.5. Ambalajın niteliğ
i ve içerdi
NEVAKSON 500 mg i.v. flakon, 1 adet + 5 ml steril enjeksiyonluk su içen ampul, 1 adet.
6.6. ^an maddelerin imhası
ve d^er özel önlemler
'TıbbiAtıklarının Kontrolü
Yönetmeliklerine uygun olarak imha edilmelidir.
Kural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmahdır.
Çözeltilerin renkleri, konsantrasyon ve saklanma sürelerine b^^^^ ^k san ile bal
rengi arasında değd^toleransını etkilemez.
Intramüsküler enjeksiyon: Intramüsküler enjeksiyon için 500 mg NEVAKSON 2 ml %1'lik lidokain çözeltisinde çözülür ve derin intragluteal enjeksiyon şeklinde uygulanır.^^^^^^^^sla i.v. uygulanmamalıdır.
7. RUHSAT SAfflm Mustafa Nevzat İlaç Sanayii A.Ş.
Prof. Dr. Bülent Tarcan Sok., Pak İş Merkezi No: 5/1 34349 Gayrettepe/İstanbul
Tel: 0 (212) 337 38 00 Fax: 0 (212) 337 38 01
8. RUHSAT NUMARASI
178/53
9. İLK RUHSAT TAMffl/RUHSAT YEMLEME TAMffl
İlk ruhsat tarihi: 07.06.1996 Ruhsat yenileme tarihi: 27.06.2005
10. KÜB'ÜN YEMLENME TAMffl
İlaç Bilgileri
Nevakson 500 mg i.v. enjektabl toz içeren flakon
Etken Maddesi: Seftriakson sodyum
Atc Kodu: J01DD04
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.