Formega 12+200 Mcg İnhalasyon İçin Toz İçeren Kaplı Tablet Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Selektif Beta 2 Adrenoreseptör Agonistleri » Formoterol KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFORMEGA 12+200 mcg inhalasyon için toz içeren kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİM 12 mcg formoterol içeren kapsül Etkin madde:Formoterol fumarat dihidratYardımcı madde:
12 mcg 24,988 mg Laktoz 200 mcg budesonid içeren kapsül Etkin madde:BudesonidYardımcı madde:
200 mcg 24,8 mg Laktoz Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için toz içeren kapsül 12 mcg formoterol içeren kapsül şeffaf kapak, natural transparan kapsül içinde, beyaz toz ve 200 mcg budesonid içeren kapsül flesh opak natural transparan kapsül içinde beyaz toz şeklindedir.4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir.Orta ve ağır KOAH olgularında semptomları ve atak sıklığım azaltır. 4.2. Pozoloji ve uygulama şekli Pozoloji/ uygulama sıklığı ve süresi: Astım:FORMEGA, astım ataklarının akut semptomlarını hafifletmek için kullanılmamalıdır. Akut atak durumunda, kısa etkili bir beta2-agonist kullanılmalıdır (bkz. Bölüm 4.4).Yetişkinler: 12 mcg formoterol içeren kapsülFormoterol dozu, hastanın kişisel ihtiyacına göre ayarlanmalı ve terapötik amaca ulaşılmasını sağlayan en düşük dozda uygulanmalıdır. Doz, önerilen maksimum dozu aşacak şekilde artınlmamalıdır (bkz. Bölüm 4.2).Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram formoterole eşdeğer) kullanılması önerilir. Önerilen en yüksek idame dozu günde 48 mikrogramdır. Daha ciddi vakalarda günde 2 kez 2 inhaler kapsül verilir. Gerekirse belirtilerin hafifletilmesi için, önerilen en yüksek günlük doz olan 48 mikrogramı aşmamak kaydıyla her gün 1-2 ilave kapsül kullanılabilir. Ancak haftada iki günden fazla ilave dozlara ihtiyaç olduğu takdirde doktora danışılmalı ve tedavi yeniden değerlendirilmelidir, çünkü bu durum hastalığın ağırlaştığının belirtisi olabilir. 200 mcg budesonid içeren kapsülTek bir kapsül içindeki en düşük doz 200 mikrogramdır. Eğer 200 mikrogramdan düşük tek bir doz gerekliyse bu ürün kullanılamaz.Hafif şiddette astımı olan yetişkinlerin tedavisine, günde bir kere 200 mikrogram olarak belirlenmiş minimum etkili dozla başlanabilir. Normal idame dozu günde iki defa 1-2 (200-400 mikrogram) inhalasyon kapsülüdür (günde 400-800 mikrograma eşdeğer). Şiddetli astım ataklan sırasında, hasta oral kortikosteroid tedavisinden budesonid inhalasyon tedavisine geçirilirken veya oral kortikosteroid tedavi dozu azaltıldığında günlük doz (2-4'e bölünerek) 1600 mikrograma kadar yükseltilebilir. İdame tedavisinin sağlanabilmesi için gereken en düşük düzey elde edilecek şekilde doz kişiye göre ayarlanmalıdır. 200 mcg budesonid içeren kapsül düzenli olarak her gün Çocuklar (6 yaş ve üzeri): 12 mcg formoterol içeren kapsülDüzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram) kullanılması önerilir. Önerilen en yüksek doz günde 24 mikrogramdır. 12 mcg formoterol içeren kapsül sadece bir inhale kortikosteroide (örneğin, 200 mcg budesonid içeren kapsül) ilave olarak reçete edilmeli ve kullanılmalıdır.200 mcg budesonid içeren kapsül6 yaşın altındaki çocuklarda klinik deneyim olmadığından, 200 mcg budesonid içeren kapsül bu yaş grubundaki hastalarda kullanılmamalıdır.Hafif şiddette astımı olan çocuklarda tedavi günde bir kere 200 mikrogram ile başlatılabilir. Normal idame dozu günde iki defa 200 mikrogramdır (günde 400 mikrograma eşdeğer). Azami günlük doz 800 mikrogramdır. 200 mcg budesonid içeren kapsül erişkinlerin denetimi altında kullanılmalıdır. Cihazın kullanımı, çocuğun inhaleri doğru bir şekilde kullanabilmesine bağlıdır. Kronik obstrüktif akciğer hastalığı (KOAH):12 mcg formoterol içeren kapsülDüzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram). Azami günlük doz 48 mikrogramdır.200 mcg budesonid içeren kapsülNormal idame dozu günde iki defa 200-400 mikrogramdır (günde 400-800 mikrograma eşdeğer).Gerekli olduğunda, hasta oral kortikosteroid tedavisinden 200 mcg budesonid içeren kapsül inhalasyon tedavisine geçirilirken veya oral kortikosteroid tedavi dozu azaltıldığında günlük doz (2-4'e bölünerek) 1600 mikrograma kadar yükseltilebilir. İdame tedavisinin sağlanabilmesi için gereken en düşük düzey elde edilecek şekilde doz kişiye göre ayarlanmalıdır. 200 mcg budesonid içeren kapsül düzenli olarak her gün Uygulama şekli:12 mcg formoterol içeren kapsül ve 200 mcg budesonid içeren kapsüller yalnızca kutudan çıkan cihaz ile tatbik edilmelidir ve sadece oral inhalasyon içindir.İnhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir. Olası bir kandida enfeksiyonu riskini azaltmak için her doz uygulamasından sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir (Bkz. Bölüm 4.4 ve Bölüm 4.8). Ayrıca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskinin azaltılmasına muhtemelen yardımcı olabilir. mİlacın akciğerlerdeki hedef bölgelere ulaşabilmesi ve uygun şekilde kullanıldığından emin olunması için doktor veya bir başka sağlık personeli kullanım talimatına uygun olarak cihazın nasıl kullanılacağını hastalara öğretmeli ve göstermeli, kapsüllerin sadece cihaz aracılığıyla inhalasyon yolu ile uygulanması gerektiği ve yutulmaması konusunda hastayı uyarmalıdır. Hastaların jelatin kapsülün parçalanabileceğim ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.Kapsüller blister ambalajındankullanımdan hemen önceçıkarılmalıdır.Kullanıma ilişkin detaylı bilgi, kullanma talimatında mevcuttur. İnhalasyon cihazının doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz. İnhalasyon cihazı kullanım talimatları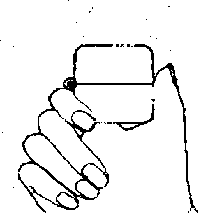 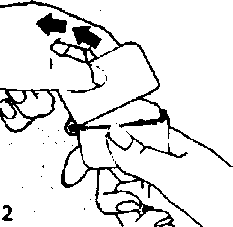  ti
ti12. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız. 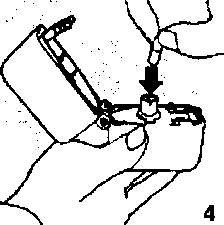 4. Blister ambalajından bir FORMEGA inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.
4. Blister ambalajından bir FORMEGA inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.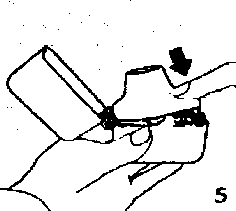 5. Ağızlık parçasını bir klik sesi duyuncaya değin
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıcakapatınız. Toz başlığını açıkbırakınız.  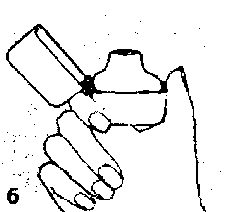 6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.
6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır. 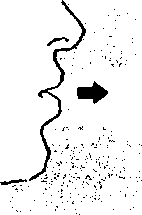 8. Nefesinizi tam olarak veriniz.
8. Nefesinizi tam olarak veriniz.Önemli: Hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz. 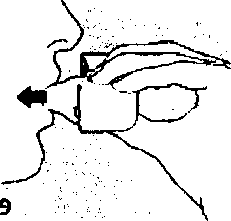 9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.
9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.Basamak 8 ve 9'u bir kez daha tekrarlayınız,bu kapsülün tamamen boşalmasını sağlayacaktır.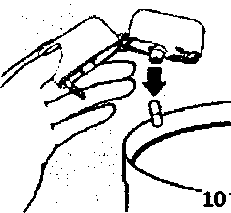 10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığım kapatınız ve inhalasyon cihazınızı yerine kaldırınız.
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığım kapatınız ve inhalasyon cihazınızı yerine kaldırınız.inhalasyon cihazının temizleme işlemiİnhalasyon cihazını ayda bir kez yıkayınız. Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan arındırınız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerine kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. Kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlamasına işaret eden veriler mevcut değildir. Oral budesonid ile elde edilen farmakokinetik verilere dayalı olarak, bu tip hastalarda ilacın sistemik maruziyetinin klinik açıdan anlamlı düzeylerde değişmesi olası değildir.Karaciğer yetmezliği olan hastalarda doz ayarlamasına işaret eden veriler mevcut değildir. Diğer yandan budesonid büyük oranda karaciğer metabolizması ile elimine edilmektedir. Dolayısıyla şiddetli karaciğer yetmezliği olan hastalarda 200 mcg budesonid içeren kapsül kullanılırken dikkatli olunmalıdır. Oral budesonid ile elde edilen farmakokinetik verilere dayalı olarak hafif ila orta şiddette karaciğer yetmezliği olan hastalarda ilaç maruziyetinde klinik açıdan anlamlı bir değişiklik olması olası değildir. Formoterolün karaciğer veya böbrek yetmezliği olan hastalardaki kullanımına ilişkin klinik çalışma yapılmamıştır. Ancak, 12 mcg formoterol içeren kapsülün böbrek ve karaciğer yetmezliği olan hastalarda kullanımında doz ayarlaması gerektiği konusunda teorik bir sebep bulunmamaktadır. Pediyatrik popülasyon:12 mcg formoterol içeren kapsülün 5 yaş ve altındaki çocuklarda kullanılması tavsiye edilmez.6 yaşın altındaki çocuklarda klinik deneyim olmadığından, 200 mcg budesonid içeren kapsül bu yaş grubundaki hastalarda kullanılmamalıdır. Geriyatrik popülasyon:65 yaş üzerindeki hastaların, genç erişkin hastalarda kullanılandan farklı bir doza gereksinim duyduğuna işaret eden herhangi bir kanıt bulunmamaktadır.4.3. Kontrendikasyonlar Formoterole, budesonide ya da içeriğindeki yardımcı maddelerden herhangi birine karşı bilinen aşın duyarlılıkta, Aktif akciğer tüberkülozlu hastalarda kontrendikedir. 4.4. Özel kullanım uyarılan ve önlemleriİnhale steroidin kombine edildiği ileri yaş hastalarda pnömoni riski artabilmektedir. KOAH'da yüksek doz kullanımının avantaj sağladığına ilişkin klinik kanıtlar yetersizdir.Astımlı hastalarda kutu içinde bulunan iki ayn ilaç, doktorun önerisi doğrultusunda mutlaka birlikte kullanılmalıdır. Sadece bir ilacın kullanımı tedavide eksiklik ve yetersizlik yaratabilir.Formoterol; astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.12 mcg formoterol içeren kapsülün etkin maddesi formoterol, uzun etkili beta2-adreneıjik agonistler sınıfına dahildir. Uzun etkili diğer bir beta2-agonist olan salmeterol ile yapılan bir çalışmada, salmeterol ile tedavi edilen hastalarda plasebo grubu ile karşılaştırıldığında astım nedeniyle ölüm oranının daha yüksek olduğu gözlenmiştir (sırasıyla 13/13, 176 ve 3/13, 179). Astımla ilişkili ölüm oranının formoterol ile artıp artmadığına dair yeterli çalışma yürütülmemiştir. Uzun etkili beta agonist preparatlanna bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.12 mcg formoterol içeren kapsül, başka bir uzun etkili beta2-agonist ile birlikte kullanılmamalıdır. 12 mcg formoterol içeren kapsül, astımda ilk tedavi seçeneği olarak kullanılmamalıdır. 12 mcg formoterol içeren kapsül, hafif astım hastalığının başlangıç tedavisi olarak önerilmez. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Astım hastalanın tedavi ederken, uzun etkili bir beta2-agonist (LABA) olan 12 mcg formoterol içeren kapsül, tek başına bir inhale kortikosteroid ile yeterli düzeyde kontrol edilemeyen ya da hastalığının şiddeti bir LABA ve inhale kortikosteroidin her ikisi ile tedavinin başlatılmasını kesin olarak gerektiren hastalarda, bir inhale kortikosteroide (örneğin, 200 mcg budesonid içeren kapsül) ilave olarak kullanılmalıdır. İnhale kortikosteroid ile uzun etkili beta2-agonistin ayrı kullanılmasının gerekli olduğu durumlar dışında 5-12 yaş arası çocuklarda, inhale kortikosteroid ile uzun etkili beta2 agonist (LABA) içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz. Bölüm 4.2. ve 4.8). İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adolesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. 12 mcg formoterol içeren kapsül reçete edildiğinde hastalar aldıkları antienflamatuvar tedavinin yeterliliği açısından değerlendirilmelidirler. Hastalara, 12 mcg formoterol içeren kapsül almaya başladıktan sonra, belirtilerde düzelme olsa bile antienflamatuvar tedaviye değişiklik yapmaksızın devam etmeleri öğütlenmelidir. Astım semptomlan kontrol altına alındıktan sonra, 12 mcg formoterol içeren kapsül dozunun kademeli olarak azaltılması düşünülmelidir. Tedavinin azaltılması sırasında hastalar yakından izlenmeli ve 12 mcg formoterol içeren kapsül etkili en düşük dozda kullanılmalıdır. Antienflamatuvar tedavi: Hastalara, inhale 200 mcg budesonid içeren kapsül tedavisinin astımdaki profılaktik niteliği ve semptomlan olmadığında bile düzenli olarak kullanmalan gerektiği anlatılmalıdır. İnhale kortikosteroidler, özellikle uzun süreli olarak yüksek dozlarda kullanıldığında, sistemik etkiler ortaya çıkarabilir. Bu etkiler, oral kortikosteroidlerle yapılan tedavide görülenden çok daha az ortaya çıkar. Bazı olası sistemik etkiler arasında adrenal supresyon, hiperadrenokortisizm/Cushing sendromu, çocuklarda ve ergenlerde büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt, glokom, aşın duyarlılık reaksiyonları ve daha seyrek olarak, psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon ya da agresyon (özellikle çocuklarda) dahil olmak üzere bir dizi psikolojik ya da davranışsal etkiler yer almaktadır. Bu nedenle, inhale kortikosteroid dozunun etkin astım kontrolünün sağlandığı en düşük doz olacak şekilde ayarlanması önemlidir (Bkz. Bölüm 4.8). Astım ataklan: Formoterol ile yapılan klinik çalışmalar, formoterol kullanan hastalarda ağır astım ataklanmn sıklığının plasebo alanlara göre özellikle 5-12 yaş arasındaki hastalarda daha yüksek olduğunu düşündürmüştür (bkz. Bölüm 4.8 İstenmeyen Etkiler). Bu çalışmalar, ağır astım atağı oranlan açısından tedavi grupları arasındaki farklann doğru olarak ölçülmesine imkân vermemektedir. Semptomlar devam ettiği takdirde ya da semptomlann kontrol edilebilmesi için gereken 12 mcg formoterol içeren kapsül dozlanmn sayısı arttığı takdirde böyle bir gelişmenin genellikle altta yatan durumun kötüleştiğini gösteriyor olması nedeniyle doktorlar kullanılan astım tedavisini yeniden değerlendirmelidir. Hastalara astımlan kötüleştiği takdirde (kısa etkili inhale bronkodilatör tedavisinin uygulanma sıklığında artış ya da inatçı solunum semptomlan) doktorlan ile temasa geçmeleri önerilmelidir. Astımın akut atakları sırasında 200 mcg budesonid içeren kapsül dozunda artışa veya kısa süreli oral kortikosteroidlerle ve/veya eğer bir enfeksiyon varsa antibiyotikle ilave bir tedaviye gereksinim duyulabilir. 200 mcg budesonid içeren kapsül, akut bronkospazmda fayda sağlamadığı gibi; status astmatikus veya diğer akut astım nöbetlerinde uygulanması gereken primer tedavi değildir. Astım atağı esnasında 12 mcg formoterol içeren kapsül tedavisine başlanmamalı ya da dozu artınlmamalıdır. Hastalar alevlenme döneminde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. 12 mcg formoterol içeren kapsül, akut astım semptomlannın rahatlatılması için kullamlmamalıdır. Akut ataklarda kısa etkili bir beta2-agonist kullanılmalıdır. Hastalar, astımlan aniden kötüleştiği takdirde hemen tıbbi tedavi almaları gerektiği konusunda bilgilendirilmelidir. Hastalar akut astım semptomlarım hafifletmek için kurtarıcı ilaç olarak her zaman yanlarında kısa etkili bir inhale bronkodilatör bulundurmalıdır. Eşlik eden şartlar: 12 mcg formoterol içeren kapsül kullanan hastalarda aşağıdaki durumların varlığında, özellikle doz sınırlan konusunda olmak üzere, özel dikkat ve denetleme gereklidir: İskemik kalp hastalığı, kardiyak aritmiler (özellikle üçüncü derece atriyoventriküler blok), şiddetli kardiyak dekompansasyon, idiyopatik subvalvüler aortik stenoz, şiddetli hipertansiyon, anevrizma, feokromositoma, hipertrofik obstrüktif kardiyomiyopati, tirotoksikoz, QT aralığında bilinen veya şüphe edilen uzama (QTc >0.44 saniye; bkz. Bölüm 4.5). Daha önceden kardiyak problemleri bulunan ve teofilin ile formoterolü bir arada kullanan hastalarda dikkatli olunmalıdır. 12 mcg formoterol içeren kapsül dahil beta2 uyarıcıların hiperglisemik etkileri nedeniyle, diyabetik hastalarda 12 mcg formoterol içeren kapsül tedavisi başlatıldığında kan glukoz değerlerinin izlenmesi tavsiye edilir. Sessiz seyreden akciğer tüberkülozu olan veya solunum yollarında flıngal veya viral enfeksiyonu olan hastalarda dikkatli kullanılmalıdır. Bronşektazi ve pnömokonyoz gibi akciğer hastalıkları olan hastaları tedavi ederken fungal enfeksiyon olasılığı göz önüne alınmalıdır. Daha önceden bilinen kalp sorunları olan hastalarda teofilin ve formoterol eş zamanlı kullanılıyorsa dikkatli olunmalıdır. Hipokalemi: 12 mcg formoterol içeren kapsül dahil beta2-agonist tedavisi sonucunda ciddi hipokalemi görülebilir. Hipokalemi, kardiyak aritmilere duyarlılığı artırabilir. Hipoksi ve birlikte uygulanan tedavi hipokalemiyi şiddetlendirebileceğinden, şiddetli astımlı hastalarda özel bir dikkat önerilir (bkz. Bölüm 4.5). Böyle durumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilir. Paradoksal bronkospazm: Diğer inhalasyon tedavilerinde olduğu gibi paradoksal bronkospazm ihtimali akılda tutulmalıdır. Böyle bir durum görüldüğünde, FORMEGA tedavisi derhal kesilmeli ve alternatif tedavi başlatılmalıdır. Büyüme üzerindeki etki: Uzun süreli olarak inhale kortikosteroid tedavisi gören çocukların boylarının düzenli olarak ölçülmesi önerilmektedir. Büyümede yavaşlama olduğu takdirde inhale kortikosteroid dozunun, mümkünse astım kontrolünün etkin şekilde sağlandığı en düşük doza indirilmesi amacıyla tedavi gözden geçirilmelidir. Aynca, hastanın bir pediyatrik solunum hastalıkları uzmanına sevk edilmesi düşünülmelidir. Gelişim hızındaki inhale kortikosteroidlerle ilişkili bu azalmanın, yetişkinlikte ulaşılan boy üzerindeki etkisi de dahil olmak üzere, uzun vadeli etkileri bilinmemektedir. Oral olarak inhale edilen kortikosteroid tedavisinin kesilmesini takiben büyümeyi yakalama potansiyeli yeterince incelenmemiştir. Eş zamanlı tedaviler: 200 mcg budesonid içeren kapsül ve güçlü bir CYP3A4 inhibitörünün (örneğin; itrakonazol, ketokonazol, ritonavir, nelfınavir, amiodaron, klaritromisin) uzun süre eş zamanlı uygulamasında dikkatli olunmalıdır (Bkz. Bölüm 4.5). Steroid ile tedaviye başlanan hastalar: Terapötik etki genellikle 10 gün içerisinde elde edilmektedir. Aşın bronşiyal mukus sekresyonu olan hastalarda, tedavinin başlangıcında, yaklaşık 2 hafta gibi kısa bir süre, oral kortikosteroid tedavisi tedaviye eklenebilir. Steroide bağımlı olan hastalar: Oral steroidlerden budesonide geçilirken, hasta görece olarak stabil bir dönemde olmalıdır. Yaklaşık 10 gün boyunca daha önceden kullanılan oral steroidle birlikte yüksek doz budesonid kombinasyonu verilir. Daha sonra, oral doz kademeli olarak azaltılarak (örneğin her ay 2.5 mg prednizolon veya eşdeğeri oranında) mümkün olan en düşük düzeye indirilmelidir. ilave sistemik kortikosteroidler ya da 200 mcg budesonid içeren kapsül ile yapılan tedavi aniden değil, yavaşça kesilmelidir. Travma, cerrahi veya ağır enfeksiyonlar gibi özel kriz durumlarına karşı koyma amacıyla hastanın adrenokortikal rezervinin yeterli düzeyde olduğundan emin olmak için sistemik kortikosteroidlerden budesonide geçilen ilk aylar boyunca özellikle dikkatli olunmalıdır. Hipotalamik-pitüiter-adrenal (HPA) eksen fonksiyonlan düzenli olarak izlenmelidir. Bazı hastalar bu gibi durumlarda ekstra kortikosteroid desteğine ihtiyaç duymaktadır; bu gibi hastaların potansiyel ciddi durumlarını bildiren bir uyarı kartını yanlarında taşımaları tavsiye edilmektedir. Sistemik kortikosteroidler yerine budesonide geçilmesi daha önce sistemık kortikosteroidler tarafından baskılanmış olan alerjik rinit veya egzema gibi alenilerin ortaya çıkmasına yol açabilir; hastalarda letarji, kas veya eklem ağrısı ve bazen de mide bulantısı ve kusma görülebilir. Bu alerjiler lokal antihistaminikler veya kortikosteroidlerle uygun bir şekilde tedavi edilmelidirler. İlave önlemler: Oral kandidiyazisi önlemek için, hastaya her uygulamadan sonra ağzını su ile çalkalaması önerilmektedir. Böyle bir durum geliştiği takdirde, çoğu vakada enfeksiyon, 200 mcg budesonid içeren kapsül tedavisi kesilmeksizin, topikal antifungal tedaviye yanıt verecektir (Bkz. Bölüm 4.2 ve 4.8). Disfoni oluşabilir; fakat bu durum geri dönüşlü olup, tedavinin kesilmesini ya da dozun azaltılmasını ve/veya sesin dinlendirilmesini takiben ortadan kalkar (Bkz. Bölüm 4.8). 12 mcg formoterol içeren kapsül ve 200 mcg budesonid içeren kapsüller yardımcı madde olarak laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBirarada kullanımın önerilmemesi ile sonuçlanan öngörülen etkileşimler:12 mcg formoterol içeren kapsül kullanımını etkileyen etkileşimler: Beta-adreneıjik blokörler 12 mcg formoterol içeren kapsülün etkisini zayıflatabilirler veya antagonize edebilirler. Bu yüzden 12 mcg formoterol içeren kapsül, zorunlu olmadıkça, beta-adreneıjik blokörler (göz damlaları dahil) ile birlikte verilmemelidir. Gözönünde bulundurulması gereken öngörülen etkileşimler: 12 mcg formoterol içeren kapsül kullanımım etkileyen etkileşimler: Diğer beta2-agonistleri gibi 12 mcg formoterol içeren kapsül de; kinidin, disopiramid, prokainamid, fenotiyazinler, antihistaminikler, makrolidler, monoamin oksidaz inhibitörleri ve trisiklik antidepresanlar gibi ilaçlarla veya QTc aralığım uzattığı bilinen herhangi bir ilaçla birlikte dikkatli kullanılmalıdır. Çünkü bu ilaçlar, adrenerjik agonistlerin kardiyovasküler sistem üzerindeki etkilerini güçlendirebilir. QTc aralığım uzattığı bilinen ilaçların ventriküler aritmi oluşturma riski artmıştır (bkz. Bölüm 4.4). Diğer sempatomimetik maddelerin birlikte verilmesi, 12 mcg formoterol içeren kapsülün istenmeyen etkilerini güçlendirebilir. Atomoksetin formoterolden kaynaklanan taşikardiyi artırabilir. Ksantin türevleri, steroidier veya diüretikler ile birlikte tedavi beta2-agonistlerin muhtemel hipokalemik etkisini kuvvetlendirebilir (bkz. Bölüm 4.4). Halojenli hidrokarbonlarla eşzamanlı anestezi alan hastalarda aritmi riski artmaktadır. Formoterol, beta-blokörlerin (betaı-selektif) bradikardik etkisini azaltabilir. Antikolinerjik ilaçlar formoterolün bronkodilatör etkisini artırabilir. 200 mcg budesonid içeren kapsül kullanımını etkileyen etkileşimler: Budesonidin ana metabolizma yolu sitokrom P450 (CYP) izoenzim 3A4 (CYP3A4) aracılığıyladır. CYP3A4 inhibitörleri olarak bilinen ilaçlar (örneğin; itrakonazol, ketokonazol, ritonavir, nelfınavir, amiodaron, klaritromisin) ile eş zamanlı uygulaması budesonid metabolizmasını inhibe ederek sistemik maruziyetini artırabilir. Eğer bu ürünler birlikte uygulanıyorsa, adrenal kortikal fonksiyon izlenmeli ve budesonidin dozu yanıta göre ayarlanmalıdır (Bkz. Bölüm 4.4 ve Bölüm 5.2). Güçlü CYP3A4 İndükleyicilerle (örn., rifampisin) eş zamanlı olarak kullanılması budesonidin metabolizmasını hızlandırabilir ve sistemik maruziyetini düşürebilir (Bkz. Bölüm 5.2). Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara özgü etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona özgü etkileşim çalışması yürütülmemiştir.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar için 12 mcg formoterol içeren kapsül tedavisi sırasında özel bir gereklilik bulunmamaktadır. Eğer gebelik tespit edilirse, devam eden 12 mcg formoterol içeren kapsül tedavisinin alternatif tedavilere karşı yarar/risk oranı değerlendirilmelidir.Çocuk doğurma potansiyeli bulunan kadınlar için 200 mcg budesonid içeren kapsül tedavisi sırasında özel bir öneri bulunmamaktadır. Gebelik dönemi12 mcg formoterol içeren kapsül ve 200 mcg budesonid içeren kapsülün gebelik döneminde emniyeti henüz tespit edilmemiştir. Daha güvenli bir alternatif olduğu takdirde gebelik dönemi süresince kullanımından kaçınılmalıdır.Gebelik sırasında glukokortikosteroid tedavisi kaçınılmazsa, oral glukokortikosteroidlerin yerine, düşük sistemik yan etkileri nedeniyle, inhale glukokortikosteroidier tercih edilmelidir. Diğer beta2-adrenerjik uyarıcılar gibi formoterol de uterus düz kası üzerine gevşetici etkisi nedeniyle, doğum sürecini baskılayabilir. Laktasyon dönemiFormoterol emziren sıçanların sütünde tespit edilmiştir. İnhale budesonid anne sütü İçine salgılanır. Bebeklerde ulaşılan plazma konsantrasyonlarının, anne plazmasında bulunan konsantrasyonların yaklaşık 1/600'üne ulaşması beklenir (bkz. Bölüm 5. Farmakolojik özellikler). FORMEGA kullanan anneler emzirmemelidir.Üreme yeteneği/FertiliteBudesonidin insanlarda herhangi bir teratojenite ya da üreme toksisitesi gösterdiğine ilişkin bir kanıt yoktur (Bkz. Bölüm 5.3).4.7. Araç ve makine kullanımı üzerindeki etkilerBaş dönmesi veya buna benzer yan etkiler gelişen hastalara, araç veya makine kullanmaktan kaçınmaları önerilmelidir.4.8. İstenmeyen etkiler12 mcg formoterol içeren kapsülAdvers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10);yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Bağışıklık sistemi hastalıklarıÇok seyrek: Aşın duyarlılık (hipotansiyon, ürtiker, anjiyonörotik ödem, kaşıntı, egzantem dahil)Psikiyatrik hastalıklarYaygın olmayan: Ajitasyon, anksiyete, asabiyet, uykusuzlukSinir sistemi hastalıklarıYaygın: Baş ağnsı, tremorYaygın olmayan: Baş dönmesi Çok seyrek: Tat alma duyusu bozukluklan Kardiyak hastalıklarYaygın: Palpitasyonlar Yaygın olmayan: Taşikardi Çok seyrek: Periferik ödemSolunum, göğüs bozukluklan ve mediastinal hastalıklarYaygın olmayan: Paradoksal bronkospazm dahil bronkospazm, boğaz irritasyonu, akut astım alevlenmesiGastrointestinal hastalıklarÇok seyrek: BulantıKas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın olmayan: Kas kramplan, miyalji 200 mcg budesonid içeren kapsülAdvers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Ağız-yutakta kandida enfeksiyonuBağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık reaksiyonları (dermatit, eritem), döküntü, ürtiker, anjiyoödem, kaşıntı, anafilaktik reaksiyonlarEndokrin hastalıklarSeyrek: Adrenal supresyon, Cushing sendromu, hiperadrenokortisizm, hipokortisizm, çocuklarda ve ergenlerde büyüme geriliğiPsikiyatrik hastalıklarSeyrek: Depresyon, huzursuzluk Çok seyrek: SinirlilikGöz hastalıklarıSeyrek: Katarakt, glokomSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: ÖksürükSeyrek: Paradoksal bronkospazm, disfoni, boğaz iritasyonu Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıSeyrek: Kemik mineral yoğunluğunda azalmainhale kortikosteroidlerin, özellikle uzun süreli olarak yüksek dozlarda kullanıldığında sistemik etkileri ortaya çıkarabilir. Bazı olası sistemik etkiler arasında adrenal supresyon, hiperkortisizm/Cushing sendromu, çocuklarda ve ergenlik çağındakilerde gelişim gecikmesi, kemik mineral yoğunluğunda azalma, katarakt, glokom ve aşın duyarlık reaksiyonları yer almaktadır (Bkz. Bölüm 4.4). Yayınlanmış literatürde uzun süreli klinik çalışmalardaki KOAH hastalarında budesonid formülasyonları ile şu istenmeyen etkiler bildirilmiştir: Deri morarmaları ve pnömoni. Pazarlama sonrası spontan bildirimlerden elde edilen istenmeyen etkiler (Sıklıklar bilinmiyor)Formoterol ile tedavi edilen hastalarda aşağıdaki pazarlama sonrası advers etkiler bildirilmiştir. Bu reaksiyonlar büyüklüğü kesin olmayan bir popülasyondan isteğe bağlı olarak bildirilmiş olduğundan, güvenilir bir şekilde sıklığı belirlemek mümkün değildir; dolayısıyla bilinmiyor olarak kategorize edilmiştir:Metabolizma ve beslenme hastalıklarıBilinmiyor: Hipokalemi, hiperglisemiKardiyak hastalıklarBilinmiyor: Elektrokardiyogramda QT uzaması, anjina pektoris, atriyal fıbrilasyon gibi kardiyak aritmiler, ventriküler ekstrasistol, taşiaritmiSolunum, göğüs bozuklukları ve mediastinal hastalıklarBilinmiyor: ÖksürükDeri ve deri altı doku hastalıklarıBilinmiyor: Deri döküntüsüAraştırmalarBilinmiyor: Kan basıncında artış (hipertansiyon dahil)Seçilmiş istenmeyen etkilerin tanımlanmasıAğır astım ataklan:Formoterol ile uygulanan en az 4 haftalık plasebo-kontrollü klinik çalışmalar, formoterol alan hastalarda ağır astım ataklannm sıklığının (günde iki kez 10-12 mikrogram için %0.9, günde iki kez 24 mikrogram için %1.9) plasebo alanlardakine (%0.3) göre daha yüksek olduğunu düşündürmüştür (özellikle 5-12 yaş arasındaki hastalarda). Astımlı adolesan ve yetişkin hastalardaki deneyimler: ABD'de ruhsatlandırma için yapılan ve 12 yaş ve üstü toplam 1095 hastanın katıldığı 12 haftalık iki önemli kontrollü çalışmada, ağır astım ataklarının (astımın hastanın hastaneye yatırılmasını gerektiren akut kötüleşmesi) günde iki kez verilen formoterol 24 mikrogram uygulamasında (9/271, %3.3) günde iki kez verilen formoterol 12 mikrogram uygulamasına (1/275, %0.4), plaseboya (2/277, %0.7) ya da albuterole (2/272, %0.7) göre daha sık ortaya çıktığı gözlenmiştir. Bu gözlemi araştırmak amacıyla daha sonra yapılan ve 2085 hastanın katıldığı bir klinik çalışmada, yüksek ve düşük doz gruplarında astımla ilgili ciddi advers olaylar karşılaştırılmıştır. 16 hafta süren bu klinik çalışmada elde edilen sonuçlar, formoterol dozuyla açık bir ilişki göstermemiştir. Bu çalışmada, ağır astım ataklarının görüldüğü hastaların yüzde oranının formoterolde plaseboya göre biraz yüksek olduğu görülmüştür (üç çift-kör tedavi grubu için: formoterol 24 mikrogram günde iki kez (2/527, %0.4), formoterol 12 mikrogram günde iki kez (3/527, %0.6) ve plasebo (1/514, %0.2) ve açık-etiketli tedavi grubu için: formoterol 12 mikrogram günde iki keze ilave olarak ayrıca günde en fazla iki ek doz (1/517, %0.2).5-12 yaş arasındaki astımlı çocuklardaki deneyimler:Günde iki kez verilen formoterol 12 mikrogram dozun günde iki kez verilen formoterol 24 mikrogram doza ve plaseboya göre güvenlilİği; günlük bronkodilatör ve antienflamatuvar tedaviye ihtiyaç duyan astım hastası 518 çocuğun (5-12 yaş arasındaki) katıldığı 52 haftalık, çok merkezli, randomize, çift-kör büyük bir çalışmada araştırılmıştır. Günde iki kez formoterol 24 mikrogram (11/171, %6.4) ya da günde iki kez formoterol 12 mikrogram alan (8/171, %4.7) çocuklarda görülen ağır astım ataklarının plasebo alan çocuklardakine (0/176, %0.0) göre daha fazla olduğu görülmüştür. Tedavi önerileri için, Bölüm 4.2 Pozoloji ve Uygulama Şekli ve Bölüm 4.4 Özel kullanım uy anlan ve önlemleri'ne bakınız. Aşağıdaki advers ilaç reaksiyonlan, budesonid ile edinilmiş olan pazarlama sonrası deneyimden çıkanlmıştır. Bu reaksiyonlar, büyüklüğü belirli olmayan bir popülasyondan gönüllülük bazında bildirilmiş olduğundan, bunlann sıklıklarını güvenilir bir şekilde tahmin etmek mümkün olmamaktadır ve bu nedenle bilinmiyor olarak sınıflandırmaktadır. Bağışıklık sistemi hastalıklarıBilinmiyor: Kontakt dermatit (Tip IV [gecikmiş] aşın duyarlılık reaksiyonu).Psikiyatrik hastalıklarBilinmiyor: Psikomotor hiperaktivite, uyku bozuklukları, davranış değişiklikleri (ağırlıklı olarak çocuklarda).Yayınlanmış literatürde uzun süreli klinik çalışmalardaki KOAH hastalannda budesonid formülasyonlan ile şu advers ilaç reaksiyonlan bildirilmiştir: Deri morarmalan ve pnömoni. 4.9. Doz aşımı ve tedavisi Belirtiler:12 mcg formoterol içeren kapsülün aşın dozuna bağlı olarak beta2-adreneıjik uyancılann tipik etkilerinin görülmesi beklenir: bulantı, kusma, baş ağnsı, tremor, sedasyon, palpitasyonlar, taşikardi, ventriküler aritmiler, metabolik asidoz, hipokalemi, hiperglisemi, hipertansiyon.200 mcg budesonid içeren kapsülün akut toksisitesi düşük düzeydedir. Kısa bir süre içerisinde yüksek miktarlarda ilacın inhalasyonunu takiben oluşan en büyük zararlı etki hipotalamik-pitüiter-adrenal (HPA) fonksiyonlanmn baskılanmasıdır. Tedavi12 mcg formoterol içeren kapsülDestekleyici ve semptomatik tedavi uygulanır. Ciddi vakalarda hastalar hastaneye yatınlmalıdır. Kardiyoselektif beta-blokörlerin kullanılması düşünülebilir, ancak bronkospazma neden olabileceğinden bu tedavi yalnızca doktor gözetimi altında ve dikkatle uygulanmalıdır. 200 mcg budesonid içeren kapsül Özel acil durum önlemlerine gerek yoktur. Astımı kontrol etmek için Önerilen dozda 200 mcg budesonid içeren kapsül tedavisine devam edilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özellikler FormoterolFarmakoterapötik grup: Seiektif beta2-adrenoreseptör agonisti ATC kodu: R03AC13FormoterolFormoterol güçlü, seçici bir beta2-adreneıjik uyarıcıdır. Geri dönüşlü hava yolu tıkanmaları olan hastalarda bronkodilatör bir etki gösterir. Etkisi çabuk (1-3 dakika içinde) başlar ve inhalasyondan 12 saat sonra hala belirgindir. Terapötik dozlarda kardiyovasküler etkileri önemsizdir ve arasıra görülür.Formoterol, pasif olarak duyarlı hale getirilen insan akciğerlerinden lökotrienlerin ve histaminin salıverilmesini inhibe eder. Hayvanlarda yapılan deneylerde; ödemin ve iltihap hücrelerinin toplanmasının inhibisyonu gibi bazı antienflamatuvar özellikler gözlenmiştir. Kobay trakeasındaki in vitroçalışmalar; rasemik formoterolün ve bunun (R,R)- ve (S,S)-enantiomerlerinin, ileri derecede selektif beta2-adrenoseptör agonistleri olduklanm göstermiştir. (R,R)-enantiomerden 800-1000 kat daha az potent olan (S,S)-enantiomeri, (R-R)-enantiomerin trakea düz kası üzerindeki aktivitesini etkilemez. Enantiomerlerden herhangi birinin rasemik karışıma tercih edilmesini gerektirecek herhangi bir farmakolojik neden yoktur.İnsanda inhale edilen al eıj enlerin, egzersizin, soğuk hava, histamin veya metakolinin neden olduğu bronkospazmı önlemede formoterolün etkili olduğu gösterilmiştir. İnhaler ile günde iki defa 12 mikrogram ve günde iki defa 24 mikrogram dozlarda inhale edilen formoterolün, stabil kronik obstrüktif akciğer hastalığı (KOAH) olan hastalarda hızlı etki ile bronkodilatasyon sağladığı, etkisinin en az 12 saat sürdüğü ve Saint George Solunum Yollan Anketi sonucuna göre yaşam kalitesi açısından kişisel faydayı beraberinde getirdiği gösterilmiştir. BudesonidFarmakoterapötik grup: Obstrüktif akciğer hastalıklan için diğer ilaçlar, inhalantlar;Glukokortikoidler ATC kodu: R03BA02 Budesonid, insanlarda belirgin topikal etki göstermekle birlikte önemli bir sistemik etkisi olmayan bir kortikosteroiddir. Diğer inhale glukokortikoidlerde olduğu gibi budesonid de farmakolojik etkilerini, hücre içi glukokortikoid reseptörleri ile etkileşerek gösterir. Birçok farklı sitokin, kemokin, enzim ve hücre adezyon molekülünün üretimi inhibe edilir. Kortikosteroid tedavisinden fayda gören hastalarda inhalasyon tozu olarak kullanıldığında, genellikle tedaviye başlandıktan sonra 10 gün içerisinde astımı kontrol altına alabilmektedir. Budesonid düzenli kullanıldığında astımlı akciğerlerdeki kronik enflamasyonu azaltmaktadır. Budesonid, ayrıca akciğer fonksiyonlarını artırmakta ve astım semptomlarının ve bronş aşın cevaplılığının azalmasını sağlamakta, astım ataklarını önlemektedir. 5.2. Farmakokinetik özellikler Genel özellikler12 mcg formoterol içeren kapsülün terapötik doz aralığı günde iki kez 12-24 mikrogramdır. Formoterolün plazma farmakokinetiği verileri sağlıklı gönüllülerde önerilen doz aralığından daha yüksek dozlar ve KOAH hastalannda terapötik dozların inhale edilmesi ile derlenmiştir. İdrarda saptanan ve sistemik maruziyetin dolaylı bir göstergesi olarak kullanılan değişime uğramamış formoterol düzeyleriyle, plazmadaki ilaç farmakokinetiği verileri arasında korelasyon vardır. İdrar ve plazma için hesaplanan eliminasyon yarı ömürleri birbirine yakındır.Emi 1 im-F ormoterol:Sağlıklı gönüllülerde formoterol fumaratın 120 mikrogramlık tek bir doz inhalasyonunu takiben, formoterol hızla plazmaya geçerek inhalasy onu izleyen 5 dakika içerisinde, maksimum konsantrasyon olan 266 pmol/l'ye ulaşmıştır. 12 hafta boyunca günde iki defa 12 veya 24 mikrogram formoterol fumarat ile tedavi edilen KOAH hastalarında inhalasyondan 10 dakika, 2 saat ve 6 saat sonraki ortalama plazma formoterol konsantrasyonlan; sırasıyla 11.5-25.7 ve 23.3-50.3 pmol/1 arasında değişmiştir. Formoterolün ve/veya (R,R) ve (S,S) enantiomerlerinin kümülatif üriner itrahını araştıran çalışmalar, dolaşımdaki formoterol miktannın inhale edilen doz ile orantılı olarak arttığım göstermiştir (12-96 mikrogram). 12 hafta süreyle günde 2 defa 12 mikrogram veya 24 mikrogram inhalasyonundan sonra idrarla atılan, değişikliğe uğramamış formoterol düzeyleri, astım hastalarında %63 ve %73 (ilk dozla son doz karşılaştınldığında), KOAH hastalannda %19 ve %38 arasında değişen oranlarda yükselmiştir. Bu veriler, tekrarlanan dozlarda kullanılan formoterolün plazmada sınırlı olarak biriktiği izlenimini vermektedir. Tekrarlayan dozlardan sonra enantiomerlerden birinin, diğerinden daha fazla biriktiğine tanık olunmamıştır. İnhale edilen diğer ilaçlar için bildirildiği üzere inhaler aracılığıyla kullanılan formoterol dozunun çok büyük bölümü yutulmakta ve daha sonra gastrointestinal kanaldan emilmektedir. 3 * H ile işaretlenmiş 80 mikrogram formoterol fumaratm iki gönüllüye oral olarak verilmesinin ardından dozun en az %65'i emilmiştir. Emilim-Budesonid:Akciğerlere ulaşan budesonid miktarı hızlı bir şekilde ve tamamen emilmektedir. Uygulamadan hemen sonra plazmada en yüksek konsantrasyona ulaşılmaktadır. Orofarenkste kalan doz için gerekli düzeltme yapıldıktan sonra mutlak biyoyararlanım %73 oranındadır. Karaciğerdeki belirgin presistemik metabolizma nedeniyle inhale edilen bir dozun yutulan fraksiyonunun sadece % 10 ila 13'ü biyoyararlanıma sahiptir. Dağılım- Formoterol;Formoterolün plazma proteinlerine bağlanma oranı %61-64'tür. Bunun önemli bir kısmı (%34) insan serum albüminine bağlanır. Terapötik dozlar ile erişilen konsantrasyon aralığında bağlanma yerlerinde doyma olmaz. Dacılım- Budesonid:Budesonidin plazma proteinine bağlanması 1 ila 100 nmoriük bir konsantrasyon aralığında % 85-90'dır. Budesonid dokulara yaygın olarak dağılır, kararlı durumda budesonidin dağılım hacmi yaklaşık 183 ila 301 L'dir. Yapılan hayvan deneylerinde dalak ve lenf bezlerinde, timusta, adrenal kortekste, üreme organlarında ve bronşlarda yüksek konsantrasyonlar gözlenmiştir. Budesonid, farelerde plasenta bariyerini aşmaktadır. Budesonid, yaklaşık 0.46 süt-plazma konsantrasyon oranı ile anne sütüne geçer. Bebeğin maruz kalacağı tahmini günlük doz, günlük matemal dozun yaklaşık %0.3'üdür ve bebeklerde ortalama plazma konsantrasyonun, bebekte oral biyoyararlammın tam olacağı varsayıldığında dahi, matemal plazmada gözlenen konsantrasyonların yaklaşık 1/600'ü olacağı tahmin edilmektedir. Bivotransformasvon- Formoterol:Formoterol başlıca metabolizma ile elimine edilir; doğrudan glukuronidasyon biyotransformasyonun ana yoludur. Glukuronidasyonun izlediği O-demetilasyon, diğer bir biyotransformasyon yoludur. Formoterolün sülfat konjügasyonu ve ardından yine sülfat konjügasyonunun gerçekleştiği deformilasyon, minör metabolik yollandır. Formoterolün glukuronidasyonunda (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7 ve 2B15) ve O-demetilasyonunda (CYP2D6, 2C19, 2C9 ve 2A6) çok sayıda izoenzimin katalizör rolünü oynuyor olması; formoterol metabolizmasındaki spesifik bir izoenzimin inhibisyonu üzerinden ilaç-ilaç etkileşim potansiyelinin düşük olduğu izlenimini vermektedir. Terapötik dozlarla elde edilen konsantrasyonlardaki formoterol, sitokrom P450 izoenzimlerini inhibe etmemiştir veya indüklememiştir.Bivotransformasvon- Budesonid:Budesonid akciğerlerde metabolize olmaz. Emilimini takiben budesonid karaciğerde yıkıma uğrar ve 6 beta-hidroksibudesonid ve 16 alfa-hidroksiprednizolon dahil olmak üzere bir dizi inaktif metabolit elde edilir. Budesonidin ana metabolizma yolu CYP3A4 aracılığıyladır ve budesonid metabolizması bu enzimin bilinen inhibitörleri ya da indükleyicileri tarafından etkilenebilir (Bkz. Bölüm 4.5). Eliminasvon- Formoterol:12 hafta boyunca günde 2 defa 12 veya 24 mikrogram formoterol fumaratla tedavi edilen astım ve KOAH hastalarında, verilen dozun sırasıyla yaklaşık %10'u ve %7'si değişikliğe uğramamış olarak idrarda saptanmıştır. İdrardaki, değişikliğe uğramamış formoterolün; 12-120 mikrogram arasında değişen tek dozlann verildiği sağlıklı gönüllülerde ve tek ve tekrarlanan dozlar kullanan astım hastalarındaki %40'ınm (R-R), %60'ımn (S,S)-enantiomeri olduğu görülmüştür. İlaç ve metabolitleri vücuttan tamamen atılırlar; bir oral dozun yaklaşık 2/3'si idrarla ve 1/3'i feçesle atılır. Kandaki formoterolün renal klerensi 150 ml/dakikadır. Sağlıklı gönüllülerde 120 mikrogram tek doz formoterol fumarat inhalasyonundan sonra, idrarla atılma oranlanndan hesaplanan, plazmadaki eliminasyon yan-ömrü, 10 saat; (R,R) ve (S,S)- enantiomerlerinde ise sırasıyla 13.9 ve 12.3 saat olarak ölçülmüştür. Eliminasyon- Budesonid:Radyoişaretli budesonid soluyan insan gönüllülerde (ölçülü doz inhaler ile) uygulanan dozun yaklaşık % 32'si idrarda geri kazanılır ve dozun % 15'i feçeste geri kazanılır. İnhalasyonu takiben budesonid idrarda tespit edilmezken, 16-alfa-hidroksiprednizolon tespit edilmiştir. Budesonid intravenöz doz uygulamasını takiben yüksek plazma klirensi (84 l/s) gösterir. Budesonidin eliminasyon yanlanma ömrü yaklaşık 2.8 ila 5 saattir. Dogrusallık/Dogrusal olmayan durum:Formoterol ve budesonidin doğrusallık/doğrusal olmayan durumu konusunda yeterli çalışma bulunmamaktadır. Hastalardaki karakteristik Özellikler:Böbrek/Karaciğer yetmezliği:Formoterolün ve budesonidin karaciğer veya böbrek yetmezliği bulunan hastalardaki farmakokinetiği incelenmemiştir. Ancak, siroz hastalarındaki oral uygulamanın ardından budesonidin sistemik yararlanımının sağlıklı kontrollere göre 2.5kat daha yüksek olduğu bildirilmiştir. Hafif karaciğer yetmezliğinin sistemik maruziyet üzerinde az etkisi olduğu bildirilmiştir.Böbrek yetmezliğinin, oral budesonidin farmakokinetiği üzerinde herhangi bir etkisinin olmasının beklenmediği bildirilmiş olmakla birlikte, budesonid metabolitleri idrar yoluyla atılmaktadır ve dolayısıyla, şiddetli böbrek yetmezliğinde metabolitlerin birikmesine bağlı olarak advers olaylann görülmesindeki artmış risk olasılığı göz ardı edilememektedir. Pedivatrik popülasyon:5-12 yaş grubundaki astımlı çocuklara 12 hafta boyunca inhalasyon yoluyla günde iki defa 12 veya 24 mikrogram formoterol fiımarat verilerek yapılan bir çalışmada; değişime uğramaksızın idrarla atılan formoterol miktarı, ilk dozdan sonrakine kıyasla %18 ile %84 arasında değişen oranda artmıştır. Çocuklardaki birikim, erişkin hastalardakİnden fazla olmamış ve %63 ile %73 arasında değişen bir oranda artmıştır (bkz. Emilim). İncelenen çocuklarda verilen formoterol dozunun yaklaşık %6'sı, değişmemiş formoterol olarak idrarda bulunmuştur. Budesonidin farmakokinetiği pediyatrik popülasyonda çalışılmamıştır. Ancak, diğer inhale budesonid ürünlerine dair veriler, 3 yaşın üzerindeki çocuklarda beden ağırlığına normalize edilen kürensin, yetişkinlere kıyasla yaklaşık %50 daha yüksek olduğunu göstermektedir. Geriyatrik popülasvon:Formoterolün ve budesonidin yaşlı hastalardaki farmakokinetiği incelenmemiştir. Cinsiyet:Formoterolün farmakokinetiği, hastaların kilosuna göre düzeltildikten sonra erkeklerle kadınlar arasında istatistiksel anlamlılığa sahip bir fark göstermemiştir. 5.3. Klinik öncesi güvenlilik verileri Mutajenisite: FormoterolDeneysel bitiş noktaları geniş bir alanı kapsayan mutajenik etki testleri formoterol ile yapılmış; hiç birin vitroin vivotestte genotoksik etki bulunmamıştır.BudesonidBir diziin vitroin vivomutajenisite testinde budesonidin mutajenik potansiyele sahip olmadığı gösterilmiştir.Karsinojenisite:FormoterolSıçanlarda ve farelerde yapılan iki yıllık çalışmalarda, herhangi bir karsinojenik potansiyel görülmemiştir.Çok yüksek dozlarla muamele edilmiş erkek farelerde selim adrenal subkapsüler hücre tümörleri görülme sıklığı hafifçe yüksek bulunmuştur. Ancak bu bulgu, yüksek dozlarda dişi genital organındaki selim düz kas tümörlerinin ve her iki cinsiyette görülen karaciğer tümörlerinin görülme sıklığında artış şeklinde patolojik değişikliklerin olduğu ikinci bir fare çalışmasında görülmemiştir. Düz kas tümörleri, beta-agonistlerin sıçanlarda yüksek dozlarda bilinen bir etkisidir. Çeşitli doz aralıklarında sıçanlarda yapılan iki çalışmada, mezovariyal leyomiyomlarda artış görülmüştür. Bu selim neoplazmalar sıçanların beta2-adreneıjik ilaçların yüksek dozları ile uzun süreli tedavisinde genellikle görülürler. Över kistleri ve selim granulosa/tekal hücreli tümörlerde de artış görülmüştür; beta-agonistlerin sıçanlarda överlere, çok muhtemelen kemiricilere has olan, etkileri olduğu bilinmektedir. Daha yüksek dozların kullanıldığı birinci çalışmada bildirilen diğer birkaç tip tümör, kontrol grubundakilere benzer sıklıkta görülmüş ve daha düşük doz kullanılan çalışmalarda görülmemiştir. Tümör sıklıklarının hiçbiri ikinci çalışmada kullanılan en düşük doz (insanlarda formoterolün tavsiye edilen maksimum dozundan beklenenden 10 kat daha yüksek sistemik düzeye yol açan bir doz) da istatistiksel olarak anlamlı bir dereceye yükselmemiştir. Bu bulgulara ve mutajenik potansiyelinin olmamasına dayanarak, formoterolün terapötik dozlarda kullanımının karsinojenik bir riski olmadığı hükmüne varılmıştır. BudesonidOral yolla uygulanan budesonidin, günde 25 mikrogram/kg/gün doz düzeylerinden itibaren erkek sıçanlarda karaciğer tümörleri insidansım arttırdığı gözlenmiştir. Bu etkiler ayrıca başka steroidleri (prednizolon ve triamsinolon asetonid) içeren bir takip çalışmasında da gözlenmiştir ve kortikosteroidlerin uygulaması ile ilişkili bir sınıf etkisi olduğu kabul edilmiştir.Üreme toksisitesi: FormoterolHayvan deneylerinde formoterolün herhangi bir teratojenik etkisi görülmemiştir. Oral verildikten sonra formoterol emziren sıçanların sütünde tespit edilmiştir.Budesonidİnhale budesonidin sıçan yavrularının beden ağırlığında düşüşe yol açtığı gösterilmiş ancak bildirilen herhangi bir teratojenik etki olmamıştır. Subkutan uygulanan budesonidin sıçan yavrularının yaşama yeteneği üzerindeki azaltıcı etkileri ve budesonidin sıçanlardaki anneye özgü toksisitesi, tavşanlardaki teratojenik potansiyeli ve büyüme geriliği üzerindeki etkileri ve fetal ölüm, glukokortikoidlerin hayvanlardaki bilinen teratojenik potansiyeli ile uyumludur. Budesonidin insanlarda herhangi bir teratojenite ya da üreme toksisitesi gösterdiğine ilişkin bir kanıt yoktur (Bkz. Bölüm 4.6). Sıçanlarda subkutan yolla uygulanan budesonidin fertilite üzerinde advers bir etkisi olmamıştır.6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesi12 mcg formoterol içeren kapsül Laktoz200 mcg budesonid içeren kapsül Laktoz 6.2. GeçimsizliklerBilinen geçimsizliği yoktur.6.3. Raf ömrü24 ayd6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Nemden koruyunuz.6.5. Ambalajın niteliği ve içeriğiFORMEGA 12+200 mcg inhalasyon için toz içeren kapsül, Formoterol 12 mcg inhalasyon için toz içeren 60 İnhaler Kapsül (PVC/PVDC/Alü Blister) ve Budesonid 200 mcg inhalasyon için toz içeren 60 İnhaler Kapsül (PVC/PVDC/Alü Blister) ile karton kutuda 1 adet inhalasyon cihazı ve kullanma talimatı ile beraber ambalajlanır.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve ® Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeli kelerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİİnventim İlaç San. Tic. Ltd. Şti.General Ali Rıza Gürcan Cad. Merter İş Merkezi Bağımsız Bölüm No: 8 Güngören/ İSTANBUL Telefon: 0 850 201 23 23 Faks : 0 212 482 24 78 e-mail: [email protected] 8. RUHSAT NUMARASI(LARI)250/689. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi:06.05.2013 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİmm29 |
İlaç BilgileriFormega 12+200 Mcg İnhalasyon İçin Toz İçeren Kaplı TabletEtken Maddesi: Formoterol Fumarat Dihidrat+budesonid Atc Kodu: R03AC13 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.