Nevakson 500 mg i.m. enjektabl toz içeren flakon Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Antibakteriyel (Antibiyotik) İlaçlar » Diğer BetaLaktam Antibakteriyeller » 3. Kuşak Sefalosporinler » Seftriakson KISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADINEVAKSON 500 mg i.m. enjektabl toz içeren flakon2. ^ ^^TİTATİF BİLEŞİM Etkin madde: H^^ ^^eftriaksona eşdeğer seftriakson sodyum içerir. Yardımcı madde:Yardımcı madde bulunmamaktadır.Yardımcı maddeler için 6. T e bakınız. 3. FARMASÖTİK FORM Enjeksiyonluk çözelti tozu Beyaz ila sanmsı renkli, kristalize toz 4. ^^LLİKLER 4.1. Terapötik endikasyonlar NEVAKSON'a duyarii patojenlerin neden olduğu enfeksiyonlar: - Sepsis, - Menenjit, - Dissemine Lyme borreliosis'i (hast^^n erken ve geç evreleri), - Abdominal enfeksiyonlar (peritonit, safra ve gastrointestinal sistem enfeksiyonlan), - Kemik, eklem, yummak doku, cilt ve yara enfeksiyonlan, - İmmün sistem bozukluğuna b^lı enfeksiyonlar, - Böbrek ve idrar yollan enfeksiyonlan, - Solunum yollan enfeksiyonlan, özellikle pnömoni, kulak-burun-b^az enfeksiyonlan, akut bakteriyel komplike olmayan otitis media, - Gonore dahil olmak üzere genital enfeksiyonlar, - Preoperatif enfeksiyon profilaksisi. 4.2. Pozoloji ve uygulama şekli Pozoloji^^^^^^^a sıklığısüresi:Doktor tarafından başka şekilde tavsiye edilmed^i takdirde; Standart doz Yet^kinler ve 12 ^^^ik çocuklar: Normal olarak günde tek doz 1-2 g (24 saatte bir) NEVAKSON'dur. ^ğır vakalarda veya orta derecede duyarlı organizmaların neden olduğu enfeksiyonlarda günde tek doz, 4 g'a çıkabilir. Tedavi süresi: Tedavi süresi hastalığın seyrine göre değişir. Genellikle bütün antibiyotik tedavilerinde old ^^^az48-72 saat NEVAKSON tedavisine devam edilmelidir. Kombine tedavi: Deneysel k^ullar, birçok gram^^^^^^^^ ^^^lere karşı NEVAKSON ile aminoglikozidler arasında sineıji olduğunu göstermektedir. Bu tür kombinasyonlarda aktivite artışı her zaman kesin olmasa da, Pseudomonas aeruginosa gibi patojenlerin neden olduğu ciddi ve hayatı tehdit eden enfeksiyonlarda NEVAKSON ile aminoglikozidler kombine edilebilinir. Ancak bu iki ilaç, aralanndaki fiziksel geçimsizlik nedeniyle önerilen dozlarda ayn ayn uygulanmalıdır. Menenjit: Bebek ve çocuklardaki bakteriyel menenjitte tedaviye günde tek doz 100 mg/kg (4 g ^^^anizmalar belirlenip duyarlılık testleri yapıldıktan sonra, ger^^^^^^ ^ iyi tedavi sonuçlan tedavi sürelerinde elde edilm^tir: Neisseria meningitidis: 4 gün Haemophilus influenzae: 6 gün Streptococcus pneumoniae: 7 gün Lyme borreliosis: Çocuk ve yet^kinlerde, 14 gün boyunca günde tek doz olarak 50 mg/kg ile en fazla 2 g arasında uygulanır. Gonore: Gonore (penisilinaz üreten ve üretmeyen s^lar) tedavisinde i.m. olarak 250 mg tek doz NEVAKSON önerilir. Preoperatif profilaksi: Enfeksiyon riskine b^^^^ ^^rasyondan 30-90 dakika önce 1-2 g^^^^ ^ doz NEVAKSON uygulaması önerilir. Kolorektal cerrahide, NEVAKSON'un tek ^midazol gibi ^^inin birlikte (ayrı ayn verilerek) uygulanmasının etkili olduğu kanıtlanmıştır. Uygulama şekli:NEVAKSON çözeltisi hazırlandıktan hemen sonra kullanılmalıdır.NEVAKSON, intramusküler enjeksiyon ile uygulama içindir. Bir bölgeye 1 gramdan daha fazla enjeksiyon yapılmaması önerilmektedir. Lidokain çözeltisi kes inlikle intravenöz olarak uygulzmmamalıdır.Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karac^er yetmezl^i: Sadece böbrek fonksiyon bozukluğu olan, karac^er fonksiyonlan nomıal hastalarda NEVAKSON dozunu azaltmaya gerek yoktur. Ancak preterminal safhada böbrek yetmezl^i olanlarda (kreatinin klerensi <10 ml/dakika) NEVAKSON dozu günde 2 g^^ ^aciğer haşan olan, böbrek fonksiyonİEin normal hastalarda NEVAKSON dozunu azaltmaya gerek yoktur. Ciddi böbrek ve karac^^^^ ^^^^^^^nın bir arada görüldüğü vakalarda, seftriakson plazma konsantrasyonlan düzenli olarak kontrol edilmeli ve gerektiğinde doz ayarlaması yapılmalıdır. Diyalize alman hastalara diyaliz sonrasında supleman olarak ilave dozlara gerek yoktur. Ancak bu hastalarda eliminasyon oranı değ^m^ olabilec^inden, doz ^^^adığmı belirlemek için serum konsantrasyonları kontrol edilmelidir. Pediyatrik popülasyon: Yenid^an, bebek ve 12 çocuklarda: doz şeması günde tek dozda uygulanır. Yenid^anlar (14 günl^e kadar): Günde tek doz 20-50 mg/kg vücut günlük doz 50 mg/kg'ı aşmamalıdır. Prematüre ve matür bebekler için farklı uygulama gerekli d^ildir. Seftriakson ve intravenöz kalsiyum içeren ürünlerin ^ zamanlı olarak yeni doğanlarda filanımı kontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya bu tirünleri kullanması beklenen) yeni doğanlarda NEVAKSON kullanılmamalıdır (Bkz: 4.3. Kontrendikasyonlar). Bebek ve çocuklar (15 günlükten 12 y^^^^adar); Günde tek doz 20-80 mg/kg. Vücut normal çocuklarda normal yetişkin dozu kullanıhnahdır. Akut bakteriyel komplike olmayan otitis media tedavisi için 50 mg/kg dozunda (1g^şmamak k^uluyla) tek uygulama önerilmektedir (single-shot therapy). Geriyatrik popülasyon: Geriyatrik hastalarda, yet^^^^^^^ ^^^^n dozlar kullanılır. 4.3. Kontrendikasyonlar NEVAKSON sefalosporin sınıfı antibiyotiklere karşı aşın hassasiyeti olan hastalarda kontrendikedir. Penisiline ka^^^ aleijik reaksiyonlann görülebileceğiunutulmamalıdır.Seftriakson veya ilacın içerdiğherhangi birine karşı aşınduyarlılığı olduğkullanımı kontrendikedir.İn vitro çalışayırabildiğzamanlı olarak yenidoğanlardaiçeren intravenöz ürünleri kullanan (veya bu ürünleri kullanması beklenen) yenidoğanlarda seftriakson kullanılmamalıdır.4.4. Özel kullanım uyarılan ve önlemleriD^er sefalosporinlerde olduğolduğu bilinmeyen ya da daha önceden alerjik reaksiyon geçirmeyen k^ilerde dahi ölümcül olabilen anafilaktik reaksiyonlar bildirilm^tir.NEVAKSON gibi sefalosporin sınıfı antibakteriyel ilaç kullanan çanemi olgulan gözlenmiştir.Seftriakson tedavisi sırasında anemi görülürse sefalosporine bağlı anemi tanısı gözbulundurulmalıdır ve hastalığın etyolojisi tespit edilene kadar tedavi^^^lıdır.^^re (CDAD)antibakteriyel ajanlann kullanımı ile bildirilmişkolonun normal florasını değ^yol açmaktadır.C.difficile, CDAD gel^^^^^ ^ ^ Esinlerini meydana getirmektedir.Bu enfeksiyonlar antimikrobiyal tedaviye dirençli old^^^^^^^^^omi yapılmasınıgerektirebild^inden, C.difficile'insuşlan artan morbidite vemortaliteye neden olabilmektedir. Antibiyotik kullanımının ardından diyare görülen tüm^^^^^^biyal maddelerin uygulanmasınınardından iki aya kadar görülebildiğ^^^^^ıbbi anamnez önemlidir.^er CDAD'dan şüpheleniliyor veya bu durum d^^^anmış ise, dorudan C. difficile'ye yönelik olmayan antibiyotik tedavisinin kesilmesi gerekebilir. Klinik olarak gerekli olması durumunda gerekli sıvı ve elektrolit yönetimi, protein desteğyapılmalıdır.Antibiyotik^^^^^embranöz vakaları seftriakson kullanımındabildirilm^^^^^^ ^anlı diyare görüldüğsonlandınimalıdır.Gastrointestinalbir hastalığı olan veya daha önce kolit hikayesi olanolunmalıdır. Diğuzun süre kullanılması duyarlı olmayan organizmaların(EnterococcusCandidatürleri gibi) gel^mesine yol açabilir.Günümüzde bilimsel verilerde, seftriakson veya kalsiyum içeren çözeltilerle veya d^er kalsiyum içeren ürünlerle tedavi edilen neonatlar haricindeki hastalarda herhangi bir intravasküler çökelti bildirimi olmamıştır. Ancak, seftriakson farklı infuzyon yollanndankanştınlarakverilmemelidir (Bkz. 4.3 Kontrendikasyonlar).D ^^^ ^^yarlı olmayan mikroorganizmalann nedenolduğ^^ılaşılabilinir.Önerilenden daha yüksek doz uygulanan vakalarda, safra kesesi ultrasonografisinde safrataşını düşündüren gölgeler belirlenmiştamamlanması veya ara verilmesi sonucu kaybolan kalsiyum seftriakson çökeltileridir. Bu bulgulara, nadiren semptomlar da ^lik edebilir. Semptomatik vakalarda, cerrahi olmayan, konservatif tedavi önerilmektedir.Semptomatik vakalarda NEVAKSON tedavisinin sonlandınimasına hekim karar verir.hastalarda safra tıkanmasına bağlı olması muhtemeltit vakalan nadiren bildirilmiştir. Hastalann çoğunda, daha önceden uygulanmış majör bir tedavi, şiddetli hastalık ve tam parenteral beslenme gibi safra stazı ve safra tortusu gibi durumlar oluşveya kofaktör rolü gözardıedilmemelidir.Yenid^an, bebek ve çocuklarda NEVAKSON'^ ^ etkinliğiPozoloji veUygulama Şekli bölümünde açı^^^^^^^^iştir. Çalışmalar, diğersefalosporinlerin old uğu gibi, seftriaksonun da bilirubini serum albüminindenayırabildiğ^^^^nile tedavisi sırasında bukullanılmamalıdır. Uzuntablosu düzenli olarzık kontrol edilmelidir. Duyarlı kişşın duyeırlılık rezıksiyonlangel^ebilir.Tanı testleri üzerindeki etkisi:NEVAKSONtedavisi gören hastalarda Coombs testi nadiren de olsa yalancı pozitiflikuğgalaktozemi testinde yalancışidrarda glikoz tayini için kullanılan enzimatik olmayan testlerde de yalancı pozitif sonuç alınabilir. Bu nedenle,tedavisi sırasında idrarda glikoz tayini enzimatik testlerle yapılmalıdır.Pediyatri:Term ve preterm bebeklerin akc^er ve böbreklerinde ölümcül olan seftriakson-kalsiyum çökeltileri bildirilm^tir. 28 günden büyük hastalarda seftriakson ve kalsiyum içeren ürünler ardışık olarak kullanılabilir.Bu durumda infüzyon yolu uygun sıvılar verilerek iyice yıkanmalıdır. Seftriakson hiçbir^ grubunda intravenöz kalsiyum içeren solüsyonlarla aynı anda bir Y kullanılarak verilmemelidir. Seftriakson Ringer ve Hartmann solsulandınhnamalı veya karıştırılmamalıdır. iiirünler arasında veya intramusküler seftriakson ile intravenöz veya oral kalsiyumarasındaki etkileşim konusunda henüz yeterli bilgi bulunmamaktadır.Bu tıbbi ürün her birgöz önünde bulundurulmalıdır.4.5.D^^^^ ile etkileşimler ve d^er etkil^im şekilleriŞ^^^^^ ^^^mid) aynı anda uygulanması sonucu herhangi bir böbrek fonksiyon bozukluğuna rastlanmamıştır.^^^ toksisitesini artırdığına ilişkin bir bulguyoktur. NEVAKSON uygulamasının ardından alkol alındığında disülfiram benzeri etkiler gözlenmem^tir. Seftriaksonun kimyasal yapısında diğer bazı sefalosporinlerde bulunan, etanol intoleransı ve kanama sorunlanna neden olabilen N-metiltiotetrazol bulunmaz. NEVAKSON'un eliminasyonu probenesid ile etkilenmez. In vitro bir çalışmada, kloramfenikol ve seftriakson kombinasyonunun antagonist etki gösterd^^^ ^^^^anmıştır. Literatür raporlanna göre, seftriakson amsakrin, vankomisin, flukonazol ve aminoglikozidlerle geçimsizdir. Çökelti ol^abilec^inden; NEVAKSON flakonlan sulandırmak veya sulandmimış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içeren çözücüler kullanmayınız. Aynca, NEVAKSON aynı IV uygulama hattında kalsiyum içeren çözeltilerle kanştmidığında da seftriakson-kalsiyum çökeltisi meydana gelebilir. NEVAKSON bir Y-bölgesinden parenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmak üzere ^ zamanlı olarak kalsi)aım içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak, neonatlar dışındaki hastalarda, NEVAKSON ve kalsiyum içeren çözeltiler infüizyonlar arasında infiizyon hatlarmın uygun bir sıvıyla çok iyi yıkanması şartı ile, birbirinin ardından sıralı olarak uygulanabilir. NEVAKSON tedavisi gören hastalarda Coombs testi nadiren de olsa yal^^^ ^zitiflik verebilir. D^er antibiyotiklerde olduğu gibi NEVAKSON da galaktozemi testinde yalancı pozitif sonuca neden olabilir. Benzer şekilde, idrarda glikoz tayini için kullanılan enzimatik olmayan testlerde de yalancı pozitif sonuç alınabilir. Bu nedenle, NEVAKSON tedavisi sırasında idrarda glikoz tayini enzimatik testlerle yapılmalıdır. Seftriakson hormonal kontraseptiflerin etkinl^ini istenmeyen biçimde etkileyebilir. Sonuç olarak, tedavi sırasında veya tedaviyi takip eden iUc ay destekleyici ve hormonal olmayan kontraseptif önlemlerin kullanılması önerilmelidir. 4.6. Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi: B Çocuk Olunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Çocuk d^^^^ ^^^^^^^^^ulunan kadınlarda NEVAKSON kullanımına ilişkin klinik veri mevcut d^ildir. kontraseptif ilaçlann etkinliği üzerinde ters etki gösterme olasılığı bulunmaktadır. Bu nedenle, hastalara seftriakson tedavisi sırasında veya tedaviyi takip eden ilk ay destekleyici ve hormonal olmayan kontraseptif önlemlerin kullanılması önerilmektedir. Gebelik dönemi Seftriakson plasenta engelini ^ar. İnsanda gebelikte kullanımının güvenirliliği henüz kesinl^mem^^^^^^ üreme çalışmalan embriyotoksisite, fetotoksisite, teratojenisite veya doğumda, perinatal ve postnatal gel^imde erkek veya d^i fertilitesinde olumsuz etkiler göstermem^tir. Primatlarda embriyotoksisite veya teratojenisite gözlenmem^tir. Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemi Seftriakson anne sütüne küçük miktarlarda da olsa geçt^i için, emziren annelerde bu durumun göz önünde bulundurulması önerilmektedir. Üreme yetendi /Fertilite : İntravenöz yolla uygulanan ve 586 mg/kg/gün'e kadar olan seftriakson dozu sıçanlarda üreme yeteneğini bozmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkilerKainin motorlu t^^^^ üzerinde olumsuz etkisi olduğuna dair birveri bulunmamaktadır. NEVAKSON, bazen sersemlik veya b^ dönmesine yol açabild^i için motorlu t^^^^ ^^me kullanımını etkileyebilir. 4.8. İstenmeyen etkiler Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek ^1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). NEVAKSON kullanımı sırasında kendiliğinden veya ilacın kesilmesiyle ortadan kalktığı gözlenen yan etkiler ^irtilmiştir. Enfeksiyonlar ve enfestasyonlar Seyrek: Genital bölgede mikoz D^^ik bölgelerde maya, mantar veya d^er dirençli organizmalarla görülen süperenfeksiyonlar. Kan ve lenf sistemi hastalıklarıSeyrek: Nötropeni, eozinofili, lökopeni, granülositopeni, hemolitik anemiyi de içerenanemi, trombositopeni, protrombin zamanında hafif uzama.Ç^^ ^^^^ksyon bozukluklanÇ ^^^ ^lam 20 g veya daha yüksek dozlannuygulanmasmdan sonra bazı tek tük agranülositoz vakaları500/mmhastalıklarıSeyrek: Anafilaktik (örn. bronkospazm) veya anafilaktoid reaksiyonlarSinir sistemi hastalıklarıSeyrek: B^ ^^^^ebaşdönmesiGastrointestinal hastalıklarıYaygın: Yumuşak dışkı ya da ishal, bulantı, kusmaSeyrek: Stomatit ve glossit. Bu yan etkiler genellikle hafiftir ve te^^^^^^^^da veya tedavinin sonlamasmın ardından çoğunlukla kaybolurlar.Çok seyrek (izole vakalar): Psödomembranöz kolit (ç oğClostridium difficile'nin^ğ^^^ ^fra kanalının kasılmasın^^^elişir). Bu nedenle,antibakteriyel tedaviye b^^^^ safra hastalığı ihtimali gözönündebulundurulmalıdır.Hepato^^^^^^^ ^^talıklarıSeyrek: Karac^^^^ ^^^^krinde artış (AST, ALT, alkalin fosfataz) Özellikle önerilen stardart dozun üzerinde ilaç alan k^ilerde seftriakson-kalsiyum tuzu çökelmesi gözlemlenm^^^^^^ ^^^^ektif çalışinsidansında değ^insidansının azalması beklenmektedir. Genelde aa^,bulantı, kusma gibikliniksemptomlarsonlandmldığında çökelme ortadan kalkmaktadır.Deri ve deri altı doku hastahklanYaygın olmayan: Makülopapülar raş^^^^^^^lan veya, aleijikdermatit,^&er, ödem.Çok seyrek: İzole vakalarda, eritema multiforme, Stevens Johnson sendromu veya Lyell's sendromu / toksik epidermal nekrolizBöbrek ve idrar hastalıklarıSeyrek: Serum kreatininde artış, oligüri, glikozüri, hematüri.Çok seyrek: İ^ğşından büyük, jâiksek doz (öm.80mg/kg/gün) veya toplam 10 g'ı aşgösteren (öm. sıvı kısıtlamaları, yatağvs) çocuklarda renal presipitasyonbildirilm^tir. Ancak, ilaç kesild^i taktirde presipitasyon ortadan kalkar. Bu olaya böbrek yetmezl^i ve anürinin ^lik ett^i gözlenm^tir. Genel bozukluklar ve uygulama bölgesine il^^^^ ^^talıkları Seyrek: At^, rigor, flebilit ve IV uygulamaya b^^^^ bölgesinde ağn.M azenjeksiyon uygulaması ile minimum düzeyeindirilebilir.Lidokain çözeltisi olmadan intramüsküler enjeksiyon ^^hdır. Ar^^^^^malar: Kalsiyum ile etkil^im 4.9. Doz ^ tedavisiDozveya diyare görülebilir. İlaç konsantrasyonu hemodiyalizveya periton diyaliziyle azaltılamaz. Spesifik bir antidot bulunmamaktadır. Doz aşımı tedavisi semptomatik olmalıdır.5.farmakoloJk özelLkler5.1. Farmakodinamik özelliklerFarmakoterapötik grup: D^er beta-laktam antibiyotikleri (3. K^ak sefalosporinler) ATC kodu: J01DD04 Seftriakson, hücre duvan sentezini inhibe ederek bakterisid etki gösterir. Seftriakson,te kısmında in vitro etkilidir.Seftriakson, gram-pozitif ve gram-negatif bakterilerin penisilinaz vesefalosporinazlanna, çoğ^bildir. Seftriakson aş^^akimikroorganizmalara ka^^^m vitro ve klinik enfeksiyonlarda etkilidir (Endikasyonlan bölümüne bakınız).Gram-pozitif aeroblar:Metisiline duyarlıStaphylococcusAyarlı koagülaz-negatifstafilokoklar1 (S. epidermisStreptococcus pyogenes (ApStreptococcus agalactiaePPStreptococcus viridans^, Streptococcus bovis, Streptococcus pneumoniae^1: Hem in vitro,in vivoStaphylococcusda dahilolmak üzere, sefalosporinlere ka^^^ Genel olarak Enterococcus faecalis,Enterococcus faeciumListeria monocytogenesde dirençlidir.Metisiline dirençli koagülaz negatif Staphylococcus(S. epidermidisgibi) d^al olarak dirençli organizmalardır.Gram-negatif aeroblar:+Acinetobacter türleri (Acinetobacter lwoffi, Acinetobacter anitratusA. baumanii]*, Acinetobacter calcoaceticus)1Borrelia burgdorferi, CapnocytophagaCitrobacter(Citrobacter diversus [C. amalonaticusCitrobacter freundii**), Escherichia coli1(Klebsiella oxytoca, Klebsiellapneumoniae**), Moraxella catarrhalis1Morganella morganii1Neisseria meningitidis1(Proteus mirabilis1Providentia rettgeri*, ProvidentiaSalmonella typhi, SalmonellaSerratia(Serratia marsescens*), SerratiaShigellaVibrioYersinia enterocolitica, Yersiniatürleri (d^er)1: Hem in vitro,in vivoolarak seftriaksona duyarlılık göstermiş olan türler * Bu türlerin izole edilen bazı suşlan, özellikle kromozoma! p-laktamaz üreterek seftriaksona direnç göstermektedir.** Bu türlerin izole edilen bazı suşlan, özellikle genişletilmiş spektrumlu ve plazmide b^^ P-laktamaz üreterek seftriaksona direnç göstermektedir. +: Bir veya birden fazla Avrupa Birliği bölgesinde yüksek direnç oranlarının gözlendiği türler, mikroorganizmalann duyarlı olup olmama olasılığı konusunda tahmini bir kılavuz niteldi t^^^^^tadır. Not: Yukandaki organizmalann, amino- ve üreido-penisilinler, eski sefalosporinler ve aminoglikozidler gibi d^er antibiyotiklere ka^^^ gösteren birçok suşu, seftriaksona duyarlıcUr. Treponema pallidum^çalışmalar ve hayvan deneylerindeduyarlı bulımmuştur. Klinik çalışmalar, primer ve sekonder sifilizin seftriakson tedavisine iyi cevap verd^^^^^ ^^^^a dışında, klinikte izole edilen P.Aeruginosa+s^^^^ ^^^^^na dirençlidir.Listeria monocytogenes, MycoplasmaStenotrophomanas maltophilia, Ureplasma urealyticum, Chlamydiatürleri de seftriaksona d^^^^ organizmalardır.Anaerob organizmalar:BacteroidesClostridium türleri^ (C. difficileFusobacterium nucleatum, FusobacteriumGaffkia anaerobica (peptococcus), Peptostreptococcustürleri1.1: Hem in vitro,in vivoolarak seftriaksona duyarlılık göstermiş olan türler* Bu türlerin izole edilen bazı suşlan, P-laktamaz üreterek seftriaksona direnç göstermektedir. Not: P-laktamaz üreten BacteroidesB. fragilis)Clostridium difficiledirençlidir.Sınır değerleri:Seftriaksona duyarlılık tayini, disk difiizyon testi, agar veya besiyeri dilüsyon testi gibi, National Committee for Clinical Laboratory Standards (NCCLS) (Klinik Laboratuvar Standartlan Ulusal Komitesi) tarafmdan önerilen standart teknikler kullanılarak yapılabilir. ^^leri NCCLS tarafından bildirilmiştir: 30 mg/L'lık ilaç konsantrasyonu kullanılarak bildirilen değerler mg/L (MIC testi) veya mm'dir (disk difüzyon testi) Klinik Laboratuvar Standartlan Ulusal Komitesi (NCCLS)-(M100-S12)
** 2002 Streptococcus viridansgrubu sınır değerleri (NCCLS M100-S12) <1 (Duyarlı), 2 (Orta derece), ve >4 (Dirençli) olarak belirlenm^tir.Duyarlılık testleri seftriakson diskleri ile yapılmalıdır, çünkü sefalosporin sınıfı disklerle yapılan in vitro testlerde dirençli olduğu bilinen salara ka^ seftriaksonun etkili olduğu görülm^^^^ ^^^^ümadığı ülkelerde alternatif olarak DIN, ICS veya d^^^^ ^^^^^^^^^^^^uyarlılık testleri kullanılabilir. 5.2. Farmakokinetik özellikler Genel özellikler Emilim:İntramüsküler, tek doz 1 g'lık uygulamadan sonraki 2-3 saat içinde ul^an maksimum plazma konsantrasyonu 81 mg/litre'dir.Bolus intravenöz enjeksiyondan sonra ortalama pik konsantrasyonlar, 500 mg'lık dozu takiben yakl^^^^ ^ takiben yaklaşık olarak 200 mg/l'dir; 30 diikikalık 2 gramlık infuzyondan sonra ortaleima 250mg/l'lık düzeyler elde edilir. %1.06'lık lidokainde 500 mg seftriaksonun intramüsküler enjeksiyonu, 1 saat içinde 40-70 mg/l'lık ortalama pik plazma konsantrasyonları oluşturur. İntramüsküler enjeksiyondan sonra biyoyararlanım %100'dür. D^^ım:Seftriaksonun hacmi 7-12 litredir. Seftriakson 1-2 g^^^^ ^^^an sonraakc^er, kalp, safra yolu/karac^er, tonsillalar, orta kulak ve nazal mukoza, kemik, serebrospinal, plevra, prostat ve sinovyal sıvılannın da dahil olduğu 60^^^ ^^rnde doku ve vücut sıvısında, etken patojenlerin çoğunun minimum inhibisyon konsantrasyonunun üzerinde ve 24 saatten uzun sürelerle mükemmel penetrasyon s^^^^^adır. intravenöz uygulamada, seftriakson interstisyel sıvıya süratle difiize olur ve duyarlı organizmalara ka^^^ ^akterisid konsantrasyonlar ^^^e bakınız). NEVAKSON'un farmakokinet^i, büyük ölçüde konsantrasyona b^^^^ ^^^ak serum albüminine ^^n plazmada serbest (bağlı olmayan) fraksiyonu, terapötik konsantrasyon aralığının çoğolarak %5'tir ve 300 mg/l'lik konsantrasyonlarda %15'e yükselir.Seftriakson albümine geri dön^ümlü olarak oranı ilacm kandakikonsantrasyonu yükseldikçe azalır; örneğkonsantrasyonlannda %95, 300 mg/litre'lik plazma konsantrasyonlarında ise %85^^ak interstisyel sıvıdaki serbestseftriakson oranı plazmadakine göre daha yüksektir.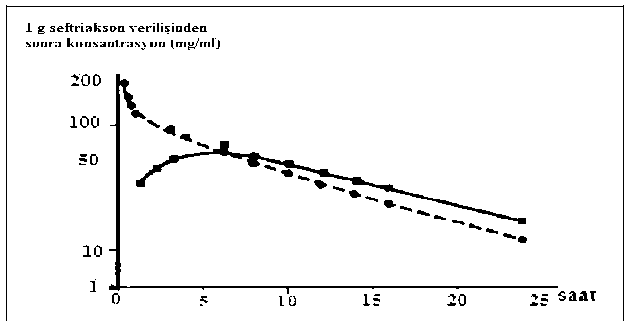 Seftriakson, yenid^an, bebek ve çocuklarda enflamasyonlu meninkslere penetre olur. Bebek ve çocuklarda 50-100 mg/kg i.v. seftriakson enjeksiyonunu izleyen 24 saat içinde,
Seftriakson, yenid^an, bebek ve çocuklarda enflamasyonlu meninkslere penetre olur. Bebek ve çocuklarda 50-100 mg/kg i.v. seftriakson enjeksiyonunu izleyen 24 saat içinde, serebrospinal sıvıda seftriakson konsantrasyonu 1.4 mg/litre'nin üstündedir.sıvıda ortalama 18 mg/1 olan doruk konsiintrasyona i.v. enşık 4 saatdüzeyleri, bakteriyel menenjitteplazmakonsantrasyonunun %17'si, aseptik menenjitte ise %4'ü kadardır. Menenjitli50 mg/kg'lık uygulamayla 2^^^^^^^^nal sıvı konsantrasyonlan, menenjitte en sık rastlanan etken patojenlerinMİ^erlerinin birkaç kat üzerindedir.Seftriakson plasentadan geçer ve anne sütünde d^ük konsantrasyonlarda bulunur. Biyotransformasyon:florası tarafindan inaktif metabolitlere dönüştürülür.Eliminasyon:^ftriaksonun %50ı
dHastalardaki karekteristik özellikler: Y^^^^^talzır:^^Izıma eliminasyon yarı ömrü genç
yet^kinlerle küçük bebeklerde ortalama eliminasyon yaniş^^^^^^^^^^ğmda 2-3 kez daha uzundur.Böbrek ve karacmer yetmezlmi olan hastalar:eliminasyon yan ömrü hafif düzeyde uzar. Tek başına böbrek fonksiyonlannda bozukluk varsa seftriaksonun safra yoluyla atılımı ve tek başına karaciğer fonksiyonlannda bozukluk varsa böbrek yoluyla atılımı artar.
|
İlaç BilgileriNevakson 500 mg i.m. enjektabl toz içeren flakonEtken Maddesi: Seftriakson sodyum Atc Kodu: J01DD04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.