Macugen 0.3 Ng/90 Mcg Intravitreal Kullanim İçin ... Kısa Ürün BilgisiDuyu Organları » Göze Uygulanan İlaçlar » Oküler Damar Bozukluğu Ajanları » Antineovascularisation Ajanlar » Pegaptanib 'i1 KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMACUGEN 0.3 mg/90jal intravitreal kullanım için enjektör2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Pegaptanib sodyum 0.3 mgYardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız3. FARMASÖTİK FORMEnjeksiyonluk çözelti.Çözelti berrak ve renksiz ile hafif san arası renkte çözeltidir. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasy onlarMACUGEN, eksüdatif (yaş) yaşa bağlı maküler dejenerasyonun (AMD) tedavisi için endikedir (bkz bölüm 5.1 Farmakodinamik özellikler).4.2 Pozoloji ve uygulama şekli Pozoioji/ uygulama sıklığı ve süresi:MACUGEN, yalnızca intravitreal enjeksiyon konusunda deneyimli bir göz doktoru tarafından uygulanmalıdır.MACUGEN 0.3 mg, uygun göze her altı haftada bir (yılda 9 enjeksiyon) intravitreal enjeksiyonla uygulanmalıdır. MACUGEN ile tedavi gören hastalarda, intravitreal uygulamayı takiben göz içi basıncında geçici yükselmeler görülmüştür. Bu nedenle optik sinir başı perfüzyonu ve göz içi basıncı yükselmeleri takip edilmelidir. Ayrıca enjeksiyon uygulamasını takip eden iki tafta içerisinde hastalar, vitröz hemoraji ve endoftalmit için yakinen gözlenmelidir. Hastalar, belirtilen durumlar ile alakalı herhangi bir belirti gözlemledikleri takdirde zaman kaybetmeden bildirmeleri konusunda yönlendirilmelidir, (bkz bölüm4.4) Tüm parenteral ilaç ürünlerinde olduğu gibi, MACUGEN uygulama öncesinde partikül madde ve renk değişikliği bakımından görsel olarak incelenmelidir. İntravitreal uygulama gerçekleştirilmeden önce hastaların aşırı duyarlılık reaksiyonlarıyla ilgili medikal geçmişleri araştırılmalıdır (bkz. bölüm 4.4 Özel kullanım uyanları ve önlemleri).
| i
ı Klinik deneylerde, emniyeti en iyi hale getirmek için enjeksiyon prosedürü cerrahi amaçlı el dezenfeksiyonu, steril eldiven, steril bir örtü ve steril gözkapağı spekulumu (veya eşdeğeri) kullanımını içeren ve gerekli ise steril parasentez mevcudiyetinde kontrollü aseptik koşullar altında gerçekleştirilmelidir. Enjeksiyon öncesinde yeterli anestezi, geniş spektrumlu topikal mikrobisidler, antibiyotik damlalar ve povidon-iyot ile yıkama (veya uygun bir alternatif) uygulanmalıdır.. Povidon-iyoda karşı alerjisi bulunan veya tolere edemeyen hastalar için, tedavi eden doktorun prosedürden 3 gün önce topikal geniş spektrumlu antibiyotik kullanması uygun olabilir. Tedavi eden doktorların enjeksiyon öncesinde parasentez yapması önerilmemektedir. Geniş spektrumlu antibiyotik damlalarına enjeksiyon sonrasında 2 gün devam edilebilir. Ardışık iki doz MACUGEN enjeksiyonundan sonra, 12. haftadaki kontrol muayenesinde fayda sağlanamamışsa ( görüş keskinliğinde 15 harften daha az kayıp) MACUGEN tedavisinin durdurulması veya kesilmesi düşünülmelidir. Uygulama şekli:MACUGEN tedavisi yalnızca intravitreal enjeksiyon içindir ve intravitreal enjeksiyon deneyimi olan oftalmolog tarafından uygulanmalıdır.Uygulama öncesi enjektör plastik muhafazadan çıkartılmalı ve kapağı çevirerek açılmalıdır. Preparatın uygulanabilmesi için luer lock adaptörüne 27 veya 30 G x 14 inch iğne ucu takılmalıdır (bkz. MACUGEN Birleştirme Talimatları). Kabarcık varlığı ithimaline karşı enjektör iğne ucu yukarıyı gösterecek şekilde tutularak kontrol edilmelidir. Kabarcık varsa» iğnenin ucuna gelene kadar, parmak ucuyla nazikçe enjektöre vurulmalıdır. Takiben piston çubuğu kabarcık enjektörden çıkana kadar irilmelidir. Piston çubuğu geri çekilmemeli, veya piston çubuğunun ucunda bulunan, tapadaki çubuğa en yakın işaret, enjektörün üzerinde bulunan dozaj çizgisini geçecek şekilde ittirilmemelidir. Gerekli dozun uygulandığından emin olmak için hemen enjeksiyon öncesi, piston çubuğunun ucunda bulunan tapadaki çubuğa en yakın işaret, enjektörün üzerinde bulunan doz çizgisi ile hizalanmahdır. Bu noktada tüm enjektör içeriği enjekte edilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:MACUGEN, karaciğer yetmezliği olan hastalarda incelenmemiştir, (bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Bu popülasyonda özel bir değerlendirmeye gerek yoktur (bkz. bölüm 5.2 Farmakokinetik özellikler).Böbrek yetmezliği:Macugen kreatınin klerensi <20 ml/dk olan hastalardaki kullanımı ile ilgili yeterli bilgi yoktur. Kreatinin klerensi >20 ml/dk olan hastalarda özel bir değerlendirme yapmaya gerek yoktur, (bkz. bölüm 4.4 Özel kullanım uyanları ve önlemleri).Pediyatrik popülasyon:MACUGEN 18 yaş altındaki hastalarında kullanılmak üzere incelenmemiştir. Bu nedenle, çocuk ve ergenlerde kullanımı tavsiye edilmez.Geriyatrik popülasyon:Özel bir değerlendirmeye gerek yoktur (bkz. bölüm 5.2 Farmakokinetik özellikler).Cinsiyet:MACUGEN'in plazma konsantrasyonları erkek ve kadın hastalarda benzer bulunmuştur. Özel bir değerlendirmeye gerek yoktur.UYARI:Kullanıma hazır şırınga, ürün hacminde fazlalık içerecek şekilde temin edilmektedir. Enjeksiyon öncesinde, fazla hacmi atmaya yönelik gerekli talimatlar için bölüm 6.6. ya bakınız.4.3 KontrendikasyonlarMACUGEN, aktif veya şüpheli oküler veya perioküler infeksiyon bulunan ya da etkin madde veya yardımcı maddelerden herhangi birine karşı aşınduyarlılığı olduğu bilinen hastalarda kontrendikedir.4.4 Özel kullanım uyarıları ve önlemleriMACUGEN, karaciğer bozukluğu bulunan hastalarda incelenmemiş veya şiddetli böbrek yetmezliği bulunan hastalarda (kreatinin klerensi 30 ml/dak. altında) yeterli olarak incelenmemiştir. Bu nedenle, klinisyenlerin, MACUGEN'i bu hasta popülasyonlarına uygulamadan önce uygun klinik değerlendirmeyi yapmaları gerekir.İntravitreal uygulamalarda beklendiği üzere göz içi basıncında geçici yükselmeler görülebilir. Bu nedenle optik sinir perfuzyonu değerlendirilmeli ve enjeksiyon sonrası göz içi basıncı yükselmeleri uygun şekilde tedavi edilmelidir. MACUGEN enjeksiyonunu takiben hemen ( enjeksiyonun yapıldığı gün) ve gecikmeli intravitröz hemoraji olabilir. İntravitreal enjeksiyon girişimleri endoftalmi riski taşımaktadır. Macugen ile yapılan klinik çalışmalarda enjeksiyon başına endoftalmi insidansı %0.1'dir. Ayrıca, hastalar enjeksiyonu takiben iki hafta endoftalmit için yakın takip edilmelidir. Bu nedenle, MACUGEN uygulanırken, her zaman uygun aseptik enjeksiyon tekniği kullanılmalıdır. Hastalara, endoftalmit olabileceğini gösteren her türlü semptomu gecikmeden bildirmeleri talimatı verilmelidir. Pazarlama sonrası deneyimlerde intravitreal pegaptanib uygulamasından birkaç saat sonra anjioödem dahil anaflaksi/anaflaktoid reaksiyon gösteren vakalar bildirilmiştir. Bu vakalarda Macugen'in, enjeksiyon hazırlık işleminde yer alan diğer ilaçların veya diğer faktörlerin direk ilişkisi bulunmamıştır. Pegaptanib sodyum tedavisinin sırası ile her iki göze uygulaması çalışılmamıştır. Pegaptanib sodyumun güvenlilik ve etkililiği 2 yıldan uzun süre için değerlendirilmemiştir. Not: Kullanıma hazır şırınganın bütün hacminin enjekte edilmesi ciddi advers olaylar ile sonuçlanabilir. Bu nedenle enjeksiyon öncesinde fazla hacim atılmalıdır (bakınız bölüm 4.8 ve 6.6). 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriMACUGEN ile ilaç etkileşim çalışmaları yapılmamıştır.MACUGEN nükleazlar tarafından metabolize edilir ve bu nedenle sitokrom P450 aracılı ilaç etkileşimleri olası değildir. MACUGEN'i tek başına ve PDT (fotodinamik tedavi) ile kombinasyon halinde alan hastalar üzerinde yapılan iki erken dönem klinik çalışma MACUGEN'in plazma farmakokinetiğinde belirgin bir fark ortaya çıkarmamıştır. 4.6 Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: BÇocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Yeterli veri bulunmamaktadır..Gebelik dönemiHayvanlarda yapılan çalışmalar yetersizdir ancak yüksek dozlara maruz kalındığında üreme sistemi üzerine toksisite yarattığı görülmüştür.Gebe kadınlar üzerinde MACUGEN ile herhangi bir çalışma yapılmamıştır. İnsanlarda potansiyel riski bilinmemektedir. Pegaptanibin oküler kullanımı sonrası sistemik maruziyetin çok düşük olması beklenir. MACUGEN, yalnızca annede sağlanacak potansiyel faydaların fetüsün maruz kalacağı potansiyel riski mazur göstermesi halinde gebelik döneminde kullanılmalıdır.Laktasyon dönemiMACUGEN'in insan sütüne geçip geçmediği bilinmemektedir. MACUGEN emziren annelere tavsiye edilmemektedir.Üreme yeteneği/FertilitePegaptanibin erkek ve kadınlardaki üreme fonksiyonu ve fertilite üzerine olan etkisi hakkında bilgi yoktur. Pegaptanib farelere 1 -40 mg/kg (tavsiye edilen insan monooküler oftalmik dozu olan 0.3 mg/ göz'ün yaklaşık 7000 katı) intravenöz dozlarında matemal toksisite görülmezken teratojeniteye ait bir kanıt elde edilmemiştir. Pegaptanib farelerde plasentaya geçer.4.7 Araç ve makine kullanımı üzerindeki etkilerHastalar, intravitreal enjeksiyon ile MACUGEN uygulandıktan sonra geçici bir süre bulanık görebilirler. Bu durum düzelene kadar araba veya makine kullanmamaları gerekir.4.8 İstenmeyen etkilerMACUGEN, bir yıla kadar süren kontrollü çalışmalar kapsamında, 0.3, 1.0 ve 3.0 mg dozlarda yaklaşık 892 hastaya uygulanmıştır (toplam enjeksiyon sayısı = 7545, ortalama hasta başına enjeksiyon sayısı = 8.5). Her üç doz da benzer bir güvenlilik profilini paylaşmaktadır. Önerilen 0.3 mg dozuna bir yıla kadar maruz kalan 295 hastada (toplam enjeksiyon sayısı = 2478, ortalama hasta başına enjeksiyon sayısı = 8.4), yürütülen çalışmada hastaların % 84'ü araştırmacıya bağlı enjeksiyon prosedürü ile ilgili yan etki yaşarken, hastaların % 3'ü potansiyel olarak enjeksiyon prosedürü ile ilgili ciddi potansiyel yan etki yaşamışlar ve hastaların % l'i potansiyel olarak enjeksiyon prosedürü ile ilgili nedenlerle tedaviyi durdurmayı gerektiren yan etki bildirmişlerdir. Araştırmacılara göre hastaların % 27'si araştırma ilacı ile ilgili olan yan etki yaşamışlardır. İki hasta ( % 0.7) potansiyel olarak çalışma ilacı ile ilgili ciddi yan etki yaşamışlardır. Bu hastalardan birinde aort anevrizması, diğerinde ise retina dekolmanı ve retina hemorajisi ortaya çıkmış ve tedavinin durdurulması gerekmiştir.MACUGEN ile tedavi edilen hastalarda ciddi oküler yan etkiler bildirilmiştir: endoftalmit (12 vaka, %1), retinal hemoraji (3 vaka, <%1), vitröz hemoraji (2 vaka, <%1), ve retina dekolmanı (4 vaka, <%1). Aşağıda tarif edilen güvenlilik verileri 0.3 mg tedavi grubunda 295 hastada potansiyel olarak girişime ve ilaca bağlı yan etkileri özetlemektedir, Advers reaksiyonlar sistem organ sınıfı ve sıklık gruplandırma (çok yaygın (>1/10); yaygın (>1/100 ila <1/10) ve yaygın olmayan (>1/1.000 ila <1/100)); seyrek (>1/10.000 ila <1/.1000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) açısından listelenmiştir. İmmün sistem bozuklukları:Bilinmiyor: Anaflaktik reaksiyonPsikiyatrik bozukluklar:Yaygın olmayan: Kabus, depresyonSinir sistemi bozuklukları:Yaygın: Baş ağrısıGöz bozuklukları:Bu oküler advers reaksiyonların potansiyel olarak MACUGEN tedavisiyle ilgili olduğu (enjeksiyon prosedürü veya çalışma ilacı) ve çoğu zaman da enjeksiyon prosedürüyle ilgili olduğu düşünülmüştür:Çok yaygın: Ön odacık enflamasyonu, göz ağrısı, artan intraoküler basınç, noktalı keratit, yüzen camsı maddeler ve vitröz matlık. Yaygın: Gözde anormal his, katarakt, konjonktival kanama, konjonktival hiperemi, konjonktival ödem, konjonktivit, komeal distrofı, komeal epitel haşan, komeal epitel bozukluğu, komeal ödem, göz kuruması, endoftalmit, oküler akıntı, göz inflamasyonu, gözde tahriş, gözde kaşıntı, gözde kızarıklık, gözde şişlik, gözkapağı ödemi, lakrimasyon artışı, maküler dejenerasyon, midriyazis, oküler rahatsızlık, oküler hipertansiyon, periorbital hematoma, fotofobi, fotopsi, retinal kanama, bulanık görme, görme keskinliğinde azalma, görsel rahatsızlıklar, vitröz ayrılması ve vitröz bozukluk. Yaygın olmayan: Astenopi, blefarit, alerjik konjonktivit, komeal tortular, göz kanaması, gözkapağında kaşıntı, keratit, vitröz kanama ve gözbebeği refleks bozukluğu, komeal aşınma, retinal eksudatlar, gözkapağında pitoz, retinal yara, şalazyon, komeal erozyon, intraoküler basınçta azalma, enjeksiyon bölgesinde reaksiyon, enjeksiyon bölgesinde vesikül, retina ayrılması, komeal rahatsızlık, retinal arter oklüzyonu, retina yırtılması, ektropion, gözde hareket bozukluğu, gözkapağında tahriş, hifema, gözbebeği bozukluğu, iris bozukluğu, oküler ikter, anterior üveit, tortulu göz, irit, optik sinir çöküntüsü, pupiller deformasyon, retinal damar oklüzyonu ve vitröz prolaps . Kulak ve iç kulak bozuklukları:Yaygın olmayan: Meniere hastalığı şiddetlenmesi, vertigo, sağırlıkKardiyak bozukluklar:Yaygın olmayan: PalpitasyonlarVasküler bozukluklar:Yaygın olmayan: Hipertansiyon, aortik anevrizmaSolunum, göğüs bozuklukları ve mediastinal bozukluklar:Yaygın: RinoreYaygın olmayan: Nazofarenjit Gastrointestinal bozukluklar:Yaygın olmayan: Kusma, dispepsiDeri ve deri altı doku bozuklukları:Yaygın olmayan: Kontakt dermatit egzema, saç renginin değişmesi, döküntü, pruritus, gece terlemeleri Bilinmiyor: Anjiyoödem*Kas-iskelet sistemi bozuklukları, bağ doku bozuklukları:Yaygın olmayan: Sırt ağrısıGenel bozukluklar ve uygulama bölgesine ilişkin bozukluklar:Yaygın olmayan: Bitkinlik, üşüme, hassaslık, göğüs ağrısı, grip benzeri hastalıkAraştırmalar:Yaygın olmayan: Gama-glutamiltransferaz artışıYaralanma ve zehirlenme:Yaygın olmayan: Abrazyon374 hasta ( 0.3 mg 128 hasta, 1 mg 126 hasta ve 3 mg 120 hasta) 2 yıl süresince MACUGEN tedavisi almıştır. Bütün güvenlilik verileri 1. yıl güvenlilik verileri ile tutarlı olup yeni acil güvenlilik sinyalleri meydana gelmemiştir. 2 yıla kadar ( 2. yıl toplam enjeksiyon sayısı= 913, 2. yıl ortalama enjeksiyon sayısı= 6.9) 0.3 mg tavsiye edilen dozlar ile tedavi edilen 128 hastada, 1. yılda görülen yan etkiler ile karşılaştırıldığında yan etkilerin sıklığında bir artış olduğu kanıtlanamamamıştır. ¦Pazarlama sonrası deneyim: Pegaptanibin enjeksiyon hazırlama prosedüründe uygulanan çeşitli ilaçlarla birlikte uygulanması sonrasında, nadir olarak anjioödemi de içeren anafilaksi/anafılaktoid reaksiyonlar rapor edilmiştir (bkz. bölüm 4.2 Pozoloji ve uygulama şekli, bölüm 4.4 Özel kullanım uyanları ve önlemleri). Enjeksiyon öncesinde kullanıma hazır şırıngadaki fazla miktarın atılmaması sonucunda göz içi basıncının ciddi şekilde artışı ile ilgili vakalar bildirilmiştir. 4.9 Doz aşımı ve tedavisiKlinik çalışmalarda MACUGEN ile ilgili doz aşımı bildirilmemiştir. Pegaptanib sodyumun tavsiye edilen dozu olan 0.3 mg'ın 10 katma kadar olan dozlar çalışılmış ve ek bir yan etki belirlenmemiştir.5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup; Oküler Vasküler Bozukluk İlaçları ATC kodu: S01LA03MACUGEN, ekstrasellüler Vasküler Endotelyal Büyüme Faktörü (VEGF) 105'e yüksek spesifiklik ve afinite ile bağlanarak aktivitesini inhibe eden pegile edilmiş, değiştirilmiş oligonükleotiddir. VEGF, Yaşa Bağlı Maküler Dejenerasyonun (AMD) neovasküler (yaş) formunun ilerlemesinde katkıda bulunduğu düşünülen anjiyogenez, vasküler geçirgenlik ve inflamasyonu indükleyen, salgılanan bir proteindir. VEGFıss patolojik oküler neovaskülarizasyon ile özellikle ilişkili olan VEGF izoformudur. MACUGEN, normal fizyolojik koşullar altında retinada ve başka yerlerde normal damar gelişiminde kritik bir izoform olan VEGF^ı'e önemli derecede bağlanmaz. Hayvanlarda MACUGEN ile seçici inhibisyonun, patolojik neovaskülarizasyonun bastırılmasında pan-VEGF inhibisyonu kadar ektili olduğu kanıtlanmıştır; ancak MACUGEN normal vaskülatürü ayrı tutarken pan-VEGF inhibisyonu aynı etkiyi göstermemektedir. Retinadaki anti-geçirgenlik ve anti-anjijyojenik etkilerden kaynaklanan, floresan sızıntı boyutu, Koroidal Neovaskülarizasyon (CNV) boyutu ve ortalama toplam lezyon boyutunun büyümesindeki azalmalar, MACUGEN ile tedavi edilen AMD'li hastalarda gösterilmiştir. MACUGEN, yeterli ve iyi kontrollü, çift-kör ve aynı tasarıma sahip iki randomize çalışmada (EOP1003; EOP1004) eksüdatif AMD'li hastalar üzerinde incelenmiştir. Toplam 1208 hasta çalışmaya alınmış ve medyan yaş değeri 77 olan 1190 hastaya tedavi uygulanmıştır (892 MACUGEN, 298 plasebo). Tüm tedavi kollarındaki hastalarda, olası bir 9 toplamından 8.4 ila 8.6 arasında bir ortalama oranda tedavi söz konusu olmuştur. Hastalar, 48 hafta boyunca her 6 haftada bir intravitreal enjeksiyon olarak uygulanan 0.3 mg, 1 mg veya 3 mg MACUGEN ya da kontrol (plasebo) alacak şekilde randomize edilmiştir. Söz konusu iki çalışmaya, tüm lezyon alt tipleri, 12 disk alanına kadar lezyon boyutları ve incelenen gözde başlangıç düzeyinde görme keskinliği 20/40 ve 20/320 olanlar dahil, geniş bir eksüdatif AMD karakteristiği bulunan hastalar alınmıştır. Primer etkinlik sonlandırma noktası, başlangıç düzeyinden 54. hafta değerlendirmesine kadar görme keskinliği 15 harften az kaybolan hastaların oranı olarak tayin edilmiştir. Baskın olarak klasik lezyonlann bulunduğu hastalarda araştırmacıların kararına göre verteporfın fotodinamik tedavisinin (PDT) kullanımına izin verilmiştir. MACUGEN 0.3 mg, her iki çalışmada da primer etkinlik sonlandırma noktası bakımından istatistiksel açıdan anlamlı bir tedavi faydası sergilemiştir. (MACUGEN 0.3mg %70'e karşılık Kontrol %55; p <0.0001). MACUGEN 0.3 mg, başlangıçtaki lezyon alt tipi, lezyon boyutu ve görme keskinliğinin yanı sıra yaş, cinsiyet, iris pigmentasyonu ve başlangıç düzeyi ve/veya öncesinde PDT kullanımından bağımsız olarak tedavi faydası göstermiştir. Genel olarak eşzamanlı PDT kullanımı düşüktür. MACUGEN 0.3 mg ile tedavi edilen hastalara kıyasla (58/294), kontrol (plasebo) tedavi gören daha çok sayıda hasta (75/296) PDT almıştır. 1 mg ve 3 mg doz düzeyleri etkili olmakla birlikte, 0.3 mg doz düzeyinde görülenin üzerinde fazladan bir klinik fayda sergilememiştir. MACUGEN 0.3 mg alan hastaların yüzde altısı, kontrol tedavi gören hastalara kıyasla başlangıç düzeyinden 54. haftaya kadar 15 harften fazla görme keskinliği kazanmıştır (%2, p<0.05). MACUGEN 0.3 mg alan hastaların yüzde otuz üçü başlangıç düzeyinde kalmış veya kontrol tedavi gören hastalara kıyasla 54. haftada görmeleri gelişmiştir (%23, p<0.05). MACUGEN 0.3 mg alan hastalar, altı hafta gibi kısa bir sürede görme keskinliğinde ortalama değişim bakımından tedavi faydası sağlamıştır (MACUGEN 0.3 mg ile -1.53 harfe karşılık Kontrol tedavi ile -4.03 harf; p=0.0069). Bu tedavi faydası 54. haftanın sonunda kadar devam etmiştir (MACUGEN 0.3 mg ile -7.99 harfe karşılık Kontrol tedavi ile -15.03 harf; p<0.0001). MACUGEN 0.3 mg alan hastalar ile karşılaştırıldığında, kontrol tedavi gören hastaların şiddetli görme kaybı (başlangıç düzeyine göre 30 harf veya üzerinde görme keskinliği) yaşama olasılığı iki kat fazla bulunmuştur (%22'ye karşılık %10; p<0.0001). MACUGEN 0.3 mg alan hastaların 54. haftada 20/200 veya daha kötü görme yetisine sahip olma olasılığı kontrol tedavi görenlerden daha düşüktür (%3'e karşılık %56; p< . 0.0001). Eşzamanlı PDT ile birlikte MACUGEN alan sınırlı sayıda hastanın emniyet profili ile tek başma MACUGEN alan hastaların emniyet profili benzer çıkmıştır. MACUGEN ile tedavi edilen hastaların yaklaşık %94'ü (834/892) 65 yaş ve üzerinde ve yaklaşık %62'si de (553/892) 75 yaş ve üzerindedir. Yaşın ilerlemesine bağlı olarak tedavinin etkisinde veya sistemik olarak maruz kalma açısından herhangi bir fark görülmemiştir. Her iki göze aynı zamanda uygulanan MACUGEN tedavisinin emniyeti ve etkililiği incelenmemiştir. MACUGEN immünojenik değildir; MACUGEN dozu uygulanan insanlarda hiçbir anti-MACUGEN IgG antikoru saptanmamıştır. 5.2 Farmakokinetik özellikler Genel özelliklerEmilim:Hayvanlarda, intravitreal uygulama sonrasında MACUGEN gözden sistemik dolaşıma yavaşça absorbe olur. Gözden absorpsiyon hızı, hayvanlarda MACUGEN'in atılımıyla ilgili hız sınırlayıcı adımdır ve insanlarda da böyle olması olasıdır. İnsanlarda, tek göze uygulanan 3 mg dozdan (önerilen dozun 10 katı) sonra MACUGEN'in ortalama ± standart sapma görünen plazma yan ömrü 10 ± 4 gündür. İnsanda tek göze 3 mg doz uygulandıktan sonra 1 ila 4 gün içinde yaklaşık 80 ng/ml ortalama maksimum plazma konsantrasyonu oluşur. Bu dozda, plazma konsantrasyonu altında kalan ortalama alan - zaman eğrisi (E A A (Eğri Altı Alan)) yaklaşık 25 \Lg-saat/mİ'dir. MACUGEN her 6 haftada bir intravitreal yolla uygulandığında plazmada birikim yapmaz. 0.5 mg/göz dozundan düşük dozlarda, MACUGEN plazma konsantrasyonlarının 10 ng/mFyi geçmesi olası değildir.İntravitreal uygulama sonrasında pegaptanibin mutlak biyoyararlanımı insanlar üzerinde değerlendirilmemiştir; ancak, tavşanlarda, köpeklerde ve maymunlarda yaklaşık %70-100 düzeyindedir. Her iki göze birden 3 mg/göz doza kadar MACUGEN alan hayvanlarda, plazma konsantrasyonlannın vitröz hümördekinin %0.03 ila %0.15'i olduğu gözlenmiştir. Dağılım:Farelerde, sıçanlarda, köpeklerde ve maymunlarda intravitröz uygulama sonrasında MACUGEN esasen plazmada dağılır ve çevredeki dokulara geniş ölçüde dağılmaz. Radyoaktif işaretli pegaptanib dozunun tavşanların her iki gözüne intravitreal yolla uygulanmasından yirmi dört saat sonra, radyoaktivite esasen camsı (vitröz) sıvıya, retinaya ve aköz sıvıya dağılmıştır. Radyoaktif işaretli pegaptanibin tavşanlara intravitreal ve intravenöz uygulanmasının ardından, en yüksek radyoaktivite konsantrasyonları (intravitreal doz için göz hariç) böbrekte elde edilmiştir. BivotransformasvonMACUGEN endonükleaz ve ekzonükleaz ile metabolize edilir. EliminasvonTavşanlarda radyoaktif işaretli MACUGEN'in intravenöz ve intravitreal tek dozlanndan sonra, bileşen nükleotid 2-floroüridin plazmada ve idrarda bulunur. Tavşanlarda, pegaptanib ana ilaç ve metabolitleri olarak idrarla atılır. Dogrusallık/Do&rusal olmayan durum:Mevcut değildir. Hastalardaki karakteristik özelliklerGerivatrik hastalar:MACUGEN'in farmakokinetiği 50 ile 90 yaş arası hastalar arasında benzer bulunmuştur (bkz. bölüm 4.2 Pozoloji ve uygulama şekli). Böbrek yetmezliği:Kreatinin klerensinde 70 ml/dak.'dan 30 ml/dak.'ya düşüş EAA (Eğri Altı Alan)'da 2.3 kat artışla ilişkilendirilmiştir. Ancak, önerilen 0.3 mg MACUGEN dozu ile tedavi edilen ve kreatinin klerensi >30 ml/dak. değerindeki hastalar için dozaj ayarlaması gerekli değildir. Farmakokinetik veriler, 0.3 mg dozun , iyi tolere edilen bir doz olan 3 mg ile görülen maruziyeti aşmayacağını göstermektedir (bkz. bölüm 4.2 Pozoloji ve uygulama şekli). Karaciğer yetmezliği:Pegaptanibin farmakokinetiği karaciğer yetmezliği olan hastalarda çalışılmamıştır. Fakat, karaciğer yetmezliği olan hastalarda 10 katına kadar olan dozlar iyi tolere edildiğinden (3 mg/ göz) sistemik maruziyetin iyi tolere edilebilir aralıkta olması beklenir. Bu nedenle, dozaj ayarlamasına veya bu popülasyonda özel bir uyarıya gerek yoktur. 5.3 Klinik öncesi güvenlilik verileriEmniyet farmakolojisi, mükerrer doz toksisitesi, genotoksisite, üreme toksisitesi ile ilgili geleneksel çalışmalara dayalı olarak, Kısa Ürün Bilgilerinin diğer bölümlerinde değinilen konular dışında insanlar açısından özel bir tehlike gözlenmemiştir.MACUGEN dozu uygulanan hayvanlarda hiçbir anti-MACUGEN IgG antikoru saptanmamıştır. MACUGEN ve monomer bileşeni olan nükleotidler (2'-MA, 2'-MG, 2-FU, 2-FC) bir dizi in vitroin vivomiktar tayin sisteminde genotoksisite bakımından değerlendirilmiştir. MACUGEN, 2'-0-metiladenozin (2-MA) ve 2-O-metilguanozin (2'-MG), değerlendirilen tüm miktar tayini sistemlerinde negatif bulunmuştur. 2'-floroüridin (2'-FU) ve 2'-florositidinin (2VFC) klastojenik olmadığı anlaşılmış ve bakteriyel mutajenite test edilen tüm suşlarda (S. typhimurium) negatif çıkmışlardır; ancak, bakteriyel mutajenite test edilen tek bir suşta (E. coli) dozla herhangi bir ilgisi olmaksızın ilk anki sıklığına göre küçük bir artış oluşturmuştur. MACUGEN, 2'-FU ve 2'-FC tüm hücre transformasyonu miktar tayinlerinde negatif test sonucu vermiştir. Bu bilgilere dayanarak, herhangi bir genotoksisite riski söz konusu değildir.MACUGEN ile kemirgenler üzerinde yaşam boyu karsinojenisite çalışmaları yapılmamıştır. Erkek veya dişi çiftleşmesini ya da doğurganlık indislerini değerlendirmeye yönelik veriler mevcut değildir. MACUGEN gelişim toksikolojisi ile ilgili çalışmalar, fareler üzerinde 1 ila 40 mg/kg/günlük intravenöz dozlarda yapılmıştır. MACUGEN anne üzerinde herhangi bir toksisite oluşturmamıştır ve teratojenisite veya fetal mortaliteye ilişkin bir kanıt yoktur. Gelişim üzerinde, vücut ağırlığında azalma (%5) ve ön ayakların parmak kemiklerinin geç kemikleşmesi gibi sınırlı etkiler gözlenmiştir. 40 mg/kg/gün grubunda, maksimum MACUGEN plazma konsantrasyonları yavru sahibi annelerde insanlarda gözlenenden 20,000 kat daha yüksektir (3 mg doz grubu, önerilen dozdan 10 kez daha büyük). MACUGEN farelerde plasentadan geçer. 40 mg/kg/gün grubunda, amniyotik sıvıdaki MACUGEN konsantrasyonları annedeki plazma düzeylerinin %0.05'i olarak bulunmuştur. 40 mg/kg/gün rejimi, insanda önerilen 0.3 mg/göz monoküler oftalmik dozunun yaklaşık 7000 katım temsil etmektedir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMonobazik sodyum fosfat monohidratDibazik sodyum fosfat heptahidrat Sodyum klorür Hidroklorik asit Sodyum hidroksit Enjeksiyonluk su Nitrojen (bitmiş üründe bulunmaz.) 6.2. GeçimsizliklerMevcut değildir. Geçimsizlik çalışmalarının bulunmaması durumunda, bu ilaç diğer ilaçlarla karıştırılmamalıdır.6.3. Raf ömrü18 ay.6.4. Saklamaya yönelik özel tedbirlerBuzdolabında saklayın (2-8°C). Dondurmayın.6.5. Ambalajın niteliği ve içeriğiBromobutil lastik piston tapa ile kapatılmış tek-kullanımlık luer lock Tip I şeffaf cam hazneli şırınga.Şınnga, bromobutil/sentetik izopren koruyucu sert polipropilen dış kalkanlı luer tip kapağa sahiptir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerMACUGEN tek kullanımlıktır. Çözelti bulanık görünüyorsa, partiküller gözleniyorsa veya enjektörde hasar olduğuna dair bir kanıt varsa kullanmayın.MACUGEN buzdolabından çıkarıldıktan sonra 8 saat içinde kullanılmalıdır. Uygulamadan önce kullanıma hazır enjektörün oda sıcaklığına ulaşması beklenmelidir. Torba içindeki MACUGEN şırıngası kümülatif zaman olarak sekiz saatten fazla oda sıcaklığında bırakılmamışsa tekrar buzdolabına konulabilir. MACUGEN'in tekrar buzdolabına konulması sadece gerekli ise yapılmalıdır ve bu tekrar buzdolabına koyma işleminin sayısı minimumda tutulmalıdır. Torba içindeki MACUGEN sekiz saatten uzun süre oda sıcaklığında bırakıldı ise atılmalıdır. Kontaminasyondan korumak için, hasta enjeksiyon için hazırlanıncaya kadar ve uygulanacak doz hazır oluncaya kadar MACUGEN şırınga torbadan çıkarılmamalıdır. Torbadan çıkarılmış şırınga kullanılmayacak ise atılmalıdır. MACUGEN torbadan çıkarıldıktan sonra tekrar buzdolabına konulmaz. Kullanılmamış olan tüm ürünler ya da atık materyaller 'Tıbbi atıkların kontrolü yönetmeliği'ne ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir. UYARI:Kullanıma hazır şırınga, ürün hacminde fazlalık içerecek şekilde temin edilmektedir. Enjeksiyon öncesinde, fazla hacmi atmaya yönelik aşağıdaki talimatları takip ediniz.Figür 1: Hava kabarcığı ve ilacın hacim fazlası enjektörden uzaklaştırılmadan önce
Enjektörü iğne ucu yukarıyı gösterecek şekilde tutularak, kabarcık oluşumu kontrol edilmelidir. Kabarcık varsa, iğnenin ucuna gelene kadar, parmak ucuyla nazikçe enjektöre vurulmalıdır. 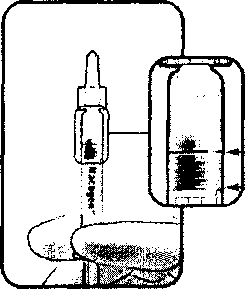 (piston çubuğuna en yakın) çıkıntı
(piston çubuğuna en yakın) çıkıntı(hava kabarcığı oluşumu değişiklik gösterebilir) YAVAŞÇA piston çubuğunu tüm kabarcıklar ve iiacm hacim fazlası enjektörden çıkarılmalısı için piston çubuğunun ucunda bulunan tapadaki çubuğa en yakın (3.) çıkıntı, enjektörün üzerinde bulunan siyah dozaj çizgisi ile hizalanana kadar itilir. (bkz.Figür 2). Piston tapası geri çekilmemelidir.Figür 2: Hava kabarcığı ve ilacın hacim fazlası enjektörden uzaklaştırıldıktan sonra -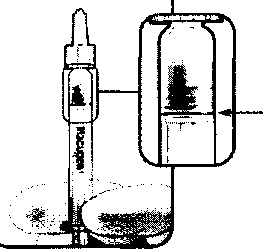 Tapadaki 3. çıkıntı enjektörün üzerinde bulunan siyah dozaj çizgisi ile hizalanmıştır Bu noktada, enjektördeki tüm içerik uygulanmalıdır. 7. RUHSAT SAHİBİPfizer İlaçlan Ltd. Şti.34347 Ortaköy-İSTANBUL Tel: 0 212 310 70 00 Faks: 0 212 310 70 58 8. RUHSAT NUMARASI(LARI)120/249. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 27.07.2006 Ruhsat yenileme tarihi: 27.05.201010. KÜB'ÜN YENİLENME TARİHİ13 |
İlaç BilgileriMacugen 0.3 Ng/90 Mcg Intravitreal Kullanim İçin ...Etken Maddesi: Pegaptanib Sodyum Atc Kodu: S01LA03 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.