Hiberix 0.5ml Im/sc Enjeksiyon İçin Liyofilize Toz İçeren Flakon ve Çözücü İçeren Kullanıma Hazır Enjektör Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Aşılar » Bakteriyel Aşılar » HIB (Hemofilus İnfluenza B) Aşıları » HIB (Hemofilus İnfluenza B), Konjuge Antijen Arıtılmış KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIHIBERIX 0.5 mL IM/SC Enjeksiyon İçin Liyofilize Toz İçeren Flakon ve Çözücü İçeren Kullanıma Hazır EnjektörHaemophilus influenzaetip b (Hib) aşısı2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde:1 doz (0.5 mL) içerisinde:Haemophilus influenzaetip b polisakkarid (PRP) poliribosilribitol fosfat1 10 mikrogram Taşıyıcı protein olarak tetanoz toksoidine konjuge yaklaşık 30 mikrogram1HIBERIX, tetanoz toksoidine kovalen olarak bağlanmış, Hib'in saflaştırılmış poliribozil-ribotil-fosfat kapsüler polisakkaridinden (PRP) oluşan liyofilize bir aşıdır. Hib polisakkaridi, Hib'in 20.752 suşundan hazırlanır. Siyanojen bromür ile aktive edilip, bir adipik hidrazid ayrıştırıcı ile derive edildikten sonra karbodiimid kondenzasyonu aracılığı ile tetanoz toksoidi ile birleştirilir. Konjugat saflaştırıldıktan sonra stabilizatör olarak laktozun varlığında liyofilize edilir. Aşının her dozu, yaklaşık 30 pg'lık tetanoz toksoidine kovalen olarak bağlanmış 10 pg saflaştırılmış kapsüler polisakkarid içerecek şekilde formüle edilmiştir. HIBERIX biyolojik maddeler ve Hib konjuge aşıları üretimi için Dünya Sağlık Örgütü'nün gereklerine uygundur. Yardımcı maddeler:Hib içeren tozLaktoz (stabilizatör olarak)
< 12.6 mg/0.5 mL 4.5 mg/0.5mL (k.m.) 0.5 mL ÇözücüSodyum klorür Enjeksiyonluk suYardımcı maddeler için 6.1'e bakınız 3. FARMASÖTİK FORMEnjeksiyonluk süspansiyon için toz ve çözücü.Liyofilize aşı cam flakonda beyaz bir pellet olarak sunulmaktadır. Steril çözücü içeren kullanıma hazır enjektör 0,5 mL serum fizyolojik içerir. 4. KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarHIBERIX, Hib'in neden olduğu hastalığa karşı, iki aylıktan itibaren bütün bebeklerin aktif bağışıklanması için endikedir.HIBERIX, Haemophilus influenzae'nındiğer tiplerine bağlı oluşan hastalığa veya diğer mikroorganizmaların neden olduğu menenjite karşı koruma sağlamaz.4.2. Pozoloji ve uygulama şekli Pozoloji / Uygulama sıklığı ve süresiPrimer aşılama takvimi, yaşamın ilk 6 ayı içinde verilen üç dozu içerir ve iki aylıktan itibaren başlatılabilir. Uzun dönemli korunma sağlamak amacıyla yaşamın ikinci yılında bir rapel doz önerilmektedir.Daha önce aşılanmamış 6 ila 12 ay aralığındaki bebeklere, aralarında bir ay bırakılan 2 doz uygulanmalıdır, bunu hayatın ikinci yılında bir rapel doz izlemelidir. Daha önce aşılanmamış 1-5 yaşlarındaki çocuklara bir doz aşı uygulanmalıdır. Aşılama şemaları ülkeden ülkeye değişkenlik gösterdiğinden, farklı ulusal önerilere göre her ülkenin şeması uyarlanabilir. Uygulama şekli:Sulandırılan aşı intramüsküler enjeksiyon içindir. Bununla birlikte, trombositopenili ya da kanama bozukluğu olan hastalarda aşının subkütan olarak uygulanması iyi bir klinik uygulamadır. Özel popülasyona ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:Böbrek/karaciğer yetmezliği olan hastalarla ilgili çalışma mevcut değildir.Geriatrik popülasyon:HIBERIX yalnızca bebeklerde kullanılmaktadır.Hem çözücü hem de kullanıma hazırlanan aşı uygulanma öncesi herhangi bir yabancı parçacık ve/veya fiziksel görünümünde değişiklik açısından görsel olarak incelenmelidir. Bunlardan birinin görülmesi durumunda çözücü ya da kullanıma hazırlanmış aşıyı kullanmadan atınız. Kullanıma hazırlama ve aşının uygulanmasıHIBERIX, kullanıma hazır enjektördeki çözücünün tümü toz içeren flakona eklenerek hazırlanmalıdır. Enjektöre iğne takmak için aşağıdaki çizime bakınız. Bununla birlikte HIBERIX enjektörü çizimdekinden biraz farklı olabilir.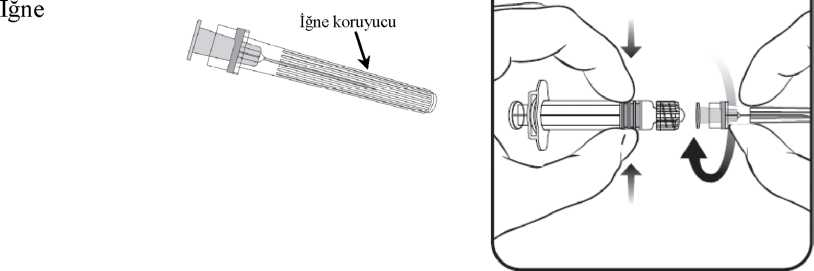 1. Bir eliniz ile enjektörün
1. Bir eliniz ile enjektörün gövdesindentutunuz (enjektör pistonuna dokunmadan), saatin ters yönüne döndürerek enjektör başlığını çeviriniz.2. Enjektöre iğne takmak için kilitlenene dek iğneyi saat yönünde çevirerek enjektöre takınız (bkz. resim).
Enjektör  3. İğne koruyucusunu çıkarınız (bazen sert olabilir). Çözücüyü toza ekleyin. Toza çözücü eklendikten sonra toz tamamen çözücüde çözünene dek çalkalanmalıdır. Sulandırılan aşı berrak renksiz bir çözeltidir. Aşı sulandırıldıktan hemen sonra kullanılmalıdır. Aşı uygulanırken yeni bir iğne kullanılmalıdır. Flakonun tüm içeriği çekilmelidir. Yukarıda Geçimsizlikler bölümünde bahsedildiği üzere, HIBERIX, tek dozlu Tritanrix HB veya Infanrix aşıları ile karıştırılabilir. Bu durumda HIBERIX paketinde mevcut olan çözücü, sıvı aşı ile yer değiştirir. HIBERIX ile beraber karıştırılmak amaçlı kullanılan aşının kabının tek dozluk kap olduğundan emin olunuz. HIBERIX paketinde bulunan çözücü içeren kullanıma hazır enjektörü kullanmadan atınız. Kombine aşı, diğer aşı içeriğinin beyaz Hib pellet içeren flakona ilave edilmesiyle sulandırılır. Hızlıca hazırlanan kombine aşı, sulandırılmış tek bileşenli HIBERIX aşısı ile aynı şekilde uygulanır.4.3. KontrendikasyonlarıHIBERIX, aşının herhangi bir bileşenine karşı aşırı duyarlılığı olduğu bilinen kişilere veya daha önceki Hib aşılamaları sonrasında aşırı duyarlılık belirtileri gösteren kişilere uygulanmamalıdır.Diğer aşılarla olduğu gibi, HIBERIX uygulaması akut ciddi ateşli hastalığı olan kişiler için ertelenmelidir. Bununla birlikte, minör bir enfeksiyonun varlığı aşılama için bir kontrendikasyon değildir. 4.4. Özel kullanım uyarıları ve önlemleriBütün diğer enjektabl aşılarda olduğu gibi aşının uygulaması sonrasında ortaya çıkabilecek nadir anafilaktik olay için gerekli tıbbi tedavi ve gözetim olanakları hazır bulundurulmalıdır. Aşılanan bireyler bu amaçla aşılama sonrasında 30 dakika süreyle tıbbi gözetim altında bulundurulmalıdırlar.İnsan İmmünyetmezlik Virüsü (HIV), HIBERIX için bir kontrendikasyon olarak görülmemektedir. Tetanoz toksoidi bileşenine karşı sınırlı immün yanıt oluşabilmesine rağmen, HIBERIX ile tek başına aşılama rutin tetanoz aşılamasının yerine geçemez.Hib aşılarının alınmasının ardından kapsüler polisakkarid antijeninin idrar ile atıldığı tanımlanmıştır. Bu nedenle Hib hastalığından şüphe edilen durumlarda aşılamadan sonraki 1 2 hafta içinde antijen saptama tanısal bir değer taşımayabilir. Trombositopenili ya da kanama bozukluğu olan bireylere yapılacak intramüsküler bir uygulama sonrasında kanama oluşabileceğinden, bu kişilere HIBERIX subkütan olarak uygulanmalıdır. HIBERIX, kesinlikle damar içine uygulanmamalıdır.Çok prematüre bebekler (gebeliğin 28. haftasından önce doğanlar) ve özellikle solunum sistemi gelişimi eksikliği hikayesi olanlarda primer bağışıklama serilerinin uygulanmasında potansiyel apne riskine karşı 48-72 saat solunum sisteminin izlenmesi gerekmektedir. Bu grup bebekte aşılamanın yararı yüksek olduğundan, aşılama alıkonmamalı ve ertelenmemelidir. Herhangi bir aşılama sırasında ve hatta öncesinde iğne ile enjeksiyona karşı psikojenik cevap olarak senkop (bayılma) olabilir. Bayılmaya bağlı yaralanmalardan kaçınmak için gerekli önlemler alınmalıdır.HIBERIX her dozunda 1 mmol (23 mg)'dan az sodyum ihtiva eder, bu dozda sodyuma bağlı herhangi bir yan etki beklenmemektedir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriHIBERIX, diğer bir inaktive veya canlı aşıdan herhangi bir süre önce, sonra ya da eşzamanlı olarak uygulanabilir.HIBERIX, GlaxoSmithKline aşılarından Infanrix (DTPa aşısı) veya Tritanrix HB (DTPw-HB aşısı) ile aynı enjektörde karıştırılabilir. Diğer enjektabl aşılar daima değişik aşılama bölgelerine uygulanmalıdırlar. Diğer aşılarla olduğu gibi, immün sistemi baskılayan tedavi uygulanan ya da immün yetmezliği olan hastalarda aşılamanın ardından yeterli yanıt elde edilemeyebilir. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hayvanlar üzerinde yapılan çalışmalar, gebelik ve-veya embriyonal/fetal gelişim ve-veya doğum ve-veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Gebelik dönemiGebelik döneminde kullanımının güvenilirliği konusunda yeterli insan verisi ve yeterli hayvan üreme çalışmaları mevcut değildir.Laktasyon dönemiLaktasyon döneminde kullanımının güvenilirliği konusunda yeterli insan verisi ve yeterli hayvan üreme çalışmaları mevcut değildir.Üreme yeteneği/ FertiliteVeri mevcut değildir.4.7. Araç ve makine kullanımı üzerine etkilerUygulanamaz.4.8. İstenmeyen etkilerİstenmeyen etkilerin sıklığı aşağıdaki gibi sınıflandırılmıştır:Çok yaygın >1/10 Yaygın >1/100, <1/10 Yaygın olmayan >1/1000, <1/100 Seyrek >1/10000, <1/1000 Çok seyrek <1/10000 Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Klinik çalışma verileriAşağıda sunulan güvenlilik profili, DTPa-HBV-IPV aşısı ile eşzamanlı olarak HIBERIX almış 8 ila 29 haftalık 1100'den fazla gönüllü üzerinde gerçekleştirilen büyük bir kontrollü, randomize klinik çalışmadan elde edilmiştir. Tüm gönüllüler çalışma dönemi boyunca ciddi advers olaylar açısından takip edilmiştir. Advers olaylar, her aşılamadan sonra 30 gün boyunca kaydedilmiştir.Birincil aşılamadan sonra gözlenen en yaygın advers reaksiyonlar, hareketlilik hali, ateş, olağandışı ağlama ve enjeksiyon bölgesinde kızarıklıktır; bunlar tüm dozların sırasıyla %32.5, %18.4, %16 ve %14.7'sinden sonra meydana gelmiştir. Bildirilen advers reaksiyonların büyük kısmı aşılamadan sonraki 2 gün içinde ortaya çıkmıştır. Bunların büyük kısmı hafif ila orta şiddettedir ve dört gün içinde ortadan kalkmıştır. Aşılama ile en azından olası bir ilişkisi olduğu düşünülen advers reaksiyonlar sistem organ sınıfı ve sıklığa göre listelenmektedir. Her bir sıklık gruplaması içinde istenmeyen etkiler azalan ciddiyet sırasına göre sunulmaktadır. Metabolizma ve beslenme hastalıklarıÇok yaygın: İştah kaybıPsikiyatrik hastalıklarıÇok yaygın: Olağandışı ağlama, hareketlilik haliGastrointestinal hastalıklarıÇok yaygın: Diyare Yaygın: KusmaGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok yaygın: Ateş, enjeksiyon bölgesinde kızarıklık Yaygın: Enjeksiyon bölgesinde şişme ve ağrıPazarlama sonrası veriler Bağışıklık sistemi hastalıklarıBilinmiyor: Alerjik reaksiyonlar (anafilaktik ve anafilaktoid reaksiyonlar dahil), anjiyoödemSinir sistemi hastalıklarıBilinmiyor: Kollaps veya şok benzeri durum (hipotonik-hiporesponsif dönem), konvülsiyonlar (ateşli veya ateşsiz), senkop veya enjeksiyona vazovagal tepkiler, somnolansSolunum, göğüs bozuklukları ve mediastinal hastalıklarBilinmiyor: Apne [bkz. Özel kullanım uyarıları ve önlemleri - çok prematür (gebeliğin 28. haftasında veya önce doğan) bebeklerde apne]Deri ve deri altı doku hastalıklarıBilinmiyor: ürtiker, döküntüGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarBilinmiyor: Enjeksiyonun yapılan uzuvun yaygın olarak şişmesi, enjeksiyon bölgesinde sertlik4.9 Doz aşımı ve tedavisiUygulanamaz.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özellikleriFarmakoterapötik grubu: Kombine bakteriyel ve viral aşılar, ATC kodu J07AG01 HIBERIX, çeşitli aşılama takvimlerinde çeşitli DTP aşılarından ayrı bir enjeksiyon olarak uygulandığında, üçüncü dozdan sonraki ilk ay içinde bebeklerin >%95'inde >0.15 mikrogram/ml anti-PRP titreleri (genel olarak Hib hastalığına karşı koruyucu olarak düşünülen düzey) elde edilmiştir.Bölüm 4.5'te listelenen aşılarla birlikte verilen HTBHTBERTX uygulanan bebeklerde anti-PRP'nin geometrik ortalama titreleri, ayrı bir enjeksiyon olarak Hiberix almış bebeklerde görülen titrelerin yaklaşık üçte biri olmuştur.Yaşamın ikinci yılında bir HTBERTX rapel dozu uygulaması, birincil aşılama için kullanılmış aşı(lar)dan bağımsız olarak aşılanmış çocukların neredeyse tamamında >1.0 mikrogram/ml anti-PRP titrelerine yol açmıştır. 5.2. Farmakokinetik özelliklerAşılar için farmakokinetik özelliklerin incelenmesi gerekmemektedir.5.3.Klinik öncesi güvenlilik verileriUygulanamaz.6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLiyofilize Hib aşısıLaktoz ÇözücüSodyum klorür ve enjeksiyonluk su 6.2.GeçimsizliklerHIBERIX, GlaxoSmithKline aşılarından Infanrix (DTPa aşısı) veya Tritanrix HB ( DTPw-HB aşısı) ile aynı enjektörde karıştırılabilir. Diğer enjektabl aşılar daima değişik aşılama bölgelerine uygulanmalıdırlar.HIBERIX diğer aşılar ile aynı enjektörde karıştırılmamalıdır (onaylı kombinasyonlar hariç).6.3. Raf ömrü36 ay6.4. Saklamaya yönelik özel tedbirlerLiyofilize aşı, +2 - +8°C arasında ışıktan korunarak saklanmalıdır. Liyofilize aşı dondurulmaktan etkilenmez.Çözücü, buzdolabında (+2 - +8°C arasında) ya da oda ısısında (25°C'ye kadar) saklanabilir. Dondurulmamalıdır. 6.5. Ambalajın niteliği ve içeriğiLiyofilize aşı bir cam flakon içerisinde beyaz pellet olarak sunulmaktadır.Steril çözücü (serum fizyolojik) berrak ve renksizdir ve kullanıma hazır enjektör içinde sunulmaktadır. Flakonlar ve kullanıma hazır enjektörler, Avrupa Farmakopesi gereklerine uygun olarak nötral cam tip I'den yapılmıştır. 6.6. Tıbbi ürünlerden arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİGlaxoSmithKline İlaçları Sanayi ve Ticaret A.Ş.Büyükdere Cad. No:173 1.Levent Plaza B Blok 34394, 1.Levent / İSTANBUL Tel no: 0 212 339 44 00 Faks no: 0 212 339 45 00 8. RUHSAT NUMARASI9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: -Ruhsat yenileme tarihi:-10. KÜB'ÜN YENİLENME TARİHİ8 |
İlaç BilgileriHiberix 0.5ml Im/sc Enjeksiyon İçin Liyofilize Toz İçeren Flakon ve Çözücü İçeren Kullanıma Hazır EnjektörEtken Maddesi: Haemophilus Influenzae Tip B Konjuge Aşı Atc Kodu: J07AG01 |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.