Spiriva Respimat 2.5 Mcg/püskürtme İnhalasyon Çöz... Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Antikolinerjik İlaçlar » Tiotropium Bromür KISA ÜRÜN BİLGİSİ 1.BEŞERİ TIBBİ ÜRÜNÜN ADISPIRIVA RESPIMAT® 2.5 mikrogram /püskürtme İnhalasyon Çözeltisi 2.KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir puf (püskürtme), 2.5 mikrogram tiotropium bromür (3.124 |ig tiotropium bromür monohidrata eşdeğer) içerir. 2 puf bir tıbbi doza karşılık gelir. Verilen doz, ilacın cihazın ağızlık kısmından geçmesinden sonra hastanın aldığı dozdur. Yardımcı maddeler: Benzalkonyum klorür 0.00221 mg Diğer yardımcı maddeler için 6.1'e bakınız. 3.FARMASÖTİK FORM İnhalasyon çözeltisi. Berrak, renksiz inhalasyon çözeltisidir. 4.KLİNİK ÖZELLİKLER 4.1Terapötik endikasyonlar Tiotropium, kronik obstrüktif akciğer hastalarının (KOAH) semptomlarını rahatlatmak için, idame bronkodilatör tedavisi olarak endikedir. 4.2Pozoloji ve uygulama şekli Pozoloji: Bu ilaç sadece inhalasyon yolu ile kullanılır. Kartuş sadece RESPIMAT inhalatörü içine yerleştirilerek kullanılabilir. RESPIMAT inhalatöründen püskürtülen 2 puf bir tıbbi doza karşılık gelmektedir. Erişkinler için önerilen doz, günde bir kez 2 puf şeklinde uygulanan 5 |ig tiotropiumdur. Önerilen doz aşılmamalıdır. Uygulama sıklığı ve süresi: İnhalasyon her gün, günün aynı saatinde, RESPIMAT inhalatörü kullanılarak yapılmalıdır. Uygulama şekli: Hastanın ilacı doğru şekilde kullanabilmesi için, ilacın nasıl kullanılacağı bir doktor veya diğer bir sağlık çalışanı tarafından hastaya anlatılmalıdır. Kapak Ağızlık Hava deliği Doz serbestleme düğmesi (D) 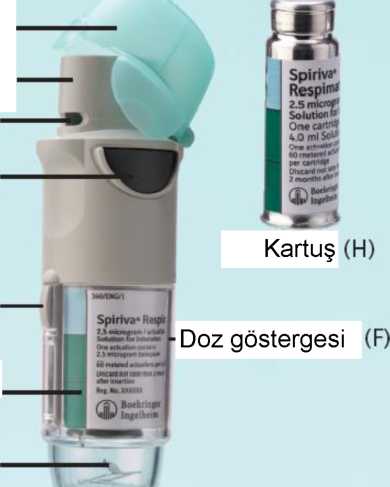 Güvenlik kilidi Saydam taban Delici iğne SPIRIVA RESPIMAT inhaler ve SPIRIVA RESPIMAT kartuş Kartuşun yerleştirilmesi ve kullanıma hazırlama İlk kullanımdan önce aşağıdaki 1'den 6'ya kadar olan basamakların uygulanması gerekir: 1. Yeşil renkli kapak kapalı durumda iken, güvenlik kilidine (E) bastırınız ve saydam taban parçasını (G) çekerek çıkarınız.
Güvenlik kilidi  2a
2a2b Kartuşu (H) kutusundan çıkarınız. Kartuşun dar olan ucunu inhalatörün içine doğru itiniz ve bir klik sesi ile yerine oturmasını sağlayınız. Kartuşun tam olarak yerleştiğinden emin olmak için, sağlam bir yüzeyin üzerine koyarak hafifçe ve dikkatli bir şekilde bastırınız (2b). Kartuş tümüyle inhalatörün içine girmez, kartuşun alt kısmındaki gümüş rengi halka görünecektir. İnhalatöre yerleştirdikten sonra kartuşu yerinden çıkartmayınız. 3. Saydam taban parçasını yerine takınız (G). Saydam tabanı bir daha yerinden çıkarmayınız. 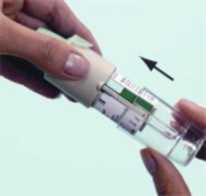 3
3SPIRIVA RESPIMAT inhalatörün ilk kullanım için hazırlanması4. SPIRIVA RESPIMAT inhalatörü, yeşil kapak (A) kapalı halde iken, dik olarak tutunuz. Saydam taban parçasını (G) etiketin üzerindeki kırmızı ok işaretleri yönünde, bir klik sesi alıncaya kadar döndürünüz (yarım tur). 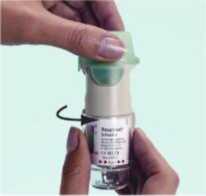 4
4 5
56 5. Yeşil kapağı (A), tamamen yana yatıncaya kadar açınız. 6. SPIRIVA RESPIMAT inhalatörü yere doğru tutunuz. Doz serbestleme düğmesine (D) basınız. Yeşil kapağı (A) kapatınız. 4, 5 ve 6. basamakları küçük bir bulut görününceye kadar tekrarlayınız. Daha sonra 4, 5 ve 6. basamakları, inhalatörün kullanıma hazır olduğundan emin olmak amacıyla üç kez daha tekrarlayınız. SPIRIVA RESPIMAT inhalatör şimdi artık kullanıma hazırdır. Bu işlemler, inhalatördeki kullanılabilir doz sayısını etkilemeyecektir. SPIRIVA RESPIMAT inhalatör, kullanım için hazırlandıktan sonra, 30 doz (60 püskürtme/puf) verebilecek durumdadır. SPIRIVA RESPIMAT inhalatörün günlük kullanımı Bu inhalatör SADECE GÜNDE BİR KEZ kullanılır. Her kullanımda 2 PUF uygulanır. I. Kazaen bir doz serbestlenmesini önlemek amacıyla yeşil kapak (A) kapalı durumda iken, SPIRIVA RESPIMAT inhalatörü dik olarak tutunuz. Saydam tabanı (G) etiketteki kırmızı ok işaretleri yönünde, bir klik sesi alıncaya kadar döndürünüz (yarım tur). I 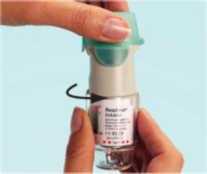 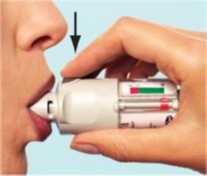 II Yeşil kapağı (A), tamamen yana yatıncaya kadar açınız. Nefesinizi yavaşça ve tamamen dışarı veriniz. Daha sonra dudaklarınızı, hava deliklerini (C) kapatmayacak şekilde, ağızlığın ucu çevresinde sıkıca kapayınız. SPIRIVA II RESPIMAT inhalatörü boğazınızın arkasına doğru yönlendiriniz. Ağzınızdan yavaş ve derin bir nefes alırken, doz serbestleme düğmesine (D) basınız ve alabildiğiniz kadar, yavaş yavaş nefes almaya devam ediniz. Nefesinizi 10 saniye kadar veya sizi zorlamayacak bir süre tutunuz. III. I. ve II. basamakları tekrarlayınız; böylelikle dozun tamamını almış olacaksınız. Bu inhalatörü sadece GÜNDE BİR KEZ kullanmanız gerekmektedir. SPIRIVA RESPIMAT inhalatörü tekrar kullanıncaya kadar yeşil kapağı kapalı durumda tutunuz. Eğer SPIRIVA RESPIMAT inhalatörünüz 7 günden daha uzun bir süre kullanılmamış ise, yere doğru bir kez püskürtünüz. Eğer SPIRIVA RESPIMAT inhalatörünüz 21 günden daha uzun bir süre kullanılmamış ise, 4'ten 6'ya kadar olan basamakları bir bulut görününceye kadar tekrarlayınız. Daha sonra 4'ten 6'ya kadar olan basamakları üç kez daha tekrarlayınız. Ne zaman yeni bir SPIRIVA RESPIMAT inhalatörü alınmalıdır: SPIRIVA RESPIMAT inhalatör 30 doz (60 puf) içermektedir. Doz göstergesi, yaklaşık olarak ne kadar ilacın kaldığını gösterir. İşaret oku ölçeğin kırmızı bölümüne girdiğinde, yaklaşık 7 günlük ilaç (14 puf) kalmış demektir. Bu durumda yeni bir SPIRIVA RESPIMAT inhalatör reçetesi alma zamanınız gelmiştir. 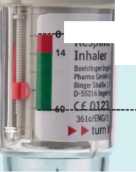 Boş
BoşHacmin: s Dolu Doz göstergesi kırmızı ölçeğin sonuna ulaştığında (yani 30 dozun tamamı kullanıldığında), SPIRIVA RESPIMAT inhalatör boşalmıştır ve otomatik olarak kilitlenir. Bu durumda iken, taban parçası artık daha fazla döndürülemez. İçindeki ilacın tamamı kullanılmamış bile olsa, SPIRIVA RESPIMAT inhalatör ilk kez kullanıldıktan en geç üç ay sonra atılmalıdır. İnhalatörünüzün bakımı Ağızlık parçasını ve içinde bulunan metal bölümünü, en az haftada bir kez, nemli bir bez veya ıslak kağıt mendil ile temizleyiniz. Ağızlık parçasında herhangi bir hafif renk değişimi, SPIRIVA RESPIMAT inhalatörün performansını etkilemez. Gerekirse, SPIRIVA RESPIMAT inhalatörün dış tarafını nemli bir bezle silebilirsiniz. Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği: Böbrek yetmezliği olan hastalar, SPIRIVA RESPIMAT'ı önerilen dozlarda kullanabilirler. Orta-şiddetli derecede böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dk) SPIRIVA RESPIMAT, sadece beklenen yararın olası riskten daha büyük olduğu durumlarda kullanılmalıdır. Bu durumda hasta yakından izlenmelidir (Bkz. 4.4 ve 5.2). Karaciğer yetmezliği: Karaciğer yetmezliği olan hastalar SPIRIVA RESPIMAT'ı önerilen dozlarda kullanabilirler (Bkz. 5.2). Pediyatrik popülasyon: SPIRIVA RESPIMAT'ın pediyatrik hastalardaki güvenlilik ve etkililiği belirlenmemiştir. Bu nedenle 18 yaşın altındaki çocuklarda ve adolesanlarda kullanımı önerilmemektedir. Geriyatrik popülasyon: Yaşlı hastalar SPIRIVA RESPIMAT'ı önerilen dozlarda kullanabilirler. 4.3Kontrendikasyonlar SPIRIVA RESPIMAT, tiotropium bromür, atropin veya türevlerine (örn. ipratropium ya da oksitropium) veya bu ilacın bileşenlerinden herhangi birisine karşı aşırı duyarlılık öyküsü olan hastalarda kontrendikedir (Bkz. 6.1). 4.4Özel kullanım uyarıları ve önlemleri SPIRIVA RESPIMAT günde bir kez kullanılan bir idame tedavisi bronkodilatörü olarak, akut bronkospazm episodlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır. SPIRIVA RESPIMAT uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir Diğer antikolinerjik ilaçlarla olduğu gibi, SPIRIVA RESPIMAT, dar açılı glokom, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda dikkatle kullanılmalıdır. İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler. SPIRIVA RESPIMAT kardiyak ritm bozuklukları olduğu bilinen hastalarda dikkatle kullanılmalıdır (bkz. 5.1). Orta-şiddetli böbrek bozukluğu olan hastalarda (kreatinin klerensi <50 ml/dk) renal fonksiyon azaldıkça ilacın plazma konsantrasyonu artar. Bu nedenle tiotropium bromür, bu durumlarda, sadece beklenen yarar potansiyel riskten fazla ise kullanılmalıdır. Şiddetli renal bozukluğu olan hastalarda uzun süreli kullanım ile ilgili bir deneyim yoktur (bkz. 5.2). Hastalar spreyin göze kaçırılmaması konusunda uyarılmalıdır. Aksi durumda, dar açılı glokomun presipitasyonuna veya kötüleşmesine, gözde ağrı veya rahatsızlık hissine, geçici görme bulanıklığına, haleler veya renkli görüntüler görme ile birlikte konjonktival konjesyon nedeniyle gözde kızarıklığa ve korneal ödeme yol açabileceği hastaya açıklanmalıdır. Gözle ilgili bu semptomların herhangi bir kombinasyonu ortaya çıkarsa, hasta bu ilacı kullanmayı durdurmalı ve derhal bir uzman doktora başvurmalıdır. Anti kolinerjik ilaçlarla yapılan tedavilerde ağız kuruluğu gözlenmiştir. Bu durum uzun süreli tedavilerde diş çürüklerine neden olabilir. SPIRIVA RESPIMAT günde bir defadan daha sık kullanılmamalıdır (Bkz. 4.9). SPIRIVA RESPIMAT yardımcı maddeler arasında, önerilen doz başına 0.00221 mg benzalkonyum klorür içermektedir. Benzalkonyum klorür göz ve deride irritasyona neden olabilir. Ayrıca solunum yoluyla doz başına 10 mg alındığında bronkospazma yol açabilir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Düzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte tiotropium bromür, KOAH tedavisinde yaygın olarak kullanılan diğer ilaçlar ile beraber, ilaç etkileşimine yönelik klinik bulgular görülmeksizin kullanılmıştır; sempatomimetik bronkodilatörler, metilksantinler, oral ve inhale steroidler, bu ilaçlar arasındadır. Tiotropium bromürün diğer antikolinerjik ilaçlar ile birlikte uygulanması incelenmemiştir. Bu nedenle, diğer antikolinerjik ilaçların SPIRIVA RESPIMAT ile birlikte uygulanması önerilmemektedir. Özel popülasyonlara ilişkin ek bilgiler: Özel bir veri bulunmamaktadır. Pediyatrik popülasyon: Özel bir veri bulunmamaktadır. 4.6 Gebelik ve laktasyon Genel tavsiye: Gebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): Lütfen aşağıdaki bilgilere bakınız. Gebelik dönemi: Gebelerde tiotropium bromür maruziyeti ile ilgili bir veri yoktur. Hayvan çalışmaları maternal toksisite ile ilişkili üreme toksisitesi bulguları göstermiştir (Bkz. 5.3). İnsanlar için potansiyel risk bilinmemektedir. Bu nedenle SPIRIVA RESPIMAT gebelikte, sadece gerçekten endike olduğunda kullanılmalıdır. Laktasyon dönemi: Tiatropium bromürün anne sütüne geçip geçmediği bilinmemektedir. Kemirgenlerde yapılan çalışmalarda, sadece az miktarda tiotropium bromürün süte geçtiği belirlenmesine rağmen, SPIRIVA RESPIMAT'ın emziren kadınlarda kullanımı önerilmemektedir. Tiotropium bromür uzun etkili bir bileşiktir. Emzirmeye devam etme/etmeme veya SPIRIVA RESPIMAT tedavisine devam etme/etmeme kararı, emzirmenin çocuğa olan yararı ile SPIRIVA RESPIMAT tedavisinin anneye sağlayacağı yarar göz önüne alınarak verilmelidir. Üreme yeteneği/Fertilite: Tiotropium için fertilite ile ilgili klinik veri yoktur. Tiotropium ile yapılan bir klinik dışı çalışmada, fertilite ile ilgili advers etki gözlenmemiştir (Bkz. 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkiler Araç ve makine kullanma becerileri üzerindeki etkilerine yönelik bir çalışma yapılmamıştır. Baş dönmesi ve görme bulanıklığın ortaya çıkması, araç ve makine kullanma becerilerini etkileyebilir. 4.8 İstenmeyen etkiler Güvenlilik profili özeti Listelenmiş olan istenmeyen etkilerin çoğu, SPIRIVA RESPIMAT'ın antikolinerjik özelliklerine bağlanabilir. Aşağıda belirtilen istenmeyen etkilerin sıklıkları, tedavi süreleri 12 hafta ile 1yıl arasında değişen 5 plasebo kontrollu çalışmadan elde edilen tiotropium grubuna (2.802 hasta) ait veri havuzunda gözlenen advers etkilerin (yani tiotropiumla ilişkilendirilen advers olaylar) ham insidens oranlarına dayanır. MedDRA konvansiyonuna göre sıklık dereceleri şu şekilde tanımlanır: Çok yaygın (>1/10); yaygın (>1/100 ilâ <1/10); yaygın olmayan (>1/1,000 ilâ <1/100); seyrek (>1/10,000 ilâ <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Metabolizma ve beslenme hastalıkları Bilinmiyor: Dehidratasyon Sinir sistemi hastalıkları Yaygın olmayan: Baş dönmesi, baş ağrısı Bilinmiyor: Uykusuzluk Göz hastalıkları Seyrek: Glokom, göz içi basıncında artış, bulanık görme Kardiyak hastalıklar Yaygın olmayan: Atriyal fibrilasyon, palpitasyonlar, supraventriküler taşikardi, taşikardi Solunum, göğüs bozuklukları ve mediyastinal hastalıklar Yaygın olmayan: Öksürük, epistaksis, farenjit, disfoni Seyrek: Bronkospazm, larenjit Bilinmiyor: Sinüzit Gastrointestinal hastalıklar Yaygın: Ağız kuruluğu, Yaygın olmayan: Konstipasyon, orofarenjiyal kandidiyazis, disfaji Seyrek: Gastroözofajiyal reflü hastalığı, diş çürükleri, gingivit, glossit, stomatit Bilinmiyor: Paralitik ileus dahil intestinal obstrüksiyon, bulantı Deri ve derialtı dokusu hastalıkları, bağışıklık sistemi hastalıkları Yaygın olmayan: Kaşıntı, döküntü Seyrek: Anjiyonörotik ödem, ürtiker, deri infeksiyonu ve deri ülseri, deride kuruluk Bilinmiyor: Aşırı duyarlılık (ani reaksiyonlar dahil) Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıkları Bilinmiyor: Eklemlerde şişlik Böbrek ve idrar hastalıkları Yaygın olmayan: İdrar retansiyonu, idrar yapmada güçlük Seyrek: İdrar yolu enfeksiyonu Seçilmiş advers etkilerin tanımı: Kontrollu klinik çalışmalarda, sık gözlenen istenmeyen etkiler hastaların yaklaşık %3.2'inde ortaya çıkan ağız kuruluğu gibi antikolinerjik etkilerdir. 5 klinik çalışmada, tiotropium kullanan 2.802 hastadan 3 tanesi (%0.1) ağız kuruluğu nedeni ile çalışmayı bırakmıştır. Antikolinerjik etkilerle uyumlu ciddi istenmeyen etkiler arasında, glokom, konstipasyon, paralitik ileus dahil intestinal obstrüksiyon ve idrar retansiyonu bulunur. Diğer özel popülasyon: Artan yaşla birlikte antikolinerjik etkilerde bir artış ortaya çıkabilir. 4.9 Doz aşımı ve tedavisi Tiotropium bromürün yüksek dozları antikolinerjik belirti ve bulgularının ortaya çıkmasına neden olabilir. Sağlıklı gönüllülerde 340 |ig tiotropium bromürün bir defada inhalasyonunu takiben hiç bir sistemik antikolinerjik advers etki gözlenmemiştir. Ek olarak, sağlıklı gönüllülerde 14 gün süreyle 40 mikrograma kadar tiotropium inhalasyon çözeltisi uygulamasından sonra, 7. günden itibaren ortaya çıkan tükürük salgısında anlamlı azalma dışında, ağız kuruluğu, boğazda kuruluk ve burun mukozasında kurumanın ötesinde, başka ilişkili bir advers olay gözlenmemiştir. Oral yoldan biyoyararlanımının düşük olması nedeniyle, kartuştaki tiotropium inhalasyon çözeltisinin kasıtsız olarak oral yoldan alınması sonucunda akut intoksikasyon pek olası değildir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1 Farmakodinamik özellikler Farmakoterapötik grup: Antikolinerjikler ATC kodu: R03B B04 Etki mekanizması: Tiotropium bromür uzun etkili bir muskarinik reseptör spesifik antagonistidir. M1'den M5'e kadar olan muskarinik reseptör alt-tiplerine karşı benzer bir afinite gösterir. Hava yollarında, bronşiyal düz kaslarda bulunan M3 reseptörlerine kompetetif ve geri dönüşümlü olarak bağlanarak asetil kolinin kolinerjik etkilerini (bronkokonstrüktif) antagonize eder ve böylece bronşiyal düz kaslar gevşer. Etki doz bağımlıdır ve 24 saatten daha uzun sürer. N-kuaterner bir antikolinerjik olarak tiotropium bromür, inhalasyon yoluyla uygulandığında, topikal olarak (bronko-) selektiftir; sistemik antikolinerjik etkilere yol açmadan önce kabul edilebilir bir terapötik aralık gösterir. Farmakodinamik etkiler: Tiotropiumun özellikle M3 reseptörlerinden dissosiyasyonu çok yavaştır. Bu açıdan ipratropiuma göre anlamlı şekilde daha uzun bir disosiyasyon yarılanma ömrü gösterir. M2 reseptörlerinden disosiyasyonu M3 reseptörlerinde olduğundan daha hızlıdır ve bu durum, fonksiyonel in vitroçalışmalarda M2'ye karşı M3 için kinetik olarak kontrol edilen bir reseptör alt-tipi seçiciliğinin varlığını açığa çıkarmıştır. Yüksek düzeydeki potens ve reseptörden çok yavaş dissosiyasyonu ve topik inhalasyon selektivitesi, klinikte KOAH'lı hastalardaki belirgin ve uzun etkili bronkodilatasyon şeklinde kendini gösterir.Klinik etkililik ve güvenlilik: Klinik Faz III programında 2901 KOAH hastası üzerinde yürütülen (1038 hastaya 5 mikrogram tiotropium dozu verilmiştir) iki tanesi 1 yıl süreli, iki tanesi 12 hafta süreli ve iki tanesi 4 hafta süreli randomize, çift-kör çalışma bulunmaktadır. Bir yıllık program plasebo kontrollü iki araştırmadan oluşmuştur. On iki hafta süreli iki araştırma, hem aktif (ipratropium) hem de plasebo kontrollu idi. Altı çalışmanın hepsi akciğer fonksiyonu ölçümlerini içermektedir. Ek olarak, 1 yıl süreli iki çalışma, dispne, sağlıkla ilişkili yaşam kalitesi ve alevlenmeler üzerindeki etkilere yönelik, sağlık sonuçlanım ölçümlerini de içermekte idi. Sözü edilen bu çalışmalarda, günde bir kez uygulanan tiotropium inhalasyon çözeltisi ilk dozu izleyen 30 dakika içinde, akciğer fonksiyonlarında, (bir saniyelik zorlu ekspirasyon hacmi ve zorlu vital kapasite) plaseboya göre, anlamlı bir iyileşme sağlamıştır (30. dakikada FEV1'de ortalama iyileşme: 0.113 litre; %95 güvenlik aralığı (GA):0.102-0.125 litre, p<0.0001). Akciğer fonksiyonlarındaki bu iyileşme, plasebo ile karşılaştırıldığında (FEV1 ortalama iyileşme: 0.122 litre; %95 güvenlik aralığı: 0.106-0.138 litre, p<0.0001) kararlı durum düzeylerinde, 24 saat süreyle kalıcı olmuştur. Farmakodinamik kararlı duruma bir hafta içerisinde ulaşılmıştır. SPIRIVA RESPIMAT, sabah ve akşam pik ekspiratuar akım hızı (PEFR) düzeylerini, günlük hasta kayıtlarıyla ölçüldüğü şekliyle, plaseboya göre, anlamlı olarak iyileştirmiştir (PEFR ortalama iyileşme: sabah ortalama iyileşme 22 l/dk; %95 güven aralığı:18-55 l/dk, p<0.0001; akşam 26 l/dk; %95 güven aralığı: 23-30 l/dk, p<0.0001). SPIRIVA RESPIMAT uygulaması, kurtarıcı bronkodilatör kullanımında, plaseboya kıyasla azalma ile sonuçlanmıştır (kurtarıcı kullanımındaki ortalama azalma 0.66 kez/gün, %95 güven aralığı: 0.51-0.81 kez/gün, p<0.0001). SPIRIVA RESPIMAT'ın bronkodilatör etkisi, toleransa ait herhangi bir belirti olmaksızın, 1 yıllık uygulama dönemi boyunca devam etmiştir. Bir yıllık uzun süreli araştırmalarda, sağlığa ilişkin olarak aşağıdaki sonuçlar ortaya çıkarılmıştır: (a) SPIRIVA RESPIMAT, plasebo ile karşılaştırıldığında dispneyi (Transizyon Dispne İndeksi kullanılarak değerlendirilmiştir) anlamlı derecede iyileştirmiştir (ortalama iyileşme 1.05 ünite; %95 güven aralığı:0.73-1.38 ünite, p<0.0001). Bu iyileşme, bütün tedavi dönemi süresince kalıcı olmuştur. (b) Hastaların kendi Yaşam Kalite'leri üzerinde yaptıkları değerlendirmelere (St. George Respiratuar Anketi kullanılarak ölçüldüğü üzere) göre saptanan ortalama total derecelerdeki iyileşme, SPIRIVA RESPIMAT ve plasebo arasında kıyaslandığında, bir yıl süreli iki çalışmanın sonunda 3.5 birim (%95 güven aralığı: 2.1-4.9, p<0.0001) olarak bulunmuştur. 4 birimlik bir azalma klinik olarak önemli kabul edilir. (c) KOAH şiddetlenmesi 3 adet, 1 yıl süreli, randomize, çift kör, plasebo kontrollu çalışmada SPIRIVA RESPIMAT tedavisi, plasebo ile karşılaştırıldığında, KOAH şiddetlenmesi riskini anlamlı olarak azaltmıştır. KOAH şiddetlenmesi: 3 gün veya daha uzun süren ve tedavinin değiştirilmesine ihtiyaç gösteren (antibiyotiklerin ve/veya sistemik kortikosteroidlerin reçetelenmesi ve/veya reçetelenmiş solunum sistemi ilacında önemli bir değişiklik) en az 2 solunum olayı/ semptomu kompleksinin varlığı olarak tanımlanmıştır. SPIRIVA RESPIMAT tedavisi KOAH şiddetlenmesine bağlı hastaneye başvurma riskinde azalma sağlamıştır (uygun güçteki büyük bir şiddetlenme çalışmasında anlamlı bulunmuştur). İki Faz III çalışmasının havuz analizleri ve ek bir şiddetlenme çalışmasının ayrıca analizi Tablo 1'de sunulmuştur. Antikolinerjikler ve uzun etkili beta agonistler haricindeki tüm solunum yolu ilaçlarının (yani hızlı etkili beta agonistler, inhale kortikosteroidler ve ksantinler) eş zamanlı tedavi olarak kullanmasına izin verilmiştir. Şiddetlenme çalışmasında uzun etkili beta agonistlere de izin verilmiştir. Tablo 1: Orta-çok şiddetli KOAH hastalarında KOAH şiddetlenmelerin ve hastanede yatmaya neden olan KOAH şiddetlenmelerinin istatistiksel analizi
A çalışmasında plasebo hastalarının %25'nde 112 günde bir şiddetlenme ortaya çıkmıştır, buna karşılık SPIRIVA RESPIMAT grubunun %25'i için bir şiddetlenme görülme süresi 173 gündür (p=0.09). B çalışmasında, plasebo hastalarının %25'nde 74 günde bir şiddetlenme ortaya çıkmıştır, buna karşılık SPIRIVA RESPIMAT grubu için bu süre 149 gündür (p<0.0001).b Tehlike oranı COX orantısal tehlike modeli ile tahmin edilmiştir. Riskteki yüzde azalma 100 (1-tehlike oranı). c Poisson regresyonu. Riskteki yüzde azalma 100(1-oluşum oranı) d Havuzlama, çalışmalar tasarlandığında tanımlanmıştır. Şiddetlenme sonlanım noktaları, bir yıl süreli iki çalışmanın her birinin ayrı analizleriyle anlamlı derecede gelişmiştir. SPIRIVA RESPIMAT ile yürütülen ve 6,096 hastayı kapsayan bir yıl süreli üç ve altı ay süreli bir plasebo kontrollü araştırmanın retrospektif toplu analizinde, SPIRIVA RESPIMAT (68; insidens oranı (IR) 2.64/100 hasta yılı) ile tedavi edilen hastalarda, tüm nedenlere bağlı mortalitede plaseboya kıyasla (51; (IR) 1.98), sayısal bir artış görülmüş (68; IR 2.64 vaka/100 hasta yılı); planlanmış tedavi dönemi içinde görülen oluşum oranı (%95 güven aralığı) 1.33 (0.93, 1.92) olmuştur. Mortalitedeki artış, ritm bozukluğu olduğu bilinen hastalarda gözlenmiştir. Pediyatrik popülasyon: Herhangi bir veri mevcut değildir (Bkz. 4.2). 5.2 Farmakokinetik özellikler Genel özellikler Tiotropium bromür, kiralite göstermeyen bir kuaterner amonyum bileşiğidir ve suda kısmen çözünür. Tiotropium bromür, RESPIMAT inhalatörü ile uygulanan inhalasyon çözeltisi şeklinde bulunmaktadır. İnhale edilen dozun %40 civarı, hedef organ olan akciğerde, kalan miktar ise gastrointestinal kanalda tutulur. Aşağıda açıklanan farmakokinetik verilerin bazıları, tedavi için önerilenden daha yüksek dozlar ile elde edilmiştir. Emilim:Sağlıklı genç gönüllülerce çözeltinin inhalasyonundan sonra elde edilen üriner atılım verileri, inhale edilen dozun yaklaşık %33'ünün sistemik dolaşıma ulaştığını düşündürmektedir. Bileşiğin kimyasal yapısına (kuaterner amonyum bileşiği) ve in vitro%2-3'dür. Tiotropium bromürün, KOAH hastalarında, RESPIMAT inhalatör ile 5 |ig doz uygulanmasından 10 dakika sonra ölçülen kararlı durum pik plazma düzeyleri 10.5-11.7 pg/ml'dir ve çoklu kompartman modeli şeklinde hızla azalır. Kararlı durum çukur plazma konsantrasyonları 1.49-1.68 pg/ml'dir. Besinlerin tiotropium absorpsiyonu üzerinde etkili olması beklenmemez.Dağılım:İlaç plazma proteinlerine %72 oranında bağlanır ve 32 L/kg'lık bir dağılım hacmi gösterir. Akciğerdeki lokal konsantrasyonlar bilinmemektedir, ancak uygulama şekli, akciğerlerde önemli oranda daha yüksek konsantrasyonların varlığını düşündürmektedir. Sıçanlarda yapılan çalışmalarda, tiotropium bromürün kan beyin bariyerini önemli bir düzeyde geçmediği gösterilmiştir. Biyotransformasyon:Biyotransformasyona uğrama derecesi küçüktür. Bu durum, sağlıklı genç gönüllülerde bir doz intravenöz uygulamadan sonra %74 oranında değişmemiş maddenin idrarla atılmasıyla belirlenmiştir. Ester yapısındaki tiotropium bromür, enzimatik olmayan bir yol ile parçalanarak, bir alkol olan N-metilskopin ve ditiyenilglikolik aside parçalanır; bu maddelerin her ikisi de muskarinik reseptörler üzerinde etkisizdir. İnsan karaciğer mikrozomları ve insan hepatositleri ile yapılan in vitroin vitroçalışmalar bu enzimatik yolağın CYP2D6 (ve 3A4) inhibitörleri olan kinidin, ketokonazol ve gestoden ile inhibe edilebildiğini göstermiştir. Böylelikle CYP2D6 ve 3A4, dozun daha küçük bir bölümünün eliminasyonundan sorumlu metabolik yolakta yer alırlar. Tiotropium bromür, supra-terapötik konsantrasyonlarda bile, insan karaciğer mikrozomlarındaki sitokrom P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ya da 3A'yı inhibe etmez.Eliminasyon:İnhalasyon sonrasında tiotropiumun terminal eliminasyon yarı-ömrü 5 ve 6 gün arasındadır. Sağlıklı genç gönüllülerde intravenöz uygulanan dozdan sonra total klerens 880 ml/dk, bireyler arası değişkenlik ise %22 bulunmuştur. İntravenöz uygulanan tiotropium bromür, asıl olarak idrar yoluyla değişmemiş halde atılır (%74). Çözeltinin inhalasyonundan sonra dozun 20.1-29.4'ü idrarla atılırken, geri kalanı başlıca bağırsaklarda emilmemiş ilaç halinde bulunur ve feçes ile elimine edilir. Tiotropium bromürün renal klerensi, kreatinin klerensininden daha yüksektir; bu durum idrara sekrete olduğunu işaret etmektedir. Doğrusallık/Doğrusal olmayan durum:Tiotropium bromür, terapötik aralıkta, intravenöz uygulama, kuru toz inhalasyonu ve çözelti inhalasyonu sonrasında doğrusal farmakokinetik gösterir. Yaş: Geriyatrik popülasyon:Esas olarak böbrekler yoluyla atılan bütün ilaçlardan beklendiği gibi, ileri yaş tiotropium bromürün renal klerensinde bir azalma ile ilişkili bulunmuştur (58 yaşından küçük KOAH hastalarında 326 ml/dk, 70 yaşından büyük KOAH hastalarında 163 ml/dk); bu durum böbrek fonksiyonlarının azalmasıyla açıklanabilir. İnhalasyon sonrasında, idrarda tiotropium bromür ekskresyonu %14'ten (sağlıklı genç gönüllüler), %7 civarına (KOAH'ı olan kişiler) azalmıştır; ancak KOAH bireyler arası ve bireyin kendi içindeki değişkenlere göre karşılaştırıldığında, plazma konsantrasyonları ilerleyen yaş ile birlikte anlamlı bir farklılık göstermemiştir (kuru toz inhalasyonu sonrasında EAA0-4saat değerinde %43 artış). Böbrek yetmezliği:Esas olarak böbrekler yoluyla atılan bütün ilaçlardaki ortak bir özellik olarak, böbrek bozukluğu, hem intravenöz infüzyon, hem de kuru toz inhalasyonlarından sonra plazma ilaç konsantrasyonlarında yükselme ve renal ilaç klerensinde azalma ile ilişkili bulunmuştur. Yaşlı hastalarda sıklıkla görülen hafif böbrek bozukluğu (CLcr 50-80 ml/dk), tiotropium bromürün plazma konsantrasyonlarını az miktarda yükseltmiştir (intravenöz infüzyon sonrasında EAA0-4saat değerinde %39 artış). Orta ile şiddetli böbrek bozukluğu (CLcr <50 ml/dk) olan KOAH hastalarında intravenöz tiotropium bromür uygulaması, plazma konsantrasyonlarının iki katına çıkmasıyla sonuçlanmıştır (EAA0-4saat değerinde %82 artış) ve bu durum kuru toz inhalasyonundan ve RESPIMAT inhalatör ile çözelti inhalasyonundan sonra ölçülen plazma konsantrasyonları ile de doğrulanmıştır. Karaciğer yetmezliği:Karaciğer yetmezliğinin tiotropium bromürün farmakokinetiği üzerinde önemli bir etkisinin olması beklenmemektedir. Tiotropium bromür büyük çoğunlukla renal eliminasyon yoluyla (sağlıklı genç gönüllülerde %74) ve enzimatik olmayan basit ester parçalanmasıyla farmakolojik olarak inaktif ürünlere ayrılarak vücuttan atılmaktadır. Pediyatrik hastalar:Bakınız: 4.2. Farmakokinetik ve farmakodinamik etkileşimler:Farmakokinetik ve farmakodinamik arasında doğrudan bir ilişki yoktur. 5.3 Klinik öncesi güvenlilik verileri Güvenlilik farmakolojisi, tekrar doz toksisitesi ve üreme toksisitesi ile ilgili yapılan konvansiyonel çalışmalarda gözlenen pek çok etki, tiotropium bromürün antikolinerjik etkileri ile açıklanabilir. Hayvanlarda tipik olarak yiyecek tüketiminde azalma, vücut ağırlığının artışında inhibisyon, ağız ve burun kuruluğu, lakrimasyonda ve salivasyonda azalma, midriyazis ve kalp hızında artış gözlenmiştir. Tekrar doz toksisite çalışmalarında belirtilen diğer ilişkili etkiler şunlardır: sıçan ve farelerde init, nasal kavite ve larinkste epiteliyal değişikliklerle beliren solunum yollarında hafif irritasyon, sıçanlarda mesanede proteinli depositler ve litiyazis ile birlikte prostatittir. Gebelik, embriyonal/fötal gelişim, doğum veya postnatal gelişim ile ilgili zararlı etkiler sadece maternal toksik doz düzeylerinde gösterilmiştir. Tiatropium bromür, sıçanlarda ve tavşanlarda teratojenik değildir. Sıçanlarda yapılan genel üreme ve fertilite çalışmalarında, tedavi edilen anne/babada ve yavrularında hiç bir dozda fertilite veya çiftleşme performansı ile ilgili bir advers etki görülmemiştir. Solunumla ilgili (irritasyon) ve ürogenital (prostatit) değişiklikler ve üreme toksisitesi, lokal veya sistemik olarak, terapötik maruziyet düzeylerinin 5 katından daha fazla maruziyet durumlarında gözlenmiştir. 6. FARMASÖTİK ÖZELLİKLER 6.1 Yardımcı maddelerin listesi Benzalkonyum klorür Disodyum edetat Saf su pH ayarlaması için hidroklorik asit 6.2 Geçimsizlikler Geçerli değil. 6.3 Raf ömrü Satışa sunulmak üzere ambalajlanmış SPIRIVA RESPIMAT'ın raf ömrü 36 aydır. 6.4 Saklamaya yönelik özel tedbirler 25o C'nin altında oda sıcaklığında saklanmalıdır. Dondurulmamalıdır. 6.5 Ambalajın niteliği ve içeriği Aluminyum silindir içinde plastik kap; entegre kapatma halkası ve kurcalamaya karşı koruyucu mühür ile birlikte plastik kapak. Her SPIRIVA RESPIMAT inhalatörü 30 doz (60 puf) içerir. Her pufta 2.5 mikrogram tiotropium salıverilmektedir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürün ya da atık materyaller Tıbbi Atıkların Kontrolü ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT S AHİBİBoehringer Ingelheim İlaç Ticaret A.Ş. Eski Büyükdere Cad., USO Center No: 245, K: 13-14 34398 - Maslak, İSTANBUL Faks: (0 212) 329 1101 8. RUHSAT NUMARASI
Tel: (0 212) 329 1100 128/08 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ İlk ruhsat tarihi: 15.06.2009 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TA RİHİ15 / 15 |
İlaç BilgileriSpiriva Respimat 2.5 Mcg/püskürtme İnhalasyon Çöz...Etken Maddesi: Tiotropium Bromür Monohidrat Atc Kodu: R03BB04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.