Nimenrix 0.5 Ml Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Aşılar » Bakteriyel Aşılar » Meningokok A, C, Y ve W135 Oligosakkariti KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADINİMENRİX 0.5mL IM enjeksiyon için toz içeren flakon ve çözücü içeren kullanıma hazır enjektörMeningokokal polisakkarit grup A, C, W-135 ve Y konjuge aşı 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde:Bir doz sulandırılmış aşı (0.5 mL) içerisinde;Neisseria meningitidisNeisseria meningitidisNeisseria meningitidisNeisseria meningitidisserogrup Y polisakkariti1
5 mikrogram 5 mikrogram 5 mikrogram 5 mikrogram 44 mikrogram 28 mg 4.5 mg 1tetanoz toksoid taşıyıcı proteine konjuge Yardımcı maddeler:SukrozSodyum klorür Yardımcı maddeler için 6.1'e bakınız. 3. FARMASOTİK FORMEnjeksiyonluk solüsyon için toz ve çözücü.Toz beyaz renktedir. Çözücü berrak ve renksizdir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar12 aylıktan itibaren bireylerin,Neisseria meningitidisA, C, W-135 ve Y serogruplarının sebep olduğu invaziv meningokokal hastalıklara karşı aktif bağışıklanması (Bkz. Bölüm 5.1).4.2. Pozoloji ve uygulama şekli Pozoloji / Uygulama sıklığı ve süresiPrimer aşılamaBağışıklama için 0.5 mL'lik tek bir doz sulandırılmış aşı kullanılır. Rapel aşılamaNİMENRİX, daha önce saf polisakkarit meningokokal aşı ile aşılanmış bireylere rapel doz olarak uygulanabilir (Bkz. Bölüm 4.4 ve 5.1). Daha önce meningokokal C konjuge aşı ile aşılanmış bireylerle ilgili bilgi mevcut değildir. Aşılanmaya NİMENRİX ile başlamış bireylerde rapel doz ihtiyacı ortaya konmamıştır (Bkz. Bölüm 4.4 ve 5.1). NİMENRİX, mevcut resmi talimatlara uygun şekilde kullanılmalıdır. Uygulama şekliNİMENRİX sadece intramüsküler enjeksiyon içindir, tercihen deltoid kasa uygulanır.Aşı ayrıca, 12 ila 23 aylık çocuklarda, uyluğun anterolateral bölümüne de uygulanabilir (Bkz. Bölüm 4.4 ve 4.5). Aşının uygulama öncesi sulandırılmasına ilişkin talimatlar için bölüm 6.6'ya bakınız. Pediyatrik popülasyon:NİMENRİX, 12 aylıktan büyük bireylerde kullanılır.4.3. KontrendikasyonlarıNİMENRİX, aktif maddeler ya da aşı içerisinde bulunan yardımcı maddelerden herhangi birine aşırı duyarlılığı olan kişilere uygulanmamalıdır.4.4. Özel kullanım uyarıları ve önlemleriNİMENRİX, hiçbir koşulda damar içine, deri içine ya da deri altına uygulanmamalıdır.Bağışıklama öncesi tıbbi geçmişin gözden geçirilmesi (özellikle daha önceki bağışıklama ve istenmeyen olayların ortaya çıkma ihtimali ile ilişkili olarak) ve klinik muayene, iyi klinik uygulamaların bir parçasıdır.Bütün enjektabl aşılarla olduğu gibi aşının uygulaması sonrasında nadir anafilaktik olay ortaya çıkması ihtimaline karşı gerekli tıbbi tedavi ve gözetim her zaman hazır bulundurulmalıdır. Diğer aşılarla olduğu gibi akut ciddi ateşli hastalığı olan bireylerde NİMENRİX uygulaması ertelenmelidir. Soğuk algınlığı gibi minör bir enfeksiyon varlığı aşılamanın ertelenmesine sebep olmamalıdır. Herhangi bir aşılama sonrasında ve hatta öncesinde iğne ile enjeksiyona karşı psikojenik cevap olarak senkop (bayılma) olabilir. Buna, geçici görme bozukluğu, parestezi ve toparlanma sırasında tonik-klonik ekstremite hareketleri gibi çeşitli nörolojik bulgular eşlik edebilir. Bayılmaya bağlı yaralanmalardan kaçınmak için gerekli önlemlerin hazır olması önemlidir. İntramüsküler uygulanan diğer aşılarla olduğu gibi, trombositopenisi veya herhangi bir pıhtılaşma bozukluğu olan kişilerde intramüsküler uygulamanın ardından kanama oluşabileceğinden, bu kişilere NİMENRİX dikkatle uygulanmalıdır. NİMENRİX sadece Neisseria meningitidisNeisseria meningitidisserogruplarına karşı korumayacaktır.Tüm aşılarla olduğu gibi, aşılanan tüm bireylerde bir koruyucu bağışıklık yanıtı meydana gelmeyebilir. İmmün sistemi baskılayan tedavi alan veya immün yetmezliği olan hastalarda, yeterli bağışıklık yanıtının elde edilememesi beklenebilir. Terminal kompleman eksiklikleri ve anatomik ya da fonksiyonel aspleni gibi durumlardan kaynaklanan meningokokal enfeksiyonlara duyarlılığı artmış hastalarda emniyet ve immünojenitesi değerlendirilmemiştir. Bu bireylerde yeterli bağışıklık yanıtı meydana gelemeyebilir. Daha önce bir polisakkarid meningokok aşısıyla ve 30-42 ay sonra Nimenrix ile aşılanan olguların tavşan kompleman serumu bakterisid yöntemiyle (rSBA) ölçülen Geometrik Ortalama Titreleri (GMT), önceki 10 yıl içinde herhangi bir meningokok aşısı yapılmamış olan olgulardan daha düşüktür (bkz. Bölüm 5.1). Bu gözlemin klinik önemi bilinmemektedir. Aşılamadan önce anti-tetanoz antikoru verilmesinin etkisiNimenrix'in yaşamın ikinci yılında bir DTaP-HBV-IPV/Hib aşısıyla sıralı olarak veya eşzamanlı olarak uygulanmasının güvenliliği ve immünojenikliği değerlendirilmiştir. Nimenrix'in DTaP-HBV-IPV/Hib aşısından 1 ay sonra uygulanması daha düşük MenA, MenC ve MenW-135 rSBA GMT'leriyle sonuçlanmıştır (bkz. Bölüm 4.5). Bu gözlemin klinik önemi bilinmemektedir. Bu aşıların birlikte veya sıralı olarak uygulandığı zaman bildirilen reaktojenlik yaşamın ikinci yılında uygulanan DTaP-HBV-IPV/Hib aşısının rapel dozundan sonra bildirilenle benzerdir. Nimenrix'in anti-tetanoz antikoru konsantrasyonları üzerindeki etkisiHer ne kadar Nimenrix ile aşılamadan sonra anti-tetanoz toksoidi (TT) antikoru konsantrasyonlarında bir artış gözlenmiş olsa da, Nimenrix tetanoz aşısı yerine kullanılamaz. Nimenrix'in yaşamın ikinci yılında TT içeren bir aşıyla birlikte veya ondan 1 ay önce uygulanması TT'ye verilen yanıtı bozmaz ya da güvenliliği anlamlı derecede etkilemez. 2 yaşın üzerindeki veriler mevcut değildir. MenA'ya karşı serum bakterisid antikor titrelerinin persistansıÇalışmalarda insan komplemanı kullanıldığında (aşılamadan sonra 12. aydan itibaren ölçüldüğünde), MenA'ya karşı serum bakterisid antikor titrelerinin diğer gruplar (C, W-135, Y) için olanlardan daha hızlı azaldığı gözlenmiştir (bkz. Farmakodinamik özellikleri). hSBA-MenA antikor titrelerindeki bu hızlı azalmanın klinik önemi bilinmemektedir. Bununla birlikte; özellikle MenA'ya maruz kalma riski altında olan ve NİMENRİX'in ilk dozunu bir yıldan daha uzun bir süre önce alan bireylerde ikinci bir NİMENRİX dozunun uygulanması düşünülebilinir. Mevcut bilgiler ikinci bir dozun, aşıda bulunan dört meningokokal tipin tümüne karşı anamnestik bağışıklık yanıtı ortaya çıkaracağını göstermektedir. Halen NİMENRİX'in ikinci dozunun emniyeti hakkında çok sınırlı bilgi bulunmaktadır. NİMENRİX her dozunda 1 mmol (23 mg)'dan az sodyum ihtiva eder, yani esasında sodyum içermez. NİMENRİX, 0.5mL'lik dozda 28 mg sukroz içermektedir. Uygulama yolu nedeniyle sukroza bağlı herhangi bir olumsuz etki beklenmez. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriNİMENRİX aşağıdaki aşılardan herhangi biriyle birlikte uygulanabilir: Hepatit A (HAV) ve Hepatit B (HBV) aşıları, kızamık - kabakulak - kızamıkçık (KKK) aşısı, kızamık - kabakulak - kızamıkçık - suçiçeği (KKKS) aşısı, 10-valan pnömokokal konjuge aşı veya adjuvan eklenmemiş mevsimsel grip aşısı.NİMENRİX ayrıca yaşamın ikinci yılında DTaP-HBV-IPV/Hib aşısı gibi hepatit B, inaktif çocuk felci ya da Haemophilus influenzae tip B ile kombine DTaP aşıları dahil olmak üzere, kombine difteri - tetanoz - aselüler boğmaca (DTaP) aşılarıyla eş zamanlı olarak verilebilir. NİMENRİX'in emniyeti ve immünojenitesi, yaşamın ikinci yılında bir DTaP-HBV-IPV/Hib aşısıyla ardarda veya beraber uygulandığında araştırılmıştır. Tavşan kompleman serum bakterisid testiyle (rSBA) ölçüldüğü üzere, DTaP-HBV-IPV/Hib aşısından bir ay sonra NİMENRİX uygulaması, daha düşük MenA, MenC ve MenW-135 Geometrik Ortalama Titreleriyle (GMTs) sonuçlanmıştır. Bu gözlemin klinik anlamı bilinmemektedir çünkü bireylerin en az %99.4'ünde (N=178) rSBA titreleri her bir grupta (A, C, W-135, Y) >8 çıkmıştır. Mümkün olduğu durumlarda, NİMENRİX ve DTaP-HBV-IPV/Hib aşısı gibi bir tetanoz toksoid (TT) içeren aşı eş zamanlı uygulanmalıdır ya da NİMENRİX, TT-içeren aşıdan en az bir ay önce uygulanmalıdır. 10-valan pnömokokal konjuge aşı ile eşzamanlı uygulamadan bir ay sonra, bir pnömokokal serotip (tetanoz toksoidi taşıyıcı proteine konjüge 18C) için daha düşük Geometrik Ortalama Antikor Konsantrasyonları (GMCs) ve Opsono Fagositik Test (OPA) antikor Geometrik Ortalama Titreleri (GMT) gözlenmiştir. Bu bulgunun klinik anlamı bilinmemektedir. Eşzamanlı uygulamanın diğer dokuz pnömokokal serotip üzerine herhangi bir etkisi olmamıştır. Eğer NİMENRIX başka bir enjektabl aşı ile aynı zamanda verilecekse, aşılar her zaman farklı enjeksiyon bölgelerine uygulanmalıdır. Diğer aşılarla olduğu gibi, bağışıklık sistemini baskılayan tedavi alan hastalarda yeterli yanıtın elde edilememesi beklenebilir. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Veri yoktur.Gebelik dönemiGebe kadınlarda NİMENRİX kullanımı hakkında kısıtlı deneyim mevcuttur.Hayvanlar üzerinde yapılan çalışmalar, gebelik ve-veya embriyonal/fetal gelişim ve-veya doğum ve-veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır. NİMENRİX gebelik esnasında, doktor önerisi ile, uygulanmasının avantajları olası istenmeyen etkiler ve fetüs için muhtemel risklerden belirgin şekilde üstünse kullanılmalıdır. Laktasyon dönemiEmziren kadınlara uygulanan NİMENRİX'in güvenilirliği araştırılmamıştır. NİMENRİX'in insan sütünden de atılıp atılmadığı bilinmemektedir.NİMENRİX emziren kadınlarda sadece muhtemel faydalar potansiyel risklerden fazla ise kullanılmalıdır. Üreme yeteneği/ FertiliteÜreme toksisitesi ve fertilite çalışmaları insanlar için özel bir tehlike ortaya çıkartmamıştır.4.7. Araç ve makine kullanımı üzerine etkilerNİMENRİX'in araç ve makine kullanma becerisi üzerine etkisi ile ilgili hiç bir çalışma yapılmamıştır. Bununla birlikte 4.8 İstenmeyen etkiler bölümünde belirtilen etkilerin bazıları araç ve makine kullanımını etkileyebilir.4.8. İstenmeyen etkiler Klinik çalışma verisi:Aşağıda sunulan emniyet profili, 8108 bireyin bir doz NİMENRİX ile aşılandığı klinik çalışmalardan elde edilen havuz analizine dayanmaktadır.İstenmeyen etkilerin sıklığı aşağıdaki gibi sınıflandırılmıştır: Çok yaygın : (>1/10) Yaygın (>1/100, <1/10) Yaygın olmayan (>1/1000, <1/100) Seyrek (>1/10000,<1/1000) Çok seyrek (<1/10000) Metabolizma ve beslenme bozukluklarıÇok yaygın: iştah kaybıPsikiyatrik bozukluklarÇok yaygın: irritabiliteYaygın olmayan: uykusuzluk, ağlama Sinir sistemi bozukluklarıÇok yaygın: uyuşukluk, başağrısı Yaygın olmayan: hipoestezi, sersemlikMide bağırsak bozukluklarıYaygın: gastrointestinal semptomlar (diyare, kusma ve bulantı dahil)Deri ve derialtı doku bozukluklarıYaygın olmayan: kaşıntı, döküntüKas-iskelet ve bağ dokusu bozukluklarıYaygın olmayan: miyalji, ekstremitelerde ağrıGenel bozukluklar ve uygulama bölgesi ile ilgili durumÇok yaygın: uygulama bölgesinde ateş, şişme, ağrı ve kızarıklık, yorgunluk Yaygın: enjeksiyon bölgesinde hematomYaygın olmayan: halsizlik, enjeksiyon bölgesinde reaksiyon (sertleşme, kaşıntı, sıcaklık, anestezi dahil) 4.9 Doz aşımı ve tedavisiHiç bir doz aşımı vakası bildirilmemiştir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özellikleriFarmakoterapötik grubu: bakteriyel aşılar, ATC kodu J07AH08Etki MekanizmasıAnti-kapsüler meningokokal antikorlar, kompleman aracılığıyla bakterileri öldürerek meningokokal hastalıklara karşı korurlar. Tavşan komplemanı (rSBA) ya da insan komplemanı (hSBA) kullanılarak yapılan testlerle ölçüldüğünde, NİMENRİX, A, C, W-135 ve Y serogruplarının kapsüler polisakkaritlerine karşı bakterisid antikorların üretimini indüklemektedir. NİMENRİX gibi meningokokal konjüge aşılar, kapsüler polisakkariti T-hücre epitopları içeren taşıyıcı bir proteine konjüge ederek, kapsüler polisakkarite bağışıklık yanıtının doğasını T-hücre bağımsızdan T-hücre bağımlıya değiştirmektedir. Farmakodinamik EtkilerNİMENRİX'in klinik çalışma programı dünya çapında 17 ülkede gerçekleştirilen 17 klinik çalışmayı içermektedir. Tek doz NİMENRİX'in immünojenitesi 12 aylıktan 55 yaşına kadar 8,000'den fazla bireyde değerlendirilmiştir. Aşının etkinliği, immünolojik bakımdan en az ruhsatlı meningokokal aşılar kadar etkili olduğu (rSBA titreleriyle en az 1:8 oranlarında karşılaştırılmasına dayanarak) gösterilerek ortaya konmuştur. İmmünojenite, A, C, W-135 ve Y meningokokal gruplara karşı koruyucu etkinliğin bio-göstergeleri olan rSBA veya hSBA kullanılarak ölçülmüştür. Aşıya yanıt, 2-55 yaşlarındaki bireylerde aşağıda belirtilen ölçümlere sahip olanların oranı olarak tanımlanmıştır: Başlangıçta seronegatif olan bireylerde (örn. aşılama öncesi rSBA titresi <8) rSBA titreleri >32 olanlar, Başlangıçta seropozitif olan bireylerde (örn. aşılama öncesi rSBA titresi >8) aşılama sonrası rSBA titrelerinde aşılama öncesi değere göre en az 4 kat artış olanlar. Aşı immünojenitesi12-23 aylık bebeklerde immünojeniteMenACWY-TT-039 ve MenACWY-TT-040 kodlu klinik çalışmalarda, NİMENRİX veya ruhsatlı bir meningokokal C-CRM197 konjuge aşı (MenC-CRM) ile bağışıklamaya karşı bağışıklık yanıtı değerlendirilmiştir. rSBA titreleri >8 olarak değerlendirildiğinde, NİMENRİX, dört gruba karşı bir bakterisid antikor yanıtı oluşturmuştur ki grup C'ye karşı ruhsatlı MenC-CRM aşısının oluşturduğu yanıtla karşılaştırılabilir bir yanıt oluşturmuştur (Tablo 1). Tablo 1:12-23 aylık bebeklerde bakterisid antikor yanıtı (rSBA)
İmmünojenite analizi, immünojenite ile ilgili protokole-uygun (ATP) kohortlarda yapılmıştır.(1)(2)MenACWY-TT-039 çalışmasında, ikinci sonlanım noktası açısından kompleman kaynağı olarak insan serumu (hSBA) kullanılarak serum bakterisid etkinliği de ölçülmüştür (Tablo 2).Tablo 2:12-23 aylık bebeklerde bakterisid antikor yanıtı (hSBA)
İmmünojenite analizi, immünojenite ile ilgili ATP kohortunda yapılmıştır.(1) kan örnekleri aşılamadan 42 ila 56 gün sonra alınmıştır2-10 yaşlarındaki çocuklarda immünojenite2-10 yaşlarındaki çocuklarda yürütülen iki karşılaştırmalı çalışmada, bir gruba bir doz NİMENRİX, diğer gruba da karşılaştırma ürünü olarak ya ruhsatlı bir MenC-CRM aşısından bir doz (MenACWY-TT-081 çalışması) ya da GlaxoSmithKline Biologicals'ın ruhsatlı bir saf polisakkarit meningokokal grup A, C, W-135, Y (ACWY-PS) aşısından bir doz (MenACWY-TT-038 çalışması) verilmiştir. MenACWY-TT-038 çalışmasında, dört gruba (A, C, W-135 ve Y) karşı aşı yanıtı açısından NİMENRİX'in, en az ruhsatlı ACWY-PS aşısı kadar etkili olduğu gösterilmiştir (Tablo 3). Tablo 3:2-10 yaşlarındaki çocuklarda aşılamadan 1 ay sonra NİMENRİX ve ACWY-PS aşısına karşı bakterisid antikor yanıtları (rSBA) (MenACWY-TT-038 çalışması)
İmmünojenite analizi, immünojenite ile ilgili ATP kohortunda yapılmıştır. VR: aşı yanıtıMenACWY-TT-081 çalışmasında, MenC grubuna karşı aşı yanıtı açısından NİMENRİX'in (N=268) en az bir diğer ruhsatlı MenC-CRM (N=92) aşısı kadar etkili olduğu gösterilmiştir [sırasıyla %94.8 (%95 GA: 91.4; 97.1) ve %95.7 (%95 GA: 89.2; 98.8)]. NİMENRİX grubu için GMTler [2794.8 (%95 GA: 2393.5; 3263.3)] MenC-CRM aşısına karşı olanlardan [5291.6 (%95 GA: 3814.6; 7340.5)] daha düşük olmuştur.11-17 yaşlarındaki ergenler ve 18 yaş ve üzeri yetişkinlerde immünojenite11-17 yaşlarındaki ergenlerde (MenACWY-TT-036 çalışması) ve 18-55 yaşlarındaki yetişkinlerde (MenACWY-TT-035 çalışması) gerçekleştirilen iki klinik çalışmada, bir doz NİMENRİX ya da bir doz ACWY-PS aşısı uygulanmıştır. Hem ergenlerde hem de yetişkinlerde, aşı yanıtı açısından, NİMENRİX'in immünolojik açıdan en az ACWY-PS aşısı kadar iyi olduğu gösterilmiştir. Dört meningokokal gruba karşı NİMENRİX tarafından oluşturulan yanıt, ACWY-PS aşısı tarafından oluşturulan yanıta ya benzer düzeyde ya da daha yüksek olmuştur (Tablo 4). Tablo 4:11-17 yaşlarındaki ergenlerde ve 18 yaş ve üzeri yetişkinlerde aşılamadan 1 ay sonra NİMENRİX ve ACWY-PS aşısına karşı bakterisid antikor yanıtları (rSBA).
İmmünojenite analizi, immünojenite ile ilgili ATP kohortlannda yapılmıştır. VR: aşı yanıtıBağışıklık yanıtının kalıcılığı12 aylıktan 55 yaşa kadar olan bireylerde NİMENRİX tarafından oluşturulan bağışıklık yanıtının kalıcılığı, aşılamadan sonraki 12 ila 42 ay aralığında değerlendirilmiştir. Tüm yaş gruplarında, kalıcılığın değerlendirildiği zaman noktasında dört grup için gözlenen rSBA GMTler, aşılanmadan öncekine göre daha yüksek olmuştur. Tüm gruplar için (A, C, W-135, Y), NİMENRİX tarafından oluşturulan antikorların kalıcılığı, ruhsatlı meningokokal aşılar (örneğin 12-23 aylık bireylerde MenC-CRM aşısı ve 2 yaş üstündeki bireylerde ACWY-PS aşısı) tarafından oluşturulanlara benzer ya da daha yüksek olmuştur. Tüm yaş gruplarında gözlemlenen rSBA-MenA kalıcılığının aksine, testlerde insan komplemanı kullanıldığında, MenA'ya karşı oluşan serum bakterisid antikor titrelerinde diğer gruplara (C, W-135, Y) karşı oluşanlara kıyasla daha hızlı bir azalma (dozlamayı takip eden 12 aydan sonraki ölçümlerde) olmuştur. (Tablo 5, 6 ve 8). hSBA-MenA antikorlarındaki bu hızlı azalma diğer meningokokal aşılarda da görülmüştür. hSBA-MenA antikor titrelerindeki bu hızlı azalmanın klinik önemi bilinmemektedir (Bkz. Özel kullanım uyarıları ve önlemleri). 12-23 aylık bebeklerde bağışıklık yanıtının kalıcılığıMenACWY-TT-048 çalışmasında bağışıklık yanıtının kalıcılığı, MenACWY-TT-039 çalışmasında ilk defa aşılanan bebeklerde aşılamadan 2 yıl sonraki rSBA ve hSBA ile değerlendirilmiştir (Tablo 5). Tablo 5:Aşılama sırasında 12-23 aylık olan bebeklerde aşılamadan 2 yıl sonraki kalıcılık verileri
İmmünojenite analizi, kalıcılık ile ilgili ATP kohortunda yapılmıştır.6-10 yaşlarındaki çocuklarda bağışıklık yanıtının kalıcılığıMenACWY-TT-028 çalışmasında bağışıklık yanıtının kalıcılığı, MenACWY-TT-027 çalışmasında ilk defa aşılanan 6-10 yaşlarındaki çocuklarda aşılamadan 1 yıl sonraki hSBA ile değerlendirilmiştir (Tablo 6). Tablo 6:6-10 yaş çocudarda aşılamadan 1 ay ve 1 sene sonraki kalıcılık
İmmünojenite analizi, kalıcılık ile ilgili ATP kohortunda yapılmıştır.11-17 yaşlarındaki ergenlerde bağışıklık yanıtının kalıcılığıMenACWY-TT-043 çalışmasında, MenACWY-TT-036 çalışmasında ilk defa aşılanan ergenlerde aşılamadan 2 yıl sonraki bağışıklık yanıtının kalıcılığı değerlendirilmiştir (Tablo 7). Bu çalışmanın ön sonuçları için Tablo 4'e bakınız. Tablo 7:Aşılama sırasında 11-17 yaşlarında olan ergenlerde 2 yıl sonraki kalıcılık verileri(rSBA)
İmmünojenite analizi, kalıcılık ile ilgili ATP kohortunda yapılmıştır.hSBA ile değerlendirildiğinde 11-25 yaşlarındaki ergenler ve yetişkinlerdeki bağışıklıkyanıtının kalıcılığıMenACWY-TT-059 çalışmasında, MenACWY-TT-052 çalışmasında ilk defa aşılanan 11-25 yaşlarındaki ergen ve yetişkinlerde aşılamadan 1 yıl sonraki bağışıklık yanıtının kalıcılığı hSBA ile değerlendirilmiştir. Tüm gruplar için (A, C, W-135, Y), NIMENRİX tarafından oluşturulan antikorların kalıcılığı, ruhsatlı kuadrivalan meningokokal difteri toksoidi (DT) konjuge aşısı (ACWY-DT) ile indüklenene benzer ya da ondan daha yüksek olmuştur (Tablo 8). Tablo 8:hSBA ile değerlendirilen 11-25 yaşlarındaki ergen ve yetişkinlerde aşılamadan 1 ay ve 1 yıl sonraki kalıcılık verileri
İmmünojenite analizi, kalıcılık ile ilgili ATP kohortunda yapılmıştır.İmmün hafızaMenACWY-TT-014 çalışmasında, daha önce MenACWY-TT-013 çalışmasında 12-14 aylıkken NİMENRİX ya da ruhsatlı bir MenC-CRM aşısı ile ilk defa aşılanan bebeklerde, yaşamlarının üçüncü yılında beşinci doz ACWY-PS (her polisakkaritten 10 |ig) aşı uygulanmasından bir ay sonra immün hafızanın indüksiyonu değerlendirilmiştir. Test dozundan bir ay sonra, ilk defa NİMENRİX ile aşılanmış bireyler tarafından oluşturulan GMTler, A, C, W-135 ve Y grupları için 6.5 ila 8 kat artmıştır ve bu NİMENRİX'in A, W-135 ve Y grupları için immün hafızayı indüklediğini göstermektedir. Test sonrası rSBA-MenC GMT her iki grupta aynı olmuştur ve bu C grubunda NİMENRİX'in ruhsatlı MenC-CRM aşısına benzer şekilde bir immün hafıza indüklediğini göstermektedir (Tablo 9). Tablo 9:12-14 aylıkken NİMENRİX ya da MenC-CRM aşısı uygulanan bireylerde test aşısından 1 ay sonraki bağışıklık yanıtı (rSBA).
İmmünojenite analizi, immünojenite ile ilgili ATP kohortunda yapılmıştır.Daha önceden saf polisakkarit meningokokal aşı ile aşılanan bireylerde immünojenite4.5-34 yaş arasındaki bireylerde yürütülen MenACWY-TT-021 çalışmasında, ACWY-PS aşısından 30 ila 42 ay sonra uygulanan NİMENRİX'in immünojenitesi, son 10 yıl boyunca herhangi bir meningokokal aşı ile aşılanmamış aynı yaştaki bireylere uygulanan NİMENRİX'in immünojenitesi ile karşılaştırılmıştır. NİMENRİX'den 30-42 ay önce bir doz ACWY-PS aşısı uygulanmış bireylerde rSBA GMTler önemli ölçüde daha düşük olmuştur (Tablo 10). Tüm bireyler her grup (A, C, W-135 ve Y) için 8 veya daha yüksek rSBA titrelerine ulaştığı için bu gözlemin klinik anlamı bilinmemektedir. Tablo 10:Bireylerin meningokokal aşılanma geçmişine göre bireylerde NİMENRİXaşılamasından 1 ay sonraki bağışıklık yanıtı (rSBA)
İmmünojenite analizi, immünojenite ile ilgili ATP kohortunda yapılmıştır.5.2. Farmakokinetik özelliklerAşılar için farmakokinetik özelliklerin değerlendirilmesi gerekmemektedir.5.3. Klinik öncesi güvenlilik verileriLokal tolerans, akut toksisite, tekrar doz toksisitesi, gelişimsel/üreme toksisitesi ve fertilite çalışmalarına dayanan klinik dışı veriler, insanlar için özel bir tehlike ortaya çıkartmamıştır.6. FARMASOTIK ÖZELLİKLER6.1. Yardımcı maddelerin listesiToz
Sukroz Trometamol
28 mg 97 ÇözücüSodyum klorür Enjeksiyonluk su
4.5 mg y.m. 0.5 mL 6.2. GeçimsizliklerGeçimsizlik çalışmaları mevcut olmadığı için, bu ürün diğer tıbbi ürünlerle karıştırılmamalıdır.6.3. Raf ömrüAşının son kullanma tarihi etiket ve ambalaj üzerinde belirtilmektedir.Raf ömrü, 3 yıldır. Aşı, sulandırıldıktan sonra hemen uygulanmalıdır. 6.4. Saklamaya yönelik özel tedbirlerNİMENRİX +2°C ila +8°C arası sıcaklıkta buzdolabında saklanmalıdır.Çözücüsü oda ısısında da saklanabilir (25°C) Dondurmayınız.Eğer aşı donmuşsa kullanmadan atınız.Işıktan koruyunuz. 6.5. Ambalajın niteliği ve içeriğiTıpalı (butil kauçuk) flakon (tip 1 cam) içerisinde 1 dozluk toz ve tıpalı (butil kauçuk) kullanıma hazır enjektör içerisinde 1 doz için 0.5 mL çözücü.Ambalaj içeriği: içinde iğne olan ya da olmayan 1 adet flakon ve 1 adet kullanıma hazır enjektör 6.6. Tıbbi ürünlerden arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.NİMENRİX, kullanıma hazır enjektör içeriğinin tamamının toz içeren flakona eklenmesiyle sulandırılmalıdır. İğneyi enjektöre takmak için aşağıdaki resme bakınız. Ancak NİMENRİX ile birlikte verilen enjektör, resimde anlatılan enjektörden biraz farklı olabilir. iğne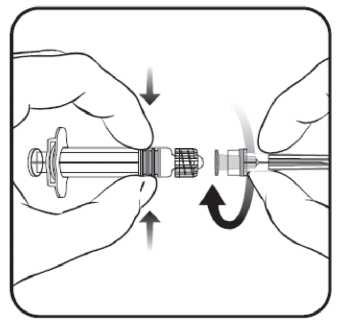 
İğne koruyucu \ 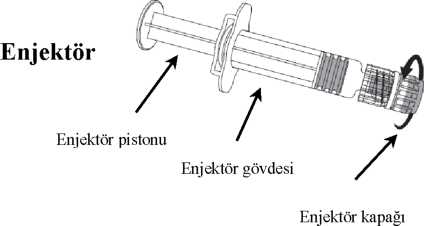 1. Enjektör gövdesini bir elde tutarak (enjektör pistonundan tutmaktan sakınınız), enjektör kapağını saat yönünün tersine çevirerek açınız. 2. İğneyi enjektöre takmak için, iğneyi saat yönünde kilitlenene kadar çeviriniz (Bkz. resim) 3. İğnenin koruyucu kapağını çıkartınız, bazen biraz sert olabilir. Çözücüyü toza ekleyiniz. Çözücüyü toza ekledikten sonra toz çözücü içinde tamamen çözünene kadar karışım iyice çalkalanmalıdır. Sulandırılan aşı berrak renksiz bir çözeltidir. Sulandırılan aşı uygulanmadan önce herhangi bir yabancı parçacık ve/veya fiziksel görünümünde değişiklik açısından görsel olarak kontrol edilmelidir. Bunlardan birinin görülmesi durumunda aşıyı kullanmadan atınız. Sulandırıldıktan sonra aşı hemen uygulanmalıdır. Aşıyı uygulamak için yeni bir iğne kullanılması gerekmektedir. 7. RUHSAT SAHİBİGlaxoSmithKline İlaçları Sanayi ve Ticaret A.Ş.Büyükdere Cad. No:173 1.Levent Plaza B Blok 34394, 1.Levent / İSTANBUL Tel no: 0 212 339 44 00 Faks no: 0 212 339 45 00 8. RUHSAT NUMARASI619. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 22.07.2013 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ20 |
İlaç BilgileriNimenrix 0.5 MlEtken Maddesi: Neisseria Meningitidis Serogrup A, C, W135, Y Pol... Atc Kodu: J07AH08 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.