Fluarix Tetra 0.5 Ml Im Enjeksiyon İçin Süspansiy... Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Aşılar » AŞI KOMBİNASYONLARI » Influenza vaccines » Influenza, purified antigen KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADIFLUARIX TETRA 0.5 mL IM enjeksiyon için süspansiyon içeren kullanıma hazır enjektör Kuadrivalan influenza aşısı (split virion, inaktif) Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler: Split influenza virüsü, inaktif, aşağıdaki suşlara eşdeğer antijen* içerir: A/California/7/2009 (H1N1) pdm09 - benzeri suş: 15 mikrogram ** A/Christchurch/16/2010 (NIB-74xp) A/Victoria/361/2011(H3N2)- benzeri suş: 15 mikrogram ** A/Texas/50/2012 (NYMC X-223A) B/Massachusetts/02/2012 benzeri suş: 15 mikrogram ** B/Massachusetts/02/2012 (NYMC BX-51B) B/Brisbane/60/2008 benzeri suş 15 mikrogram ** Belirtilen miktarlar 1 doz (0.5 mL) içindir. * Sağlıklı tavuk sürülerinden elde edilen döllenmiş tavuk yumurtalarında üretilmiştir. ** Hemaglutinin Bu aşı, 2013/2014 sezonu Dünya Sağlık Örgütü (Kuzey Yarımküre) önerileri ve Avrupa Birliği kararına uygundur. Yardımcı maddeler: Sodyum klorür
3,75 mg 1,3 mg 0,2 mg 0,1 mg Disodyum fosfat dodekahidrat Potasyum dihidrojen fosfat Potasyum klorür Yardımcı maddeler için 6.1'e bakınız. FLUARIX TETRA, üretim prosesinde kullanılan, ovalbumin ve tavuk proteini gibi yumurtalar, formaldehit, gentamisin sülfat ve sodyum deoksikolat kalıntıları içerebilir (bkz. Bölüm 4.3). 3. FARMASÖTİK FORM Enjeksiyon için süspansiyon içeren kullanıma hazır enjektör Renksiz-hafif opak bir süspansiyondur. 4. KLİNİK ÖZELLİKLER 4.1. Terapötik endikasyonlar FLUARIX TETRA, yetişkinler ve 3 yaşından büyük çocukların aşı içeriğinde bulunan influenza A ve B virüs tipleri sebebiyle oluşan grip hastalığından korunması amacıyla aktif bağışıklanmasında endikedir. 4.2. Pozoloji ve uygulama şekli Pozoloji Yetişkinler: FLUARIX TETRA tek bir 0,5 mL'lik enjeksiyon olarak uygulanmalıdır. Pediyatrik popülasyon: Daha önce influenzaya karşı hiç aşılanmamış 3 yaş üstü ve 9 yaş altı çocuklara, en az 4 hafta ara ile ikinci bir 0,5 mL'lik doz uygulanmalıdır. Uygulama sıklığı ve süresi Grip aşısı her yıl tek doz olarak uygulanmalıdır. Grip aşısının uygulanması için en önemli konu grip salgınının başlamamış olmasıdır. Grip salgınının başlangıcından önce (Eylül, Ekim, Kasım, Aralık) kullanımı önerilmektedir. Eğer kişi gribe yakalanmamış ise grip sezonunun sonuna kadar aşılama yapılabilir. Uygulama şekli FLUARIX TETRA intramüsküler enjeksiyon şeklinde, tercihen deltoid kasa veya anterolateral uyluğa (kas yoğunluğuna bağlı olarak) uygulanmalıdır. Kullanıma hazır enjektörün kullanılışı: Aşı kullanılmadan önce oda sıcaklığına getirilmelidir. Kullanmadan önce dolu enjektörü dikkatlice çalkalayınız. Aşı uygulamadan önce herhangi bir yabancı madde ve/veya fiziksel durumda değişiklik açısından gözle incelenmelidir. Bunlardan herhangi birinin görülmesi halinde aşı kullanılmamalıdır. Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği: Böbrek ve karaciğer yetmezliği olan kişilerdeki güvenilirlik ve etkinliği incelenmemiştir. Pediyatrik popülasyon: 3 yaşından küçük çocuklardaki güvenilirlik ve etkinliği incelenmemiştir. Bu nedenle 3 yaşından küçük çocuklarda kullanılmamalıdır. Geriyatrik popülasyon: Yaşlılarda etkinliği ve güvenilirliği incelenmiştir ve talimatlara uygun olarak kullanılması tavsiye edilmektedir. Diğer: Endojen ya da iyatrojenik immünsüpresyonu olan hastalarda antikor yanıtı yetersiz olabilir. 4.3. Kontrendikasyonlar Etkin maddelere, yardımcı maddelerden herhangi birine, veya yumurta (ovalbumin, tavuk proteinleri), formaldehit, gentamisin sülfat ve sodyum deoksikolat gibi eser miktarda bulanabilecek bileşenlere karşı aşırı duyarlılık. Ateşli hastalık ya da akut enfeksiyon geçiren hastalarda aşılama ertelenmelidir. 4.4. Özel kullanım uyarıları ve önlemleri FLUARIX TETRA, hiçbir koşulda damar içine, deri içine ya da deri altına uygulanmamalıdır. Bağışıklama öncesi tıbbi geçmişin gözden geçirilmesi (özellikle daha önceki bağışıklama ve istenmeyen olayların ortaya çıkma ihtimali ile ilişkili olarak) ve bir klinik muayene, iyi klinik uygulamaların bir parçasıdır. Tüm enjektabl aşılarda olduğu gibi aşının uygulanmasını takiben görülebilecek anafilaktik olaylar için gerekli tıbbi tedavi ve gözetim hazır bulundurulmalıdır. Diğer aşılarla olduğu gibi akut ciddi ateşli hastalığı olan bireylerde FLUARIX TETRA uygulaması ertelenmelidir. Soğuk algınlığı gibi minör bir enfeksiyonun varlığı aşılamanın ertelenmesine sebep olmamalıdır. Bağışıklık sistemini baskılayan tedavi gören veya bağışıklık sistemi yetersizliği olan hastalarda yeterli bağışıklık yanıtının alınamaması beklenebilir. FLUARIX TETRA influenza virüsünün tüm mevcut suşlarına karşı etkili değildir. FLUARIX TETRA aşının hazırlandığı suşlara ve yakından alakalı suşlara karşı koruma sağlamak için tasarlanmıştır. Tüm aşılarla olduğu gibi, aşılanan tüm bireylerde bir koruyucu bağışıklık yanıtı meydana gelmeyebilir. İntramüsküler uygulanan diğer aşılarla olduğu gibi, trombositopenisi veya herhangi bir pıhtılaşma bozukluğu olan kişilerde intramüsküler uygulamanın ardından kanama oluşabileceğinden, bu kişilere FLUARIX TETRA dikkatle uygulanmalıdır. Özellikle adolesanlarda, iğne ile enjeksiyona karşı bir psikojenik yanıt olarak aşılamanın ardından, hatta aşılama öncesinde senkop (bayılma) görülebilir. Buna geçici görme bozukluğu, parestezi ve iyileşme sırasında tonik-klonik hareketler gibi birçok nörolojik belirti eşlik edebilir. Bayılma sebebiyle oluşabilecek yaralanmaları önlemek için gerekli prosedürlerin hazır olması önemlidir. Herhangi bir aşılama sonrasında ve hatta öncesinde iğne ile enjeksiyona karşı psikojenik cevap olarak senkop (bayılma) olabilir. Buna, geçici görme bozukluğu, parestezi ve toparlanma sırasında tonik-klonik ekstremite hareketleri gibi çeşitli nörolojik bulgular eşlik edebilir. Bayılmaya bağlı yaralanmalardan kaçınmak için gerekli önlemlerin hazır olması önemlidir. FLUARIX TETRA Sodyum klorür, disodyum fosfat dodekahidrat, potasyum (klorür, dihidrojen fosfat) içerir. FLUARIX TETRA 0.5 ml'lik dozunda 23 mg'dan daha az sodyum ve 39 mg'dan daha az potasyum ihtiva eder. Sodyum ve potasyuma bağlı herhangi bir etki beklenmez. 4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleri Hiçbir etkileşim çalışması yapılmamıştır. Eğer FLUARIX TETRA diğer enjektabl aşılar ile aynı anda verilecekse, aşılar her zaman farklı enjeksiyon bölgelerine uygulanmalıdır. Grip aşısının ardından HIV1, Hepatit C ve özellikle HTLV1 antikorlarını saptamak için ELISA yöntemi kullanılarak yapılan serolojik testlerde yalancı pozitif sonuçlar gözlenmiştir. Western Blot tekniği ELISA ile alınan yalancı pozitif test sonuçlarınının aksini ispatlar. Geçici yalancı pozitif reaksiyonlar aşıya karşı gelişen IgM yanıtına bağlı olabilir. 4.6. Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon) FLUARIX TETRA ile hayvanlar üzerinde yapılan çalışmalar, üreme ve gelişimsel toksisite ile ilgili doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Klinik öncesi güvenlilik verileri). FLUARIX TETRA gebelik esnasında sadece açıkça gerekli olduğu durumlarda ve söz konusu yararların fötusa olan muhtemel risklerden daha fazla olduğunda kullanılmalıdır. Gebelik dönemi Hamile kadınlara uygulandığında FLUARIX TETRA'nın güvenilirliği değerlendirilmemiştir. İnaktif influenza aşıları gebeliğin bütün evrelerinde kullanılabilir. İlk trimester ile karşılaştırıldığında gebeliğin ikinci ve üçüncü trimesteri için daha çok sayıda güvenlilik verisi mevcut olmakla birlikte inaktif influenza aşılarının kullanımına ilişkin tüm dünyadan elde edilen veriler aşı ile ilişkili herhangi bir advers fetal veya maternal sonuç göstermemektedir. FLUARIX TETRA ile hayvanlar üzerinde yapılan çalışmalar, üreme ve gelişimsel toksisite ile ilgili doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Klinik öncesi güvenlilik verileri). FLUARIX TETRA gebelik esnasında sadece açıkça gerekli olduğu durumlarda ve söz konusu yararların fötusa olan muhtemel risklerden daha fazla olduğunda kullanılmalıdır. Laktasyon dönemi Emziren kadınlara uygulandığında FLUARIX TETRA'nın güvenilirliği değerlendirilmemiştir. FLUARIX TETRA'nın anne sütüne geçip geçmediği bilinmemektedir. FLUARIX TETRA laktasyon döneminde sadece söz konusu yararlar fötusa olan muhtemel risklerden daha fazla olduğunda kullanılmalıdır. Üreme yeteneği / Fertilite Üreme yeteneğini etkileyip etkilemediği bilinmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkiler Aşının araç ve makine kullanımı üzerinde etkisi yoktur. 4.8. İstenmeyen etkiler Klinik çalışmalar Güvenilirlik profili özeti 18 yaş ve üstü sağlıklı yetişkinler ve 3-17 yaş aralığındaki sağlıklı çocuklarda yapılan iki çalışmada FLUARIX TETRA (3000 yetişkinden ve 900 çocuktan daha fazla) veya GlaxoSmithKline trivalan influenza aşısı FluarixTM (1000 yetişkinden ve 900 çocuktan daha fazla) verilmiştir. FLUARIX TETRA ve FluarixTM ile aşılananlarda önceden belirlenerek raporlanması istenilen yan etkiler benzer oranlarda gözlenmiştir. Tüm yaş gruplarında aşılamanın ardından en sık rapor edilen lokal advers reaksiyon enjeksiyon bölgesinde ağrı (%36.4 'den %40.9'a kadar) olmuştur.18 yaş ve üzeri yetişkinlerde aşılamanın ardından en sık rapor edilen genel advers reaksiyonlar yorgunluk (%11.1), başağrısı (%9.2) ve miyalji (%11.8) olmuştur. 6-17 yaş arasındaki çocuklarda aşılamanın ardından en sık rapor edilen genel advers reaksiyonlar yorgunluk (%12.6), miyalji (%10.9) ve baş ağrısı (%8.0) olmuştur. 3-5 yaş arası çocuklarda aşılamanın ardından en sık rapor edilen genel advers reaksiyonlar sersemlik (%9,8) ve irritabilite (% 11.3) olmuştur. İstenmeyen etkilerin listesi Bir doz FLUARIX TETRA için bildirilen advers reaksiyonlar aşağıdaki sıklık derecelerine göre sıralanmıştır: Çok yaygın ( >1/10); Yaygın ( >1/100, <1/10 ); Yaygın değil ( >1/1.000, <1/100); Seyrek (>1/10.000, <1/1.000); Çok seyrek (<1/10.000), izole bildirimler dahil. Metabolizma ve beslenme bozuklukları Yaygın: iştah kaybı1 Psikiyatrik bozukluklar Çok yaygın: irritabilite1 Sinir sistemi bozuklukları Yaygın: sersemlik1, başağrısı Yaygın değil: baş dönmesi Mide-bağırsak bozuklukları Yaygın: mide-bağırsak semptomları (bulantı, kusma, ishal ve/veya karın ağrısı dahil) Deri ve ciltaltı doku bozuklukları o Yaygın olmayan: döküntü Kas-iskelet ve bağ doku bozuklukları Çok yaygın: miyalji Yaygın: artralji Genel bozukluklar ve uygulama bölgesine ilişkin durumlar Çok yaygın: Enjeksiyon bölgesinde ağrı, yorgunluk Yaygın: enjeksiyon bölgesinde kızarıklık4, enjeksiyon bölgesinde şişme4, titreme, ateş Yaygın olmayan: enjeksiyon bölgesinde hematom , enjeksiyon bölgesinde kaşıntı 16 yaşından küçük çocuklarda önceden belirlenmiş semptomlar olarak rapor edilmiştir. Yetişkinlerde rapor edilmiştir. 33 yaş -17 yaş aralığındaki çocuklarda rapor edilmiştir. 43 yaş - 17 yaş aralığındaki çocuklarda çok yaygındır. Ek olarak daha önceki Fluarix çalışmalarında aşağıdaki advers reaksiyonlar rapor edilmiştir. Deri ve ciltaltı doku bozuklukları Yaygın: terleme Genel bozukluklar ve uygulama bölgesine ilişkin durumlar Yaygın: Enjeksiyon bölgesinde sertlik Pazarlama sonrası veriler FLUARIX TETRA kullanımına dair pazarlama sonrası rapor mevcut değildir. Ancak, FluarixTM içerisindeki üç influenza suşunun tümü FLUARIX TETRA içinde bulunduğu için, FluarixTM için pazarlama sonrası takip esnasında gözlenen aşağıdaki advers olaylar, onaylanmasının ardından FLUARIX TETRA kullanan hastalarda görülebilir. Kan ve lenfatik sistem bozuklukları Seyrek: geçici lenfadenopati Bağışıklık sistemi bozuklukları Seyrek: alerjik reaksiyonlar (anafilaktik reaksiyonlar dahil) Sinir sistemi bozuklukları Seyrek: nörit (sinir inflamasyonu), akut dissemine ensefalomiyelit, Guillain-Barre sendromu1 Deri ve derialtı doku bozuklukları Seyrek: ürtiker, kaşıntı, eritem, anjiyoödem Genel bozukluklar ve uygulama bölgesine ilişkin durumlar Seyrek: influenza benzeri hastalık, kırıklık 4.9. Doz aşımı ve tedavisi Doz aşımı halinde herhangi bir istenmeyen veya olumsuz etki görülmesi olası değildir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grubu: Grip aşısı ATC Kodu: J07B B02 FLUARIX TETRA, aşı içerisinde bulunan dört adet influenza virüs suşuna (iki adet A alttipi ve iki adet B tipi) karşı aktif bağışıklanma sağlar. FLUARIX TETRA hemaglutininlere karşı humoral antikorları indükler. Bu antikorlar influenza virüslerini etkisiz hale getirir. İnaktif influenza virüsü aşısı ile aşılamanın ardından oluşan özel hemaglutin-inhibisyonu (HI) antikor titresi seviyeleri ile grip hastalığından korunma ilişkilendirilmemiştir ancak HI antikor titreleri aşı aktivitesinin bir ölçüsü olarak kullanılmıştır. Bazı insan uyarma (challenge) çalışmalarında, 1:40'a eşit veya büyük olan HI antikor titrelerine, kişilerin %50'si kadarında grip hastalığından korunma eşlik etmiştir. Güncel aşı ile her yıl aşılanma tavsiye edilir çünkü aşılamadan sonraki yıl içerisinde bağışıklık azalır ve dolaşan influenza virüsü suşları yıldan yıla değişir. Farmakodinamik etkilerTMFLUARIX TETRA'nın immünojenisitesinin Fluarix ile karşılaştırılmasıYetişkinlerde (D-QIV-001 ve D-QIV-008) ve 3 - 17 yaş arasındaki çocuklarda (D-QIV-003) yapılan klinik çalışmalar, 21. Gün (yetişkinler için) ve 28. Gündeki (çocuklar için) HI geometrik ortalama antikor titresi (GMT) ve HI serokonversiyon oranı (karşılıklı titrede 4-kat artış veya tayin edilemeyen miktardan [<10] 40 veya daha fazla karşılıklı titreye değişim) açısından FLUARIX TETRA ile FluarixTM'nin eşdeğerliğini değerlendirmiştir. Tüm çalışmalarda, üç ortak suş için FLUARIX TETRA'nın oluşturduğu bağışıklık yanıtı, FluarixTM ile eşit etkinlik göstermiştir. FLUARIX TETRA, içeriğinde bulunan ilave B suşu için FluarixTM'den daha üstün bağışıklık yanıtı ortaya çıkartmıştır. 18 yaş ve üzeri yetişkinlerD-QIV-008 klinik çalışmasında 18 yaş ve üzerinde yaklaşık 1800 yetişkin tek doz FLUARIX TETRA ve yaklaşık 600 yetişkin tek doz FluarixTM almıştır. Aşılama sonrası GMT ve serokonversiyon oranları aşağıdadır:
32008-2009 sezonunda tavsiye edilen ve FLUARIX TETRA içerisinde bulunan ilave B suşu Aşılama sonrası FLUARIX TETRA için seroproteksiyon oranları (21. Günde karşılıklı titre >40) A/H1N1'e karşı %91.3, A/H3N2'ye karşı %96.8, B (Victoria)'ye karşı %98.8 ve B (Yamagata)'ye karşı %91.8 olmuştur. D-QIV-001 klinik çalışmasında (2007-2008 sezonunun aşı bileşimi), aşılama sonrası seroproteksiyon oranı FLUARIX TETRA için A/H1N1'e karşı %92.3, A/H3N2'ye karşı %97.1, B (Victoria)'ye karşı %97.1 ve B (Yamagata)'ye karşı %98.1 olmuştur. 3-17 yaş arası çocuklarKlinik çalışmada (D-QIV-003), 3-17 yaş aralığında yaklaşık 900 çocuk sırasıyla bir veya iki doz FLUARIX TETRA veya FluarixTM almışlardır. Aşılama sonrası GMT ve serokonversiyon oranları aşağıdadır:
32008-2009 sezonunda tavsiye edilen ve FLUARIX TETRA içerisinde bulunan ilave B suşu Aşılama sonrası FLUARIX TETRA için seroproteksiyon oranları A/H1N1'e karşı %96.6, A/H3N2'ye karşı %98.0, B (Victoria)'ye karşı %97.3 ve B (Yamagata)'ye karşı %99.2 olmuştur. 5.2. Farmakokinetik özellikler Aşılar için farmakokinetik özelliklerin değerlendirilmesi gerekmemektedir. 5.3. Klinik öncesi güvenlilik verileri Yapılan konvensiyonel akut toksisite, lokal tolerans, tekrar doz toksisitesi ve üreme/gelişim toksisitesi çalışmalarına dayanan klinik öncesi veriler insanlar için hiçbir özel tehlike ortaya koymamaktadır. 6. FARMASÖTİK ÖZELLİKLER 6.1. Yardımcı maddelerin listesi Sodyum klorür Disodyum fosfat dodekahidrat Potasyum dihidrojen fosfat Potasyum klorür Magnezyum klorür hekzahidrat a-tokoferil hidrojen süksinat Polisorbat 80 Oktoksinol 10 Enjeksiyonluk su. Artık maddeler: hidrokortizon, gentamisin sülfat, ovalbumin, formaldehid ve sodyum deoksikolat 6.2. Geçimsizlikler Bu tıbbi ürüne ait geçimlilik çalışmaları olmadığından diğer tıbbi ürünlerle karıştırılarak kullanılmamalıdır. 6.3. Raf ömrü 12 aydır. 6.4. Saklamaya yönelik özel uyarılar Buzdolabında (2 °C - 8 °C) saklayınız. Dondurmayınız. Işıktan korumak için kendi ambalajı içinde saklayınız. 6.5. Ambalajın niteliği ve içeriği Kutuda; kilitli adaptöre ve sert plastik enjektör kapaklarına sahip, iğne takılı olmayan veya gri butil kauçuk koruyuculu, iğne takılı renksiz kullanıma hazır Tip I cam enjektör (1'lik ve 10'luk ambalajlarda) Bütün ticari şekiller piyasada bulunmayabilir. 6.6. Tıbbi ürünlerden arta kalan maddelerin imhası ve diğer özel önlemler 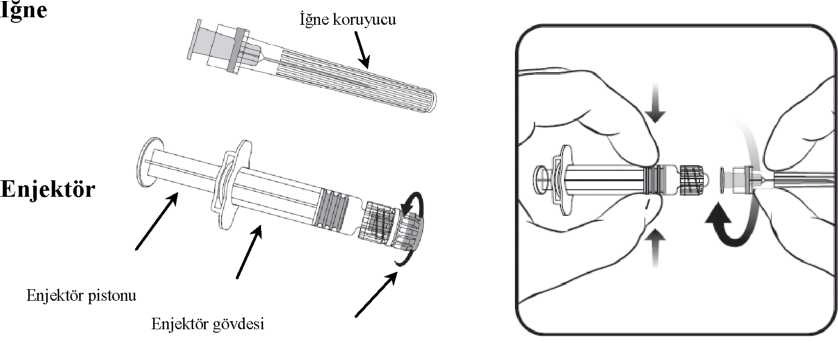 Enjektör kapağı
Enjektör kapağı1. Enjektör gövdesini bir elde tutarak (enjektör pistonundan tutmaktan sakınınız), enjektör kapağını saat yönünün tersine çevirerek açınız. 2. İğneyi enjektöre takmak için, iğneyi saat yönünde kilitlenene kadar çeviriniz (Bkz. resim) 3. İğnenin koruyucu kapağını çıkartınız, bazen biraz sert olabilir. Tüm enjektabl aşılarda olduğu gibi aşının uygulanmasını takiben görülebilecek anafilaktik olaylar için gerekli tıbbi tedavi ve gözetim hazır bulundurulmalıdır. Aşı kas içine enjeksiyon olarak uygulanmalıdır. FLUARIX TETRA hiçbir koşulda intravasküler olarak uygulanmamalıdır. FLUARIX TETRA diğer aşılarla aynı anda uygulanabilir. Aşılama farklı uzuvlara yapılmalıdır. Kullanıma hazır enjektör tek kullanım içindir ve birden fazla aşılama için kullanılmamalıdır. Kullanmadan önce aşının oda sıcaklığına gelmesi sağlanmalıdır. Aşı tedarik edildiği şekliyle kullanılmalıdır; seyreltme veya hazırlama gerekmez. Aşının önerilen tam dozu kullanılmalıdır. Kullanmadan önce enjektör çalkalanmalıdır ve herhangi bir yabancı madde ve/veya fiziksel durumda değişiklik açısından gözle incelenmelidir. Bunlardan herhangi birinin görülmesi halinde aşı kullanılmamalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ GlaxoSmithKline İlaçları Sanayi ve Ticaret A.Ş. Büyükdere Cad. No:173 1.Levent Plaza B Blok 34394, 1.Levent / İSTANBUL Tel no: 0 212 339 44 00 Faks no: 0 212 339 45 00 8. RUHSAT NUMARASI: 2014/200 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ: İlk ruhsat tarihi: 21.02.2014 Ruhsat yenileme tarihi: 10. KÜB'ün YENİLENME TARİHİ: 11 1 Fluarix ile aşılamanın ardından spontan Guillain-Barre sendromu raporları alınmıştır; ancak aşılama ve Guillain Barre sendromu arasındaki ilişki ortaya konmamıştır. |
İlaç BilgileriFluarix Tetra 0.5 Ml Im Enjeksiyon İçin Süspansiy...Etken Maddesi: Influenza Virüsü (inaktif, Split) Atc Kodu: J07BB02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.