Votrient 200mg Film Kaplı Tablet Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Diğer Kanser İlaçları » Protein Kinaz İnhibitörleri » Pazopanib KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIVOTRIENT 200 mg film kaplı tablet2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde:Her film kaplı tablette:Pazopanib (pazopanib hidroklorür olarak)...................200 mg Yardımcı maddeler:Sodyum nişasta glikolat..............................................0.80 mgYardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet.Bir yüzünde GS JT işareti bulunan pembe, kapsül şeklinde film kaplı tablet 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlar Pazopanib, biyolojik tedaviler (interferon ya da interlökin) sonrasında progresyon gelişmiş lokal ileri ya da metastatik evredeki renal hücreli kanserli hastalarda endikedir. VOTRİENT metastatik hastalık için en az bir seri kemoterapi/ en fazla iki seri kemoterapi kullanış ve sonrasında progresyon göstermiş metastatik sarkomun aşağıda belirtilen alt tiplerinde endikedir: Fibroblastik sarkomlar (erişkin fibrosarkom, miksofibrosarkom, sklerozan epiteloid fibrosarkom, malign soliter fibröz tümor), fibrohistiositik sarkomlar (pleomorfik malign fibröz histiositom, dev hücreli malign fibröz histiositom, inflamatuar malign fibröz histiositom), leiomyosarkom pleomorfik veya alveolar rabdomyosarkom, epiteloid hemanjioendotelyoma, anjiosarkomlar, epiteloid sarkomlar, sinoviyal sarkom, alveolar soft part sarkoma, malign glomüs tümörü, berrak hücreli sarkom, desmoplastik küçük yuvarlak hücreli sarkom, malign mezenkimoma, PEComa, intinal sarkom, malign periferik sinir kılıfı tümörlerinde endikedir. 4.2 Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:VOTRIENT tedavisi ancak kanser ilaçlarının uygulamasında deneyimli bir hekim tarafından başlatılmalıdır.Renal hücre karsinomu (Renal Cell Carcinoma; RCC) veya yumuşak doku sarkomu (Soft Tissue Sarkoma; STS) tedavisi için önerilen pazopanib dozu günde bir kez alınan 800 mg'dır. Dozun Değiştirilmesi İstenmeyen etkilerin kontrolü için sonraki doz değişiklikleri bireysel tolerabiliteye göre kademeli şekilde artırılarak 200 mg'lık dozlarla değiştirilmelidir. Pazopanib dozu 800 mg'ı aşmamalıdır. Uygulama şekli:Pazopanib aç karnına (yemeklerden en az bir saat önce veya iki saat sonra) uygulanmalıdır (bkz bölüm 5.2). Tabletler, bölünmeden ve parçalanmadan, bütün olarak su ile alınmalıdır.Bir dozun alınması unutulursa ve sonraki doza 12 saatten az bir süre kaldıysa unutulan doz alınmamalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Pazopanib ve metabolitlerinin renal yolla atılmasının düşük olduğu göz önüne alındığında böbrek yetmezliğinin pazopanib farmakokinetiğinde klinik açıdan anlamlı bir etki yapması beklenmez (bkz bölüm 5.2). Kreatinin klirensi 30 mL/dak'nın üzerinde olan hastalarda dozaj ayarlaması gerekli değildir. Ancak kreatin klerensi 30 ml/dak değerinin altında olan hastalarda pazopanib kullanılacaksa dikkatli olunmalıdır. Şiddetli böbrek yetmezliği bulunan veya peritoneal diyaliz veya hemodiyalize giren hastalarda pazopanib ile ilişkili deneyim mevcut olmadığı için bu hastalarda pazopanibin kullanılması önerilmemektedir.Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda pazopanib farmakokinetiği ve güvenliliği tam olarak gösterilmemiştir (bkz bölüm 4.4). Karaciğer yetmezliği olan hastalarda dozaj önerileri, değişik derecelerde karaciğer fonksiyon bozukluğu olan hastalarda pazopanib ile yapılan farmakokinetik çalışmalara dayanmaktadır (bkz. Bölüm 5.2). Hafif ila orta şiddette karaciğer yetmezliği olan hastalar, potansiyel olarak ilaca maruziyetin artması sebebiyle dikkatle ele alınmalı ve izlenmelidirler. Karaciğer fonksiyon testlerinde hafif anormallik bulunan (normal bilirubin ve herhangi bir düzeyde alanin aminotransferaz (ALT) artışı veya ALT değerinden bağımsız olarak üst normal sınırın (ULN) 1,5 katı bilirubin (> %35 direkt) artışı olarak tanımlanan) hastalarda tedaviye günde bir kez 800 mg pazopanib dozu ile başlanılması önerilir. Orta şiddetli karaciğer yetmezliği olan hastalarda (ALT değerlerinden bağımsız olarak bilirubinde >1.5 x ila 3 x ULN kat artış olarak tanımlanır) pazopanib dozunun günde bir kez 200 mg'a düşürülmesi önerilmektedir (bkz. bölüm 5.2).Pazopanib, şiddetli karaciğer yetmezliği (ALT düzeyinden bağımsız olarak total bilirubin değerinin >3 x ULN kat artışı şeklinde tanımlanır) olan hastalarda kontrendikedir (bkz bölüm 4.3). Pediatrik popülasyon:Pazopanibin güvenlilik ve etkililiğine ilişkin yeterli veri bulunmadığından 18 yaş altı adolesan ve çocuklarda kullanımı önerilmemektedir (bkz. Bölüm 4.4 ve 5.3).Geriyatrik popülasyon:65 yaş ve üstündeki hastalarda pazopanib kullanımına ilişkin sınırlı veri mevcuttur. Pazopanib ile yapılan klinik çalışmalarda en az 65 yaşın üzerindeki hastalar ile daha genç hastalar arasında pazopanibin güvenliliğine ilişkin klinik açıdan anlamlı fark mevcut değildi. Bildirilen diğer klinik deneyimde yaşlı hastalar ile genç hastalar arasında yanıt açısından bir fark tanımlanmamakla birlikte bazı yaşlı hastaların daha duyarlı olabileceği göz ardı edilemez.4.3 KontrendikasyonlarEtkin madde veya yardımcı maddelerden birine karşı aşırı duyarlılığı olan hastalarda ve şiddetli karaciğer yetmezliği olan hastalarda kullanılmamalıdır.VOT RTENT gebelik döneminde kullanılmamalıdır (bkz. bölüm 4.6).4.4 Özel kullanım uyarıları ve önlemleriHepatik Etkiler:Pazopanib kullanımı sırasında karaciğer yetmezliği vakaları (ölümle sonuçlananlar dahil) bildirilmiştir. Hafif ila orta şiddette karaciğer yetmezliği olan hastalara pazopanib uygulaması dikkatli yapılmalı ve bu hastalar yakinen izlenmelidir. Karaciğer fonksiyon testlerinde hafif anormallik bulunan hastalarda tedaviye günde bir kez 800 mg pazopanib dozu ile başlanması önerilir. Orta şiddette karaciğer yetmezliği olan hastalarda günde 200 mg'a düşürülmüş pazopanib dozu önerilmektedir (bkz bölüm 4.2). Pazopanib, şiddetli karaciğer yetmezliği olan hastalarda kontrendikedir (bkz bölüm 4.3). Pazopanib ile yapılan klinik çalışmalarda serum transaminaz (ALT, AST) ve bilirubin değerlerinde artış gözlenmiştir (bkz bölüm 4.8). Vakaların çoğunda alkalen fosfataz veya bilirubinde eşzamanlı artışlar olmaksızın ALT ve AST değerlerinde izole artışlar bildirilmiştir. Herhangi bir evrede transaminaz düzeylerindeki artışların büyük bir bölümü (%90'nın üzerinde) ilk 18 haftada meydana gelmiştir. Evreler, Ulusal Kanser Enstitüsü Yan Etkiler İçin Genel Terminoloji Kriterleri, Versiyon 3'e (NCI CTCAE) dayanmaktadır. Pazopanib tedavisinden önce ve tedavinin en az ilk 4 aylık süresinde en az 4 haftada bir ve klinik açıdan endike olduğunda serum karaciğer fonksiyon test bulguları izlenmelidir. Bu periyottan sonra periyodik izlem devam ettirilmelidir. Aşağıdaki kılavuzlar, başlangıçta toplam bilirubin değerleri <1,5 X ULN ve AST ve ALT <2 X ULN olan hastalara yöneliktir. Serum transaminaz düzeylerinde 3 X ULN ila 8 X ULN arasında izole artışlar görülen hastalarda, serum transaminaz değerleri evre 1 (NCI CTCAE) veya başlangıç düzeyine dönene kadar karaciğer fonksiyonu haftalık olarak izlenerek pazopanib tedavisine devam edilebilir. Serum transaminazlarının değeri >8 X ULN olan hastalarda pazopanib tedavisi, evre 1 (NCI CTCAE) veya başlangıç düzeyine dönene kadar kesilmelidir. Pazopanib tedavisinin yeniden başlatılmasıyla elde edilecek potansiyel yararın hepatotoksisite riskinden daha fazla olduğu düşünülüyorsa, pazopanib tedavisi günlük 400 mg'lık daha düşük dozda yeniden başlatılmalı ve 8 hafta süreyle haftada bir kez serum karaciğer testleri yapılmalıdır (bkz bölüm 4.2). Pazopanibin yeniden uygulanmasını takiben ALT değerleri >3 X ULN düzeyinde yeniden artarsa, pazopanib tedavisi kalıcı olarak kesilmelidir. Serum transaminazlarının ALTdüzeyleri >3 X ULN ve bilirubin düzeyleri >2 X ULN düzeyine yükselirse pazopanib tedavisi kalıcı olarak kesilmelidir. Hastalar, evre 1 (NCI CTCAE) veya başlangıç düzeyine dönene kadar izlenmelidir. Pazopanib bir üridin glukronosilat transferaz (uridine glucuronosyl transferase; UGT1A1) inhibitörüdür. Gilbert sendromu görülen hastalarda hafif, indirekt (konjuge edilmemiş) hiperbilirubinemi meydana gelebilir. Gilbert sendromu olduğu bilinen veya şüphelenilen, sadece hafif indirekt hiperbilirubinemisi olan ve ALT değerlerinde >3 X ULN'lik artış görülen hastalar, izole ALT artışlarına yönelik öneriler uyarınca kontrol edilmelidir.Pazopanib ve simvastatinin eşzamanlı kullanımı, ALT düzeylerinde artış riskini artırmaktadır (bkz. Bölüm 4.5) ve bu ilaçlar dikkatli bir şekilde ve yakın gözetim altında kullanılmalıdır. Hafif karaciğer yetmezliği olan hastaların tedavisinde günde bir kez 800 mg pazopanib dozunun uygulanması ve orta derecede karaciğer yetmezliği olan hastalarda başlangıç dozunun günde 200 mg'a düşürülmesi dışında, tedavi sırasında uygulanan serum karaciğer testlerinin sonuçlarına dayanarak karaciğer yetmezliği olan hastalar için herhangi bir ek doz değişiklik kılavuzu oluşturulmamıştır. Hipertansiyon: Pazopanib ile yapılan klinik çalışmalarda, yeni tanı konmuş semptomatik yükselmiş kan basıncı epizodları (hipertansif krizler) dahil olmak üzere hipertansiyon olayları meydana gelmiştir. Pazopanib tedavisinden önce kan basıncı iyi kontrol edilmelidir. Hastalar, tedaviye başlanmasının hemen ardından (pazopanib tedavisine başladıktan sonra bir haftayı geçmeyecek şekilde) hipertansiyon yönünden değerlendirilmeli ve ondan sonra da sıklıkla kan basıncını kontrol altında tutmak amacıyla izlenmeli ve klinik açıdan gerektiğinde standart anti-hipertansif tedavi uygulanarak ve pazopanib dozu azaltılarak veya pazopanib uygulamasına ara verilerek tedavi edilmelidir (bkz. bölüm 4.2 ve 4.8). Pazopanib tedavisinin erken dönemlerinde (vakaların yaklaşık %40'ı 9. günde meydana gelirken yaklaşık %90'ı ilk 18 haftada meydana gelmiştir) kan basıncında yükselmeler (sistolik kan basıncı >150 veya diyastolik kan basıncı >100 mmHg) meydana gelmektedir. Bir hipertansif kriz bulgusu varsa veya hipertansiyon şiddetliyse ve antihipertansif tedavisine ve pazopanib dozunun azaltılmasına karşın devam ediyorsa pazopanib kesilmelidir. Kardiyak Disfonksiyon/Kalp yetmezliği Pazopanib ile yapılan klinik çalışmalarda, konjestif kalp yetmezliği ve azalmış sol ventrikül ejeksiyon fraksiyonu (LVEF) gibi kardiyak disfonksiyon olayları meydana gelmiştir. Orta şiddet ila şiddetli kalp yetmezliği olan hastalarda pazopanibin güvenliliği ve farmakokinetiği çalışılmamıştır. STS popülasyonunda 382 kişiden 2'sinde (%0,5) konjestif kalp yetmezliği bildirilmiştir. Plasebo grubunun %3 (1/39)'üne kıyasla pazopanib grubunun %11(15/140)'inde başlangıç sonrasında ölçüm yapılan kişilerin LVEF değerlerinde düşüş tespit edilmiştir. Pazopanib grubunda 15 kişinin 13'ünde eşzamanlı hipertansiyon mevcuttu ve bu, riskli hastalarda (ör. önceden antrasiklin tedavisi görmüş kişiler) ard yükü artırarak kardiyak disfonksiyonu alevlendirmiş olabilir. Sonuç olarak 15 kişinin 4'ü tamamen iyileşirken (temel değerin 5%'inin içerisinde) ve 5'i kısmen iyileşmiştir (normal aralığın içerisinde, fakat 5% temel değerin altında). Bir kişi iyileşmemiştir ve diğer 5 kişi için izleme verileri mevcut değildir. Kan basıncı izlenmeli ve anti-hipertansif tedavi uygulanarak ve pazopanib dozu değiştirilerek (klinik karara dayalı olarak tedavinin kesilmesi veya azaltılmış dozda tedaviye tekrar başlanması) acilen kontrol altına alınmalıdır. Hastalar konjestif kalp yetmezliğini gösteren klinik belirti ve semptomlar için dikkatle izlenmelidir. Kardiyak disfonksiyon riski bulunan hastalarda başlangıçta ve periyodik olarak LVEF değerlendirmesi önerilmektedir. QT uzaması ve torsade de pointes: Pazopanib ile yapılan klinik çalışmalarda QT uzaması ve Torsade de Pointes vakaları meydana gelmiştir (bkz bölüm 4.8). Pazopanib QT aralığı uzaması olan hastalarda, antiaritmikler veya QT aralığında uzamaya neden olabilen diğer ilaçları kullanan veya önceden mevcut önemli kardiyak hastalığı olan hastalarda dikkatli şekilde kullanılmalıdır. Pazopanib kullanımı sırasında EKG parametrelerinin başlangıçta ve periyodik olarak izlenmesi ve elektrolit dengesinin (örn, kalsiyum, magnezyum, potasyum) normal aralık dahilinde tutulması önerilmektedir. Arteriyel trombotik olaylar: Pazopanib ile yapılan klinik çalışmalarda miyokard infarktüsü, anjina, iskemik inme ve geçici iskemik atak gözlenmiştir (bkz bölüm 4.8). Ölümcül olaylar gözlemlenmiştir. Pazopanib, trombotik olay riski yüksek veya bir trombotik olay öyküsü bulunan hastalarda dikkatli kullanılmalıdır. Pazopanib, geçmiş 6 ay içerisinde bir olay yaşamış hastalarda incelenmemiştir. Hastanın bireysel yarar/risk durumu değerlendirilerek bir tedavi kararı verilmelidir. Venöz tromboembolik olaylar: Pazopanib ile yapılan kilinik çalışmalarda, venöz tromboz ve ölümcül pulmoner emboli dahil olmak üzere venöz tromboembolik olaylar meydana gelmiştir. Hemorajik olaylar: Pazopanib ile yapılan klinik çalışmalarda hemorajik olaylar bildirilmiştir (bkz bölüm 4.8). Ölümcül hemorajik olaylar meydana gelmiştir. Pazopanib son altı ay içerisinde hemoptizi, serebral veya klinik açıdan anlamlı gastrointestinal (GI) hemoraji öyküsü bulunan hastalarda kullanılmamalıdır. Pazopanib anlamlı hemoraji riski bulunan hastalarda dikkatli şekilde kullanılmalıdır. Gastrointestinal perforasyon ve fistül: Pazopanib ile yapılan klinik çalışmalarda GI perforasyon ve fistül meydana gelmiştir (bkz bölüm 4.8). Ölümcül perforasyon olayları meydana gelmiştir. Pazopanib GI perforasyonu veya fistül için yüksek risk bulunan hastalarda dikkatli şekilde kullanılmalıdır. Yara iyileşmesi: Yara iyileşmesinde pazopanibin etkisine ilişkin bir çalışma yapılmamıştır. Vasküler Endotelyal Büyüme Faktörü (VEGF) inibitörü yara iyileşmesini geciktirebildiğinden pazopanib tedavisi planlanan cerrahiden en az 7 gün önce kesilmelidir. Cerrahiden sonra pazopanib tedavisine devam edilmesi kararı yeterli yara iyileşmesine ilişkin klinik değerlendirmeye dayandırılmalıdır. Yara açılması bulunan hastalarda pazopanib kesilmelidir. Hipotiroidizm: Pazopanib ile yapılan klinik çalışmalarda hipotiroidizm olayları bildirilmiştir (bkz bölüm 4.8). Tiroid fonksiyonları için başlangıç labratuvar ölçümleri tavsiye edilir, hipotiroidizmli hastalar pazopanib tedavisine başlamadan önce standart medikal uygulamalara bağlı olarak tedavi edilmelidir. Tüm hastalar pazopanib tedavisinde tiroid bozukluk belirtileri için yakından takip edilmelidir. Klinik açıdan gerektiğinde tedavi ile tiroid fonksiyon testlerinin proaktif olarak izlenmesi önerilmektedir. Proteinüri: Pazopanib ile yapılan klinik çalışmalarda proteinüri rapor edilmiştir. Tedavi süresince, başlangıçta ve periyodik olarak idrar analizleri önerilmektedir ve hastalar proteinürinin kötüleşmesi açısından izlenmelidir. Hastada seviye 4 proteinüri gelişmesi durumunda pazopanib kesilmelidir. Pnömotoraks: İlerlemiş yumuşak doku sarkomunda pazopanib ile yapılan klinik çalışmalarda, pnömotoraks vakaları meydana gelmiştir (bkz bölüm 4.8). Pazopanib tedavisi gören hastaların pnömotoraks belirtileri için yakından izlenmesi gereklidir. Enfeksiyonlar: Bazıları ölümle sonuçlanan ciddi enfeksiyon vakaları (nötropeni ile birlikte veya nötropeni olmadan) bildirilmiştir. Diğer sistemik anti-kanser tedavileri ile kombinasyon: Pazopanibin pemetrexed (küçük hücreli olmayan akciğer kanseri (NSCLC)) ve lapatinib (serviks kanseri) ile kombinasyon halinde kullanıldığı klinik çalışmalar, artan toksisite ve/veya mortalite sebebiyle bu rejimlerle efektif doz kombinasyonu belirlenemediğinden erken aşamada sonlandırılmıştır. Pediyatrik popülasyon: Pazopanibin etki mekanizması, erken post natal gelişim döneminde organ büyümesini ve olgunlaşmasını ciddi şekilde etkileyebildiği için (bkz. Bölüm 5.3), pazopanib tedavisi 2 yaşından küçük pediyatrik hastalara uygulanmamalıdır. Etkileşimler: Güçlü sitokrom P450(CYP)3A4, P-glikycoprotein (P-gp) inhibitörleri veya meme kanseri direnç proteini (BCRP) ile eş zamanlı kullanımı, pazopanibe maruziyet riskini arttırdığından bu bileşiklerde beraber kullanımında kaçınılmalıdır. (bkz bölüm 4.5) CYP3A4, P-gp veya BCRP inhibisyon potansiyeli bulunmayan veya minimum olan tıbbi ürünlerin alternatif kombinasyonlarının seçimi göz önünde bulundurulmalıdır. Pazopanib maruziyetini azaltma riskinden dolayı P450(CYP)3A4 indükleyicileri ile birlikte kullanımından kaçınılmalıdır (bkz bölüm 4.5). Ketokonazol ile birlikte tedavisinde hiperglisemi vakaları gözlenmiştir. Pazopanib üridin difosfat glukronosilat transferaz 1A1 (UGT1A1) inhibitörü olduğundan, pazopanib UGT1A1 substratları ile birlikte uygulanırken dikkat edilmelidir. Pazopanib tedavisi sırasında greyfurt suyu kullanımından kaçınılmalıdır (bkz. bölüm 4.5) Yardımcı maddeler: VOTRIENT 0.80 mg sodyum nişasta glikolat içermektedir. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer ilaçların pazopanib üzerindeki etkileriİn vitroçalışmalar insan karaciğer mikrozomlarında pazopanibin oksidatif metabolizmasına temelde CYP3A4 enziminin aracılık ettiğini ve CYP1A2 ve CYP2C8 enzimlerinin minör katkıda bulunduğunu düşündürmüştür. Bu nedenle CYP3A4 inhibitörleri ve indükleyicileri pazopanib metabolizmasını değiştirebilir.CYP3A4, P-gp, BCRP inhibitörleri: Pazopanib, CYP3A4, P-gp ve Meme Kanseri Direnç Proteini (BCRP) için bir subtrattır. Pazopanibin (günde bir kez 400 mg) güçlü CYP3A4 ve P-gp inhibitorü, ketokonazol (günde bir kez 400 mg) ile birlikte art arda 5 gün uygulanması sonucunda; pazopanib'in tek başına verilmesine (7 gün boyunca günde bir kez 400 mg) kıyasla, ortalama pazopanib Eğri Altı Alan (EAA)(0-24) ve Cmaks değerleri sırasıyla %66 ve %45 artış meydana gelmiştir. Dozun 50 mg'dan 2000 mg'a olan bir aralıkta artırılması ile pazopanib Cmaks ve EAA değerleri de doz orantısallığının altında olacak bir biçimde artış göstermiştir. Dolayısıyla, güçlü CYP3A4 inhibitörlerinin varlığında pazopanibin günlük dozunun 400 mg olarak azaltılması ile, hastaların büyük çoğunluğunda, tek başına günlük 800 mg pazopanib verilenlere benzer sistemik maruziyet tablosu ile sonuçlanmıştır. Ancak bazı hastalar tek başına günlük 800 mg pazopanib uygulaması sonrasındaki gözlenenden daha fazla sistemik maruziyet gösterebilmektedir. Pazopanib ile birlikte diğer güçlü CYP3A4 inhibitörlerinin kullanılması (örn, ketokonazol, itrakonazol, klaritromisin, atazanavir, indinavir, nefazodon, nelfinavir, ritonavir, saquinavir, telitromisin, vorikonazol) pazopanib konsantrasyonlarını artırabilir. Greyfurt suyu bir CYP3A4 inhibitörü içermekte olup ayrıca plazmadaki pazopanib konsantrasyonlarını artırabilir. 1500 mg lapatinib (CYP3A4 ve P-gp'nin zayıf bir inhibitörü ve BCRP'nin potent bir inhibitörü) ile 800 mg pazopanib uygulaması tek başına 800 mg pazopanib uygulamasına kıyasla ortalama pazopanib EAA(0-24) ve Cmaks değerlerinde yaklaşık %50 ila %60 artışa neden olmuştur. P-gp ve/veya BCRP inhibitörünün lapatinib ile inhibisyonunun pazopanib maruziyetinde artışa neden olması beklenmektedir. Pazopanib'in güçlü bir CYP3A4 inhibitörü ile eş zamanlı kullanımından kaçınılmalıdır. Eğer güçlü bir CYP3A4 inhibitörüne tıbbi olarak uygun bir alternatif bulunması söz konusu değilse, eş zamanlı kullanım süresince pazopanib'in dozu günlük 400 mg'a azaltılmalıdır (bkz. Bölüm 4.4). İlave doz azaltımları, ilaca bağlı yan etkilerin gözlenmesi halinde eğer uygunsa göz ününde bulundurulabilir. Pazopanibin lapatinib gibi CYP3A4, P-gp ve BCRP inhibitörleri ile birlikte uygulanması plazma pazopanib konsantrasyonlarında artışla sonuçlanacaktır. Potent P-gp veya BCRP inhibitörleriyle birlikte kullanım da pazopanib maruziyetini ve merkezi sinir sistemine (MSS) yayılma da dahil olmak üzere pazopanib dağılımını değiştirebilir. Bu nedenle güçlü CYP3A4, P-gp veya BCRP inhibitörleri ile kombinasyondan kaçınılmalıdır veya CYP3A4, P-gp veya BCRP için minimum inhibisyon potansiyeli olan veya hiç olmayan alternatif eşzamanlı medikasyon seçilmesi önerilmektedir. CYP3A4, P-gp, BCRP indükleyiciler: Rifampin gibi CYP3A4 indükleyicileri plazma pazopanib konsantrasyonlarını düşürebilir. Pazopanibin potent P-gp veya BCRP indükleyiciler ile birlikte kullanımı pazopanib maruziyetini ve MSS'ne yayılma da dahil olmak üzere pazopanib dağılımını değiştirebilir. Enzim indüksiyonu minimal olan veya hiç bulunmayan alternatif eşzamanlı medikasyon seçilmesi önerilmektedir. Pazopanibin diğer ilaçlar üzerindeki etkileri İnsan karaciğer mikrozomları ile yapılan in vitroin vitroinsan Pregnane X Receptor (PXR) testinde gösterilmiştir. Günde bir kez pazopanib 800 mg dozu ile yapılan klinik farmakoloji çalışmaları pazopanibin kanser hastalarında kafein (CYP1A2 prob substratı), warfarin (CYP2C9 prob substratı) veya omeprazol (CYP2C19 prob substratı) farmakokinetiğinde klinik açıdan anlamlı bir etkiye sahip olmadığını göstermiştir. Pazopanib ortalama midazolam EAA ve Cmaks (CYP3A4 prob substratı) değerlerinde yaklaşık %30 artışa ve oral yolla dekstrometrofan (CYP2D6 prob substratı) uygulandıktan sonra idrardaki dekstrometorfan-dekstorfan konsantrasyonu oranında %33 ila %64 artışa neden olmuştur. Günde bir kez 800 mg pazopanib ve haftada bir kez 80 mg/m paklitaksel'in (CYP3A4 ve CYP2C8 substratı) birlikte uygulanması paklitaksel EAA ve Cmaks değerlerinde sırasıyla ortalama %25 ve %31 artışa neden olmuştur.In vitroin vivoCmaks değerlerine dayanarak, pazopanibin GSK1268992 ve GSK1268997 metabolitleri, pazopanibin BCRP üzerinden net inhibitör etkisine katkı sağlayabilmektedirler. Ayrıca, gastrointestinal yolda BCRP ve P-gp'nin pazopanib ile inhibisyonu göz ardı edilemez. Pazopanibin diğer oral BCRP ve P-gp substratları ile birlikte kullanılması durumunda dikkatli olunmalıdır.Pazopanibin diğer enzim ve taşıyıcılar üzerindeki etkileri In vitroçalışmalarda pazopanibin, sırasıyla 1.2 IC50 ve 0.79 mikromolar değerleri ile UGT1A1 ve OATP1B1 (organik anyon taşıyıcısı)'in potent bir inhibitörü olduğu gösterilmiştir. Pazopanib, primer olarak UGT1A1 ve OATP1B1 (organik anyon taşıyıcısı) yoluyla elimine edilen ilaçların konsantrasyonlarını artırabilmektedir.Pazopanibin OATP1B1 substratlarının (örn. rosuvastatin) farmakokinetiğini etkileyeceği göz ardı edilemez. Pazopanib ve simvastatinin eşzamanlı kullanımının etkisi Pazopanib ve simvastatinin eşzamanlı kullanımı, ALT değerlerinde yükseliş insidansını artırmaktadır. Pazopanib ile yapılan monoterapi çalışmalarında, statin kullanmayan 126 / 895 (%14) hastada ALT >3xULN bildirilirken eşzamanlı simvastatin kullananlarda bu oran 11/41 (%27) olmuştur (p = 0,038). Eşzamanlı simvastatin alan bir hastada ALT düzeyleri artarsa, pazopanib dozaj kılavuzları takip edilmeli ve simvastatin kesilmelidir (bkz. Bölüm 4.4). Alternatif statinlerle pazopanibin eşzamanlı uygulamasına yönelik risk değerlendirilmesi için yeterli veri mevcut değildir. Yiyecek ve içecek ile kullanılmasıYüksek oranda veya düşük oranda yağ içeren öğünlerle birlikte pazopanib uygulanımı EAA ve Cmaks değerlerinde yaklaşık 2 kat artışa neden olmuştur. Bu nedenle pazopanib öğünlerden en az 1 saat önce veya 2 saat sonra uygulanmalıdır.Mide asiditesini yükselten ilaçlarPazopanibin esomeprazol ile birlikte kullanımı pazopanibin biyoyararlanımını yaklaşık olarak %40 (EAA ve Cmax) düşürmektedir, ve pazopanibin mide asiditesini yükselten ilaçlar ile birlikte uygulanmasından kaçınılmalıdır. Eğer proton pompa inhibitörü (PPI) ile birlikte kullanımı medikal açıdan gerekliyse, pazopanib dozunun günde 1 kez akşam saatlerinde aç karnına PPI ile birlikte alınması önerilmektedir. Eğer H2-reseptör antagonisti ile birlikte uygulanması medikal açıdan gerekliyse, H2-reseptör antogonist dozundan en az 2 saat önce veya en az 10 saat sonra aç karnına alınmalıdır. Pazopanib, kısa etkili antasid alınmasından 1 saat önce veya 2 saat sonra alınmalıdır. PPI ve H2-reseptör antagonistlerinin birlikte nasıl uygulanacağı ile ilgili tavsiyeler fiziksel değerlendirmelere bağlıdır.4.6 Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: DÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolüDoğurganlık çağındaki kadınlar, pazopanib tedavisi sırasında yeterli kontrasepsiyon kullanmaları ve gebelikten kaçınmaları konusunda uyarılmalıdır.Gebelik DönemiGebe kadınlarda pazopanib kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalarda üreme toksisitesi görülmüştür (Bkz: bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.Pazopanibin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. Pazopanib gebelik döneminde kullanıldığında veya hasta tedavi sırasında gebe kaldığında hasta fetüs için potansiyel risk konusunda uyarılmalıdır. VOTRIENT, hastanın klinik durumu pazopanib ile tedaviyi gerektirmedikçe gebelik döneminde kullanılmamalıdır. LaktasyonPazopanibin insan sütüyle atılıp atılmadığı bilinmemektedir. Pazopanibin süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Memedeki çocuk açısından bir risk olduğu göz ardı edilemez. VOTRIENT emzirme döneminde kullanılmamalıdır.FertilitePazopanib erkek ve kadınlarda fertiliteyi azaltabilir. Dişi sıçanlar üzerinde gerçekleştirilen üreme toksisitesi çalışmalarında dişi fertilitesinin azaldığı gözlemlenmiştir (bkz. Bölüm 5.3).4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerindeki etkilere ilişkin bir çalışma yapılmamıştır. Pazopanib farmakolojisi göz önüne alındığında bu aktiviteler üzerinde zararlı bir etkisi olup olmadığı öngörülemez. Hastanın muhakeme, motor veya kognitif yetenekler gerektiren işleri yapabilme becerisi hastanın klinik durumu ve pazopanibin istenmeyen etki profili göz önünde bulundurularak değerlendirilmelidir. Hastaların yorgun, zayıf ve sersemlemiş hissetmeleri durumunda araba ve makina kullanmaları önlenmelidir.4.8 İstenmeyen etkilerÖncü RCC çalışması (VEG105192, n=290), uzatma çalışması (VEG107769, n=71) ve destekleyici Faz II çalışma (VEG102616, n=225) bulguları bir arada değerlendirilerek RCC'li deneklerde (total n=586) pazopanib'in genel güvenlilik ve tolerabilite değerlendirilmesinde kullanılmıştır (bkz bölüm 5.1).Öncü STS çalışması (VEG110727, n=369) ve destekleyici Faz II çalışmadan (VEG20002, n=142) elde edilen birleştirilmiş veriler, STS'li hastalarda (toplam güvenlilik popülasyonu sayısı=382) pazopanib'in genel güvenlilik ve tolerabilite incelemesinde değerlendirilmiştir (bkz. bölüm 5.1). RCC veya STS çalışmalarında tespit edilmiş, pazopanib tedavisi ile ilişkili en önemli istenmeyen etkiler geçici iskemik atak, iskemik inme, miyokard iskemisi, miyokard infarktüsü ve serebral infarktüs, gastrointestinal perforasyon ve fistül, QT uzaması ve pulmoner, gastrointestinal ve serebral hemoraji olup bu olayların tümü tedavi uygulanan hastaların %1'inden daha azında bildirilmiştir. STS çalışmalarında belirtilen diğer önemli ciddi istenmeyen etkiler arasında venöz tromboembolik olaylar, sol ventrikül disfonksiyonu ve pnömotoraks bulunur. Pazopanib ile olasılıkla ilişkili olduğu düşünülen ölümcül olaylar arasında gastrointestinal hemoraji, pulmoner hemoraji/hemoptizi, anormal hepatik fonksiyon, intestinal perforasyon ve iskemik inme bulunmaktadır. RCC ve STS çalışmalarındaki, tedavi ile ilişkili herhangi bir evredeki en yaygın istenmeyen etkiler (hastaların en az %10'unda meydana gelen) aşağıdakileri içermiştir: diyare, saç renginde değişiklik, ciltte hipopigmentasyon, eksfolyatif döküntü, hipertansiyon, bulantı, baş ağrısı, yorgunluk, anoreksi, kusma, disguzi, stomatit, alanin aminotransferaz düzeyinde artış ve aspartat aminotransferaz düzeyinde artış. RCC ve STS hastalarında bildirilen tedavi ile ilişkili yan etkiler aşağıda MedDRA vücut organ sistemi sınıfına göre liste halinde sunulmaktadır. Frekansın sınıflandırılması için aşağıdaki sınıflandırma ölçeği kullanılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Kategoriler klinik çalışma verilerindeki mutlak frekanslara göre atanmıştır. RCC tedavisi ile ilişkili istenmeyen etkilerKan ve lenf sistemi hastalıklarıYaygın: Trombositopeni, nötropeni, lökopeniEndokrin hastalıklarıYaygın: HipotiroidizmMetabolizma ve beslenme hastalıklarıÇok yaygın: İştah azalmasıeYaygın olmayan: Hipofosfatemi, hipomagnezemi Sinir sistemi hastalıklarıÇok yaygın: DisguzicYaygın: Baş ağrısı, sersemlik, letarji, parestezi Yaygın olmayan: Periferik duyusal nöropati, hipoestezi, geçici iskemik atak, serebrovasküler olay, iskemik inme Göz hastalıklarıYaygın olmayan: Kirpikte renksizleşmeKardiyak hastalıklarÇok Yaygın : Bradikardi*Yaygın olmayan: Kardiyak disfonksiyon (ejeksiyon fraksiyonunda azalma ve konjestif kalp yetmezliği gibi), miyokard infarktüsü, miyokard iskemisi, Torsades des Pointes Vasküler hastalıklarÇok yaygın: HipertansiyonYaygın: Sıcak basması, hematüri Yaygın olmayan: Al basması, hemoraji, hipertansif kriz, venöz tromboembolik olaylar Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Epistaksis, disfoniYaygın olmayan: Pulmoner emboli, hemoptizi, pulmoner hemoraji Gastrointestinal hastalıklarÇok yaygın: Diyare, bulantı, kusma, karın ağrısıaYaygın: Dispepsi, stomatit, flatulans, abdominal distansiyon Yaygın olmayan: Ağızda ülser, sık barsak hareketleri, gastrointestinal hemoraji, rektal hemoraji, geniş barsak perforasyonu, ağızda hemoraji, enterokutan fistül, hematemez, hematokezi, hemoroidal hemoraji, ileum perforasyonu, melana, özefageal hemoraji, pankreatit, peritonit, retroperitoneal hemoraji, üst gastrointestinal hemoraji Hepato-biliyer hastalıklarYaygın: Anormal hepatik fonksiyon, hiperbilirubinemiYaygın olmayan: Hepatotoksisite, sarılık, karaciğer yetmezliği, hepatit Deri ve deri altı doku hastalıklarıÇok yaygın: Saç renginde değişiklikYaygın: Döküntü, alopesi, palmar-plantar eritrodizestezi sendromu, deride hipopigmentasyon, eritem, pruritus, deride depigmentasyon, ciltte kuruluk, hiperhidroz Yaygın olmayan: Fotosensitivite reaksiyonu, deride eksfolyasyon, kabarcıklı döküntü, jeneralize pruritus, papüler döküntü, plantar eritema, eritematöz döküntü, jeneralize döküntü, maküler döküntü, pruritik döküntü Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Miyalji, kas spazmlarıBöbrek ve idrar hastalıklarıYaygın: ProteinüriYaygın olmayan: Üriner sistemde hemoraji Gebelik, pueperiyum durumları ve perinatal hastalıklarYaygın olmayan: Menoraji, metroraji, vajinal hemorajiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: YorgunlukYaygın: Asteni, mukozal inflamasyon, ödemb, göğüs ağrısı Yaygın olmayan: Mukoz membran bozukluğu Alanin aminotransferaz artışı, aspartat aminotransferaz artışı Kilo kaybı, kanda kreatinin artışı, kanda bilirubin artışı, beyaz kan hücresi sayısında azalmad, lipaz artışı, kan basıncında artış, kanda tiroidi uyaran hormon artışı, gama-glutamiltransferaz artışı, hepatik enzim artışı AraştırmalarÇok yaygın: Yaygın:Yaygın olmayan: Aspartat aminotransferaz, kanda üre artışı, elektrokardiyogram QT uzaması, kanda amilaz artışı, kanda glukoz artışı, alanin aminotransferaz, transaminaz artışı, diastolik kan basıncında artış, anormal tiroid fonksiyon testi, sistolik kan basıncında artış, anormal karaciğer fonksiyon testi Aşağıdaki terimler birleştirilerek sunulmuştur. a Karın ağrısı, üst karın ağrısı ve alt karın ağrısı b Ödem, periferal ödem, gözde ödem, lokalize ödem ve yüzde ödem c Disguzi, aguzi ve hipoguzi d Beyaz hücre sayısında azalma, nötrofil sayısında azalma ve lökosit sayısında azalma e İştah azalması ve anoreksi *Advers etki raporlarından daha ziyade kalp atım hızı ölçümüne bağlı frekans (< 60 atım/dakika). Semptomatik bradikardi, pazopanib güvenlik veri tabanı incelemeleri baz alındığında seyrek olarak tanımlanmıştır. STS tedavisi ile ilişkili istenmeyen etkilerEnfeksiyonlar ve enfestasyonlarYaygın: Gingiva enfeksiyonuEndokrin hastalıklarıYaygın: HipotiroidizmMetabolizma ve beslenme hastalıklarıÇok yaygın: Tad alma duyusunda azalma, kilo kaybı, anoreksi, hiperalbuminemiYaygın: Dehidrasyon Yaygın olmayan: Hipomagnesemi Psikiyatrik hastalıklarYaygın: İnsomniaYaygın olmayan: Deprese duygu durumu Sinir sistemi hastalıklarıÇok yaygın: Disguzic, baş ağrısıYaygın: Sersemlik Yaygın olmayan: Somnolans, serebral infarktüs, iskemik inme Göz hastalıklarıYaygın: Bulanık görmeKardiyak hastalıklarYaygın: Sol ventrikül disfonksiyonuYaygın olmayan: Miyokard infarktüsü Vasküler hastalıklarÇok yaygın: HipertansiyonYaygın: Venöz tromboembolik olay Yaygın olmayan: Hemoraji Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Epistaksis, disfoni, dispne, öksürük, pnömotoraks, hıçkırık, pulmonerhemoraji Yaygın olmayan: Orofaringeal ağrı, bronşiyal hemoraji, rinore, hemoptizi Gastrointestinal hastalıklarÇok yaygın: Diyare, bulantı, kusma, karın ağrısıa, stomatitYaygın: Ağız kuruluğu, dispepsi, ağızda hemoraji, anal hemoraji Yaygın olmayan: Gastrointestinal hemoraji, rektal hemoraji, enterokutan fistül, gastrik hemoraji, ileum perforasyonu Hepato-biliyer hastalıklarYaygın: Karaciğer fonksiyonlarında bozulmaYaygın olmayan: Kanda bilirubin artışı Deri ve deri altı doku hastalıklarıÇok yaygın: Saç renginde değişiklik, deride hipopigmentasyon, eksfolyatif döküntüYaygın: Alopesi, cilt bozukluğu0, cilt kuruluğu, tırnak bozukluğu, pruritus Yaygın olmayan: Cilt ülseri, akne, blister, palmar-plantar eritrodizestezi sendromu Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Müsküloskeletal ağrı, miyalji, kas spazmlarıYaygın olmayan: Artralji Böbrek ve idrar hastalıklarıYaygın olmayan: ProteinüriGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: YorgunlukYaygın: Ödemb, göğüs ağrısı, ürperme Yaygın olmayan: Asteni Aşağıdaki terimler birleştirilerek sunulmuştur. a Karın ağrısı, üst karın ağrısı ve gastrointestinal ağrı b Ödem, periferal ödem ve göz kapağı ödemi 0 Vakaların çoğu palmar-plantar eritrodizestezi sendromu idi. Pazarlama sonrası verileri:Aşağıdaki istenmeyen etkiler, pazopanibin onay sonrası kullanımı sırasında tespit edilmiştir. Bunlar, spontan vaka raporları ile birlikte devam eden klinik çalışmalardan, klinik farmakoloji çalışmalarından ve eksploratuvar çalışmalardan gelen ciddi istenmeyen etkileri içermektedir.Enfeksiyonlar ve enfetasyonlarYaygın olmayan: Enfeksiyonlar (nötropeni ile birlikte ve nötropeni olmadan)AraştırmalarYaygın: Alanin aminotransferaz artışı, aspartat aminotransferaz artışı, gammaglutamiltransferaz artışı Yaygın olmayan: Elektrokardiyogramda QT uzaması 4.9 Doz aşımı ve tedavisi2.000 mg'a kadarki pazopanib dozları klinik çalışmalarda değerlendirilmiştir. Günde 2000 mg ve 1000 mg doz verilmiş 3 hastadan 1'inde sırasıyla Derece 3 yorgunluk (doz sınırlayıcı toksisite) ve Derece 3 hipertansiyon gözlenmiştir.Semptomlar ve belirtiler Pazopanib doz aşımı ile sınırlı tecrübe mevcuttur. Tedavisi Pazopanib doz aşımı için spesifik antidot mevcut değildir ve doz aşımı vakalarında genel destekleyici önlemlerle tedavi uygulanmalıdır. Pazopanib önemli ölçüde böbrekler yoluyla atılmadığından ve plazma proteinlerine yüksek oranda bağlandığından hemodiyalizin pozopanib eliminasyonunu artırması beklenmemektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grubu: Antineoplastik ajanlar - Protein- kinaz inhibitörü,ATC kodu: L01XE11 Etki mekanizması Pazopanib oral yolla uygulamaya yönelik, sırasıyla 10, 30, 47, 71, 84 ve 74 nanometre'lik IC50 değerleri ile Vasküler Endotelyal Büyüme Faktör Reseptörleri (VEGFR)-l, -2 ve -3, platelet-kaynaklı büyüme faktörü (PDGFR)-a ve -P, ve kök hücre faktör reseptörünün (c-KIT) potent çok hedefli tirozin kinaz inhibitörüdür (TKI). Klinik dışı deneylerde pazopanib hücrelerde VEGFR-2, c-Kit ve PDGFR-P reseptörlerin ligand kaynaklı oto-fosforilasyonunu doza bağlı şekilde inhibe etmiştir. İn vivo,pazopanib fare akciğerlerinde VEGF-kaynaklı VEGFR-2 fosforilasyonu, çeşitli hayvan modellerinde anjiyogenezi ve farelerde çoklu insan tümör ksenogreftlerinin büyümesini inhibe etmiştir.Klinik Çalışmalar Renal Hücreli Kanser (RCC) Lokal reküren veya metastatik berrak hücreli renal hücre kanserli 225 hastada yapılan bir Faz 2 çalışmada bağımsız incelemeye göre objektif yanıt %35 olup ortalama yanıt süresi 68 haftaydı. Ortalama PFS 11.9 aydı.Pazopanibin güvenlilik ve etkililiği bir randomize, çift kör, plasebo kontrollü çok merkezli çalışmada renal hücre kanserinde (RCC) değerlendirilmiştir. Lokal olarak ilerlemiş ve/veya metastatik RCC hastaları (N= 435) günde bir kez pazopanib 800 mg veya plasebo uygulanmak üzere randomize edilmiştir. Bu çalışmadaki toplam 435 hastadan 233'üne daha önce tedavi uygulanmamış olup 202 hastada daha önce bir IL-2 veya INFa-bazlı tedavi uygulanmıştır. Primer sonlanma noktası PFS'nin primer analizi tüm çalışma popülasyonunda (tedavi uygulanmamış ve sitokin uygulanmış) bağımsız radyolojik inceleme ile incelenen hastalık değerlendirmesine dayanmaktadır. Tablo 1: Bağımsız değerlendirme ile genel etkililik bulguları
HR = Risk oranı; ITT = Tedavi amaçlı; PFS = İlerlemesiz sağkalım. * - Tedavi Uygulanmamış ve Sitokin Uygulanmış Popülasyonlar.Şekil 1: Genel popülasyon için (tedavi uygulanmamış ve sitokin uygulanmış popülasyonlar) bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi Ay
AyŞekil 2: Tedavi uygulanmamış popülasyon için bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi
1.0f Pazopanib (N=155) Medyan 11.1 ay
0.8 i 4l
++-
Tehlike Oranı = 0.40 %95 CI (0.27, 0.60) P<0.0000001
Plasebo (N=78) Medyan 2.8 ay
+- 4 -.20
10
15 Ay Şekil 3: Sitokin uygulanmış popülasyon için bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi 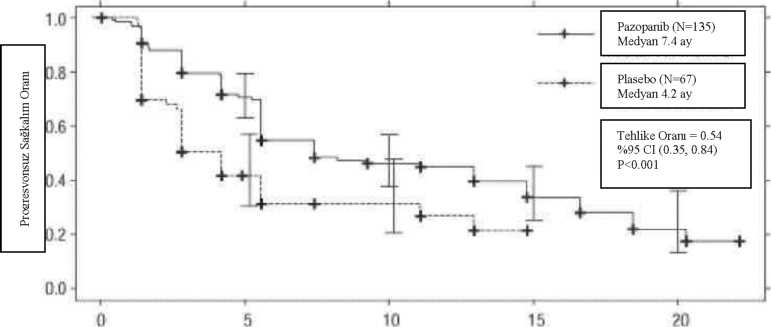 Ay
AyTedaviye yanıt veren hastalar için yanıt elde edilene kadar geçen ortalama süre bağımsız incelemeye göre 11.9 hafta ve ortalama yanıt süresi 58.7 haftaydı. Protokolde belirtilmiş nihai sağ kalım analizindeki ortalama genel sağkalım (OS) verisi, pazopanib ve plasebo kollarına randomize edilmiş hastalar için sırasıyla 22.9 ay ve 20.5 aydır [HR = 0.91 (% 95 CI: 0.71, 1.16; p = 0.224)]. Plasebo kolundaki hastaların %54'ü, hastalığın ilerlemesi üzerine bu çalışmanın uzatma kısmında pazopanib almış olduklarından, OS sonuçları potansiyel sapmaya tabidir. Plasebo hastalarının % 66'sı, pazopanib alan hastaların % 30'una kıyasla, çalışma sonrası tedavi almışlardır. Primer sonlanma noktası için analiz tarihinde genel sağkalım verileri yeterli değildi. Yumuşak Doku Sarkomu (STS) Pazopanib'in STS'de güvenlilik ve etkinliği bir randomize, çift kör, plasebo kontrollü çok merkezli çalışmada değerlendirilmiştir. Daha önce antrasiklin tedavisi görmüş veya bu tedavi için uygun olmayan, İlerlemiş STS'si olan hastalar (N= 369) günde bir kez pazopanib 800 mg veya plasebo uygulanmak üzere randomize edilmiştir. Kişilerin medyan izlem süresi (randominasyon tarihinden son irtibat veya ölüm tarihine kadarki süre olarak tanımlanır) her iki tedavi grubu için de benzerdi [plasebo için 9,36 (aralık 0,69 - 23,0 ay), pazopanib için 10,04 ay (aralık 0,2 - 24,3 a) idi]. Bu çalışmadaki temel amaç, her iki tedavi kolunun progresyonsuz sağ kalım (PFS) bakımından değerlendirilmesi ve karşılaştırılmasıydı; sekonder sonlanma noktaları, genel sağ kalım (OS), genel yanıt oranı ve yanıt süresini içermiştir. Tablo 2: Bağımsız değerlendirme ile STS'de genel etkinlik bulguları (VEG110727)
HR = Risk oranı; ITT = Tedavi amaçlı; PFS = Progresyonsuz sağ kalım; CR = Tam yanıt; PR = Kısmi yanıt.Bağımsız radyoloji incelemesi ile yapılan değerlendirmelere benzer şekilde, araştırmacının değerlendirmelerine göre plasebo koluna kıyasla pazopanib kolunda PFS'de klinik olarak anlamlı ve istatistiksel olarak önemli bir düzelme tespit edilmiştir (Risk oranı: 0.39; %95 CI, 0.30 ila 0.52, p <0.001).Şekil 4. Genel popülasyon için bağımsız değerlendirme ile STS'de progresyonsuz sağ kalım için Kaplan-Meier eğrisi (Tedavi edilmemiş ve önceden sitokin tedavisi görmüş popülasyonlar) (VEG110727)  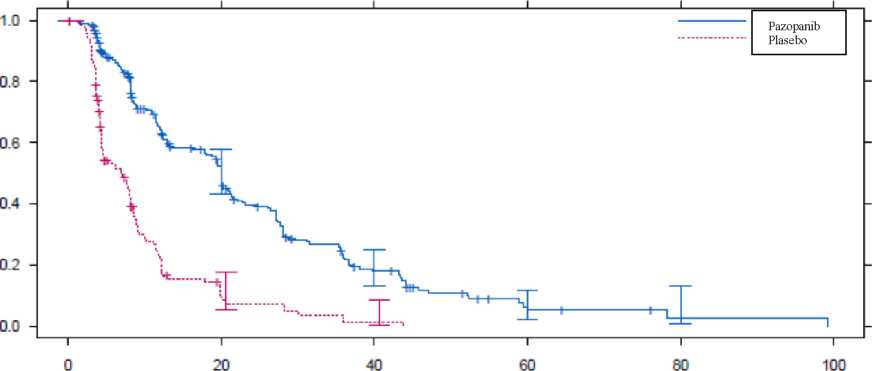 Risk altındaki gönüllüler
Risk altındaki gönüllülerRandomizasyondan itibaren geçen süre (Hafta) ss
25 _L_
Pazopanib Plasebo__Not: %95 güven aralığı bantları her bir tedavi için gösterilmiştir Önceden belirtilen ara analizde pazopanib lehine genel sağ kalım için risk oranı istatistiksel olarak anlamlı olmayıp, medyan genel sağ kalım plasebo kolunda 10.4 ay (%95 CI 8.7 ila 12.7) ve pazopanib kolunda 11.9 aydı (%95 CI 10.7 ila 15.1); HR = 0.82 (%97.87 CI:0.59 ila 1.14, p = 0.156). 5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:800 mg tek doz pazopanibin solid tümörlü hastalara oral yoldan uygulanmasını takiben, ortalama 3.5 saat sonra (1.0 ila 11.9 saat aralığında) yaklaşık 19 ± 13 mikrogram/mL'lik maksimum plazma konsantrasyonu (Cmax) ve yaklaşık 650 ± 500 mikrogram/ml'lik EEA« elde edilmiştir. Günlük dozlama EAA'da 1.23- ila 4-kat artışa neden olmaktadır. EAA veya Cmaks değerlerinde 800 mg'ın üstündeki pazopanib dozlarında tutarlı artış mevcut değildir. Pazopanib için sistemik maruziyet gıdalarla birlikte uygulandığında artmaktadır. Yüksek oranda veya düşük oranda yağ içeren öğünlerle birlikte pazopanib uygulanımı EAA ve Cmaks değerlerinde yaklaşık 2 kat artışa neden olmuştur. Bu nedenle pazopanib öğünlerden en az 1 saat önce veya 2 saat sonra uygulanmalıdır (bkz bölüm 4.2). Bütün olarak uygulanan tablet ile kıyaslandığında, parçalanmış bir tek pazopanib 400 mg tabletin uygulanması, EAA(0-72)'yı %46 ve Cmax'ı yaklaşık 2 kat artırmış ve tmax'ı yaklaşık 2 saat azaltmıştır. Bu sonuçlar, tabletlerin bütün uygulanmasına kıyasla tabletlerin parçalanarak uygulanmasının ardından biyoyararlanımın ve pazopanibin oral absorpsiyon hızının arttığını göstermektedir (bkz bölüm 4.2). Dağılım:Pazopanibin insan plazma proteinine in vivoİn vitroçalışmalar pazopanibin P-glikoprotein (P-gp) ve meme kanseri dirençli protein (BCRP) için bir substrat olduğunu düşündürmektedir.Metabolizma:İn vitroçalışmalar pazopanib metabolizmasına temelde CYP3A4'ün aracılık ettiğini ve CYP1A2 ve CYP2C8 enzimlerinin minör katkıda bulunduğunu göstermiştir. Dört temel pazopanib metaboliti plazmadaki maruziyetin sadece %6'sını oluşturmaktadır. Bu metabolitlerden biri, VEGF ile uyarılan insan umblikal ven endotel hücrelerinin çoğalmasını pazopanibinkine benzer bir potens ile inhibe ederken diğerleri 10 ila 20 kat daha az aktiftirler. Bu nedenle, pazopanibin aktivitesi temel olarak parent pazopanib maruziyetine dayanmaktadır.Eliminasyon:Pazopanib önerilen 800 mg dozunun uygulanmasından sonra ortalama 30.9 saatlik yarılanma ömrü ile yavaş elimine edilmektedir. Eliminasyon temelde feçes aracılığıyla gerçekleşmekte olup, renal eliminasyon yolu uygulanan dozun <% 4'ünü oluşturmaktadır. Hastalardaki karekteristik özelliklerBöbrek yetmezliği:Sonuçlar, oral uygulanmış pazopanib dozunun %4'ünün pazopanib ve metabolitleri şeklinde idrar ile atıldığını göstermektedir. Popülasyon farmakokinetik modellemesinden elde edilen sonuçlar (başlangıç CLCR değerleri 30.8 mL/dak ila 150 mL/dak aralığında değişen deneklerden elde edilen veriler) böbrek yetmezliğinin pazopanib farmakokinetiği üzerinde klinik olarak anlamlı bir etkisinin olması beklenmemektedir. Böbrek yetmezliğinin pazopanib maruziyetini etkilemesi beklenmemektedir ve kreatinin klirensi 30 mL/dak'nın üzerinde olan hastalarda dozaj ayarlaması gerekli değildir.Karaciğer yetmezliği:Karaciğer parametrelerinde hafif anormallik bulunan (normal bilirubin ve herhangi düzeyde alanin aminotransferaz (ALT) artışı veya ALT değerinden bağımsız olarak üst normal sınırın (ULN) 1.5 katına kadar yükselmiş bilirubin olarak tanımlanmaktadır) hastalarda günde bir kez 800 mg/gün dozunun uygulanmasını takiben medyan kararlı durum pazopanib Cmaks ve EAA (0-24) değerleri (30.9 mikrogram/ml, aralık 12.5-47.3 ve 841.8 mikrogram.s/ml, aralık 600.4-1078), karaciğer fonksiyonu normal hastalardaki medyan değerlerle benzerdir (49.4 mikrogram/ml, aralık 17.1-85.7 ve 888.2 mikrogram.s/ml, aralık 345.5-1482). Karaciğer parametrelerinde hafif anormallik bulunan hastalarda tedaviye günde bir kez 800 mg pazopanib dozu ile başlanması önerilir (bkz. bölüm 4.2). Orta şiddette karaciğer yetmezliği olan (deneklerde, günde 800 mg'lık doza normalize edildiğinde ortalama pazopanib Cmax'ı ve EEA(0-6 sa)'sı, normal karaciğer fonksiyonuna sahip olan deneklerindekilere kıyasla 2 kat artmıştır. Güvenlilik, tolerabilite ve farmakokinetik verilere dayanarak, orta şiddette karaciğer yetmezliği (ALT değerlerinden bağımsız olarak bilirubinde >1.5 x ila 3 x ULN kat artış olarak tanımlanır) olan hastalarda pazopanib dozu günde 200 mg'a düşürülmelidir (bkz bölüm 4.2). Pazopanib, şiddetli karaciğer yetmezliği olan hastalarda kontrendikedir (bkz bölüm 4.3).5.3 Klinik öncesi güvenlilik verileriPazopanibin klinik dışı güvenlilik profili fare, sıçan, tavşan ve maymunlarda değerlendirilmiştir. Kemirgenlerde yapılan tekrarlı doz çalışmalarında çeşitli dokulardaki (kemik, dişler, tırnak yatakları, üreme organları, hematolojik dokular, böbrek ve pankreas) etkilerin VEGFR inhibisyon farmakolojisi ve/veya VEGF sinyal ileti yolağının bozulması ile ilişkili olduğu düşünülmekte olup bu etkilerin büyük bir bölümü klinikte gözlenenin altındaki plazma maruziyet düzeylerinde meydana gelmiştir Diğer gözlemlenmiş etkiler, kilo kaybı, yüksek lokal mukozal ilaç maruziyetinin (maymunlarda) veya farmakolojik etkilerin (sıçanlarda) neden olduğu lokal gastrointestinal etkilere bağlı ikincil sonuçlar olan diyare ve/veya morbiditeyi içermektedir. EEA'ya göre insan maruziyetinin 1.5 katı maruziyetlerde dişi farelerde çoğalan hepatik lezyonlar (eozinofilik odak ve adenom) görülmüştür.Jüvenil hayvanlarda yapılan toksisite çalışmalarında, sıçanlara doğumdan sonra 9. günden başlayarak 21. güne kadar doz uygulandığında (insanlarda <2 yaşa karşılık gelir) pazopanib, erişkinlerde EAA değerine dayanarak klinik maruziyetin yaklaşık 0.1 katı dozda mortalitelere ve böbrek, akciğer, karaciğer ve kalpte anormal organ büyümesi/matürasyonuna neden olmuştur. Sıçanlara doğumdan sonra 21. günden başlayarak 62. güne kadar doz uygulandığında (insanlarda >2 yaşa karşılık gelir), benzer maruziyet düzeyleriyle toksikolojik bulgular erişkin sıçanlarla benzer olmuş ve kemik, trakea, dişler, adrenal, pankreas, mide, duodenum, lenf nodülü, erkek meme guddesi ve üreme organlarında değişiklikler kaydedilmiştir. Ekstremitelerde kısalma dahil bu değişiklikler jüvenil sıçanlarda >10 mg/kg/gün (erişkinlerde EAA düzeyine dayanarak klinik maruziyetin yaklaşık 0.1-0.2 katı) dozunda görüldüğünden erişkinlere kıyasla pediyatrik insan hastalar kemik ve diş etkileri açısından daha yüksek risk altındadır (bkz. Bölüm 4.4).Üreme, fertilite ve teratojenik etkiler Pazopanibin sıçanlara ve tavşanlara, insan maruziyetinden >300 kat daha düşük maruziyetlerde (EAA'ya göre) uygulandığında embriyotoksik ve teratojenik olduğu gösterilmiştir. Bu etkiler dişilerde azalan fertilite, artan preimplantasyon ve postimplantasyon kaybı, erken rezorpsiyon, embriyoletalite, ölümcül düzeyde azalan vücut ağırlığı ve kardiyovasküler malformasyonu içermiştir. Ayrıca, kemirgenlerde azalan korpora lutea, artan kistler ve over atrofisi gözlenmiştir. Sıçanlarda yapılan bir erkek fertilite çalışmasında fertilite veya çiftleşme üzerinde bir etki görülmemekle birlikte EAA'ya göre insanlardaki maruziyetin 0.5 katı maruziyetlerde gözlenen sperm üretim oranları, sperm motilitesi ve epididimal ve testiküler sperm konsantrasyonlarındaki azalmalar ile testiküler ve epididmal ağırlıkta azalma saptanmıştır. Genotoksisite Pazopanib genotoksisite testlerinde (Ames testi, insan periferik lenfosit kromozom aberasyon testi ve sıçanlarda in vivo mikronükleus testi) genetik hasara neden olmamıştır. Karsinojenisite Pazopanib ile karsinojenisite çalışması yapılmamış ise de 13 hafta süreyle 1,000 mg/kg/gün (EAA'ya göre insanlardaki klinik maruziyetin 1.5 katı) pazopanib verilen farelerden 2 dişi farede karaciğerde eozinofilik odaklı çoğalan lezyon ve diğer bir dişide tek bir adenom vakası gözlenmiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiMikrokristalin selüloz Sodyum nişasta glikolat Magnezyum stearat Povidon (K30)Hipromelloz Polisorbat Kırmızı Demir Oksit (E172) Makrogol 400 Titanyum dioksit (E171) 6.2 GeçimsizliklerGeçerli değildir.6.3 Raf ömrü:24 ay6.4 Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında saklanmalıdır.6.5 Ambalajın niteliği ve içeriği30 veya 90 tabletlik, çocuk emniyetli polipropilen kapaklı yüksek yoğunluklu polietilen (HDPE) şişeler.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİAdı: GlaxoSmithKline İlaçları Sanayi ve Ticaret A.Ş.Adresi: Büyükdere cad. No:173 1.Levent Plaza B Blok 34394, 1.Levent - İSTANBUL Tel no: 0 212 339 44 00 Faks no: 0 212 339 45 00 8. RUHSAT NUMARASI131/359. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ |
İlaç BilgileriVotrient 200mg Film Kaplı TabletEtken Maddesi: Pazopanib Hidroklorür Atc Kodu: L01XE11 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.