Avamys 27.5 Mcg Burun Spreyi Kısa Ürün BilgisiSolunum Sistemi » Burunla İlgili İlaçlar » Topikal Dekonjestanlar ve Diğer Nazal İlaçlar » Kortikosteroidler » Flucticasone furoate KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIAVAMYS 27.5 mikrogram Burun Spreyi2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Flutikazon furoat 27.5 mikrogramYardımcı maddeler:Benzalkonyum klorür 16.5 mikrogram Yardımcı maddeler için bölüm 6.1'e bakınız.3. FARMASÖTİK FORMUBurun spreyi, süspansiyon.Beyaz renkli, homojen dağılımlı bir süspansiyondur. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarYetişkinler ve 12 yaşından büyük adolesanlarda:Mevsimsel alerjik rinitin nazal ve oküler belirtilerinin tedavisinde endikedir. Yıl boyu devam eden alerjik rinitin nazal belirtilerinin tedavisinde endikedir. Çocuklar (2 - 11 yaş): Mevsimsel ve yıl boyu devam eden alerjik rinitin nazal belirtilerinin tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekli Pozoloji:Yetişkinlerde ve 12 yaşından büyük adolesanlarda:Önerilen başlangıç dozu, her burun deliğine günde bir kez uygulanan iki spreydir (her spreyde 27.5 mikrogram flutikazon furoat, günlük toplam doz 110 mikrogram). Belirtiler yeterince kontrol altına alındıktan sonra her burun deliğine günde bir kez uygulanan birer sprey (toplam günlük doz 55 mikrogram), idame tedavisinde etkilidir. Çocuklarda (2- 11 yaş): Önerilen başlangıç dozu, her burun deliğine günde bir kez uygulanan bir spreydir (her spreyde 27.5 mikrogram flutikazon furoat, günlük doz 55 mikrogram). Çocuklarda her burun deliğine günde bir kez uygulanan bir spreye (toplam günlük doz, 55 mikrogram) yeterli yanıt vermeyen hastalar; her burun deliğine günde bir kez iki sprey (toplam günlük doz 110 mikrogram) uygulayabilir. Belirtiler yeterince kontrol altına alındıktan sonra dozun; her burun deliğine günde bir spreye (toplam günlük doz 55 mikrogram) düşürülmesi önerilir. Uygulama sıklığı ve süresi:Tedavi süresi hekim tarafından belirlenmelidir.Tam terapötik fayda sağlanması için, düzenli kullanım önerilir. Etkisi, başlangıçtaki uygulamayı izleyen 8. saat gibi erken bir dönemde gözlenmiştir. En üst düzeyde fayda sağlayabilmek için, daha uzun süreli tedavi gerekmektedir. Düzenli kullanım ile belirtilerin düzeleceği konusunda hasta bilgilendirilmelidir. (bkz. Bölüm 5.1).Tedavi süresi alerjene maruz kalınan süre ile sınırlı olmalıdır.Uygulama şekli:AVAMYS Burun Spreyi, sadece intranazal uygulama içindir.Cihaz kullanıma hazırlandığında (ince bir duman çıkıncaya kadar yaklaşık 6 kez aktive edildiğinde) her sprey, 27.5 mikrogram etkin madde (flutikazon furoat) verir. Kapak, kullanım sonrası kapatılmalıdır. 1. Sprey uygulanmadan önce, sümkürülerek burun delikleri temizlenmelidir. 2. Sprey gözlere püskürtülmemelidir, kazara sprey gözlere temas ederse, gözler suyla iyice yıkanmalıdır. 3. Baş öne doğru biraz eğilir. Sprey dik olarak tutulup uç parçası burun deliklerinden birine yerleştirilir. Uç pa(bkz.Şekil 1).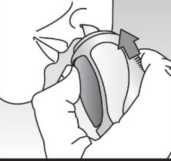 Şekil 1
Şekil 1
4. Burundan soluk alınırken, düğmeye bir kez basılarak ilacın buruna püskürmesi sağlanır {bkz.Şekil 2). Uç parçası burundan çıkarılır ve ağızdan soluk verilir. Şekil 2 5. Uygulama diğer burun deliğinde de tekrarlanır. Eğer 2 püskürtme yapılması gerekliyse, 4'üncü ve 5'inci basamaklar tekrarlanır. Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliğiBöbrek yetmezliğinde doz ayarlaması gerekmemektedir(bkz. Bölüm 5.2).Karaciğer yetmezliğiHafif - orta şiddette karaciğer bozukluğunda, doz ayarlaması gerekmemektedir. Şiddetli karaciğer bozukluğunda kullanım ile ilgili bilgi bulunmamaktadır(bkz. Bölüm 5.2).Pediyatrik popülasyon2 yaşın altındaki çocuklarda mevsimsel ve yılboyu süren alerjik rinitin tedavisinde intranazal flutikazon furoat kullanımının önerilmesi için yeterince veri yoktur.2 Geriyatrik popülasyonNormal yetişkin dozu kullanılır(bkz. Bölüm 5.2).4.3 KontrendikasyonlarAVAMYS Burun Spreyi'ndeki etkin maddeye veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir.4.4 Özel kullanım uyarıları ve önlemleriFlutikazon furoatın sistemik maruziyetindeki artış riski nedeniyle CYP3A4 ile metabolize olan bir diğer glukokortikoid olan ritonavir ile birlikte uygulanması tavsiye edilemez(bkz. Bölüm 4.5).Flutikazon furoat, karaciğer enzimi CYP3A4 ile geniş kapsamlı bir ilk geçiş metabolizmasına uğradığından, şiddetli karaciğer hastalığında intranazal flutikazon furoatın farmakokinetiği değişebilir (bkz. Bölüm 4. ve bölüm 5.2).Bu hastaların tedavisinde dikkatli olunmalıdır.Nazal kortikosteroidler, özellikle çok yüksek dozların uzun süre kullanılması durumunda sistemik etkilere neden olabilir. Bu etkiler, oral kortikosteroidlere göre daha az gözlenir ve kortikosteroidden kortikosteroide ve hastadan hastaya değişir (bkz. Bölüm 5. 2).Nazal kortikosteroidlerin önerilenden daha yüksek dozlarda kullanılması, klinik önem taşıyacak düzeyde adrenal supresyonla sonuçlanabilir. Önerilenden daha yüksek dozlar kullanıldığına dair kanıtlar varsa stres ya da elektif ameliyatlar sırasında ilave sistemik kortikosteroid kullanımı düşünülmelidir. Günde bir kez 110 mikrogram flutikazon furoata yetişkinlerde, adolesanlarda veya pediatrik hastalarda hipotalamus-hipofiz-adrenal (HPA) ekseninin supresyonu eşlik etmemiştir. Ancak intranazal flutikazon furoat, rinit belirtilerini etkili bir şekilde kontrol altında tutacak en düşük dozda kullanılmalıdır. Tüm nazal kortikosteroidlerde olduğu gibi, başka kortikosteroid formları ile birlikte tedavi öngörüldüğünde, toplam sistemik kortikosteroid yükü dikkate alınmalıdır. Bir yıl boyunca günde 110 mikrogram flutikazon furoat ile tedavi görmüş çocuklarda büyüme hızında azalma gözlenmiştir (bkz. bölüm 4.8 ve bölüm 5.1).Nazal kortikosteroidlerle uzun süre tedavi edilen çocukların boylarının düzenli olarak izlenmesi önerilir. Büyüme yavaşlarsa tedavi, kortikosteroid dozunun belirtileri etkili bir şekilde kontrol altında tutacak en düşük doza düşürülmesi amacıyla, gözden geçirilmelidir. Diğer intranazal kortikosteroidlerle de olduğu gibi uzmanların gözle görülür değişiklikler dahil tüm potansiyel sistemik steroid etkilerine karşı hazır olmaları gerekmektedir. Ayrıca böyle bir çocuğun, bir pediatri uzmanına sevki de düşünülmelidir.Adrenal fonksiyonunun bozulduğu izlenimini veren herhangi bir neden olduğunda, hastaların sistemik kortikosteroid tedavisinden flutikazon furoat tedavisine geçiş sırasında dikkatli olmak gerekir. Kortikosteroid kullanımı, depresyon, öfori, insomniya, ruh hali değişiklikleri, ve kişilik değişimleri gibi psikiyatrik bozukluklara yol açabilir. Kortikosteroid kullanımıyla mevcut psikiyatrik durum alevlenebilir. Kortikosteroidlerin uzun süreli kullanımı sekonder enfeksiyon insidansını artırabilir, akut enfeksiyonları (mantar enfeksiyonları dahil) maskeleyebilir, viral enfeksiyonları uzatabilir veya alevlendirebilir veya aşılara verilen yanıtı sınırlayabilir. Kortikosteroid kullanımı esnasında suçiçeğine maruz kalmaktan kaçınılmalıdır. Latent tüberkülozu (TB) olanların ve/veya tüberküloz reaktif hastaların yakından izlenmesi gereklidir; aktif TB'si olanlarda kısıtlı kullanılmalıdır (sadece antitüberküloz tedavisi ile birlikte). Nadir vaskülit vakaları (Churg-Strauss sendromu) veya diğer eozinofilik durumlar oluşabilir. Kortikosteroidlerle yapılan uzun süreli tedaviler Kaposi sarkoma gelişimi ile ilişkilidir (vaka raporları); böyle durumlarda tedavinin sonlandırılması düşünülmelidir. Tiroid hastalığı, karaciğer bozukluğu, böbrek bozukluğu, kardiyovasküler hastalığı, diyabet, glokom, katarakt, miyastenia gravis olan hastalarda, osteoporoz riski altındaki hastalarda, nöbet riski olan hastalarda veya gastrointestinal hastalıklarda (divertikülit, peptik ülser, ülseratif kolit) perforasyon riski nedeniyle dikkatli kullanılmalıdır. Akut miyokard enfarktüsünü takiben dikkatli kullanılmalıdır (kortikosteroidler miyokard yırtılmasıyla ilişkili bulunmuştur). Advers etki riskinden dolayı sistemik kortikosteroidler yaşlılarda kısa süreli olarak ve en küçük, olası ekili dozda kullanılmalıdır. Nazal septal ülserasyonu olanlarda, burun ameliyatı geçirmiş olanlarda veya burun travması geçirmiş olanlarda iyileşmeden nazal kortikosteroid kullanımından kaçınılmalıdır. AVAMYS benzalkonyum klorür içerir. Bu nedenle iritan mukoza reaksiyonlarına sebep olabilir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFlutikazon furoat, karaciğerdeki sitokrom P450 3A4 izoenzimi tarafından gerçekleştirilen ilk geçiş metabolizmasıyla dolaşımdan hızla temizlenir.Sistemik maruziyetteki artış ihtimali gözardı edilemeyeceğinden, flutikazon furoatın kuvvetli CYP3A4 inhibitörleriyle kombinasyon halinde kullanımında dikkatli olunmalıdır. İntranazal flutikazon furoat ile güçlü bir CYP3A4 inhibitörü olan ketokonazol arasındaki bir ilaç etkileşim çalışmasında; ketokonazol grubunda ölçülebilir flutikazon furoat konsantrasyonlarının saptandığı deneklerin sayısı, plasebo grubunda saptanandan daha yüksek (1/20'ye karşılık 6/20) bulunmuştur. Flutikazon furoat maruziyetindeki bu küçük artış, iki grubun 24 saatlik serum kortizol düzeyleri arasında, istatistiksel önemi olan bir fark yaratmamıştır (bkz. Bölüm 4.4).Flutikazon furoata sistemik maruziyetinin artma riski nedeniyle; CYP3A4 tarafından metabolize edilen başka bir glukokortikoidin (flutikazon propiyonat) ritonavirle birlikte verilmesiyle elde edilen verilere dayanılarak, böyle bir kombinasyonun kullanılması önerilmemektedir. Enzim inhibisyonu ve indüksiyonu verileri; klinikte kullanılan dozlarda flutikazon furoat ile diğer bileşiklerin sitokrom P450 enzimleri tarafından gerçekleştirilen metabolizmaları arasında metabolik ilaç-ilaç etkileşimi beklenmesine neden olacak herhangi bir teorik nedenin söz konusu olmadığını gösterdiğinden flutikazon furoatın diğer ilaçlarla etkileşimin incelendiği, herhangi bir klinik çalışma yapılmamıştır (bkz. Bölüm 4.4).4.6 Gebelik ve laktasyon Genel tavsiye:Gebelik Kategorisi C.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Veri bulunmamaktadır.Gebelik dönemi:Flutikazon furoatın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik, embriyonal/fetal gelişim, doğum veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir(bkz. Bölüm 5.3).İnsanlara yönelik potansiyel risk bilinmemektedir.Klinik öncesi çalışmalar:Hayvanlarda yapılan çalışmaların bulguları, güçlü kortikosteroidlere sistemik olarak maruz kalınmasını izleyen tipik belirtiler şeklindedir (bkz. Bölüm 5.3).İnsanlarda elde edilen veriler:İntranazal flutikazon furoatın insanlarda önerilen en yüksek günlük dozda (110 mikrogram) verilmesinin ardından plazmada tipik olarak, ölçülebilir konsantrasyonlar gözlenmemiştir (bkz. Bölüm 5.2).Fetusun ilacın etkilerine maruz kalması ve dolayısıyla üreme toksisite potansiyelinin çok düşük olması beklenmektedir.Flutikazon furoat hamilelik sırasında yalnızca anne adayında elde edilmesi beklenen faydalar, fetusun karşılaşabileceği risklerden fazlaysa kullanılmalıdır. AVAMYS gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemi:Flutikazon furoatın anne sütüyle atılıp atılmadığı bilinmemektedir. Flutikazon furoatın süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Emzirmenin durdurulup durdurulmayacağına ya da AVAMYS tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken emzirmenin çocuk açısından faydası ve AVAMYS tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği / Fertiliteİntranazal flutikazon furoatın insanlarda önerilen en yüksek günlük dozda (110 mikrogram) verilmesinin ardından plazmada tipik olarak, ölçülebilir konsantrasyonlar gözlenmemiş olduğundan, üreme toksisitesinin çok düşük olması beklenmektedir.4.7 Araç ve makine kullanımı üzerindeki etkilerFlutikazon furoatın ve intranazal olarak kullanılan diğer steroidlerin farmakolojisi dikkate alındığında, flutikazon furoatın araç veya makine kullanma yeteneği üzerinde olumsuz etki oluşturması beklenmez.4.8 İstenmeyen etkilerAdvers reaksiyonlarının sıklığını belirlemek amacıyla, büyük klinik çalışmalarda elde edilen veriler kullanılmıştır. Advers olay sıklığı, aşağıdaki gibi değerlendirilmiştir:Çok yaygın >1/10 Yaygın >1/100 ila <1/10 Yaygın olmayan >1/1000 ila <1/100 Seyrek >1/10,000 ila <1/1000 Çok seyrek <1/10,000 Bağışıklık sistemi hastalıklarıSeyrek: Anaflaksi/anafilaktik reaksiyonlar, anjiyoödem, yüz ve dilde ödem, deri döküntüsü ve ürtikeri de kapsayan aşırı duyarlılık reaksiyonları, hipersensitivite reaksiyonlarıSinir sistemi hastalıklarıÇok yaygın: Baş ağrısı Yaygın: Sersemlik, ateşYaygın olmayan: Psikomotor hiperaktivite Göz hastalıklarıYaygın olmayan: Gözlerde kuruluk ve iritasyon, katarakt, konjonktivit, bulanık görme, glokom, intraoküler basınçKardiyak hastalıklarıYaygın olmayan: Palpitasyon, AV blok (2.derece)Solunum, gögüs bozuklukları ve mediasten hastalıklarıÇok yaygın: Burun kanaması Yaygın: Burun yaralarıYaygın olmayan: Rinalji, burun rahatsızlıkları (burunda yanma, burunda tahriş ve burunda ağrı gibi), burun kuruluğu, hırıltılı solunum, ses değişiklikleri, sinüs konjesyonu, ses kısıklığı, dispne, boğaz ağrısı, bronkospazm, nazal kandidiyaz, nazal septal perforasyon. Burun kanaması, genellikle hafif-orta şiddette olmuştur. Burun kanamasının yetişkinlerdeki ve adolesanlardaki insidansı uzun süreli (>6 hafta) kullanımda, kısa süreli (<6 hafta) kullanıma kıyasla daha yüksek olmuştur. Pediatrik hastalarda yapılan süresi 12 haftaya varan çalışmalardaki burun kanaması insidansı, flutikazon furoat veya plasebo kullanan hastalarda birbirine yakın bulunmuştur. Gastrointestinal hastalıklarYaygın: Bulantı/kusma, abdominal ağrı, diyare Yaygın olmayan: AST artışDeri ve deri altı doku hastalıklarıYaygın olmayan: PruritusKas iskelet sistemi, bağ doku ve kemik hastalıkları:Yaygın: Sırt ağrısıYaygın olmayan: Tremor Bilinmiyor: Çocuklarda büyüme geriliği Puberte öncesi günde bir kez 110 mikrogram flutikazon furoat kullanan çocuklarda büyümeyi değerlendiren bir yıllık klinik çalışmada, plasebo ile karşılaştırıldığında ortalama yıllık büyüme hızı farkı -0.27 cm olarak gözlenmiştir. Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Ağrı sızı, gribi andıran sendromlarYaygın olmayan: Tat ve/veya koku alma duyusunda değişiklik veya his kaybı, boğazda kuruluk 4.9 Doz aşımı ve tedavisiBir biyoyararlanım çalışmasında, günde 2640 mikrograma varan intranazal dozların 3 gün içerisinde kullanılmasına eşlik eden hiçbir advers sistemik etki gözlenmemiştir(bkz. Bölüm 5.2).Akut doz aşımının, hastanın gözlem altında tutulmasının dışında herhangi bir tedavi gerektirmesi, neredeyse olanaksızdır.5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özellikler:Farmakoterapötik grup: Kortikosteroidler ATC kodu: R01A D12Flutikazon furoat; glukokortikoid reseptör affinitesi ileri derecede yüksek, güçlü anti-inflamatuvar etkilere sahip, sentetik, florlu bir kortikosteroiddir. Klinik deneyim: Yetişkin ve adolesanlardaki mevsimsel alerjik rinit: Günde bir kez kullanılan 110 mikrogram flutikazon furoat, günlük (geçen 12 saatte hastanın kendini nasıl hissettiği) ve anlık (değerlendirme sırasında hastanın nasıl hissettiği) dozlama öncesi toplam nazal belirtiler (burun akıntısı, burunda tıkanıklık, hapşırma ve burun kaşıntısını kapsayan rTNSS ve iTNSS) ve günlük ve anlık toplam oküler belirtilerde (kaşıntı/yanma hissi, göz yaşarması/sulanma ve gözün kızarmasını kapsayan rTOSS) plasebo ile kıyaslandığında belirgin bir düzelme sağlamıştır. Günde bir kez uygulama ile 24 saat boyunca nazal ve oküler belirtilerde etkililik sağlanmıştır.
Yetişkin ve adolesanlarda yıl boyunca devam eden (perennial) alerjik rinit: Günde bir kez kullanılan 110 mikrogram flutikazon furoat, günlük rTNSS (LS ortalama fark = -0.706, P= 0.005, %95 CI -1.20,-0.21)'de belirgin bir düzelme sağlamıştır. Nazal belirtilerdeki düzelme günde bir kez uygulamadan sonra 24 saatten fazla devam etmiştir. Tedaviye genel cevaba dair hastaların algı dağılımına göre de plasebodan belirgin derecede daha avantajlıdır. Flutikazon furoatın (günde bir kez 110 mikrogram intranazal sprey) oküler güvenliliğinin değerlendirilmesi için tasarlanan iki yıllık çalışmada perennial alerjik riniti olan yetişkin ve adolesanlara flutikazon furoat (n=367) ve ya plasebo (n=181) verilmiştir. Primer sonlanım noktalarına bakıldığında [posterior subkapsüler opasitede artış başlangıcına kadar geçen zaman - Lens Opasitesi Sınıflandırma Sistemi, Versiyon III'de (LOCS III derecelendirmesi) başlangıca göre >0.3'lük artış ve intraoküler basınçta artış başlangıcına kadar geçen zaman (intraoküler basınçta başlangıca göre >7 mmHg'lik artış) zamanı)] iki grup arasında istatistiksel olarak anlamlı fark görülmemiştir. Posterior subskapsüler opasite artışı (başlangıca göre >0.3) flutikazon furoat 110 mikrogram ile tedavi edilen hastalarda [14 (%4)] plaseboya [4 (%2)] göre daha sık saptanmıştır ve flutikazon furoat grubunda 10; plasebo grubunda 2 hastada geçici olmuştur. İntraoküler basınç (IOP) artışı (başlangıca göre >7 mmHg) flutikazon furoat 110 mikrogram ile 7 (%2) ve plasebo ile 1 (<%1) hastada olmak üzere flutikazon furoat 110 mikrogram grubunda daha sık saptanmıştır. Bu olay flutikazon furoat grubunda 6 ve plasebo grubunda 1 hastada geçici olarak görülmüştür. 52. ve 104. haftalarda, her iki tedavi grubundaki hastaların %95'inde posterior subkapsüler opasite değerleri her göz için başlangıç değerinin ± 0.1 aralığında bulunmuştur. 104. haftada her iki tedavi grubunda deneklerin <%1'inde posterior subkapsüler opasitede başlangıca göre >0.3 artış saptanmıştır. 52. ve 104. haftalarda deneklerin çoğunda (>%95) IOP değeri başlangıç değerinin ± 5mmHg aralığında bulunmuştur. Posterior subkapsüler opasite ya da IOP olaylarına katarakt ya da glokom advers olayları eşlik etmemiştir. Çocuklarda mevsimsel ve yıl boyunca devam eden (perennial) alerjik rinit: Pediyatrik pozolojide çocuklardaki alerjik rinit popülasyonu üzerinde etkililik verilerinin değerlendirmesi baz alınır. Çocuklarda mevsimsel alerjik rinit çalışmasında, iki hafta süresince intranazal flutikazon furoat 110 mikrogram uygulaması primer (günlük rTNSS LS ortalama fark =-0.616, P=0.025, %95 CI -1.15,-0.08) ve tüm sekonder nazal sonlanım noktalarında, burun akıntısı için bağımsız yansıtıcı skor hariç, etkili bulunmuştur. Günde bir kere 55 mikrogram flutikazon furoat nazal spreyin plasebo ile karşılaştırıldığında hiç bir sonlanım noktasında belirgin bir fark yaratmadığı gözlenmiştir. Bir perennial alerjik rinit çalışmasında, intranazal 55 mikrogram flutikazon furoat günlük rTNSS (LS ortalama fark =-0.754, P=0.003, %95 CI -1.24,-0.27) üzerinde etkili bulunmuştur. 100 mikrogramda rTNSS'de düzelme eğilimi olmasına karşın, istatistiksel açıdan anlamlı sonuca ulaşılamamıştır (LS ortalama fark = -0.452, P=0.073, 95% CI -1.24,-0.04). Aynı çalışmada, 6 ve 12 hafta üzerinden yapılan post-hoc analizi ve 6 haftalık HPA ekseni güvenilirlik çalışması, günde bir kez 110 mikrogram flutikazon furoat nazal sprey için rTNSS'de düzelmenin plasebodan istatistiksel açıdan anlamlı derecede iyi olduğunu göstermektedir. Randomize, çift kör, paralel grup, çok merkezli, plasebo kontrollü bir yıllık klinik büyüme çalışması puberte öncesindeki 474 çocukta (kızlar 5 - 7.5 yaş; erkekler 5 - 8.5 yaş) stadiyometre ile günde 110 mikrogram flutikazon furoat nazal sprey tedavisinin büyüme hızına etkisini değerlendirmiştir. 52 haftalık tedavi periyodunda ortalama büyüme hızı flutikazon furoat (5.19 cm/yıl) kullanan çocuklarda, plasebo (5.46 cm/yıl) kullanan çocuklara göre daha düşük olmuştur. Ortalama tedavi farkı yılda -0.27 cm bulunmuştur [%95 GA -0.48 - -0.06]. Genel özellikler:Flutikazon furoat; glukokortikoid reseptör affinitesi ileri derecede yüksek, güçlü anti-inflamatuvar etkilere sahip, sentetik, florlu bir kortikosteroid olmakla birlikte suda çözünmeyen, molekül ağırlığı 538.6 olan beyaz renkli bir tozdur.AVAMYS Burun Spreyi beyaz renkli, homojen dağılımlı bir süspansiyondur. Süspansiyonun pH değeri yaklaşık olarak 6'dır. Emilim:Flutikazon furoat tam olarak emilmez; sistemik maruziyet, karaciğerde ve bağırsakta geçirdiği geniş kapsamlı ilk-geçiş metabolizması sonucu, ihmal edilebilir düzeydedir. Günde 110 mikrogram flutikazon furoatın intranazal kullanımı plazmada tipik olarak, ölçülebilir konsantrasyonlarla (<10 pikogram/ml) sonuçlanmamıştır. Günde 3 kez 880 mikrogram olarak uygulanan intranazal flutikazon furoat için mutlak biyoyararlanım %0.50'dir (toplam günlük doz 2640 mikrogram). Dağılım:Plazmadaki flutikazon furoatın >%99'u proteinlere bağlanır. Flutikazon furoat vücutta yaygın olarak dağılır ve kararlı plazma düzeylerindeki ortalama dağılım hacmi 608 litredir. Biyotransformasyon:Flutikazon furoat sistemik dolaşımdan; öncelikle karaciğerde, sitokrom P450 izoenzimi CYP3A4 tarafından inaktif bir 17beta-karboksilik metabolit (GW694301X) yönünde metabolize edilerek hızla temizlenir (total plazma klerensi saatte 58.7 litre). S-florometil karbotiyoat fonksiyonunun 17beta-karboksilik asit metaboliti oluşturmak üzere hidrolizi, başlıca metabolizma yoludur. In vivoçalışmalarda furoatın, flutikazon oluşturmak üzere bölündüğünü gösteren hiçbir kanıt elde edilmemiştir.Eliminasyon:Oral veya intravenöz flutikazon furoatın öncelikle dışkı yoluyla eliminasyonu, bu kortikosteroidin ve metabolitlerinin safraya salgılandığını göstermektedir. İntravenöz kullanımı izleyen eliminasyon fazı yarı-ömrü 15.1 saattir. Oral ve intravenöz dozların sırasıyla %1'i ve %2'si, böbrekler yoluyla vücuttan atılır. Doğrusallık/Doğrusal olmayan durum:Flutikazon furoat doğrusal farmakokinetik sergiler. Hastalardaki karakteristik özelliklerBöbrek bozukluğu:Sağlıklı gönüllülerde intranazal uygulama sonrası flutikazon furoat, idrarda ölçülebilen düzeylerde çıkmaz. Dozla ilişkili materyalin %1'inden daha küçük bir bölümü idrara çıktığından böbrek bozukluğunun, flutikazon furoat farmakokinetiğini etkilemesi beklenmemektedir. Karaciğer bozukluğu:Karaciğer bozukluğu olan hastalarda intranazal flutikazon furoat ile yapılmış bir çalışma bulunmamaktadır. Orta derecede şiddetli karaciğer bozukluğu olan hastalarda inhale edilen 400 mikrogramlık tek bir flutikazon furoat dozunun kullanıldığı bir çalışmada Cmaks ve EAA (0-ro) değerlerinin, sağlıklı deneklerdekine kıyasla, sırasıyla %42 ve %172 oranında yükseldiği ve kortizol seviyesinin yaklaşık %23 oranında az miktarda düştüğü görülmüştür. Bu çalışmadaki verilere göre, 110 mikrogram intranazal flutikazon furoatın orta derecede şiddetli karaciğer bozukluğu olan hastalardaki tahmin edilen ortalama maruziyetinin, kortizol supresyonu ile sonuçlanması beklenmez. Bu yüzden orta derecede şiddetli karaciğer bozukluğunun normal yetişkin dozu üzerinde klinik öneme sahip bir etki göstermesi beklenmemektedir. Şiddetli karaciğer yetmezliği bulunan hastalar için herhangi bir veri bulunmamaktadır. Bu hastalarda flutikazon furoat maruziyetinin daha fazla olması beklenir. Pediyatrik popülasyon:Hastaların çoğunda, günde bir kez 110 mikrogram dozunda verilen flutikazon furoat tipik olarak plazmada ölçülemeyecek düzeylerde (<10 pikogram/ml) bulunur. Pediyatrik hastaların %15.1'inde günde bir kez 110 mikrogram intranazal flutikazon furoatı takiben ve yalnızca %7'sinde günde bir kez 55 mikrogram intranazal flutikazon furoatı takiben ölçülebilir düzeyler tespit edilmiştir. Daha küçük çocuklarda (6 yaşın altındaki çocuklar) flutikazon furoatın ölçülebilir düzeylerinin daha yüksek insidansına dair bir kanıt yoktur. 55 mikrogramda ölçülebilir düzeye sahip deneklerde ortalama flutikazon furoat konsantrasyonu 2-5 yaş ve 6-11 yaş için sırasıyla 18.4 pikogram/ml ve 18.9 pikogram/ml'dir. 110 mikrogramda ölçülebilir düzeylere sahip olan deneklerde ortalama flutikazon furoat konsantrasyonu 2-5 yaş ve 6-11 yaş için sırasıyla 14.3 pikogram/ml ve 14.4 pikogram/ml'dir. Sonuçlar 12 yaş üzeri adolesanlarda görülen sonuçlar ile benzerdir (55 mikrogramda ölçülebilir düzeye sahip deneklerde ortalama konsantrasyon 15.4 pikogram/ml, 110 mikrogramda ölçülebilir düzeye sahip deneklerde ortalama konsantrasyon 21.8 pikogram/ml). Geriyatrik popülasyon:Bu yaş grubuna ait farmakokinetik veriler yalnızca az sayıda (> 65 yaş, n=23/872; %2.6) hastadan derlenmiştir. Plazmada ölçülebilen flutikazon furoat konsantrasyonları insidansının ileri yaşlardaki hastalarda, gençlerdekinden daha yüksek olduğunu gösteren hiçbir kanıt yoktur. Diğer:Günde 110 mikrogram intranazal dozu takiben flutikazon furoat genellikle tayin edilebilir düzeye değildir (< 10 pg/ml). 12 yaş ve üzeri hastaların %31'inden azında ve pediyatrik hastaların % 16'sından azında günde bir kez 110 mikrogram intranazal dozlamayı takiben tayin edilebilir düzeyler gözlenmiştir. Diğerleri ile karşılaştırıldığında, cinsiyet, yaş (pediyatrik hastalar dahil) veya ırkın tayin edilebilir düzey ile bağlantılı olduğuna dair bir kanıt yoktur. 5.3 Klinik öncesi güvenlilik verileriGenel toksikoloji çalışmalarının sonuçları, diğer glukokortikoidlerde gözlemlenen sonuçlar gibidir ve flutikazon furoatın intranazal kullanımı ile klinik açıdan ilgisi olmadığı değerlendirilmektedir. Ayrıca, sıçanlarda ve farelerde yapılan 2 yıllık inhalasyon çalışmalarında tümör insidanslarında tedavi ile ilişkili olarak yükselme gözlenmemiştir. Flutikazon furoatin vitroin vivogenotoksik değildir. Flutikazon furoata yüksek sistemik maruziyetten emin olmak için hayvanlarda inhalasyon uygulaması ile üreme toksisitesi potansiyeli değerlendirilmiştir. Dişi veya erkek sıçanların çiftleşme performansında veya doğurganlığında herhangi bir etki gözlenmemiştir. Sıçanlarda gelişimsel toksikoloji, düşük doğum ağırlığı ile bağlantılı olarak tamamen kemikleşmemiş sternabra (sternumun bir parçası) görülme sıklığında artış ile sınırlandırılmıştır. Tavşanlarda yüksek dozlar düşüğü tetiklemiştir. Bu bulgular güçlü kortikosteroidlere sistemik maruziyet sonrası gözlenen tipik bulgulardır. Ne sıçanlarda ne de tavşanlarda majör iskelete bağlı veya iç organlarla ilgili anomaliler gözlenmemiş ve sıçanlarda doğum öncesi veya doğum sonrası gelişim üzerinde etkisi olmamıştır. Bu sonuçların minimum sistemik maruziyet için önerilen nazal dozları kullanan insanlarda geçerli olması beklenmez. Konvansiyonel genotoksisite testlerinde, flutikazon furoata ait genotoksik etkiler gözlenmemiştir.6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiGlukoz (susuz)Süspanse olabilen selüloz Polisorbat 80 Benzalkonyum klorür Disodyum edetat Saf su 6.2 GeçimsizliklerGeçerli değildir.6.3 Raf ömrü24 ay.6.4 Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında saklayınız. Buzdolabında saklamayınız veya dondurmayınız.6.5 Ambalajın niteliği ve içeriğiAVAMYS Burun Spreyi; ölçülü bir atomizör sprey pompası takılı, amber rengi cam bir şişe içerisinde yer alan, beyaz renkte, homojen dağılımlı bir süspansiyondur. Bu şişe daha çok kırık-beyaz renkte olan, bir doz gösterge penceresi bulunan, yan tarafındaki aktive edilme kolu açık mavi renk olan ve tıpalı kapağı olan, plastik bir cihaz içerisindedir. Her bir püskürtme cihaz dışına, yaklaşık 27.5 mikrogram, mikronize flutikazon furoat verilmesini sağlar. Bir şişe burun spreyinde 120 püskürtmelik ürün bulunmaktadır.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi atıkların kontrolü yönetmeliği ve Ambalaj ve ambalaj atıklarının kontrolü yönetmeliğine uygun olarak imha edilmelidir.
8. RUHSAT NUMARASI126/169. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 26/11/2008 Ruhsat yenileme tarihi:10. KÜB'ün YENİLENME TARİHİ12 |
İlaç BilgileriAvamys 27.5 Mcg Burun SpreyiEtken Maddesi: Flutikazon Furoat Atc Kodu: R01AD12 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.