Prexet 500mg I.v. İnfüzyon İçin Liyofilize Toz Iç... Kısa Ürün BilgisiKISA URUN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIPREXET 500 mg i.v. infüzyon için liyofilize toz içeren flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her bir 50 mlMik flakon 500 mg pemetrekset baza eşdeğer miktarda 614.65 mg pemetrekset disodyum içerir. Sulandırıldıktan sonra (Bkz. Bölüm 6.6.) her bir 50 ml'lik flakon 25 mg/ml pemetrekset içerir.Yardımcı maddeler:Sodyum hidroksit (yeterli miktarda)Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMinfıizyon çözeltisi için toz.Beyaz ila açık sarı ya da sarı-yeşil liyofilize toz. %0.9'Iuk sodyum klorür ile çözülerek hazırlanan çözelti berrak renksiz-sarı ya da yeşil(-sarı arasında renklidir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarMalien plevral mezotelvomaPREXET, daha önce kemoterapi almamış, rezeke edilemeyen malign plevral mezote|lyoması olan hastaların tedavisinde platin ile kombine olarak endikedir. Non-skuamöz küçük hücreli dışı akciğer kanseriPemetrekset lokal ileri hastalık ya da metastatik evredeki küçük hücreli dışı akdiğer kanserli hastaların, sadece non-skuamöz histolojik alt gruplarında olanlarında platinle kombine olarak başlangıç tedavisinde endikedir (Bkz. Bölüm 5.1.).PREXET non-skuamöz küçük hücreli dışı akciğer kanserli hastaların ikinci basama^ tedavisinde endikedir (Bkz. Bölüm 5.1.). 4.2. Pozoloji ve uygulama şekliPREXET sadece, antikanser kemoterapi s inde deneyimli bir hekimin gözetimi altında uygulanmalıdır.Pozoloji/uvgulama sıklığı ve süresi:PREXET çözeltisi Bölüm 6.6.'da verilen talimatlara uygun olarak hazırlanmalıdır.
£ iPREXET sisplatinle kombine olarak:Önerilen PREXET dozu, her 21 günlük kürün ilk gününde 10 dakikalık intravenöz infüiz uygulanmak üzere, 500 mg/m2 vücut yüzey alanıdır. Önerilen sisplatin dozu, her 21 günl gününde pemetrekset inflizyonunun tamamlanmasından yaklaşık 30 dakika sonra, i
yon şeklinde ük kürün ilk d saatlik bir ara sisplatinsüreyle inflizyon ile uygulanmak üzere, 75 mg/m vücut yüzey alanıdır. HastaIverilmeden önce ve/veva sonra yeterli antiemetik tedavi ve uygun hidrasvon uygulanmalıdır(özeldozlama için ayrıca sisplatin Kısa Ürün Bilgisi'ne bakınız). PREXET tek aian olarak:Önceden kemoterapi almış non-skuamöz küçük hücreli dışı akciğer kanseri için (tedavi edilen hastalarda, önerilen PREXET dozu her 21 günlük kürün ilk gününde 10 dakikalık intravenöz inflizyon şeklinde uygulanmak üzere 500 mg/m vücut yüzey alanıdır. Premedikasvon rejimi:Cilt reaksiyonlarının sıklık ve şiddetini azaltmak için, pemetrekset uygulamasından 1 gün önce, uygulama gününde ve uygulamadan sonraki günde kortikosteroid verilmelidir. Verilen kortikosteroid oral olarak günde iki kez uygulanan 4 mg deksametazona eşdeğer olmalıdır (Bkz. Bölün} 4.4.). Hastalar ilacın kullanımı ve vitamin destekleri konusunda bilgilendirilmelidir. Monitorizasvon:Pemetrekset uygulanan hastalar, her dozdan önce diferansiyel lökosit ve trombosit sayımımı da içeren, tam kan sayımı ile izlenmelidir. Her kemoterapi uygulamasından önce, renal ve hepatik fonksiyonları değerlendirmek için kan biyokimya testleri yapılmalıdır. Herhangi bir kemoterapi kürüne başlamadan önce hastanın aşağıdaki değerlere sahip olması gereklidir: Mutlak nötrofıl sayısı (MNS) >1500 hücre/mm3 ve trombosit sayısı >100,000 hücre/mimJ olmalıdır. Kreatinin klerensi >45 ml/dak olmalıdır. Toplam bilirubin, normal değer üst limitinin <1.5 katı olmalıdır. Alkalen fosfataz transaminaz (AST veya SGOT) ve alanin transaminaz (ALT veya SGPT) normal değer <3 katı olmalıdır. Eğer karaciğerde tümör metastazı varsa, alkalen fosfataz, AST normal değer üst limitinin <5 katı olması kabul edilebilir.
(J^P), aspartat üst limitinin ALT'nin
vı sya Doz ayarlaması:Bir sonraki kürün başlangıcındaki doz ayarlaması, bir önceki tedavi küründeki en düşük hematolojik sayımlara veya maksimum hematolojik olmayan toksisiteye dayanarak yapılmalıdır. Laboratuvar bulguları düzelene kadar tedavi ertelenebilir. Düzelme sağlandıktan sonra hastalar, PREXET'in tek ajan veya sisplatin ile kombinasyon halinde kullanımı için geçerli olan Tablo 1, 2 ve 3'teki kılavuzlara göre yeniden tedavi edilmelidir.
3 Bu kriter Ulusal Kanser Enstitüsü Genel Toksisite Kriterleri (GTK) (v2.0; NC1 1998) >GTK Grade 2 kjanama tanımına uyar Eğer hastalarda (nörotoksisite hariç) >Grade 3 hematolojik olmayan toksisite gelişirse, hastanın tedavi öncesi değerlerinden daha düşük veya eşit değerlere geri dönülünceye dek PREXET uygulaması durdurulmalıdır. Tedavi, Tablo 2'deki kılavuzlara uygun olarak sürdürülmelidir. TABLO 2 - PREXET (tek ajan veva kombine olarak) ve sisplatin için doz ayarlam Hematolojik olmayan toksisiteler8la tablosu -
Nörotoksisite gelişmesi halinde, PREXET ve sisplatin için önerilen doz ayarlamaları Tablo 3'te verilmiştir. Eğer Grade 3 veya 4 nörotoksisite gözlenirse, hastalarda tedavi kesilmelidir.
PREXET tedavisi, hastanın iki doz azaltılması sonrasında herhangi bir hematolojik veyş olmayan Grade 3 veya 4 toksisite görülmesi halinde bırakılmalı veya Grade 3 veya 4 görülmesi halinde ise derhal kesilmelidir.
hematolojik nörotoksisite Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:(Standard Cockcroft ve Gault formülü veya Tc99m-DPTA serum klerens metodu ile ölçülen Glomerüler Filtrasyon Oranı): Pemetrekset esas olarak değişmemiş halde böbrek yoluyla atılır. Klinik çalışmalarda, kreatinin klerensi >45 ml/dak olan hastalar, tüm hastalar için önerilenler dışında bir doz ayarlamasına gereksinim duymamışlardır. Kreatinin klerensi 45 ml/dak'nın altında olan hastalarda pemetrekset kullanımı ile ilgili yeterli veri mevcut değildir; bu nedenle bu hastalarda pemetrekset kullanılması önerilmemektedir (Bkz. Bölüm 4.4.).Karaciğer yetmezliği:AST (SGOT), ALT (SGPT) veya toplam bilirubin ve pemetrekset farmakokinetiği arasında bir ilişki saptanmamıştır. Bununla beraber, bilirubin değeri normal değer üst limitinin >1.5 katı ve/veya transaminazları normal değer üst limitinin >3.0 katı (hepatik metastazın olmadığı) veya normal değer üst limitinin >5.0 katı (hepatik metastazın olduğu) olan karaciğer yetmezliği bulanan hastalar spesifik olarak araştırılmamıştır.Pediyatrik popülasyon:Bu hasta grubunda güvenlilik ve etkililiği araştırılmamış olduğundan PREXET'in 18 ya)şm altındaki hastalarda kullanılması önerilmemektedir.Geriyatrik popülasyon:Klinik çalışmalarda, 65 yaş veya üzerindeki hastaların 65 yaşın altındaki hastalarla karşılaştırıldığında artmış bir istenmeyen etki riski altında bulunduklarına dair bir bulgu saptanmamıştır. Önerilenler dışında, genel olarak tüm hastalar için, doz azaltılması gerekli değildir.4.3. Kon tren di kasy on larPemetrekset veya ilacın içerdiği maddelerden herhangi birine karşı bilinen aşırı duyarlılığı bulunan hastalarda kontrendikedir.Pemetrekset ile tedavi sırasında emzirme kesilmelidir (Bkz. Bölüm 4.6.). Sarıhumma aşısı ile birlikte kullanımı kontrendikedir (Bkz. Bölüm 4.5.). 4.4. Özel kullanım uyarıları ve önlemlerijin kemik iliği toksisitedir. ıcjtrofıl sayıları
Pemetrekset, nötropeni, trombositopeni ve anemi (veya pansitopeni) ile kendini gösteri inhibisyonu yapabilir (Bkz. Bölüm 4.8.). Miyelosupresyon genellikle doz kısıtlayıcı Hastalar tedavi süresince miyelosupresyon açısından izlenmeli ve hastalara, mutlak nö (MNS) >1500 hücre/mmJ ve trombosit sayısı >100,000 hücre/mm"* düzeyine döniinceye kadar
pemetrekset uygulanmamalıdır. Bir sonraki kürler için doz azaltılması bir önceki kürde; düşük MNS, trombosit sayısı ve hematolojik olmayan maksimum toksisiteye dayanar (Bkz. Bölüm 4.2.). gözlenen en rak ayarlanır Kortikosteroid ile premedikasyon görmemiş hastalarda cilt reaksiyonları bildirilmiştir. E eksametazon (veya eşdeğeri) ile premedikasyon cilt reaksiyonlarının sıklık ve şiddetini azaltabilir "Bkz. Bölüm 4.2.). Kreatinin klerensi 45 ml/dak'nın altında olan araştırılmış hasta sayısı yeterli değildir. Bu nedenle, kreatinin klerensi 45 ml/dak'nın altında olan hastalarda pemetreksetin kullanımı önerilmemektedir (Bkz. Bölüm 4.2.). Hafif ile orta derecede böbrek yetmezliği bulunan hastalar (kreatinin klerensi 45-79 ml/dak), pemetrekset uygulamasının 2 gün öncesinden itibaren, uygulama gününde ve uygulamadan sonra 2 gün süreyle ibuprofen ve asetilsalisilik asit (günlük >1.3 g) gibi nonsteroidal antienflamatuar ilaçlar (NSAİİ) almaktan kaçınmalıdır (Bkz. Bölüm 4.5.). Pemetrekset tedavisi için düşünülen tüm hastalar, uzun atılım yarılanma Ömürlü NSAİİ'leri pemetrekset uygulamasının en az 5 gün öncesinden itibaren, uygulama gününde gününden sonra en az 2 gün süresince kullanmaktan kaçınmalıdır (Bkz. Bölüm 4.5.).
e uygulama Pemetreksetin tek başına ya da diğer kemoterapötik ajanlarla birlikte kullanıldığında akut böbrek yetmezliği dahil ciddi böbrek olayları bildirilmiştir. Bu hastaların çoğu, dehidrasyon veya önceden var olan hipertansiyon veya diyabet dahil böbrek bozukluklarının gelişimi için alttia yatan risk faktörlerine sahiptir. Plevral efüzyon veya asit gibi vücut boşluk sıvılarının pemetrekset üzerine olan etkileri tam olarak bilinmemektedir. Klinik olarak anlamlı vücut boşluk sıvısı bulunan hastalarda, pemetrekset uygulaması öncesinde efıizyonun direne edilmesine önem verilmelidir. Pemetreksetin, sisplatin ile kombine olarak verildiğindeki gastrointestinal toksisitesine bağlı olarak şiddetli dehidrasyon gözlenmiştir. Bu nedenle, hastalara tedavi öncesinde ve/veya sonrasında yeterli antiemetik tedavi ve uygun hidrasyon uygulanmalıdır. Pemetrekset klinik çalışmalarında, genellikle diğer bir sitotoksik ajan ile kombine verildiği durumlarda, yaygın olmayan miyokardiyal enfarktüs ve serebrovasküler olaylar dahil ciddi kardiyovasküler olaylar bildirilmiştir. Bu olayların gözlendiği hastaların çoğu önceden var olan kardiyovasküler risk faktörlerine sahiptir (Bkz. Bölüm 4.8.). Kanser hastalarında bağışıklık sistemin baskılandığı durum yaygındır. Sonuç olarak, fcanlı atenüe aşıların beraber kullanımı önerilmez (Bkz. Bölüm 4.3. ve 4.5.). Pemetreksetin, genetik olarak hasar verici etkileri olabilir. Cinsel olgunluktaki erkeklere, tedavi sırasında ve sonraki 6 aya kadar çocuk sahibi olmamaları önerilir. Kontraseptif yöntemler veya ilişkiden kaçınma tavsiye edilir. Pemetrekset tedavisinin geri dönüşümsüz infertiliteye sebep olabilme ihtimalinden dolayı erkeklere, tedaviye başlamadan önce sperm saklanması hakkında, danışmanlık almaları önerilir. Doğum yapma potansiyeli olan kadınlarda yöntemler kullanılmalıdır (Bkz. Bölüm 4.6.).
pemetrekset ile tedavi sırasında etkin
kontraseptif Pemetrekset tedavisini takiben veya tedaviden önce radyasyon tedavisi gören hastalarda radyasyon pnömönisi bildirilmiştir. Bu hastalarda ve diğer radyosensitif ajanların kullanımında özjellikle dikkat edilmesi gerekir. Haftalar veya yıllar öncesi radyasyon tedavisi gören hastalarda radyasyon çağrışırr (radyasyon recall) vakaları bildirilmiştir.
ı reaksiyonu Bu tıbbi ürün her flakonda yaklaşık 54 mg sodyum ihtiva eder. Bu durum kontrollü sod>jum diyetinde olan hastalar için göz önünde bulundurulmalıdır, 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriPemetrekset büyük bir oranda değişmeden tübüler sekresyon ve daha az olarak d;i glomerüler fıltrasyon ile böbrek yoluyla atılır. Nefrotoksik ilaçların (ör. aminoglikozid, kıvrım diüretikleri, platin bileşikleri, siklosporin) eşzamanlı olarak kullanılması, potansiyel olarak pemetreksetin klerensinin gecikmesine neden olabilir. Bu kombinasyon dikkatle kullanılmalıdır. Gerekiyorsa, krea:inin klerensi yakından izlenmelidir.Pemetreksetin, tübüler olarak salınan maddeler (ör. probenesid, penisilin) ile de eşzamanlı olarak kullanılması potansiyel olarak klerensinin gecikmesine neden olabilir. Bu ilaçlar pemetrekset ile kombine kullanıldığında dikkatli olunmalıdır. Gerekiyorsa, kreatinin klerensi yakından İ2İenmelidir. Normal böbrek fonksiyonu olan hastalarda (kreatinin klerensi >80 ml/dak), yüksek dozlarda nonsteroidal antienflamatuar ilaçlar (NSAİİ, ör. ibuprofen >1600 mg/gün) ve daha yüksek dozda asetilsalisilik asit (günde >1.3 g) pemetrekset atılımını azaltabilir ve sonuç olarak pemetrekset advers etkilerinin oluşumunu artırabilir. Bu nedenle, pemetrekset ile eşzamanlı olarak yüksek dozlarda NSAİİ ve yüksek dozda asetilsalisilik asit alan normal böbrek fonksiyonu olan hastalarjda (kreatinin klerensi >80 ml/dak) dikkatli olunmalıdır. Hafif ile orta derecede böbrek yetmezliği bulunan hastalarda (kreatinin klerensi 45-79 ml/dak), pemetrekset uygulamasının 2 gün öncesinden itibaren, uygulama gününde ve uygulamadan sonra en az 2 gün süreyle NSAİİ (ör. ibuprofen) veya yüksek dozlarda asetilsalisilik asit ile pemetreksetin eşzamanlı uygulamasından kaçınılmalıdır (Bkz. Bölüm 4.4.). Pemetreksetin, piroksikam veya rofekoksib gibi uzun yarılanma ömürlü NSAİİ etkileşimine ilişkin veri bulunmadığından bunların, pemetrekset uygulamasının en öncesinden itibaren, uygulama gününde ve uygulamadan sonra en az 2 gün sürey kullanımından kaçınılmalıdır (Bkz. Bölüm 4.4.).
potansiyel az 5 gün e eşzamanlı ile Pemetrekset sınırlı hepatik metabolizmaya maruz kalır. İnsan karaciğer mikrozomları vitroçalışmaların sonuçları, pemetreksetin CYP3A, CYP2D6, CYP2C9 ve CYP1A2 i edilen ilaçların metabolik klerenslerinde klinik olarak anlamlı bir inhibisyona nedle beklenmediğine işaret etmektedir.nda
yapılan ine metabolize n olmasınınTüm sitotoksiklerde görülen etkileşimler: Kanserli hastalardaki artmış trombotik riskten dolayı, antikoagülan tedavisi kullanımı siktir. Hastalık boyunca, koagülasyon durumunun kişideki yüksek değişkenliği ve eğer hastanın oral antikoagülanlar ile tedavisine karar verildiyse, oral antikoagülanlar ve antikanser kemoterapisi arasındaki olası etkileşim daha sık INR (Uluslararası Normalleştirilmiş Değer) izlemesini gerektirir. Kontrendike eşzamanlı kullanım: Sarıhumma aşısı: Ölümcül jeneralize aşı hastalığı riski
(Bkz. Bölüm 4.3.). Önerilmeyen eşzamanlı kullanım: Canlı atenüe aşılar (eşzamanlı kullanımı kontrendike olan sarıhumma dışında): Sistemik, olasılıkla ölümcül hastalık riski. Altta yatan hastalıklarıyla bağışıklık sistemi baskılanmış bireylerde risk artmaktadır. Bulunabilirse bir inaktif aşı kullanılır (çocuk felci) (Bkz. Bölüm 4.4.). Özel popülasyonlara ilişkin ek bilgiler:Pediatrik popülasyon:Herhangi bir etkileşim çalışması yapılmamıştır.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: DÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Doğum yapma potansiyeli olan kadınlarda pemetrekset ile tedavi sırasında etkin yöntemler kullanılmalıdır.
kontraseptif Gebelik dönemiPemetreksetin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bu PREXET, annenin ihtiyaçları ve fetüs için riskin dikkatle değerlendirmesinden sonra, bel} gerekli olmadıkça gebelik döneminde kullanılmamalıdır (Bkz. Bölüm 4.4.).
unmaktadır. rgin şekilde Laktasyon dönemiPemetreksetin insan ya da hayvan sütüyle atıldığına ilişkin yetersiz bilgi mevcuttur. Pemetreksetin süt ile atılmasına yönelik fizikokimyasal ve eldeki farmakodinamik/toksikolojik veriler nedeniyle memedeki çocuk açısından bir risk olduğu göz ardı edilemez. PREXET emzirme döneminde kullanılmamalıdır (Bkz. Bölüm 4.3.).Üreme yeteneği / FertiliteHayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Bölüm5.3.). Pemetreksetin, genetik olarak zarar verici etkileri olabilir. Cinsel olgunluktaki erkeklere, tedavi sırasında ve sonraki 6 aya kadar çocuk sahibi olmamaları önerilir. Kontraseptif yöntemler veya ilişkiden kaçınma tavsiye edilir. Pemetrekset tedavisinin geri dönüşümsüz infertiliteye sebep olabilme ihtimalinden dolayı erkeklere, tedaviye başlamadan önce sperm saklanması konusunda danışmanlık almaları önerilir. 4.7. Araç ve makine kullanımı üzerindeki etkilerPemetreksetin, araç ve makine kullanma yeteneği üzerine olan etkileri ile ilgili bir çalışma gerçekleştirilmemiştir. Bununla birlikte, yorgunluğa neden olabileceği bildirilmiştir Bu etkinin ortaya çıkması durumunda, hastalar araç sürme veya makine kullanma konusunda uyarıltjıahdır.4.8. İstenmeyen etkiler Mezotelyoma çalışması:Aşağıdaki tablo, sisplatin ve pemetrekset uygulanmak üzere randomize edilmiş mezotdlyomalı168163hastanın % 5'inden fazlasında bildirilmiş olan istenmeyen etkilerin sıklık ve şiddetlerini göstermekte'i ir.Advers reaksiyonlar: Sıklık derecesi: Çok yaygın (> 1/10);1/100<1/10);1/1,000ila <1/100); seyrek (> 1/10,000 ila <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Her bir sıklık grubu içinde, istenmeyen etkiler ciddiyetindeki azalmaya göre sıralanmıştır
** renal/genitoüriner diğer teriminden türetilen *** Ulusal Kanser Enstitüsü Genel Toksisite Kriterlerine (GTK) (v2.0; NC1 1998) göre tat alma bozuklıjğu ve alopesi yalnız Grade 1 ve 2 olarak rapor edilmelidir. Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların >%1 ve <% 5'inde bildirilmiş olan klinik olarak anlamlı Genel Toksisite Kriterleri (GTK) toks i siteleri: Böbrek yetmezliği, enfeksiyon, yüksek ateş, febril nötropeni, artmış AST, ALT ve GGT, ürtiker ve göğüs ağrısını içermektedir.Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların <%1'inde bildirilmiş olan klinik olarak anlamlı GTK toksisiteleri aritmi ve motor nöropatiyi içermektedir. İkinci basamak çalışması:Aşağıdaki tablo tek ajan olarak pemetrekset uygulanmak üzere randomize edilmiş 2&5 hasta ve tek ajan dosetaksel uygulanmak üzere randomize edilmiş 276 hastanın % 5'inden fazlasında bildirilmiş olan istenmeyen etkilerin sıklık ve şiddetlerini göstermektedir. Tüm hastalara lokal darak ilerlemişveya metastatik küçük hücreli dışı akciğer kanseri tanısı konmuş olup, daha ön almışlardır.
ce kemoterapi
Ulusal Kanser Enstitüsü GTK 2. baskı referans alınmıştır. Genel Toksisite Kriterlerine (GTK) (v2.0; NC1 1998) göre alopesi yalnız Gratie 1 ve 2 olarak Pemetrekset kullanmak üzere randomize olan hastaların >% 1 ve <% 5'inde bildirilmiş olan klinik olarak anlamlı Genel Toksisite Kriterleri (GTK) toksisiteleri: Nötropenİ olmaksızın enfeksiyon, febril nötropeni, alerjik reaksiyon/aşırı duyarlılık, artmış kreatinin, motor nöropati, sensoriyel nöropati, eritema multiforme ve abdominal ağrıyı içermektedir. Pemetrekset kullanmak üzere randomize olan hastaların <%1'inde bildirilmiş olan anlamlı GTK toksisiteleri supraventriküler aritmiyi içermektedir.
dinik olarak Üç tek ajan pemetrekset ile yapılan Faz 2 çalışmasının (n=164) birleştirilmiş sonuçları ve yukarıda tanımlanan tek ajan pemetrekset ile Faz 3 çalışması arasında nötropeni (sırasıyla %12.8'e karşılık % 5.3) ve alanın transaminaz yükselmesi (sırasıyla % 15.2'ye karşılık % 1.9) dışında klinik olarak anlamlı Grade 3 ve Grade 4 laboratuvar toksisiteleri benzer olmuştur. Bu farklılıklar hasta popülasyonundaki farklılığa bağlı olarak ortaya çıkmış olabilir, çünkü Faz 2 çalışmaları hem daha önce kemoterapi almamış hem de daha önce yoğun şekilde tedavi uygulanmış, önceden mevcut karaciğer metastazları ve/veya anormal başlangıç karaciğer fonksiyon testleri bulunar meme kanseri hastalarını içermiştir.Birinci basamak çalışması:Aşağıdaki tabloda, çalışmaya randomize edilen, sisplatin ile pemetrekset alan 839 kü<J akciğer kanseri hastasında ve sisplatin ile gemsitabin alan 830 küçük hücreli dışı hastasında, %5'den daha büyük sıklıkla bildirilen ve çalışma ilacı ile muhtemelen düşünülen istenmeyen etkilerin sıklık ve şiddeti verilmektedir. Hastaların tümü lokal veya metastatik küçük hücreli dışı akciğer kanseri için başlangıç tedavisi olarak çalı|ş almıştır.
ük hücreli dışı ^kciğer kanseri ilişkili olduğu cjlarak ilerlemiş ma tedavisini
başvurunuz uğu ve alopesi
*** Ulusal Kanser Enstitüsü Genel Toksisite Kriterlerine (GTK) (v2.0; NC1 1998) göre tad alma bozurçl yalnız Grade 1 ve 2 olarak rapor edilmelidir. Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların >%1 ve <%5'inde (yaygın) bildirilmiş olan klinik olarak anlamlı toksisiteler: Artmış AST ve ALT, enfeksiyon, febrİl nötropeni, böbrek yetmezliği, yüksek ateş, sıvı kaybı, konjunktivit ve kreatinin klerensinde azalmayı içermektedir. Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların <% Tinde (yaygın olmayan) bildirilmiş olan klinik olarak anlamlı toksisiteler: GGT artışı, göğüs ağrısı, aritmi ve rr içermektedir.
otor nöropatiyi Pemetrekset ile birlikte sisplatin alan hastalarda, cinsiyete göre klinik açıdan önemli toksisiteler, genel hasta popülasyonuyla benzer olmuştur. Pemetrekset klinik çalışmalarında, genellikle diğer bir sitotoksik ajan ile kombine olarak verildiği durumlarda, miyokardiyal enfarktüs, angina pektoris, serebrovasküler araz ve geçici iskemik atak dahil yaygın olmayan kardiyovasküler ve serebrovasküler olaylar bildirilmiştir. Bu olayların gözlendiği hastaların çoğu Önceden var olan kardiyovasküler risk faktörlerine sahiptir. Pemetrekset klinik çalışmalarında, potansiyel olarak ciddi hepatit vakaları seyrek olarak bildirilmiştir. Pemetrekset klinik çalışmalarında yaygın olmayan pansitopeni bildirilmiştir. Klinik çalışmalarda, pemetrekset ile tedavi edilen hastalarda (bazen fatal olan intestinal ve rektal kanama, intestinal perforasyon, intestinal nekroz ve tiflit dahil) yaygın olmayan kolit vakaları bildirilmiştir. Klinik çalışmalarda, pemetrekset ile tedavi edilen hastalarda nadir olarak bazen fatal yetmezliği ile seyreden interstisyel pnömoni vakaları bildirilmiştir.
olan solunum bildirilmiştir, advers etkiler Pemetrekset ile tedavi edilen hastalarda yaygın olmayan ödem vakaları bildirilmiştir. Pemetrekset ile yapılan klinik çalışmalarda yaygın olmayan ösofajit/radyasyon ösofajiti Pazarlama sonrası araştırmalara göre pemetrekset ile tedavi edilen hastalarda aşağıdaki bildirilmiştir: Pemetreksetin tek başına veya diğer kemoterapötik ajanlarla birlikte kullanıldığında akut böbrek yetmezliği bildirilmiştir (Bkz. Bölüm 4.4.). Pemetrekset tedavisi sırasında, sonrasında veya tedaviden önce radyasyon tedavisi gören hastalarda radyasyon pnömonisi bildirilmiştir (Bkz. Bölüm 4.4.). Daha önce radyoterapi gören hastalarda radyasyon çağrışımı reaksiyonu (radyasyon recall) vakaları bildirilmiştir (Bkz. Bölüm 4.4.). Ekstremitede nekrolize yol açan periferal iskemi vakaları bildirilmiştir. 4.9. Doz aşımı ve tedavisiBildirilmiş doz aşımı semptomları nötropeni, anemi, trombositopeni, mukozit, sensoriyel polinöropati ve döküntüyü içermektedir. Doz aşımının beklenen komplikasyonları kendini nötropeni, trombositopeni ve anemi ile belli eden kemik iliği baskılanmasıdır. Ayrıca ateş ile birlikte veya ateşolmaksızın enfeksiyon, diyare ve/veya mukozit görülebilir. Doz aşımından şüpjhelenildiğinde, hastalar kan sayımı ile izlenmeli ve gereken destek tedaviler uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özellikler
Farmakoterapötik grubu ATC kodu
: Folik asit analogları : L01BA04 PREXET (pemetrekset) etkisini, hücre çoğalması için temel teşkil eden folata bağımlı metabolik süreçleri bozmak suretiyle gösteren çok hedefli, antikanser, antifolat bir ajandır. İn vitrode novobiyosentezi için folata bağımlı Önemli enzimler olan timidilat sentaz (TS), dihidrofolat redüktaz (DHFR) ve glisinamid ribonükleotid formiltransferazı (GARFT) inhibe etmek suretiyle çok-hedefli bir antifolat olduğunu göstermiştir. Pemetrekset, indirgenmiş folat taşıyıcı ve membran folat bağlayıcı protein taşıma sistemlerinin her ikisi tarafından hücre içine taşınmaktadır. Hücre içine girdiğinde pemetrekset, folilpoliglutamat sentetaz enzimi tarafından hızla ve etkin bir şekilde poliglutamat formlarına dönüştürülür. Poliglutamat formları hücre içinde tutulur ve daha da kuvvetli TS! ve GARFT inhibitörleridirler. Poliglutamasyon, tümör hücrelerinde ve daha az olarak da normal dokularda meydana gelen, zaman ve konsantrasyona bağımlı bir süreçtir. Poliglutamata dönüştürülmüş metabolitlerin hücre içi yarılanma ömrü artmış olup, bu da malign hücrelerde ilaç etkisinin daha uzun sürmesini sağlamaktadır.Klinik Etkililik: Mezotelyoma: Malign plevral mezotelyomalı, daha önce kemoterapi almamış hastalarda, pemetreksdt ve sisplatin kombinasyonuna karşılık sisplatinin karşılaştırıldığı çok merkezli, randomize, tek kör, Faz 3 çalışması (EMPHACIS), pemetrekset sisplatin kombinasyonu ile tedavi edilen hastaların yalnızca sisplatin verilen hastalara kıyasla klinik olarak anlamlı 2.8 aylık bir medyan sağ kalım avantajına sahip olduklarını göstermiştir. Bu çalışmanın primer analizi, randomize olarak bir tedavi grubuna ayrılan ve çalışma ilacı verilen (randomize olan ve tedavi edilen) tüm hasta popülasyonunda gerçekleştirilmiştir. Bu etkililik analizlerinin sonuçlan aşağıdaki tabloda özetlenmiştir: Maligıı plevral mezotelyomada pemetrekset - sisplatin kombinasyonuna karşılık sisplatin
** Pemetrekset/sisplatin kolunda, randomize ve tedavi edilmiş (N=225) ve tam takviye almış (NM67) Tek başına sisplatin koluna (218 hasta) kıyasla pemetrekset/sisplatin kolunda (212 Kanseri Semptom Ölçeği (Lung Cancer Symptom Scale) kullanılarak, malign plevral ile ilişkili klinik olarak önemli semptomlarda (ağrı ve dispne) istatistiksel olarak anlam gözlenmiştir. Pulmoner fonksiyon testlerinde de istatistiksel olarak anlamlı iyileşmeler hasta)
Akciğer mezotelyoma ı bir iyileşme gözlenmiştir. İkinci basamak küçük hücreli dışı akciğer kanseri: Lokal olarak ilerlemiş veya metastatİk küçük hücreli dışı akciğer kanseri hastalarında, daha önce alınan kemoterapi sonrasında, pemetrekset ile dosetakselin karşılaştırıldığı çok merkezli, randomize, açık faz 3 çalışması, pemetrekset ile tedavi edilen hastalarda 8.3 aylık (Tedavi denenenler (TD) popülasyonu; n=283), dosetaksel ile tedavi edilen hastalarda 7.9 aylık (TD n=288) klinik olarak anlamlı medyan sağ kalım süreleri göstermiştir. Küçük hücreli dışı akciğer kanseri histolojisinin genel sağ kalım üzerindeki etkisi ile ilgili bir analiz, baskın olarak skuamöz hücreli karsinom histolojisine sahip olanlar dışındaki küçük hücreli dışı akciğer kanseri hastalarında, p emetreksetin dosetaksele istatistiksel olarak anlamlı düzeyde üstün olduğunu göstermiştir (n=399, 8.(1 aya karşılık 9.3 ay, düzeltilmiş TO (tehlike oranı) = 0.78; % 95 GA=0.61-1.00, p=0.047), skuamöz hücreli karsinom histolojisine sahip hastalarda ise dosetaksel lehindedir (n=172, 7.4 aya karşılık 6.2 ay, düzeltilmiş TO = 1.56; % 95GA=1.08-2.26, p=0.018). Histolojik alt gruplar arasında pemetreksetin güvenlilik profili açısından klinik olarak önemli hiçbir fark gözlenmemiştir.
%28.2 (% 95 GA. 25.0-31.4). Progresyonsuz sağkalım verileri bağımsız bir değerlendirme ile kısmen desteklenmiştir (1725 hastadan 400'ü değerlendirme için rastgele seçilmiştir).Küçük hücreli dışı akciğer kanseri histolojisinin genel sağ kalım üzerindeki etkisi il|e ilgili analiz histolojiye göre klinik olarak farklılıklar göstermektedir, bakınız aşağıdaki tablo. ile Gemsitabin + Sisplatinin Etkililiklerinin Karşılaştırması - Tedavi Denenenve Histolojik Alt Gruplar'opülasyon
a TO oranı için tüm güven aralığı 1.17645 non-inferiorite sınırının oldukça altında olacak şekilde, n<j>n-inferiorite için istatistiksel olarak anlamlılık vardır. Histolojiye Göre Genel Sağ Kalım İçin Kaplan Meier Eğrileri Adenokarsinoma Büyük hücreli karsinoma  S*6kaİHnaiira*l(ay|
S*6kaİHnaiira*l(ay|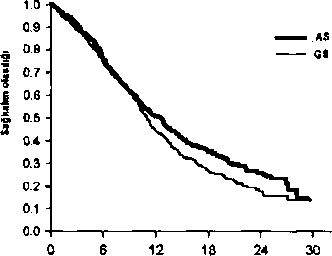 SaGkahn ıürs«l (ay)
SaGkahn ıürs«l (ay)Histoloji alt gruplarında pemetrekset artı sisplatinin güvenlilik profilinde klinik olarjak ilişkili bir farklılık gözlenmemiştir. Pemetrekset ve sisplatin ile tedavi edilen hastalarda daha az transfuzyon (% 28.9'a karşılık % 16.4, p<0.001), eritrosit transfıizyonu (% 27.3'e karşılık % 16.1, p<0.001) ve trombosİt transfıizyonu (% 4.5'e karşılık % 1.8, p=0.002) gerekmiştir. Ayrıca bu hastalara daha az eritropoietin/darpopoietin (% 18.l*c karşılık % 10.4, pcO.OOl), G-CSF/GM-CSF (% 6.1'e karşılık % 3.1, p=0.0|)4) ve demir preperatı (% 7.0'a karşılık % 4.3, p=0.021) verilmesi gerekmiştir. 5.2. Farmakokinetik özelliklerEmilim:Pemetreksetin farmakokinetik Özellikleri, çeşitli solid tümörü bulunan 426 kanser hastasında tek ajan olarak 0.2-838 mg/m2 arası dozlarda, 10 dakikalık inflizyon sonrası değerlendirilmiştir. Pemetreksetin toplam eğri altı alanı (EAA) ve doruk plazma konsantrasyonu dozla doğru orantılı olarak artar. Pemetreksetin farmakokinetiği, tekrarlayan tedavi kürleri boyunca değişmemektedir. Dağılım:Pemetreksetin kararlılık durumundaki dağılım hacmi 9 L/m2,dir. İn vitroçalışmalar, pemetreksetin yaklaşık % 81 oranında plazma proteinlerine bağlandığını göstermiştir. Değişik evrelerdeki böbrek bozuklukları bu bağlanmayı anlamlı şekilde etkilememiştir.Biyotransformasvon:Pemetrekset sınırlı hepatik metabolizmaya maruz kalır. Eliminasvon:Pemetrekset esas olarak idrar ile atılmakta olup, uygulamayı takiben 24 saat içinde uygulanan dozun % 70 ile % 90 kadarı idrarda değişmemiş halde saptanmaktadır. Pemetreksetin toplam sistemik klerensi 91.8 ml/dak ve normal böbrek fonksiyonlarına (kreatinin klerensi 90 ml/dak) sahip olan hastalarda plazmadan atılım yarılanma ömrü 3.5 saattir. Klerensteki hastalar arası değişkenlik % 19.3 ile orta düzeydedir. Doğrusallık/Doğrusal olmayan durum:Pemetreksetin toplam eğri altı alanı (EAA) ve doruk plazma konsantrasyonu dozla doğru orantılı olarak artar. Pemetreksetin farmakokinetiği, tekrarlayan tedavi kürleri boyunca değişmemektedir. Farmakokinetik/farmakodinamik ilişkilerPemetreksetin farmakokinetik özellikleri, eşzamanlı uygulanan sisplatinden etkilenmemektedir.5.3. Klinik öncesi güvenlilik verileriGebe farelere pemetrekset uygulanması, fotal yaşama kabiliyetinde düşüş, fötal ağırlıkta azalma, bazı iskelet yapılarının kemikleşmesinde tamamlanamama ve yarık damak oluşmasıyla sonuçlanmıştır.Erkek farelere pemetrekset uygulanması, fertilite oranında azalma ve testiküler atrofı ijle karakterize olan üreme toksisitesiyle sonuçlanmıştır. 9 ay boyunca intravenöz bolus enjeksiyonu yapılan av köpeklerinde gerçekleştirilen bir çalışmada testiküler bulgular (seminifer epitelyumun dejenerasyonu/ nekrozu) gözlenmiştir. Bu pemetreksetin erkek fertilitesini azaltabileceğini göstermektedir. Dişi fertiütesi araştırılmamıştır. Çin hamsteri över hücrelerinde yapılan in vitroin vivomikronükleus testinde pemetreksetin klastojenik olduğu gösterilmiştir.Pemetreksetin karsinojenik potansiyelini değerlendiren çalışma yapılmamıştır. 6.1. Yardımcı maddelerin listesiMannitol Hidroklorik asit Sodyum hidroksit6.2. GeçimsizliklerPemetrekset, laktatlı Ringer enjeksiyonu ve Ringer enjeksiyonu dahil kalsiyurjn içeren tüm seyrelticileri ile fiziksel olarak geçimsizdir. Pemetreksetin diğer ilaçlar ve seyrelticiler ile diğer geçimlilik çalışmaları olmadığından, bu tıbbi ürün diğer tıbbi ürünler ile karıştırılmamalıdır.6.3. Raf ömrüAçılmamış flakon:24 ay Rekonstitüe edilmiş ve seyreltilmiş tıbbi ürün; Tarif edildiği şekilde seyreltilen PREXET infüzyon çözeltileri antibakteriVel koruyucu içermemektedir. Pemetrekset infüzyon çözeltilerinin kullanım sırasındaki kimyasal ve fiziksel stabilitesi 2-8°C veya 25°C sıcaklıkta 24 saattir. Mikrobiyolojik açıdan ürün hemen kullanılmalıdır. Eğer hemen kullanılmazsa, kullanmadan önceki saklama süresi ve koşulları kullanıcının sorumluluğundadır ve rekonstitüsyon/seyreltme işlemleri kontrollü ve valide edilmiş aseptik koşullar altında gerçekleştirilmediği sürece normalde 2°C-8°C arasında 24 saatten fazla olmama(ıdır. 6.4. Saklamaya yönelik özel tedbirlerAçılmamış flakon:25°C'nin altındaki oda sıcaklığında saklayınız. Rekonstitüe edilmiş infıizyon çözeltileri: Rekonstitüe tıbbi ürünlerin saklama koşulları için Bkz. Bölüm 6.3. 6.5. Ambalajın niteliği ve içeriğiKoruyucu blister seperatör içerisinde, lastik tıpa ve flip-off aluminyum kapak ile kapatılmış renksiz 50 ml'lik Tip 1 cam flakonda 500 mg pemetrekset içeren liyofılize toz bulunur. 1 flakonluk ambalajda kullanma talimatı ile birlikte piyasaya sunulmaktadır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler1. Pemetreksetin intravenöz infüzyon uygulaması için rekonstitüsyonu ve daha fazla sırasında uygun aseptik teknikleri kullanınız.2. Gerekli olan doz ve PREXET flakon sayısını hesaplayınız. Her flakon, etikette belirtjilen miktarın rahatça çekilebilmesi için bir miktar fazla pemetrekset içermektedir. seyreltilmesi 3. Her bir 50 ml'lik flakon ise 20 mİ 9 mg/ml (% 0.9'Iuk) sodyum klorür enjeksiyonluk çözeltisi ile çözülerek 25 mg/ml pemetrekset içeren bir çözelti elde edilir. Toz tamamen çözünene kadar flakonları hafifçe çalkalayınız. Elde edilen çözelti berrak ve ürün kalitesi üzerinde olumsuz etkisi olmaksızın renksiz-sarı veya yeşil-sarı arasında renklidir. Hazırlanmış çözeltinin pH'ı 6.6-7.8 arasındadır. Daha fazla seyreltme gereklidir.4. Hazırlanan pemetrekset çözeltisinin uygun hacmi, 9 mg/ml (% 0.9'luk) sodyum klorür enjeksiyonluk çözeltisi ile 100 ml'ye seyreltilmelidir ve 10 dakika süreyle intravsnöz infüzyon şeklinde uygulanmalıdır.5. Yukarıda tarif edildiği şekilde hazırlanan pemetrekset infüzyon çözeltileri, infüzyon cam şişeleri ile uyumludur. 6. Parenteral ilaç ürünleri uygulamadan önce partikül içeriği ve renk bozuklukları açısından görsel olarak kontrol edilmelidir. Eğer partikül madde gözlenirse ürün kullanılmamalıdır. 1.Pemetrekset çözeltileri tek kullanım içindir. Kullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrol Yönetmeliği ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.Hazırlama ve uygulama önlemleri:Diğer potansiyel olarak toksik antikanser ajanlarda olduğu gibi, pemetrekset infüzyon çözeltilerinin hazırlanması ve kullanımında dikkatli olunmalıdır. Eldiven kullanılması önerilir. Eğer pemetrekset çözeltisi cilt ile temas ederse, cilt hemen sabun ve suyla iyice yıkanmalıdır. Eğer pemetrekset çözeltisi müköz membranlar ile temas ederse su püskürtülerek iyice yıkanmalıdır. Pemetrekset, vezikan bir madde değildir. Pemetreksetin ekstravazasyonıı için spesifik bir antidot bulunmamaktadır. Pemetrekset ekstravazasyonu İçin bildirilen birkaç vaka, araştırıcı tarafından ciddi olarak değerlendirilmemiştir. Ekstravazasyon için diğer non-vezikanlarda olduğu gibi yerel standart pratikler uygulanmalıdır.7. RUHSAT SAHİBİMustafa Nevzat İlaç Sanayii A.Ş. Pak İş MerkeziProf. Dr. Bülent Tarcan Sok. No: 5/1 34349 Gayrettepe - İstanbul 8. RUHSAT NUMARASI253/159* İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 11.09.2013 Ruhsat yenileme tarihi: -10. KÜB'ÜN YENİLENME TARİHİ19/19 |
İlaç BilgileriPrexet 500mg I.v. İnfüzyon İçin Liyofilize Toz Iç...Etken Maddesi: Pemetrekset Disodyum Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.