Koate-dvi 500 Iu/5 Ml Iv Enjeksiyon İçin Liyofili... Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIKOATE-DVI 500 IU / 5 mL IV enjeksiyon için liyofilize toz içeren flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her bir doz içinde;Koagülasyon Faktör VIII 500 IU * *IU; İnsan kan koagülasyon faktör VIII için Dünya Sağlık Örgütü'nün standart tanımlamasına göre 1 IU yaklaşık olarak; 1 ml taze toplanmış insan plazması içerisindeki antihemofilik faktör düzeyine eşittir. Yardımcı maddeler:Sodyum klorür 0.044gYardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti için liyofilize toz içeren flakon, sulandırıldıktan sonra homojen renksiz çözelti.4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar KOATE-DVI, plazma pıhtılaşma faktörü (Faktör VIII) aktivite eksikliğinin olduğu gösterilen klasik hemofili tedavisi için (Hemofili A) endikedir. KOATE-DVI, hemofilisi olan kişilerde elektif cerrahi ve acil olarak uygulanması gerekli kanama epizodlarının düzeltilmesi/ önlenmesi için eksik olan pıhtılaşma faktörünün geçici olarak yerine konulmasını sağlar. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresiAşağıdaki tanımlanan dozlar genel yöntem olarak yer almaktadır. Hemostaz için gereken KOATE-DVI dozu için, hastanın ihtiyacına, eksikliğin şiddetine, hemorajinin ciddiyetine, inhibitörlerin varlığına ve istenen Faktör VIII düzeyine göre kişiselleştirilmesine önem verilmelidir. Sıklıkla, Faktör VIII düzeyinin tespiti ile tedavinin seyrini izlemek kritiktir.KOATE-DVI'nın klinik etkisi, tedavinin etkinliğini değerlendirmede en önemli unsurdur. Belirlenenden daha fazla KOATE-DVI uygulanması daha tatminkar klinik sonuçların elde edilmesinde gerekebilir. Eğer hesaplanan doz, beklenilen Faktör VIII düzeyini elde etmede başarılı olmazsa veya eğer kanama, hesaplanan dozun uygulanması sonrası kontrol edilemezse, hastanın kan dolaşımındaki inhibitör varlığından şüphelenilir. Böyle bir durumda inhibitör varlığı kanıtlanmalı ve inhibitör düzeyleri uygun laboratuar testleriyle belirlenmelidir. İnhibitör mevcut olduğunda, antihemofilik faktör için doz gerekliliği oldukça değişkendir ve doz sadece klinik yanıtla tayin edilebilir. Düşük titre inhibitörlü bazı hastalar (10 Bethesda ünitesi) inhibitör titresindeki oluşan anamnestik artış olmaksızın faktör VIII ile başarılı olarak tedavi edilebilir. Tedaviye yönelik faktör VIII düzeyleri ve klinik yanıt yeterli yanıtı sağlamak için değerlendirilmelidir. Faktör IX kompleksi konsantreleri, antihemofilik faktör (domuz) veya anti- inhibitör koagülan kompleksi gibi alternatif tedavi ürünlerinin kullanımı, yüksek titre inhibitörlü hastalar için gerekebilir. Önceden tayin edilen plana göre sık olarak uygulanan Faktör VIII konsantresinin tekrarlanan dozları kullanılarak immün tolerans tedavisi, Faktör VIII inhibitörünün eradikasyonuna neden olabilir. En başarılı doz rejimleri, en az günde bir kere yüksek dozlarda Faktör VIII uygulanmasıyla yapılmıştır. Ancak, tek bir doz rejimi dünyada en etkili olarak kabul edilmemiştir. İmmün tolerans rejimlerinin idaresinde tecrübesi olan bir hemofili uzmanı ile konsültasyon önerilir. Dozun hesaplanması Faktör VIII düzeyindeki in vivo artışı (%), kg vücut ağırlığı için (IU/kg), gerekli dozun % 2 ile çarpılmasıyla tespit edilebilir. Hesaplama metodu, Abilgarrd ve arkadaşları (Abilgarrd ve et. al., çöktürülmüş glisin faktör VIII ile hemofili tedavisi, N Engl J Med 275(9): 47 1-5, 1966) tarafından verilen klinik bulgulara dayanmaktadır ve aşağıdaki örneklerde gösterilmiştir: Uygulanan IU x % 2/IU/kg Beklenilen % faktör VIII artışı =-------------------------------------- Vücut ağırlığı (kg) 1400 IU x % 2/ IU/ kg Örneğin: 70 kg ağırlığındaki bir yetişkin için: ---------------------------------=% 40 70 kg veya Vücut ağırlığı (kg) x istenilen %faktör VIII artışıİstenilen doz (I.U.)= ---------------------------------------------------------- % 2/ IU/ kg 15 kg x % 100 Örneğin: 15 kg'lık çocuk için:---------------------------= 750 IU gereklidir. % 2/ IU/kg Hemostazisi sağlamak için gereken doz aşağıdaki genel kılavuza göre kanama epizodlarının ciddiyeti ve tipine bağlıdır. Hafif Hemoraji Hafif yüzeysel veya erken hemorajiler Faktör VIII düzeyinde yaklaşık olarak in vivo % 20 artışa yol açan, kg başına 10 IU'luk tek bir doza cevap verebilir. İleride başka bir kanama olmadıkça tedavinin tekrarlanması gerekli değildir. Orta Derecede Hemoraji Daha ciddi kanama epizodları (Ör: kesin hemartroz, bilinen travma) için, Faktör VIII düzeyi her kg için yaklaşık olarak 15-25 IU uygulanmasıyla %30-% 50' ye artırılabilir. Eğer, başka bir tedavi gerekiyorsa, her 8-12 saatte bir her kg için 10-15 IU'luk tekrarlanan doz verilebilir.Ciddi Hemoraji Yaşamsal organları kapsayan hayatı tehdit edici kanamalar veya olası hemorajilerin görüldüğü hastalarda (Ör: Santral sinir sistemi, retrofarenjiyal ve retroperitonal boşluklar, iliopsoas kılıf) faktör VIII, hemostazis sağlamak için normalin % 80-% 100'üne artırılmalıdır. Bu, ilk rAHF [Antihemofilik faktör (İnsan), KOATE-DVI] dozunun kg başına 40-50 IU ve sürdürme dozunun her 8-12 saatte bir kg başına 20-25 IU olmasıyla hastaların çoğunda sağlanabilir. Majör cerrahi işlemler için faktör VIII düzeyleri yeterli yerine koyma tedavisini sağlamak için ameliyat öncesi ve sonrası dönemde kontrol edilmelidir. Ameliyat Majör cerrahi işlemler için, Faktör VIII düzeyi 50 IU/kg'lık ön-cerrahi dozunun verilmesiyle yaklaşık olarak % 100'e arttırılabilir. Faktör VIII düzeyi, hasta ameliyata girmeden önce beklenen düzeyin sağlanıp sağlanmadığı hususunda kontrol edilmelidir. Hemostatik düzeyleri sağlamak için, başlangıçta her 6-12 saatte bir ve iyileşme tamamlanıncaya kadar toplam 10-14 gün boyunca tekrarlanan infüzyonlar gerekebilir. Gereken faktör VIII yerine koyma tedavisinin şiddeti, uygulanan ameliyat sonrası rejim ve ameliyatın tipine bağlıdır. Minör cerrahi işlemler için, daha az şiddetteki tedavi yeterli hemostazı sağlayabilir. Profilaksi Ağır hemofili-A hastalarında (faktör VIII düzeyi< %1) tekrarlayan hedef eklem kanamalarında profilaktik amaçla kullanılabilir. Hastalarda bireysel olarak doğru olmayan teşhis, yetersiz doz, uygulama yolu ve biyolojik farklılıklar bu ürünün etkinliğini düşürebilir veya kullanımını takiben hastalık oluşturucu etkiye neden olabilir. Önemli olan noktalar; bu ürünün uygun şekilde saklanması, kullanım sırasında kullanma talimatları dikkatlice izlenmiş olması, ürünün reçetelendirilmesi öncesinde virüs geçiş riskinin dikkatlice tartılmış olması ve klinik yanıtın yetersiz olarak görüldüğü tedavinin başlangıcında plazma faktör VIII düzeylerinin ölçülmüş olmasıdır. Uygulama şekli:KOATE-DVI'nın her şişesi, etiketi üzerinde bildirilen internasyonel ünitede (IU) insan antihemofilik faktör içermektedir. Sulandırılmış ilaç direk enjeksiyon veya damla infüzyonuyla intravenöz olarak verilmelidir. Ürün, sulandırma sonrası 3 saat içinde sadece intravenöz yol ile uygulanır.Aşağıda verilen direktiflere göre ilaç sulandırılır. Uygulama hızı, hastalardaki kişisel yanıta göre adapte belirlenir. Ancak 5-10 dakika içinde ilk dozun uygulanması genellikle iyi tolere edilmektedir. Özel popülasyonlara ilişkin ek bilgilerBöbrek/Karaciğer yetmezliği:KOATE-DVI'nın böbrek ve karaciğer yetmezliği olan kişilerdeki güvenlilik ve etkililik incelenmemiştir. Yarar/zarar oranı dikkate alınarak açıkça ihtiyaç duyulduğu durumlarda kullanılmalıdır.Pediatrik popülasyon:Geriyatrik popülasyon:KOATE-DVI'nın geriyatrik popülasyondaki güvenlilik ve etkililik incelenmemiştir. Yarar/zarar oranı dikkate alınarak açıkça ihtiyaç duyulduğu durumlarda kullanılmalıdır.4.3. KontrendikasyonlarBileşenlerden herhangi birine karşı aşırı duyarlılık olduğu durumlarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleri:_
|
|||||||||||||||||||||||||||||||||
|
|
Zarflı virüs modelleri |
Zarflı olmayan virüs modelleri | |||||
|
|
HIV-1 |
BVDV |
PRV |
VSV |
Reo |
HAV |
PPV |
Model |
HIV- 1/2 |
HCV |
Büyük, zarflı DNA Virüsleri |
RNA Zarflı Virüsler |
Kimyasal ve fiziksel ajanlara rezis-tan HAV ile virüsler |
HAV |
B19 |
Globalazalmafaktörü |
> 9.4 |
> 10.3 |
> 9.3 |
> 10.9 |
9.4 |
> 4.5 |
3.7 |
KOATE-DVI, faktör VIII aktivitesini artırması yanında polisorbat 80 ile TNBP miktarlarının azaltılmasıyla bir dual etki gösteren jel geçirgenlik kromatografi basamağıyla saflaştırılmıştır.
Klinik güvenilirlik bilgileri
KOATE-DVI kullanılarak iki basamaklı bir klinik çalışma; öncesinde diğer plazma türevi antihemofilik faktör konsantreleri ile tedavi almış olan hemofili A'sı olan kişilerde uygulanmıştır. 1. basamakta, 19 bireyle yapılan farmakokinetik çalışmada istatistiksel kıyaslamalar KOATE-DVI'nın ısıtılmayan ürüne (KOATE-HP) biyoeşdeğer olduğunu göstermiştir. KOATE-DVI infüzyonundan 10 dakika sonra in vivo olarak yeniden kazanımın artışı
%%
1.82). KOATE-DVI'nın ortalama biyolojik yarı-ömrü 16.12 saattir (KOATE-HP: 16.13 saat). Çalışmanın ikinci basamağında, ortalama 54 gün boyunca (aralık: 24-93) evde tedavi ile 6 ay boyunca katılımcılar KOATE-DVI tedavisi almışlardır. Klinik çalışma veya klinik öncesi araştırmalarda inhibitör oluşumuna yönelik kanıtlar gözlenmemiştir. İkinci çalışma ise, immün yanıtı maksimize etmek için sadece, HIV negatif hastalar üzerinde uygulanmıştır. Hastalar, inhibitör gelişimi açısından gözlenirken, KOATE-DVI ile 50 maruziyet günü ve en az 6 aylık bir süre boyunca gözlenmiştir. Bu çalışmada, 17 adet HIV- negatif hemofili A hastasında, immünojenisite oluşumuna rastlanmamıştır.Etki mekanizması
KOATE-DVI, intravenöz yolla uygulanan, insan antihemofilik faktörünün (Faktör VIII) steril, stabil, arıtılmış ve kurutulmuş konsantresidir. Hemofili A hastalığı, plazma proteini pıhtılaşma faktörünün (Faktör VIII) koagülasyon aktivitesinin eksikliği ile karakterize herediter bir kanama hastalığıdır. Hastalık olan kişilerde hemoraji, spontan olarak veya sadece minör travma sonrası oluşabilir. Bu şekildeki bireylerde ameliyat, ilk olarak pıhtılaşma anormalliği düzeltilmeden mümkün değildir.
KOATE-DVI uygulaması, faktör VIII plazma düzeylerinde bir artışa neden olurken bu hastalardaki koagülasyon eksikliğini de geçici olarak düzeltebilir.
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
İnsan antihemofilik faktörünün infüzyonu sonrası, genellikle koagülasyon düzeyinde ani olarak bir artış takibinde ise aktivitede hızlı bir azalma vardır; daha sonrasında ise, aktivitede azalma daha yavaş hızda görülür. Erken hızlı faz ekstravasküler kompartman ile dengeye ulaşma zamanını temsil eder ve ikinci veya yavaş olan faz ise, degredasyon sonucudur ve infüzyon edilen insan antihemofilik faktörünün gerçek biyolojik yarılanma ömrünü yansıtır.
Dağılım:
Ürünün enjekte edilmesinden sonra, faktör VIII'in yaklaşık üçte ikisi ila dörtte üçü dolaşımda kalır. Plazmada ulaşılan faktör VIII aktivitesi önceden tahmin edilenin % 80 ile % 120'si arasında değişir. Plazma faktör VIII aktivitesi iki fazlı üstel fonksiyon eğrisi şeklinde azalır. Başlangıç fazında, damar içi ve diğer vücut sıvı kompartmanları arasında dağılım söz konusudur.
Biyotransformasyon:
Artımlı geri kazanımı yaklaşık olarak 0.020 ± 0.003 IU/ml/IU/kg v.a.'dır. Kg vücut ağırlığı başına 1 IU faktör VIII'nun intravenöz kullanımından sonra, faktör VIII aktivite seviyesi, yaklaşık % 2 dir.
Eliminasyon:
Başlangıç fazında, damar içi ve diğer vücut sıvı kompartmanları arasında dağılım söz konusu olup plazmadan eliminasyon yarı ömrü 3-6 saattir. Daha yavaş olan sonraki fazda ise yarı- ömür 8-20 saat arasında değişmekte olup, yarı ömür ortalama 12 saat civarındadır.
5.3. Klinik öncesi güvenlilik verileri:
Isı ile işlem görmüş KOATE-DVI'nın intravenöz uygulanmasını takiben tavşan ve sıçanlarda kardiyovasküler, solunum, hematolojik ve koagülasyon fonksiyonları değerlendirilmiştir. Materyal 8 ml/ dakika hızında 100 IU/ kg dozunda enjekte edilmiştir. Hayvanların anestezi düzeyleri ile ilişkili olabilecek hafif dalgalanmalar haricinde bloke edilmemiş ve kaptopril bloke edilmiş sıçanlarda kardiyovasküler değişiklikler gözlenmemiştir. İnfüzyon sonrası 5-60 dakikada tavşan ve sıçanlarda beyaz kan hücreleri ve trombositlerde hafif bir düşme gözlenmiş ve bunlar 120 ile 240. dakikalarda yeniden kazanılmıştır. Hafifçe etkilenen diğer hematolojik parametreler kırmızı kan hücreleri, hemoglobin, hemotokrit, trombosit ve fibrinojenlerdir ve tümü de normal aralık içinde kalmıştır. Koagülasyon parametrelerinde, aktive edilen kısmi tromboplastin zamanı (aPTT) ve protrombin zamanı hemen hemen sabit kalmıştır. Dört saatlik periyod boyunca toplam plazma proteinindeki dereceli düşme çalışmadaki kanama rejiminin bir etkisi olabilir. Solunum parametrelerinde hafif değişiklikler (kan pH, pCO2, pO2, HCO3 ve total CO2) oluşmuştur, ancak, bunlar fizyolojik önemde değildir. Test edilen diğer parametreler materyalin intravenöz infüzyonuyla etkilenmemiştir. KOATE-DVI'nın intravenöz uygulanmasını takiben kardiyovasküler, koagülasyon ve solunum fonksiyonlarında anlamlı etkiler olmamıştır. Bu sonuçlar, bu nedenle, 72 saat boyunca 80°C'de ısıtılan KOATE-DVI'nın çalışmada kullanılan her iki türde yan etkilere neden olmadığını göstermiştir.6. FARMASÖTİK ÖZELLİKLER:
6.1. Yardımcı maddelerin listesi
İnsan albumini Sodyum klorür L-histidin Kalsiyum klorür6.2. Geçimsizlikler
KOATE-DVI başka ürünlerle birlikte veya karıştırılarak kullanılmamalıdır.6.3. Raf ömrü
24 aydır.6.4. Saklamaya yönelik özel tedbirler
Sulandırıldıktan sonra 3 saat içerisinde kullanılmalıdır. Açıldıktan sonra kullanılmamış ürün atılmalıdır. Son kullanma tarihinden sonra kullanmayınız. 2-8°C arası sıcaklıklarda (buzdolabında), serin ve kuru yerlerde saklanmalıdır. Evde tedavi gibi durumlarda liyofilize toz 6 aya kadar oda sıcaklığında (25°C) Faktör VIII aktivitesinde bir kayıp olmadan saklanabilir. Seyreltici şişenin kırılmasına neden olacağından dondurmayınız. Donmuş ürünleri çözüp kullanmayınız.6.5. Ambalajın niteliği ve içeriği
5 mL, USP, Tip I renksiz camAyrıca enjeksiyonluk su, steril çift sonlu transfer iğnesi, steril filtre iğnesi ve steril uygulama seti beraberinde yer almaktadır.
Alüminyum etek-çerçeve ile mühürlenmiş fiskeyle çıkartılabilen plastik kapağın açılması aşamasında ikinci bir güvenlik olarak şişenin ağız kısmında plastik kapağı da çevreleyen bir emniyet bandrolü, üretici firma tarafından ambalaj sistemine eklenmiştir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tüm kullanılmayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir.Aseptik kurallara uyulmalıdır. İğneler veya şişelerin steril lastik tıpaları hiçbir şekilde steril olmayan yüzeylere temas etmemelidir. Kontamine olmuş tüm iğneler hemen atılmalı ve yeni bir iğne seti kullanılmalıdır.
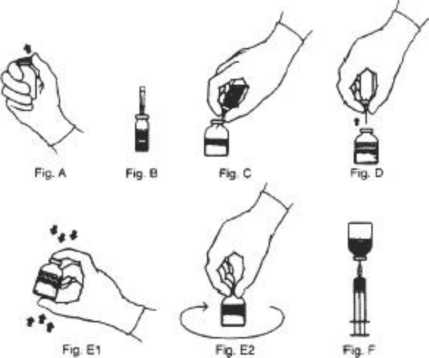
1. Tüm materyali kutudan çıkardıktan sonra sulandırıcıyı, oda sıcaklığı olan 25°C' ye gelene kadar bekletiniz.
2. Her flakonun ağzındaki plastik kapakları açtıktan sonra, kauçuk tıpalarını alkollü pamuk ile temizleyiniz. Temizleme sonrasında, lateks (kauçuk) tıpa ile herhangi bir nesneyi temas ettirmeyiniz.
3. Transfer iğnesinin kısa olan sonundaki plastik kılıfı dikkatlice çıkartınız. Açığa çıkan iğneyi, sulandırıcı şişenin kauçuk tıpasına batırınız.
4. Dikkatlice, transfer iğnesinin diğer sonundaki kılıfı kavrayınız ve çıkarmak için bükünüz.
5. Seyreltici flakonu ters çeviriniz ve 45°'lik açıda konsantreyi içeren flakon içine ilişik iğneyi yerleştiriniz. Bu, köpürmeyi en aza indirirken, konsantreyi içeren flakonun duvarına karşı seyrelticinin direkt akmasını sağlayacaktır. Vakum, seyrelticiyi konsantre flakonu içine çekecektir.
6. Seyreltici şişe ve transfer iğnesini çıkartınız.
7. Seyrelticinin eklenmesi sonrasında hemen, 10-15 saniye boyunca kuvvetlice karıştırınız, sonra tam olarak çözününceye kadar sürekli olarak çeviriniz. Biraz köpürme oluşacaktır ama aşırı köpük oluşumundan sakınınız. Uygulama öncesinde renk kaybı ve partikül maddeleri için flakon görsel olarak incelenmelidir.
8. Sulandırılmış KOATE-DVI flakonunun tepesini tekrar alkol ile siliniz ve kurumaya bırakınız.
9. Ambalajından filtre iğnesini çıkartıp, steril şırıngaya takınız. Filtre iğnesi içinden şırıngaya KOATE-DVI çözeltisini çekiniz.
10. Şırıngadan filtre iğnesini ayırınız ve uygulama için uygun enjeksiyon veya kelebek iğnesini yerleştiriniz. Filtre iğnesini kap içine atınız.
11. Eğer, aynı hastaya bir şişeden daha fazla KOATE-DVI uygulanacak ise, aynı enjektöre filte iğnesi aracılığıyla her iki şişenin içeriği de çekilebilir.
Konsantre flakon içinde eğer, vakum kaybolacak olursa, seyreltici flakondan steril suyu
uzaklaştırmak için steril şırınga ve iğne kullanınız; suyu konsantre şişesinin duvarına doğru
püskürtünüz.
7. RUHSAT SAHİBİ
Dem İlaç Sanayi ve Ticaret A.Ş.Dem Plaza İnönü Mah. Kayışdağı Cad. No:172 34755 Ataşehir-İstanbul Tel: 0 216 4284029 Faks: 0 216 4284069
8. RUHSAT NUMARASI:
899. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ:
İlk Ruhsat Tarihi: 05.03.2013 Ruhsat Yenileme Tarihi:10. KÜB'ÜN YENİLENME TARİHİ:
12İlaç Bilgileri
Koate-dvi 500 Iu/5 Ml Iv Enjeksiyon İçin Liyofili...
Etken Maddesi: Insan Koagülasyon Faktör Viii
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.