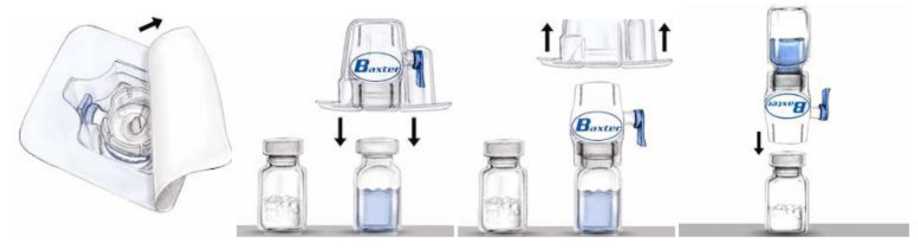
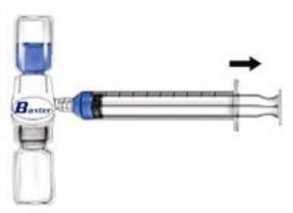
Advate 250 Iu Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADIADVATE 250 IU/5 mL IV Enjeksiyon İçin Liyofilize Toz İçeren Flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Oktokog alfa (İnsan koagülasyon faktör VIII): Her bir flakon 250 IU Oktokog alfa içermektedir.Yardımcı madde(ler): Her bir flakonda 0.45 mmol (ya da 10 mg) sodyum içerir.Yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTİK FORMEnjeksiyon çözeltisi için toz ve çözücü.Beyazdan, kirli beyaza değişen renkte gevrek toz.Sulandırıldıktan sonra, çözelti berrak, renksiz, yabancı partiküller bulundurmaz ve pH'sı 6.77.3 arasındadır.4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarHemofili A (konjenital faktör VIII eksikliği) hastalarında, kanamanın tedavisi ve profilaksisinde endikedir.ADVATE, farmakolojik olarak etkili miktarlarda von Willebrand Faktörü içermez ve bu nedenle von Willebrand hastalığında endike değildir.4.2 Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Uygulama hemofili tedavisinde deneyimli doktor gözetimi altında ve anafilaksi durumunda derhal temin edilmesi mümkün resüsitasyon olanaklarıyla başlatılmalıdır.Pozoloji ve yerine koyma tedavi süresi faktör VIII eksikliğinin ciddiyetine, kanama yerine, büyüklüğüne ve hastanın klinik durumuna bağlıdır.Kanadıkça tedaviFaktör VIII (FVIII) dozu, faktör VIII ürünleri için geçerli WHO standardına uygun olarak Uluslararası Birimlerde (IU) ifade edilmektedir. Plazmada Faktör VIII dozu yüzde (normal insan plazmasına göre) veya IU (plazmada faktör VIII için uluslararası standart) olarak ifade edilmektedir.Bir IU faktör VIII aktivitesi bir ml normal insan plazmasındaki faktör VIII miktarına karşılık gelmektedir. Gerekli faktör VIII dozunun hesaplaması bir kilo vücut ağırlığı başına 1 IU faktör VIII'ün plazma faktör VIII aktivitesini 2 IU/dL arttırdığı yönündeki gözlemsel bulguya dayanmaktadır. Doz aşağıdaki formüle göre belirlenir:Gerekli doz (IU) = vücut ağırlığı (kg) x istenen faktör VIII artışı (%) x 0.5Aşağıdaki hemorajik olayların gerçekleşmesi durumunda, faktör VIII aktivitesi ilgili dönemde belirtilen plazma aktivitesi seviyesinin (normal seviyenin %'si veya IU/dl) altına düşmemelidir. Aşağıda sunulan Tablo 1, kanama episodları ve cerrahide dozaj belirlenmesinde kullanılabilir:
Uygulama dozu ve sıklığı her hastada alınan klinik yanıta göre düzenlenmelidir. Belirli koşullarda (örn. düşük titre inhibitörü varlığı) formül kullanarak hesaplanandan daha büyük dozlara ihtiyaç duyulabilir.Tedavi esnasında uygulanacak dozun ve tekrarlanan enjeksiyonların sıklığının belirlenmesi için uygun plazma faktör VIII seviyelerinin tayin edilmesi önerilmektedir. Özellikle majör cerrahi müdahalelerde, plazma faktör VIII aktivite tayini ile yerine koyma tedavisinin tam takibi gerekmektedir. Farklı hastaların faktör VIII'e verdikleri yanıt yarılanma ömrü ve in vivo recovery seviyelerinin farklı olması yoluyla değişkenlik gösterebilir.ProfilaksiAğır Hemofili A hastalarında kanamalara karşı uzun süreli profilaksi için olağan dozlar 2-3 günlük aralıklarla vücut ağırlığı (kg) başına 20-40 IU faktör VIII'dir. 6 yaşından küçük hastalarda, haftada 3-4 defa, vücut ağırlığı (kg) başına 20-50 IU faktör VIII önerilmektedir.Hastalar faktör VIII inhibitörlerinin gelişimi açısından takip edilmelidir. Beklenen faktör VIII plazma aktivitesi seviyelerine ulaşılamazsa veya kanama uygun dozla kontrol edilemiyorsa, faktör VIII inhibitörünün mevcut olup olmadığını belirlemek için testler yapılmalıdır. Yüksek seviyelerde inhibitör bulunan hastalarda faktör VIII yerine koyma tedavisi etkili olmayabilir ve diğer tedavi seçenekleri düşünülmelidir. Söz konusu hastaların yönetimi hemofili hastalarının bakımında deneyimli doktorlar tarafından sağlanmalıdır (bkz. bölüm 4.4).Uygulama şekli:İntravenöz yoldan uygulanır. Sağlık hizmetleri profesyoneli olmayan bir kişi tarafından uygulanması için uygun eğitimin alınması gerekmektedir.Uygulama hızı dakikada 10 mL'yi geçmeyecek şekilde hastanın rahat edeceği bir hızda olmalıdır.Hastalara faydalı olması amacıyla her ADVATE uygulamasında, ürünün adı ve parti numarası kaydedilmelidir.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/karaciğer yetmezliği: Özel kullanımı yoktur.Pediyatrik popülasyon: ADVATE'in çocuklarda uygulaması (intravenöz yoldan) yetişkinlerdeki uygulamadan farklı değildir. Bir santral venöz erişim aleti (SVEA), FVIII ürünlerinin sık infüzyonuna olanak vermek için gerekli olabilir.Geriyatrik popülasyon: Özel kullanımı yoktur.4.3 KontrendikasyonlarADVATE, ürünün etkin maddesine, yardımcı maddelere ya da fare veya hamster proteinlerine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.4.4 Özel kullanım uyarıları ve önlemleriAşırı duyarlılık reaksiyonlarıHerhangi bir intravenöz protein ürününde olduğu gibi, alerjik tipte aşırı duyarlılık reaksiyonları mümkündür. ADVATE ile baş dönmesi, parestezi, kaşıntı, kızarma, yüzde şişme, ürtiker ve kaşıntı ile ortaya çıkan anafilaksi de dahil olmak üzere alerjik tipte aşırı duyarlılık reaksiyonları rapor edilmiştir. Ürün fare ve hamster proteini izleri içermektedir. Hastalara kurdeşen, kaşıntı, genel ürtiker, anjiyoödem, hipotansiyon (örn. baş dönmesi veya senkop), şok ve solunum sistemi ile ilgili akut durumlar (örn. göğüste sıkışma hissi, hırıltı) gibi ani gelişen aşırı duyarlılık reaksiyonlarının belirtileri hakkında bilgi verilmelidir. Bu semptomların görülmesi halinde ürün kullanımını derhal kesmeleri ve doktora başvurmaları önerilmelidir. Anafilaktik şok durumunda şok tedavisine yönelik mevcut tıbbi standartlar uygulanmalıdır.İnhibitör GelişimiFaktör VIII'e karşı antikorların (inhibitörler) oluşumu, hemofili A hastalarının yönetiminde bilinen bir komplikasyondur. Bu inhibitörler modifiye Bethesda testi kullanılarak bir mL plazmada Bethesda Ünitesi (BU) olarak ölçülen, faktör VIII' e karşı gelişen genellikle IgG tipi antikorlardır. Faktör VlII'e karşı inhibitör gelişen hastalarda, yetersiz klinik yanıt ortaya çıkabilir. Bu gibi durumlarda, özel bir hemofili merkeziyle temasa geçilmesi önerilmektedir. İnhibitör gelişim riski, faktör VIII maruziyetinin süresi (tedavinin ilk 20 günü içinde risk en yüksektir) ile diğer genetik ve çevresel faktörlerle ilişkilidir. Maruziyetin ilk 100 gününden sonra inhibitör gelişimi nadiren görülmektedir. İnhibitör öyküsü bulunan ve 100 günden uzun maruziyet süresi bulunan daha önceden tedavi almış (PTP) hastalarda bir faktör VIII ürününden diğerine geçiş sonrasında nükseden inhibitör (düşük titre) vakaları gözlemlenmiştir. Koagülasyon faktörü VIII ile tedavi edilen hastalar uygun klinik gözlemler ve laboratuar testleriyle inhibitör gelişimi açısından dikkatle takip edilmelidir.Kateter ile ilişkili komplikasyonlarSantral venöz erişim aleti (SVEA) gerekirse, lokal enfeksiyonlar, bakteriyemi ve kateter bölgesi trombosisi de dahil olmak üzere SVEA ile ilişkili komplikasyon riskinin göz önünde bulundurulması gerekmektedir.Yardımcı maddeler ile ilgili konularBu tıbbi ürün sulandırma sonrasında flakon başına 0.45 mmol sodyum (10 mg) içermektedir. Kontrollü sodyum diyetindeki hastalarda dikkate alınmalıdır.4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriADVATE ile diğer tıbbi ürünlerin etkileşimi olup olmadığı bilinmemektedir.4.6 Gebelik ve Laktasyon Genel Tavsiye:Gebelik Kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Bilinen bir etkileşimi yoktur.Gebelik DönemiADVATE'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.ADVATE gerekli olmadıkça (başka bir tedavi seçeneği yoksa) gebelik döneminde kullanılmamalıdır.Laktasyon DönemiBu ilacın anne sütüne geçip geçmediği bilinmemektedir. Birçok ilacın anne sütüne geçtiği bilindiğinden emzirmekte olan annelerde ADVATE dikkatle kullanılmalıdır.Üreme yeteneği/FertiliteADVATE'in insanlarda üreme yeteneği / fertilite üzerindeki etkisini araştıran bir çalışma bulunmamaktadır.4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine bilinen bir etkisi bulunmamaktadır.4.8 İstenmeyen etkilerGüvenlilikprofilinin özetiADVATE ile yapılan klinik çalışmalar sırasında, 234 hastadan 27'sinde toplam 56 advers ilaç reaksiyonu (ADR) rapor edilmiştir. Hastaların en büyük çoğunluğunda meydana gelen advers olaylar, hepsi yüksek inhibitör gelişim riskine sahip daha önceden tedavi almamış hasta olmak üzere 5 hastada faktör VIII'e karşı inhibitör gelişimi, , baş ağrısı (5 hasta), ateş ve baş dönmesi (3 hastanın her birinde) olmuştur. 56 ADR'den hiçbiri yenidoğanlarda meydana gelmemiştir. Advers olayların 16'sı 13/32 bebeklerde, 7'si 4/56 çocuklarda, 8'i 4/31 gençlerde ve 25'i 14/94 erişkinlerde rapor edilmiştir.1Advers etkilerin görülme sıklığı, aşağıdaki kriterler kullanılarak değerlendirilmiştir: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).aEnfeksiyon ve enfestasyonlarYaygın olmayan: İnfluenza, larenjit, lenfanjitBağışıklık sistemi hastalıklarıBilinmiyor: Anafilaktik reaksiyonlar, aşırı duyarlılıkcSinir sistemi hastalıklarıYaygın: Baş ağrısı, baş dönmesi/sersemlik haliYaygın olmayan: Hafıza bozukluğu, tremor, migren, tat alma duyusunda bozulmaGöz hastalıklarıYaygın olmayan: Gözde enflamasyonVasküler hastalıklarıYaygın olmayan: Hematom, ateş basması, soluklukSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Nefes darlığıGastrointestinal hastalıklarıYaygın olmayan: İshal, üst karın ağrısı, bulantı, kusmaDeri ve deri altı doku hastalıklarıYaygın olmayan: Kaşıntı, döküntü, hiper hidroz, bez dermatitiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYüksek ateşYaygın:Yaygın olmayan: Bilinmiyor:Periferik ödem, göğüs ağrısı, üşüme, anormal hissetme Yorgunluk, halsizlikAraştırmalarYaygın: Anti-faktör VIII antikoru pozitifliğicYaygın olmayan: Alanin aminotransferaz yükselmesi, koagülasyon faktör VIIIseviyesinde azalmabYaralanma ve zehirlenmeYaygın olmayan: Prosedür sonrası komplikasyon, prosedür sonrası hemoraji,prosedür bölgesinde reaksiyonabcSeçilmiş advers reaksiyonların açıklaması İnhibitör GelişimiADVATE'in immünojenesitesi daha önce tedavi almış hastalarda (PTP) değerlendirilmiştir. >150 gün boyunca faktör VIII konsantrelerine maruz kalmış pediyatrik ve erişkin 145 ağır ve orta hemofili A (FVIII <%2), hastada2Devam etmekte olan bir klinik çalışmada daha önce tedavi almamış hastalarda, ADVATE uygulanan 25 hastadan 5'inde (%20) faktör VIII'e karşı inhibitör gelişmiştir. Bunlardan 4'ü yüksek titreli (> 5 BU) ve 1'i düşük titreli (< 5 BU) olarak bulunmuştur. Bugüne dek tespit edilen FVIII inhibitörlerinin sıklığı beklenen ve daha önce gözlemlenen aralıktadır.Üretim süreci artıklarına özel ADR'lerHastanın kontamine eden eser miktarda proteine verdiği bağışıklık yanıtı bu proteinlere karşı antikor titreleri, laboratuar parametreleri ve rapor edilen advers olaylar ile analiz edilmiştir.Çin hamsteri over (CHO) hücre proteini antikoru açısından değerlendirilen, tedavideki 182 hasta arasından 3'ünde lineer regresyon analizi ile titrelerde istatistiki açıdan anlamlı bir yükselme eğilimi görülmüş, 4'ünde ise sürekli tepe noktaları veya anlık yükselmeler görülmüştür. Bir hastada anti-CHO proteini antikor seviyesinde hem istatistiksel açıdan anlamlı hem de kalıcı bir yükselme görülmüştür, ancak alerjik veya aşırı duyarlılık yanıtına dair diğer semptomlar veya bulgular saptanmamıştır. Murin IgG antikoru açısından değerlendirilen, tedavideki 182 hasta arasından 10'unda lineer regresyon analizi ile istatistiki açıdan anlamlı bir yükselme eğilimi görülmüş, 2'sinde ise kalıcı veya anlık yükselmeler görülmüştür. Bir hastada anti-murin IgG antikor seviyesinde hem istatistiksel açıdan anlamlı hem de kalıcı bir yükselme görülmüştür. Bu hastalardan dördünde çalışma ürürüne çok sayıda maruziyet arasında, farklı ürtiker, kaşıntı, döküntü ve hafifçe artmış eozinofil sayıları rapor edilmiştir.Aşırı duyarlılıkAnafilaksiyi de içeren alerjik tipte reaksiyonlar baş dönmesi, parestezi, kaşıntı, kızarma, yüzde şişlik, ürtiker ve döküntü ile ortaya çıkmıştır.Pediyatrik popülasyonDaha önce tedavi almamış pediyatrik hastalarda (PUP'lar) gerçekleştirilen klinik çalışmalarda inhibitör gelişimi ve kateterle ilgili komplikasyonlar dışında, advers olaylarda yaşa özgü farklılıklar gözlemlenmemiştir.4.9 Doz aşımı ve tedavisiRekombinant koagülan faktör VIII ile aşırı doz semptomları rapor edilmemiştir.İnhibitörlü hastalarda İmmün Tolerans İndüksiyonu (ITI) hakkında veriler toplanmıştır. PUP çalışması 060103'nın bir alt çalışması kapsamında, 11 hastadaki ITI tedavileri bildirilmiştir. ITI tedavisi gören (çalışma 060703) 30 gönüllünün dosyaları retrospektif olarak incelenmiştir ve verilerin toplanmasına devam edilmektedir.5.2. Farmakokinetik ÖzelliklerADVATE'in gerçekleştirilen tüm farmakokinetik çalışmaları daha önce tedavi görmüş ağır ve orta hemofili A hastalarda gerçekleştirilmiştir (başlangı faktör VIII seviyesi <%2). Plazma örneklerinin analizi tek aşamalı pıhtılaşma analizi kullanılarak merkezi bir laboratuarda gerçekleştirilmiştir. Daha önce tedavi görmüş 10 yaş ve üzeri 100 hastada yapılan bir çapraz geçişli çalışmadan elde edilen farmakokinetik parametreler aşağıda Tablo 3'te listelenmektedir.
*Geometrik ortalama6 yaşından küçük 53 pediyatrik hastada ADVATE'in tek doz uygulamasından elde edilen veriler aşağıdaki tabloda sunulmaktadır:
*Geometrik ortalamaDüzeltilmiş recovery ve terminal yarılanma ömrü (t/) küçük çocuklarda (6 yaşından küçük), erişkinlere kıyasla yaklaşık %20 daha düşüktür, bu durum küçük yaştaki hastalarda vücut ağırlığına göre plazma hacminin daha yüksek olmasından kaynaklanıyor olabilir.Daha önce tedavi almamış hastalarda ADVATE farmakokinetik verileri günümüzde mevcut değildir.Emilim:Bebek, çocuk, adölesan ve erişkinlerdeki düzeltilmiş in vivo elde edilen ilaç düzeyleri, EAA ve Vss değerlerinin bir özeti için Tablo 3 ve 4'e bakınız.Dağılım:ADVATE hemofili hastalarına uygulandığında, hastanın dolaşımındaki endojen von Willebrand Faktörüne bağlanır. Faktör VIII / von Willebrand Faktör kompleksi esas olarak intravasküler olarak dağılıma uğrar.Biyotransformasyon:Uygulanabilir değil.Eliminasyon:Günümüzde Faktör VIII klerensinin, aralarında düşük dansiteli lipoprotein reseptör-ilişkili protein (LPR) ve heparin sülfat proteoglikanlarının (HSPGs) bulunduğu vasküler reseptörlerce, tam olarak bilinmeyen bazı mekanizmalarca yönetildiğine inanılmaktadır.Doğrusallık / doğrusal olmayan durum:Bilinmemektedir.Hastalardaki karakteristik özellikler:Pediyatrik hastalar: Bu popülasyonda ADVATE'in güvenliliği ve hemostatik etkililiği, erişkinlerdekine benzer. Çocuklarda düzeltilmiş in vivo elde edilen miktarları ve yarı ömürleri, erişkinlerdekinden %20 kadar düşük bulunmuştur.Farmakokinetik/farmakodinamik ilişki(ler):Bilinmemektedir.5.3 Klinik öncesi güvenlilik verileriGüvenlilik farmakolojisi, akut toksikoloji, tekrarlayan doz toksisitesi, lokal toksisite ve genotoksisite konusunda yapılan çalışmalara dayanarak, klinik dışı veriler insana yönelik özel bir risk olmadığını göstermektedir.- Kalsiyum klorür- Trometamol [Tris(hidroksimetil)]- Polisorbat 80- Glutatyon (indirgenmiş)Çözücü- Sterilize enjeksiyonluk su6.2 GeçimsizliklerADVATE ile gerçekleştirilen bir geçimsizlik çalışması bulunmamaktadır. Bu nedenle diğer ilaçlarla ve çözücülerle karıştırılmamalıdır.6.3 Raf ömrüAçılmamış kuru toz flakon24 ay.
|
İlaç BilgileriAdvate 250 IuEtken Maddesi: Oktokog Alfa Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.