Zytiga 250 mg Tablet Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Hormonal Tedavi İlaçları » Hormon Antagonistleri » Diğer Hormon Antagonistleri ve İlgili Maddeler » Abirateron KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADIZYTIGA 250 mg tablet2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler:Her bir tablet 250 mg abirateron asetat içerir.Yardımcı maddeler:Her bir tablet 198.65 mg laktoz monohidrat, 42.9 mg kroskarmelloz sodyum ve 28.6 mg sodyum lauril sülfat içerir.Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMBeyaz - gri beyaz renkli, bir yüzünde AA250 baskılı oval tabletler.4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarZYTIGA, hormonal tedaviye ve sonrasında dosetaksel temelli kemoterapiyle progresyonun PSA ve radyolojik görüntüleme yöntemleriyle gösterildiği, ECOG performans skorunun(0-1) olduğu ve testosteron düzeyinin kastrasyon seviyesinde olduğu gösterilmiş metastatik prostat kanserli hastalarda prednizolon ile kombine kullanımında endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji, uygulama sıklığı ve süresi:ZYTIGA'nın günde tek seferde 1000 mg (dört adet 250 mg tablet) olarak, aç karnına yani yemekten en az iki saat önce ve ilacın alınmasından sonra en az bir saat hiçbir şey yenmemelidir. Tabletler bir bütün olarak suyla yutulmalı, çiğnenmemeli, bölünmemeli veya ezilmemelidir. ZYTIGA'nın yiyeceklerle birlikte alınması ilaca sistemik maruziyeti arttırır(bkz.Bölüm 4.5 ve 5.2).ZYTIGA düşük doz prednizon veya prednizolonla birlikte kullanılır. Önerilen prednizon veya prednizolon dozu günde 10 mg'dır. ZYTIGA ile tedaviye başlamadan önce serum transaminaz ve bilirubin düzeyleri ölçülmelidir; tedavinin ilk üç ayında iki haftada bir, daha sonra ayda bir bu testler tekrarlanmalıdır. Hastalar kan basıncı, serum potasyumu ve sıvı retansiyonu açısından aylık olarak izlenmelidir (bkz.Bölüm 4.4).ZYTIGA, prednizon veya prednizolonun günlük dozunun alınmasının unutulması durumunda, tedaviye ertesi gün olağan günlük dozla devam edilmelidir. HepatotoksisiteZYTIGA tedavisi sırasında hepatotoksisite gelişen hastalarda (alanin aminotransferaz [ALT] düzeyleri normal kabul edilen üst sınırın 5 katından fazla yükselen hastalar) ise tedavi hemen durdurulmalıdır (bkz.Bölüm 4.4). Karaciğer fonksiyon testleri tedaviye başlamadan önceki başlangıç değerlerine döndükten sonra tedaviye azaltılmış dozla günde 500 mg (iki tablet) olarak başlanabilir. Tedaviye yeniden başlanan bu hastaların serum transaminaz düzeyleri, tedavinin ilk üç ayında iki haftada bir, daha sonra ise ayda bir ölçülmelidir. Azaltılmış 500 mg'lık günlük dozla da tekrar hepatotoksisite gelişmesi durumunda, tedavi tümüyle kesilmelidir.Tedavinin herhangi bir döneminde ağır hepatotoksisite gelişmesi durumunda (ALT düzeylerinin normal kabul edilen üst sınırın 20 katı kadar yükselmesi) tedaviye hemen son verilmeli ve ZYTIGA ile yeniden tedavi uygulanmamalıdır. Uygulama şekli:ZYTIGA, yemekten en az iki saat sonra alınmalı ve ilacın alınmasından sonra en az bir saat boyunca hiçbir şey yenilmemelidir. Tabletler bütün olarak suyla yutulmalıdır.Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlamasına gerek yoktur(bkz.(bkz.Bölüm 4.4).Karaciğer yetmezliği:Önceden hafif derecede karaciğer yetmezliği olan hastalarda (Child-Pugh sınıf A) doz ayarlamasına gerek yoktur.Orta şiddette karaciğer yetmezliğinin (Child-Pugh sınıf B), abirateron asetatın oral yoldan 1,000 mg dozunda alınması sonrası abiraterona sistemik maruziyeti yaklaşık dört kat arttırdığı gösterilmiştir (bkz.Bölüm 5.2).Orta şiddette veya ağır karaciğer yetmezliği (Child-Pugh sınıf B veya C) olan hastalarda abirateron asetatın çoklu dozlarının klinik güvenlilik ve etkililiğini gösteren bir veri bulunmamaktadır. Bu tür hastalarda doz ayarlaması öngörülemez ve ZYTIGA kullanımından kaçınılmalıdır. Pediyatrik popülasyon:Pediyatrik popülasyonda prostat kanseri görülmediğinden ZYTIGA'nın pediyatrik hastalarda kullanımı bulunmamaktadır.4.3. Kontrendikasyonlar- Abirateron asetata veya ürünün bileşimindeki herhangi bir yardımcı maddeye karşı bilinen aşırı duyarlılığı olan hastalar (yardımcı maddeler içinbkz.Bölüm 6.1).- Gebe olan ya da gebe olma olasılığı bulunan kadınlar (bkz.Bölüm 4.6).4.4. Özel kullanım uyarıları ve önlemleriM^-neralokortikoid fazlalığına bağlı hipertansiyon, hipopotasemi ve sıvı retansi^^^uZYTIGA ile yürütülen faz 3 çalışmada kontrolsüz hipertansiyonu olan, miyokard enfarktüsüyle ortaya çıkmış klinik açıdan anlamlı kalp hastalığı olan, son 6 ayda arteriyel trombotik olay geçirmiş olan, ağır ya da unstabil anjinası olan, New York Kalp Cemiyeti Sınıf III ve IV kalp hastalığı olan ya da kardiyak ejeksiyon fraksiyon ölçümü %50'den az olan hastalar çalışmaya dahil edilmemiştir. ZYTIGA kardiyovasküler hastalık anamnezi olan hastalarda dikkatle kullanılmalıdır. Sol ventrikül ejeksiyon fraksiyonu %50'den düşük olan ya da NewYork Kalp Cemiyeti (NYHA) sınıf III veya IV kalp yetmezliği olan hastalarda ZYTIGA'nın güvenliliği gösterilememiştir. ZYTIGA ile tedaviye başlamadan önce, hastada varsa hipertansiyon kontrol altına alınmalı ve hipopotasemi düzeltilmelidir. ZYTIGA, CYP17 inhibisyonu sonucunda artan mineralokortikoid düzeylerinin bir sonucu olarak (bkz.(bkz.Bölüm 4.8). Birlikte bir kortikosteroid uygulanması, adrenokortikotropin hormon (ACTH) salgılanmasını baskılayarak bu advers etkilerin görülme sıklığı ve şiddetinde bir azalma sağlar. Kan basıncının yükselmesine, hipopotasemi (örneğin kardiyak glikozidleri kullanan hastalar) veya sıvı retansiyonuna (örneğin kalp yetmezliği olan hastalar), ağır veya unstabil anjina pektorise, yakın zamanda miyokard enfarktüsü veya ventriküler aritmiye ve ağır böbrek yetmezliğine bağlı olarak altta yatan tıbbi durumunun bozulabileceği hastalar tedavi edilirken dikkatli olunmalıdır. Bu tür hastalar kan basıncı, serum potasyum düzeyleri ve sıvı retansiyonu açısından tedaviye başlamadan önce ve tedavi sırasında en az ayda bir izlenmelidir.HepatotoksisiteKontrollü klinik çalışmalarda karaciğer enzimlerinde ilacın kesilmesine ya da doz ayarlanmasına neden olacak şekilde belirgin artışlar bildirilmiştir (bkz.(bkz.Bölüm 4.2).Tedavinin herhangi bir döneminde ağır hepatotoksisite gelişmesi durumunda (ALT düzeylerinin normal kabul edilen üst sınırın 20 katı kadar yükselmesi) ZYTIGA uygulamasına hemen son verilerek bir daha yeniden ZYTIGA ile tedavi uygulanmamalıdır. Klinik çalışmalara aktif veya semptomatik viral hepatiti olan hastalar dahil edilmemiştir; bu nedenle ZYTIGA'nın bu popülasyonda kullanımını destekleyen bir veri bulunmamaktadır. Kortikosteroid geri çekilmesi ve stresli durumların karşılanmasıPrednizon veya prednizolon tedavisinin kesilmesi durumunda dikkatli olunması ve adrenokortikal yetmezlik gelişmemesi için hastaların izlenmesi önerilir. Kortikosteroidler kesildikten sonra ZYTIGA tedavisine devam edilecekse, hastalar mineralokortikoid fazlalığına bağlı semptomlar açısından izlenmelidir (bkz.Mineralokortikoid fazlalığına bağlı hipertansiyon, hipopotasemi ve sıvı retansiyonu"başlığı).Prednizon veya prednizolon tedavisi almakta olan hastalarda olağan dışı stresli bir durumda, bu stresli durum öncesinde, esnasında ve sonrasında kortikosteroidlerin dozunun arttırılması gerekebilir. Kemik dansitesiİleri evre metastatik prostat kanseri (kastrasyona dirençli prostat kanseri) olan erkeklerde kemik dansitesinde azalma görülebilir. ZYTIGA'nın bir glukokortikoid ile birlikte kullanımı bu etkiyi arttırabilir. Daha önceden ketokonazol kullanımıDaha önceden ketokonazol kullanmış prostat kanserli hastalarda daha düşük yanıt oranları beklenebilir. Yardımcı maddelere karşı intoleransBu tıbbi ürün laktoz ihtiva eder. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorbsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. Bu tıbbi ürünün dört tabletlik her bir dozu 1 mmol'den (veya 27.2 mg'dan) fazla sodyum ihtiva eder. Bu durum kontrollü sodyum diyetinde olan hastalarda göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriZYTIGA'nın yiyeceklerle birlikte alınması abirateron asetatın emilimini anlamlı derecede arttırır. ZYTIGA'nın yiyeceklerle birlikte alınması halindeki etkililik ve güvenliliği gösterilmemiştir. ZYTIGA yiyeceklerle birlikte alınmamalıdır(bkz.Bölüm 4.2 ve 5.2).Abirateron asetatın (artı prednizon) tek dozda alınan CYP2D6 substratı dekstrometorfan üzerindeki etkisini belirlemek için yapılan bir çalışmada, dekstrometorfanın sistemik maruziyetinin (AUC) yaklaşık 2.9 kat arttığı bildirilmiştir. Dekstrometorfanın aktif metaboliti dekstrorfanın AUC24'ü ise yaklaşık %33 artmıştır. ZYTIGA, özellikle dar terapötik indeksi olanlar olmak üzere CYP2D6 tarafından aktive veya metabolize edilen ilaçlarla birlikte uygulandığında dikkatli olunmalıdır. Birlikte uygulamada CYP2D6 tarafından metabolize edilen terapötik indeksi dar olan ilaçların dozunun azaltılması düşünülebilir. CYP2D6 tarafından metabolize edilen ilaçlara örnek olarak metoprolol, propranolol, desipramin, venlafaksin, haloperidol, risperidon, propafenon, flekanid, kodein, oksikodon ve tramadol gösterilebilir (kodein, oksikodon ve tramadolun aktif analjezik metabolitlerinin oluşabilmesi için CYP2D6 gereklidir). İn vitroverilere göre, ZYTIGA, hepatik ilaç metabolize eden CYP2C8 enziminin inhibitörüdür. CYP2C8 tarafından metabolize edilen tıbbi ürünler içerisinde paklitaksel ve repaglinid bulunmaktadır. CYP2C8 substratı olan ilaçlarla ZYTIGA kullanımına ilişkin hiçbir klinik veri bulunmamaktadır.vitroin vivoolarak değerlendirilmemiştir. Tedavi sırasında CYP3A4 enzimini güçlü bir şekilde inhibe eden veya stimüle eden ilaçların kullanımından kaçınılmalı veya dikkatle kullanılmalıdır.Özel popülasyonlara ilişkin ek bilgilerHerhangi bir etkileşim çalışması yapılmamıştır.Pediyatrik popülasyon:Herhangi bir etkileşim çalışması yapılmamıştır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: XZYTIGA kadınlarda kullanım için bir ilaç değildir. ZYTIGA gebe olan ya da gebe olma olasılığı bulunan kadınlarda kontrendikedir (bkz.Bölüm 4.3).Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (kontrasepsiyon)Abirateron asetatın gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açtığından şüphelenilmektedir. ZYTIGA gebelik döneminde kontrendikedir.Gebelikte ZYTIGA kullanımına ilişkin klinik bir veri mevcut değildir ve ZYTIGA çocuk doğurma potansiyeli bulunan kadınlarda kullanım için bir ilaç değildir. C^17 inhibitörü bir ilacın maternal kullanımı, fetüsün gelişimini etkileyebilecek şekilde hormon düzeylerinde değişikliklere neden olabilir (bkz.Bölüm 5.3).ZYTIGA ya da metabolitlerinin semen ile salgılanıp salgılanmadığı bilinmemektedir. Hastanın gebe bir kadınla cinsel ilişkiye girmesi durumunda kondom kullanması gerekir. Hastanın çocuk doğurma potansiyeli bulunan bir kadınla cinsel ilişkiye girmesi durumunda etkili bir doğum kontrol yöntemine ek olarak kondom kullanması gerekir. Gebelik dönemiGebelikte ZYTIGA kullanımına ilişkin klinik bir veri mevcut değildir. ZYTIGA gebelik döneminde kontrendikedir(bkz.Bölüm 4.3).ZYTIGA kadınlarda kullanım için bir ilaç değildir. Laktasyon dönemiAbirateronun insan ya da hayvan sütü ile atıldığına ilişkin yetersiz bilgi mevcuttur. Abirateronun süt ile atılmasına yönelik fizikokimyasal ve eldeki farmakodinamik/toksikolojik veriler nedeniyle memedeki cocuk açısından bir risk olduğu göz ardı edilemez. ZYTIGA, emzirme döneminde kullanılmamalıdır.ZYTIGA kadınlarda kullanım için bir ilaç değildir. Üreme yeteneği / FertiliteAbirateron asetat ile üreme toksikolojisi çalışmaları gerçekleştirilmemiştir. Fertilite ile ilgili veri bulunmamaktadır.4.7. Araç ve makine kullanımı üzerindeki etkilerZYTIGA'nın araç ve makine kullanımı yeteneği üzerinde etkisi yoktur ya da ihmal edilebilir düzeydedir.4.8. İstenmeyen etkilerZYTIGA kullanımı ile en yaygın olarak görülen advers etkiler periferik ödem, hipopotasemi, hipertansiyon ve idrar yolu enfeksiyonudur.ZYTIGA etki mekanizmasının farmakodinamik sonucu olarak hipertansiyon, hipopotasemi ve sıvı retansiyonuna neden olur. Bir faz 3 çalışmasında ZYTIGA alanlarda plasebo uygulanan hastalara oranla görülmesi beklenen mineralokortikoid advers etkiler daha fazla görülmüştür. Çalışmada hipopotasemi ZYTIGA alanlarda %17 iken plasebo uygulananlarda %8, hipertansiyon ZYTIGA alanlarda %9 iken plasebo uygulananlarda %7 ve sıvı retansiyonu (periferik ödem) ZYTIGA alanlarda %25 iken plasebo uygulananlarda %17 olarak bildirilmiştir. ZYTIGA alanların %4'ünde evre 3 ve 4 hipopotasemi (CTCAE, versiyon 3.0 sınıflamasına göre), %1'inde ise evre 3 ve 4 hipertansiyon (CTCAE, versiyon 3.0 sınıflamasına göre) bildirilmiştir. Tıbbi tedaviyle mineralokortikoid etkiler genellikle başarıyla tedavi edilebilmiştir. Kortikosteroidlerin birlikte kullanılması bu advers ilaç reaksiyonlarının sıklık ve şiddetini azaltır ( bkz.Bölüm 4.4).Tablolaştırılmış özet advers etkilerBir luteinizan hormon salıverici hormon (LHRH) agonistinin kullanılmakta olduğu ya da daha önceden orşiektomi tedavisi uygulanmış ileri evre metastatik prostat kanserli hastalarda ZYTIGA, düşük doz prednizon veya prednizolon (günlük 10 mg) ile kombine olarak günde 1,000 mg dozunda kullanılmıştır. Hastalarda daha önceden birisi taksan içeren en az iki kemoterapi rejimine yanıt alınamamıştı ya da hastalar bu rejimleri tolere edememişti. ZYTIGA ile gerçekleştirilen klinik çalışmalarda rapor edilen advers etkiler aşağıdaki sıklık derecelerine göre listelenmiştir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1,000 ila <1/100); seyrek (>1/10,000 ila <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). ZYTIGA ile gerçekleştirilen klinik çalışmalarda belirlenen advers ilaç reaksiyonları Enfeksiyonlar ve enfestasyonlarÇok yaygın: İdrar yolu enfeksiyonuEndokrin hastalıklarıYaygın olmayan: Adrenal yetmezlikMetabolizma ve beslenme hastalıklarıÇok yaygın: Hipopotasemi Yaygın: HipertrigliseridemiKardiyak hastalıklarıYaygın: Kalp yetmezliği*, anjina pektoris, aritmi, atrial fibrilasyon, taşikardiVasküler hastalıklarıÇok yaygın: HipertansiyonHepato-bilier hastalıklarıYaygın: Alanin aminotransferaz düzeylerinde yükselmeGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok yaygın: Periferik ödemYaralanma, zehirlenme ve prosedürel komplikasyonlarYaygın : Kırıklar*** Kalp yetmezliği aynı zamanda konjestif kalp yetmezliği, sol ventriküler disfonksiyon ve ejeksiyon fraksiyonunda azalmayı da içermektedir.**Kırıklar patolojik kırık dışında tüm kırıkları içerir.ZYTIGA ile tedavi gören hastalarda aşağıdaki evre 3 advers ilaç reaksiyonları (CTCAE, versiyon 3.0 sınıflamasına göre) oluşmuştur: %3 hipopotasemi; %2 idrar yolu enfeksiyonu;%1 periferik ödem, alanin aminotransferaz düzeylerinde yükselme, hipertansiyon, kalp yetmezliği ve atrial fibrilasyon, <%1 hipertrigliseridemi ve anjina pektoris. Hastaların <%1'inde evre 4 (CTCAE, versiyon 3.0 sınıflamasına göre) periferik ödem, hipopotasemi, idrar yolu enfeksiyonu, kalp yetmezliği ve kırıklar görülmüştür.Seçilmiş advers reaksiyonların tanımlanmasıKardiyovasküler etkilerZYTIGA ile yürütülen faz 3 çalışmada kontrolsüz hipertansiyonu olan, miyokard enfarktüsüyle ortaya çıkmış klinik açıdan anlamlı kalp hastalığı olan, son 6 ayda arteriyel trombotik olay geçirmiş olan, ağır ya da unstabil anjinası olan, New York Kalp Cemiyeti Sınıf III ve IV kalp hastalığı olan ya da kardiyak ejeksiyon fraksiyon ölçümü %50'den az olan hastalar çalışmaya dahil edilmemiştir. Çalışmaya alınan diyabet, miyokard enfarktüsü, serebrovasküler olay ve ani kardiyak ölüm riski olan tüm hastalara (hem aktif ilaç, hem de plasebo alanlar) aynı zamanda öncelikle LHRH agonistleri kullanılarak androjen azaltma tedavisi uygulanmıştır. Faz 3 çalışmasında kardiyovasküler advers reaksiyonların sıklığı ZYTIGA alanlarda %11 ve plasebo alanlarda %7 olarak bulunmuştur. HepatotoksisiteZYTIGA tedavisi uygulanan hastalarda ALT, aspartat transaminaz (AST) ve total bilirubin düzeylerinde yükselmeyle seyreden ilaca bağlı hepatotoksisite bildirilmiştir. Tüm çalışmalarda, ZYTIGA alan hastaların yaklaşık %2'sinde tipik olarak tedaviye başladıktan sonraki ilk 3 ayda karaciğer fonksiyon testlerinde yükselmeler (ALT ve AST düzeylerinde normal kabul edilen üst sınırın 5 katından fazla yükselme veya bilirubin düzeylerinde normal kabul edilen üst sınırın 1.5 katından fazla yükselme) bildirilmiştir. Faz 3 klinik çalışmasında, başlangıç ALT veya AST düzeyleri yüksek olan hastalarda, başlangıç değerleri normal olanlara göre karaciğer fonksiyon testleri yükselmeleri daha fazla olmuştur. ALT veya AST düzeylerinde normal kabul edilen üst sınırın 5 katından fazla yükselme olduğunda ya da bilirubin düzeylerinde normal kabul edilen üst sınırın 3 katından fazla yükselme olduğunda ZYTIGA uygulamasına ara verilmiş ya da kesilmiştir. İki vakada karaciğer fonksiyon testlerinde belirgin yükselmeler görülmüştür (bkz.Bölüm 4.4). Başlangıç değerleri normal olan bu iki hastada ALT veya AST düzeyleri normal üst sınır değerlerin 15 ila 40 katı ve bilirubin düzeyleri ise normal üst sınır değerlerin 2 ila 6 katı yükselmiştir. ZYTIGA tedavisinin kesilmesinden sonra, her iki hastada da karaciğer fonksiyon testleri normale dönmüş ve hastalardan birinde bu defa yükselme olmaksızın ZYTIGA ile yeniden tedavi uygulanabilmiştir.Klinik çalışmalarda aktif hepatiti olan ya da başlangıç ALT ve AST düzeyleri karaciğer metastazının olmadığı durumlarda normal kabul edilen üst sınırın >2.5 katı, metastaz olanlarda ise normal kabul edilen üst sınırın >5 katı olan hastalar çalışmaya dahil edilmeyerek hepatotoksisite riski azaltılmıştır. Klinik çalışmaya alınan hastalarda karaciğer fonksiyon testlerinde anormalleşme olduğundaysa, bu hastalarda tedaviyi kesilmiş ve ancak karaciğer fonksiyon testleri tedavinin başlangıcındaki düzeylerine döndükten sonra yeniden tedavi almalarına izin verilmiştir ( bkz.Bölüm 4.2). ALT ve AST düzeyleri normal kabul edilen üst sınırın 20 katından fazla yükselen hastalarda yeniden tedavi uygulanmamıştır. Bu tür hastalarda tedaviye yeniden başlamanın güvenliliği bilinmemektedir. ZYTIGA tedavisi sırasında gelişen hepatotoksisitenin mekanizması anlaşılamamıştır.4.9. Doz aşımı ve tedavisiZYTIGA ile gerçekleştirilen klinik çalışmalarda doz aşımına rastlanmamıştır.Spesifik antidotu yoktur. Doz aşımı durumunda ZYTIGA uygulaması durdurularak aritmilerin, hipopotaseminin ve sıvı retansiyonunun bulgu ve belirtilerinin izlenmesi dahil genel destekleyici önlemler alınmalıdır. Karaciğer fonksiyonları da değerlendirilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Endokrin tedavi, diğer hormon antagonistleri ve ilişkili ajanlar ATC kodu: L02BX03Etki mekanizmasıAbirateron asetat (ZYTIGA) in vivoolarak bir androjen biyosentez inhibitörü olan abiraterona dönüşür. Spesifik olarak abirateron 17a-hidroksilaz/C17,20-liyaz (CYP17) enzimini seçici olarakinhibe eder. Bu enzim testiküler, adrenal ve prostatik tümör dokularında eksprese olur ve androjenin biyosentezi için gereklidir. CYP17 enzimi, sırasıyla 17a-hidroksilasyon ve C17,20 bağının kırılmasıyla pregnenolon ve progesteronun testesteron prekürsörleri olan DHEA ve androstenediona dönüşümünü katalize eder. CYP17 inhibisyonu aynı zamanda adrenaller tarafından mineralokortikoid üretiminde artışa da yol açar (bkz.Bölüm 4.4).Androjene duyarlı prostat karsinomu, androjen düzeylerini azaltan tedaviye yanıt verir. LHRH agonistleri ya da orşiektomi gibi androjen azaltıcı tedaviler, testislerdeki androjen üretimini azaltmalarına rağmen, adrenaller ya da tümör dokusundaki androjen üretimini etkilemezler. LHRH agonistleri (ya da orşiektomi) ile birlikte ZYTIGA tedavisi uygulandığında serum testesteron düzeyleri (ticari testlerle ölçüldüğünde) belirlenebilir düzeylerin altına düşer. Farmakodinamik etkilerZYTIGA, tek başına LHRH agonistleri ya da orşiektomi ile ulaşılan serum testesteron ve diğer androjenlerin düzeylerinden daha düşük seviyelere düşürür. Bu androjen biyosentezi için gereken CYP17 enziminin selektif olarak inhibe edilmesinin bir sonucudur. Prostat spesifik antijen (PSA) prostat kanserli hastalarda bir biyolojik belirteç olarak kullanılır. Daha önce taksanlarla yapılan kemoterapiden fayda görmeyen hastalarda gerçekleştirilen bir faz 3 klinik çalışmada ZYTIGA verilen hastaların %38'inde başlangıç PSA değerlerine göre en az %50 azalma sağlanabilmişken, bu azalma oranı plasebo uygulananların ancak %10'unda sağlanabilmiştir. Klinik etkililik ve güvenlilikZYTIGA'nın etkililiği daha önce taksan içeren kemoterapi almış ilerlemiş metastatik prostat kanserli (kastrasyona dirençli prostat kanseri) hastalarda gerçekleştirilen plasebo kontrollü çok merkezli randomize bir faz 3 çalışmayla gösterilmiştir. Çalışmaya alınan hastalar daha önceden dosetaksel kullanmıştı. Dosetaksel ile kemoterapiye bağlı toksisite de tedavinin kesilmesine neden olabileceğinden, hastaların dosetaksel tedavisi sırasında progresyon göstermiş olmasına ihtiyacı yoktu. Hastalar LHRH agonisti kullanıyorlardı ya da daha önce orşiektomi uygulanmıştı (N=1,195). Aktif tedavi uygulanan kolda, ZYTIGA, günde iki defa 5 mg düşük doz prednizon veya prednizolonla kombine olarak günde 1,000 mg dozunda kullanıldı (N=797). Kontrol grubundaysa plaseboya ek olarak günde iki defa 5 mg düşük doz prednizon ya da prednizolon uygulandı (N=398). Radyografik bulgulardaki ya da serum PSA konsantrasyonlarındaki değişiklikler bağımsız olarak her zaman klinik faydayı göstermeyebilir. Bu nedenle, çalışmada hastalar PSA progresyonuyla (hastadaki başlangıç değerlerinin %25'inde fazla artış) birlikte protokolle belirlenen radyografik bulgular ve semptomatik ya da klinik progresyon görülene kadar bulundukları tedavi kolundaki ilaçları almaya devam ettiler. Daha önce prostat kanseri için ketokonazol kullanmış hastalar çalışma dışı bırakıldı. Çalışmada primer etkililik sonlanma noktası genel sağkalım olarak belirlenmişti. Çalışmaya alınan hastaların medyan yaşı 69 idi (Yaş aralığı 39 - 95 yaş). ZYTIGA tedavisi uygulanan kişilerin ırk olarak 737'si (%93.2) beyaz ırktan, 28'i (%3.5) siyah ırktan, 11'i (%1.4) sarı ırktan ve geri kalan 14'ü (%1.8) ise diğer ırktandı. Çalışmaya alınan hastaların %11'inin ECOG performans skoru 2 idi; %70'inde PSA progresyonlu ya da progresyonsuz hastalık progresyonuna kanıt olacak radyografik bulgular bulunuyordu; %70'i daha önce bir seri ve %30'u iki seri sitotoksik kemoterapi görmüştü. ZYTIGA ile tedavi edilen hastaların %11'inde karaciğer metastazı vardı. 552 ölüm gözlendikten sonra yapılan planlı bir analizde, ZYTIGA ile tedavi uygulanan hastaların %42'si (797 hastanın 333'ü), plasebo tedavi kolundaki hastaların ise %55'i (398 hastanın 219'u) hayatını kaybetmişti. ZYTIGA ile tedavi uygulanan hastalardaki medyan genel sağkalımda istatistiksel olarak anlamlı bir fark görüldü ( bkz.Tablo 2).Tablo 2: Prednizon veya prednizolon + LHRH agonisti ya da daha önceden yapılanorşiektomiyle birlikte ZYTIGA veya plasebo ile tedavi edilen hastalardaki genel sağkalım
a P-değeri ECOG performans skorlarına (0-1'e karşı 2), ağrı skoruna (yok'a karşı var), daha önceden alınmış kemoterapi sayısına (1'e karşı 2) ve hastalık progresyonunun tipine (yalnız PSA'ya karşıradyografik) göre tabakalaştırılmış bir logaritmik-sıralama testinden elde edilmiştir. b Tehlike oranı tabakalandırılmış orantısal bir risk modeline göre hesaplanmıştır. Risk oranı <1 ZYTIGA lehineTedavinin başlangıçtaki ilk birkaç ayından sonra her değerlendirme noktasında, ZYTIGA tedavisi uygulanan hastaların canlı kalanlarının oranı, plasebo uygulanan hastaların canlı kalanlarının oranından daha fazlaydı(bkz.Şekil 1).Şekil 1: Prednizon veya prednizolon + LHRH agonisti ya da daha önceden yapılanorşiektomiyle birlikte ZYTIGA veya plasebo ile tedavi edilen hastalarda Kaplan Meier sağkalım eğrileri
AA 797 Plasebo 398 100 a C3 M 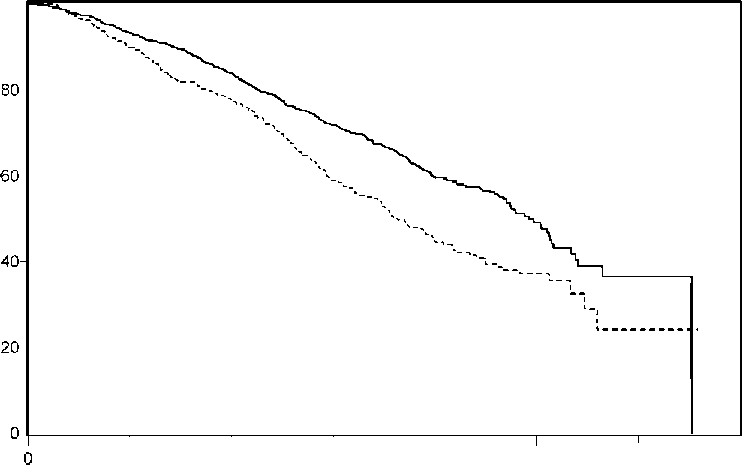
-AA AA=ZYTIGA Altgrup sağkalım analizi ZYTIGA ile tedavi uygulananlarda tutarlı bir sağkalım faydasını gösterdi (bkz.Şekil 2).Alt Grup Ortalama (ay) AA Plasebo
Değişken
TUMU 0-1 2 <4 >-4 1 2 Sadece PSA Radyografi <65 >=65 >=75 EVET NO EVET HAYIR EVET HAYIR EVET HAYIR YOK Diğer
148 153 73163 126 154 Ur142 14 4 148 149 125 1$4 126 162 104 rc 11 S NE ıst 148
066 064 081 064
10 »77 13 «9 11 S 10 3 123 »0 4 112 107 93 84 112 88 132 e 16 4 81 16 4 10 7 11 5
052 0.70
05 O 75 I
15
06»
AA lehine
Tüm katılımcılar BAŞLANGIÇ ECOG Başlangıç BPI
Medyanın üzerinde başlangıç ALK-Psi
Daha önceki kemo rejimlerinin sayısı
Medyanın üzerinde başlangıç BSA'sı
Medyanın üzerinde başlangıç LDHsi
Girişte viskeral hastalık
İlerleme türü
Bölge
Yaş
(0 56, 0T9) (0S3, 078) (0S3. ti4) (0 50, 002) 088 (0S3. oas) 0« (051,078) 0 74 (0 55, 099) 0.59 (O 42, 082) 069 (056, 084) 066 (04S, 091) 067 (O 55, 0 82) (038, 071) (0 52, 094) 0.62 (0 50, 0 76) 065 (0 52, 081) 06» (053, OâO) 0 71 (OSe, 088) 064 (0 47, 0 87) (0 40, 074) AA=ZYTIGA; BPI=Kısa ağrı envanteri: oncology group) performans skoru; HR= ,GA=Güven aralığı; ECOG=Doğu kooperatif onkoloji grubu (eastern cooperative =Tehlike oranı; NE=Değerlendirilebilir değil Genel sağkalımda gözlenen iyileşmeye ek olarak, tüm ikincil sonlanma noktaları ZYTIGA lehine idi ve aşağıda gösterildiği şekilde bu farklılıklar birden fazla test için ayarlandığında istatistiksel olarak anlamlı düzeylerdeydi: ZYTIGA alan hastalarda, plasebo verilenlere göre istatistiksel olarak anlamlı düzeylerde daha yüksek PSA yanıt oranı (başlangıç değerinden >%50 olarak tanımlanmış) elde edildi (ZYTIGA ile %38, plaseboyla %10, p <0.0001). ZYTIGA ile tedavi görenlerde PSA progresyonu açısından medyan süre 10.2 ay iken bu süre plasebo uygulananlarda ise, 6.6 ay idi (HR=0.580; %95 GA: [0.462; 0.728], p <0.0001). ZYTIGA ile tedavi görenlerde radyografik progresyonsuz medyan süre 5.6 ay iken bu süre plasebo uygulananlarda 3.6 ay idi (HR=0.673; 95% GA: [0.585; 0.776], p <0.0001). AğrıAğrısında hafifleme olan hastaların oranı ZYTIGA ile tedavi görenlerde, plasebo uygulananlara oranla istatistiksel olarak daha fazlaydı (%44'e karşı %27, p=0.0002). Bir hastada dört hafta arayla yapılan iki ardışık değerlendirmede 24 saatlik bir sürede analjezik kullanım puanlamasında herhangi bir artış olmaksızın BPI-SF en kötü ağrı yoğunluğu skorlamasında en az %30 azalma sağlanması ağrının hafiflemesi yanıtı olarak tanımlandı. Ağrının hafiflemesi açısından yalnızca başlangıç ağrı puanı >4 olan hastalar değerlendirildi ve en az bir başlangıç-sonrası ağrı skoru analiz edildi (N=512). ZYTIGA ile tedavi görenlerde, plasebo uygulananlara oranla daha düşük oranda ağrıda progresyon görüldü: 6. ayda ZYTIGA tedavisi görenlerin %22'sine karşılık plasebo alanların %28'i, 12. ayda ZYTIGA tedavisi görenlerin %30'una karşılık plasebo alanların %38'i ve 18. ayda ZYTIGA tedavisi görenlerin %35'ine karşılık plasebo alanların %46'sında ağrıda artış vardı. Bir hastada iki ardışık değerlendirmede 24 saatlik bir sürede analjezik kullanımında herhangi bir azalma olmaksızın BPI-SF en kötü ağrı yoğunluğu skorlamasında başlangıca göre >%30 artış olması ya da iki ardışık değerlendirmede analjezik kullanım puanlamasında >%30 artış olması ağrıda progresyon olarak tanımlandı. Ağrıda progresyon süresi 25'inci persentilde ZYTIGA grubunda 7.4 ay iken plasebo grubunda 4.7 ay idi. İskelet sistemiyle ilişkili olaylar6. ayda, 12'inci ayda ve 18'inci ayda ZYTIGA grubunda iskelet sistemiyle ilişkili olay görülen hasta oranı plasebo ile karşılaştırıldığında daha düşüktü (sırasıyla 6. ayda %18'e karşı %28, 12. ayda %30'a karşı %40 ve 18. ayda %35'e karşı %40). İskelet sistemiyle ilişkili ilk olayın görülme süresi 25'inci persentilde ZYTIGA grubunda 9.9 ay ve plasebo grubunda 4.9 ay olacak şekilde iki kat daha uzundu. Patolojik bir kırık görülmesi, spinal kordda kompresyon gelişmesi, kemiğe palyatif radyoterapi uygulanması veya kemiğe yönelik cerrahi girişim iskelet sistemiyle ilişkili bir olay olarak tanımlandı. Pediyatrik popülasyomPediyatrik popülasyonda prostat kanseri görülmediğinden ZYTIGA'nın pediyatrik hastalarda kullanımı bulunmamaktadır. ZYTIGA'ya ait pediatrik popülasyonda klinik etkililik ve güvenlilik verisi yoktur. 5.2. Farmakokinetik özellikler Genel özelliklerAbirateron asetat uygulamasından sonra abirateron ve abirateron asetatın farmakokinetiği sağlıklı gönüllülerde, ilerlemiş metastatik prostat kanserli hastalarda ve kanseri olmayan karaciğer veya böbrek yetmezliği olan bireylerde çalışılmıştır. Abirateron asetatin vivo(bkz.Bölüm 5.1).Emilim:Abirateron asetatın açlık durumunda oral yoldan uygulanmasını takiben yaklaşık 2 saatte maksimum plazma abirateron konsantrasyonlarına ulaşılır. Abirateron asetatın yiyeceklerle birlikte alınması, besinlerin yağ içeriğine göre aç karına alınmasına oranla 10 kata kadar (AUC açısından) ve 17 kata kadar (Cmax açısından) daha fazla abirateron sistemik maruziyetine yol açabilmektedir. Yiyeceklerin içerik ve bileşimindeki normal farklılıklar nedeniyle, ZYTIGA'nın yiyeceklerle birlikte alınması oldukça çeşitli ilaç maruziyetlerine yol açabilecek potansiyele sahiptir. Bu nedenle ZYTIGA yiyeceklerle birlikte alınmamalıdır. ZYTIGA, yemek yedikten en az iki saat sonra alınmalı ve ZYTIGA alınmasından sonra en az bir saat hiçbir yiyecek yenilmemelidir. Tabletler bir bütün olarak suyla yutulmalıdır (bkz.Bölüm 4.2).Dağılım:İnsan plazmasında 14C-abirateronun proteine bağlanma oranı %99.8'dir. Görünür dağılım hacmi, abirateronun periferik dokuya yoğun bir şekilde dağılıma uğradığını gösterecek şekilde yaklaşık 5,630 litredir. Biyotransformasyon:14C-abirateron asetatın kapsül formunda oral yoldan uygulanmasından sonra, abirateron asetat abiraterona hidrolize olur ve daha sonra primer olarak karaciğerde olmak üzere sülfatlanma, hidroksilasyon ve oksidasyona uğrar. Dolaşımdaki radyoaktivitenin büyük çoğunluğu (yaklaşık %92) abirateronun metabolitleri formundaydı. Belirlenebilen 15 metabolitten iki temel metabolit her biri toplam radyoaktivitenin yaklaşık %43'ünü temsil eden abirateron sülfat ve N-oksit abirateron sülfat idi. Eliminasyon:Sağlıklı gönüllülerden elde edilen verilere göre plazmadaki abirateronun yarılanma süresi yaklaşık 15 saattir. 1,000 mg 14C-abirateron asetatın oral yoldan uygulanmasından sonra radyoaktif dozun yaklaşık %88'i feçeste ve yaklaşık %5'i idrarda görülür. Feçeste bulunan majör bileşikler değişmemiş abirateron asetat ve abiraterondur (sırasıyla uygulanan dozun yaklaşık %55 ve %22'si). Karaciğer yetmezliği olan hastalarAbirateron asetatın farmakokinetiği hafif ya da orta şiddette karaciğer yetmezliği olan hastalar (sırasıyla Child-Pugh sınıf A ve B) ile sağlıklı kontrollerde çalışılmıştır. 1,000 mg 'lık tek bir oral doz sonrası abiraterona sistemik maruziyet hafif ve orta şiddette karaciğer yetmezliği olan hastalarda sırasıyla %11 ve %260 oranında artmaktadır. Abirateronun ortalama yarılanma süresi hafif karaciğer yetmezliği olan hastalarda yaklaşık 18 saate ve orta şiddette karaciğer yetmezliği olan hastalarda ortalama 19 saate uzamaktadır. Hafif derecede karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. ZYTIGA orta şiddette ya da ağır karaciğer yetmezliği olan hastalarda kullanılmamalıdır ( bkz.Bölüm 4.2).ZYTIGA tedavisi sırasında hepatotoksisite gelişen hastalarda, uygulamanın durdurulması ve doz ayarlaması gerekebilir (bkz.Bölüm 4.2 ve 4.4).Böbrek yetmezliği olan hastalarStabil bir hemodiyaliz programında olan son dönem böbrek yetmezliği olan hastaları ile böbrek fonksiyonları normal olan kontrol grubu deneklerde ZYTIGA asetatın farmakokinetiği karşılaştırılmıştır. Diyaliz programında olan son dönem böbrek yetmezliği olan hastalarında 1,000 mg'lık tek bir oral doz sonrası abiraterona sistemik maruziyet artmamıştır. Ağır böbrek yetmezliği dahil, böbrek yetmezliği olan hastalarda ZYTIGA uygulanması sırasında dozu azaltmaya gerek yoktur (bkz.Bölüm 4.2). Ancak prostat kanseri olan ağır böbrek yetmezliği olan hastalarda klinik deneyim bulunmamaktadır. Bu tür hastalarda dikkatli olunması tavsiye edilir.5.3. Klinik öncesi güvenlilik verileriAbiraterone asetatla gelişimsel veya üreme toksikolojisi çalışmaları yapılmamıştır; buna rağmen tüm hayvan toksisite çalışmalarında, dolaşımdaki testesteron düzeyleri anlamlı derecelerde azalmıştır. Buna bağlı olarak üreme organlarıyla adrenal, hipofiz ve meme bezlerinin ağırlıklarında azalma ile morfolojik ve/veya histopatolojik değişiklikler gözlenmiştir. Tüm değişiklikler tam ya da kısmi geri dönüşebilir nitelikteydi. Üreme organları ve androjene duyarlı organlardaki değişiklikler abirateronun farmakolojisiyle uyumludur. Tüm tedaviyle ilişkili hormonal değişikliklerin 4 haftalık toparlanma döneminde geri döndüğü ya da düzelmeye başladığı gösterildi. ZYTIGA gebelikte kontrendikedir(bkz.Bölüm 4.3).Tüm hayvan toksikoloji çalışmalarında görülen üreme organlarındaki değişiklikler dışında, klasik güvenlilik farmakolojisi, tekrarlayan doz toksisitesi ve genotoksisite çalışmalarından elde edilen klinik dışı veriler insanlar için özel bir tehlikeyi göstermemiştir. Karsinojenite çalışmaları yapılmamıştır. 6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesiLaktoz monohidrat Mikrokristalin selüloz Kroskarmelloz sodyum Povidon (K29/K32)Sodyum lauril sülfat Magnezyum stearat Kolloidal anhidröz silika 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25 °C' nin altındaki oda sıcaklığında saklanmalıdır.Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. 6.5. Ambalajın niteliği ve içeriğiZYTIGA, polipropilen kapaklı, çocuk emniyetli, yüksek dansiteli polietilen beyaz ve yuvarlak şişelerde sunulmaktadır. Her bir şişe 120 tablet içerir.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerGebe olan ya da gebe olma olasılığı bulunan kadınlar ZYTIGA ile korunmasız temas etmemeli; örneğin eldiven kullanmalıdır(bkz.Bölüm 4.6)Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİJohnson and Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti.Kavacık Mahallesi Ertürk Sokak Keçeli Plaza No:13 Kavacık, Beykoz-İstanbul Tel : 0 216 538 20 00 Faks : 0 216 538 23 69 8. RUHSAT NUMARASI135/409. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ |
İlaç BilgileriZytiga 250 mg TabletEtken Maddesi: Abirateron asetat Atc Kodu: L02BX03 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.