Airplus 25/250mcg İnhalasyon İçin Aerosol Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Adrenerjikli Kombinasyonlar » Salmeterol Kombinasyonları KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIAİRPLUS 25/250 mcg inhalasyon için aerosol2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler:Salmeterol ksinafoat* 36 25 mcgFlutikazon propiyonat 250,00 mcg * 25 mcg Salmeterol'e eşdeğer Yardımcı madde:Yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTİK FORMinhalasyon için aerosol.Alüminyum inhaler kab, içinde basınçlı propellant gaz ile doldurulmuş homojen süspansiyon. Alüminyum konteynere bir dozajlama valf eklidir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAst,m semptomlar,mn düzeltilmesi ve kontrol altına almması amaeıyla kullandır. Ast,m hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularında semptomları ve atak sıklığını azaltır.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:AİRPLUS sadece inhalasyon yolu ile uygulanır.Hastalara semptomların görülmediği zamanlar da dahil olmak üzere, AİRPLUS'm optimum yarar sağlamak üzere günlük olarak kullanılması gerektiği yönünde bilgi verilmelidir. Hastalar düzenli olarak bir doktor tarafmdan değerlendirilmeli, ald.klan AİRPLUS dozunun optimum düzeyde kalmas, sağlanmalı ve doz sadece doktor önerisi ile değiştirilmelidir. Doz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalar. Günde iki kez uygulanan en düşük kombinasyon dozajıyla semptomların kontrolü sağlandığında, bir sonraki adımda inhale kortıkosteroidin tek başına kullanımı test edilmelidir. Alternatif olarak, uzun süre etkili beta 2 agonistlerinin kullanılması gereken hastalar, reçete eden hekimin görüşüne göre hastalık kontrolünü sağlamakta yeterli olacağ, düşünülüyorsa, günde bir kez AİRPLUS alacak şekilde de titre edilebilirler. Hastada gece görülen semptom öyküsü varsa ve günde bir kez dozlama uygulanıyorsa, doz geceleri verilmeli; hastada genellikle gündüz görülen semptom öyküsü varsa, doz sabahlan verilmelidir. Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren AİRPLUS verilmelidir. Not: AİRPLUS 25 mikrogram/50 mikrogram dozu şiddetli astımı olan erişkinlerde ve çocuklarda kullanıma uygun değildir. Reçete eden hekim, astımlı hastalarda flutikazon propiyonat,n mikrogram emsinden günlük dozun yaklaşık yansı kadar dozda diğer inhale steroidler kadar etkin olduğunun bilincinde olmalıdırlar, örneğin, 100 mikrogram flutikazon propiyonat yaklaşık 200 mikrogram beklometazon dipropiyonata (CFC içeren) veya budesonide eşdeğerdir. Bireysel olarak bir hastada önerilen rejimin dışmda dozajların gerekmesi durumunda, uygun beta agonisti ve/veya kortikosteroid dozları reçete edilmelidir. w Tavsiye edilen dozlar: Astım Erişkinler ve 12 yaş ve üstündeki adolesanlar: Günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 50 mikrogram flutikazon propiyonat. Veya günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 125 mikrogram flutikazon propiyonat. Veya günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat. Astımın hızl. şekilde kontrol edilmesi gereken, orta dereceli inatçı astımı olan erişkin veya adolesan hastalarda (hastanın günlük semptomlarına, günlük kurtarma ilacı kullanımına ve orta ila şiddetli hava yolu sınırlamasına göre tanımlanır), kısa süreli bir AİRPLUS denemesi başlangıç tedavisi olarak kabul edilebilir. Bu durumlarda, önerilen başlangıç dozu günde iki kez iki inhalasyon olarak 25 mikrogram salmeterol ve 50 mikrogram flutikazon propiyonattır. Astım kontrolü sağlandığında, tedavi tekrar gözden geçirilmeli ve hastaların tek başına inhale kortıkosteroid alacak şekilde dozlarının azaltılması düşünülmelidir. Tedavide doz azaltılırken hastaların düzenli olarak incelenmesi önemlidir. Bir veya iki hastalık şiddeti kriteri eksik olduğunda, başlangıç tedavisi olarak tek başına inhale flutikazon propiyonat kullanımına kıyasla net bir yarar gösterilmemiştir. Genel olarak inhale ^ kortıkosteroıdler hastaların büyük çoğunluğunda birinci basamak tedavi olmaya devam etmektedir. AİRPLUS ın hafif astımın ilk tedavisinde kullanımı amaçlanmamaktadır. AİRPLUS 25 mıkrogram/50 mikrogram dozları, şiddetli astımı olan çocuklarda ve erişkinlerde kullanıma uygun değildir; şiddetli astım hastalarında herhangi bir sabit kombinasyonun kullanılmasından önce uygun inhale kortikosteroid dozunun gösterilmesi önemlidir. Kronik Obstrüktif Akciğer Hastalığı (KOAH) Yetişkinler Yetişkin hastalar için tavsiye edilen doz günde 2 kez 2 inhalasyon 25/125 mikrogram - 25/250 mikrogram salmeterol/flutikazon propiyonattır. Günde iki kez alınan toplam 50/500 mikrogramlık maksimum salmeterol/flutikazon kombinasyon dozunun tüm nedenlere bağlı ölümleri azalttığı gösterilmiştir (Bkz. 5.1 Klinik Çalışmalar). Kullanımı: Hastalara inhalasyon için aerosolü nasıl kullanacakları ve bakımını nasıl yapacaklar, konusunda bilgi verilmeli ve inhale ilacın akciğerlere optimum dağıtımını sağlamak üzere kullanım tekniklen kontrol edilmelidir. Hasta inhalasyon için aerosolü kullanmada sıkıntı yaşarsa, bir spacer cihazı kullanabilir. Spacer cihazlarının değiştirilmesi akciğerlere giden doz miktarında değişiklik meydana getirebileceğinden, hastalar aynı tip spacer cihazını kullanmaya devam etmelidirler. Bir spacer cihaz, kullanılmaya başlandığında veya cihaz değiştirildiğinde daima tekrar en düşük doz titrasyonu gerçekleştirilmelidir. Uygulama şekli:AİRPLUS, sadece inhalasyon yolu ile uygulanır.İnhalasyon için aerosolün doğra kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. İnhalasyon sırasında hastalar tercihen oturmalı veya ayakta durmalıdır. İnhalasyon için aerosol dik konumda kullanım için tasarlanmıştır. Olası bir kandida enfeksiyonu riskini azaltmak için her uygulamadan sonra ağzın su ile iyice çalkalanması vc tükürülmesi önerilmektedir. Ayrıca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskinin azaltılmasına muhtemelen yardımcı olabilir. Kullanıma ılışkm detaylı bilgi, kullanma talimatında mevcuttur. İnhalasyon için aerosolün doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz. İnhalasyon için aerosolün kullanım talimatıİnhalasyon için aerosolün test edilmesi: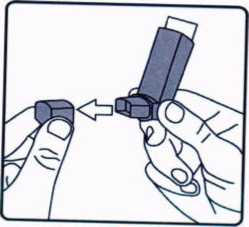 ilk kez kullanımdan önce hastalar ağızlık kapağım, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon için aerosolü iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon için aerosolün tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon için aerosol her sıkımdan önce sallanmalıdır.
ilk kez kullanımdan önce hastalar ağızlık kapağım, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon için aerosolü iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon için aerosolün tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon için aerosol her sıkımdan önce sallanmalıdır.İnhalasyon için aerosol bir hafta veya daha uzun süre kullanılmadığında hastalar ağızlık kapağını çıkarmalı ve inhalasyon için aerosol ile boşluğa iki kez sıkım yapmalıdır. İnhalasyon için aerosolü kullanacağınız zaman oturunuz veya ayakta dik durunuz. 1. ilk resimde gösterildiği gibi .g,zl,k kapagm, ç.kanmz. Ağ,zhğ,n temiz olduğundan emin olmak için içini ve dışını kontrol ediniz. 2. İnhalasyon için aerosolü her kullanımdan önce iyice çalkalayınız. 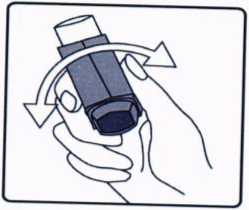 3. İnhalasyon için aerosolü baş parmağınız ağızl.ğın altında, inhalasyon için aerosolün tabanında olacak şekilde dik tutunuz.
3. İnhalasyon için aerosolü baş parmağınız ağızl.ğın altında, inhalasyon için aerosolün tabanında olacak şekilde dik tutunuz.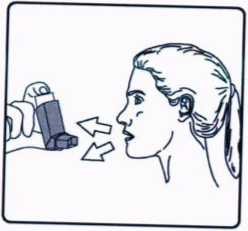 4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız.
4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız.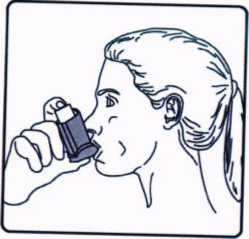 5. Ağzınızdan yavaş ve derin nefes al.nız ve aynı anda bir puf doz boşaltmak için inhalasyon için aerosolün üst kısmına basınız.
5. Ağzınızdan yavaş ve derin nefes al.nız ve aynı anda bir puf doz boşaltmak için inhalasyon için aerosolün üst kısmına basınız.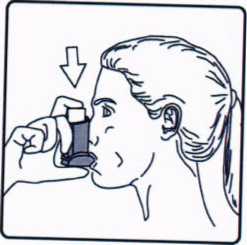 6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağ.zl.ğı ağzınızdan çıkarıp parmağınızı inhalasyon için aerosolün üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.
6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağ.zl.ğı ağzınızdan çıkarıp parmağınızı inhalasyon için aerosolün üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.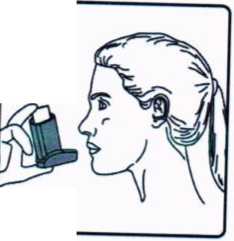 7. Her bir puf ilaç alım, arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.
7. Her bir puf ilaç alım, arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.8. Daha sonra, ağzınızı su ile çalkalayınız ve tükürünüz. Bunu yapmanız ağzınızda pamukçuk oluşumunun ve ses kısıklığının önlenmesine yardımcı olmak için önemlidir. 9. Kullanımdan sonra tozdan korumak için ağızlığın kapağını hemen kapatınız. Ağızlık kapağı doğru bir şekilde yerleştirildiğinde tam yerine oturacaktır. Eğer yerine oturmuyorsa, ağızlık kapağını diğer yöne çeviriniz. Çok fazla güç uygulamayınız. Hastalar 4, 5 ve 6. basamakları hızlı bir şekilde yapmamalıdır. Hastaların inhalasyon için aerosolü etkin hale getirmeden hemen önce mümkün olduğunca yavaş bir şekilde nefes almaya başlaması önemlidir. Hastalar aynanın önünde ilk birkaç uygulama için pratik yapmalıdırlar. Eğer hastalar inhalasyon için aerosolün üstünden veya ağızlarının yanından buhar geldiğini görürse, 2. basamaktan itibaren uygulamaya tekrar başlamalıdırlar. İnhalasyon için aerosolün temizlenmesiİnhalasyon için aeorolü haftada en az bir kez temizleyiniz.1. Ağızlık kapağını çıkarınız. 2.Tüpü plastik gövdeden çıkarmayınız.3.Kuru bir bez veya kumaş ile ağızlığın içini ve dışını ve plastik gövdeyi siliniz.4. Ağızlık kapağını doğru bir şekilde yerleştiriniz. Kapağı yerleştirmek için çok fazla güç uygulamayınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda dozun ayarlanmasına gerek yoktur.Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda AİRPLUS kullanımına ilişkin bilgi yoktur.Pediyatrik popülasyon:4-12 yaş arasj çocuklarda:Günde ıkı kez ıkı inhalasyon halinde 25 mikrogram salmeterol Ve 50 mikrogram flutikazon propiyonat. Çocuklarda AİRPLUS inhalasyon için aerosol ile verilen maksimum onaylı flutikazon propiyonat dozu, günde iki kez 100 mikrogram'dır. 4 yaşından küçük çocuklarda AİRPLUS inhalasyon için aerosol kullanımına ilişkin veri yoktur. Geriyatrik popülasyon:Yaşlı hastalarda dozun ayarlanmasına gerek yoktur.4.3. KontrendikasyonlarAİRPLUS, etkin madde veya yardımcı maddelerden birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleri- Astım tedavisinde normalde kademeli bir program izlenmeli ve hasta yanıtı klinik olarak ve akciğer fonksiyon testleriyle izlenmelidir.AİRPLUS hafif astım tedavisi için önerilmez. - AİRPLUS hızlı ve k.sa etkili bir bronkodilatörün gerektiği akut astım semptomlarının tedavisinde kullanılmamalıdır. Hastalara her zaman bir akut astım atağı durumunda semptomların hafifletilmesinde kullanılmak üzere ilaçlarını yanlarında bulundurmaları söylenmelidir. - Hastalarda bir alevlenme sırasında veya anlamlı şekilde kötüleşen veya akut şekilde şiddetlenen astım hastalıkları varsa AİRPLUS tedavisi başlatılmamalıdır. - AİRPLUS ile tedavi sırasında ciddi astım kaynaklı yan etkiler ve alevlenmeler meydana gelebilir. AİRPLUS tedavisine başlandıktan sonra astım semptomları kontrol edilmezse veya kötüleşirse hastalara tedaviye devam etmeleri, ancak doktorlarına danışmaları gerektiği söylenmelidir. - Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. - Astım semptomlarının hafifletilmesi için kısa etkili bronkodilatörlerin artan kullanımı astım kontrolünün kötüleştiğini göstermektedir ve hasta, bir hekim tarafından incelenmelidir.. - Astım kontrolündeki ani ve progresif bir kötüleşme potansiyel anlamda yaşamı tehdit edicidir ve hastalar acil tıbbı yardım almalıdır. Kortikosteroid tedavisi dozunun arttırılması düşünülmelidir. Hasta ayrıca mevcut AİRPLUS dozunun yeterli astım kontrolü sağlayamadığı durumlarda tıbbi açıdan incelenmelidir. Ek kortikosteroid tedavilerinin kullanımı düşünülmelidir. - Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. - Astım semptomlar, kontrol edildiğinde AİRPLUS dozunun kademeli şekilde azaltılması düşünülmelidir. Tedavi dozu azaltılırken hastaların düzenli şekilde incelenmesi önemlidir. AİRPLUS'm en düşük etkin dozu kullanılmalıdır. AİRPLUS ile tedavi aniden kesilmemelidir. - Tüm ınhale ilaç içeren kortikosteroidlerde olduğu gibi AİRPLUS, pulmoner tüberkülozlu hastalarda dikkatli şekilde kullanılmalıdır. - Seyrek şekilde AİRPLUS yüksek terapötik dozlarda kardiyak aritmi (örn, supraventriküler taşıkardı, ekstrasistol ve atrıal fibrilasyon) ve serum potasyumunda hafif geçici bir düşmeye neden olabilir. Bu nedenle AİRPLUS şiddetli kardiyovasknler bozukluk, kalp ritim anomalileri, diabetes mellitns, tirotoksikoz, düzeltilmemiş hipokalemi veya düşük serum potasyum düzeylerine eğilimli olan hastalarda dikkatli şekilde kullanılmalıdır. - Seyrek şekilde kan glukoz düzeylerinde artışlar bildirilmiş olup, Diabetes mellitus öyküsü olan hastalara bu ilaç reçete edilirken bu dikkate alınmalıdır. - Diğer inhalasyon tedavilerinde olduğu gibi, dozlamadan sonra hırıltıda hızlı bir artışla paradoksıkal bronkospazm meydana gelebilir. AİRPLUS derhal kesilmeli, hasta değerlendirilmeli ve gerektiğinde alternatif tedaviye başlanmalıdır. - Özellikle adrenal fonksiyonun önceki sistemik steroid tedavisi nedeniyle bozulduğunun düşünülmesi için herhangi bir gerekçe mevcutsa, hastalar AİRPLUS tedavisine geçirilirken dikkatli olunmalıdır. - Özellikle uzun süreli periyotlarda önerilenden yüksek dozlarda olmak üzere tüm inhale kortıkosteroıd ilaçlarla sistemik etkiler meydana gelebilir. Bu etkiler oral kortikosteroidlere kıyasla çok daha seyrek meydana gelmektedir. Olası sistemik etkiler Cushing sendromu, Cushmg benzen özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu, katarakt ve glokomu içermektedir. Bu nedenle hastaların düzenli şekilde incelenmesi ve inhale kortikosteroid dozunun astımın etkinlik kontrolünün sürdürüldüğü en düşük doza indirilmesi önemlidir. - İnhale kortıkosteroidlerin yüksek dozlarıyla hastalarda uzun süreli tedavi adrenal süpresyon ve akut adrenal krize neden olabilir. Yüksek flutikazon dozu (tipik olarak >1000 mcg/gün) kullanan çocuklar ve <16 yaşındaki adolesanlar özellikle riskli olabilir. Çok seyrek vakalarda ayrıca 500 ila <1000 mcg arasındaki flutikazon propiyonat dozlarıyla adrenal süpresyon ve akut adrenal kriz tanımlanmıştır. Akut adrenal krizi tetikleme potansiyeli olan durumlar travma, cerrahı, enfeksiyon veya dozdaki herhangi bir hızlı azalmayı içermektedir. Görülen semptomlar tipik olarak belirsizdir ve anoreksi, karın ağrısı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, hipotansiyon, azalan bilinç düzeyi, hipoglisemi ve nöbetleri içerebilir. Stres veya elektıf cerrahi periyotlarında ek sistemik kortikosteroid kullanımı düşünülmelidir. Salmeterol ve flutikazon propiyonatın sistemik emilimi büyük ölçüde akciğerlerde gerçekleşmektedir. Bir ölçülü doz inhaler ile bir spacer cihazının kullanımı akciğerlere ilaç salıverilmesini arttırabildiğinden, bunun sistemik yan etki riskinde bir artışa neden olma potansiyeli olduğu göz önünde bulundurulmalıdır. Tek doz farmakokinetik veriler, salmeterol/flutıkazon propiyonat kombinasyonunun ölçülü doz inhalerinin Volumatik spacer cihaz, ile kullanımının AeroChamber Plus spacer cihazı ile kullanımına kıyasla salmeterol ve flutikazon propiyonat sistemik maruziyetini iki kat arttırabilirle ihtimalini göstermiştir. - İnhale flutikazon propiyonat tedavisinin yararları oral steroid ihtiyacını minimize edecektir, ancak oral steroıdlerden bu ilaçla tedaviye geçirilen hastalarda uzun bir süre adrenal rezervde azalma riski devam edebilir. Daha önce yüksek doz acil kortikosteroid tedavisine ihtiyaç duyan hastalar da riskli olabilir. Strese neden olması muhtemel acil ve elektif durumlarda daima rezidüel yetmezlik olasılığı göz önünde bulundurulmalı ve uygun kortikosteroid tedavisi düşünülmelidir. Adrenal yetmezlik boyutu, elektif prosedürlerden önce uzman önerisi gerektirebilir. Ritonavir plazmadaki flutikazon propiyonat konsantrasyonunu ciddi şekilde arttırabilir. Bu nedenle, hasta için potansiyel yararı sistemik kortikosteroid yan etkileri riskinden daha yüksek olmadığı sürece eşzamanlı kullanımdan kaçınılmalıdır. Ayrıca flutikazon propiyonat ile diğer potent CYP3A inhibitörleri birlikte kullanıldığında sistemik yan etki riski artmaktadır. - Plaseboya kıyasla salmeterol/flutikazon propiyonat kombinasyonu alan Kronik Obstrüktif Akciğer Hastalığı (KOAH) bulunan hastalarda 3 yıllık bir çalışmada alt solunum yolu enfeksiyonları (özellikle pnömoni ve bronşit) daha sık bildirilmiştir. Üç yıllık KOAH çalışmasında yaşlı hastalar, daha düşük vücut kitle endeksi olan (< 25 kg/m2) hastalar ve çok şiddetli hastalığı (FEVİ beklenenin <%30'u) bulunan hastalarda, tedaviden bağımsız şekilde pnomonı gelişme riski en yüksek düzeydedir. Bu enfeksiyonların klinik özellikleri ve alevlenme sıklıkla aynı anda meydana geldiğinden, hekimler KOAH hastalarında pnömoni ve diğer alt solunum yolu enfeksiyonlarının olası gelişimi konusunda dikkatli olmalıdır. Şiddetli KOAH bulunan hastada pnömoni gelişirse, AİRPLUS ile tedavi yeniden değerlendirilmelidir. - Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. - Büyük ölçekli bir klinik çalışmada (Salmeterol Çok Merkezli Astım Araştırma Çalışması -S MART) veriler Afro-Amerikalı hastalarda, plaseboya kıyasla salmeterol kullanımı sırasında solunum ile ilişkili ciddi olay veya ölüm riskinin daha yüksek olduğunu düşündürmüştür. Bu artışın farmakogenetiğe veya diğer faktörlere bağlı olup olmadığı bilinmemektedir. Bu nedenle siyah Afrikalı veya Afro-Karayip kökenli hastalara, AİRPLUS tedavisi sırasında astım semptomları kontrol edilmezse veya kötüleşirse tedaviye devam etmeleri gerektiği, ancak doktorlarına danışmaları gerektiği söylenmelidir. - Eşzamanlı sistemik ketokonazol kullanım,, salmeterol maruziyetini anlamlı şekilde arttırmaktadır. Bu sistemik etki insidansında (örn, QTc aralığında uzama ve palpitasyonlar) bir artışa neden olabilir. Dolayısıyla, salmeterol tedavisinin yararları potansiyel anlamda artan sistemik yan etki riskinden daha fazla olmadığı sürece ketokonazol veya diğer potent CYP3A4 inhıbitörleri ile eşzamanlı tedaviden kaçınılmalıdır. - Inhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altında almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. V 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriSelektif ve selektif olmayan beta blokerler, kullanılan için güçlü gerekçeler olmadı* süreee astım hastalarında kullanılmamalıdır.Diğer beta adrenerjik içeren ilaçların eşzamanlı kullanımı potansiyel aditif etkiye sahip olabilir. Flutikazon Propiyonat Normal şartlar altında, bağırsak ve karaciğerde sitokrom P450 3A4 enziminin aracılık ettiği yoğun ilk geçiş metabolizması ve yüksek sistemik klirens nedeniyle inhale dozlamadan sonra flutikazon propiyonatm düşük plazma konsantrasyonları elde edilmektedir. Bu nedenle flutikazon propiyonat aracılı klinik açıdan anlamlı ilaç etkileşimleri muhtemel değildir. ~ Sağlıklı deneklerde intranazal flutikazon propiyonat ile yapılan bir etkileşim çalışmasında, günde iki kez ritonavir (oldukça potent bir sitokrom P450 3A4 inibitörü) 100 mg dozu flutikazon propiyonat plazma konsantrasyonlarını yüzlerce kat arttırmış ve serum kortizol konsantrasyonlarının belirgin şekilde azalmasına neden olmuştur. Bu etkileşime ilişkin bilgiler inhale flutikazon propiyonat için mevcut değildir, ancak flutikazon propiyonat plazma düzeyinde belirgin bir artış beklenmektedir. Cushing sendromu ve adrenal süpresyon vakaları bildirilmiştir. Yararları, artan sistemik kortikosteroid yan etkiler riskinden daha yüksek olmadığı sürece bu kombinasyondan kaçınılmalıdır. Sağl.kh gönüllülerde yap,lan küçük ölçekli bir çalışmada daha düşük polense sahip bir CYP3A ' ' 'törii olan ketokonazol, tek inhalasyondan sonra flutikazon propiyonat maruziyetini %150 arttırmıştır. Bu etki tek başına flutikazon propiyonata kıyasla plazma kortizol düzeyinde daha fazla düşüşe neden olmuştur. İtrakonazol gibi diğer potent CYP3A inhibitörleri ile birlikte tedavinin de, sistemik flutikazon propiyonat maruziyetini »e sistemik yan etki riskini arttırması beklenmektedir. Dikkatli olnnmas, ve bu ilaçlarla uzun süreli tedaviden mümkünse kaçınılması önerilmektedir. Salmeterol Potent CYP3A4 inhibitörleri 15 sağlıklı denekte 7 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mikrogram) ve ketokonazol (oral yolla günde bir kez 400 mg) ^ uygulanımı, plazma salmeterol maruziyetinde anlamlı bir artışa neden olmuştur (Cks 1.4 kat ve EAA 15 kat). Bu etki tek başına salmeterol ve ketokonazol tedavisine kıyasla salmeterol tedavisinin diğer sistemik yan etki insidansında (öm, QTc aralığında uzama ve palpitasyonlar) bir artışa neden olabilir. Kan basıncı, kalp hızı, kan glukoz ve kan potasyum düzeylerinde klinik açıdan anlamlı etkiler görülmemiştir. Ketokonazol ile birlikte uygulanımı, salmeterol eliminasyon yan ömrünü veya tekrarlı dozlamayla salmeterol birikimini arttırmamıştır. Ketokonazol ile eşzamanlı kullammından, tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4 inhibitörleri ile benzer bir etkileşim riskinin olmas, muhtemeldir (öm, itrakonazol, telitromisin, ritonavir). Orta düzeyde CYP 3A4 inhibitörleri 15 sağl.kh denekte 6 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mikrogram) ve eritromisin (oral yolla günde bir kez 500 mg) uygulanımı, salmeterol maruziyetinde küçük ancak istatistiksel açıdan anlamlı olmayan bir artışa neden olmuştur (Cmaks 1.4 kat ve EAA 1.2 kat). Eritromisinin birlikte uygulanımı herhangi bir ciddi yan etki ile ilişkilendirilmemiştir. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popiilasyon:İnhale kortikosteroid ile uzun süreli tedavi gören çocukların boyunun düzenli şekilde izlenmesiönerilmektedir, inhale kortikosteroid dozu, astımın etkinlik kontrolünün sürdürüldüğü en düşük doza indirilmelidir. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: C.Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)AİRPLUS inhalasyon için aerosolün doğum kontrol yöntemleri üzerine etkisi olup olmadtğma dair herhangi bir bilgi bulunmamaktadır.Gebelik dönemiSalmeterol/flutikazon propiyonat kombinasyonunun gebelikte kullanım, ile ilgili yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Kısım 5.3). insanlara yönelik potansiyel risk bilinmemektedir.Tek ilaç veya kombinasyon halindeki ilaçlarla hayvanlar üzerinde yapılan üreme toksisite çalışmaları, güçlü bir beta 2 adrenoreseptör agonistinin ve glukokortikosteroidin aşır, sistemik maruzıyet seviyelerinde beklenen fötal etkilerini açığa çıkarmıştır. Haç kullanım, ancak anneye sağlaması beklenen yarar, fetusa olan olas, bir riskten fazla ise düşünülmelidir. Bu sınıftaki ilaçlarla ilgili geniş klinik deneyim, etkilerinin terapötik dozlarla ilişkili olduğuna dair bir kanıt ortaya koymamıştır. Ne salmeterol ksinafoatın ne de flutikazon propiyonatm genetik toksisite potansiyeline sahip olduğu gösterilmiştir. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiSalmeterol ksinafoat ve flutikazon propiyonatm gebelik ve emzirme döneminde kullanımı ile ılgılı deneyimler yetersizdir. Emzirme döneminde tercihen kullanılmamalıdır. Salmeterol süte geçer. Terapötik dozlarda inhale edilen salmeterol ve flutikazon propiyonatm plazma düzeyleri çok düşüktür ve buna bağlı olarak anne sütündeki konsantrasyonların düşük olmaşı muhtemeldirBu, sütünde düşük ilaç konsantrasyonlar] ölçülen emziren hayvanlar üzerinde yapılan çalışmalarla desteklenmiştir. Üreme yeteneği/FertiliteVeri bulunmamaktadır.4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullan,mı üzerindeki etkilere ilişkin bir çalışma yapılmam,ştır. Ancak her iki ilacın farmakolojisi herhangi bir etkisi olmayacağını göstermektedir.4.8. İstenmeyen etkilerAİRPLUS salmeterol ve flutikazon propiyonat içerdiğinden, bileşiklerden her biriyle ıhşkilendirilen tipte ve şiddette yan etkiler beklenebilir. İki bileşiğin eşzamanlı uygulanmasın, takiben ek yan etki insidansı söz konusu değildir. Salmeterol/flutikazon propiyonat ile ilişkilendirilen yan etkiler aşağıda organ sistemi smıfma ve görülme sıklığına göre liste halinde sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır:Çok yaygın (>1/10), yaygm (>1/100 ila <1/10). yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Çok yaygın, yaygın ve yaygın olmayan olaylar klinik çal.şma verilerinden elde edilmiştir. Plasebo insidansı dikkate alınmamıştır. Çok seyrek olaylar pazarlama sonrası spontan verilerden elde edilmiştir. Enfeksiyonlar ve enfestasyonlarYaygın. Ağız ve boğazda kandidiyazis, pnömoni, bronşitBağışıklık sistemi hastalıklarıYaygın olmayan: Kütanöz duyarlılık reaksiyonlarıÇok seyrek: Anjiyoödem (temelde yüzde ve orofarinksde ödem), solunum semptomları (dispne ve/veya bronkospazm), anafılaktik şok dahil, anafılaktik reaksiyonlar Endokrin hastalıklarıÇok seyrek: Cushing sendromu, Cushing benzeri özellikler, adrenal süpresyonu, çocuklar ve adolesanlarda gelişin, geriliği, azalan kemik mineral yoğunluğu, katarakt, glokomMetabolizma ve beslenme hastalıklarıYaygın: Hipokalemi Çok seyrek: HiperglisemiPsikiyatrik hastalıklarÇok seyrek: Anksiyete, uyku bozukluklar, ve hiperaktivite ve iritabilite (temelde çocuklarda) dahil davranış değişiklikleriBilinmiyor: Depresyon, huzursuzluk (çoğunlukla çocuklarda) Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı Yaygın: TremorKardiyak hastalıklarYaygın: Palpitasyon Yaygın olmayan: TaşikardiÇok seyrek: Kardiyak aritmi (atrial fibrilasyon, supraventriküler taşikardi ve ekstrasistol dahil) Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok yaygın: NazofarenjitYaygın. Boğaz ırrıtasyonu, ses kısıklığı/disfoni, sinüzit, pnömoni (KOAH'lı hastalarda) Çok seyrek: Paradoksikal bronkospazm Deri ve deri altı doku hastalıklarıYaygın: KontüzyonlarKas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Kas krampları, travmatik kırıklar Çok seyrek: Artralji, miyalji4.9. Doz aşımı ve tedavisiAİRPLUS ile doz aşımına ilişkin klinik çalışmalardan elde edilmiş veri yoktur, ancak her iki madde ile doz aşımına yönelik veriler aşağıda sunulmaktadır:Salmeterol doz aşımının belirti ve semptomlar, tremor, baş ağrısı ve taşikardidir. Tercih edilen antıdotlar, bronkospazm öyküsü olan hastalarda dikkatli şekilde kullanılması gereken kardiyoselektif beta bloker maddelerdir. AİRPLUS tedavisi ilacın beta agonist bileşeni nedeniyle kesilirse, uygun replasman steroid tedavisinin sağlanması düşünülmelidir. Buna ek olarak hipokalemi meydana gelebilir ve potasyum replasmanı düşünülmelidir. Akut: Önerilenden yüksek flutikazon propiyonat dozlarının akut inhalasyonu adrenal ^ fonksiyonunda geçici süpresyona neden olabilir. Adrenal fonksiyonu plazma kortizol ölçümleri ile doğrulandığı gibi birkaç günde normale döndüğünden bu doz acil tedavi gerektirmemektedir, inhale flutikazon propiyonat ile kronik doz aşım, adrenal süpresyon riskini doğurmaktadır. Adrenal rezervin izlenmesi gerekli olabilir. Flutikazon propiyonat ile doz aşım, vakalarında semptom kontrolü için uygun dozda AİRPLUS tedavisine yine de devam edilebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapotık grup: Selektif Beta 2 adrenerjik reseptör agonistleri (inhale)Kortikosteroidler (inhale) ATC kodu: R03AK06 Salmeterol/flutıkazon propiyonat kombinasyonu astım klinik çalışmaları Uzun süreli astımlı 3416 erişkin ve adolesanda 12 aylık bir çalışmada (Optimal Astım Kontrolünün Sağlanmas,, OAKS) astım tedavisi hedeflerinin erişilebilir olup olmadığının belirlenmesi için, tek başına inhale kortikosteroidler (Flutikazon Propiyonat) ile salmeterol/flutikazon propiyonat kombinasyonunun etkinlik ve güvenilirliği karşılaştırılm.ştır. Tedavi dozu 1Toplam kontrol sağlanana veya çal.şma ilacının en yüksek dozuna erişilene kadar 12 haftada bir arttırılmıştır. OAKS, salmeterol/flutikazon propiyonat kombinasyonu verilen daha fazla hastada, tek başına inhale kortikosteroid (İKS) verilen hastalara kıyasla astım kontrolü sağlandığı ve bu kontrolün daha düşük kortikosteroid dozunda elde edildiğini göstermiştir. İyi kontrol altına alınmış astım, tek başına İKS'ye kıyasla, salmeterol/flutikazon propiyonat kombinasyonu ile daha hızlı şekilde elde edilmiştir. İlk bireysel iyi kontrol altına alınım; haftanın elde edilmesi için deneklerin %50'sindeki tedavi süresi salmeterol/flutikazon propiyonat kombinasyona için 16 gün ve İKS grubnnda 37 gündü. Daha önce steroid tedavisi görmeyen bir hasta alt gmbunda bireysel iyi kontrol altına alınmış haftaya kadar geçen süre salmeterol/flutikazon propionat kombinasyonu ile 16 gün olurken, İKS ile 23 gündü. Genel çalışma bulgulan aşağıdakileri göstermiştir:
Çok Merkezli Salmeterol Astım Araştırma Çalışması (SMART) S MART çok merkezli, randomize, çift kör, plasebo kontrollü, paralel gruplu 28 haftalık bir çalışma olup ABD'de yapılan, hastanın normal astım tedavisinde ek olarak 13.176 hastanın salmeterol (günde iki kez 50 pg) ve 13.179 hastanın plasebo grubnna atandığı bir çalışmaydı. >12 yaşında olan, astım tanısı konulan ve astım ilacı kullanmakta olan (ancak bir UESBA değil) hastalar çalışmaya dahil edilmiştir. Çalışmaya girişte başlangıçta İKS kullanımı kaydedilmiş, ancak çalışmada buna gerek duyulmamıştır. SMART çalışmasında primer sonlanma noktası,' solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olayların kombine sayısıydı.
S MART Çalışmasında Başlangıçta inhale S.eroidlerle ilişkili Temel Bulgular: Sekonder Sonlanma Noktaları f
veya yaşam, tehdit edici deneyim, tüm nedenlere bağlı mortalite veya tüm nedenlere bağlı hastaneye yatma sekonder sonlanma noktalar,, tüm popülasyonda istatistiksel anlamhlığa erişmemiştir. KOAH Kısa etkili beta 2 agonistlerine % 10 reversibilite kısıtlaması olmayan semptomatik KOAH hastaları: Alt, ay boyunca yürütülen plasebo kontrollü klinik çahşmalar, 50/250 mikrogram ve 50/500 mıkrogram'lık salmeterol/flutikazon propiyonat kombinasyonunun düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımım anlamlı derecede azalttığın, göstermiştir. Ayn, zamanda hastalar,n sağlık durumunda da anlamlı derecede düzelme olmuştur. Kısa etkili beta 2 agonistlerine % 10'dan daha az reversibilite gösteren semptomatik KOAH hastaları: 6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram salmeterol/flutikazon propiyonat kombinasyonunun düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecede düzelttiğini, nefes darlığın, ve rahatlatıcı ilaç kullanımım anlamlı derecede azalttığını göstermiştir. 12 aylık periyod boyunca KOAH alevlenme riski ve ilave oral kortikosteroid ihtiyacı anlamlı derecede azalmıştır. Ayn. zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur. 50/500 mikrogram salmeterol/flutikazon propiyonat kombinasyonu hem tedavi sırasında sigara içen, hem dc sigarayı bırakmış hastalarda akciğcr fonksiyonunu ve sağlık durumunu düzeltmede ve KOAH alevlenme riskini azaltmada etkili bulunmuştur. TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru): TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram salmeterol/flutikazon propiyonat kombinasyonu kuru toz inhaleri/inhalasyon için aerosolü, günde 2 kez 50 mikrogram salmeterol kuru toz inhaleri/inhalasyon için aerosolü, günde 2 kez 500 mikrogram FP (flutikazon propiyonat) kuru toz inhaleri/ inhalasyon için aerosolü veya plasebo ile yapılan tedavinin tüm nedenlere bağlı ölümler üzerindeki etkisini değerlendirmek için yapılan 3 yıllık bir çalışmadır. Başlangıç (bronkodilatörden önce) FEVİ'İ beklenen normal değerin % «Tından az olan orta- şiddetli ve şiddetli KOAH hastaları çift-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzun etkili bronkodilatörler ve uzun süre sistemik kortikosteroidler d.ş.nda, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık hayatta kalma durumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir. Başlıca sonlanma noktası, plaseboya kıyasla salmeterol/flutikazon propiyonat kombinasyonu için 3 yılda tüm nedenlere bağlı ölümlerin azaltılmasıdır (Tablo 1). Tablo 1
7 .-1- -1-1__1 birincil etkinlik karşılaştırılması üzerinde yapılmış 2 ara analizin sigara içme durumu açısından Salmeterol/flutikazon propiyonat kombinasyonu, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini % 17.5 oranında azaltmıştır (Risk Oranı 0.825 (% 95 GA 0.68, 1.00, p = 0.052; tümü ara analizler için ayarlanmıştır). Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamanda herhangi bir nedenden dolayı şekillenen ölümlerde, salmeterol ile % 12 azalma (p = 0.180) ve FP ile % 6 artış (p = 0.525) olmuştur (Tablo 1). Cox'un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde % 19 azalma gösteren salmeterol/flutikazon propiyonat kombinasyonu için 0.811'lik (% 95 GA 0.670, 0.982, p - 0.031) bir risk oranı olduğunu göstermiştir. Model önemli faktörler (sigara içme durumu, yaş, cinsiyet, bölge, başlangıç FEVİ ve Vücut Kitle İndeksi) için ayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur (Tablo 1). Üç yıl içinde KOAH'a bağlı nedenlerden dolay, ölen hastaların yüzdesi plasebo için % 6.0, salmeterol için % 6.1, FP için % 6.9 ve salmeterol/flutikazon propiyonat kombinasyonu için % 4.7'dir (Tablo 1). Plaseboya kıyasla salmeterol/flutikazon propiyonat kombinasyonu, orta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 aras.nda; p <0.001) oran.nda azaltm.şt.r, Salmeterol/flutikazon propiyonat kombinasyonu alevlenme oranını, salmeterol ile karşılaştırıldığında % 12 (% 95 GA: % 5 ve % 19 arasında; p = 0.002), FP ile karşılaştırıldığında da /o 9 (% 95 GA: % 1 ve % 16 arasında; p = 0.024) oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla % 15 (% 95 GA: % 7 ve % 22 arasında; p <0.001) ve % 18 (% 95 GA: % 11 ve % 24 arasında; p <0.001) omunda azaltmıştır. St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca salmeterol/flutikazon propiyonat kombinasyonu ile sağlanan ortalama düzelme plaseboya kıyasla - 3.1 birim (% 95 GA: - 4.1 ve - 2.1 arasında; p <0.001), salmeterole kıyasla - 2.2 birim (p <0.001) ve FP'ye kıyasla - 1.2 birimdir (p = 0.017). Üç yıllık tedavi süresi boyunca, FEVİ değerleri salmeterol/flutikazon propiyonat kombinasyonu ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir (3 yıl boyunca ortalama fark 92 mİ, % 95 GA: 75 - 108 mİ; p <0.001). FEVİ M düzeltmede salmeterol/flutikazon propiyonat kombinasyonu salmeterolden veya FP'den daha etkilidir (salmeterol için ortalama fark 50 mİ, p <0.001 ve FP için 44 mL'dir, p <0.001). Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için % 12.3, salmeterol için % 13.3, FP için «/o 18.3 ve salmeterol/flutikazon propiyonat kombinasyonu için % 19.6'dır (salmeterol/flutikazon propiyonat kombinasyonunun plaseboya karşı risk oranı: 1.64, % 95 GA: 1.33 ve 2.01 arasında, p <0.001). Pnömoni ile ilişkili ölümlerde artış olmamıştın tedavi sırasında birincil olarak pnömoniye bağlı olduklar, düşünülen ölümler plasebo için 7,salmeterol için 9, FP için 13 ve salmeterol/flutikazon propiyonat kombinasyonu için 8 olarak tespit edilmiştir. Kemik kırılma olasılığmda anlamlı farklılık yoktur (plasebo % 5.1, salmeterol % 5.1, FP % 5.4 ve salmeterol/flutikazon propiyonat kombinasyonu % 6.3; plaseboya karşı salmeterol/flutikazon propiyonat kombinasyonu için risk oranı: 1.22, % 95 GA: 0.87 ve 1.72 arasında, p = 0.248). Göz bozuklukları, kemik bozuklukları ve hipotalamus-hipofiz-adrenal eksen bozuklukları ile ilgili advers olayların insidansı düşüktür ve tedaviler arasında farklılık gözlenmemiştir. Salmeterol alan tedavi gruplarında kardiyak advers olaylarında artış olduğuna dair kanıt yoktur. Etki mekanizması: AİRPLUS, farklı etki şekline sahip salmeterol ve flutikazon propiyonat içermektedir. İki etkin maddenin ilgili etki mekanizmaları aşağıdaki tartışılmaktadır. . Salmeterol: Salmeterol reseptörün sekonder bağlanma bölgesine bağlanan uzun bir yan zincire sahip selektif uzun etkili (12 saat) bir beta 2 adrenoseptör agonisttir. Salmeterol klasik kısa etkili beta 2 agonistlerin önerilen dozlarına kıyasla, en az 12 saat süren daha uzun süreli bronkodilatasyon sağlamaktadır. Flutikazon propiyonat: Önerilen dozlarda inhalasyon yoluyla verilen flutikazon propiyonat, akciğerlerde bir glukokortıkoıd antıenflamatuvar etkiye sahiptir ve bu etki, kortikosteroidler sistemik yolla uygulandığında görülenden daha az yan etkiyle semptomlarda ve astım alevlenmelerinde azalma sağlamaktadır. 5.2. Farmakokinetik özellikler Genel özelliklerSalmeterol ve flutikazon propiyonat inhalasyon yoluyla kombinasyon halinde uyguland,ğ,nda her bileşenin farmakokinetiği, ilaçlar ayr, ayn uygulandığında gözlenene benzerdi. Bu nedenle farmakokinetik açıdan her bileşik ayrı ayrı ele alınabilir.Salmeterol: Emilim:Salmeterol akciğerde lokal olarak e,ki eder, bu nedenie plazma düzeyleri terapötik etkinin bir belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra fok düşük plazma konsantrasyonlar, gösterdiği İçin (yak|aş,k 200 pg/m, veya daha ^ plazmadakj i|aç mi|(tannm tayın, tekmk olarak zor olduğundun salmeterolün farmakokinetiği ile ilgili sadeee sm.rl, veriler bulunmutodır. S.Imeterol ksinafoatm düzenli kullanımın, tnkiben, hldroksinnftoik asit sistemik dolaşımda tay,n ed.lebilir ve kararlı durum konsantrasyonla yaklaşık 100 ng/ml'ye ulaşır Bu konsantrasyonlar, toksisite çalışmalarında gözlenen kararlı durum konsantrasyonlarından 1000 kez daha düşüktür. Hava yolu t.kan.khğ, olan hastalarda uzun süreli düzenli kullanımında (12 aydan fazla) herhangi bir zararlı etki görülmemiştir. Dağılım:Salmeterolün plazma proteinlerine bağlanma oranı % 96'dır. Biyotransformasvon In vitro bir çalışma salmeterolün sitokrom P450 (CYP3A4) tarafından büyük oranda a-hıdroksısalmeterole (alifatik oksidasyon) metabolize edildiğini göstermiştir. Eliminasvon-Eliminasyon yarılanma ömrü 5.5 saattir. Salmeterol %60 dışk, ile %25 idrar ile itrah edilir. Do ğusallık/Doğrusal olmavan durum-Veri bulunmamaktadır.Flutikazon propiyonat: Emilim:Sağlıklı deneklerde inhalasyon yoluyla alman tek doz flutikazon propiyonatm mutlak bıyoyararlanımı, kullanılan inhalasyon cihazına göre nominal dozun yaklaşık %5-lH arasında değişmektedir. Ast,mİ, hastalarda inhale flutikazon propiyonata sistemik maruziyetin daha düşük bir düzeyi gözlenmiştir. Sistemik emilim temelde akciğerlerde meydana gelmekte olup, ilk başta hızlı ve sonrasında uzun sürelidir. İnhale dozun kalan, yutulabilir ancak düşük suda çözünürlük ve presistemik metabolizma nedeniyle sistemik maruziyete minimum katkıda bulunur ve oral biyoyararlanımımn %1'den az olmasını sağlar. Dağılım:Flutikazon propiyonat kinetiği yüksek plazma klirensi (1150 mL/dak), kararlı durumda yüksek dağılım hacmi (yaklaşık 300 L) ve yaklaşık 8 saatlik terminal yarı ömürle karakterizedir. Plazma proteinine bağlanma oranı %91'dir. Biyotransformasvon Flutikazon propiyonat sistemik dolaşımdan çok hızlı elimine edilmektedir. Temel yolak, sitokrom P450 enzim CYP3A4 tarafından inaktif karboksilik asit metabolitine metabolizasyondur. Ayrıca feçeste tanımlanmamış diğer metabolitler tespit edilmektedir. Eliminasvon:Flutikazon propiyonatm renal klirensi önemsiz düzeydedir. Dozun %5'inden daha azı idrarda temelde metabolitler olarak atılmaktadır. Dozun büyük bir bölümü feçeste metabolitler ve değişmemiş ilaç olarak atılmaktadır. Doğrusallık/Doğrusal olmavandurum-Artan inhale dozla sistemik maruziyette doğrusal bir artış söz konusudur. 5.3. Klinik öncesi güvenlilik verileriHayvanlarda ayrı ayrı verilen salmeterol ksinafoat ve flutikazon propiyonat çalışmalarında görülen insanlarda kullanıma yönelik tek güvenilirlik sorunu, aşırı farmakolojik etkilerle ilişkilendirilmiştir. Hayvan üreme çalışmalarında glukokortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonları) neden olduğu gösterilmiştir. Bununla birlikte bu hayvandeneylerinin önerilen dozlar,n verildiği insanlar için anlaml, oldnğu düşünülmemektedir. Salmeterol ksinafoat ile yap,lan hayvan çalışmalar, sadece yüksek maruziyet düzeylerinde embriyofetal toksisite göstermiştir. Birlikte uygulan,m, takiben bilinen glukokortikoid kaynakl, anomalilerle ilişkilendirilen dozlarda, s,çanlarda artan transpoze umblikal arter vc ossipital kemikte eksik osifikasyon insidans, tespit edilmiştir. Kloroflorokarbon (CFC) olmayan itici norf]uranın iki yıllık periyotlarda günlük maruziyet uygulanan çok çeşitli hayvan türlerinde, hastaların bulunması muhtemel düzeylerden çok daha yüksek buhar konsantrasyonlarında toksik etki sergilemediği gösterilmiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiHFA134a6.2.GeçimsizliklerBilinen geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcakl.ğında saklayınız. Direkt gün ,ş,ğmdan ve donmaktan koruyunuz Aerosol kutusu delinmemcli, boş olsa bile k.nlmamah, ateşten uzak tutulmahd.r,6.5. Ambalajın niteliği ve içeriğiAİRPLUS 25/250 mcg inhalasyon için aerosol, 120 dozluk aerosol tüplerde karton kutuda, kullanma talimatı ile beraber ambalajlanır.6.6.Beşeri ftbbi üründen arta kalan maddelerin in.has. ve diğer özel önlemlerKullan,İmam,ş olan ürünler ya da at,k materyaller T.bbi Atıkta Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklar,nın Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİNeutec İnhaler İlaç San. Ve Tic. A.Ş.Sakarya 1. Organize Sanayi Bölgesi 2. Yol No:3 Arifiye / Sakarya Telefon numarası: 0850 201 23 23 Faks numarası: 0212 482 24 78 e-mail: [email protected] 8. RUHSAT NUMARASI (LARI)253/369. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 18.09.2013 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ271 Toplam astım kontrolü; semptom yok, KESBA kullanımı yok, beklenen akciğer fonksiyonunun >%80'i veya gece uyanmaları yok, alevlenme ve tedavide bir değişikliği gerektiren yan etkiler yok. Bu çalışmadaki bulgular günde iki kez salmeterol/flutikazon propiyonat 50/100 mikrogram dozunun, hızlı astım kontrolünün gerekli olduğu düşünülen orta şiddette dirençli astım hastalarında ilk idame tedavisi olarak değerlendirilebileceğini düşündürmektedir. |
İlaç BilgileriAirplus 25/250mcg İnhalasyon İçin AerosolEtken Maddesi: Salmeterol,flutikazon Propiyonat Atc Kodu: R03AK06 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.