Evorabin 1 mg /1 ml İnfüzyon İçin Konsantre Çözelti İçeren Flakon Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Diğer Kanser İlaçları » Platin » Sisplatin KISA URUN biLGİSİ1.BEŞERITıBBıURUNUNADIEVORABİN 1 mg/1 mL İnfüzyon İçin Konsantre Çözelti İçeren Flakon2.KALITATIF VE KANTİTATIF BİLEŞİMEtkin madde:Klofarabin20.0 mgYardımcı madde(ler):S odyum klorür180.0 mgYardımcı maddeler için bkz. 6.1. 3.FARMASÖTIK FORMFlakon içerisinde renksiz ve berrak infüzyon çözeltisi.4.KLINIK ÖZELLIKLER4.1.Terapötik endikasyonlarEVORABİN, en az iki farklı kemoterapi rejimine dirençli veya bu rejimler sonrası nüks eden ve kalıcı yanıt sağlayabilecek başka bir tedavi seçeneği olmayan çocukluk çağı (< 21 yaş) akut lenfoblastik lösemi (ALL) tedavisinde kullanılır. İlacın güvenliliği ve etkililiği ilk tanı aldığında 21 yaş ve altında olan hastalarda değerlendirilmiştir.4.2.Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Tedavi, akut lösemili hastaların tedavisinde uzmanlaşmış bir hekim tarafından başlatılmalı ve kontrol edilmelidir.Yetişkinler ^yaşlılar dahil);Yetişkinlerde klofarabinin etkililiği ve güvenliliğini belirlemek için yeterli veri yoktur.Uygulama şekli:Uygulamadan önce ilacın seyreltilmesi ile ilgili yönergeler bölüm 6.6'da açıklanmıştır. Tavsiye edilen doz intravenöz infüzyon yoluyla uygulanmalıdır, aynı zamanda devam eden klinik çalışmalarda santral venöz katater aracılığıyla da uygulanmıştır. Klofarabin başka ilaçlarla karıştırılmamalı veya aynı intravenöz yoldan uygulanmamalıdır.Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Kreatin klerensi azalmış hastalarda klofarabinin birikebileceğini gösteren sınırlı bir veri mevcuttur. Klofarabin şiddetli böbrek yetmezliği olan hastalardakontrendikedir ve hafif veya orta dereceli böbrek yetmezliği olanlarda dikkatle kullanılmalıdır. Orta dereceli böbrek yetmezliği olan (kreatinin klirensi 30 - <60 mL/dk) hastalarda %50'lik bir doz azaltımı gerekir. Karaciğer yetmezliği:Karaciğer yetmezliği olan (serum bilirubin > 1.5 x ULN artı AST ve ALT > 5 x ULN) hastalarla ilgili herhangi bir deneyim yoktur ve karaciğer toksisite açısından potansiyel olarak hedef bir organdır.Pediyatrik popülasyon:Tavsiye edilen doz 52 mg/m2 vücut yüzey alanına göre hesaplanıp 5 ardışık gün boyunca 2 saatlik intravenöz infüzyonla uygulanır. Vücut yüzey alanı hastanın her kür öncesinde tespit edilen mevcut boyu ve ağırlığı kullanılarak hesaplanır. Tedavi kürleri normal hematopoez sağlandıktan (örn. MNS (mutlak nötrofil sayısı) > 0.75 x 109/L) ve organ işlevi temel düzeyine döndükten sonra her 2 ila 6 haftada bir tekrarlanır (önceki kürün başlangıç gününden itibaren). Belirgin toksisitelerin görüldüğü hastalarda % 25'lik bir doz azaltımı yapılmalıdır. 3 tedavi küründen daha uzun süre klofarabin kullanan hastalardaki deneyimler henüz sınırlıdır.Tedaviye yanıt oluşan hastaların büyük bir çoğunluğunda yanıt bir veya iki tedavi kürü sonunda elde edilir. Bu nedenle 2 tedavi kürü sonunda hematolojik ve/veya klinik gelişim göstermeyen hastalarda tedavinin devamıyla ilişkili potansiyel yarar ve zararlar tedaviyi uygulayan hekim tarafından değerlendirilmelidir. 20 kg altındaki çocuklar:Anksiyete ve iritabilite semptomlarını azaltmak ve aşırı yüksek klofarabin konsantrasyonlarının oluşmasını engellemek için 2 saatin üstünde bir infüzyon süresi düşünülmelidir.1 yaşın altındaki çocuklar:İnfantlarda klofarabinin farmakokinetiği, güvenliliği veya etkililiği ile ilgili bir veri yoktur. Bu nedenle 1 yaşın altındakiler için güvenli ve etkili bir doz önerisi henüz yoktur.Geriyatrik popülasyon:Geriyatrik hastalarda klofarabinin etkililiği ve güvenliliğini belirlemek için yeterli veri yoktur.Hematolojik toksisite gözlenen hastalarda doz azaltımıBir tedavi kürü başladıktan 6 hafta sonra MNS'de düzelme olmuyorsa, refrakter hastalık ihtimalinin saptanması için kemik iliği aspirasyonu/ biyopsisi yapılmalıdır. Eğer inatçı lösemi kesin değilse gelecek kür için dozun MNS > 0.75 x 109/L'ye düzeldikten sonra uygulanması ve bir önceki küre göre %25 azaltılması önerilir. Hastalarda son kürün başlangıcı sonrasında 4 haftadan daha uzun süre MNS < 0.5 x 109/L olursa, gelecek kürde dozun yaklaşık %25 düşürülmesi tavsiye edilir.Hematolojik olmayan toksisite gözlenen hastalarda doz azaltımıEnfeksiyöz olaylar:Hastada klinik olarak belirgin bir enfeksiyon gelişirse, klofarabin tedavisi enfeksiyon klinik olarak kontrol altına alınana kadar kesilmelidir. Bundan sonra tedaviye tam dozla tekrar başlatılabilir. İkinci bir klinik olarak belirgin enfeksiyondurumunda klofarabin tedavisi enfeksiyon klinik olarak kontrol altına alınana kadar kesilmelidir ve tekrar başlatılması gerektiğinde doz %25 azaltılabilir. Enfeksiyon dışı olaylar:Hastada bir veya daha fazla şiddetli toksisite gelişirse (bulantı ve kusma dışındaki ABD Ulusal Kanser Enstitüsü [NCI] Genel Toksisite Kriteri [CTC] Evre 3 toksisiteler), tedavi toksisitelerde başlangıç parametreleri düzeyine kadar bir gerileme gerçekleşene veya şiddetli olmadığı düzeye ininceye kadar ve klofarabin tedavisinin devamı ile elde edilecek yarar bu tip risklerden daha fazla ise ertelenmelidir. Sonrasında klofarabin dozunda bir %25'lik azaltım önerilmektedir.Hastada ikinci bir sefer aynı şiddette toksisite gelişirse, tedavi toksisitelerde başlangıç parametreleri düzeyine kadar bir gerileme gerçekleşene veya şiddetli olmadığı düzeye ininceye kadar ve klofarabin tedavisinin devamı ile elde edilecek yarar bu tip risklerden daha fazla ise ertelenmelidir. Sonrasında klofarabin dozunda %25'lik ek bir azaltım daha önerilmektedir. Üçüncü bir sefer ciddi toksisite gelişen, 14 gün içinde düzelmeyen (harici durumlar yukarıdadır) veya hayatı-tehdit edici toksisite ya da sınırlayıcı toksisite gelişen (ABD NCI CTC Evre 4 toksisite) herhangi bir hastada klofarabin tedavisi kesilmelidir. 4.3.KontrendikasyonlarEVORABİN'in aşağıdaki hastalarda kullanımı kontrendikedir:-Klofarabin ve içeriğindeki herhangi bir maddeye karşı aşırı duyarlılığı olanlar. -Ciddi renal yermezliği veya ciddi hepatik bozukluğu olanlar. Klofarabin tedavisi öncesinde, tedavi devam ederken veya tedavi sonrasında emzirme yapılmamalıdır. 4.4.Özel kullanım uyarıları ve önlemleriEVORABİN hematolojik ve hematolojik olmayan toksisite potansiyeli taşıyan, güçlü bir antineoplastik ajandır.Klofarabin tedavisi uygulanacak hastalarda aşağıdaki parametreler yakından izlenmelidir: -Tam kan ve platelet sayısı, sitopeni gelişen hastalarda daha sıklıkla olmak üzere, düzenli aralıklarla kontrol edilmelidir. -Aktif tedavi öncesinde, sırasında ve sonrasında renal ve hepatik işlevler. Kreatinin veya bilirübin düzeylerinde ani yükselmeler oluşursa klofarabin derhal kesilmelidir. -Solunum durumu, kan basıncı, sıvı dengesi ve ağırlık ardışık 5 günlük klofarabin tedavisi boyunca ve sonrasında kontrol edilmelidir. Kemik iliği supresyonu beklenmelidir. Bu genellikle geri dönüşlüdür ve doza bağlı olduğu görülür. Klofarabin ile tedavi edilen hastalarda nötropeni, anemi ve trombositopeni dahil ciddi kemik iliği supresyonu gözlenmiştir. Bununla birlikte klinik çalışmalardaki çoğu hastada tedavinin başlangıcında lösemi gibi hematolojik bozukluklar mevcuttur. Bu hastalarda daha önce var olan immün yetmezlik durumu ve klofarabin nedenli uzamış nötropeni sebebiyle hastalar fatal sonuç potansiyeli olan şiddetli sepsis dahil şiddetli fırsatçı reaksiyonlar açısından artmış risk altındadır. Hastalar belirtiler ve semptomlar açısından izlenmeli ve derhal tedavi edilmelidir. Klofarabin tedavisi süresince hastalarda, nötropenik kolit ve C. Difficilekolit dahil enterokolit oluşumu raporlanmıştır. Bu tedavinin 30 günü içerisinde ve kombinasyon tedavi uygulanması halinde daha sık oluşur.Klofarabin uygulaması periferal lösemi hücrelerinde hızlı bir düşüşle sonuçlanır. Klofarabin tedavisi uygulanacak hastalar Sistemik Enflamatuvar Yanıt Sendromu (SIRS), kapiler sızıntı sendromu ve/veya organ disfonksiyonuna dönüşebilecek olan tümör lizis sendromu ve sitokin salımına (örn. taşipne, taşikardi, hipotansiyon, pulmoner ödem) belirti ve semptomlarına karşı incelenmeli ve değerlendirilmelidir. -Hiperürisemi (tümör lizis) bekleniyorsa, profilaktik allopurinol uygulaması düşünülmelidir. -Tümör lizis ve diğer olayların etkilerini azaltmak için 5 günlük klofarabin uygulaması süresince hastalara intravenöz sıvı uygulanmalıdır. -Profilaktik steroid uygulaması (örn. 100 mg/m2 hidrokortizon 1-3 gün) SIRS veya kapiler sızıntı belirti ve semptomlarını önlemede yararlı olabilir. Hastalarda SIRS, kapiler sızıntı sendromu veya ani organ disfonksiyonu ile ilgili erken belirti ve semptomlar gözlenirse klofarabin uygulaması derhal kesilmeli ve uygun destekleyici önlemler alınmalıdır. Bunun yanı sıra 5 günlük uygulama süresince hastada herhangi bir nedenden dolayı hipotansiyon gelişirse klofarabin tedavisi kesilmelidir. Klofarabin ile tedavinin devamı genellikle düşük dozlarda olmak üzere, hasta stabilize haldeyse ve organ fonksiyonları normale dönmüşse düşünülebilir. Klofarabin tedavisine yanıt oluşan hastaların büyük bir kısmında 1 veya 2 tedavi kürü sonrasında yanıt elde edilir. Bu nedenle 2 tedavi kürü sonunda hematolojik veya klinik gelişim göstermeyen hastalarda tedaviye devam etmenin oluşturacağı potansiyel yarar ve zararlar tedaviyi uygulayan hekim tarafından değerlendirilmelidir. Kalp hastalığı olanlar ve bunun için kan basıncını veya kardiyak işlevi etkilediği bilinen ilaç tedavisi alanlar klofarabin tedavisi boyunca dikkatle izlenmelidir. Renal yetmezliği olan (klinik çalışmalarda "serum kreatinin > 2 x ULN yaşa göre" olarak tanımlanmıştır) pediyatrik hastalarla ilgili hiçbir klinik deneyim yoktur ve klofarabin çoğunlukla böbrekler aracılığıyla atılır. Farmakokinetik veriler düşük kreatinin klirensi olan hastalarda klofarabinin birikebileceğini belirtmektedir. Bu nedenle klofarabin hafif veya orta dereceli renal yetmezliği olan hastalarda dikkatle kullanılmalıdır. Şiddetli renal yetmezliği olan veya böbrek replasman tedavisi uygulanan hastalarda klofarabinin güvenlilik profili tespit edilmemiştir. Renal toksisite ile ilişkilendirilen ve NSAİİ, amfoterisin B, metotreksat, aminosid, organoplatin, foskarnet, pentamidin, siklosporin takrolimus, asiklovir ve valgansiklovir gibi tübüler sekresyonla atılan ilaçlarla eş zamanlı kullanımından, özellikle 5 günlük klofarabin uygulaması süresince kaçınılmalıdır, tercihen nefrotoksik olmadığı bilinen tıbbi ürünler verilmelidir. Klofarabin uygulanan hastalarda kusma ve diyare görülebilir; bu nedenle dehidratasyonu önleyici önlemler alınması önerilir. Hastalar sersemlik, bayılma nöbeti veya idrar çıkışında azalma gözlenmesi halinde hastaneye başvurmaları konusunda yönlendirilmelidir. Profilaktik anti-emetik ilaçların kullanımı düşünülmelidir. Hepatik yetmezliği olan (serum bilirübin >1.5 x ULN artı AST ve ALT > 5 x ULN) hastalarla ilgili hiçbir deneyim yoktur ve karaciğer toksisite için potansiyel hedef organdır. Bu nedenle hafif ve orta dereceli hepatik yetmezliği olan hastalarda klofarabin dikkatle kullanılmalıdır. Hepatik toksisite ile ilişkilendirilen ilaçlarla klofarabinin eş zamanlı kullanımından mümkün olduğunca kaçınılması önerilir. Eğer hastada > 4 haftadan uzun süren Evre 4 nötropeni hematolojik toksisite gelişirse, bir sonraki kürde doz %25 düşürülmelidir. Üçüncü defa şiddetli hematolojik olmayan toksisite (ABD NCI CTC Evre 3 toksisite) deneyimleyen, şiddetli toksisitesi 14 gün içinde düzelmeyen (bulantı/kusma hariç) veya hayatı-tehdit edici toksisite ya da sınırlayıcı toksisite gelişen (ABD NCI CTC Evre 4 toksisite) herhangi bir hastada klofarabin tedavisi kesilmelidir. Daha önce hematopoetik kök hücre nakli (HSCT) uygulanan hastalar etoposid (100 mg/m2) ve siklofosfamid (440 mg/m2) ile eş zamanlı kullanılan klofarabin (40 mg/m2) tedavisini takiben veno-oklüzif hastalığı düşündüren yüksek hepatotoksisite riski altında olabilir. Hepatotoksik olaylar, relapslı veya refrakter akut lösemili pediyatrik hastalar üzerinde klofarabinin devam eden bir Faz 1/2 kombinasyon çalışmasında bildirilmiştir. Klofarabinin 3 tedavi küründen fazla uygulanmasının etkililiği ve güvenliliği ile ilgili halihazırda sınırlı sayıda veri mevcuttur. EVORABİN her flakonunda 3,1 mmol (ya da 71,34 mg) sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBugüne kadar klofarabin ile ilgili resmi bir etkileşim çalışması yürütülmemiştir. Bununla birlikte diğer ilaçlarla veya laboratuvar testleriyle klinik olarak anlamlı bilinen hiçbir etkileşimi yoktur.Klofarabin sitokrom P450 (CYP) enzim sistemi ile saptanabilir düzeyde metabolize edilmemektedir. Bu nedenle, sitokrom P450 enzimlerini indükleyen veya inhibe eden aktif maddelerle etkileşim oluşturması beklenmez. Bununla birlikte klofarabinin 52 mg/m2'lik günlük intravenöz infüzyonu sonrasında oluşan plazma konsantrasyonlarında majör 5 insan CYP formlarından (1A2, 2C9, 2D6 ve 3A4) hiçbirini inhibe etmesi veya bunların içindeki iki izoformu indüklemesi (1A2 ve 3A4) de beklenmez. Sonuç olarak bu enzimlerin substratı olarak bilinen aktif maddelerin metabolizmasını değiştirmesi beklenmez. Klofarabin büyük oranda böbrekler aracılığıyla atılır. Bu nedenle renal toksisite ile ilişkili olan tıbbi ürünler ve NSAİİ, amfoterisin B, metotreksat, aminosid, organoplatin, foskarnet, pentamidin, siklosporin takrolimus, asiklovir ve valgansiklovir gibi tübüler sekresyonla atılan ilaçlarla eş zamanlı kullanımından, özellikle 5 günlük klofarabin uygulaması süresince kaçınılmalıdır. Karaciğer toksisite açısından potansiyel hedef organdır. Bu nedenle hepatik toksisite ile ilişkilendirilen tıbbi ürünlerle eş zamanlı kullanımından mümkün olduğunca kaçınılmalıdır. Kan basıncını veya kardiyak işlevi etkilediği bilinen tıbbi ürünleri kullanan hastalar klofarabin tedavisi süresince yakından izlenmelidir. 4.6.Gebelik ve Laktasyon Genel tavsiyeGebelik kategorisi D'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar tedavi süresince etkili bir kontrasepsiyon yöntemi kullanmalıdırlar.Bunun yanı sıra seksüel olarak aktif erkekler de tedavi süresince etkili bir kontrasepsiyon yöntemi kullanmalıdırlar. Gebelik dönemiKlofarabinin gebelerde kullanımı ile ilgili herhangi bir veri yoktur. Hayvanlarda yapılan çalışmalarda teratojenite dahil üreme toksisitesi gösterilmiştir. Klofarabin gebelik döneminde kullanıldığında ciddi doğum defektlerine neden olabilir. Bu nedenle EVORABİN gebelik döneminde, özellikle ilk trimester süresince, kullanımı mutlak suretle gerekmedikçe (örn. anneye olan potansiyel yararı fetüse olan yararından fazlaysa) kesinlikle kullanılmamalıdır. Eğer hasta klofarabin ile tedavi ederken hamile kalırsa, ilacın fetüs üzerinde oluşturabileceği potansiyel zarar ile ilgili bilgilendirilmelidir.Laktasyon dönemiKlofarabin veya metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Klofarabinin süte atılımı hayvanlar üzerinde çalışılmamıştır. Bununla birlikte yenidoğanda ciddi yan etki oluşma potansiyeli nedeniyle emzirme tedavi öncesinde, sırasında ve sonrasında klofarabin uygulaması kesilmelidir.Üreme yeteneği/FertiliteFare, rat ve köpeklerin erkek üreme organlarında ve dişi farelerin üreme organlarında toksisiteler dozla ilgili toksisiteler gözlenmiştir. Klofarabin tedavisinin insan fertilitesi üzerine olan etkileri bilinmediğinden, uygun bir döneme kadar hastalar üreme ile ilgili planlamalarını ertelemelidir.4.7.Araç ve makine kullanımı üzerindeki etkilerKlofarabinin araç ve makine kullanımı üzerindeki etkilerini inceleyen herhangi bir çalışma yapılmamıştır. Bunun yanı sıra hastalara sersemlik, baş dönmesi veya bayılma gibi yan etkiler gözlemleyebilecekleri bildirilmeli ve bu tip durumlar söz konusunda olduğunda araç ve makine kullanmamaları gerektiği belirtilmelidir.4.8.İstenmeyen etkilerYan etkilerle ilgili bilgiler en az bir defa 5 gün boyunca 52 mg/m2/gün klofarabin uygulanan ALL veya akut miyeloid lösemili (AML) 115 hastanın (>1 ve <21 yaş) yer aldığı klinik çalışmalardan elde edilen verilere göre oluşturulmuştur. Yan etkiler sistem organ sınıfına ve sıklığına göre (çok yaygın [>1/10]; yaygın [>1/100 ila <1/10]; yaygın olmayan [>1/1000 ila <1/100]; seyrek [>1/10000 ila 1/1000] ve çok seyrek [<1/10000]) aşağıdaki tabloda sıralanmıştır. Pazarlama sonrası dönemde raporlanan yan etkiler de tabloya eklenmiş olup sıklığı "bilinmiyor" (eldeki verelere göre hesaplanamamaktadır) olarak belirtilmiştir. Her sıklık gruplaması içinde yan etkiler azalan önem durumlarına göre sıralanmıştır.İleri evre ALL veya AML'li hastalar, kendilerinde oluşan yan etkilerin altta yatan hastalıkları, bu hastalığın progresyonu ve birçok tıbbi ürünün eş zamanlı uygulanması ile ilgili çeşitli semptomlara bağlı olup olmadığının değerlendirilmesini zorlaştıran karışık medikal durumlara sahip olabilirler. Hemen hemen tüm hastalar (%98) çalışmanın araştırmacısı tarafından klofarabin ile ilişkili olduğu düşünülen en az bir yan etki deneyimlemiştir. En sık raporlananlar bulantı (hastaların %61'i), kusma (%59), febril nötropeni (%35), baş ağrısı (%24), raş (%21), diyare (%20), prürit (%20), pireksi (%19), palmar-plantar eritrodisastezi sendromu (%15), yorgunluk (%14), anksiyete (%12), mukozal inflamasyon (%11) ve kızarma (%11). 68 hastada (%59) klofarabin ile ilişkili en az bir ciddi yan etki oluşmuştur. Bir hasta 52 mg/m2/gün klofarabin uygulandıktan sonra, klofarabinle ilişkili olduğu düşünülen evre 4 hiperbilirübinemi nedeniyle ilacı kesmiştir. Üç hasta çalışma araştırmacısı tarafından klofarabinle alakalı olduğu düşünülen yan etkiler nedeniyle ölmüştür: bir hasta solunum sıkıntısı, hepatoselüler hasar ve kapiler sızıntı sendromu; bir hasta VRE sepsis ve çoklu-organ yetmezliği; ve diğer hastada septik şok ve çoklu organ yermezliği nedeniyle hayatını kaybetmiştir.
Kan ve lenfatik sistem bozuklukları:klofarabin ile tedavi edilen hastalarda en sık gözlenen hematolojik laboratuvar anomalileri: anemi (%87.7; 100/114); lenfopeni (%82.3; 93/113), nötropeni (%63.7; 72/113) ve trombositopeni (%80.7; 92/114). Bu olayların büyük bir çoğunluğu evre >3'tür.Vasküler hastalıklar:115 hastanın 64'ü (%55.7) en az bir vasküler hastalık yaşamışlardır. 115 hastadan 23'ü klofarabin ile ilişkili olduğu düşünülen bir vasküler hastalık deneyimlemiş olup, en sık raporlananlar kızarma (13 olay, ciddi olmayan) ve hipotansiyondur (5 olay; tümü ciddi olarak değerlendirilen). Ancak bu hipotansif olayların çoğunluğu karışık ciddi enfeksiyonları olanlarda bildirilmiştir.Kardiyak hastalıklar:Hastaların yüzde ellisi en az bir kardiyak bozukluk yaşamıştır. 115 hastadan 11'inde görülen bu bozuklukların klofarabin ile ilişkili olduğu düşünülmüş olup, bunlardan hiçbiri ciddi değildir ve en sık raporlanan kardiyak hastalık taşikardi (%35); hastaların %6.1'inin (7/115) taşikardisi klofarabin ile ilgili olarak değerlendirilmiştir.Kardiyak advers olayların büyük bir çoğunluğu ilk iki kürde bildirilmiştir.Perikardiyal efüzyon ve perikardit hastaların %9'unda (10/115) bir advers etki olarak raporlanmıştır. Bunlardan üçü klofarabinle alakalı olarak değerlendirilmiştir; perikardiyal efüzyon( x 2 olay, biri ciddi) ve perikardit (1 olay, ciddi olmayan). Hastaların büyük bir kısmında (8/10) perikardiyal efüzyon ve perikardit asemptomatik ve ekokardiyografik değerlendirmede klinik olarak önemi olmayan veya az öneme sahip olarak düşünülmüştür. Bununla birlikte, ilgili bazı hemodinamik uyumu olan 2 hastada perikardiyal efüzyon klinik olarak önemlidir. Enfeksiyonlar ve enfestasyonlar:hastaların %48'inde klofarabin tedavisi uygulanmadan önce bir veya daha fazla devam eden enfeksiyona sahiptir. Hastaların toplam %83'ü klofarabin tedavisinden sonra en az bir enfeksiyon; fungal, bakteriyel ve viral enfeksiyonlar dahil yaşamıştır. 21 (%18.3) olayın klofarabinle ilgili olduğu düşünülmüştür; kateterle ilgili enfeksiyon (1 olay), sepsis (2 olay) ve septik şok (2 olay; 1 hasta ölmüştür) ciddi olarak değerlendirilmiştir.Böbrek ve idrar yolu hastalıkları:115 hastadan 41'i en az bir böbrek veya idrar yolu ile ilgili yan etki ile karşılaşmıştır. Pediyatrik hastalarda en prevalan yan etki kreatinin yükselmesidir.hastaların %8'inde evre 3 veya 4 kreatinin yükselmesi görülmüştür. Nefrotoksik tıbbi ürünler, tümör lizis ve tümör lizisle birlikte hiperürisemi böbrek toksisitesine katkıda bulunabilir. Hematüri tüm hastaların %13'ünde gözlenmiştir. 115 hastada böbrekle ilgili 4 yan etkinin klofarabinle ilgili olduğu düşünülmüştür, bunların hiçbiri ciddi değildir; hematüri (3 olay) ve akut böbrek yetmezliği (1 olay).Hepato-biliyer hastalıklar:Karaciğer klofarabin toksisitesi için potansiyel hedef organdır ve hastaların %25.2'si en az bir hepato-biliyer hastalık yan etkisi ile karşılaşmıştır. 6 olayın klofarabin ile ilgili olduğu düşünülmüştür; akut kolesistit (1 olay), kolelitiyaz (1 olay), hepatoselüler hasar (1 olay; hasta ölmüştür) ve hiperbilirübinemi (1 olay; hasta tedaviyi kesmiştir) ciddi olarak değerlendirilmiştir. Veno-oklüzif hastalığı (VOD) içeren iki pediyatrik raporun (%1.7) çalışma ilacıyla alakalı olduğu düşünülmüştür. Bununla birlikte, klofarabin kullanan 50/113 hastada en az şiddette (en az ABD NCI CTC Evre 3) yüksek ALT, 36/100 hastada yüksek AST ve 15/114 hastada yüksek bilirübin düzeyi mevcuttur. ALT ve AST'de oluşan yükselmelerin büyük bir kısmı klofarabin uygulamasının 10 günü içerisinde gerçekleşir ve 15 gün içerisinde <evre 2 düzeyine döner. Var olan takip verilerine göre bilirübin yükselmelerinin büyük bir çoğunluğu 10 gün içinde <evre 2 düzeyine döner.Sistemik İnflamasyon Yanıt Sendromu (SIRS) veya kapiler sızıntı sendromu:SIRS, kapiler sızıntı sendromu (sitokin kinaz belirti ve semptomları örn. taşikardi, taşipne, hipotansiyon, pulmoner ödem) pediyatrik hastaların %5'inde (6/115) bir yan etki olarak raporlanmıştır (5 ALL ve 1 AML).13 tümör lizis sendromu, kapiler sızıntı sendromu veya SIRS raporlanmıştır; SIRS (2 olay, her ikisi de ciddi olarak değerlendirilmiştir), kapiler sızıntı sendromu (4 olay, 3'ü ciddi ve ilaçla ilgili olarak değerlendirilmiştir), ve tümör lizis sendromu (7 olay, 6'sı ilaçla ilgili ve 3'ü ciddi olarak değerlendirilmiştir).4.9. Doz aşımı ve tedavisiHerhangi bir doz aşımı vakası bildirilmemiştir. Bununla birlikte doz aşımı ile ilgili muhtemel semptomların bulantı, kusma, diyare ve ciddi kemik iliği baskılanması olması beklenir. Bu zamana kadar insanlara uygulanan en yüksek günlük doz ardışık 5 gün uygulanmak üzere 70mg/m2'dir (ALL'li 2 pediyatrik hasta). Bu hastalarda gözlenen toksik etkiler içerisinde bulantı, hiperbilirübinemi, yüksek transaminaz düzeyleri ve makülo-papüler raş yer almaktadır.Herhangi bir özel antidotu yoktur. Tedavinin derhal kesilmesi, dikkatli gözlem ve uygun destekleyici önlemlerin alınması önerilmektedir. 5.FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu : Antineoplastik ajanlar, antimetabolitler ATC kodu: L01BB06Etki mekanizması:Klofarabin saf bir nükleosid anti-metabolittir. Antitümör aktivitesinin 3 mekanizmaya bağlı olduğu düşünülmektedir: ¦DNA zinciri uzamasında ve/veya DNA sentezi/tamirinin sonlanmasıyla sonuçlanan DNA polimeraz a inhibisyonu. ¦Hücresel deoksinükleotid trifosfat (dNTP) havuzlarında düşüş ile birlikte ribonükleotid redüktaz inhibisyonu. ¦Bölünmeyen lenfositlerde bile programlanmış hücre ölümüne yol açan, sitokrom C ve diğer proapoptik faktörlerin salımı ile birlikte mitokondriyal membran bütünlüğünün bozulması. Klofarabin ilk olarak hedef hücrelere difüze olmalı veya taşınmalıdır ve burada hücre içi kinazlarla sırasıyla mono- ve bi- fosfata ve ardından son olarak aktif konjugat klofarabin 5'-trifosfata fosforile olur. Klofarabinin aktive fosforilleyici enzimlerden biri olan (doğal substrat olan deoksisitidini aşan) deoksisitidin kinaza yüksek afinitesi vardır. Bununla birlikte, klofarabin bu sınıf içindeki diğer aktif maddelere göre, adenozin deaminaz aracılı hücresel bozunmaya karşı yüksek dirence ve fosforilik ayrılmaya karşı düşük hassasiyete sahipken, klofarabin trifosfatın DNA polimeraza ve ribonükleotid redüktaza afinitesi deoksiadenozin trifosfatla benzer veya ondan fazladır. Farmakodinamik etkiler:In vitroçalışmalar klofarabinin hızlı bölünen hematolojik ve solid tümör hücre hattı tiplerinde hücre büyümesini inhibe ettiğini ve bunlarda sitotoksik olduğunu ortaya koymuştur. Klofarabin ayrıca pasif lenfosit ve makrofajlara karşı da aktiftir. Bunun yanı sıra, klofarabin tümör büyümesini geciktirmiş ve bazı vakalarda, ayrılmış insan ve murin ksenografları implante edilen farelerde tümör gerilemesi sağlamıştır.Klinik etkililik ve güvenlilikKlinik etkililik:Hastalarda görülen yanıttan sağlanan sistemik değerlendirmede, kör olmayan bir Bağımsız Yanıt İnceleme Paneli (IRRP) Children's Oncology Group tarafından oluşturulan tanımlara dayanan aşağıdaki yanıt oranlarını tespit etmiştir:
Çok merkezli, faz II, açık-etiketli, karşılaştırmasız bir klofarabin çalışması ağır düzeyde ön-tedavi uygulanan Fransız-Amerikan-İngiliz sınıflandırma sistemine göre tanımlanan tekrarlayan veya inatçı ALL'li hastalarda (ilk diyagnoz < 21 yaş) tüm remisyon (OR) oranını değerlendirmek amacıyla yürütülmüştür. Yukarıda tanımlandığı gibi faz I çalışmasında en yüksek tolere edilebilir dozda, 52 mg/m2/gün klofarabin her 2 ila 6 haftada bir 5 ardışık gün boyunca intravenöz infüzyonla uygulanmıştır. Aşağıdaki tabloda bu çalışmadaki anahtar sonuçlar özetlenmiştir. ALL'li hastalar yüksek küratif tedavi potansiyeli için seçilebilir olmamalıdırlar ve ikinci veya sonraki tekrarlayan ve/veya inatçı (örn. en az iki ön rejimden sonra başarısız remisyona ulaşmada olan) olmalıdırlar. Çalışmada yer almadan önce, 61 hastanın 58'i (%95) 2 ila 4 farklı indüksiyon tedavisi almıştır ve bu hastaların 18/61'ine (%30) daha önce en az bir defa hematopoetik kök hücre nakli (HSCT) uygulanmıştır. Tedavi edilen hastaların yaş ortalaması (37 erkek, 24 kadın) 12'dir. Klofarabin uygulaması, en başta ölçülebilir mutlak blast miktarına sahip olan 33 hastanın 31'indeki (%94) periferal lösemi hücrelerinde dramatik ve hızlı bir düşüş sağlamıştır. Tam remisyon (CR + PR) sağlanmış olan 12 hastada ortalama sağkalım süresi veri toplanmasının kesildiği tarihte 66.6 hafta olarak belirlenmiştir.Yanıt, ön-B hücresi ve T-hücresi de dahil olmak üzere ALL'nin farklı immünofenotiplerinde gözlenmiştir. Nakil oranı çalışmanın bir sonlanma noktası değilse bile 10/61 hasta (%16) klofarabin tedavisinden sonra (3'ü CR, 2'si CRp, 3'ü PR elde edildikten sonra, IRRP'ye göre tedavi başarısızlığı düşünülmüş olan 1 hasta ve IRRP'ye göre değerlendirilemez olarak düşünülmüş olan 1 hasta) HSCT uygulamasına girmiştir. Yanıt süresi HSCT uygulanan hastalardakine katılmıştır.
*** Relaps sonrası nakil uygulanan hasta Bu tıbbi ürün "istisnai durumlar" altında onaylanmıştır. Bu, hastalığın seyrek görülmesine bağlı olarak ilaçla ilgili tam bir bilginin elde edilmesinin mümkün olmadığı anlamına gelmektedir. Avrupa İlaç Ajansı her yıl elde edilen tüm yeni bilgileri inceleyecektir ve bu kısa ürün bilgisi gerekli oldukça yenilenecektir. 5.2. Farmakokinetik özellikler Genel özelliklerKlofarabinin farmakokinetiği yaşları 2 ila 19 arasında değişen tekrarlayan veya inatçı ALL veya AML'li 40 hastada değerlendirilmiştir. Hastalar tekli faz I (n= 12) veya iki faz II (n=14 / n= 14) etkililik ve güvenlilik çalışmasında yer almış ve intravenöz infüzyon yoluyla çoklu dozlarda klofarabin almışlardır.
eşdeğer maruziyet oluşturmuştur. Bununla birlikte, Cmaks hastanın kilosuyla ters orantılıdır ve bu nedenle her m2 başına aynı dozda yapılan infüzyon sonrasında küçük çocuklarda 40 kg ağırlığa sahip tipik bir çocuğa göre daha yüksek Cmaks değerleri elde edilebilir. Benzer şekilde, <20 kg altındaki çocuklarda daha uzun infüzyon süresi düşünülmelidir. Klofarabin böbrek ve böbrek-dışı yollarla atılmaktadır. 24 saat sonunda uygulanan dozun yaklaşık %60'ı idrardan değişmeden atılır. Klofarabin klirens oranlarının glomerüler filtrasyon oranından daha yüksek olduğu görülmektedir bu nedenle böbreklerden atılım mekanizmasının filtrasyon ve tübüler sekresyon olduğu belirtilmektedir. Ayrıca klofarabin sitokrom P450 (CYP) enzim sistemi ile tespit edilebilir düzeyde metabolize edilmediğinden böbrek-dışı atılım yolları henüz bilinmemektedir. ALL veya AML'li hastalarda ya da kadınla erkek arasında farmakokinetik açısından hiçbir farklılık gözlenmemiştir. Klofarabin veya klofarabin trifosfat maruziyeti arasında hiçbir ilişki yoktur ve bu popülasyonda hem etkililik hem de toksisite tespit edilmiştir. Hastalardaki karakteristik özelliklerErişkinler (>21 yaş ve <65 yaş):Halihazırda klofarabinin erişkinlerdeki güvenliliğini ve etkililiğini belirleyen yeterli bilgi yoktur. Bununla birlikte tekrarlayan veya inatçı AML'li hastalarda 1 saatlik intravenöz infüzyonla uygulanan tek doz 40 mg/m2 klofarabinin erişkinlerdeki farmakokinetiği, yukarıda sözü geçen ardışık 5 gün 2 saatlik intravenöz infüzyonla 52 mg/m2 klofarabin uygulanan 2-19 yaş arası tekrarlayan veya inatçı ALL veya AML'li pediyatrik hastalardaki ile karşılaştırılabilirdir.Geriyatrik hastalar (>65 yaş):Geriyatrik hastalarda klofarabinin güvenliliği ve etkililiğini değerlendiren yeterli bilgi mevcut değildir.Böbrek yetmezliği olan hastalar:Bugüne kadar kreatinin klirensi azalmış pediyatrik hastalarda klofarabin farmakokinetiği ile ilgili sınırlı veri mevcuttur. Bununla birlikte bu veriler klofarabinin bu tip hastalarda birikim oluşturabileceğini belirtmektedir. Erişkin veya pediyatrik hasta popülasyonundan elde edilen farmakokinetik veriler stabil seyreden orta dereceli böbrek yetmezliği olan hastalara (kreatinin klirensi 30-60 mL/dk) %50 daha az dozda uygulama yapılmasının, normal böbrek fonksiyonu olan hastalara standart dozlarda uygulanan klofarabin ile elde edilen kadar bir maruziyet oluşturduğunu göstermektedir.Yaşları 2 ila 19 arasında değişen, tekrarlayan veya refrakter ALL veya AML (n=11 / n=12) pediyatrik hastalarda çoklu dozlarda klofarabinin intravenöz infüzyon yoluyla uygulamasını takiben hesaplanan temel kreatinin klirensine göre klofarabin AUC0-24 saat (kreatinin klirensi Schwartz formülüne göre hesaplanmıştır). 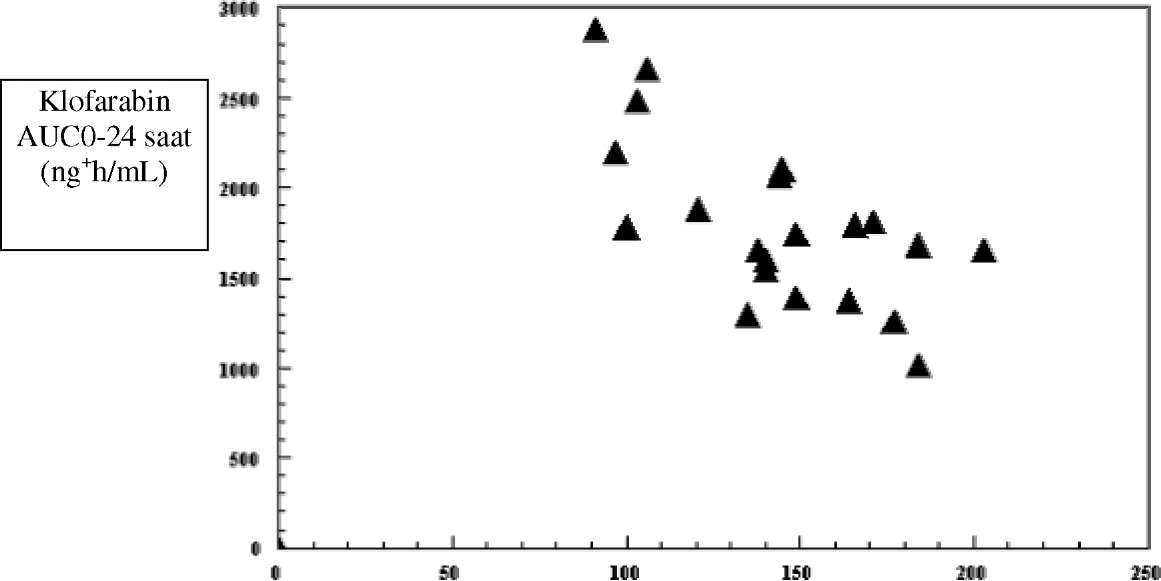 Hesaplanan kreatinin klirensi (mL/dk)
Hesaplanan kreatinin klirensi (mL/dk)Böbrek yetmezliği olan hastalar:Bugüne kadar kreatinin klirensi azalmış pediyatrik hastalarda klofarabin farmakokinetiği ile ilgili sınırlı veri mevcuttur. Bununla birlikte bu veriler klofarabinin bu tip hastalarda birikim oluşturabileceğini belirtmektedir. Erişkin veya pediyatrik hasta popülasyonundan elde edilen farmakokinetik veriler stabil seyreden orta dereceli böbrek yetmezliği olan hastalara (kreatinin klirensi 30-60 mL/dk) %50 daha az dozda uygulama yapılmasının, normal böbrek fonksiyonu olan hastalara standart dozlarda uygulanan klofarabin ile elde edilen kadar bir maruziyet oluşturduğunu göstermektedir.5.3. Klinik öncesi güvenlilik verileri :Klofarabin ile fare, rat ve köpekler üzerinde yapılan toksisite çalışmalarında, toksisite için birincil hedef organın hızlı bölünen hücreler olduğu gösterilmiştir.Ratlarda gözlenen kardiyak etkiler kardiyomiyopati ile uyumludur ve tekrarlayan tedavi kürleri sonrasında kalp yetmezliği belirtilerine katkıda bulunmaktadır. Bu toksisitelerin insidansı hem uygulanan klofarabin dozuna hem de tedavinin süresine bağlıdır. Bunlar klinik uygulamalardakinden yaklaşık 7 ila 13 kat (3 veya daha fazla kür sonrası) veya 16 ila 35 kat (1 veya daha fazla kür sonrası) daha yüksek maruziyet düzeylerinde (Cmaks) raporlanmıştır. Daha düşük dozlarda gözlenen minimal etkiler kalp üzerindeki toksisiteler için bir eşik değerinin mevcut olduğunu ve ratlardaki lineer-olmayan farmakokinetiğin, gözlenen bu etkilerin oluşumunda rol oynayabileceğini düşündürmüştür. İnsanlardaki muhtemel risk bilinmemektedir. Ratlarda 6 kür klofarabin tedavisinden sonra oluşan klinik AUC'den 3 ila 5 kat yüksek maruziyet düzeylerinde glomerülonefropati bildirilmiştir. Bu, hafif bir tübüler hasarla birlikte glomerüler taban membranındaki minör kalınlaşma ile karakterize edilmiştir ve buna serum kimyasındaki değişiklikler eşlik etmez. Erkek üreme organındaki dozla ilişkili toksisiteler fare, rat ve köpeklerde gözlenmiştir. Bu etkiler, ratlarda yüksek maruziyet düzeylerinde (150 mg/m2/gün) spermatid tutulumunun eşlik ettiği seminifer epitelyumundaki bilateral dejenerasyonu ile interstisyel hücrelerin atrofisini ve köpeklerde klinik olarak ilişkili maruziyet düzeylerinde (> 7.5 mg/m2/gün) epidermisin hücre dejenerasyonu ile seminifer epitelyumun dejenerasyonunu içerir. Dişi farelerde sadece 225 mg/m2/gün dozunda uygulanan klofarabin ile gecikmiş over atrofisi veya dejenerasyonu ve uterinin mukozal apoptozu gözlenmiştir. Klofarabin ratlarda ve tavşanlarda teratojeniktir. Ratlarda yaklaşık 2 ila 3 kat fazla klinik maruziyet oluşturan dozlarda (54 mg/m /gün) ve tavşanlarda 12 mg/m /gün dozunda (tavşanlarda herhangi bir maruziyet verisi bulunmamaktadır) malformasyon (yumuşak doku) sayısında yükselme birlikte postimplantasyon hasarında artışlar, fetal vücut ağırlığında azalma ve doğan yavru sayısındaki azalma ile iskeletle ilgili değişiklikler (osifikasyonda yavaşlama) raporlanmıştır. Gelişimsel toksisite için eşiğin ratlarda 6 mg/m2/gün ve tavşanlarda 12 mg/m2/gün olduğu düşünülmektedir. Maternal toksisite için gözlenebilir etki oluşturmayan düzey ratlarda 18 mg/m2/gündür ve tavşanlarda 12 mg/m /gün'ün üzerindedir. Fertilite ile ilgili herhangi bir çalışma yürütülmemiştir. Genotoksisite çalışmaları klofarabinin bakteriyel ters mutasyon analizinde mutajenik olmadığını ortaya koymuştur ancak Çin Hamster Over (CHO) hücrelerinde yapılan aktive olmayan kromozomal sapma analizinde ve in vivorat mikronükleus analizinde klastojenik etki oluşturmuştur.Herhangi bir karsinojenite çalışması yürütülmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiSodyum klorür Enjeksiyonluk su6.2.GeçimsizliklerBu tıbbi ürün bölüm 6.6'da belirtilenlerin dışındaki tıbbi ürünlerle karıştırılmamalıdır.6.3.Raf ömrü24 aydır.Bir defa hazırlandıktan ve seyreltildikten sonra EVORABİN derhal veya 25°C'nin altındaki oda sıcaklığında saklanması koşuluyla 3 gün içinde kullanılmalıdır. Ancak mikrobiyolojik açıdan, hazırlandıktan sonra hemen kullanılmalıdır. Hemen kullanılamadığı durumda, kullanım süresi ile kullanım öncesindeki saklama koşulları kullanıcının sorumluluğundadır ve seyreltilmiş ürün kontrollü ve valide edilmiş aseptik şartlar altına alınmadığı takdirde genellikle 2-8° C'de 24 saatten daha uzun süre bekletilmemelidir. 6.4.Saklamaya yönelik özel tedbirlerDondurmayınız. Seyreltilmemiş ürün 25" C'nin altındaki oda sıcaklığında saklanmalıdır. Seyreltilmiş ürünün saklanmasıyla ilgili olarak bölüm 6.3'e bakınız.6.5.Ambalajın niteliği ve içeriği20 mL şeffaf cam flakon, 20 mm gri teflon tıpa ve 20 mm flipofflu alüminyum kapak.6.6.Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerEVORABİN 1 mg/1 mL uygulamadan önce mutlaka seyreltilmelidir. 0.2 mikrometre steril şırınga filtresinden süzülmeli ve sonra 9 mg/mL (%0.9) intravenöz sodyum klorür infüzyonu ile aşağıda örnekleri yer alan toplam hacim elde edilecek şekilde seyreltilir. Bununla birlikte son seyreltme hacmi hastanın klinik durumuna ve hekimin kararına göre değişiklik gösterebilir. (0.2 mikrometre şırınga filtresinin kullanımı mümkün değilse, konsantrat 5 mikrometrelik bir filtreyle ön-filtrelemeye tabi tutulmalı, seyreltilmeli ve sonra 0.22 mikrometrelik infüzyon filtresi ile uygulanmalıdır.)
EVORABİN tek kullanımlıktır. Kullanılmamış olan ürünler atılmalıdır. Antineoplastik ajanlar için geçerli/uygun olan hazırlama prosedürleri izlenmelidir. Sitotoksik tıbbi ürünler dikkatle ele alınmalıdır. EVORABİN'in hazırlanması sırasında tek kullanımlık eldivenlerin ve koruyucu kıyafetlerin kullanılması önerilir. Eğer ürün göz, cilt veya muköz membranla temas ederse, ilgili bölge bol miktarda suyla yıkanmalıdır. EVORABİN hamile personel tarafından hazırlanmamalıdır. Kullanılmamış veya atık materyallerin tümü yerel gerekliliklere göre imha edilmelidir. 7.RUHSAT SAHİBİKOÇAK FARMA İlaç ve Kimya Sanayi A.Ş. Bağlarbaşı, Gazi Cad. No:40 Üsküdar/İSTANBUL Tel. : 0216 492 57 08 Faks : 0216 334 78 888.RUHSAT NUMARASI(LARI)247/749.İLK RUHSAT TARIHI/RUHSAT YENİLEME TARIHIİlk ruhsat tarihi: 25.01.2013 Ruhsat yenileme tarihi:10.KUB'ün YENİLENME TARİHİ |
İlaç BilgileriEvorabin 1 mg /1 ml İnfüzyon İçin Konsantre Çözelti İçeren FlakonEtken Maddesi: Klofarabin Atc Kodu: L01XA01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.