Cholvast 10 Mg Film Tablet Kısa Ürün BilgisiKalp Damar Sistemi » Lipid Metabolizması İlaçları » Yağ Metabolizması İlaçları » HMG CoA Redüktaz İnhibitörleri » Atorvastatin Kalsiyum KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADICHOLVAST® 10 mg film tablet2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:10 mg atorvastatine eşdeğer atorvastatin kalsiyumYardımcı maddeler:Laktoz DC 32.70 mgKroskarmelloz sodyum 6.00 mg Sükroz stearat 3.00 mg Yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTİK FORMFilm tablet.Beyaz, yuvarlak, bikonveks, film kaplı tablet. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasy onlarHiperkolesterolemi |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Etkileşen ajanlar |
Reçeteleme önerisi |
|
Siklosporin, HIV proteaz inhibitörleri (tipranavir ile ritonavir), hepatit C proteaz inhibitörü (telaprevir) |
Atorvastatin kullanımından kaçınılmalıdır |
|
HIV proteaz inhibitörü (lopinavir ile ritonavir) |
Dikkatle ve gereken en düşük dozda kullanınız |
|
Klaritromisin, itrakonazol, HIV proteaz inhibitörleri (sakinavir ile ritonavir*, danmavir ile ritonavir, fosamprenavir, fosamprenavir ile ritonavir) |
Günlük 20 mg atorvastatin aşılmamalıdır |
|
HIV proteaz inhibitörleri (nelfinavir) Hepatit C proteaz inhibitörü (boceprevir) |
Günlük 40 mg atorvastatin aşılmamalıdır |
|
* Dikkatle ve gereken en düşük dozda |
çullanınız |
Akut, miyopatiyi düşündürecek ciddi durumları olan hastalarda veya rabdomiyolize sekonder olarak böbrek yetmezliği oluşma eğilimini artıracak predispozan bir faktörü (örneğin, ciddi akut enfeksiyon, hipotansiyon, önemli cerrahi müdahale, travma, ciddi metabolik, endokrin ve elektrolit bozuklukları ve kontrol edilemeyen krizler) olan hastalarda atorvastatin tedavisi geçici olarak veya tamamen kesilmelidir.
Diabetes Mellitus ve diğer endokrin etkileri:
Diğer HMG-KoA redüktaz inhibitörlerinde olduğu gibi atorvastatin ile tedavi edilen hastalarda HbAlc ve serum glukoz düzeylerinde artışlar gözlenmiştir. Diyabet açısından risk faktörleri taşıyan hastalarda, atorvastatin ile diyabet sıklığında artış bildirilmiştir. Bununla birlikte, HMG-KoA redüktaz inhibitörlerinin majör kardiyovasküler olay sıklığını azaltarak sağladıkları fayda göz önüne alındığında, toplamda yarar zarar dengesi belirgin olarak olumlu görünmektedir ve bu nedenle statin tedavisinin kesilmesi için bir neden olmamalıdır. Riskli hastalar (açlık kan şekeri 5.6 ila 6.9 mmol/L, BMI >30 kg/m2, trigliseritlerde artış, hipertansiyon) klinik ve biyokimyasal açıdan izlenmelidir.
HMG-KoA redüktaz inhibitörleri, kolesterol sentezine karışır ve teorik olarak adrenal ve/veya gonadal steroid üretimini etkiliyor olabilirler. Klinik çalışmalar atorvastatinin bazal plazma kortizol düzeyini azaltmadığını veya adrenal rezervini zayıflatmadığını göstermiştir. HMG-KoA redüktaz inhibitörlerinin erkek fertilitesi üzerindeki etkileri yeterli sayıda hasta üzerinde çalışılmamıştır. Eğer varsa, premenopozal kadınlarda pitüiter-gonadal eksen üzerindeki etkiler bilinmemektedir. Eğer HMG-KoA redüktaz inhibitörü, ketokonazol, spironolakton ve simetidin gibi endojen steroid hormonların seviyelerini veya aktivitesini düşürebilecek ilaçlarla birlikte kullanılırsa uyanlar dikkate alınmalıdır.
Hemorajik inme:
Koroner kalp hastalığı (KKH) olmayan fakat son 6 ay içinde inme veya geçici iskemik atak (GİA) geçiren ve 80 mg atorvastatin alan 4731 hastada yapılan bir klinik çalışmanın post-hoc analizine göre, atorvastatin 80 mg grubunda plasebo grubuyla karşılaştırıldığında hemorajik inme sıklığı daha yüksek bulunmuştur (33 plaseboya karşı 55 atorvastatin). Başlangıçta hemorajik inmesi olan hastalar, reküran hemorajik inme açısından daha fazla risk altında gibi görünmektedir (2 plaseboya karşı 7 atorvastatin). Bununla birlikte atorvastatin 80 mg ile tedavi edilen hastalarda herhangi bir tip inme (Atorvastatin ile 265'e karşı plaseboda 311) ve KKH'na bağlı olay (123'e karşı 311) daha düşük oranda idi. (Bkz. Bölüm 5.1, Tekrarlayan İnme)
Hasta için uyanlar:
Özellikle halsizlik veya ateş ile beraber görünen açıklanamayan kas ağrısı, hassasiyeti veya zayıflığı olması durumunda hastalann durumu ivedilikle bildirmeleri öğütlenmelidir.
Pediyatrik kullanım:
10-17 yaş arasında heterozigot ailesel hiperkolesteremili hastalarda güvenlik ve etkinlik; 6 ay süreli kontrollü bir klinik deneyde değerlendirilmiştir. Atorvastatin ile tedavi edilen hastalarda genellikle plasebo verilen hastalarınkine benzer bir advers deneyim profili görülmüştür; en sık görülen advers deneyimler, nedensellik değerlendirmesine bakılmaksızın, enfeksiyonlardır. Bu hasta popülasyonunda 20 mg üzeri dozlar çalışılmamıştır. Bu sınırlı kontrollü çalışmada, erkeklerde büyüme veya seksüel gelişme ile kızlarda menstrual siklus uzunluğu üzerine hiçbir kaydedilebilir etki olmamıştır. Ergen kızlara CHOLVAST® tedavisi uygulanırken uygun bir kontraseptif yöntem tavsiye edilmelidir (Bkz. Bölüm 4.3, 4.4 ve 4.6). Atorvastatin, ergenlik öncesi veya 10 yaşından küçük hastalan kapsayan kontrollü klinik deneylerde incelenmemiştir. Pediyatrik popülasyonda büyüme ve gelişmeye etkilerinin güvenliliği konusundaki bilgiler yeterli değildir.
Geriyatrik kullanım:
Atorvastatinin plazma konsantrasyonları sağlıklı yaşlılarda (65 yaş ve üstü) genç yetişkinlere göre daha yüksektir (Cmaks için yaklaşık % 40 ve EAA için yaklaşık % 30). LDL-K düşüşü, eşit dozda atorvastatin verilen daha genç hasta popülasyonlarmda görülen oranlarla benzer olmuştur (Bkz. Bölüm 5.2).
İnterstisyel akciğer hastalığı:
Bazı statinlerle özellikle uzun dönem tedavide interstisyel akciğer hastalığının istisnai vakaları rapor edilmiştir (bkz. bölüm 4.8). Bu hastalığın göstergeleri; dispne, nonprodüktif öksürük ve genel sağlık durumunda gerilemeyi içerebilir (yorgunluk, kilo kaybı ve ateş). Eğer bir hastanın interstisyel akciğer hastalığı geliştirdiğinden şüphelenilirse, statin tedavisi kesilmelidir.
Bu tıbbi ürün laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorbsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
Bu tıbbi ürün sükroz içerir. Nadir kalıtımsal fruktoz intoleransı, glukoz-galaktoz malabsorbsiyon veya sükraz izomaltaz yetmezliği problemi olan hastaların bu ilacı kullanmamaları gerekir.
Bu tıbbi ürün sodyum içerir. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
HMG-KoA redüktaz inhib körleriyle tedavi sırasında; siklosporin, fıbrik asit türevleri (gemfibrozİl, fenofibrat gibi), niasin veya sitokrom P450 3A4 inhibitörlerinin (örneğin, eritromisin, klaritromisin (aşağıya bakınız) ve azol antıfungalleri) birlikte uygulanması miyopati riskini arttırmaktadır (Bkz. Bölüm 4.4, İskelet Kasına Etkileri).Atorvastatinin plazma konsantrasyonunu arttıran ilaç alan hastalarda atorvastatin günlük başlangıç dozu 10 mg olmalıdır. Klaritromisin ve itrakonazol alınması halinde daha düşük bir maksimum atorvastatin dozu kullanılmalıdır.
Sitokrom P450 3A4 inhibitörleri:
Atorvastatin sitokrom P450 3A4 ile metabolize edilir. Atorvastatinin sitokrom P450 3A4 inhibitörleri ile birlikte uygulanması, atorvastatinin plazma konsantrasyonlarında artışa neden olabilir. Etkileşimin derecesi ve etkinin artması sitokrom P450 3A4 üzerindeki etkinin değişkenliğine bağlıdır.
Eritromi sin/klaritromi sin:
Sitokrom P450 3A4'ün bilinen inhibitörleri olan eritromisinin (günde 4 kez, 500 mg) veya klaritromisinin (günde 2 kez 500 mg) atorvastatin ile birlikte uygulanması, yüksek plazma atorvastatin konsantrasyonlarıyla ilişkili bulunmuştur (Bkz. Bölüm 4.4, İskelet Kasına Etkileri). Klaritromisinin atorvastatin ile birlikte uygulanması gerektiğinde atorvastatinin idame dozu günlük 20 mg'ı geçmemelidir.
Proteaz İnhibitörleri:
Atorvastatinin birçok HIV proteaz inhibitörü kombinasyonu ve hepatit C proteaz inhibitörü telaprevir ile birlikte kullanımı atorvastatin EAA'sını atorvastatinin tek başına kullanımı ile karşılaştırıldığında belirgin olarak arttırmıştır. Bu nedenle HIV proteaz inhibitörü tipranavir ile ritonavir veya hepatit C proteaz inhibitörü telaprevir alan hastalarda; CHOLVAST®'ın birlikte kullanımından kaçınılmalıdır. HIV proteaz inhibitörü lopinavir ile ritonavir alan hastalarda CHOLVAST® reçetelenirken dikkatli olunmalıdır ve gerekli olan en düşük doz kullanılmalıdır. HIV proteaz inhibitörü saquinavir ile ritonavir ve darunavir ile ritonavir, fosamprenavir veya fosamprenavir ile ritonavir alan hastalarda CHOLVAST® dozu 20 mg'ı aşmamalıdır ve dikkatli kullanılmalıdır (Bkz. bölüm 4.2 ve 4.4 iskelet kasına etkileri). HIV proteaz inhibitörü nelfinavir veya hepatit C proteaz inhibitörü boceprevir alan hastalarda, CHOLVAST® dozu 40 mg'ı aşmamalıdır ve yalın klinik izleme önerilmektedir.
Diltiazem hidroklorid:
Atorvastatin (40 mg) ve diltiazemin (240 mg) birlikte kullanılması, atorvastatin plazma konsantrasyonlarında artış ile sonuçlanmıştır.
Simetidin:
Simetidin ile etkileşim çalışması yapılmış ve klinik olarak anlamlı hiçbir etkileşim görülmemiştir.
Itrakonazol:
Atorvastatin (20-40mg) ile itrakonazolun (200 mg) eş zamanlı kullanımı atorvastatinin EAA değerlerinde artış ile ilişkilendirilmiştir. itrakonazolün atorvastatin ile birlikte uygulanması gerektiğinde atorvastatinin idame dozu günlük 40 mg'ı geçmemelidir.
Greyfurt Suyu:
Greyfurt suyu içerisinde bulunan bazı maddeler CYP3A4'ü inhibe eder ve özellikle fazla tüketilirse (>1.2 litre/günde) atorvastatinin plazma konsantrasyonunun artmasına sebep olur.
Sitokrom P450 3A4 indükleyidleri:
Atorvastatinin sitokrom P450 3A4 indükleyicileri ile (ör. Efavirenz, rifampin) birlikte uygulanması, atorvastatinin plazma konsantrasyonlarında değişik oranlarda azalmaya neden olabilir. Rifampinin çift yönlü etki mekanizması nedeniyle, (sitokrom P450 3A4 indüksiyonu ve hepatosit alım transporteri OATP1B1 inhibisyonu), atorvastatinin rifampinle birlikte alınması önerilmektedir. Çünkü rifampin alımmdan sonra atorvastatinin gecikmeli alınması, atorvastatinin plazma konsantrasyonlarında anlamlı azalmalara neden olmaktadır.
Antasitler:
Magnezyum ve alüminyum hidroksit içeren bir oral antasit süspansiyonun atorvastatinle birlikte uygulanması atorvastatinin plazma konsantrasyonlarını yaklaşık %35 azaltmıştır, bununla birlikte LDL-K düşme oranı değişmemiştir.
Antipirin:
Atorvastatin, antipirin farmakokinetiğini etkilemez. Bu sebeple aynı sitokrom izoenzimleri ile metabolize olan ilaçlar ile etkileşim beklenmez.
Azitromisin:
Günde tek doz 10 mg atorvastatin ile günde tek doz 500 mg azitromisinin beraber uygulanması sonucunda atorvastatinin plazma konsantrasyonları değişmemiştir.
Oral kontraseptifler:
Noretindron ve etinil östradiol içeren bir oral kontraseptifle birlikte uygulama, noretindron ve etinil östradiole ait E AA değerlerinde sırasıyla yaklaşık %3Û ve %20 artışa sebep olmuştur. Atorvastatin kullanan bir kadın için oral kontraseptif dozları seçilirken, bu artmış konsantrasyonlar göz önüne alınmalıdır.
Varfarin:
Atorvastatin kronik varfarin tedavisi gören hastalara verildiğinde, protrombin zamanı üzerine klinik olarak belirgin bir etkide bulunmadığı gözlenmiştir. Ancak varfarin kullanan hastaların CHOLVAST® kullanması gerektiğinde, hastalar yakından takip edilmelidir.
Amlodip
in:Sağlıklı bireylerde yapılan ilaç etkileşimleri çalışmasında, 80 mg atorvastatin ve 10 mg amlodipinin beraber kullanımında açığa çıkan atorvastatindeki %18'lik artış klinik açıdan anlamlı bulunmamıştır.
Kol şişin:
Atorvastatin kolşisin ile birlikte kullanıldığında rabdomiyolizi de içeren miyopati vakaları bildirilmiştir; bu nedenle atorvastatin kolşisin ile birlikte kullanılacağı zaman dikkatli olunmalıdır.
Taşıyıcı protein inhibitörleri:
Atorvastatin ve metabolitleri OATP1B1 taşıyıcılarının substratlandır. OATP1B1 inhibitörleri (örn. Siklosporin) atorvastati
nin
biyoyararlanımım arttırır. 10 mg atorvastatin ve 5.2 mg/kg/gün siklosporinin eş zamanlı kullanımı atorvastatine maruziyette 7.7 kat artışa sebep olmuştur.Atorvastatin ile siklosporinin beraber kullanımından kaçınılmalıdır. (Bkz. Bölüm 4.4,
İskelet Kasma Etkileri)
Gemfıbrozil:
HMG-KoA redüktaz inhibitörleri ile gemfibrozilin birlikte kullanımındaki artmış miyopati/rabdomiyoliz riski nedeniyle, atorvastatinin gemfıbrozil ile birlikte uygulanmasından kaçınılmalıdır.
Ezetimib:
Ezetimibin tek başına kullanılması rabdomiyolizi içeren kas ile ilgili olaylarla bağlantılıdır. Bu nedenle atorvastatinin ezetimib ile birlikte kullanıldığında bu olayların görülme riski artabilir. Bu hastaların uygun klinik izlenmesi önerilir.
Kolestipol:
Kolestipol atorvastatinle birlikte uygulandığında atorvastatinin plazma konsantrasyonları daha düşük olmuştur (yaklaşık %25). Bununla birlikte, atorvastatin ve kolestipolün birlikte uygulandığında görülen LDL-K azalması, ilaçlardan herhangi biri tek başına verildiğinde görülenden daha fazla olmuştur.
Fusidik asit:
Atorvastatin ve fusidik asit ile etkileşim çalışmaları yapılmamış olsa da, pazarlama sonrası deneyimlerde bu kombinasyon ile rabdomiyoliz gibi şiddetli kas problemleri rapor edilmiştir. Hastalar yakından izlenmelidir ve atorvastatin tedavisine geçici olarak ara verilmesi düşünülebilir.
Digoksin:
Atorvastatin 10 mg ve digoksinin multipl dozlarının birlikte uygulanması, kararlı hal plazma digoksin konsantrasyonlarını etkilememiştir. Ancak günde 80 mg atorvastatin uygulamasını takiben, digoksin konsantrasyonları yaklaşık %20 artmıştır. Digoksin alan hastalar dikkatle izlenmelidir.
Diğer fibratlar:
Diğer fibratlarla HMG-KoA redüktaz inhibitörleri birlikte kullanıldığında miyopati riskinin arttığı bilindiğinden, CHOLVAST® diğer fibratlarla birlikte kullanılacağı zaman dikkat edilmelidir.
Niasin:
Atorvastatin niasin ile birlikte kullanıldığında iskelet kasma etki riski artabilir; bu durumda CHOLVAST® dozunun azaltılması düşünülmelidir.
Birlikte kullanılan diğer ilaçlar:
Antihipertansif ajanlar ile ve östrojen replasman tedavilerinde atorvastatinin beraber kullanıldığı klinik çalışmalarda, klinik olarak önemli istenmeyen etkileşimlere ait kanıtlar bildirilmemiştir. Tüm spesifik ajanlara ait etkileşim çalışmaları mevcut değildir.
4.6 Gebelik ve laktasyon Genel tavsiye
Gebelik kategorisi: X.Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar uygun kontraseptif yöntemler kullanmalıdır (Bkz. Bölüm 4.3), Atorvastatin, çocuk doğurma yaşında olan kadınlarda, sadece gebe kalması büyük ölçüde mümkün görülmeyenlerde ve fetüse olabilecek potansiyel zararlar konusunda bilgilendirildiğinde kullanılmalıdır.Gebelik dönemi
Atorvastatin gebelikte kontrendikedir.Laktasyon dönemi
Atorvastatin laktasyon döneminde kontrendikedir. Bu ilacın insan sütü ile itrah edilip edilmediği bilinmemektedir. Emzirilen bebeklerdeki advers reaksiyon potansiyeli nedeniyle, atorvastatin kullanan kadınlar emzirmemelidirler (Bkz. Bölüm 4.3).Üreme yeteneği / Fertilite
Bkz. Bölüm 5.3.4.7 Araç ve makine kullanımı üzerindeki etkiler
(i&CHOLVAST 5m araç ve makina kullanma yeteneği üzerine etkisi ihmal edilebilir düzeydedir.
4.8 istenmeyen etkiler
Atorvastatin genelde iyi tolere edilir. Advers reaksiyonlar çoğunlukla hafif ve geçici olmuştur. 16.066 hastanın ortalama 53 hafta tedavi edildiği plasebo kontrollü (8.755 atorvastatin ve 7.311 plasebo) klinik çalışma veri tabamnda advers olay nedeniyle tedaviyi bırakma oranları atorvastatin grubunda %5.2, plasebo grubunda ise %4 olmuştur.Klinik çalışmalardan ve pazarlama sonrası deneyimden gelen verilere dayanarak; aşağıdaki tablo atorvastatin için yan etki profilini göstermektedir.
Tahmini yan etki sıklıkları şu sıklıklara göre sıralanmıştır:
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden t
ahm
inle hareket edilemiyor).Enfeksiyonlar ve enfestasyonlar:
Yaygın : nazofarenjitKan ve lenf sistemi hastalıkları:
Seyrek : trombositopeniBağışıklık sistemi hastalıkları:
Yaygın : alerjik reaksiyonlarÇok seyrek : anafılaksi
Metabolizma ve beslenme hastalıkları:
Yaygın : hiperglisemiYaygın olmayan : hipoglisemi, kilo artışı, anoreksi
Psikiyatrik hastalıklar:
Yaygın olmayan : kabus görme, uykusuzlukSinir sistemi hastalıkları:
Yaygın : baş ağrısıYaygın olmayan : sersemlik, parestezi, hipoestezi, tat alma bozuklukları, amnezi Seyrek : periferal nöropati
Göz hastalıkları:
Yaygın olmayan : bulanık görme Seyrek : görme bozukluğuKulak ve iç kulak hastalıkları:
Yaygın olmayan : kulak çınlaması Çok seyrek : işitme kaybıSolunum, göğüs hastalıkları ve mediastinal hastalıklar:
Yaygın : faringolaringeal ağrı, epistaksisGastrointestinal hastalıklar:
Yaygın : konstipasyon, gaza bağlı şişkinlik, dispepsi, mide bulantısı, diyareYaygın olmayan : kusma, abdominal ağrı (üst ve alt), geğirme, pankreatit
Hepato-bilier hastalıklar:
Yaygın olmayan : hepatit Seyrek : kolestazÇok seyrek : karaciğer yetmezliği
Deri ve deri altı doku hastalıkları:
Yaygın olmayan : ürtiker, deri döküntüsü, kaşıntı, al öpesiSeyrek : anjiyonörotik ödem, büllü döküntüler (eritema multiforme, Stevens
Johnson Sendromu ve toksik epidermal nekroliz dahil)
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları:
Yaygın : miyalji, artralji, ekstremitelerde ağrı, kas spazmları, eklem şişmesi, sırtağrısı
Yaygın olmayan : boyun ağrısı, kas güçsüzlüğü
Seyrek : miyopati, miyozit, rabdomiyoliz, bazen rüptür ile seyreden tendonopati
Üreme sistemi ve meme hastalıkları:
Yaygın olmayan : impotans Çok seyrek : jinekomastiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
Yaygın olmayan : halsizlik, asteni, göğüs ağrısı, periferal ödem, yorgunluk, ateşAraştırmalar:
Yaygın : anormal karaciğer fonksiyon testleri, artmış kan kreatin kinaz değerleriYaygın olmayan : idrarda pozitif beyaz kan hücreleri
Diğer HMG-KoA redüktaz inhibitörleri ile olduğu gibi, atorvastatin alan hastalarda artmış serum transaminaz değerleri rapor edilmiştir. Bu değişiklikler genellikle hafif ve geçici olmuştur ve tedaviye müdahele edilmesini gerektirmemiştir. Atorvastatin alan hastaların %0.8'inde serum transaminazlarında klinik olarak önemli artışlar (normal üst limitin 3 katından fazla) gözlenmiştir. Bu artışlar doz ile ilişkilidir ve tüm hastalarda geri dönüşümlü olduğu görülmüştür.
Normal üst limitin 3 katından fazla artmış serum kreatin kinaz seviyeleri; klinik çalışmalarda diğer HMG-KoA redüktaz inhibitörleri ile gözlenenlere benzer şekilde atorvastatin alan hastaların %2.5'unda görülmüştür. Normal üst limitin 10 katından fazla değerler atorvastatin ile tedavi edilen hastaların %0.4'ünde görülmüştür (bkz. bölüm 4.4).
Pediyatrik popülasvon
Klinik güvenlilik veritabanı atorvastatin alan 249 pediyatrik hasta için güvenlilik verisi içermektedir. Bu hastalarda 7'si 6 yaşından küçük, 14'ü 6-9 yaş arasında, 228'i 10-17 yaş arasındaydı.
Sinir sistemi hastalıkları:
Yaygın : baş ağrısıGastrointestinal hastalıklar:
Yaygın : abdominal ağrıAraştırmalar:
Yaygın : artmış alanin aminotransferaz, artmış kan kreatin fosfokinaz değerleri Elde olan verilere dayanarak, çocuklarda gözlenen yan etki sıklık, tip ve şiddetinin yetişkinlerde görülenlerle aynı olması beklenmektedir. Pediyatrik popülasyonda uzun dönem güvenlilik açısından halihazırda sınırlı deneyim bulunmaktadır.Aşağıdaki advers olaylar bazı statinler ile bildirilmiştir:
Uyku bozukluğu, uykusuzluk ve kabus görme dahil.
Hafıza kaybı.
Seksüel disfonksiyon.
» Depresyon
Nadir interstisyal akciğer hastalığı» özellikle uzun dönem tedavide (bkz. Bölüm 4.4).
Diyabet: Sıklık, risk faktörlerinin varlığı veya yokluğuna bağlı olacaktır (açlık kan şekeri
> 5.6 mmol/L. BMI >30 kg/m2, trigliseritlerde artış, hipertansiyon hikayesi)
Pazarlama sonrası deneyimde nadir olarak, statin kullanımıyla bağlantılı kognitif bozukluk (öm: hafıza kaybı, unutkanlık, amnezi, hafıza bozukluğu, konfüzyon) bildirilmiştir. Bu kognitif sorunlar tüm statinler için bildirilmiştir. Bildirimler genellikle ciddi değildir, statin kullanımının bırakılmasıyla genellikle geri dönüşlüdür, semptomların ortaya çıkması (1 gün -yıllar) ve semptomların kaybolması (medyan 3 hafta) için geçen süreler değişkendir.
Statin kullanımı ile bağlantılı immün aracılı nekrotizan miyopati nadir olarak rapor edilmiştir (Bkz. Bölüm 4.4).
4.9 Doz aşımıtedavisi
CHOLVAST®'m doz aşımı için spesifik tedavi bulunmamaktadır. Doz aşımının oluşması halinde, hasta semptomatik olarak tedavi edilmeli ve gereken destekleyici tedbirler alınmalıdır. Karaciğer fonksiyon testleri ve CPK seviyeleri izlenmelidir. Plazma proteinlerine fazlaca ilaç bağlanmasına bağlı olarak hemodiyalizin atorvastatin klerensini anlamlı olarak arttırması beklenmez.5. FARMAKOLOJİK ÖZELLİKLER
5.1 Farmakodinamik özellikler
Farmakoterapötik grup: Kardiyovasküler İlaçlar, Serum Lipid Düşürücü İlaçlar, HMG-KoA Redüktaz İnhibitörleri ATC Kodu: C10AA05Atorvastatin 3-hidroksi-3-metil-glutaril-koenzim A'mn (HMG-KoA), kolesterolü de içeren sterollerin bir prekürsörü olan mevalonata dönüşmesinden sorumlu hız sınırlayıcı enzim olan HMG-KoA redüktazm selektif, kompetitif bir inhibitörüdür. Homozigot ve heterozigot ailesel hiperkolesterolemi, hiperkolesteroleminin ailesel olmayan tipleri ve karma dislipidemisi olan hastalarda atorvastatin total-K, LDL-K ve apoB'yi düşürür. Atorvastatin ayrıca VLDL-K ve trigliseridi düşürür ve HDL-K'da değişken artışlar meydana getirir. Trigliseridler ve kolesterol, karaciğerde VLDL (çok düşük dansiteli lipoprotein) yapısına katılarak periferik dokulara taşınmak üzere plazmaya salınır. LDL (düşük dansiteli lipoprotein) VLDL'den oluşur ve esas olarak yüksek afiniteli LDL reseptörü üzerinden katabolize olur, VLDL, LDL ve kalıntıları içeren kolesterol ile zenginleştirilmiş trigliseridden zengin lipoproteinlerde, LDL gibi aterosklerozu arttırabilir. Artmış plazma trigliseridleri, sıklıkla, düşük HDL kolesterol seviyeleri ve küçük LDL partikülleri ile beraber üçlü bir ortamda bulunur, bu duruma koroner kalp hastalığı için non-lipid metabolik risk faktörleri eşlik eder. Total plazma trigliseridlerinin tek başlarına koroner kalp hastalığı için bir risk faktörü oluşturduğu gösterilmemiştir.
Atorvastatin HMG-KoA redüktazı inhibe ederek plazma kolesterolü ve LDL düzeylerini düşürür, karaciğerdeki kolesterol sentezini azaltır ve hücre yüzeyindeki hepatik LDL reseptörlerinin sayısını artırarak LDL alımı ve katabolizmasım artırır.
Atorvastatin LDL üretimini ve LDL partiküllerinin sayısını azaltır, dolaşımdaki LDL partiküllerinin kalitesinde yararlı bir değişimle beraber LDL reseptör aktivitesinde büyük ve devamlı bir artış sağlar. Atorvastatin total kolesterol, LDL kolesterol, VLDL kolesterol, apo B, trigliseridleri düşürür, HDL kolesterolü artırır. Atorvastatin, disbetalipoproteinemili hastalarda LDL kolesterolü (orta dansiteli lipoprotein) düşürür.
Bir doz-yanıt çalışmasında, atorvastatin (10-80 mg) total kolesterolü (%30-%46), LDL kolesterolü (%41-%61), apo B'i (%34-%50) ve trigliseridi (%14-%33) azaltmıştır. Bu sonuçlar, heterozigot ailesel hiperkolesterolemisi, hiperkolesteroleminin ailesel olmayan tipleri ve kombine hiperkolesterolemisi olan hastalardaki sonuçlar ile (insüline bağımlı olmayan diabetes mellitus hastalan da dahil) uyumludur.
Atorvastatin 10-80 mg ile yapılmış 24 kontrollü çalışmadaki Fredrickson tip Ha ve Ilb hiperlipoproteinemi hastalarının toplu olarak analizi, bu hastalarda total kolesterol, LDL-kolesterol, trigliserid düzeylerinde ve total-K/HDL-K ve LDL-K/HDL-K oranlarında başlangıca göre tutarlı olarak anlamlı azalmalar göstermiştir. Ayrıca atorvastatin (10-80 mg), dozdan bağımsız bir şekilde HDL-K'de ortalama %5.1-8.7 oranında artış sağlamıştır. Atorvastatin ve bazı metabolitleri insanda farmakolojik olarak aktiftir. Atorvastatinin en önemli etki merkezi, kolesterol sentezinin ve LDL klerensinin yapıldığı esas merkez olan karaciğerdir. LDL-K düşüşü, sistemik ilaç konsantrasyonundan daha çok ilaç dozu ile ilişkilidir. Terapötik cevap göz önüne alınarak ilaç dozu kişiye göre ayarlanmalıdır (Bkz. Bölüm 4.2).
Kardivovasküler Hastalıkların Önlenmesi
Anglo-İskandinav Kardiyak Sonuçlar Çalışması Lipid Azaltma Kolunda (Anglo-Scandinavian Cardiac Outcomes Trial Lipid Lowering Arm, ASCOT-LLA), atorvastatinin ölümcül ve ölümcül olmayan koroner kalp hastalığı üzerindeki etkisi, daha önce miyokard enfarktüsü veya anjina tedavisi öyküsü olmayan ve total kolesterol düzeyi <251 mg/dL olan 40-80 yaş arasındaki (ortalama 63 yaş) 10305 hipertansif hastada değerlendirilmiştir. Ayrıca tüm hastalarda şu kardiyovasküler risk faktörlerinden en az üçü mevcuttu: erkeklerde, >55 yaş, sigara kullanımı, diyabet, birinci derece akrabada KKH öyküsü,
TK:HDL oranı >6, periferik vasküler hastalık, sol ventrikül hipertrofısi, geçirilmiş serebrovasküler olay, spesifik EKG anomalisi, proteinüri/albuminüri. Bu çift kör, plasebo kontrollü çalışmada, hastalar antihipertansif terapi ile tedavi edildiler (Hedef kan basıncı diyabetik olmayan hastalarda <140/90 mmHg, diyabetik hastalarda <130/80 mmHg) ve günde 10 mg atorvastatin (n=5168) veya plasebo (n=5137) kollarına randomize edildiler. Her iki tedavi kolunda da iyi kan basıncı kontrolü sağlanan bu çalışmanın ara analizinde atorvastatin tedavisi uygulanan grupta sağlanan kardiyovasküler olay riskindeki azalmanın plasebo grubu ile karşılaştırıldığında istatistiksel anlamlılık eşiğini aşması sebebiyle çalışma, planlanan süreden (5 yıl) daha erken (3.3 yıl) sonlandınlmıştır.
ASCOT çalışmasında atorvastatin aşağıdaki olayların sıklığını anlamlı ölçüde azaltmıştır:
|
Olay |
Risk azalması (%) |
Olay sayısı (atorvastatine karşı plasebo) |
P değeri |
|
Koroner olaylar (ölümcül KKH + ölümcül olmayan MI) |
%36 |
100 ve 154 |
0.0005 |
|
Total kardiyovasküler olaylar ve revaskülarizasyon girişimleri |
%20 |
389 ve 483 |
0.0008 |
|
Total koroner olaylar |
%29 |
178 ve 247 |
0.0006 |
|
Ölümcül ve ölümcül olmayan inme* |
%26 |
89 ve 119 |
0.0332 |
Risk azalması yaş, sigara kullanımı, obezite ve renal fonksiyon bozukluğundan bağımsız
uıaıaA. luıaiiiuıı.
Gruplar arasında total mortalite (p=0.17) ve kardiyovasküler mortalite (p=0.51) açısından anlamlı fark bulunmamıştır.
Atorvastatin Diyabet İşbirliği Çalışmasında (Collaborative Atorvastatin Diabetes Study, CARDS), atorvastatinin ölümcül ve ölümcül olmayan kardiyovasküler hastalık üzerindeki etkisi, kardiyovasküler hastalık öyküsü bulunmayan, LDL <160 mg/dL ve trigliserid <600
tna/HT nlan 40-7^ -uuc arçıcınHaVi 983S tın0HK/CiKp't Vıactiicmrlçı ^nrliTnlmictir Âvnra
y<tÂ.
İJ iltüm hastalarda şu risk faktörlerinden en az biri mevcuttu: hipertansiyon, sigara kullanımı, retinopati, mikroalbuminüri veya makroalbuminüri. Bu randomize, çift kör, çok merkezli, plasebo kontrollü çalışmada ortalama 3.9 yıllık izlem süresince hastalar günlük 10 mg atorvastatin (n=1428) ya da plasebo (n=1410) ile tedavi edilmiştir. Atorvastatin tedavisinin primer sonlanım noktası üzerindeki etkisi önceden belirlenmiş olan etkinlik sebebiyle sonlandırma kuralına eristi&inden. CARDS beklenenden 2 vıl önce sonlandırılmıstır.
CARDS Çalışmasında Atorvastatinin mutlak ve göreceli risk azaltımı etkisi aşağıdaki gibidir:
Göreceli Risk Olay Sayısı p değeri Azaltımı (%) (atorvastatin ve plasebo ile)
Olay
0.0010
% 37
83 ve 127
38 ve 64
38 ve 64
yo
u.uu/u
0.0163
0.0163
21 ve 39
% 48
Majör kardiyovasküler olaylar [ölümcül ve ölümcül olmayan AMI, sessiz MI, akut KKH ölümü, kararsız angina, KABG, PTKA, revaskülarizasyon, inme]
MI (ölümcül ve ölümcül olmayan AMI, sessiz MI)
İnme (ölümcül ve ölümcül olmayan)
MI (ölümcül ve ölümcül olmayan AMI, sessiz MI)
İnme (ölümcül ve ölümcül olmayan)
AMI = akut miyokard enfarktüsü; KABG = koroner arter baypas greft; KKH = koroner kalp hastalığı; MI = miyokard enfarktüsü; PTKA = perkütan transluminal koroner anjiyoplasti.
Tedavinin etkisinde hastanın cinsiyeti, yaşı ya da başlangıç LDL-K düzeylerine bağlı bir farklılığa rastlanmamıştır.
Mortalite oranları açısından olumlu bir rölatif risk azalması eğilimi görülmüştür (%27'lik azalma (plasebo grubunda 82 ölüme karşılık tedavi kolunda 61 ölüm (p=0.0592))).
Her iki grupta toplam advers olay ve ciddi advers olay sıklığı benzer olmuştur.
Ateroskleroz
Agresif Lipid Düşürme ile Aterosklerozun Durdurulması Çalışmasında (Reversing Atherosclerosis with Aggressive Lipid-Lowering Study, REVERSAL), atorvastatin 80 mg ve pravastatin 40 mg'ın koroner ateroskleroz üzerindeki etkisi, koroner kalp hastalığı olan hastalarda anjiyografı sırasında intravasküler ultrasonografi (IVUS) ile değerlendirilmiştir. Bu randomize, çift kör, çok merkezli, kontrollü klinik çalışmada, 502 hastaya başlangıçta ve 18. ayda IVUS uygulanmıştır. Bu çalışmada atorvastatin kolunda (n=253) ateroskleroz progresyonu görülmemiştir. Başlangıca göre toplam aterom hacmindeki ortalama değişiklik oranı (primer çalışma kriteri), atorvastatin grubunda (n=253) %-0.4 (p=0.98) ve pravastatin grubunda (n=249) %+2.7 (p=0.001) olmuştur. Pravastatin ile karşılaştırıldığında, atorvastatinin etkisi istatistiksel olarak anlamlı bulunmuştur (p=0.02).
Atorvastatin grubunda LDL-K başlangıçtaki 150 mg/dl ± 28'den ortalama 78.9 mg/dL ± 30'a düşmüştür ve pravastatin grubunda LDL-K başlangıçtaki 150 mg/dL ± 26'dan ortalama 110 mg/dL ± 26'ya düşmüştür (p<0.0001). Atorvastatin aynı zamanda ortalama TK'ü %34.1 oranında (pravastatin: %-18.4, p<0.0001), ortalama TG düzeyini %20 oranında (pravastatin: %-6.8, p<0.0009) ve ortalama apolipoprotein B'i %39.1 oranında (pravastatin: %-22.0, p<0.0001) anlamlı ölçüde azaltmıştır. Atorvastatin ortalama HDL-K'ü %2.9
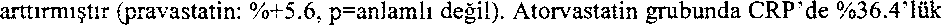 (pravastatin: %+5.6, p=anlamlı değil). Atorvastatin grubunda CRP'de %36,4'lük ortalama azalma olmuştur, buna karşılık pravastatin grubundaki azalma %5.2 olmuştur (p<0.0001).
(pravastatin: %+5.6, p=anlamlı değil). Atorvastatin grubunda CRP'de %36,4'lük ortalama azalma olmuştur, buna karşılık pravastatin grubundaki azalma %5.2 olmuştur (p<0.0001).İki tedavi grubunun güvenlik ve tolerabilite profilleri birbirine benzer olarak gözlenmiştir.
Tekrarlayan İnmenin Önlenmesi
Kolesterol Seviyelerinin Agresif Olarak Düşürülmesi Yoluyla İnmenin Önlenmesi (Stroke Prevention by Aggressive Reduction in Cholesterol Levels, SPARCL) çalışmasında günde 80 mg atorvastatin veya plasebonun inme üzerindeki etkisi, son 6 ay içinde inme veya geçici iskemik atak (GİA) geçiren ve koroner kalp hastalığı (KKH) öyküsü bulunmayan 4731 hasta üzerinde değerlendirilmiştir. Hastaların % 60'ı erkek, yaşları 21-92 arasında (ortalama 63 yaş) ve ortalama başlangıç LDL düzeyi 133 mg/dl idi. Ortalama izlem süresi
4.9 yıl olan bu çalışmada tedavi sonrası ortalama LDL-K düzeyleri atorvastatin grubunda 73 mg/dl, plasebo grubunda ise 129 mg/dl olmuştur.
Atorvastatin 80 mg, plasebo ile karşılaştırıldığında primer sonlamm noktası olan ölümcül ve ölümcül olmayan inme riskini % 15 oranında azaltmıştır (HR 0.85; %95 CI, 0.72-1.00; p=0.05 veya başlangıç faktörleri için yapılan ayarlamadan sonra 0.84; % 95 CI, 0.71-0.99; p=0.03). Atorvastatin 80 mg tedavisi, majör koroner olayların (HR 0.67; %95 CI, 0.51 -0.89; p=0.06), herhangi bir KKH olayının (HR 0.60; %95 CI, 0.48-0.74; p<0.001) ve revaskülarizasyon girişimlerinin (HR 0.57; %95 CI, 0.44-0.74; p<0.001) riskini anlamlı ölçüde azaltmıştır.
Post-hoc analizine göre, atorvastatin 80 mg plasebo ile karşılaştırıldığında iskemik inme sıklığını azaltmış (218/2365, % 9.2' ye karşı 274/2366, %11.6, p=0.01) ve hemorajik inme sıklığını arttırmıştır (55/2365, %2.3'e karşı 33/2366, %1.4, p=0.02). Ölümcül hemorajik inme sıklığı gruplar arasında benzerdi (17 atorvastatine karşı 18 plasebo). Atorvastatin 80 mg ile kardiyovasküler olay riskinde azalma, çalışmaya hemorajik inme ile giren ve tekrarlayan hemorajik şoku olan (7 atorvastatine karşı 2 plasebo) hastalar hariç tüm hasta gruplarında görülmüştür.
Atorvastatin 80 mg ile tedavi edilen hastalarda herhangi bir tip inme (265 atorvastatine karşı 311 plasebo) ve KKH olayları (123 atorvastatine karşı 204 plasebo) daha az sayıda idi. İki grup arasında total mortalite oranları (216 atorvastatine karşı 211 plasebo) benzer bulunmuştur. Toplam advers olay sıklığı açısından tedavi grupları arasında fark bulunmamıştır.
Kardiyovasküler Olaylardan Sekonder Korunma
Yeni Hedefler Tedavi çalışmasında (Treating to New Targets, TNT), atorvastatin 80 mg/gün'e karşın atorvastatin 10 mg/gün'ün etkisi klinik olarak saptanmış koroner kalp hastası olan 10001 kişide (%94 beyaz, %81 erkek, %38 >65 yaş) değerlendirilmiştir ve bu hastalar 8 haftalık açık etiketli aktif çalışma sürecinin sonunda atorvastatin 10 m g/gün ile <130 mg/dLTik LDL-K seviyesi hedefine ulaşmışlardır. Daha sonra hastalar atorvastatin 10 mg/gün ya da 80 mg/gün almak üzere randomize edilerek ortalama 4.9 yıl takip edilmişlerdir. 12. haftada ortalama LDL-K, TK, TG, non-HDL-K ve HDL-K seviyeleri atorvastatin 80 mg ile tedavi sırasında 73, 145, 128, 98 ve 47 mg/dL; atorvastatin 10 mg ile ise 99, 177,152, 129 ve 48 mg/dL olmuştur.
TNT çalışmasında, primer sonlanım noktası majör kardiyovasküler olaya (KKH nedeniyle ölüm, ölümcül olmayan miyokard enfarktüsü, canlandırma yapılan arrest, ölümcül olan veya olmayan inme) kadar geçen süre olarak belirlenmiştir. Atorvastatin 80 mg/gün kolunda, atorvastatin 10 mg/gün kolu ile karşılaştırıldığında daha az oranda majör kardiyovasküler olay görülmüş (atorvastatin 80 mg/gün kolunda 434 olaya karşı atorvastatin 10 mg/gün kolunda 548 olay) ve atorvastatin 80 mg/gün tedavisi ile majör kardiyovasküler olaylarda %22 rölatif risk azalması elde edilmiştir (p=0.0002).
TNT çalışmasında atorvastatin 80 mg/gün tedavisi ile sağlanan risk azalması:
Önemli Sonuç |
Atorvastatin 10 mg (N=5006) |
Atorvastatin 80 mg (N=4995) |
HRa (%95 CI) | ||
BIRINCILSONUÇ* |
n |
(%) |
n |
(%) |
|
|
ilk majör kardiyovasküler olay |
548 |
(10.9) |
434 |
(8.7) |
0.78 (0.69, 0.89) |
Birincil sonucun bileşenleri |
|
|
|
|
|
|
Ölümcül olmayan, işlem gerektirmeyen MI |
308 |
(6.2) |
243 |
(4.9) |
0.78 (0.66,0.93) |
İnme(ölümcül ve ölümcül olmayan) |
155 |
(3.1) |
117 |
(2.3) |
0.75 (0.59, 0.96) |
İKİNCİL SONUÇLAR** |
|
|
|
|
|
|
ilk KKY ile hastaneye yatma |
164 |
(3.3) |
122 |
(2.4) |
0.74 (0.59, 0.94) |
|
İlk KABG ya da diğer koroner re-vaskülarizasyon prosedürü15 |
904 |
(18.1) |
667 |
(13.4) |
0.72 (0.65, 0.80) |
|
Belgelenen ilk angina sonucu0 |
615 |
(12.3) |
545 |
(10.9) |
0.88 (0.79, 0.99) |
* majör kardiyovasküler sonuç (MCVE) = KKH'na bağlı ölüm, ölümcül olmayan miyokard enfarktüsü, hayata döndüriilen kardiyak arest, ölümcül ve ölümcül olmayan inme ** birincil sonuçlara dahil olmayan ikincil sonuçlar
HR = tehlike oranı; CI = güven aralığı; MI = miyokard enfarktüsü; KKY = konjestif kalp yetmezliği; KABG = koroner arter baypas gneft
İkincil sonuçlar için güven aralığı çoklu karşılaştırmalara uyarlanmamıştır.
Tedavi grupları arasında tüm nedenlere bağlı mortalite açısından önemli bir fark saptanmamıştır: atorvastatin 10 mg/gün grubunda 282 (%5.6); 80 mg/gün grubunda 284 (%5.7). KKH ölümü ve ölümcül inme bileşenleri dahil kardiyovasküler ölüm yaşayan hastaların oranı 10 mg atorvastatin grubuna göre 80 mg atorvastatin grubunda daha az olmuştur. Kardiyovasküler sebeple olmayan ölüm yaşayan hastaların oranı atorvastatin 80 mg grubunda atorvastatin 10 mg grubuna göre daha fazla olmuştur.
Atorvastatinin iskemik olaylar ve total mortalite üzerindeki etkileri, Agresif Kolesterol Az altımı ile Miyokard İskemisinin Azaltılması (Myoeardial Ischemia Reduetion with Aggressive Cholesterol Lowering, MIRACL) çalışmasında incelenmiştir. Bu çok merkezli, randomize, çift kör, plasebo kontrollü çalışmaya, 3.086 akut koroner sendromu (kararsız anjina ve Q dalgasız miyokard enfarktüsü) hastası dahil edilmiştir. Ortalama 16 haftalık bir süre boyunca günde 80 mg atorvastatin veya plasebo gruplarına randomize edilmişlerdir. Atorvastatin grubunda son LDL-K düzeyi 72 mg/dL, total-K 147 mg/dL, HDL-K 48 mg/dL ve TG 139 mg/dL bulunmuştur. Plasebo grubunda ise son LDL-K düzeyi 135 mg/dL, total -K 217 mg/dL, HDL-K 46 mg/dL ve TG 187 mg/dL bulunmuştur. Atorvastatin, iskemik olay ve ölüm riskini %16 oranında anlamlı ölçüde azaltmıştır. Belgelenmiş miyokard iskemisi ile angina pektoris nedeniyle tekrar hastaneye yatış riski %26 oranında anlamlı bir şekilde azalmıştır. Başlangıç LDL-K aralığının tümünde atorvastatin iskemik olay ve ölüm riskini benzer oranlarda azaltmıştır. Buna ek olarak, atorvastatin, Q dalgasız miyokard enfarktüsü ve kararsız anginası olan, erkek ya da kadın, 65 yaş üzeri ya da altı hastalarda iskemik olay ve ölüm riskini benzer oranlarda azaltmıştır.
İDEAL (Agresif Lipid düşürücü tedavi ile son noktalarda ek azalma, In the Incremental Decrease in Endpoints Through Aggresive Lipid Lowering Study) koroner kalp hastalığı öyküsü olan 8.888 hastada (< 80 yaş) atorvastatin tedavisi ile simvastatin 20-40 mg/gün tedavisi karşılaştırılmış ve her iki tedavinin kardiyovasküler risklerde ek azalma sağlayıp sağlamadığı değerlendirilmiştir. Hastaların çoğu erkek (%81), beyaz (%99) olup ortalama yaş 61.7 idi. Randomizasyonda ortalama LDL-K değeri 121.5 mg/dL olup hastaların %76'sı statin tedavisi alıyordu. Prospektif, randomize, açık kollu, kör olan bu çalışmada hastalar ortalama 4.8 yıl takip edildi. Atorvastatin 80 mg tedavisi ile ortalama LDL-K, total kolesterol, trigliserid ve non HDL-K değerleri 12 haftada 78, 145, 115, 45 ve 100 mg/dL iken simvastatin 20-40 mg/gün tedavisi ile 105, 179, 142, 47 ve 132 mg/dL olmuştur. Çalışmanın primer son noktası olan ilk majör kardiyovasküler olay oranında (ölümcül KKH, ölümcül olmayan miyokard enfarktüsü, canlandırma yapılmış kardiyovasküler arrest) her iki tedavi kolu arasında anlamlı fark saptanmamıştır (Atorvastatin 80 mg/gün kolunda 411 (%9.3) olaya karşı simvastatin 20-40 mg/gün kolunda 463 (%10.4) olay, HR 0.89 %95 C1 (0.78 - 1.01), p= 0.007). Tüm nedenlere bağlı mortalite oranlan açısından, her iki tedavi kolunda fark saptanmamıştır (Atorvastatin 80 mg tedavi kolunda 366 (%8.2)5a karşı simvastatin 20-40 mg tedavi kolunda 374 (%8.4)). Kardiyovasküler nedenlere bağlı olan ve olmayan Ölüm oranlan her iki tedavi kolunda benzer olmuştur.
Pediyatrik Hastalarda Heterozigot Familval Hiperkolesterolemi
Çift kör, plasebo kontrollü bir çalışma ve bunu izleyen açık etiketli fazda, heterozigot familyal hiperkolesterolemisi (FH) veya ciddi hiperkolesterolemisi olan 10-17 yaşındaki (ortalama yaş 14.1) 187 erkek çocuk ve menarş sonrası kız çocuk 26 hafta boyunca atorvastatin (n=140) veya plasebo (n=47) koluna randomize edildi ve daha sonra 26 hafta boyunca tümü atorvastatin aldı. Çalışmaya dahil edilme koşulları, 1) >190 mg/dL başlangıç LDL-K seviyesi veya 2) >160 mg/dL başlangıç LDL-K seviyesi ve ailevi FH öyküsü ya da birinci veya ikinci derece akrabada belgelenmiş erken dönem kardiyovasküler hastalık olmasıydı. Ortalama başlangıç LDL-K değeri, atorvastatin grubunda 218.6 mg/dL (aralık: 138.5-385.0 mg/dL), buna karşılık plasebo grubunda 230.0 mg/dL (aralık: 160.0-324.5 mg/dL) idi. Atorvastatin dozajı (günde bir kez) ilk 4 hafta 10 mg idi, LDL-K düzeyi >130 mg/dL olan olgularda 20 mg'a titre edildi. Çift kör fazda 4. haftadan sonra 20 mg'a çıkılması gereken hasta sayısı, atorvastatin ile tedavi gören grupta 80 idi (%57.1). Atorvastatin, 26 haftalık çift kör fazda plazmada total-K, trigliserid ve apolipoprotein B düzeylerini anlamlı ölçüde azalttı.
Atorvastatinin, Heterozigot Familyal Hiperkolesterolemisi veya Ciddi Hiperkolesterolemisi Olan Adolesan Erkek ve Kız Çocuklarında Lipid Düşürücü Etkisi (Intention-to-Treat Popülasyonda Sonlanım Noktasında Başlangıca Göre Ortalama Fark Yüzdesi)
|
DOZAJ |
N |
Total-K |
LDL-K |
HDL-K |
TG |
Apolipoprotein B |
|
Plasebo |
47 |
-1.5 |
-0.4 |
-1.9 |
1.0 |
0.7 |
|
Atorvastatin |
140 |
-31.4 |
-39.6 |
2.8 |
-12.0 |
-34.0 |
Bu kısıtlı kontrollü çalışmada, kız çocukların adet döngüsü süresinde veya erkek çocukların cinsel olgunlaşma ve büyümeleri üzerinde herhangi bir saptanabilir etkisi yoktu. Atorvastatin, puberte öncesi hastalar veya 10 yaşın altındaki çocuklarda kontrollü klinik çalışmalarla incelenmemiştir. 20 mg'm üzerindeki dozların güvenliği ve etkinliği, çocuklarda kontrollü çalışmalarda denenmemiştir. Çocukluk çağında alınan atorvastatin terapisinin, erişkinlik döneminde morbidite ve mortalitenin azaltılması yönündeki uzun vadeli etkinliği belirlenmemiştir.
5.2 Farmakokinetik özellikler
Emilitn:
Atorvastatin oral uygulamadan sonra hızla absorbe olur; maksimum plazma konsantrasyonları 1 ila 2 saat arasında görülür. Emilimin derecesi ve plazma atorvastatin konsantrasyonları, atorvastatin dozuyla orantılı olarak artar. Atorvastatin tabletleri solüsyonlarla kıyaslandığında %95 - %99 biyoyararlılığa sahiptir. Atorvastatinin mutlak biyoyararlılığı yaklaşık %14'dür ve HMG-KoA redüktaz inhibıtör aktivitesinin sistemik yararlılığı yaklaşık %30'dur. Düşük sistemik yararlılık gastrointestinal mukozadaki pre-sistemik klerense ve/veya hepatik ilk-geçiş metabolizmasına bağlanır. Cmaks ve EAA ile değerlendirildiğinde yemekler ilaç emiliminin hızını yaklaşık %25 ve miktarını %9 oranında azaltsa da, atorvastatinin yemekler ile beraber veya ayrı verilmesi durumunda LDL-K azalmasının benzer olduğu görülür. Plazma atorvastatin konsantrasyonu ilaç akşam kullanıldığında sabah kullanımına göre daha düşük olur (Cmaks ve EAA için yaklaşık %30). Ancak LDL-K azalması ilacın alınma zamanına bağlı olmaksızın aynıdır (Bkz. Bölüm 4.2). Darılım:
............................O
Atorvastatinin ortalama dağılım hacmi yaklaşık 381 L'dir. Atorvastatin plazma proteinlerine
> %98 oranında bağlanır. Alyuvar/plazma oranı yaklaşık 0.25'dir ve bu oran alyuvarlara penetrasyonun zayıf olduğunu gösterir.
B ivo transformasyon:
Atorvastatin büyük oranda sitokrom P450 3A4 enzimi ile orto- ve parahidroksilat türevlerine ve çeşitli beta oksidasyon ürünlerine metabolize olur. İn vitro olarak HMG-KoA redüktazın orto- ve parahidroksilat metabolitleri yoluyla inhibisyonu atorvastatininkine denktir. HMG-KoA redüktaz için sirküle eden inhibitör aktivitenin yaklaşık %70'i aktif metabolitlere bağlıdır. Sitokrom P4503A4 izoenziminin bilinen bir inhibitörü olan eritromisin ile birlikte uygulandığında insanlarda atorvastatinin plazma konsantrasyonlarının artışıyla uyumlu olarak, in vitro çalışmalar atorvastatinin hepatik sitokrom P4503A4 ile metabolizmasının önemini göstermektedir. Ayrıca in vitro çalışmalar göstermektedir ki atorvastatin sitokrom P4503A4'ün zayıf bir inhibitörüdür. Atorvastatin ile büyük oranda sitokrom P450 3A4 tarafından metabolize edilen bir bileşik olan terfenadinin beraber uygulanması, terfenadinin plazma konsantrasyonlarını klinik açıdan önemli olarak etkilemez. Bu sebeple atorvastatinin diğer sitokrom P450 3A4 substratlarınm farmakokinetiğini önemli oranda (ölçüde) değiştirmesi beklenmez (Bkz. Bölüm 4.5). Hayvanlarda, orto-hidroksi metabolitleri daha ileri glukuronidasyona tabi olur.
Eliminasyon:
Atorvastatin ve metabolitleri, hepatik ve/veya ekstrahepatik metabolizmayı takip ederek öncelikle safrada elimine edilir. Bununla birlikte, ilacın enterohepatik re-sirkülasyona uğramadığı görünmektedir. Atorvastatinin ortalama plazma eliminasyon yarı-ömrü insanlarda yaklaşık 14 saattir. HMG-KoA redüktaz için inhibitör aktivitenin yan-ömrü aktif metabolitlerin katkısı nedeniyle yaklaşık 20-30 saattir. Oral uygulanan atorvastatin dozunun %25sinden daha az kısmı idrarda saptanmıştır.
Hastalardaki karakteristik özellikler
Yaslılar:
Atorvastatinin plazma konsantrasyonu, sağlıklı yaşlılarda (>65 yaş) genç yetişkinlere göre daha yüksektir (yaklaşık Cmaks için %40, EAA için %30). ACCESS çalışması, özellikle yaşlı hastaları NCEP tedavi hedeflerine ulaşmaları açısından değerlendirmiştir. Çalışmaya 65 yaş altında 1087, 65 yaş üstü 815, ve 75 yaş üstü 185 hasta katılmıştır. Güvenlilik, etkinlik veya lipid tedavi hedeflerine ulaşma açısından yaşlı hastalar ve tüm popülasyon arasında fark gözlenmemiştir.
Çocuklar:
Pediyatrik popülasyonda farmakokinetik veri bulunmamaktadır.
Cinsiyet:
Atorvastatin plazma konsantrasyonları kadınlarda erkeklerden farklıdır (kadınlarda yaklaşık olarak Cmaks %20 yüksek ve EAA %10 düşüktür). Fakat kadınlar ve erkekler arasında lipid düşürücü etkileri yönünden klinik olarak anlamlı hiçbir fark olmamıştır.
Böbrek yetmezliği:
Böbrek hastalığı atorvastatinin plazma konsantrasyonlarını veya LDL-K düşüşünü etkilemez; bu sebeple böbrek fonksiyon bozukluğu olan hastalarda doz ayarlanması gerekli değildir. (Bkz. Bölüm 4.2)
Hemodiyaliz:
Böbrek hastalığının son safhasındaki hastalarda çalışma yapılmamıştır. İlaç yüksek oranda plazma proteinlerine bağlandığı için hemodiyalizin atorvastatin klerensini önemli ölçüde artırması beklenmemektedir.
Karaciğer yetmezliği:
Atorvastatin plazma konsantrasyonları kronik alkolik karaciğer hastalığı olan hastalarda belirgin olarak (yaklaşık Cmaks'ta 16 kat ve EAA'da 11 kat) artmıştır (Childs-Pugh B) (Bkz. Bölüm 4.3).
SLOC1B1 polimorfizmi:
Atorvastatin dahil tüm HMG-KoA redüktaz inhibitörlerinin hepatik alımı; OATP1B1 taşıyıcısı ile gerçekleşmektedir. SLOC1B1 polimorfizmi olan hastalarda atorvastatinden etkilenme riskinde artış vardır. Bu durum artmış rabdomiyoliz riskine yol açabilir (bkz. bölüm 4.4). OATPIB1 (SLOC1B1 c.521CC) gen kodlamasında polimorfizm; bu genotip varyantı bulunmayan bireylere (c.521TT) göre 2.4-kat daha yüksek bir atorvastatin maruziyeti (EAA) ile bağlantılıdır. Bu hastalarda atorvastatinin genetik olarak bozulmuş bir hepatik alımı da olasıdır. Etkinlik için olası sonuçlar bilinmemektedir.
İlaç Etkileşimleri
Birlikte uygulanan ilaçların atorvastatinin farmakokinetiği üzerindeki ve atorvastatinin birlikte uygulanan ilaçların farmakokinetiği üzerindeki etkileri aşağıdaki tabloda verilmiştir (bkz.
Bölüm4.4Özel kullanım uyarıları ve önlemleri, ve bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).
Birlikte Uygulanan İlaçların Atorvastatinin Farmakokinetiği Üzerindeki Etkileri
|
Birlikte uygulanan ilaç ve doz rejimi |
Atorvastatin | ||
|
|
Doz (mg) |
Eğri Altında Kalan Alan ........_ ... . &(AUCj'daki Değişim" |
C^u/taki Değişim- |
|
#Siklosporin 5.2 mg/kg/gün, stabil doz |
28 gün boyunca günde bir kez 10 mg |
i 8.7 kat |
i 10.7 kat |
itTipranavir 500 m0 Günde iki kez / ritonavir 200 mg Günde iki kez, 7 gün |
Tek doz 10 mg |
t 9.4 kat |
T 8.6 kat |
|
# Telaprevir 750 mg q8h, 10 gün |
Tek doz 20 mg |
i 7.88 kat |
110.6 kat |
#Sakinavir 400 mg, Günde iki kez / ritonavir 400 mg, Günde iki kez, 15 gün |
4 gün boyunca günde bir kez 40 mg |
f 3.9 kat |
i 4.3 kat |
|
# Klaritromisin 500 mg, Günde iki kez, 9 gün |
8 gün boyunca günde bir kez 80 mg |
i 4.4 kat |
i 5.4 kat |
|
# Darunavir 300 mg Günde iki kez /ritonavir 100 mg Günde iki kez, 9 gün |
4 gün boyunca günde bir kez 10 mg |
i 3.4 kat |
f 2.25 kat |
|
#itrakonazol 200 mg, Günde bir kez, 4 gün |
Tek doz 40 mg |
f 3.3 kat |
|%20 |
|
# Fosamprenavir 700 mg Günde iki kez /ritonavir 100 iii§ Günde iki kez, 14 gün |
4 gün boyunca günde Kır Vp7 1 fi mor |
f 2.53 kat |
t 2.84 kat |
|
# Fosamprenavir 1400 mg Günde iki kez, 14 gün |
4 gün boyunca günde bir kez 10 mg |
i 2.3 kat |
|4.04 kat |
|
#Nelfinavir 1250 mg Günde İki kez, 14 gün |
28 gün boyunca günde bir kez 10 mg |
i%74 |
t 2.2 kat |
|
# Greyfurt Suyu, 240 mL, Günde bir kez* |
Tek doz 40 mg |
i%37 |
f%16 |
|
Diltiazem 240 mg, Günde bir kez, 28 gün |
Tek doz 40 mg |
i%51 |
Değişiklik yok |
|
Eritromisin 500 mg, Günde dört kez, 7 gün |
Tek doz 10 mg |
i%33 |
i%38 |
|
Amlodipine 10 mg, Tek doz |
Tek doz 80 mg |
i%15 |
J.%12 |
|
Simetidin 300 mg, Günde bir kez, 4 hafta |
2 hafta boyunca günde bir kez 10 mg |
J.%1 'den küçük |
J.%11 |
|
Kolestipol lOmg, Günde iki kez, 28 hafta |
28 hafta boyunca günde bir kez 40 mg |
Belirlenmemiştir |
i%26** |
|
Maalox TC® 30 mİ, Günde bir kez, 17 gün |
15 gün boyunca günde 1 kez 10 mg |
|%33 |
|%34 |
|
Efavirenz 600 mg, Günde bir kez, 14 gün |
3 gün boyunca 10 mg |
J.%41 |
ı%ı |
|
#Rifampin 600 mg, Günde bir kez, 7 gün (birlikte verilir) t |
Tek doz 40 mg |
i%30 |
t 2.7 kat |
|
#Rifampin 600 mg Günde bir kez, 5 gün (ayrı dozlarda) f |
Tek doz 40 mg |
j%80 |
|%40 |
|
#Gemfibrozil 600 mg Günde iki kez, 7 gün |
Tek doz 40 mg |
i%35 |
1%1'den küçük |
|
Fenofibrat 160 mg Günde bir kez, 7 gün |
Tek doz 40 mg |
i%3 |
i%2 |
|
Boceprevir 800 mg Günde 3 kez, 7 gün |
Tek doz 40 mg |
İ2.30 kat |
İ2.66 kat |
&%
değişim = % oran değişimi# Klinik yönden anlamlılık için Bölüm 4.4 ve 4.5'e bakınız
* Eğri Altında Kalan Alan (AUC) (1.5 kata kadar) ve/veya Cmaks'da (%71'e kadar) aşırı greyfurt tüketimi (günde 750 mİ - 1.2 litre veya daha fazla) ile büyük artışlar olduğu bildirilmiştir.
** Doz verilmesinden 8-16 saat sonra tek örnek alınmıştır.
*Rifampinin çift etkileşim mekanizması nedeniyle atorvastatinin, rifampin uygulamasının ardından gecikmeli olarak uygulanmasının atorvastatin plazma konsantrasyonlarında anlamlı ölçüde azalma ile ilişkilendirildiğinden rifampin ile eş zamanlı olarak uygulanması önerilmektedir.
%
Bu çalışmadaki sakinavir ile ritonavir dozu klinik olarak kullanılan doz değildir. Klinik olarak kullanıldığında atorvastatin maruziyetindeki artışın bu çalışmada olduğundan daha yüksek olması beklenir. Bu nedenle, dikkatli olunmalı ve gerekli olan en düşük doz kullanılmalıdır.Atorvastatinin Birlikte Uygulanan İlaçların Farmakokinetiği Üzerindeki Etkisi
|
Atorvastatin |
Birlikte uygulanan ilaç ve doz rejimi | ||
|
|
İlaç/Doz (mg) |
Eğri Altında Kalan Alan (AUC)'daki Değişim* |
Cmalcs takt Değişim* |
|
15 gün boyunca günde bir kez 80 mg |
Antipirin, Tek doz 600 mg |
i%3 kat |
4% 11 kat |
|
14 gün boyunca günde bir kez 80 mg |
#Digoksin, günde bir kez 0.25 mg, 20 gün |
T% 15 kat |
i%20 kat |
|
22 gün boyunca günde bir kez 40 mg |
Günde bir kez oral kontraseptif, 2 ay - 1 mg nortindron - 35 H-g etinil estradiol |
i%28 kat i%19kat |
|%23 kat i%30 kat |
|
Tek doz 10 mg |
Tipranavir 500 mg Günde iki kez/ritonavir 200 mg Günde iki kez, 7 gün |
Değişiklik yok |
Değişiklik yok |
|
4 gün boyunca günde 1 kez 10 mg |
Fosamprenavir 1400 mg Günde iki kez, 14 gün |
i%27 |
| %18 |
|
4 gün boyunca günde 1 kez 10 mg |
Fosamprenavir 700 mg Günde iki kez/ritonavir 100 mg Günde iki kez, 14 gün |
Değişiklik yok |
Değişiklik yok |
*
Klinik yönden anlamlılık için Bölüm 4.5'e bakınız.5.3 Klinik öncesi güvenlilik verileri
Karsınoıenez, Mutaıenez. Fertilıte Bozukluğu.
Atorvastatin sıçanlarda karsinojenik bulunmamıştır. Kullanılan maksimum doz, mg/kg vücut ağırlığı olarak, en yüksek insan dozundan (80 mg/gün) 63 kat yüksekti ve EAA (0-24) değeri bazında 8-16 kez daha fazlaydı. Farelerde yapılan 2 yıllık bir çalışmada; erkeklerde hepatosellüler adenom ve dişilerde hepatosellüler karsinom insidansı, kullanılan maksimum dozda; mg/kg vücut ağırlığı bazında en yüksek insan dozundan 250 kat fazla artmıştır. EAA
('fl-94'iha7nlınrlı5ınHn oiotptniV \arrlarm A. 1 1 Vnt Rıı drııftati hiitiin 1ritnva«al
I y İJJUIVİ11 i İVJ
U1 ui 1U111U1 V 1 4 V41. V» k/MlUJ.1 1V1111 iolarak benzer ilaçlar, hem fare hem de sıçanlarda, mg/vücut ağırlığının kilosu olarak, tavsiye edilen en yüksek klinik dozun 12 ila 125 katında tümörleri indüklemiştir.
Metabolik aktivasyonlu ve aktivasyonsuz
in vitro(Salmonella typhimuriumEscherichia coliin vitroin vivo
fare mikronukleus testinde negatiftir.Hayvan çalışmalarında atorvastatinin erkek ve dişi sıçanlarda, 175 - 225 mg/kg/gün'e varan dozlarında fertilite ve üreme üzerine hiçbir advers etki gözlenmemiştir. Bu dozlar mg/kg vücut ağırlığı bazında tavsiye edilen maksimum insan dozunun 100 ila 140 katıdır. iki yıl süreyle verilen 10, 40 veya 120 mg/kg dozlarda atorvastatin, köpeklerde, sperm veya semen parametrelerinde veya üreme organları histopatolojisinde, hiçbir advers etki oluşturmamıştır.
HMG-KoA redüktaz inhİbitörlerinin embriyo ve fetüsün gelişimini etkileyebileceğine dair deneysel hayvan çalışmalanndan gelen kanıtlar bulunmaktadır. Sıçan, tavşan ve köpeklerde atorvastatinin fertilite üzerine etkisi olmamıştır ve teratojenik değildir. Ancak matemal açıdan toksik dozlarda sıçan ve tavşanlarda fetal toksisite gözlenmiştir. Annelerin yüksek doz atorvastatine maruz kalması sırasmda; sıçan yavrularının gelişimi gecikmiş ve doğum sonrası sağkalım düşmüştür. Sıçanlarda; plasental transfere dair kanıt bulunmaktadır. Sıçanlarda, atorvastatinin plazma konsantrasyonları süttekine benzerdir. Atorvastatin veya metabolitlerinin insan sütüne atılıp atılmadığı bilinmemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1 Yardımcı maddelerin listesi
Kalsiyum karbonat Laktoz DCMikrokristalin selüloz Kroskarmelloz sodyum Sükroz stearat Magnezyum stearat (E572)
Hidroksipropil metil selüloz (E464)
Titanyum dioksit (El71)
Polietilen glikol
6.2 Geçimsizlikler
İlgili değildir.6.3 Raf ömrü
36 ay.6.4 Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklanmalıdır.6.5 Ambalajın niteliği ve içeriği
30 ve 90 tablet içeren Alüminyum folyo-Alüminyum poliamid folyo blister ve karton kutu ambalaj.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetme! iğf'nc uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ
Ad :Biofarma İlaç San. ve Tic. A.Ş.Adres :Akpmar Mah. Osmangazi Cad. No: 156 Sancaktepe/İstanbul Telefon :(0216) 398 10 63 - 4 hat Faks :(0216) 419 27 80
8. RUHSAT NUMARASI
209/479.
İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 09.11.2006 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ
İlaç Bilgileri
Cholvast 10 Mg Film Tablet
Etken Maddesi: Atorvastatin
Atc Kodu: C10AA05
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.