Sinir Sistemi » Ağrı Kesici / Ateş Düşürücüler (Aneljezik) » Migren İlaçları » Selectif Serotonin (5HT1) Agonistleri » Zolmitriptan
KISA ÜRÜN BİLGİSİ
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MİGTERA 5 mg film tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:
Zolmitriptan 5
mg
Yardımcı maddeler;
Laktoz anhidrat 213.08 mg
Sodyum nişasta glikolat (Explotab) 5.00 mg Film kaplama materyali
Opadrypink 20A24556 8.0 mg
Yardımcı maddeler için, bölüm 6.1'e bakınız.
3. FARMASÖTİK FORM
Film tablet
Pembe renkli film kaplı ova!, bikonveks tabletler.
4. KLİNİK ÖZELLİKLER
4.1.Terapötik endikasyonlar
MİGTERA, auralı veya aurasız migren ataklarının akut tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:
Bir migren atağının tedavisinde önerilen MİGTERA dozu 2.5 mg'dır.
Eğer semptomlar devam eder veya 24 saat içerisinde tekrarlarsa, alınacak ikinci bir dozun etkili olduğu gösterilmiştir. İkinci bir doz gerekiyorsa bu, başlangıç dozundan en az 2 saat geçtikten sonra alınmalıdır.
Eğer hasta 2.5 mg'lık dozlardan tatmin edici bir fayda görmüyorsa, daha sonraki ataklar 5 mg'lık MİGTERA dozlarıyla tedavi edilebilir. Bu hastalarda dozun alınmasını izleyen 1 saat içerisinde anlamlı bir etki görülür. ¦ "
Migren atağı sırasında alındığı zaman da aynı derecede etkili olan MİGTERA tabletlerin, migren atağı başladıktan sonra mümkün olan en kısa zamanda alınması önerilir.
Tekrarlayan ataklarda 24 saat içerisinde alınacak toplam MİGTERA miktarı 10 mg'ı aşmamalıdır.
MİGTERA migren profılaksisinde kullanılmaz.
Uygulama şekli:
Ora! yolla kullanılır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek /Karaciğer yetmezliği:
Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur (bkz. bölüm 5.2 Farmakokınetik özellikler).
Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır (bkz. bölüm 5.2 Farmakokinetik özellikler). Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır.
Pediyatrik popülasyon:
12 yaşın altındaki çocuklarda kullanım:
Pediyatrik hastalarda zolmitriptanm güvenlilik ve etkililiği değerlendirilmemiştir. Bu nedenle MİGTERA nın bu yaş grubu çocuklarda kullanımı önerilmemektedir.
Ergenlik döneminde kullanım (12-17.yaş arası):
12 ila 17 yaş arası hastalar için zplmitriptan tabletin etkinliği plasebo kontrollü klinik çalışmalarda gösterilmemiştir. Bu sebeple MİGTERA tabletin ergenlik döneminde kullanımı önerilmemektedir.
Geriyatrik popülasyon:
Zolmitriptanm yaşı 65'in üzerinde olan hastalardaki ilaç emniyeti ve etkinliği, sistematik olarak değerlendirilmemiştir. ,
4.3. Kontrendikasyonlar
MİGTERA aşağıdaki durumlarda kontrendikedir;
Ürün bileşiminde bulunan maddelerden herhangi birine karşı bilinen aşırı duyarlığı olanlarda,
Kan basıncı kontrol altında olmayan hipertansiyon vakalarında,
İskemik kalp hastalığında, '
Koroner spazm/ Prinzmeta! angina vakalarında,
Serebrovasküler olay (CVA) veya geçici iskemik atak (TİA) hikayesi olanlarda
MİGTERA tabletin ergotamin veya ergotamin türevleri veya diğer 5-HTj reseptör antagonistleri ile birlikte uygulanması,
Hemiplejik, baziller ve oftalmoplejik migren vakalarında kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
MİGTERA yalnızca, migren teşhisi açıkça konulmuş olan hastalarda kullanılmalı ve önemli olabilecek diğer nörolojik durumların bulunmadığı kesinleştinlmelidir. Zolmitriptanm hemiplejik veya baziler migren tedavisinde kullanımıyla ilgili herhangi bir veri mevcut değildir. Migren hastalarında, belirli serebrovasküler olayların gelişme riski söz konusu
olabilir. 5HTi
B
MİGTERA, semptomatik Wolf-Parkinson-White sendromu vakalarına veya kalpteki aksesuar uyaran iletim yollan ile ilişkili başka aritmileri olan hastalara verilmemelidir.
Çok nadir durumlarda, diğer
5HTIB/JD
agonistleri ile olduğu gibi, koroner vazospazm, anjına pektoris ve miyokard enfarktüsü bildirilmiştir. İskemik kalp hastalığı riski olan hastalara MİGTERA da dahil bu sınıftan bileşiklerle tedaviye başlamadan önce kardiyovasküler değerlendirme yapılması önerilir (bkz. bölüm 4.3 Kontrendikasyonlar). Ancak bu değerlendirmeler kalp hastalığı olan her hastayı belirleyemeyebilir ve çok seyrek olarak herhangi bir kardiyovasküler rahatsızlığı olmayan hastalarda da ciddi kardiyak olaylar gelişmiştir, ¦,
Diğer 5HT]
B
Diğer
5HTIB/ID
agonistleri ile olduğu gibi, hipertansiyon hikayesi olan veya olmayan hastalarda sistemik kan basıncında geçici artış bildirilmiştir, çok nadiren kan basıncındaki bu artışlar belirgin klinik olaylara neden olmuştur.
Diğer
5HTIB/ID
agonistleri ile olduğu gibi, zolmitriptan alan hastalarda nadiren anaflaksi/anaflaktoid reaksiyonlar bildirilmiştir. .
Akut anti- migren ilaçların aşırı kullanımı baş ağrısı sıklığının artmasına ve muhtemelen tedavinin durdurulmasına sebep olabilir.
Triptanların, Selektif Serotonin Geri Alım İnhİbitörleri (SSRIs) ve Serotoııin/ Norepinefrin Geri Alım İııhibitörleriyle (SNRIs) birlikte kullanımının Serotonin Sendromuna neden olabileceği bildirilmiştir. Serotonin Sendromu hayati tehlike oluşturma potansiyeline sahiptir ve mental durum değişikliği (örn: ajitasyon, halüsinasyonlar, koma), otonomik instabilite, (örn: taşikardi, değişken kan basıncı, hipertermi), nöromuskuler bozukluklar (örn: hıperrefleksi, koordinasyon bozukluğu), ve/veya gastrointestinal semptomlar (örn: bulantı, kusma, diyare) gibi belirti ve semptomlar gösterir. MİGTERA ile birlikte SSRI veya SNRI kullanması klinik açıdan gerekli olan hastalarda, özellikle tedavinin başlangıcında ve doz artırıldığında dikkatli bir gözlem önerilir (bkz. bölüm 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri).
MİGTERA tabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
Bu tıbbi ürün 5.0 mg sodyum nişasta glikolat içerir. Sodyum miktarının 23 mg (Immol)'dan az olması nedeniyle sodyuma bağlı herhangi bir olumsuz etki beklenmez.
Kaplama maddesinde bulunan, sunset sarısı FCF Al lak (El 10) ve karmoizin (E122) alerjik reaksiyonlara sebep olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Beta blokörler, oral dihidroergotamin, pizotifen gibi migren profılaksisi ilaçlarının birlikte kullanılmasının, zolmitriptanın etkinliğinde değişiklik yaptığını veya istenmeyen etkilere yol açtığım gösteren hiçbir kanıt yoktur.
Akut semptomatik tedavi amacıyla kullanılan parasetamol, metoklopramid ve ergotamin gibi ilaçlar zolmitriptanın farmakokinetiğini veya tolerabilitesini etkilememiştir. MİGTERA tedavisini izleyen 12 saat içerisinde, diğer 5HT|B/iDagonistlerİnin kullanılmaması gerekir.
Sağlıklı gönüllülerden elde edilen veriler, zolmitriptan ile ergotamin arasında farmakokinetİk veya klinik olarak önemli 'bir etkileşim olmadığını gösterse de, teorik olarak koroner vazospazm riskinin artması olasıdır. Bu nedenle ergotamin içeren preparatlarm kullanılmasını takiben MİGTERA kullanılması için en az 24 saat beklenmesi, bunun aksine MİGTERA kullanılmasını takiben ergotamin içeren preparatlar kullanılması için en az 6 saat beklenmesi önerilir (bkz. bölüm 4.3 Kontrendikasy onlar).
Spesifik bir MAO-A (monoamin oksidaz-A) inhibitörü olan moklobemid kullanılmasını takiben, zolmitriptanın EAA (Eğri Altındaki Alan) değeri küçük bir oranda (%26), aktif metabolitinin EAA değeri ise 3 kat arttığından; bir MAO-A inhibitörü kullanan hastalarda 24 saat içerisinde kullanılacak MİGTERA dozu 5 mg'ı aşmamalıdır.
Genel bir P450 inhibitörü olan simetidin kullanılmasını takiben, zolmitriptanın eliminasyon yarı-ömrü %44, EAA değeri %48 oranında artmıştır. Ayrıca, zolmitriptanın aktif metabolİti olan 183C91'in (N-desmetil) eliminasyon yarı-ömrü ve EAA değeri 2 kat artmıştır. Simetidin kullanan hastalarda 24 saat içerisinde maksimum 5 mg MİGTERA kullanılması önerilir. Etkileşim profili bir bütün olarak göz önünde bulundurulduğunda, bir sitokrom P450 İzoenzimi olan CYP1A2 inhibitörleriyle etkileşim göz ardı edilemez. Bu nedenle, fluvoksamin ve kinolon grubu antibiyotikler (örneğin siprofloksasin) gibi bileşiklerle de aynı şekilde doz azaltılması önerilir Fluöksetİn zolmitriptanın farmakokinetİk parametrelerini etkilemez.
Spesifik serotonin geri alım inhibitörleri olan fluoksetin, sertralin, paroksetin ve sitalopramm terapötik dozları, CYPlA2'yi inhİbe etmez. Fakat, triptanların ve SSRIs (örn: fluoksetin, paroksetin, sertralin) ve SNRIs (örn: venlafaksin, duloksetin) ile kombine kullanımı sırasında Serotonin Sendromu bildirilmiştir (bkz. bölüm 4.4) .
Diğer 5HTib/id agonistleri ile olduğu gibi, zolmitriptan kullanımı ile bitkisel tedavi St John's Wort bitkisel preparatınm
(Hypericum perforatum,
sarı kantaron) arasında dinamik etkileşim potansiyeli mevcut olduğundan, istenmeyen etkilerin artışına neden olabilir.
4.6. Gebelik ve laktasyon Genel tavsiye:
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğuni köntroiü (Kontrasepsiyon):
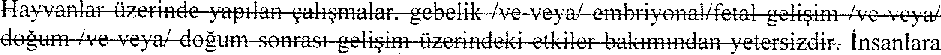
yönelik potansiyel risk bilinmemektedir.
Gebelik dönemi
MİGTERA, gebe kadınlarda yalnızca, annede elde edilecek faydaların, fetüsün karşı karşıya kalabileceği risklerden açıkça daha fazla olması durumunda kullanılmalıdır. Gebe kadınlarda yapılmış herhangi bir çalışma yoktur fakat hayvan çalışmalarında hiçbir teratojenık etki ile karşılaşıl mamı ştır (bkz. bölüm 5.3 Klinik öncesi güvenlilik verileri).
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir.
Laktasyon dönemi -
Zolmitriptanm süt veren hayvanların sütüne geçtiği gösterilmiştir. Zolmitriptanm insanlarda anne sütüne geçişi konusunda herhangi bir veri mevcut olmadığından MİGTERA'nm bebeğini emziren kadınlarda kullanılması sırasında dikkatli olmak gerekir.
Üreme yeteneği/Fertilite
Hayvanlarda yapılan üreme çalışmalarında, fertilite üzerinde bir etki ortaya çıkmamıştır. İnsanlar üzerinde ya da klinik dışı üreyebilirlik çalışmalarından elde edilmiş veri bulunmamaktadır,
4.7. Araç ve makine kullanımı üzerindeki etkiler
20 mg'a kadar çıkan zolmitriptan dozları, psikomotor test performansını anlamlı şekilde bozmanııştır. MİGTERA kullanımının, hastaların araç ya da makine kullanma .yeteneğini bozma olasılığı yoktur. Ancak somnolansa neden olabileceğinden, hastalar motorlu araçlar da dahil makine kullanımı sırasında dikkatli olmaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Zolmitriptan, iyi tolere edilir. Advers olaylar tipik olarak hafif/orta şiddettedir, geçicidir, ciddi değildir ve ek tedavi gerektirmeksizin kendiliğinden düzelir.
Olası yan etkilerin, dozun alınmasını izleyen 4 saat içerisinde görülme eğilimi vardır ve bunlar, tekrarlanan dozlardan sonra sıklaşmaz.
İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır:
Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). . ¦
Bağışıklık sistemi hastalıkları:
Seyrek: Anaflaktik /anaflaktoid reaksiyonlar, aşırı duyarlılık reaksiyonları
Sinir sistemi hastalıkları:
Yaygın: Duyu anormallikleri ve bozuklukları, baş dönmesi, baş ağrısı, hiperestezi, parestezi, somnolans, sıcaklık hissi
Kardiyak hastalıklar:
Yaygın: Palpitasyon
Yaygın olmayan: Taşİkardi ¦
Çok seyrek: Anjina pektoris, koroner vazospazm, miyokard enfarktüsü
Vasküler hastalıklar:
Yaygın olmayan: Sistemik kan basıncında geçici artış
Gastrointestinal hastalıklar:
Yaygın: Karın ağrısı, ağız kuruluğu, bulantı, kusma
Çok seyrek: Kanlı ishal, gastrointestinal enfarkt veya nekroz, gastrointestinal iskemik olaylar, iskemik kolit, splenik enfarkt
Deri ve deri altı doku hastalıkları:
Seyrek: Anjiyoödem, ürtiker '
Kas- iskelet sistemi, bağ doku ve kemik hastalıkları
Yaygın: Kas zayıflığı, miyalji
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Poliüri, idrar sıklığı ...
Çok seyrek: Acil İdrar yapma hissi
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Astenı, boğaz boyun ekstremitelerde veya göğüste ağırlık, daralma veya baskı hissi
50 mg'lık bir tek oral doz zolmitriptan alan gönüllülerde genellikle sedasyon görülmüştür, Zolmitriptan tabletlerin eliminasyon yan-ömrü 2.5-3 saat olduğundan (bkz. bölüm 5.2 Farmakokinetik özellikler) aşırı doz alan hastalar, en az 15 saat boyunca veya semptomlar ve belirtiler devam ettiği sürece izlenmelidir.
Zolmitriptanın spesifik bir antidotu yoktur. Şiddetli intoksikasyon durumunda yoğun bakım önlemlerinin alınması ve bu arada açık bir hava yolu sağlanması ve devam ettirilmesi, yeterli oksijenasyon ve ventilasyon sağlanması, kardiyovasküler sistemin izlenmesi ve desteklenmesi önerilir. ¦
Hemodiyaliz veya peritoneal diyalizin zolmitriptanın serum konsantrasyonları üzerinde etkileri bilinmemektedir.
S. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Selektif serotonin (5HTı) agonistleri ATC kodu: N02CC03
Preklinik çalışmalarda zolmitriptanın, vasküler insan rekombinant 5HT
İB ve 5HT
İD reseptör alt tiplerinin selektif agonisti olduğu gösterilmiştir. Zolmitriptan, yüksek afiniteli bir 5HTıg/
]D reseptör agonistidir ve ona dereceli 5HTı
A reseptör afinitesine sahiptir. Zolmitriptanın 5HT
2-, 5HT3-, 5HT4, alfar, alfa2- veya betaı-adrenerjik; Hı-, H2-, histaminik; muskarinik, dopaminerjikı veya dopaminerjik2 reseptörlerine belirgin bir afmitesi (radyoligand bağlanma analizleri ile ölçüldüğü gibi) veya farmakolojik aktivitesi yoktur, 5HT
ID reseptörü baskın
olarak, trigemiııal sinirlerin hem perİferik hem de merkezi sinapslarmda presinaptik yerleşmiştir ve klinik öncesi çalışmalar zolmitriptanın her iki bölgeyi de etkileyebildiğini göstermiştir.
Bir kontrollü çalışmada 696 ergenlik dönemindeki migren hastasında, zolmitriptan tabletlerin
2.5 mg, 5 mg ve 10 mg dozlarının plaseboya üstünlüğü gösterilememiştir.
5.2. Farmakokinetik özellikler Genei özellikler
Zolmitriptan hızla ve iyi bir şekilde emilir. Asıl bileşiğin ortalama mutlak biyoyararlanım oranı yaklaşık %40'tır. ¦
Emilim:
Zolmitriptan konvensiyonel tabletlerin oral yolla alınmasını takiben, zolmitriptan hızla ve iyi bir şekilde (dozun en az %64'ü) emilir. Asıl bileşiğin ortalama mutlak biyoyararlanım oranı yaklaşık %40'tır. Yine bir
5HTIB/ID
agonisti olan ve hayvan modellerinde zolmitriptanın 2-6 katı daha güçlü olduğu gösterilen, aktif bir metaboliti de vardır (183C91, N-desmetil metabolit).
Dağılım;
Sağlıklı kişilerde, tek doz olarak verildiğinde,-zolmitriptan ve aktif metaboliti 183C91, 2.5 ila 50 mg doz aralığında dozla orantılı EAA ve C
mak
5 gösterir. C
maks'ın %75'İ İle absorpsiyon hızlıdır ve
t
şaat içinde ulaşılır, plazma konsantrasyonları 4 ila 6 saat devam eder. Zolmitriptan absorpsiyonu gıda varlığından etkilenmez. Zolmitriptanın çoklu dozlarında bile biriktiği gösterilmemiştir.
Zolmitriptan vücuttan daha çok, karaciğerde biyotransformasyon geçirerek oluşan metabolitlerinin böbrekler yoluyla atılması şeklinde uzaklaştırılır. Zolmitriptanın başlıca 3 metaboliti vardır: İndol asetik asit (plazmadaki ve idrardaki ana metabolit), N-oksit ve N-desmetil analogları. Bunlardan N-desmetil metabolit (183C91) aktiftir, diğerleri değildir. Plazmadaki 183C91 konsantrasyonları, asıl ilacın yaklaşık yarısı olduğundan bu metabolitin, zolmitriptanın terapötik etkisine katkıda bulunması beklenir. Tek oral dozun %60'dan fazlası idrarla (esas olarak indol asetik asit metaboliti olarak) atılır ve %30'u değişmemiş ana bileşen olarak feçesle atılır. ¦
Karaciğer hastalığının zolmitriptanın farmakokinetiği üzerindeki etkisini değerlendirmek için yapılan çalışmada, sağlıklı gönüllülerle orta veya ileri derecede karaciğer bozukluğu olan hastalar karşılaştırıldığında orta dereceli karaciğer bozukluğu olan hastaların EAA ve C
maks değerleri sırasıyla %94 ve %50 ve ileri derecede karaciğer bozukluğu olan hastaların ise %226 ve %47 arttığı gösterilmiştir. 183C91 metaboliti için, orta düzeyde karaciğer yetmezliği olan hastalarda EAA ve C
maks sırasıyla %33 ve %44 azalmış, şiddetli karaciğer yetmezliği olan hastalarda sırasıyla %82 ve %90 azalmıştır.
Eliminasvon:
.
Zolmitriptanın plazma yarı ömrü (tj/a) sağlıklı gönüllülerde 4.7 saat, orta derecede karaciğer bozukluğu olan hastalarda 7.3 saat ve ileri derecede karaciğer bozukluğu olanlarda ise 12 saattir. 183C91 metaboliti için ilgili 1
1/2 değerleri sırasıyla 5.7 saat, 7.5 saat ve 7.8 saattir.
İntravenöz kullanımdan sonraki ortalama total plazma klerensi 10 ml/dak/kg kadardır ve bunun üçte biri renal klerenstir. Renal klerensin glomerüler fıltrasyon hızından fazla olması renal tübüler sekresyonu akla getirmektedir. İntravenöz dozdan sonraki dağılım hacmi, 2.4 lıtre/kg'dır. Plazma proteinlerine bağlanma oram düşüktür (yaklaşık %25). Zolmitriptamn ortalama elimınasyon yarı-ömrü 2.5-3 saat kadardır. Metabolitlerinin yan ömrünün de benzer olması, eliminasyonlarmın oluşum hızı ile sınırlı olduğunu akla getirmektedir.
Zolmitriptamn ve metabolitlerinin renal klerensi, orta-ileri derecede böbrek bozukluğu vakalarında sağlıklı gönüllülere göre 7 ila 8 kat azalmıştır, ana bileşenin ve aktif metabolitin EAA değeri hafif artarken (sırasıyla %16 ve %35), yarı ömrü 1 saat artış ile 3 İla 3,5 saattir. Bu parametreler sağlıklı gönüllülerde gözlenen aralık dahilindedir.
Hastalardaki karakteristik özellikler
Yaslılar
Z.°
lrnİtr*
ptanm iler* y
aS
ta= sağlıklı insanlardaki farmakokinetiği, sağlıklı genç gönüllülerdekine benzer bulunmuştur.
Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur.
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır. Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastâlarda, 24 saatte önerilen maksimum doz 5 mg'dır.
Etkileşimler
Sağlıklı küçük bir gönüllü grubunda, zolmitriptan ergotaminle birlikte kullanıldığında farmakolojik etkileşim görülmemiştir. Zolmitriptamn ergotamin/kafein ile birlikte verilmesi, ıyı tolere edilmiş ve yan etkilerde ya da kan basıncı değişikliklerinde, zolmitriptamn tek başına kullanılmasına kıyasla herhangi bir artışla sonuçlanmamıştır.
Rifampisin uygulanmasını takiben, zolmitriptan veya aktif metabolitlerinde klinik olarak ilişkili bir fark gözlenmemiştir.
Bir MAO-B ınhibitörü olan selegilin, serotonin geri-alım inhibitörü (SSRI) olan fluoksetin, zolmitriptan farmakokinetik parametreleri üzerinde etkili olmamıştır. '
5.3. Klinik öncesi güvenliiik verileri
Zolmitriptan kullanılarak oral teratojen etki çalışması yapılmıştır. Zolmitriptamn maksimum tolere edilebilen dozları 1200 mg/kg/gün (EAA 605 jıg/ml saat = insanda önerilen maksimum günİük dozdan 15 mg'a ait EAA'nın yaklaşık 3700 katı) ve 30 mg/kg/gün (EAA 4.9 fig/ml. saat - insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nın yaklaşık 30 katı) sıçan ve tavşanlarda herhangi bir teratojenik etki görülmemiştir.
Beş genotoksisite çalışması yapılmış ve bunların sonucunda zolmitriptamn, insanlarda herhangi bir genetik risk taşımadığına karar verilmiştir.
Sıçanlarda ve farelerde uygulanabilen en yüksek dozlarla yapılan karsinojen etki çâlışmalan, tümorojen etki izlenimi vermemiştir. '
Erkek ve dişi sıçanlarda, toksisite tarafından sınırlanan dozlar kullanılarak yapılan üreme çalışmaları, fertilite üzerinde herhangi' bir etki göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz anhidrat
Mikrokristalin selüloz PH 102 Sodyum nişasta glikolat (Explotab)
Magnezyum stearat
Film kaplama materyali Opadry ¦ pink 20A24556 (titanyum dioksit (El71) karmoizin (E 122),sarı demir oksit (E172),sunset sarısı FCF lak (El 10) ve indigo karmin lak (E132))
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay -
6.4. Saklamaya yönelik özel uyarılar
25
DC'nin altındaki oda sıcaklığında ve'ambalajında saklanır.
6.5. Ambalajın niteliği ve içeriği
Al/Al blister
Kutuda 2, 3 ya da 6 film tabletlik blisterler halinde.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların. Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
NOBEL İLAÇ SANAYİİ ve TİCARET A.Ş.
İnkılap Mah. Akçakoca Sok. No: 10
34768 Ümraniye / İstanbul '
Tel: (216) 633 60 00 Fax: (216) 633 60 01-02
8. RUHSAT NUMARASI(LARI)
220/68 ¦
9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 02.09.2009 Ruhsat yenileme tarihi:
10. KÜB'ün YENİLENME TARİHİ
KISA ÜRÜN BİLGİSİ
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MİGTERA 5 mg film tablet ' '
2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:
Zolmitriptan 5 mg
Yardıma maddeler:
Laktoz anhidrat 213.0 8 mg
Sodyum nişasta glikolat (Explotab) 5.00 mg Film kaplama materyali '
Opadry pink 20A24556 8.0 mg
Yardımcı maddeler için, bölüm 6. T e bakınız.
3. FARMASÖTİK FORM
Film tablet '
Pembe renkli film kaplı oval, bikonveks tabletler.
4.
KLİNİK ÖZELLİKLER
4.
1 .Terapötik endikasyonlar .
MİGTERA, auralı veya aurasız migren ataklarının akut tedavisinde endikedir.
4.2.Pozoloji ve uygulama şekli Pozoloji/uygülama sıklığı ve süresi:
Bir migren atağının tedavisinde önerilen MİGTERA dozu 2.5 mg'dır.
Eğer semptomlar devam eder veya 24 saat içerisinde tekrarlarsa, alınacak ikinci bir dozun etkili olduğu gösterilmiştir. İkinci bir doz gerekiyorsa bu, başlangıç dozundan en az 2 saat geçtikten sonra alınmalıdır.
Eğer hasta 2.5 mg'lık dozlardan tatmin edici bir fayda görmüyorsa, daha sonraki ataklar 5 mg'lık MİGTERA dozlarıyla tedavi edilebilir. Bu hastalarda dozun alınmasını izleyen 1 saat içerisinde anlamlı bir etki görülür.
Migren atağı sırasında alındığı zaman da aynı derecede etkili olan MİGTERA tabletlerin, migren atağı başladıktan sonra mümkün olan en kısa zamanda alınması önerilir.
Tekrarlayan ataklarda 24 saat içerisinde alınacak toplam MİGTERA miktarı 10 mg'ı aşmamalıdır.
MİGTERA migren profılaksisinde kullanılmaz.
Uygulama şekli:
Oral yolla kullanılır. ' '
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek /Karaciğer yetmezliği:
Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur (bkz. bölüm 5.2 Farmakokinetik özellikler).
Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır (bkz. bölüm 5.2 Farmakokinetik özellikler). Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır.
Pediyatrik popülasyon:
12 yaşm altındaki çocuklarda kullanım: ¦.
Pediyatrik hastalarda zolmitriptanm güvenlilik ve etkililiği değerlendirilmemiştir. Bu nedenle MİGTERA'mn bu yaş grubu çocuklarda kullanımı önerilmemektedir.
Ergenlik döneminde kullanım (12-17 yaş arası):
12 ila 17 yaş arası hastalar için zolmitriptan tabletin etkinliği plasebo kontrollü klinik çalışmalarda gösterilmemiştir. Bu sebeple MİGTERA tabletin ergenlik döneminde kullanımı önerilmemektedir.
Geriyatrik popülasyon:
Zolmitriptanm yaşı 65'in üzerinde olan hastalardaki ilaç emniyeti ve etkinliği, sistematik olarak değerlendirilmemiştir.
4.3. Kontrendikasyonlar
MİGTERA aşağıdaki durumlarda kontrendikedir;
Ürün bileşiminde bulunan maddelerden herhangi birine karşı bilinen aşırı duvarlısı olanlarda, '
Kan basıncı kontrol altında olmayan hipertansiyon vakalarında,
İskemik kalp hastalığında,
Koroner spazm/ Prinzmetal angina vakalarında,
Serebrovasküler olay (CVA) veya geçici iskemik atak (TİA) hikayesi olanlarda
MİGTERA tabletin ergotamin veya ergotamin türevleri veya diğer 5-HTı reseptör antagonistleri İle birlikte uygulanması,
Hemiplejik, baziller ve oltalmoplejik migren vakalarında kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
MİGTERA yalnızca, migren teşhisi açıkça konulmuş olan hastalarda kullanılmalı ve önemli olabilecek diğer nörolojik durumların bulunmadığı kesinleştirilmelidir. Zolmitriptanm hemiplejik veya baziler migren tedavisinde kullanımıyla ilgili herhangi bir veri mevcut değildir. Migren hastalarında, belirli serebrovasküler olayların gelişme riski söz konusu
olabilir. 5HTib/id agonistleriyle tedavi edilen hastalarda serebral hemoraji, subaraknoid hemoraji, inme veya diğer serebrovasküler olaylar bildirilmiştir.
MİGTERA, semptomatik Wolf-Parkinson-White sendromu vakalarına veya kalpteki aksesuar uyaran iletim yollan ile ilişkili başka aritmileri olan hastalara verilmemelidir.
Çok nadir durumlarda, diğer 5HT1B
Diğer 5HTIB/ID
agonistleri gibi zolmitriptan kullanılmasından sonra da prekordiyal bölgede atipık duyular bildirilmiştir (bkz. bölüm 4.8, İstenmeyen etkiler). Eğer göğüs ağrısı veya iskemik kalp hastalığı ile uyumlu semptomlar gözlenirse, uygun bir tıbbi değerlendirme yapılmadan daha fazla zolmitriptan alınmamalıdır.
Diğer 5HTIB/ID
agonistleri ile olduğu gibi, hipertansiyon hikayesi olan veya olmayan hastalarda sistemİk kan basıncında geçici artış bildirilmiştir, çok nadiren kan basıncındaki bu artışlar belirgin klinik olaylara neden olmuştur.
Diğer 5HTİB/ID
agonistleri ile olduğu gibi, zolmitriptan alan hastalarda nadiren anaflaksi/anaflaktoid reaksiyonlar bildirilmiştir.
Akut anti- migren ilaçların aşırı kullanımı baş ağrısı sıklığının artmasına ve muhtemelen tedavinin durdurulmasına sebep olabilir.
Toptanların, Selektif Serotonin Geri Alım İnhibitörleri (SSRIs) ve Serotonin/ Norepinefrin Geri Alım İnhibitörleriyle (SNRIs) birlikte kullanımının Serotonin Sendromuna neden olabileceği bildirilmiştir.' Serotonin Sendromıı hayati tehlike oluşturma potansiyeline sahiptir ve mental durum değişikliği (örn: ajitasyon, halüsinasyonlar, koma), otonomık instabilite, (örn: taşikardi, değişken kan basıncı, hipertermi), nöromuskuler bozukluklar (örn: hiperrefleksİ, koordinasyon bozukluğu), ve/veya gastrointestinal semptomlar (örn: bulantı, kusma, di yare) gibi belirti ve semptomlar gösterir. MİGTERA ile birlikte SSRI veya SNRI kullanması klinik açıdan gerekli olan hastalarda, özellikle tedavinin başlangıcında ve doz artırıldığında dikkatli bir gözlem önerilir (bkz. bölüm 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri). ¦
MİGTERA tabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu İlacı kullanmamaları gerekir.
Bu tıbbi ürün 5.0 mg sodyum nişasta glikolat içerir. Sodyum miktarının 23 mg (Iıiımol^dan az olması nedeniyle sodyuma bağlı herhangi bir olumsuz etki beklenmez.
Kaplama maddesinde bulunan, sunset sarısı FCF Al lak (El 10) ve karmoizin (E 122) alerjik reaksiyonlara sebep olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Beta blokörler, oral dihidroergotamin, pizotıfen gibi migren profılaksisi ilaçlarının birlikte kullanılmasının, zolmitriptanın etkinliğinde değişiklik yaptığını veya istenmeyen etkilere yol açtığını gösteren hiçbir kanıt yoktur.
Akut semptomatik tedavi amacıyla kullanılan parasetamol, metoklopramid ve ergotamin gibi ilaçlar zolmitriptanın farmakokinetiğini veya tolerabilitesini etkilememiştir. MİGTERA tedavisini izleyen 12 saat içerisinde, diğer 5HTiB/iDagonistlerinin kullanılmaması gerekir.
Sağlıklı gönüllülerden elde edilen veriler, zolmitriptan ile ergotamin arasında farmakokınetik veya klinik olarak önemli bir etkileşim olmadığını gösterse de, teorik olarak koroner vazospazm riskinin artması olasıdır. Bu nedenle ergotamin içeren preparatlarm kullanılmasını takiben MİGTERA kullanılması için en az 24 saat beklenmesi, bunun aksine MİGTERA kullanılmasını takiben ergotamin içeren preparatlar kullanılması için en az 6 saat beklenmesi önerilir (bkz. bölüm 4.3 Kontrendikasyonlar).
Spesifik bir MAO-A (monoamin öksidaz-A) İnhibitörü olan moklobemid kullanılmasını takiben, zolmitriptanın EAA (Eğri Altındaki Alan) değeri küçük bir oranda (%26), aktif metabolitinin EAA değeri ise 3 kat arttığından; bir MAO-A inhibitörü kullanan hastalarda 24 saat içerisinde kullanılacak MİGTERA dozu 5 mg'ı aşmamalıdır.
Genel bir P450 inhibitörü olan simetidin kullanılmasını takiben, zolmitriptanın eliminasyon yarı-ömrü %44, EAA değeri %48 oranında artmıştır. Ayrıca, zolmitriptanın aktif metaboliti olan 183C91'in (N-desmetil) eliminasyon yarı-ömrü ve EAA değeri 2 kat artmıştır. Simetidin kullanan hastalarda 24 saat içerisinde maksimum 5 mg MİGTERA kullanılması önerilir. Etkileşim profili bir bütün olarak göz önünde bulundurulduğunda, bir sitokrom P450 izoenzimi olan CYP1A2 inhibitörleriyle etkileşim göz ardı edilemez. Bu nedenle, fluvoksamin ve kinolon grubu antibiyotikler (örneğin siprofloksasin) gibi bileşiklerle de aynı şekilde doz azaltılması önerilir Fluoksetin zolmitriptanın farmakokinetik parametrelerini etkilemez. 1
Spesifik serotonin geri alım inhibitörleri olan fluoksetin, sertralin, paroksetin ve sitalopramm terapötik dozları, CYPlA2'yi inhıbe etmez. Fakat, triptanların ve SSRIs (örn: fluoksetin, paroksetin, sertralin) ve SNRIs (örn: venlafaksin, duloksetin) ile kombine kullanımı sırasında Serotonin Sendromu bildirilmiştir (bkz. bölüm 4.4).
Diğer 5HTJB/ID(Hypericum perforatum,
sarı -kantaron) arasında dinamik etkileşim potansiyeli mevcut olduğundan, istenmeyen etkilerin artışına neden olabilir.
4.6. Gebelik ve laktasyon . Genei tavsiye:
Gebelik kategorisi: C ¦ '
Çocuk doğurma potansiyeli bulunan kadıniar/Doğum kontrolü (Kontrasepsiyon):
İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebelik dönemi
MİGTERA, gebe kadınlarda yalnızca, annede elde edilecek faydaların, fetüsün karşı karşıya kalabileceği risklerden açıkça daha fazla olması durumunda kullanılmalıdır. Gebe kadınlarda yapılmış herhangi bir çalışma yoktur fakat hayvan çalışmalarında hiçbir teratojenik etki ile karşılaşılmamıştır (bkz. bölüm 5.3 Klinik öncesi güvenlilik verileri).
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir.
Laktasyon dönemi
Zolmitriptanın süt veren hayvanların sütüne geçtiği gösterilmiştir. Zolmitriptanm insanlarda anne sütüne geçişi konusunda herhangi bir veri mevcut olmadığından MİGTERA'nm bebeğini emziren kadınlarda kullanılması sırasında dikkatli olmak gerekir.
Üreme yeteneği/FertiIite ,
Hayvanlarda yapılan üreme çalışmalarında, fertilite üzerinde bir etki ortaya çıkmamıştır. İnsanlar üzerinde ya da klinik dışı üreyebilirlik çalışmalarından elde edilmiş veri bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
20 mg'a kadar çıkan zolmitriptan dozları, psikomotor test performansını anlamlı şekilde bozmamıştır. MİGTERA kullanımının, hastaların araç ya da makine kullanma yeteneğini bozma olasılığı yoktur. Ancak somnolansa neden olabileceğinden, hastalar motorlu araçlar da dahil makine kullanımı sırasında dikkatli olmaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Zolmitriptan, iyi tolere edilir. Advers olaylar tipik olarak hafif/orta şiddettedir, geçicidir, ciddi değildir ve ek tedavi gerektirmeksizin kendiliğinden düzelir.
Olası yan etkilerin, dozun alınmasını izleyen 4 saat içerisinde görülme eğilimi vardır ve bunlar, tekrarlanan dozlardan sonra sıklaşmaz.
İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır:
Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (>1/10,000 ila <1/1.000); çok seyrek (<1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları: .
Seyrek: Anaflaktik /anaflaktoid reaksiyonlar, aşırı duyarlılık reaksiyonları Sinir sistemi hastalıkları:
Yaygın: Duyu anormallikleri ve bozuklukları;' baş dönmesi, baş ağrısı, hiperestezi, parestezi, somnolans, sıcaklık hissi
Kardiyak hastalıklar: .
Yaygın: Palpitasyon Yaygın olmayan: Taşikardi
Çok seyrek: Anjina pektoris, koroner vazospazm, miyokard enfarktüsü
Vaskiiler hastalıklar:
Yaygın olmayan: Sistemik kan basıncında geçici artış '
Gastrointestinal hastalıklar:
Yaygın: Karın ağrısı, ağız kuruluğu, bulantı, kusma
Çok seyrek: Kanlı ishal, gastrointestinal enfarkt veya nekroz, gastrointestinal iskemik olaylar, iskemik kolit, splenik enfarkt
Deri ve deri altı doku hastalıkları:
Seyrek: Anjiyoödem, ürtiker
Kas- iskelet sistemi, bağ doku ve kemik hastalıkları
Yaygın: Kas zayıflığı, miyalji
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Poliüri, idrar sıklığı Çok seyrek: Acil idrar yapma hissi
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Asteni, boğaz boyun ekstremİtelerde veya göğüste ağırlık, daralma veya baskı hissi
4.9. Doz aşımı vc tedavisi
50 mg'lık bir tek oral doz zolmitriptan alan gönüllülerde genellikle sedasyon görülmüştür. Zolmitriptan tabletlerin eİiminasyon yaıı-ömrü 2.5-3 saat olduğundan (bkz. bölüm 5.2 Farmakokinetik özellikler) aşırı doz alan hastalar, en az 15 saat boyunca veya semptomlar ve belirtiler devam ettiği sürece izlenmelidir,
Zolmitriptanm spesifik bir antidotu yoktur. Şiddetli intoksikasyon durumunda yoğun bakım önlemlerinin alınması ve bu arada açık bir hava yolu sağlanması ve devam ettirilmesi, yeterli oksijenasyon ve ventilasyon sağlanması, kardiyovasküler sistemin izlenmesi ve desteklenmesi önerilir.
Hemodiyaliz veya peritoneal diyalizin zolmitriptanm serum konsantrasyonları üzerinde etkileri bilinmemektedir,
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötİk grup: Selektif serotonin (5HT0 agonistleri ATC kodu: N02CC03
Preklinik çalışmalarda zolmitriptanm, vasküler insan rekombinant 5HT]B ve 5HT]D reseptör alt tiplerinin selektif agonisti olduğu gösterilmiştir. Zolmitriptan, yüksek afmiteli bir 5HT18/id reseptör agonistidir ve orta dereceli 5HT]A reseptör afmitesine sahiptir. Zolmitriptanm 5HT2-, 5HT3-, 5HT4, alfaj-, alfa2- veya betaj-adrenerjik; H5-, Hj-, histaminik; muskarinik, dopaminerjikı veya dopammerjik2 reseptörlerine belirgin bir afınitesi (radyoligand bağlanma analizleri ile ölçüldüğü gibi) veya farmakolojik aktivitesi yoktur. 5HTİD reseptörü baskın
olarak, trigemiııal sinirlerin hem periferik hem de merkezi sinapslarmda presinaptik yerleşmiştir ve klinik öncesi çalışmalar zolmitriptanın her iki bölgeyi de etkileyebildiğini göstermiştir.
Bir kontrollü çalışmada 696 ergenlik dönemindeki migren hastasında, zolmitriptan tabletlerin
2.5 mg, 5 mg ve 10 mg dozlarının plaseboya üstünlüğü gösterilememiştir.
5.2. Farmakokinetik özellikler Genel özellikler
Zolmitriptan hızla ve iyi bir şekilde emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oram yaklaşık %40'tır. '
Emilim:
..
Zolmitriptan konvensiyonel tabletlerin oral yolla alınmasını takiben, zolmitriptan hızla ve iyi bir şekilde (dozun en az %64!ü) emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oranı yaklaşık %40'tır. Yine bir 5HTIB/ID
agonisti olan ve hayvan modellerinde zolmitriptanın 2-6 katı daha güçlü olduğu gösterilen aktif bir metaboliti de vardır (183C9L N-desmetil metabolit).
Dağılım:
Sağlıklı kişilerde, tek doz olarak verildiğinde, zolmitriptan ve aktif metaboliti 183C91, 2.5 ila 50 mg doz aralığında dozla orantılı EAA ve CmakS gösterir. CmaicS'ın %75'i ile absorpsiyon hızlıdır ve 1 saat içinde ulaşılır, plazma konsantrasyonları 4 ila 6 saat devam eder. Zolmitriptan absorpsiyonu gıda varlığından etkilenmez. Zolmitriptanın çoklu dozlarında bile biriktiği gösterilmemiştir.
Biyotransformasvon:
.
Zolmitriptan vücuttan daha çok, karaciğerde biyotransformasyon geçirerek oluşan metabolitlerinin böbrekler yoluyla atılması şeklinde uzaklaştırılır. Zolmitriptanın başlıca 3 metaboliti vardır: İndol asetik asit (plazmadaki ve idrardaki ana metabolit), N-oksit ve N-desmetil analogları. Bunlardan N-desmetİl metabolit (183C91) aktiftir, diğerleri değildir. Plazmadaki 183C91 konsantrasyonları, asıl ilacın yaklaşık yarısı olduğundan bu metabolitin, zolmitriptanın terapötik etkisine katkıda bulunması beklenir. Tek oral dozun %60'dan fazlası idrarla (esas olarak indol asetik asit metaboliti olarak) atılır ve %30'u değişmemiş ana bileşen olarak feçesle atılır.
Karaciğer hastalığının zolmitriptanın farmakokinetiğı üzerindeki etkisini değerlendirmek için yapılan çalışmada, sağlıklı gönüllülerle orta veya ileri derecede karaciğer bozukluğu olan hastalar karşılaştırıldığında orta dereceli karaciğer bozukluğu olan hastaların EAA ve CmakS değerleri sırasıyla %94 ve %50 ve ileri derecede karaciğer bozukluğu olan hastaların ise %226 ve %47 arttığı gösterilmiştir. 183C91 metaboliti için, orta düzeyde karaciğer yetmezliği olan hastalarda EAA ve'Cmaks sırasıyla %33 ve %44 azalmış, şiddetli karaciğer yetmezliği olan hastalarda sırasıyla %82 ve %90 azalmıştır.
Eliminasvon:
Zolmitriptanın plazma yarı ömrü (t1/2) sağlıklı gönüllülerde 4.7 saat, orta derecede karaciğer bozukluğu olan hastalarda 7.3 saat ve ileri derecede karaciğer bozukluğu olanlarda ise 12 saattir. 183C91 metaboliti için ilgili tıa
değerleri sırasıyla 5.7 saat, 7.5 saat ve 7.8 saattir.
İntravenöz kullanımdan sonraki ortalama total plazma klerensi 10 ml/dak/kg kadardır ve bunun üçte biri renal klerenstir. Renal klerensin glomeriiler filtrasyon hızından fazla olması renal tübüler sekresyonu akla getirmektedir. İntravenöz dozdan sonraki dağılım hacmi, 2.4 litre/kg'dır. Plazma proteinlerine bağlanma oram düşüktür (yaklaşık %25). Zolmitriptanın ortalama eliminasyon yarı-ömrü 2.5-3 saat kadardır. Metabolitlerinin yarı Ömrünün de benzer olması, eliminasyonlarının oluşum hızı ile sınırlı olduğunu akla getirmektedir.
Zolmitriptanın ve metabolitlerinin renal klerensi, orta-ileri derecede böbrek bozukluğu vakalarında sağlıklı gönüllülere göre 7 ila 8 kat azalmıştır, ana bileşenin ve aktif metabolitin EAA değeri hafif artarken (sırasıyla %16 ve %35), yarı ömrü 1 saat artış ile 3 ila 3.5 saattir. Bu parametreler sağlıklı gönüllülerde gözlenen aralık dahilindedir.
Hastalardaki karakteristik özellikler
Yaslılar
Zolmitriptanın ileri yaşta,, sağlıklı insanlardaki farmakokinetiği, sağlıklı genç gönüllülerdekine benzer bulunmuştur.
Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur.
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır. Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır.
Etkileşimler
Sağlıklı küçük bir gönüllü grubunda, zolmitriptan ergotaminle birlikte kullanıldığında farmakolojik etkileşim görülmemiştir. Zolmitriptanın ergotamin/kafein ile birlikte verilmesi, iyi tolere edilmiş ve yan etkilerde ya da kan basıncı değişikliklerinde, zolmitriptanın tek başına kullanılmasına kıyasla herhangi bir artışla sonuçlanmamıştır.
Rifampisin uygulanmasını takiben, zolmitriptan veya aktif metabolitlerinde klinik olarak ilişkili bir fark gözlenmemiştir,
Bir MAO-B inhibitörü olan selegilin, serotonin geri-alım inhibitörü (SSRI) olan fluoksetin, zolmitriptan farmakokinetik parametreleri üzerinde etkili olmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Zolmitriptan kullanılarak oral teratojen etki çalışması yapılmıştır. Zolmitriptanın maksimum tolere edilebilen dozları 1200 mg/kg/gün (EAA 605 fig/ml saat = insanda önerilen maksimum günlük dozdan İ5 mg'a ait EAA'nın yaklaşık 3700 katı) ve 30 mg/kg/gün (EAA 4.9 fig/ml. saat = insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nın yaklaşık 30 katı) sıçan ve tavşanlarda herhangi bir teratojenik etki görülmemiştir.
Beş genotoksisite çalışması yapılmış ve bunların sonucunda zolmitriptanın, insanlarda herhangi bir genetik risk taşımadığına karar verilmiştir.
Sıçanlarda ve farelerde uygulanabilen en yüksek dozlarla yapılan karsinojen etki çalışmaları, tümorojen etki izlenimi vermemiştir. ¦ '
Erkek ve dişi sıçanlarda, toksisite tarafından sınırlanan dozlar kullanılarak yapılan üreme çalışmaları, fertilite üzerinde herhangi bir etki göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz anhidrat .
Mikrokristalin selüloz PH 102 Sodyum nişasta glikolat (Explotab)
Magnezyum stearat
Film kaplama materyali Opadry pink 20A24556 (titanyum dioksit (E171),karmoizin (E 122),sarı demir oksit (E172),sunset sarısı FCF lak (El 10) ve indigo karmin lak (El 32))
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel uyanlar
25°C'nin altındaki oda sıcaklığında ve ambalajında saklanır.
6.5. Ambalajın niteliği ve içeriği
Al/Al blister
Kutuda 2, 3 ya da 6 film tabletlik blisterler halinde.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
NOBEL İLAÇ SANAYİİ ve TİCARET A.Ş. .
İnkılap Mah. Akçakoca Sok. No: 10 34768 Ümraniye / İstanbul Tel: (216) 633 60 00
Fax: (216)633 60 01-02 ¦
8. RUHSAT NUMARASI(LARI)
220/68
9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 02,09.2009 Ruhsat yenileme tarihi:
10. KÜB'ün YENİLENME TARİHİ
KISA ÜRÜN BİLGİSİ
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MİGTERA 5 mg film tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde:
5 mg
Zolmitriptan
Yardımcı maddeler:
213.08 mg . 5.00 mg
8.0 mg
Laktoz anhidrat
Sodyum nişasta glikolat (Explotab) Film kaplama materyali Opadry pink 20A24556
Yardımcı maddeler için, bölüm 6.1 'e bakınız.
3. FARMASÖTİK FORM
Film tablet
Pembe renkli film kaplı oval, bikonveks tabletler.
4. KLİNİK ÖZELLİKLER
4.1.Terapötik endikasyonlar
MİGTERA, auralı veya aurasız migren ataklarının akut tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:
Bir migren atağının tedavisinde önerilen MİGTERA dozu 2.5 mg'dır.
Eğer semptomlar devam eder veya 24 saat içerisinde tekrarlarsa, alınacak ikinci bir dozun etkili olduğu gösterilmiştir. İkinci bir doz gerekiyorsa bu, başlangıç dozundan en az 2 saat geçtikten sonra alınmalıdır.
Eğer hasta 2.5 mg'lık dozlardan tatmin edici bir fayda görmüyorsa, daha sonraki ataklar 5 mg'lık MİGTERA dozlarıyla tedavi edilebilir. Bu hastalarda dozun alınmasını izleyen 1 saat içerisinde anlamlı bir etki görülür.
Migren atağı sırasında alındığı zaman da aynı derecede etkili olan MİGTERA tabletlerin, migren atağı başladıktan sonra mümkün olan en kısa zamanda alınması önerilir.
Tekrarlayan ataklarda 24 saat içerisinde alınacak toplam MİGTERA miktarı 10 mg'ı aşmamalıdır.
MİGTERA migren profılaksİsinde kullanılmaz.
Uygulama şekli:
Oral yolla kullanılır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek /Karaciğer yetmezliği:
Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur (bkz. bölüm 5.2 Farmakokinetİk özellikler).
Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır (bkz. bölüm 5.2 Farmakokinetİk özellikler). Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır.
Pediyatrik popülasyon:
12 yaşın altındaki çocuklarda kullanım:
Pediyatrik hastalarda zolmitriptanın güvenlilik ve etkililiği değerlendirilmemiştir. Bu nedenle MİGTERA'nın bu yaş grubu çocuklarda kullanımı önerilmemektedir.
Ergenlik döneminde kullanım (12-17 yaş arası):
12 ila 17 yaş arası hastalar için zolmitriptan tabletin etkinliği plasebo kontrollü klinik çalışmalarda gösterilmemiştir. Bu sebeple MİGTERA tabletin ergenlik döneminde kullanımı önerilmemektedir.
Geriyatrik popülasyon: ¦
Zolmitriptanın yaşı 65'İn üzerinde olan hastalardaki ilaç emniyeti ve etkinliği, sistematik olarak değerlendirilmemiştir.
4.3. Kontrendikasyonlar
MİGTERA aşağıdaki durumlarda kontrendıkedir;
Ürün bileşiminde bulunan maddelerden herhangi birine karşı bilinen aşırı duyarlığı olanlarda, '
Kan basıncı kontrol altında olmayan hipertansiyon vakalarında,
İskemik kalp hastalığında,
Koroner spazm/ Prinzmetal angına vakalarında,
Serebrovasküler olay (CVA) veya geçici iskemik atak (TİA) hikayesi olanlarda
MİGTERA tabletin ergotamin veya ergotamin türevleri veya diğer 5-HTı reseptör antagonistleri ile birlikte uygulanması,
Hemiplejik, baziller ve oftalmoplejik migren vakalarında kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
MİGTERA yalnızca, migren teşhisi açıkça konulmuş olan hastalarda kullanılmalı ve önemli olabilecek diğer nörolojik durumların bulunmadığı kesinleştirilmelidir. Zolmitriptanın hemiplejik veya baziler migren tedavisinde kullanımıyla ilgili herhangi bir veri mevcut değildir. Migren hastalarında, belirli serebrovasküler olayların gelişme riski söz konusu olabilir. 5HTib/id agonistleriyle tedavi edilen hastalarda serebral hemoraji, subaraknoid hemoraji, inme veya diğer serebrovasküler olaylar bildirilmiştir.
MİGTERA, semptomatik Wolf-Parkİnson-White sendromu vakalarına veya kalpteki aksesuar uyaran iletim yolları ile ilişkili başka aritmileri olan hastalara verilmemelidir.
Çok nadir durumlarda, diğer 5HTib/id agonistleri ile olduğu gibi, koroner vazospazm, anjina pektoris ve miyokard enfarktüsü bildirilmiştir. İskemik kalp hastalığı riski olan hastalara MİGTERA da dahil bu sınıftan bileşiklerle tedaviye başlamadan önce kardiyovasküler değerlendirme yapılması önerilir (bkz. bölüm 4.3 Kontrendikasyonlar). Ancak bu değerlendirmeler kalp hastalığı olan her hastayı belirleyemeyebilir ve çok seyrek olarak herhangi bir kardiyovasküler rahatsızlığı olmayan hastalarda da ciddi kardiyak olaylar gelişmiştir.
Diğer 5HTib/id agonistleri gibi zolmitriptan kullanılmasından sonra da prekordiyal bölgede atipik duyular bildirilmiştir (bkz. bölüm 4.8, İstenmeyen etkiler). Eğer göğüs ağrısı veya iskemik kalp hastalığı ile uyumlu semptomlar gözlenirse, uygun bir tıbbi değerlendirme yapılmadan daha fazla zolmitriptan alınmamalıdır.
Diğer 5HTib/id agonistleri ile olduğu gibi, hipertansiyon hikayesi olan veya olmayan hastalarda sistemik kan basıncında geçici artış bildirilmiştir, çok nadiren kan basıncındaki bu artışlar belirgin klinik olaylara neden olmuştur.
Diğer 5HT.ib/]d agonistleri ile olduğu gibi, zolmitriptan alan hastalarda nadiren anaflaksi/anaflaktoid reaksiyonlar bildirilmiştir.
Akut anti- migren ilaçların aşırı kullanımı baş ağrısı sıklığının artmasına ve muhtemelen tedavinin durdurulmasına sebep olabilir,
Triptanların, Selektif Serotonin Geri Alım İnhibitörleri (SSRIs) ve Serotonin/ Norepinefrin Geri Alım İnhibitörleriyle (SNRIs) birlikte kullanımının Serotonin Sendromuna neden olabileceği bildirilmiştir. Serotonin Sendromu hayati tehlike oluşturma potansiyeline sahiptir ve mental durum değişikliği (om: ajitasyon, halüsinasyonlar, koma), otonomik instabilite, (örn: taşikardi, değişken kan basıncı, hipertermi), nöromuskuler bozukluklar (örn: hiperrefleksi, koordinasyon bozukluğu), ve/veya gastrointestinal semptomlar (örn: bulantı, kusma, diyare) gibi belirti ve semptomlar gösterir. MİGTERA ile birlikte SSRI veya SNRI kullanması klinik açıdan gerekli olan hastalarda, özellikle tedavinin başlangıcında ve doz artırıldığında dikkatli bir gözlem önerilir (bkz. bölüm 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri).
MİGTERA tabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleranss, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
Bu tıbbi ürün 5.0 mg sodyum nişasta glikolat içerir. Sodyum miktarının 23 mg (lmmoiydan az olması nedeniyle sodyuma bağlı herhangi bir olumsuz etki beklenmez.
Kaplama maddesinde bulunan, sunset sarısı FCF Al lak (El 10) ve karmoizin (E 122) alerjik reaksiyonlara sebep olabilir.
4.5. Diğer tıbbi ürünler ilte etkileşimler ve diğer etkileşim şekilleri
Beta blokörler, oral dihidroergotamin, pizotifen gibi migren profılaksisi ilaçlarının birlikte kullanılmasının, zolmitriptamn etkinliğinde değişiklik yaptığını veya istenmeyen etkilere yol açtığım gösteren hiçbir kanıt yoktur.
Akut semptomatik tedavi amacıyla kullanılan parasetamol, metoklopramid ve ergotamin gibi ilaçlar zolmitriptamn farmakokinetiğini veya tolerabilitesim etkilememiştir, MİGTERA tedavisini izleyen 12 saat içerisinde, diğer 5HTib/id agoııistlerinin kullanılmaması gerekir.
Sağlıklı gönüllülerden elde edilen veriler, zolmitriptan ile ergotamin arasında farmakokinetik veya klinik olarak önemli bir etkileşim olmadığını gösterse de, teorik olarak koroner vazospazm riskinin artması olasıdır. Bu nedenle ergotamin içeren preparatlarm kullanılmasını takiben MİGTERA kullanılması için, en az 24 saat beklenmesi, bunun aksine MİGTERA kullanılmasını takiben ergotamin içeren preparatlar kullanılması için en az 6 saat beklenmesi önerilir (bkz. bölüm 4.3 Kontrendikasyonlar)..
Spesifik bir MAO-A (monoamin oksidaz-A) inhibitörü olan moklobemid kullanılmasını takiben, zolmitriptamn EAA (Eğri Altındaki Alan) değeri küçük bir oranda (%26), aktif metabolitinin EAA değeri ise 3 kat arttığından; bir MAO-A inhibitörü kullanan hastalarda 24 saat içerisinde kullanılacak MİGTERA dozu 5 mg'ı aşmamalıdır.
Genel bir P450 -inhibitörü olan simetidin kullanılmasını takiben, zolmitriptamn eliminasyon yarı-ömrü %44, EAA değeri %48 oranında artmıştır. Ayrıca, zolmitriptamn aktif metaboliti olan 183C91'in (N-desmetil) eliminasyon yarı-ömrü ve EAA değeri 2 kat artmıştır. Simetidin kullanan hastalarda 24 saat içerisinde maksimum 5 mg MİGTERA kullanılması önerilir. Etkileşim profili bir bütün olarak göz önünde bulundurulduğunda, bir sitokrom P450 izoenzimi olan CYP1A2 inhibitörleriyle etkileşim göz ardı edilemez. Bu nedenle, fluvoksamin ve kinolon grubu antibiyotikler (örneğin siprofloksasin) gibi bileşiklerle de aynı şekilde doz azaltılması önerilir Fluoksetin zolmitriptamn farmakokinetik parametrelerini etkilemez. ¦
Spesifik serotonin geri alım inhibitörleri olan fluoksetin, sertralin, paroksetin ve sitalopramm terapötik dozları, CYPlA2'yi inhibe etmez. Fakat, triptanların ve SSRIs (örn: fluoksetin, paroksetin, sertralin) ve SNRIs (örn: venlafaksin, duloksetin) ile kombine kullanımı sırasında Serotonin Sendromu bildirilmiştir (bkz. bölüm 4.4).
Diğer 5HTIB/ID(Hypericum perforatum,
sarı kantaron) arasında dinamik etkileşim potansiyeli mevcut olduğundan, istenmeyen etkilerin artışına neden olabilir.
4.6. Gebelik ve laktasyon Genel tavsiye:
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):
İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebelik dönemi
MİGTERA, gebe kadınlarda yalnızca, annede elde edilecek faydaların, fetüsün karşı karşıya kalabileceği risklerden açıkça daha fazla olması durumunda kullanılmalıdır. Gebe kadınlarda yapılmış herhangi bir çalışma yoktur fakat hayvan çalışmalarında hiçbir teratojenik etki İle karşılaşılmamıştır (bkz. bölüm 5.3 Klinik öncesi güvenlilik verileri).
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. '
Laktasyon dönemi
Zolmitriptanın süt veren hayvanların sütüne geçtiği gösterilmiştir. Zolmitriptanın insanlarda anne sütüne geçişi konusunda herhangi bir veri mevcut olmadığından MİGTERA'nm bebeğini emziren kadınlarda kullanılması sırasında dikkatli olmak gerekir.
Üreme yeteneği/FertiIite
Hayvanlarda yapılan üreme çalışmalarında, fertilite üzerinde bir etki ortaya çıkmamıştır. İnsanlar üzerinde ya da klinik dışı üreyebilirlik çalışmalarından elde edilmiş veri bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
20 mg'a kadar çıkan zolmitriptan dozları, psikomotor test performansını anlamlı şekilde bozmamıştır. MİGTERA kullanımimn, hastaların araç ya da makine kullanma yeteneğini bozma olasılığı yoktur. Ancak somnolansa neden olabileceğinden, hastalar motorlu araçlar da dahil makine kullanımı sırasında dikkatli olmaları konusunda uyarılmalıdır,
4.8. İstenmeyen etkiier
Zolmitriptan, iyi tolere edilir. Advers olaylar tipik olarak hafıf/orta şiddettedir, geçicidir, ciddi değildir ve ek tedavi gerektirmeksizin kendiliğinden düzelir.
Olası yan etkilerin, dozun alınmasını izleyen 4 saat içerisinde görülme eğilimi vardır ve bunlar, tekrarlanan dozlardan sonra sıklaşmaz.
İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır:
Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları:
Seyrek: Anaflaktik /anaflaktoid reaksiyonlar, aşırı duyarlılık reaksiyonları Sinir sistemi hastalıkları:
Yaygın: Duyu anormallikleri ve bozuklukları, baş dönmesi, baş ağrısı, hİperestezi, parestezi, somnolans, sıcaklık hissi
Kardiyak hastalıklar:
Yaygın: Palpitasyon Yaygın olmayan: Taşikardi
Çok seyrek: Anjina pektoris, koroner vazospazm, ¦mİyokard enfarktüsü
Yaygın olmayan: Sistemik kan basıncında geçici artış
Gastrointestinal hastalıklar;
Yaygın: Karın ağrısı, ağız kuruluğu, bulantı, kusma
Çok seyrek: Kanlı İshal, gastrointestinal enfarkt veya nekroz, gastrointestinal iskemik olaylar, iskemik kolit, splenik enfarkt "'
Deri ve deri altı doku hastalıkları:
Seyrek: Anjiyoödem, ürtiker .
Kas- iskelet sistemi, bağ doku ve kemik hastalıkları
Yaygın: Kas zayıflığı, rtıiyalji
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Poliüri, idrar sıklığı Çok seyrek: Acil idrar yapma hissi
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Asteni, boğaz boyun ekstremitelerde veya göğüste ağırlık, daralma veya baskı hissi
4.9. Doz aşımı ve tedavisi
50 mg'lık bir tek oral doz zolmitriptan al an'gönüllülerde genellikle sedasyon görülmüştür. Zolmitriptan tabletlerin eliminasyoıı yarı-ömrü 2.5-3 saat olduğundan (bkz. bölüm 5.2 Farmakokinetik özellikler) aşırı doz alan hastalar, en az 15 saat boyunca veya semptomlar ve belirtiler devam ettiği sürece izlenmelidir.
Zolmitriptanm spesifik bir antidotu yoktur. Şiddetli İntoksikasyon durumunda yoğun bakım önlemlerinin alınması ve bu arada açık bir hava yolu sağlanması ve devam ettirilmesi, yeterli oksijenasyon ve ventilasyon sağlanması, kardiyovasküler sistemin izlenmesi ve desteklenmesi önerilir.
Hemodiyaliz veya peritoneal diyalizin zolmitriptanm serum konsantrasyonları üzerinde etkileri bilinmemektedir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Selektif serotonin (5HTı) agonistleri ATC kodu: N02CC03
Preklinik çalışmalarda zolmitriptanm, vasküler insan rekombinant 5HTib ve 5HTid reseptör alt tiplerinin selektif agonisti olduğu gösterilmiştir. Zolmitriptan, yüksek afiniteli bir 5IITsb/id reseptör agonistidir ve orta dereceli 5HTiA reseptör afmitesine sahiptir, Zolmitriptanm 5HT2-, 5HT3-, 5HT4, alfaı-, alfa2- veya beta(-adrenerjik; Hı-, H2-, histaminik; muskarinik, dopamiııerjiki veya dopaminerjik2 reseptörlerine belirgin bir afınitesi (radyoligand bağlanma analizleri ile'ölçüldüğü gibi) veya farmakolojik aktivitesi yoktur. 5HTid reseptörü baskın olarak, trigemınal sinirlerin hem periferik hem de merkezi sinapslarmda presinaptik yerleşmiştir ve klinik Öncesi çalışmalar zolmitriptanın her iki bölgeyi de etkileyebildiğini göstermiştir. '
Bir kontrollü çalışmada 696 ergenlik dönemindeki migren hastasında, zolmitriptan tabletlerin
2.5 mg, 5 mg ve 10 mg dozlarının piaseboya üstünlüğü gösterilememiştir.
5.2. Farraakokinetik özellikler Genel özellikler
Zolmitriptan hızla ve iyi bir şekilde emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oranı yaklaşık %40'tır.
Emilim:
_ _ _
Zolmitriptan konvensiyonel tabletlerin oral yolia alınmasını takiben, zolmitriptan hızla ve iyi bir şekilde (dozun en az %64'ü) emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oram yaklaşık %40'tır. Yine bir 5HT1B
Dağılım:
...
Sağlıklı kişilerde, tek doz olarak verildiğinde, zolmitriptan ve aktif metaboliti 183C91, 2.5 ila 50 mg doz aralığında dozla orantılı EAA ve Cmaks gösterir. Cmaks'm %75'i ile absorpsiyon hızlıdır ve 1 saat içinde ulaşılır, plazma konsantrasyonları 4 ila 6 saat devam eder. Zolmitriptan absorpsiyonu gıda varlığından etkilenmez. Zolmitriptanın çoklu dozlarında bile biriktiği gösterilmemiştir.
B i votransfo rmas yon:
Zolmitriptan vücuttan daha çok, karaciğerde biyotransformasyon geçirerek oluşan metabolitlerinin böbrekler yoluyla atılması şeklinde uzaklaştırılır. Zolmitriptanın başlıca 3 metaboliti vardır: İndol asetik asit (plazmadaki ve idrardaki ana metabolit), N-oksit ve N-desmetil analogları. Bunlardan N-desmetil metabolit (183C91) aktiftir, diğerleri değildir. Plazmadaki 183C91 konsantrasyonları, asıl ilacın yaklaşık yarısı olduğundan bu metaboiitin, zolmitriptanın terapötik etkisine katkıda bulunması beklenir. Tek oral dozun %60'dan fazlası idrarla (esas olarak indol'asetik asit metaboliti olarak) atılır ve %30'u değişmemiş ana bileşen olarak feçesle atılır. '
Karaciğer hastalığının zolmitriptanın farmakokinetiği üzerindeki etkisini değerlendirmek için yapılan çalışmada, sağlıklı gönüllülerle orta veya ileri derecede karaciğer bozukluğu olan hastalar karşılaştırıldığında orta dereceli karaciğer bozukluğu olan hastaların EAA ve CmakS değerleri sırasıyla %94 ve %50 ve İleri derecede karaciğer bozukluğu olan hastaların ise %226 ve %47 arttığı gösterilmiştir. 183C91 metaboliti için, orta düzeyde karaciğer yetmezliği olan hastalarda EAA ve Cmaks sırasıyla %33 ve %44 azalmış, şiddetli karaciğer yetmezliği olan hastalarda sırasıyla %82 ve %90 azalmıştır.
Eliminasvon:
_
Zolmitriptanın plazma yarı ömrü (tı/2) sağlıklı gönüllülerde 4.7 saat, orta derecede karaciğer bozukluğu olan hastalarda 7.3 saat ve ileri derecede karaciğer bozukluğu olanlarda ise 12 saattir. 183C91 metaboliti için ilgili tı/2 değerleri sırasıyla 5.7 saat, 7.5 saat ve 7.8 saattir.
İntravenöz kullanımdan sonraki ortalama total plazma klerensi 10 ml/dak/kg kadardır ve bunun üçte biri renal klerenstir, Renal klerensin glomerüler filtrasyon hızından fazla olması renal tübüler sekresyonu akla getirmektedir. İntravenöz dozdan sonraki dağılım hacmi, 2.4 litre/kg'dır. Plazma proteinlerine bağlanma oranı düşüktür (yaklaşık %25). Zolmitriptanın ortalama eiiminasyon yarı-ömrü 2,5-3 saat kadardır. Metabolitlerinin yarı ömrünün de benzer olması, eiiminasyonlarınm oluşum hızı ile sınırlı olduğunu akla getirmektedir.
Zolmitriptanın ve metabolitlerinin renal klerensi, orta-ileri derecede böbrek bozukluğu vakalarında sağlıklı gönüllülere göre 7 ila 8 kat azalmıştır, ana bileşenin ve aktif metabolitin EAA değeri hafif artarken (sırasıyla %16 ve %35), yarı ömrü 1 saat artış ile 3 ila 3.5 saattir. Bu parametreler sağlıklı gönüllülerde gözlenen aralık dahilindedir.
Hastalardaki karakteristik özellikler
Yaşlılar
Zolmitriptanın ileri yaşta, sağlıklı insanlardaki farmakokinetiği, sağlıklı genç gönül lülerdekine ¦ benzer bulunmuştur.
Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur.
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır. Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır.
Etkileşimler
Sağlıklı küçük bir gönüllü grubunda, zolmitriptan ergotaminle birlikte kullanıldığında farmakolojik etkileşim görülmemiştir. Zolmitriptanın ergotamin/kafein ile birlikte verilmesi, iyi tolere edilmiş ve yan etkilerde ya da kan basıncı değişikliklerinde, zolmitriptanın tek başma kullanılmasına kıyasla herhangi bir artışla sonuçlanmamıştır.
Rifampisin uygulanmasını takiben, zolmitriptan veya aktif metabolitlerinde klinik olarak ilişkili bir fark gözlenmemiştir. .
Bir MAO-B inhibitörü olan selegilin, serotonin geri-alım inhibitörü (SSRI) olan fluoksetin, zolmitriptan farmakokinetik parametreleri üzerinde etkili olmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Zolmitriptan kullanılarak oral teratojen etki çalışması yapılmıştır. Zolmitriptanın maksimum tolere edilebilen dozları 1200 mg/kg/gün (EAA 605 fag/ml saat = insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nın yaklaşık 3700 katı)1 ve 30 mg/kg/gün (EAA 4.9 (o.g/mi. saat - insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nm yaklaşık 30 katı) sıçan ve tavşanlarda herhangi bir teratojenik etki görülmemiştir.
Beş genotoksisite çalışması yapılmış ve bunların sonucunda zolmitriptanın, insanlarda herhangi bir genetik risk taşımadığına karar verilmiştir.
Sıçanlarda ve farelerde uygulanabilen en yüksek dozlarla yapılan karsinojen etki çalışmaları, tümorojen etki izlenimi vermemiştir,
Erkek ve dişi sıçanlarda, toksısite tarafından sınırlanan dozlar kullanılarak yapılan üreme çalışmaları, fertilite üzerinde herhangi bir etki göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz anhidrat
Mikrokristalin selüloz PH 102 ¦
Sodyum nişasta glikolat (Explotab)
Magnezyum stearat . _ _
Film kaplama materyali Opadry pink 20A24556 (titanyum dioksit (E171),karmoizin (E 122),sarı demir oksit (E172),sunset sarısı FCF lak (El 10) ve indigo karmin lak (E132))
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği bulunmamaktadır. ,
24 ay
6.4. Saklamaya yönelik özel uyanlar
25°C,nin altındaki oda sıcaklığında ve ambalajında saklanır.
Kutuda 2, 3 ya da 6 film tabletlik blisterler halinde.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
NOBEL İLAÇ SANAYİİ ve TİCARET A.Ş.
İnkılap Mah. Akçakoca Sok. No: 10 34768 Ümraniye / İstanbul '
Tel: (216)633 60 00 Fax:(216)633 60 01-02
8. RUHSAT NUMARA SI (L ARI)
220/68 '
9 |LK RUHSAXiRUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi; 02.09.2009 Ruhsat yenileme tarihi:
İ0. KİİB'ün YENİLENME TARİHİ
10
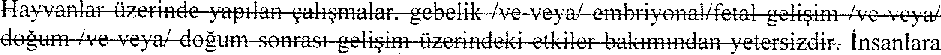 yönelik potansiyel risk bilinmemektedir.
yönelik potansiyel risk bilinmemektedir.