Migtera 2.5 Mg Film Tablet Kısa Ürün BilgisiSinir Sistemi » Ağrı Kesici / Ateş Düşürücüler (Aneljezik) » Migren İlaçları » Selectif Serotonin (5HT1) Agonistleri » Zolmitriptan KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMİGTERA 2.5 mg film tablet2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Zolmitriptan
¦ 2.5 mg Yardımcı maddeler:Laktoz aııhidrat
106.54 mg 2.50 mg 4.0 mg Sodyum nişasta glikolat (Explotab) Film kaplama materyali Öpadry yellow OY-C-22902 Yardımcı maddeler için, bölüm 6.1 'e bakınız. 3. FARMASÖTİK FORMFilm tablet ,Sarı renkli film kaplı oval, bikonveks tabletler.' 4. KLİNİK ÖZELLİKLER4.1.Terapötik endikasyonlarMİGTERA, auralı veya aurastz migren ataklarının akut tedavisinde endikedir.4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi: .Bir migren atağının tedavisinde önerilen MİGTERA dozu 2.5 mg'dır.Eğer semptomlar devam eder'veya 24 saat içerisinde tekrarlarsa, alınacak ikinci bir dozun etkili olduğu gösterilmiştir. İkinci bir doz gerekiyorsa bu, başlangıç dozundan en az 2 saat geçtikten sonra alınmalıdır. Eğer hasta 2.5 mg'lık dozlardan tatmin edici bir fayda görmüyorsa, daha sonraki ataklar 5 mg'lık MİGTERA dozlarıyla tedavi edilebilir. Bu hastalarda dozun alınmasını izleyen 1 saat içerisinde anlamlı bir etki görülür. Migren atağı sırasında alındığı zaman da aynı derecede etkili olan MİGTERA tabletlerin, migren atağı başladıktan sonra mümkün olan en kısa zamanda alınması önerilir. Tekrarlayan ataklarda 24 saat içerisinde alınacak toplam MİGTERA miktarı 10 mg'ı aşmamalıdır.' MİGTERA migren profİİaksisİnde kullanılmaz. Uygulama şekli:Oral yolla kullanılır.Özel popülasyonlara ilişkin ek bilgiler:Böbrek /Karaciğer yetmezliği:Böbrek yetmezliği olan' hastalarda doz ayarlanmasına ihtiyaç yoktur (bkz, bölüm 5.2 Farmakokinetik özellikler).Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır (bkz. bölüm 5.2 Farmakokinetik özellikler). Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır. Pediyatrik popülasyon: '12 yaşın altındaki çocuklarda kullanım:Pediyatrik hastalarda zolmitriptanm güvenlilik ve etkililiği değerlendirilmemiştir. Bu nedenle MİGTERA'nın bu yaş grubu çocuklarda kullanımı önerilmemektedir. Ergenlik döneminde kullanım'(12-17 yaş arası): 12 ila 17 yaş arası hastalar-için zolmitriptan tabletin etkinliği plasebo kontrollü klinik çalışmalarda gösterilmemiştir. Bu sebeple MİGTERA tabletin ergenlik döneminde kullanımı önerilmemektedir. Geriyatrik popülasyon:Zolmitriptanm yaşı 65'in üzerinde olan hastalardaki ilaç emniyeti ve etkinliği, sistematik olarak değerlendirilmemiştir.4.3. KontrendİkasyönlarMİGTERA aşağıdaki durumlarda kontrendikedir; Ürün bileşiminde bulunan maddelerden herhangi birine karşı bilinen aşırı duyarlığı olanlarda, ' Kan basıncı kontrol altında olmayan hipertansiyon vakalarında, İskemik kalp hastalığında, Koroner spazm/ Prinzmetal angina vakalarında, Serebrovasküler olay (CVA) veya geçici iskemik atak (TİA) hikayesi olanlarda MİGTERA tabletin ergotamin veya ergotamin türevleri veya diğer 5-HTs reseptör antagonistleri ile birlikte uygulanması, Hemiplejik, baziller ve oftalmoplejik migren vakalarında kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriMİGTERA yalnızca, migren teşhisi açıkça konulmuş olan hastalarda kullanılmalı ve önemli olabilecek diğer nörolojik durumların bulunmadığı kesinleştirilmelidir. Zolmitriptanm hemiplejik veya.baziler migren tedavisinde kullanımıyla ilgili herhangi bir veri mevcut değildir. Migren hastalarında, belirli serebrovasküler olayların gelişme riski söz konusu olabilir. 5HTjb/id agonistleriyle tedavi edilen hastalarda serebral hemoraji, subaraknoid hemoraji, inme veya diğer serebrovasküler olaylar bildirilmiştir.MİGTERA, semptomatik Wolf-Parkinson-White sendromu vakalarına veya kalpteki aksesuar uyaran iletim yollan ile ilişkili başka aritmileri olan hastalara verilmemelidir. Çok nadir durumlarda, diğer 5HTJBagonistleri ile olduğu gibi, koroner vazospazm, anjina pektoris ve miyokard enfarktüsü bildirilmiştir. İskemik kalp hastalığı riski olan hastalara MİGTERA da dahil bu sınıftan bileşiklerle tedaviye başlamadan önce kardiyovasküler değerlendirme yapılması önerilir (bkz. bölüm 4.3 Kontrendikasyonlar). Ancak bu değerlendirmeler kalp hastalığı olan her hastayı belirleyemeyebİIir ve çok seyrek olarak herhangi bir kardiyovasküler rahatsızlığı olmayan hastalarda da ciddi kardİyak olaylar gelişmiştir.Diğer 5HT)b/id agonistleri gibi zolmitriptan kullanılmasından sonra da prekordiyal bölgede atıpik duyular bildirilmiştir (bkz. bölüm 4.8, İstenmeyen etkiler). Eğer göğüs ağrısı veya iskemik kalp hastalığı ile uyumlu semptomlar gözlenirse, uygun bir tıbbi değerlendirme yapılmadan daha fazla zolmitriptan alınmamalıdır. Diğer 5HT1B/1D agonistleri ile olduğu gibi, hipertansiyon hikayesi olan veya olmayan hastalarda sistemik kan basıncında geçici artış bildirilmiştir, çok nadiren kan basıncındaki bu artışlar belirgin klinik olaylara neden olmuştur. Diğer 5HTIB/IDagonistleri ile olduğu gibi, zolmitriptan alan hastalarda nadiren anaflaksi/anaflaktoid reaksiyonlar bildirilmiştir.Akut anti- migren ilaçların aşırı kullanımı baş ağrısı sıklığının artmasına ve muhtemelen tedavinin durdurulmasına sebep olabilir. Toptanların, Selektif Serotonin Geri Alım İnhibitörleri (SSRIs) ve Serotonin/ Norepinefrin Geri Alım İnhibitörlerİyle (SNRIs) birlikte kullanımının Serotonin Sendromuna neden olabileceği bildirilmiştir, Serotonin Sendromu hayati tehlike oluşturma potansiyeline sahiptir ve mental durum değişikliği (örn: ajitasyon, halüsinasyonlar, koma), otonomik instabilite, (örn: taşikardi,. değişken kan basıncı, hipertermi), nöromuskuler bozukluklar (örn: hiperrefleksi, koordinasyon bozukluğu), ve/veya gastrointestinal semptomlar (örn: bulantı, kusma, diyare) gibi belirti ve semptomlar gösterir. MİGTERA ile birlikte S SRİ veya SNRI kullanması klinik açıdan gerekli olan hastalarda, özellikle tedavinin başlangıcında ve doz artırıldığında dikkatli bir gözlem önerilir (bkz. bölüm 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri), MİGTERA tabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. Bu tıbbi ürün 2.50 mg sodyum nişasta glikolat içerir. Sodyum miktarının 23 mg (lmmol)'dan az olması nedeniyle sodyuma bağlı herhangi bir olumsuz etki beklenmez. Kaplama maddesinde bulunan, sunşet sarısı FCF Al Lak (E 110) ve ponceau 4R Al Lak (E 124) alerjik reaksiyonlara sebep olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBeta blokörler, oral dihidroergotamin, pizotifen gibi migren profılaksisi ilaçlarının birlikte kullanılmasının, zolmitriptanm etkinliğinde değişiklik yaptığını veya istenmeyen etkilere yol açtığını gösteren hiçbir kanıt yoktur.Akut semptomatik tedavi amacıyla kullanılan parasetamol, metoklopramid ve ergotamin gibi ilaçlar zolmitriptanm farmakokinetiğini veya tolerabilitesini etkilememiştir. MİGTERA tedavisini izleyen 12 saat içerisinde, diğer 5ÜT'i b/j d agoni s i 1 erinin kullanılmaması gerekir. Sağlıklı gönüllülerden elde edilen veriler, zolmitriptan ile ergotamin arasında farmakokinetik veya klinik olarak önemli bir etkileşim olmadığını gösterse de, teorik olarak koroner vazospazm riskinin artması olasıdır. Bu nedenle ergotamin içeren preparatların kullanılmasını takiben MİGTERA kullanılması için en az 24 saat beklenmesi, bunun aksine MİGTERA kullanılmasını takiben ergotamin içeren preparatlar kullanılması için en az 6 saat beklenmesi önerilir (bkz. bölüm 4.3 Kontrendikasyonlar). Spesifik bir MAO-A (monoamin oksidaz-A) inhibitörü olan moklobemid kullanılmasını takiben, zolmitriptanm E AA (Eğri Altındaki Alan) değeri küçük bir oranda (%26), aktif metabolitinin EAA değeri ise 3 kat arttığından; bir MAO-A inhibitörü kullanan hastalarda 24 saat içerisinde kullanılacak MİGTERA dozu 5 mg'ı aşmamalıdır. ¦ Genel bir P450 inhibitörü olan simetidin kullanılmasını takiben, zolmitriptanm eliminasyon yarı-ömrü %44, EAA değeri %48 oranında artmıştır. Ayrıca, zolmitriptanm aktif metaboliti olan IS3C91 'in (N-desmetil) eliminasyon yarı-ömrü ve EAA değeri 2 kat artmıştır. Simetidin kullanan hastalarda 24 saat içerisinde maksimum 5 mg MİGTERA kullanılması önerilir. Etkileşim profili bir bütün olarak göz önünde bulundurulduğunda, bir sitokrom P450 izoenzimi olan CYP1A2 inhibitörleriyle etkileşim göz ardı edilemez. Bu nedenle, fluvoksamin ve kinolon grubu antibiyotikler (örneğin siprofloksasin) gibi bileşiklerle de aynı şekilde doz azaltılması önerilir. Fluoksetin zolmitriptanm farmakokinetik parametrelerini etkilemez. ¦ Spesifik serotonin geri alım inhibitörieri olan fluoksetin, sertralin, paroksetin ve sitalopramm terapötik dozları, CYPlA2'yi inhib'e etmez. Fakat, triptanlarm ve SSRIs (öm: fluoksetin, paroksetin, sertralin) ve SNRIs (öm: venlafaksin, duloksetin) ile kombine kullanımı sırasında Serotonin Sendromu bildirilmiştir (bkz. bölüm 4.4). Diğer 5HT]B/id agonistleri ile olduğu gibi, zolmitriptan kullanımı ile bitkisel tedavi St John's Wort bitkisel preparatmm (Hypericum perforatum,sarı kantaron) arasında dinamik etkileşim potansiyeli mevcut olduğundan, istenmeyen etkilerin artışına neden olabilir,4.6. Gebelik ve iaktasyon Genel tavsiye:Gebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):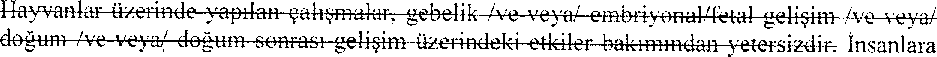 yönelik potansiyel risk bilinmemektedir.
yönelik potansiyel risk bilinmemektedir.Gebelik dönemiMİGTERA, gebe kadınlarda yalnızca, annede elde edilecek faydaların, fetüsün karşı karşıya kalabileceği risklerden açıkça daha fazla olması durumunda kullanılmalıdır. Gebe kadınlarda yapılmış herhangi bir çalışma yoktur fakat hayvan çalışmalarında hiçbir teratojenik etki ile karşılaşılmamıştır (bkz. bölüm 5.3 Klinik öncesi güvenlilik verileri).Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. Laktasyon dönemiZolmitriptanm süt veren hayvanların sütüne geçtiği gösterilmiştir. Zolmitriptanm insanlarda anne sütüne geçişi konusunda herhangi bir veri mevcut olmadığından MİGTERA'mn bebeğini emziren kadınlarda kullanılması sırasında dikkatli olmak gerekir.Üreme yeteneği/FertiliteHayvanlarda yapılan üreme çalışmalarında, fertilite üzerinde bir etki ortaya çıkmamıştır. İnsanlar üzerinde ya da klinik dışı üreyebilirlik çalışmalarından elde edilmiş veri bulunmamaktadır.4.7, Araç ve makine kullanımı üzerindeki etkiler20 mg'a kadar çıkan zolmitriptan dozları, psikomotor test performansını anlamlı şekilde bozmamıştır. MİGTERA kullanımının, hastaların araç ya da makine kullanma yeteneğini bozma olasılığı yoktur. Ancak somnolansa neden olabileceğinden, hastalar motorlu araçlar da dahil makine kullanımı sırasında dikkatli olmaları konusunda uyarılmalıdır.4.8. İstenmeyen etkilerZolmitriptan, iyi tolere edilir. Advers olaylar tipik olarak hafif/orta şiddettedir, geçicidir, ciddi değildir ve ek tedavi gerektirmeksizin kendiliğinden düzelir.Olası yan etkilerin, dozun alınmasını izleyen 4 saat içerisinde görülme eğilimi vardır ve bunlar, tekrarlanan dozlardan sonra sıklaşmaz. İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıkları:Seyrek: Anaflaktik /anaflaktoid reaksiyonlar, aşırı duyarlılık reaksiyonlarıSinir sistemi hastalıkları:Yaygın: Duyu anormallikleri ve bozuklukları, baş dönmesi, baş ağrısı, hiperestezi, parestezi, somnolans, sıcaklık hissiKardiyak hastalıklar:Yaygın: Palpitasyon 'Yaygın olmayan: Taşikardi Çok seyrek: Anjina pektoris, koroner vazospazm, miyokard enfarktüsü Vasküler hastalıklar:Yaygın olmayan: Sistemik kan basıncında geçici artışGastrointestinal hastalıklar:Yaygın: Karın ağrısı, ağız kuruluğu, bulantı, kusmaÇok seyrek: Kanlı ishal, gastrointestinal enfarkt veya nekroz, gastrointestinal iskemik olaylar, iskemik kolit, splenik enfarkt . Deri ve deri altı doku hastalıkları:Seyrek: Anjiyoödem, ürtikerKas- iskelet sistemi, bağ doku ve kemik hastalıklarıYaygın: Kas zayıflığı, miyalji 'Böbrek ve idrar yolu hastalıklarıYaygın olmayan: Poliüri, idrar sıklığı ,Çok seyrek: Acil idrar yapma hissi Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Asteni, boğaz boyun ekstremitelerde veya göğüste ağırlık, daralma veya baskı hissi4.9. Doz aşımı ve tedavisi50 mg'lık bir tek oral doz zolmitriptan alan gönüllülerde genellikle sedasyon görülmüştür. Zolmitriptan tabletlerin eliminasyon yarı-ömrü 2,5-3 saat olduğundan (bkz. bölüm 5.2 Farmakokinetik özellikler) aşırı doz alan hastalar, en az 15 saat boyunca veya semptomlar ve belirtiler devam ettiği sürece izlenmelidir.Zolmitriptanın spesifik bir antidotu yoktur. Şiddetli intoksikasyon durumunda yoğun bakım Önlemlerinin alınması ve bu arada açık bir hava yolu sağlanması ve devam ettirilmesi, yeterli oksijenasyon ve ventilasyon sağlanması, kardiyovasküler sistemin izlenmesi ve desteklenmesi önerilir. ' Hemodiyaliz veya peritoneal diyalizin zolmitriptamn serum konsantrasyonları üzerinde etkileri bilinmemektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Selektif serotonin (5HTj) agonistleri ATC kodu: N02CC03Preklinik çalışmalarda zolmitriptamn, vasküler insan rekombinant 5HTıB ve 5HTjD reseptör alt tiplerinin selektif agoriisti olduğu gösterilmiştir. Zolmitriptan, yüksek afmiteli bir 5HTib/id reseptör agonistidir ve orta dereceli 5HTia reseptör afınitesine sahiptir. Zolmitriptamn 5HT2-, 5HT3-, 5HT4, alfaı-, alfa2- veya betat-adrenerjik; Hı-, H2-, histaminik; muskarinik, dopaminerjikt veya dopaminerjik2 reseptörlerine belirgin bir afınitesi (radyoligand bağlanma analizleri ile ölçüldüğü gibi) veya farmakolojik aktivitesi yoktur. 5HTid reseptörü baskın olarak, trigeminal sinirlerin hem periferik hem de merkezi sinapsl arında presinaptik yerleşmiştir ve klinik öncesi çalışmalar zolmitriptanın her iki bölgeyi de etkileyebildiğini göstermiştir. ' Bir kontrollü çalışmada 696 ergenlik dönemindeki migren hastasında, zolmitriptan tabletlerin 2.5 mg, 5 mg ve 10 mg dozlarının plaseboya üstünlüğü gösterilememiştir. 5.2. Farmakokinetik özellikler Genel özelliklerZolmitriptan hızla ve iyi bir şekilde emilir. Asıl bileşiğin ortalama mutlak biyoyararlanım oranı yaklaşık %40'tır.Emilim;Zolmitriptan konvensiyonel tabletlerin oral yolla alınmasını takiben, zolmitriptan hızla ve iyi bir şekilde (dozun en az %64'ü) emilir. Asıl bileşiğin ortalama mutlak biyoyararlanım oranı yaklaşık %40'tır. Yine bir 5HT 1BDağılım:Sağlıklı kişilerde, tek doz olarak verildiğinde, zolmitriptan ve aktif metaboliti 183C91, 2.5 ila 50 mg doz aralığında dozla orantılı.EAA ve Cmaks gösterir. CmakS'ın %75'i ile absorpsiyon hızlıdır ve 1 saat içinde ulaşılır, plazma konsantrasyonları 4 ila 6 saat devam eder. Zolmitriptan absorpsiyonu gıda varlığından etkilenmez. Zolmitriptanın çoklu dozlarında bile biriktiği gösterilmemiştir. Bivotransformasvon:Zolmitriptan vücuttan daha çok, karaciğerde biyotransformasyon geçirerek oluşan metabolitlerinin böbrekler yoluyla atılması şeklinde uzaklaştırılır. Zolmitriptanın başlıca 3 metaboliti vardır: indol asetik asit (plazmadaki ve idrardaki ana metabolit), N-oksit ve N-desmetil analogları. Bunlardan N-desmetil metabolit (183091) aktiftir, diğerleri değildir. Plazmadaki 183C91 konsantrasyonları, asıl ilacın yaklaşık yansı olduğundan bu metabolitin, zolmitriptanın terapötik etkisine katkıda bulunması beklenir. Tek oral dozun %60'dan fazlası idrarla (esas olarak İndol asetik asit metaboliti olarak) atılır ve %30'u değişmemiş ana bileşen olarak feçesle atılır, ¦ Karaciğer hastalığının zolmitriptanın farmakokinetiği üzerindeki etkisini değerlendirmek için yapılan çalışmada, sağlıklı gönüllülerle orta veya ileri derecede karaciğer bozukluğu olan hastalar karşılaştırıldığında orta dereceli karaciğer bozukluğu olan hastaların EAA ve Cmaks değerleri sırasıyla %94 ve %50 ve ileri derecede karaciğer bozukluğu olan hastaların ise %226 ve %47 arttığı gösterilmiştir. 183C91 metaboliti için, orta düzeyde karaciğer yetmezliği olan hastalarda EAA ve CmakS sırasıyla %33 ve %44 azalmış, şiddetli karaciğer yetmezliği olan hastalarda sırasıyla %82 ve %90 azalmıştır. . Eliminasyon:.Zolmitriptanın plazma yarı ömrü (t 1/2) sağlıklı gönüllülerde 4.7 saat, orta derecede karaciğer bozukluğu olan hastalarda 7.3 saat ve ileri derecede karaciğer bozukluğu olanlarda ise 12 saattir. 183C91 metaboliti için ilgili tı/2 değerleri sırasıyla 5.7 saat, 7,5 saat ve 7,8 saattir. İntravenöz kullanımdan sonraki ortalama total plazma klerensi 10 ml/dak/kg kadardır ve bunun üçte biri renal klerenstir. Renal klerensinglomerüler fıltrasyon hızından fazla olması renal tübüler sekresyonu akla getirmektedir. İntravenöz dozdan sonraki dağılım hacmi, 2.4 litre/kg'dır. Plazma proteinlerine bağlanma oranı düşüktür (yaklaşık %25). Zolmitriptanm ortalama eliminasyon yarı-ömrü 2.5-3 saat kadardır. Metabolitlerinin yarı ömrünün de benzer olması, eliminasyonlarmın oluşum hızı ile sınırlı olduğunu akla getirmektedir. Zolmitriptanm ve metabolitlerinin renal klerensi, orta-ileri derecede böbrek bozukluğu vakalarında sağlıklı gönüllülere göre 7 ila 8 kat azalmıştır, ana bileşenin ve aktif metabolitin EAA değeri hafif artarken (sırasıyla %16 ve %35), yarı ömrü 1 saat artış ile 3 ila 3.5 saattir. Bu parametreler sağlıklı gönüllülerde gözlenen aralık dahilindedir. Hastalardaki karakteristik özelliklerYaşlılarZolmitriptanm ileri yaşta, sağlıklı insanlardaki farmakokinetiği, sağlıklı genç gönüllülerdekine benzer bulunmuştur. Böbrek yetmezliğiBöbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur. Karaciğer yetmezliğiKaraciğer yetmezliği olan hastalarda metabolizma azalmıştır. Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır. EtkileşimlerSağlıklı küçük bir gönüllü grubunda, zolmitriptan ergotaminle birlikte kullanıldığında farmakolojik etkileşim görülmemiştir. Zolmitriptanm ergotamin/kafein ile birlikte verilmesi, iyi tolere edilmiş ve yan etkilerde ya da kan basıncı değişikliklerinde, zolmitriptanm tek başına kullanılmasına kıyasla herhangi bir artışla sonuçlanmamıştır. Rifampisin uygulanmasını takiben, zolmitriptan veya aktif metâbolitlerinde klinik olarak ilişkili bir fark gözlenmemiştir. Bir MAO-B inhibitörü olan selegilin, serotonin geri-alım iııhibitörü (SSRİ) olan fluoksetin, zolmitriptan farmakokinetİk parametreleri üzerinde etkili olmamıştır. 5.3, Klinik öncesi güvenlilik verileri ,Zolmitriptan kullanılarak oral teratojen etki çalışması yapılmıştır. Zolmitriptanm maksimum tolere edilebilen dozları 1200 mg/kg/gün (EAA 605 (ig/ml saat = insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nın yaklaşık 3700 katı) ve 30 mg/kg/gün (EAA 4,9 [ig/ml. saat = insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nın yaklaşık 30 katı) sıçan ve tavşanlarda herhangi bir teratojenik etki görülmemiştir.Beş genotoksisİte çalışması yapılmış ve bunların sonucunda zolmitriptanm, insanlarda herhangi bir genetik risk taşımadığına karar verilmiştir. Sıçanlarda ve farelerde uygulanabilen en yüksek dozlarla yapılan karsinojen etki çalışmaları, tümorojen etki izlenimi vermemiştir. Erkek ve dişi sıçanlarda, toksisite tarafından sınırlanan dozlar kullanılarak yapılan üreme çalışmaları, fertilite üzerinde herhangi bir etki göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz anhidrat 1Mikrokristalin selüloz FH 102 Sodyum nişasta glikolat (Explotab) Magnezyum stearat Film kaplama materyali Opadry yellow OY-C-22902 (Titanyum dioksit (E171),Kinolin sarısı Al lak (E104),Sunset sarısı FCF A! lak (El 10),Ponceau 4R Al lak (E124)) 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel uyarılar '25°C'nin altındaki oda sıcaklığında ve ambalajında saklanır.6.5. Ambalajın niteliği ve içeriğiAl/Al blister ' 'Kutuda 2 ya da 3 film tabletlik blisterler halinde. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer Özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİNOBEL İLAÇ SANAYİİ ve TİCARET A.Ş.İnkılap Mah. Akçakoca Sok. No: 10 34768 Ümraniye / İstanbul ¦¦ Tel: (216) 633 60 00 Fax: (216) 633 60 01-02 8. RUHSAT NUMARASI(LARI)220/699. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 02.09.2009 Ruhsat yenileme tarihi: 10. KÜB'ün YENİLENME TARİHİKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMİGTERA 2.5 mg film tablet2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Zolmitriptan
2.5 mg Yardımcı maddeler:Laktoz anhİdrat
106.54 mg 2.50 mg 4.0 m: Sodyum nişasta-glikolat (Explotab) Film kaplama materyali ' Opadry yellow OY-C-22902 Yardımcı maddeler için, bölüm 6. Fe bakınız. 3. FARMASÖTİK FORMFilm tablet ¦Sarı renkli film kaplı oval, bikonveks tabletler. 4. KLİNİK ÖZELLİKLER4.1.Terapötik endikasyonlarMİGTERA, auralı veya aurasız migren ataklarının akut tedavisinde endikedir.4.2. Pozoloji ve uygulama şekli Pözoloji/uygulama sıklığı ve süresi:Bir migren atağının tedavisinde önerilen MİGTERA dozu 2.5 mg'dır.Eğer semptomlar devam eder veya 24 saat içerisinde tekrarlarsa, alınacak ikinci bir dozun etkili olduğu gösterilmiştir. İkinci bir doz gerekiyorsa bu, başlangıç dozundan en az 2 saat geçtikten sonra alınmalıdır. Eğer hasta 2.5 mg'lık dozlardan tatmin edici bir fayda görmüyorsa, daha sonraki ataklar 5 mg'lık MİGTERA dozlarıyla tedavi edilebilir. Bu hastalarda dozun alınmasını izleyen 1 saat içerisinde anlamlı bir etki görülür. Migren atağı sırasında alındığı zaman da aynı derecede etkili olan MİGTERA tabletlerin, migren atağı başladıktan sonra mümkün olan en kısa zamanda alınması önerilir. Tekrarlayan ataklarda 24 saat içerisinde alınacak toplam MİGTERA miktarı 10 mg'ı açmamalıdır. MİGTERA migren profilaksisinde kullanılmaz. Uygulama şekli:Öral yolla kullanılır.Özel popülasyonlara ilişkin ek bilgiler:Böbrek /Karaciğer yetmezliği: .Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur (bkz, bölüm 5.2 Farmakokinetik özellikler).Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır (bkz. bölüm 5.2 Farmakokinetik özellikler). Bu sebeple orta.veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır. Pediyatrik popülasyon:12 yaşın altındaki çocuklarda kullanım:Pediyatrik hastalarda zolmitriptanm güvenlilik ve etkililiği değerlendirilmemiştir. Bu nedenle MİGTERA'nm bu yaş grubu çocuklarda kullanımı önerilmemektedir. Ergenlik döneminde kullanım (12-17 yaş arası): 12 ila 17 yaş arası hastalar için zolmitriptan tabletin etkinliği plasebo kontrollü klinik çalışmalarda gösterilmemiştir. Bu sebeple MİGTERA tabletin ergenlik döneminde kullanımı öneri İmemektedir. Geriyatrik popülasyon:.Zolmitriptanm yaşı 65'in üzerinde olan hastalardaki ilaç emniyeti ve etkinliği, sistematik olarak değerlendirilmemiştir.4.3. KontrendikasyonlarMİGTERA aşağıdaki durumlarda kontrendikedir; Ürün bileşiminde bulunan maddelerden herhangi birine karşı bilinen aşırı duyarlığı olanlarda, Kan basıncı kontrol altında olmayan hipertansiyon vakalarında, İskemik kalp hastalığında, Koroner spazm/ Prinzmetal angina vakalarında, Serebrovasküler olay (CVA) veya geçici iskemik atak (TİA) hikayesi olanlarda MİGTERA tabletin ergotamin veya ergotamin türevleri veya diğer 5-HTj reseptör antagonistleri ile birlikte uygulanması, Hemiplejik, baziller ve oftalmoplejik migren vakalarında kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriMİGTERA yalnızca, migren teşhisi açıkça konulmuş olan hastalarda kullanılmalı ve önemli olabilecek diğer nörolojik durumların bulunmadığı kesinleştİrİlmelidir. Zolmitriptanm hemiplejik veya baziler migren tedavisinde kullanımıyla ilgili herhangi bir veri mevcut değildir. Migren hastalarında, belirli serebrovasküler -olayların gelişme riski söz konusu olabilir. 5HTjb/id agonistleriyle tedavi edilen hastalarda serebral hemoraji, subaraknoid hemoraji, inme veya diğer serebrovasküler olaylar bildirilmiştir.MİGTERA, semptomatik Wolf-Parkinson-White sendromu vakalarına veya kalpteki aksesuar uyaran iletim yolları ile ilişkili başka aritmileri olan hastalara verilmemelidir. Çok nadir durumlarda, diğer 5HTi BDiğer 5HTj b/i d agonistleri gibi zolmitriptan kullanılmasından sonra da prekordiyal bölgede atipık duyular bildirilmiştir (bkz. bölüm 4.8, İstenmeyen etkiler). Eğer göğüs ağrısı veya iskemik kalp hastalığı ile uyumlu semptomlar gözlenirse, uygun bir tıbbi değerlendirme yapılmadan daha fazla zolmitriptan alınmamalıdır.Diğer 5HTib/id agonistleri ile olduğu gibi, hipertansiyon hikayesi olan veya olmayan hastalarda sistemik kan basıncında geçici artış bildirilmiştir, çok nadiren kan basıncındaki bu artışlar belirgin klinik olaylara neden olmuştur. Diğer 5HT İBAkut anti- migren ilaçların aşırı kullanımı baş ağrısı sıklığının artmasına ve muhtemelen tedavinin durdurulmasına sebep olabilir. ¦Toptanların, Selektif Serotonin Geri Alım inhibitörleri (SSRIs) ve Serotonin/ Norepinefrİn Geri Alım İnhibitörleriyle (SNRIs) birlikte kullanımının Serotonin Sendromuna neden olabileceği bildirilmiştir. Serotonin Sendromu hayati tehlike oluşturma potansiyeline sahiptir ve mental durum değişikliği (örn: ajitasyon, halüsinasyonlar, koma), otonomik İnstabilite, (örn: taşikardi, değişken kan basıncı, hipertermi), nöromuskuler bozukluklar (örn: hiperrefleksi, koordinasyon bozukluğu), ve/veya gastrointestinal semptomlar (öm: bulantı, kusma, diyare) gibi belirti ve semptomlar gösterir. MİGTERA ile birlikte SSRI veya SNRI kullanması klinik açıdan gerekli olan hastalarda, özellikle tedavinin başlangıcında ve doz artırıldığında dikkatli bir gözlem önerilir (bkz. bölüm 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri). MİGTERA tabletler laktoz içerir! Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. Bu tıbbi ürün 2.50 mg sodyum nişasta glikolat içerir. Sodyum miktarının 23 mg (Immol)'dan az olması nedeniyle sodyuma bağlı herhangi bir olumsuz etki beklenmez. Kaplama maddesinde bulunan, sunset sarısı FCF Al Lak (El 10) ve ponceau 4R Al Lak (E 124) alerjik reaksiyonlara sebep olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBeta biokörler, oral dihidroergotamiıl, pizotifen gibi migren profılaksisi ilaçlarının birlikte kullanılmasının, zolmitriptanın etkinliğinde değişiklik yaptığını veya istenmeyen etkilere yol açtığını gösteren hiçbir kanıt yoktur. Akut semptomatik tedavi amacıyla kullanılan parasetamol, metoklopramid ve ergotamin gibi ilaçlar zolmitriptanın farmakokinetiğini veya tolerabiiitesini etkilememiştir. MİGTERA tedavisini izleyen 12 saat içerisinde, diğer 5HTiB/sDagonistlerinin kullanılmaması gerekir. Sağlıklı gönüllülerden elde edilen veriler, zolmitrıptan ile ergotamin arasında farmakokinetik veya klinik olarak önemli bir etkileşim olmadığını gösterse de, teorik olarak koroner vazospazm riskinin artması olasıdır. Bu nedenle ergotamin içeren preparatların kullanılmasını takiben MİGTERA kullanılması için en az 24 saat beklenmesi, bunun aksine MİGTERA kullanılmasını takiben ergotamin içeren preparatlar kullanılması için en az 6 saat beklenmesi önerilir (bkz. bölüm 4.3 Kontrendikasyonlar). Spesifik bir MAO-A (monoamin oksidaz-A) inhibitörü olan moklobemid kullanılmasını takiben, zolmitriptanın EAA (Eğri Altındaki Alan) değeri küçük bir oranda (%26), aktif metabolitinin EAA değeri ise 3 kat arttığından; bir MAO-A inhibitörü kullanan hastalarda 24 saat içerisinde kullanılacak MİGTERA dozu 5 mg'ı aşmamahdır. Genel bir P450 inhibitörü olan simetidin kullanılmasını takiben, zolmitriptanın eliminasyon yarı-ömrü %44, EAA değeri %48 oranında artmıştır. Ayrıca, zolmitriptanın aktif metaboliti olan 183C91 'in (N-desmetil) eliminasyon yarı-ömrü ve EAA değeri 2 kat artmıştır. Simetidin kullanan hastalarda 24 saat içerisinde maksimum 5 mg MİGTERA kullanılması önerilir. Etkileşim profili bir bütün olarak göz önünde bulundurulduğunda, bir sitokrom P450 izoenzimi olan CYP1A2 iııhibitörferiyle etkileşim göz ardı edilemez. Bu nedenle, fluvoksamin ve kinolon grubu antibiyotikler (örneğin siprofloksasin) gibi bileşiklerle de aynı şekilde doz azaltılması önerilir. Fluoksetin zolmitriptanın farmakokinetik parametrelerini etkilemez. Spesifik serotonin geri alım inhibitörleri olan fluoksetin, sertralin, paroksetin ve sitalopramm terapötik dozları, CYPlA2'yi inhibe etmez. Fakat, triptanların ve SSRIs (örn: fluoksetin, paroksetin, sertralin) ve SNRIs (örn: venlafaksin, duloksetin) ile kombine kullanımı sırasında Serotonin Sendromu bildirilmiştir (bkz. bölüm 4.4). Diğer 5HTIB/ID(Hypericum perforgtum, sarı kantaron) arasında dinamik etkileşim potansiyeli mevcut olduğundan, istenmeyen etkilerin artışına neden olabilir.4.6. Gebelik ve laktasyon Genel tavsiye:Gebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon):İnsanlara yönelik potansiyel risk bilinmemektedir.Gebelik dönemiMİGTERA, gebe kadınlarda yalnızca, annede elde edilecek faydaların, fetüsün karşı karşıya kalabileceği risklerden açıkça daha fazla olması durumunda kullanılmalıdır. Gebe kadınlarda yapılmış herhangi bir çalışma yoktur fakat hayvan çalışmalarında hiçbir teratojenik etki ile karşılaşılmamıştır (bkz. bölüm 5.3 Klinik öncesi güvenlilik verileri).Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya 1embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir.Laktasyon dönemiZolmitriptanın süt veren hayvanların sütüne geçtiği gösterilmiştir. Zolmitriptanın insanlarda anne sütüne geçişi konusunda herhangi bir veri mevcut olmadığından MİGTERA'nın bebeğini emziren kadınlarda kullanılması sırasında dikkatli olmak gerekir.Üreme yeteneği/Fertilite ,Hayvanlarda yapılan üreme çalışmalarında, fertilite üzerinde bir etki ortaya çıkmamıştır. İnsanlar üzerinde ya ¦ da klinik dışı üreyebilirlik çalışmalarından elde edilmiş veri bulunmamaktadır.4.7. Araç ve makine kullanımı üzerindeki etkiler20 mg'a kadar çıkan zolmitriptan dozları, psikomotor test performansını anlamlı şekilde bozmamıştır, MİGTERA kullanımının, hastaların araç ya da makine kullanma yeteneğini bozma olasılığı yoktur. Ancak somnolansa neden olabileceğinden, hastalar motorlu araçlar da dahil makine kullanımı sırasında dikkatli olmaları konusunda uyarılmalıdır.4.8. İstenmeyen etkilerZolmitriptan, iyi tolere edilir. Advers olaylar tipik olarak hafıfi'orta şiddettedir, geçicidir, ciddi değildir ve ek tedavi gerektirmeksizin kendiliğinden düzelir.Olası yan etkilerin, dozun alınmasını izleyen 4 saat içerisinde görülme eğilimi vardır ve bunlar, tekrarlanan dozlardan sonra sıklaşmaz. İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıkları:Seyrek: Anaflaktik /anaflaktoid reaksiyonlar, aşırı duyarlılık reaksiyonlarıSinir sistemi hastalıkları:Yaygın: Duyu anormallikleri ve bozuklukları, baş dönmesi, baş ağrısı, hiperestezi, parestezi, somnolans, sıcaklık hissi ' ¦Kardiyak hastalıklar:Yaygın: Palpitasyon Yaygın olmayan: Ta'şikardiÇok seyrek: Anjinapektoris, koroner vazospazm, miyokard enfarktüsü Vasküler hastalıklar:.....Yaygın olmayan: Sistemİk kan basıncında geçici artışGastrointestinal hastalıklar:Yaygın: Karın ağrısı, ağız kuruluğu, bulantı, kusmaÇok seyrek: Kanlı ishal, gastrointestinal enfarkt veya nekroz, gastrointestinal iskemik olaylar, iskemik kolit, splenik enfarkt Deri ve deri altı doku hastalıkları:Seyrek: Anjiyoödem, ürtikerKas- iskelet sistemi, bağ doku ve kemik hastalıklarıYaygın: Kas zayıflığı, miyaljiBöbrek ve idrar yolu hastalıklarıYaygın olmayan: Poliüri, idrar sıklığı Çok seyrek: Acil idrar yapma hissiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Asteni, boğaz boyun ekstremitelerde veya göğüste ağırlık, daralma veya baskı hissi4.9. Doz aşımı ve tedavisi50 mg'lık bir tek oral doz zolmitriptan alan gönüllülerde genellikle sedasyon görülmüştür. Zolmitriptan tabletlerin eliminasyon yarı-ömrü 2.5-3 saat olduğundan (bkz. bölüm 5.2 Farmakokinetik özellikler) aşırı doz alan hastalar, en az 15 saat boyunca veya semptomlar ve belirtiler devam ettiği sürece izlenmelidir.Zolmitriptanm spesifik bir antidotu yoktur. Şiddetli intoksikasyon durumunda yoğun bakım Önlemlerinin alınması ve bu arada açık bir hava yolu sağlanması ve devam ettirilmesi, yeterli oksijenasyon ve ventilasyon sağlanması, kardiyovasküler sistemin izlenmesi ve desteklenmesi önerilir. Hemodiyaliz veya peritoneal diyalizin zolmitriptanm serum konsantrasyonları üzerinde etkileri bilinmemektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Selektif serotonin (5HTı) agonistleri ATC kodu: N02CC03 .Preklİnik çalışmalarda zolmitriptanm, vasküler insan rekombinant 5HTjb ve 5HTi D!B[A reseptör afmitesine sahiptir. Zolmitriptanm 5HT2-, 5HT3-, 5HT4, alfaı-, alfa2- veya beta^adrenerjik; Hr, H2-, histaminik; muskarinik, dopaminerjikı veya dopaminerjiki reseptörlerine belirgin bir afınitesi (radyoligand bağlanma analizleri ile ölçüldüğü gibi) veya farmakolojik aktivitesi yoktur. 5HTıD reseptörü baskınolarak, trigeminal sinirlerin hem periferik hem de merkezi sinapslarmda presinaptik yerleşmiştir ve klinik öncesi çalışmalar zolmitriptamn her iki bölgeyi de etkileyebildiğini göstermiştir. Bir kontrollü çalışmada 696 ergenlik dönemindeki migren hastasında, zolmitriptan tabletlerin 2.5 mg, 5 mg ve 10 mg dozlarının plaseboya üstünlüğü gösterilememiştir. 5.2. Farmakokinetik özellikler Genel özellikler ,Zolmitriptan hızla ve iyi bir şekilde emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oranı yaklaşık %40'tır. 'Emilim:Zolmitriptan konvensiyonel tabletlerin oral yolla alınmasını takiben, zolmitriptan hızla ve iyi bir şekilde (dozun en az %64'ü) emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oram yaklaşık %40'tır. Yine bir 5HTi BDağılım:Sağlıklı kişilerde, tek doz olarak verildiğinde, zolmitriptan ve aktif metaboliti 183C91, 2.5 ila 50 mg doz aralığında dozla orantılı EAA ve Cmaks gösterir. Cmaks'ın %75'i ile absorpsiyon hızlıdır ve 1 saat içinde ulaşılır, plazma konsantrasyonları 4 ila 6 saat devam eder. Zolmitriptan absorpsiyonu gıda varlığından etkilenmez. Zolmitriptamn çoklu dozlarında bile biriktiği gösterilmemiştir. Biyotransformasvon:Zolmitriptan vücuttan daha çok, karaciğerde biyo transformasyon geçirerek oluşan metabolitlerinin böbrekler yoluyla atılması şeklinde uzaklaştırılır. Zolmitriptamn başlıca 3 metaboliti vardır: İndol asetik asit (plazmadaki ve idrardaki ana metabolit), N-oksit ve N-desmetil analogları. Bunlardan N-desmetil metabolit (183C91) aktiftir, diğerleri değildir. Plazmadaki 183C91 konsantrasyonları, asıl ilacın yaklaşık yarısı olduğundan bu metabolitin, zolmitriptamn terapötik etkisine katkıda bulunması beklenir. Tek oral dozun %60'dan fazlası idrarla (esas olarak indol asetik asit metaboliti olarak) atılır ve %30'u değişmemiş ana bileşen olarak feçesle atılır. Karaciğer hastalığının zolmitriptamn farmakokinetiği üzerindeki etkisini değerlendirmek için yapılan çalışmada, sağlıklı gönüllülerle orta veya ileri derecede' karaciğer bozukluğu olan hastalar karşılaştırıldığında orta dereceli karaciğer bozukluğu olan hastaların EAA ve Cmaks değerleri sırasıyla %94 ve %50 ve ileri derecede karaciğer bozukluğu olan hastaların ise %226 ve %47 arttığı gösterilmiştir. 183C91 metaboliti için, orta düzeyde karaciğer yetmezliği olan hastalarda EAA ve Cmaks sırasıyla %33 ve %44 azalmış, şiddetli karaciğer yetmezliği olan hastalarda sırasıyla %82 ve %90 azalmıştır. Eliminasyon:Zolmitriptamn plazma yarı ömrü (tı/2) sağlıklı gönüllülerde 4.7 saat, orta derecede karaciğer bozukluğu olan hastalarda 7.3 saat ve ileri derecede karaciğer bozukluğu olanlarda ise 12 saattir. 183C91 metaboliti için ilgili 11/2 değerleri sırasıyla 5.7 saat, 7.5 saat ve 7.8 saattir. İntravenöz kullanımdan sonraki ortalama total plazma klerensi 10 ml/dak/kg kadardır ve bunun üçte biri renal klerenstir. Renal klerensin glomerüler fıltrasyon hızından fazla olması renal tübüler sekresyonu akla getirmektedir, İntravenöz dozdan sonraki dağılım hacmi, 2.4 litre/kg'dır. Plazma proteinlerine bağlanma oranı düşüktür (yaklaşık %25). Zolmitriptanm ortalama eliminasyon yarı-ömrü 2.5-3 saat kadardır. Metabolitlerinin yarı ömrünün de benzer olması, eliminasyonlarınm oluşum hızı ile sınırlı olduğunu akla getirmektedir. Zolmitriptanm ve metabolitlerinin renal klerensi, orta-ileri derecede böbrek bozukluğu vakalarında sağlıklı gönüllülere göre 7 ila 8 kat azalmıştır, ana bileşenin ve aktif metabolitin EAA değeri hafif artarken (sırasıyla %16 ve %35), yarı ömrü 1 saat artış ile 3 ila 3.5 saattir. Bu parametreler sağlıklı gönüllülerde gözlenen aralık dahilindedir. Hastalardaki karakteristik özelliklerYaslılarZolmitriptanm ileri yaşta, sağlıklı insanlardaki farmakokinetiği, sağlıklı genç gönüllülerdekine benzer bulunmuştur. Böbrek yetmezliğiBöbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur. Karaciğer yetmezliğiKaraciğer yetmezliği olan hastalarda metabolizma azalmıştır. Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum -doz 5 mg'dır. EtkileşimlerSağlıklı küçük bir gönüllü grubunda, zolmitriptan ergotaminle birlikte kullanıldığında farmakolojik etkileşim görülmemiştir. Zolmitriptanm ergotamin/kafein ile birlikte verilmesi, iyi tolere edilmiş ve yan etkilerde ya da kan basıncı değişikliklerinde, zolmitriptanm tek başına kullanılmasına kıyasla herhangi bir artışla sonuçlanmamıştır. Rifampisin uygulanmasını takiben, zolmitriptan veya aktif metabolitlerinde klinik olarak ilişkili bir fark gözlenmemiştir. Bir MAO-B inhibitörü olan selegİIin, serotonin geri-alım inhibitörü (SSRİ) olan fluoksetin, zolmitriptan farmakokinetik parametreleri üzerinde etkili olmamıştır. 5.3. Klinik öncesi güvenlilik verileriZolmitriptan kullanılarak oral teratojen etki çalışması yapılmıştır. Zolmitriptanm maksimum tolere edilebilen dozları 1200 mg/kg/gün (EAA 605 jag/ml saat = insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nın yaklaşık 3700 katı) ve 30 mg/kg/gün (EAA 4.9 (ig/ml. saat = insanda önerilen maksimum günlük dozdan 15 mg'a ait EAA'nın yaklaşık 30 katı) sıçan ve tavşanlarda herhangi bir teratojenik etki görülmemiştir.Beş genotoksisite çalışması yapılmış ve bunların sonucunda zolmitriptanm, insanlarda herhangi bir genetik risk taşımadığına karar verilmiştir. Sıçanlarda ve farelerde uygulanabilen en yüksek dozlarla yapılan karsinojen etki çalışmaları, tümorojen etki izlenimi vermemiştir. ¦¦ Erkek ve dişi sıçanlarda, toksisite tarafından sınırlanan dozlar kullanılarak yapılan üreme çalışmaları, fertilite üzerinde herhangi bir etki göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesi ¦Laktoz anhidrat . .Mikrokristalin selüloz PH 102 Sodyum nişasta glikolat (ExpIotab) Magnezyum stearat Film kaplama materyali Opadry yellow OY-C-22902 (Titanyum dioksit (E171),Kinolin sarısı Al lak (E104),Sunset sarısı FCF Al lak (El 10),Ponceau 4R Al lak (E 124)) 6.2. Geçimsizlikler - ' ¦Bilinen herhangi bir geçimsizliği bulunmamaktadır.6.3. Raf ömrü24 ay ¦ 6.4. Saklamaya yönelik özel uyanlar25°C,nin alımdaki oda sıcaklığında ve ambalajında saklanır.6.5. Ambalajın niteliği ve içeriğiAl/Al blisterKutuda 2 ya da 3 film tabletlik blisterler halinde. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü YönetmeliğP'nc uygun olarak imha edilmelidir.7. RUHSAT SAHİBİNOBEL İLAÇ SANAYİİ ve TİCARET A.Ş.İnkılap Mah. Akçakoca Sok. No: 10 34768 Ümraniye / İstanbul Tel: (216)633 60 00 Fax: (216) 633 60 01-02 8. RUHSAT NUMARASI(LARI)220/699. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 02.09.2009 Ruhsat yenileme tarihi: 10. KÜB'iin YENİLENME TARİHİKISA ÜRÜN BİLGİSİ1 BEŞERj TIBBj ürüjsjün ADIMİGTERA 2.5 mg film tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Zolmitriptan
2.5 mg Yardımcı maddeler:Laktoz anhidrat
106.54 mg . 2.50 mg 4.0 mg Sodyum nişasta glikolat (Explotab) Film kaplama materyali Opadry ye!low OY-C-22902 Yardımcı maddeler için, bölüm 6.1'e bakınız. ¦ 3. FARMASÖTİK FORMFilm tabletSarı renkli film kaplı oval, bikonveks tabletler. 4. KLİNİK ÖZELLİKLER4.1.Terapötik endikasyonlarMİGTERA, auralı veya aurasız migren ataklarının akut tedavisinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:.Bir migren atağının tedavisinde önerilen MİGTERA dozu 2.5 mg'dır.Eğer semptomlar devam eder veya 24 saat içerisinde tekrarlarsa, alınacak ikinci bir dozun etkili olduğu gösterilmiştir. İkinci bir .doz gerekiyorsa bu, başlangıç dozundan en az 2 saat geçtikten sonra alınmalıdır. Eğer hasta 2.5 mg'lık dozlardan tatmin edici bir fayda görmüyorsa, daha sonraki ataklar 5 mg'lık MİGTERA dozlarıyla tedavi edilebilir. Bu hastalarda dozun alınmasını izleyen 1 saat içerisinde anlamlı bir etki görülür. Migren atağı sırasında alındığı zaman da aynı derecede etkili olan MİGTERA tabletlerin, migren atağı başladıktan sonra mümkün olan en kısa zamanda alınması önerilir. Tekrarlayan ataklarda 24 saat içerisinde alınacak toplam MİGTERA miktarı 10 mg'ı aşmamahdır. ' MİGTERA migren profilaksisinde kullanılmaz. Uygulama şekli:Oral yolla kullanılır. .Özel popülasyonlara ilişkin ek bilgiler:Böbrek /Karaciğer yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur (bkz, bölüm 5.2 Farmakokinetik özellikler)..Karaciğer yetmezliği olan hastalarda metabolizma azalmıştır (bkz. bölüm 5.2 Farmakokinetik özellikler). Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır. Pediyatrik popülasyon:12 yaşın altındaki çocuklarda kullanım:Pediyatrik hastalarda zolmitriptanm güvenlilik ve etkililiği değerlendirilmemiştir. Bu nedenle MİGTERA'nın bu yaş grubu çocuklarda kullanımı önerilmemektedir. Ergenlik döneminde kullanım (12-17 yaş arası): 12 ila 17 yaş arası hastalar için zolmitriptan tabletin etkinliği plasebo kontrollü klinik çalışmalarda gösterilmemiştir. Bu sebeple MİGTERA tabletin ergenlik döneminde kullanımı önerilmemektedir. Geriyatrik popülasyon:Zolmitriptanm yaşı 65'in üzerinde olan hastalardaki ilaç emniyeti ve etkinliği, sistematik olarak değerlendirilmemiştir.4.3. KontrendikasyonlarMİGTERA aşağıdaki durumlarda kontrendikedir; Ürün bileşiminde bulunan maddelerden herhangi birine karşı bilinen aşırı duyarlığı olanlarda, ' ' Kan basıncı kontrol altında olmayan hipertansiyon vakalarında, İskemik kalp hastalığında, Koroner spazm/ Prinzmetal angına vakalarında, Serebrovasküler olay (CVA) veya geçici iskemik atak (TİA) hikayesi olanlarda MİGTERA tabletin ergotamin veya ergotamin türevleri veya diğer 5-HTj reseptör antagonistleri ile birlikte uygulanması, . . Flemiplejik, baziller ve oftalmoplejik migren vakalarında kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriMİGTERA yalnızca, migren teşhisi açıkça konulmuş olan hastalarda kullanılmalı ve önemli olabilecek diğer nörolojik durumların bulunmadığı kesinleştirilmelidir. Zolmitriptanm hemiplejik veya baziler migren tedavisinde kullanımıyla ilgili herhangi bir veri mevcut değildir. Migren hastalarında, belirli serebrovasküler olayların gelişme riski söz konusu olabilir. 5HTjb/id agonistleriyle tedavi edilen hastalarda serebral hemorajİ, subaraknoid hemoraji, inme veya diğer serebrovasküler olaylar bildirilmiştir. ........MİGTERA, semptomatik Wolf-Parkinson-White sendromu vakalarına veya kalpteki aksesuar uyaran iletim yolları ile ilişkili başka aritmileri olan hastalara verilmemelidir. Çok nadir durumlarda, diğer 5HTJB/IDagonistleri ile olduğu gibi, koroner vazo spazm, anjina pektoris ve miyokard enfarktüsü bildirilmiştir. İskemik kalp hastalığı riski olan hastalara MİGTERA da dahil bu sınıftan bileşiklerle tedaviye başlamadan önce kardiyovasküler değerlendirme yapılması önerilir (bkz. bölüm 4.3 Kontrendikasyonlar). Ancak bu değerlendirmeler kalp hastalığı olan her hastayı belirleyemeyebilir ve çok seyrek olarak herhangi bir kardiyovasküler rahatsızlığı olmayan hastalarda da ciddi kardiyak olaylar gelişmiştir.Diğer 5HTJB/IDagonistleri gibi zolmitriptan kullanılmasından sonra da prekordiyal bölgede atipik duyular bildirilmiştir (bkz, bölüm 4.8, İstenmeyen etkiler). Eğer göğüs ağrısı veya iskemik kalp hastalığı ile uyumlu semptomlar gözlenirse, uygun bir tıbbi değerlendirme yapılmadan daha fazla zolmitriptan alınmamalıdır. ¦Diğer 5HTIB/IDagonistleri ile olduğu gibi, hipertansiyon hikayesi olan veya olmayan hastalarda sistemik kan basıncında geçici artış bildirilmiştir, çok nadiren kan basıncındaki bu artışlar belirgin klinik olaylara neden olmuştur.Diğer 5HTIB/IDagonistleri ile olduğu gibi, zolmitriptan alan hastalarda nadiren anaflaksi/anaflaktoid reaksiyonlar bildirilmiştir.Akut anti- migren ilaçların aşırı kullanımı baş ağrısı'sıklığının artmasına ve muhtemelen tedavinin durdurulmasına sebep olabilir. Triptanlarm, Selektif Serotonin Geri Alım Inhibitörleri (SSRIs) ve Serotonin/ Norepinefrin Geri Alım Inhibitörleriyle (SNRIs) birlikte kullanımının Serotonin Sendromuna neden olabileceği bildirilmiştir. Serotonin Sendromu hayati tehlike oluşturma potansiyeline sahiptir ve mental durum değişikliği (Örn: 'ajitasyon, 'halüsinasyonlar, koma), otonomİk instabilite, (örn: taşikardi, değişken kan basıncı, hipertermi), nöromuskuler bozukluklar (örn: hiperrefleksi, koordinasyon bozukluğu), ve/veya gastrointestinal semptomlar (örn: bulantı, kusma, diyare) gibi belirti ve semptomlar gösterir. MİGTERA ile birlikte SSRİ veya SNRI kullanması klinik açıdan gerekli olan hastalarda, özellikle tedavinin başlangıcında ve doz artırıldığında dikkatli bir gözlem önerilir (bkz. bölüm 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri). MİGTERA tabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. Bu tıbbi ürün 2.50 mg sodyum nişasta glikolat içerir. Sodyum miktarının 23 mg (lmmol)'dan az olması nedeniyle sodyuma bağlı herhangi bir olumsuz etki beklenmez. Kaplama maddesinde bulunan, sunset sarısı FCF Al Lak (El 10) ve ponceau 4R Al Lak (E 124) alerjik reaksiyonlara sebep olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBeta blokörler, oral dihidroergotamin, pizotifen gibi migren profılaksisi ilaçlarının birlikte kullanılmasının,' zolmitriptanın etkinliğinde değişiklik yaptığını veya istenmeyen etkilere yol açtığını gösteren hiçbir kanıt yoktur.Akut semptomatik tedavi amacıyla kullanılan parasetamol, metoklopramid ve ergotamin gibi ilaçlar zolmitriptanın farmakokinetiğini veya tolerabilitesini etkilememiştir. MİGTERA tedavisini izleyen 12 saat içerisinde, diğer 5HTıB/iDagonistIerinin kullanılmaması gerekir. Sağlıklı gönüllülerden elde edilen veriler, zolmitriptan ile ergotamin arasında farmakokinetik veya klinik olarak önemli bir etkileşim olmadığım. gösterse de, teorik olarak koroner vazospazm riskinin artması olasıdır. Bu nedenle ergotamin içeren preparatların kullanılmasını takiben MİGTERA kullanılması için en az 24 saat beklenmesi, bunun aksine MİGTERA kullanılmasını takiben ergotamin içeren preparatlar kullanılması için en az 6 saat beklenmesi önerilir (bkz. bölüm 4,3 Kontrendikasyonlar). Spesifik bir MAO-A (monoamin ,oksidaz-A) inhibitörü olan moklobemid kullanılmasını takiben, zolmitriptanın EAA (Eğri Altındaki Alan) değeri küçük bir oranda (%26), aktif metabolitinin EAA değeri ise 3 kat arttığından; bir MAO-A inhibitörü kullanan hastalarda 24 saat içerisinde kullanılacak MİGTERA dozu 5 mg'ı aşmamalıdır. Genel bir P450 inhibitörü olan simetidin kullanılmasını takiben, zolmitriptanın eliminasyon yarı-ömrü %44, EAA değeri %48 oranında artmıştır. Ayrıca, zolmitriptanın aktif metaboliti olan 183C91'in (N-desmetil) eliminasyon yarı-ömrü ve EAA değeri 2 kat artmıştır. Simetidin kullanan hastalarda 24 saat içerisinde maksimum 5 mg MİGTERA kullanılması önerilir. Etkileşim profili bir bütün olarak göz önünde bulundurulduğunda, bir sitokrom P450 izoenzimi olan CYP1A2 inhibitörleriyle etkileşim göz ardı edilemez. Bu nedenle, fluvoksamin ve kinolon grubu antibiyotikler (örneğin siprofloksasin) gibi bileşiklerle de aynı şekilde doz azaltılması önerilir. Fluoksetin zolmitriptanın farmakokinetik parametrelerini etkilemez. Spesifik serotonin geri alım inhibitörleri olan fluoksetin, sertralin, paroksetin ve sitalopramın terapötik dozları, CYPlA2'yi inhibe etmez. Fakat, triptanların ve SSRIs (örn: fluoksetin, paroksetin, sertralin) ve SNRIs (örn: venlafaksin, duloksetin) ile kombine kullanımı sırasında Serotonin Sendromu bildirilmiştir (bkz. bölüm 4.4). Diğer 5HTib/id agonistleri ile olduğu gibi, zolmitriptan kullanımı ile bitkisel tedavi St John's Wort bitkisel preparatmm {Hypericum perforatum,sarı kantaron) arasında dinamik etkileşim potansiyeli mevcut olduğundan, istenmeyen etkilerin artışına neden olabilir.4.6. Gebelik ve laktasyon Genel tavsiye:Gebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon):İnsanlara yönelik potansiyel risk bilinmemektedir.Gebelik dönemiMİGTERA, gebe kadınlarda yalnızca, annede elde edilecek faydaların, fetüsün karşı karşıya kalabileceği risklerden açıkça daha fazla olması durumunda kullanılmalıdır. Gebe kadınlarda yapılmış herhangi bir çalışma yoktur fakat hayvan çalışmalarında hiçbir teratojenik etki ile karşılaşılmamıştır (bkz. bölüm 5.3 Klinik öncesi güvenlilik verileri).Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. Laktasyon dönemiZolmitriptanın süt veren hayvanların sütüne geçtiği gösterilmiştir. Zolmitriptanın insanlarda anne sütüne geçişi konusunda herhangi bir veri mevcut olmadığından MİGTERA'nm bebeğini emziren kadınlarda kullanılması sırasında dikkatli olmak gerekir.Üreme yeteneği/FertiliteHayvanlarda yapılan üreme çalışmalarında, fertilite üzerinde bir etki ortaya çıkmamıştır. İnsanlar üzerinde ya da klinik dışı üröyebilirlik çalışmalarından elde edilmiş veri bulunmamaktadır.4.7. Araç ve makine kullanımı üzerindeki etkiler20 mg'a kadar çıkan zolmitriptan dozları, psikomotor test performansını anlamlı şekilde bozmamıştır. MİGTERA kullanımının, hastaların araç ya da makine kullanma yeteneğini bozma olasılığı yoktur. Ancak somnolansa neden olabileceğinden, hastalar motorlu araçlar da dahil makine kullanımı sırasında dikkatli olmaları konusunda uyarılmalıdır.4.8. İstenmeyen etkiler .Zolmitriptan, iyi tolere edilir. Advers olaylar tipik olarak hafıf/orta şiddettedir, geçicidir, ciddi değildir ve ek tedavi gerektirmeksizin kendiliğinden düzelir.Olası yan etkilerin, dozun alınmasını izleyen 4 saat içerisinde görülme eğilimi vardır ve bunlar, tekrarlanan dozlardan sonra sıklaşmaz. İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıkları:Seyrek: Anaflaktik /anaflaktoid reaksiyonlar, aşırı duyarlılık reaksiyonlarıSinir sistemi hastalıkları:Yaygın: Duyu anormallikleri ve bozuklukları, baş dönmesi, baş ağrısı, hiperestezi, parestczi, somnolans, sıcaklık hissi.Kardiyak hastalıklar:Yaygın: Palpitasyon Yaygın olmayan: TaşikardıÇok seyrek: Anjina pektoris, koroner vazo spazm, miyokard enfarktüsü Vasküler hastalıklar: .....Yaygın olmayan: Sistemik kan basıncında geçici artışGastrointestinal hastalıklar;Yaygın: Karın ağrısı, ağız kuruluğu, bulantı, kusmaÇok seyrek: Kanlı ishal, gastrointestinal enfarkt veya nekroz, gastrointestinal iskemik olaylar, iskemik kolit, splenik enfarkt Deri ve deri altı doku hastalıkları:Seyrek: Anjiyoödem, ürtikerKas- iskelet sistemi, bağ doku ve kemik hastalıklarıYaygın: Kas zayıflığı, miyaljiBöbrek ve idrar yolu hastalıklarıYaygın olmayan: Poliüri, idrar sıklığı Çok seyrek: Acil idrar yapma hissiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Asteni, boğaz boyun ekstrem itelerde veya göğüste ağırlık, daralma veya baskı hissi4.9. Doz aşımı ve tedavisi50 mg'lık bir tek oral doz zolmitriptan alan gönüllülerde genellikle sedasyon görülmüştür. Zolmitriptan tabletlerin eliminasyon yarı-ömrü 2.5-3 saat olduğundan (bkz. bölüm 5.2 Farmakokinetik özellikler) aşırı doz alan hastalar, en az 15 saat boyunca veya semptomlar ve belirtiler devam ettiği sürece izlenmelidir.Zolmitriptanm spesifik bir antidotu yoktur. Şiddetli intoksikasyoıı durumunda yoğun bakım önlemlerinin alınması ve bu arada açık bir hava yolu sağlanması ve devam ettirilmesi, yeterli oksijenasyon ve ventilasyon sağlanması, kard i yo vasküler sistemin izlenmesi ve desteklenmesi önerilir. Hemodiyaliz veya peritoneal diyalizin zolmitriptanm serum konsantrasyonları üzerinde etkileri bilinmemektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Selektif serotonin (5HTı) agonistleri ATC kodu: N02CC03Preklinİk çalışmalarda zolmitriptanm, vasküler insan rekombinant 5HTıB ve 5HT1D reseptör alt tiplerinin selektif agonisti olduğu gösterilmiştir. Zolmitriptan, yüksek afmiteli bir 5HT|b/id reseptör agonistidir ve orta dereceli 5HTia reseptör afmitesine sahiptir. Zolmitriptanm 5HT2-, 5HT3-, 5HT4, alfa;-, alfa2- veya betaj-adrenerjik; Hı-, H2-, histaminik; muskarinik, dopaminerjikı veya dopaminerjik2 reseptörlerine belirgin bir afmitesi (radyoligand bağlanma analizleri ile ölçüldüğü gibi) veya farmakolojik aktİvitesi yoktur. 5HTlD reseptörü baskın olarak, trigeminal sinirlerin hem periferik hem de merkezi sinapslarmda presinaptik yerleşmiştir ve klinik öncesi çalışmalar zolmitriptamn her iki bölgeyi de etkileyebildiğini göstermiştir. Bir kontrollü çalışmada 696 ergenlik dönemindeki migren hastasında, zolmitriptan tabletlerin 2.5 mg, 5 mg ve 10 mg dozlarının plaseboya üstünlüğü gösterilememiştir, 5.2. Farnıakokinetik özellikler Genel özelliklerZolmitriptan hızla ve iyi bir şekilde emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oranı yaklaşık %40'tır,Emilim:Zolmitriptan konvensiyonel tabletlerin oral yolla alınmasını takiben, zolmitriptan hızla ve iyi bir şekilde (dozun en az %64'ü) emilir. Asıl bileşiğin ortalama mutlak biyoyararlamm oranı yaklaşık %40'tır. Yine bir 5HT§B/IDagonisti olan ve hayvan modellerinde zolmitriptamn 2-6 katı daha güçlü olduğu gösterilen aktif bir metaboliti de vardır (183C91, N-desmetil metabolit).Dağılım:'Sağlıklı kişilerde, tek doz olarak verildiğinde, zolmitriptan ve aktif metaboliti 183C91, 2.5 ila 50 mg doz aralığında dozla orantılı EAA ve Cmaks gösterir. Cmaks'^ %75'i ile absorpsiyon hızlıdır ve 1 saat içinde ulaşılır, plazma konsantrasyonları 4 İla 6 saat devam eder. Zolmitriptan absorpsiyonu gıda varlığından etkilenmez. Zolmitriptamn çoklu dozlarında bile biriktiği gösterilmemiştir. Bivotransformasyon:Zolmitriptan vücuttan daha çok, karaciğerde biyotransformasyon geçirerek oluşan metabolitlerinin böbrekler yoluyla atılması şeklinde uzaklaştırılır. Zolmitriptamn başlıca 3 metaboliti vardır: İndol asetik asit (plazmadaki ve İdrardaki ana'metabolit), N-oksit ve N-desmetil analogları. Bunlardan N-desmetil metabolit (183C91) aktiftir, diğerleri değildir. Plazmadaki 183C91 konsantrasyonları, asıl ilacın yaklaşık yarısı olduğundan bu metabolitin, zolmitriptamn terapötik etkisine katkıda bulunması beklenir. Tek oral dozun %60'dan fazlası idrarla (esas olarak indol asetik asit metaboliti olarak) atılır ve %30'u değişmemiş ana bileşen olarak feçesle atılır. Karaciğer hastalığının zolmitriptamn farmakokinetiği üzerindeki etkisini değerlendirmek için yapılan çalışmada, sağlıklı gönüllülerle orta veya ileri derecede karaciğer bozukluğu olan hastalar karşılaştırıldığında orta dereceli karaciğer bozukluğu olan hastaların EAA ve CmakS değerleri sırasıyla %94 ve'%50 ve ileri derecede karaciğer bozukluğu olan hastaların ise %226 ve %47 arttığı gösterilmiştir. 183C91 metaboliti için, orta düzeyde karaciğer yetmezliği olan hastalarda EAA ve Cmaks sırasıyla %33 ve %44 azalmış, şiddetli karaciğer yetmezliği olan hastalarda sırasıyla %82 ve %90 azalmıştır. Eliminasyon:Zolmitriptamn plazma yarı ömrü (t 1/2) sağlıklı gönüllülerde 4,7 saat, orta derecede karaciğer bozukluğu olan hastalarda 7.3 saat ve ileri derecede karaciğer bozukluğu olanlarda ise 12 saattir. 183C91 metaboliti için İlgili t I/2 değerleri sırasıyla 5.7 saat, 7.5 saat ve 7.8 saattir. intravenöz kullanımdan' sonraki ortalama total plazma klerensi 10 ml/dak/kg kadardır ve bunun üçte biri renal klerenstir. Rerial klerensin glomerüler fütrasyon hızından fazla olması renal tübüler sekresyonu akla getirmektedir. İntravenöz dozdan sonraki dağılım hacmi, 2.4 litre/kg'dır. Plazma proteinlerine bağlanma oranı düşüktür (yaklaşık %25). Zolmitriptanın ortalama eliminasyon yarı-ömrü 2.5-3 saat kadardır. Metabolitlerinin yarı ömrünün de benzer olması, elİminasyonlarımn oluşum hızı ile sınırlı olduğunu akla getirmektedir. Zolmitriptanın ve metabolitlerinin renal klerensi, orta-ileri derecede böbrek bozukluğu vakalarında sağlıklı gönüllülere göre 7 ila 8 kat azalmıştır, ana bileşenin ve aktif metabolitin EAA değeri hafif artarken (sırasıyla %16 ve %35), yarı ömrü 1 saat artış ile 3 ila 3.5 saattir. Bu parametreler sağlıklı gönüllülerde gözlenen aralık dahilindedir. Hastalardaki karakteristik özelliklerZolmitriptanın ileri yaşta, sağlıklı insanlardaki farmakokinetiği, sağlıklı genç gönüllülerdekine benzer bulunmuştur.Böbrek yetmezliğiBöbrek yetmezliği olan hastalarda doz ayarlanmasına ihtiyaç yoktur. Karaciğer yetmezliğiKaraciğer yetmezliği olan hastalarda metabolizma azalmıştır. Bu sebeple orta veya şiddetli karaciğer yetmezliği olan hastalarda, 24 saatte önerilen maksimum doz 5 mg'dır. Etkileşimler.
Sağlıklı küçük bir gönüllü grubunda, zolmitriptan ergotaminle birlikte kullanıldığında farmakolojik etkileşim görülmemiştir. Zolmitriptanın ergotamin/kafein ile birlikte verilmesi, iyi tolere edilmiş ve yan etkilerde1 ya da kart basıncı değişikliklerinde, zolmitriptanın tek başına kullanılmasına kıyasla herhangi bir artışla sonuçlanmamıştır. |
İlaç BilgileriMigtera 2.5 Mg Film TabletEtken Maddesi: Zolmitriptan Atc Kodu: N02CC03 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.