Combivent ölçülü doz inhalatörlü aerosol Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Antikolinerjik İlaçlar » İpratropium Bromür KISA ÜRÜN BİLGİSİ11. BEŞERİ TIBBİ ÜRÜNÜN ADICOMBIVENT® Ölçülü Doz Inhalatörlü Aerosol, 10 mL - 200 Ölçülü doz2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:Her ölçülü doz;21 mikrogram(8r)-3a-Hidroksi-8-izopropil-1a,5a-tropanyum bromür (±)-tropat monohidrat = İpratropium bromür monohidrat (INN) (20 mikrogram ipratropium bromür anhidr'e eşdeğer ) ve 120 mikrogram di[(RS)-2-ters-bütilamino-1-(4-hidroksi-3-hidroksimetil-fenil)etanol] sülfat = Salbutamol sülfat (INN) (100 mikrogram salbutamol baz'a eşdeğer ) içerir. Yardımcı maddeler:Yardımcı maddelerin tam bir listesi için, bölüm 6.1'e bakınız.3. FARMASÖTİK FORMÖlçülü doz inhalatörlü aerosol4. KLİNİK ÖZELLİKLER 4.1 Terapötik endikasyonlarCombivent® Ölçülü Doz İnhalatörlü Aerosol, birden fazla bronkodilatöre gerek duyulan hastalarda, obstrüktif havayolu hastalıklarına eşlik eden geri dönüşümlü bronkospazmın tedavisinde endikedir.4.2 Pozoloji ve uygulama şekli Pozoloji ve uygulama sıklığı:Erişkinler (yaşlı hastalardahil) ve 12 yaşındanGünde dört kez iki inhalasyon. büyük çocuklar:Bu doz ihtiyaca göre, 24 saat içerisinde en çok 12 inhalasyon sınırına kadar arttırılabilir. Günde 12 inhalasyon geçilmemelidir. Uygulama şekli:Kullanım talimatları için bölüm 6.6'ya bakınız.Özel popülasyonlara ilişkin ek bilgilerPediyatrik popüla^syon:12 yaşından küçük çocuklarda Combivent® Ölçülü Doz İnhalatörlü Aerosol kullanımına ilişkin deneyim bulunmamaktadır.4.3 KontrendikasyonlarCombivent® Ölçülü Doz İnhalatörlü Aerosol, hipertrofik obstrüktif kardiyomiyopati ya da taşiaritmisi olan hastalarda kontrendikedir.Combivent® Ölçülü Doz İnhalatörlü Aerosol aynı zamanda, soyada bulunan lesitine ya da bununla ilişkili soya fasülyesi ve yer fıstığı gibi besinlere karşı aşırı duyarlık öyküsü bulunan hastalarda da kontrendikedir. Bu türlü hastalarda, soya lesitini içermeyen Combivent Tek Dozluk Flakon kullanılabilir. Combivent® Ölçülü Doz İnhalatörlü Aerosol aynı zamanda, atropin ya da türevlerine karşı, veya ilacın herhangi başka bir bileşenine karşı aşırı duyarlı olduğu bilinen hastalar tarafından da kullanılmamalıdır. 4.4 Özel kullanım uyarıları ve önlemleriSadece inhalasyon içindir.Combivent® Ölçülü Doz İnhalatörlü Aerosol uygulamasından sonra ani aşırıduyarlık reaksiyonları oluşabilir; bu şekilde nadiren ürtiker, anjiyoödem, döküntüler, bronkospazm ve orofarenjeal ödem vakaları görülmüştür. Bu gibi durumlarda uygun anti-alerjik ajanlar kullanılmalı ve gerekirse genel destekleyici tedavi uygulanmalıdır.2Oküler komplikasyonlarAerosol şeklindeki ipratropium bromür tek başına veya bir adrenerjik beta2-agonist ile kombine halde göze kaçtığında, oküler komplikasyonlar (midriyazis, göz içi basıncında artış, dar-açılı glokom, göz ağrısı) geliştiği bildirilen izole vakalar vardır. Konjonktivada konjesyon ve korneada ödem sonucu gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde gelişirse, miyotik damlalar ile tedaviye başlanmalı ve hemen bir uzman hekimin görüşü alınmalıdır. Hastalara Combivent® Ölçülü Doz İnhalatörlü Aerosol'ün doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Gözlerin Combivent içindeki aerosol ile temas etmemesiiçin dikkatli olunmalıdır. Glokoma karşı predispozisyon gösterebilecek hastalar, gözlerini korumaları konusunda özel olarak uyarılmalıdır.Combivent® Ölçülü Doz İnhalatörlü Aerosol aşağıdaki durumlarda, özellikle önerilenden daha yüksek dozların uygulanması söz konusu olduğunda, yalnızca dikkatli bir risk/yarar değerlendirilmesi yapıldıktan sonra kullanılmalıdır: Yeterince kontrol altında olmayan diabetes mellitus, yakınlarda geçirilmiş miyokard enfarktüsü, şiddetli organik kalp veya damar hastalıkları, hipertiroidizm, feokromositoma, dar açılı glokom riski, prostat hipertrofisi ya da mesane boynu obstrüksiyonu. Beta2-agonist tedavisi, potansiyel olarak ağır bir hipokalemi ile sonuçlanabilir. Ayrıca hipoksi, hipokaleminin kalp ritmi üzerindeki etkilerini şiddetlendirebilir. Kistik fibrozlu hastalar, gastrointestinal motilite bozukluklarına daha yatkın olabilirler. Akut, hızla kötüleşen dispne (solunum zorluğu) durumunda hemen bir doktora danışılması gereklidir. Semptomların kontrol altına alınabilmesi için önerilenden daha yüksek Combivent® Ölçülü Doz İnhalatörlü Aerosol dozlarına ihtiyaç duyuluyorsa, hastanın tedavi planı bir doktor tarafından yeniden gözden geçirilmelidir. 4.5 Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriKsantin türevlerinin, diğer beta-adrenerjiklerin ve antikolinerjiklerin birlikte uygulanması yan etkileri arttırabilir.Beta-agonistlerin indüklediği hipokalemi, ksantin türevleri, glukokortikosteroidler ve diüretikler ile yapılan eş-zamanlı tedavi ile artabilir. Bu durum özellikle şiddetli havayolu obstrüksiyonu olan hastalarda dikkate alınmalıdır. Hipokalemi, digoksin verilen hastalarda aritmilere karşı duyarlılığı arttırabilir. Bu gibi durumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilmektedir. Beta-blokerler ile birlikte eş-zamanlı uygulama esnasında, bronkodilatör etkide potansiyel olarak ciddi bir azalma ortaya çıkabilir. Monoamin oksidaz inhibitörleri veya trisiklik antidepresanlar ile tedavi edilmekte olan hastalarda beta-adrenerjik agonistler dikkatle uygulanmalıdır, çünkü beta-adrenerjik agonistlerin aktiviteleri artabilir. Halotan, trikloroetilen ve enfluran gibi halojenli hidrokarbon anestetiklerinin inhalasyonu, beta-agonistlerin kardiyovasküler etkilerine karşı duyarlılığı arttırabilir. 4.6Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: C (ipratropium bromür: B; salbutamol sülfat: C).3Gebelik dönemi:Combivent® Ölçülü Doz İnhalatörlü Aerosol'ün insanlarda gebelik sırasındaki güvenliği belirlenmemiştir. Gebelik sırasında ve özellikle ilk üç ay içerisinde, gebelikte ilaç kullanımıyla ilgili olağan önlemlere uyulmalıdır.Combivent® Ölçülü Doz İnhalatörlü Aerosol'ün uterus kontraksiyonları üzerindeki inhibitör etkisi dikkate alınmalıdır. Laktasyon dönemi:Salbutamol sülfat ve ipratropium bromür muhtemelen süte geçerler ve bunların yeni doğan üzerindeki etkileri bilinmemektedir. Yağda erimeyen kuaterner bazlar anne sütüne geçmekle birlikte ipratropium bromürün, özellikle de inhalasyon yoluyla alındığında, bebekte önemli düzeylere ulaşabilme olasılığı çok uzaktır. Ancak birçok ilaç anne sütüne geçtiğinden, bebeğini emziren bir anneye Combivent® Ölçülü Doz İnhalatörlü Aerosol verilirken dikkatli olunması gerekir.4.7Araç ve makine kullanımı üzerindeki etkilerBilinen herhangi bir etkisi yoktur.4.8İstenmeyen etkilerDiğer beta-agonist içeren ürünlerde olduğu gibi, Combivent® Ölçülü Doz İnhalatörlü Aerosol ile daha sık olarak görülen istenmeyen etkiler, özellikle duyarlı hastalarda baş ağrısı, baş dönmesi, sinirlilik, taşikardi, iskelet kaslarında ince tremor ve palpitasyondur.Beta2-agonist tedavisi, potansiyel olarak ağır bir hipokalemi ile sonuçlanabilir. İnhalasyon yoluyla kullanılan diğer ilaçlarda olduğu gibi öksürük, lokal irritasyon ve daha seyrek olarak da, inhalasyonun indüklediği bronkospazm ortaya çıkabilir. Diğer beta-mimetiklerle olduğu gibi, bulantı, kusma, terleme, halsizlik ve miyalji/kas krampları oluşabilir. Ender olgularda, özellikle yüksek dozlardan sonra, diyastolik kan basıncında düşme, sistolik kan basıncında yükselme ve aritmiler ortaya çıkabilir. Beta-mimetiklerle inhalasyon tedavisi altında, bireysel olgular şeklinde psikolojik bozulmalar bildirilmiştir. Antikolinerjiklere bağlı en sık karşılaşılan solunum dışı advers olaylar ağız kuruluğu ve seste bozulmalar (disfoni) olmuştur. Aerosol şeklindeki ipratropium bromür tek başına veya bir adrenerjik beta2-agonist ile kombine halde göze kaçtığında, oküler komplikasyonlar (midriyazis, göz içi basıncında artış, dar-açılı glokom, göz ağrısı) geliştiği bildirilen izole vakalar vardır. Oküler yan etkiler, gastrointestinal motilite bozuklukları ve idrar retansiyonu ender olarak ortaya çıkabilir ve geri dönüşümlüdür (Özel kullanım uyarıları ve önlemleri bölümüne bakınız). Deri döküntüleri, dil, dudaklar ve yüzde anjiyoödem, ürtiker (dev ürtiker dahil), laringospazm gibi allerjik tipte reaksiyonlar ve anaflaktik reaksiyonlar bildirilmiştir ve bazı vakalarda ilaca yeniden başlanmasıyla reaksiyonlar tekrarlamıştır. Bu hastaların çoğunda, soya fasulyesi de dahil, diğer ilaç ve/veya besinlere karşı allerji öyküsü bulunmaktaydı (Kontrendikasyonlar bölümüne bakınız). 4.9 Doz aşımı ve tedavisiSemptomlarDoz aşımının oluşturduğu etkilerin öncelikle salbutamol ile bağıntılı olması beklenmektedir. Doz aşımında beklenen semptomlar, aşırı beta-adrenerjik uyarının yol açtığı semptomlardır; en belirgin olanları taşikardi, palpitasyon, tremor, hipertansiyon, hipotansiyon, nabız basıncının genişlemesi, anjinal ağrı, aritmiler ve yüz-boyun bölgesinde kızarıklıktır. İpratropium bromür doz aşımının beklenen semptomları (ağız kuruluğu, görsel akomodasyon bozuklukları gibi), sahip olduğu geniş terapötik aralık ve topikal uygulama nedeniyle hafif ve geçici niteliktedirler. TedaviSedatifler ve trankilizanlar verilir; ağır vakalarda yoğun bakım uygulanır. Beta-reseptor blokerleri, tercihen beta1-selektif olanları, spesifik antidotlar olarak uygundurlar; ancak, bronşiyal obstrüksiyonda muhtemel bir artış dikkate alınmalıdır ve doz, bronşiyal astımı olan hastalarda dikkatle uyarlanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER 5.1 Farmakodinamik özelliklerATC kodu: R03AKİpratropium bromür, antikolinerjik (parasempatolitik) özellikleri olan bir kuaterner amonyum bileşiğidir. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen transmitter ajan olan asetilkolinin etkilerini antagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe eden bir bileşik olarak görünmüştür. Antikolinerjikler, asetilkolinin bronş düz kaslarındaki muskarinik reseptörlerle etkileşimi sonucu meydana gelen hücre içi siklik guanozin monofosfat (siklik-GMP) artışlarını önlerler. İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, esas olarak lokal ve akciğere özgüdür ve sistemik yapıda değildir. Salbutamol sülfat, hava yollarındaki düz kaslara etki ederek, gevşemelerine yol açan bir beta2-adrenerjik ajandır. Salbutamol, trakeadan terminal bronşiyollere kadar olan bütün düz kasları gevşetir ve bronkokonstriksiyona yol açan tüm etkilere karşı korunma sağlar. Combivent® Ölçülü Doz İnhalatörlü Aerosol, ipratropium bromür ile salbutamol sülfatın eşzamanlı olarak salıverilmesi sonucu akciğerdeki muskarinik ve beta2-adrenerjik reseptörlerin her ikisi üzerinde de aditif bir etki oluşturur, ve sonuç olarak her bir ajan ile elde edilenden daha üstün bir bronkodilatasyon elde edilmesini sağlar. Geri dönüşümlü bronkospazmı olan hastalar üzerinde yapılan kontrollü çalışmalarda Combivent® Ölçülü Doz İnhalatörlü Aerosol'ün, her iki bileşeninden daha büyük bir bronkodilatör etkiye sahip olduğu ve advers etkilerde herhangi bir artışın bulunmadığı ortaya konulmuştur. 5.2 Farmakokinetik özelliklerİpratropium bromür:Emilim:Dağılım ve Biyotransformasyon:İnhalasyondan sonraki sistemik biyoyararlanımın, alınan dozun %10'undan düşük olduğu hesaplanmıştır. İpratropium bromür, kan-beyin bariyerini geçmez. Terminal eliminasyon fazındaki yarılanma ömrü, intravenöz uygulamadan sonra belirlendiği üzere, 1.6 saat civarındadır.Eliminasyon:İntravenöz uygulamadan sonra ipratropium bromürün böbrekler ile atılımının, alınan dozun %46'sı kadar olduğu belirtilmektedir. İlaç ve metabolitlerinin eliminasyon yarılanma ömrü, radyoaktif işaretleme ile belirlendiği şekliyle 3.6 saattir.Salbutamol sülfat:Emilim:Salbutamol sülfat, oral uygulama sonrasında gerek inhalasyonla gerekse mide yoluyla hızla ve tamamen emilir.Dağılım ve Biyotransformasyon:Plazma doruk salbutamol konsantrasyonları uygulamayı izleyen üç saat içerisinde elde edilir. Salbutamol kan-beyin bariyerini geçer ve burada plazma konsantrasyonunun %5'i civarında bir konsantrasyona ulaşır.Eliminasyon:İlaç, 24 saat sonra, hiç değişmemiş olarak idrarla vücuttan atılır. Eliminasyon yarı ömrü 4 saattir.İpratropium bromür ve salbutamol sülfatın birlikte nebülize edilmelerinin, her iki bileşen için de sistemik emilimi potansiyalize etmediği ve bu nedenle Combivent® Ölçülü Doz İnhalatörlü Aerosol'deki aditif aktivitenin, inhalasyon sonrasında akciğer üzerindeki kombine lokal etkiye bağlı olduğu gösterilmiştir. 5.3 Klinik öncesi güvenlilik verileriCombivent'in tek inhalasyon şeklinde uygulama sonrasındaki akut toksisitesi, sıçanlarda ve köpeklerde incelenmiştir. Teknik olarak incelenmesi mümkün en yüksek dozlara kadar (sıçan: 887/5397 mikrogram/kg vücut ağırlığı [ipratropium bromür/salbutamol], köpek: 165/862 mikrogram/kg vücut ağırlığı [ipratropium bromür/salbutamol]) sistemik toksik etki belirtisi bulunmamaktaydı ve bileşik lokal olarak iyi tolere edildi. Tekil maddeler için intravenöz uygulama sonrasında yaklaşık LD50 değerlerinin, ipratropium bromürün test edildiği türlere bağlı olarak (fare, sıçan, köpek), ipratropium bromür için 12 ile 20 mg/kg ve salbutamol için 60 ile 70 mg/kg vücut ağırlığı arasında olduğu hesaplanmıştır.İpratropium bromür ve salbutamol kombinasyonu ile, sırasıyla sıçanlar ve köpeklerde, 13 haftalık iki inhalasyon toksisitesi çalışması yürütülmüştür. Bu çalışmalarda, kalbin hedef organ olduğu ortaya çıkmıştır. 31.3/183.4 ile 375.5/2188.4 mikrogram/kg vücut ağırlığı/gün ipratropium bromür/salbutamol dozlarında, sıçanların kalp ağırlıklarında doza bağlı olmayan bir artış gözlendi, ancak bu saptanabilir herhangi bir histopatolojik değişiklik ile birlikte değildi. Köpeklerde 32.3/197.6 ile 129.2/790.4 mikrogram/kg vücut ağırlığı/gün ipratropium bromür/salbutamol dozları, kalp hızlarını hafifçe arttırdı ve, daha yüksek dozlarda, sol ventrikül papiller kaslarında, bazen mineralizasyonun eşlik ettiği, histopatolojik olarak saptanabilir sikatrisler ve/veya fibrozis gözlendi. Yukarıda sözü edilen çalışmalarda elde edilen bulgular, salbutamol gibi beta-adrenerjiklerin iyi bilinen etkileri olarak görülmelidir. Aynı zamanda ikinci bileşenin (ipratropium bromür) toksikolojik profili de yıllardır iyi bilinmektedir ve kafada bulunan mukozal membranlarda kuruluk, midriyazis, yalnızca köpeklerde keratokonjonktivitis sikka (kuru göz), tonüs azalması ve gastrointestinal kanalda motilitenin inhibisyonu (sıçan) gibi tipik antikolinerjik etkilerdir. Combivent'in iki tekil bileşeni için de üreme toksisitesi çalışmaları mevcuttur. Salbutamol farelerde yüksek dozlarda yarık damaklara neden olmuştur. Bu olay iyi bilinmektedir ve diğer beta-adrenerjik bileşiklerin uygulanmasından sonra da ortaya çıkmaktadır. Günümüzde bu etkinin annedeki kortikosteron düzeyindeki bir artış sebebiyle ortaya çıktığı varsayılmaktadır ve başka türler için önem taşımayan bir genel stresin sonucu olduğu kabul edilebilir. Ek olarak, salbutamolün teratojenik özelliklere sahip olabileceği yönündeki kuşkuların oluşmasına yol açan preklinik bulgular, kadınlardaki kullanımını ilgilendiren kısıtlamalarda dikkate alınmış bulunmaktadır. Bu bulguların dışında, salbutamol ve ipratropium bromür ile yapılan çalışmalar, embriyo, fetüs ve yavrularda varsa bile, yalnızca marjinal etkiler ortaya çıkarmıştır, ve bu etkiler yalnızca maternal toksisite aralığı içinde oluşmuştur. Her iki tekil madde de çok sayıda in-vivo ve in-vitro testlerde incelenmiştir. Ne salbutamol ne de ipratropium bromür, herhangi bir mutajenik özellik belirtisi göstermemiştir. Salbutamol ve ipratropium bromür ayrı ayrı, çeşitli in vivo karsinojenisite çalışmalarında neoplastik özellikleri yönleriyle incelenmişlerdir. Farelerde, ama sıçanlarda ve köpeklerde değil, oral salbutamol uygulamasından sonra, insanlarda kullanılan inhalasyon dozlarının 100 katından daha yüksek dozlarda, mezovaryum leiomyoması insidansında artış gözlenmiştir. Leiomyoma gelişiminin eş-zamanlı beta-bloker uygulamasıyla engellenebilir özellikte olduğu bulunmuştur. Bu bulguların türe özgü olduğu ve klinik önem taşımadıkları, ve sonuç olarak salbutamolün klinik kullanımında herhangi bir kısıtlamaya yol açmayacakları yönünde değerlendirme yapılmıştır. İpratropyum bromür farelerde ve sıçanlarda oral yoldan incelendiğinde, karsinojenik potansiyel açığa çıkmamıştır. Combivent ya da tekil aktif bileşenlerinin sebep olduğu herhangi bir immünotoksikolojik etkiye ilişkin hiçbir veri bulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSoya Lesitini Propelan 11 Propelan 12 Propelan 1146.2 GeçimsizliklerCombivent® Ölçülü Doz İnhalatörlü Aerosolün bilinen bir geçimsizliği yoktur.6.3 Raf ömrüCombivent ® Ölçülü Doz İnhalatörlü Aerosolün raf ömrü 36 aydır.6.4 Saklamaya yönelik özel uyarılar15 °C - 30 °C arasında oda sıcaklığında saklayınız. Aerosol tüpü yüksek ısıda bırakılmamalı ve delinmemelidir. Direkt güneş ışığından ve donmaktan koruyunuz.ÇOCUKLARIN GÖREMEYECEĞİ, ERİŞEMEYECEĞİ YERLERDE VE AMBALAJINDA SAKLANMALIDIR. 6.5 Ambalajın niteliği ve içeriğiCombivent Ölçülü Doz İnhalatörlü Aerosol, 200 ölçülü doz içeren 17 mL' lik aluminyum tüplere doldurulmuş 10 mL süspansiyon içerir.Combivent Ölçülü Doz İnhalatörlü Aerosol'ün ana kabı 4 ana parçadan oluşmaktadır: 1.Aluminyum Tüp 2.Valf 3.Ağızlık 4.O-halkası 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanım Talimatı |
İlaç BilgileriCombivent ölçülü doz inhalatörlü aerosolEtken Maddesi: İpratropium bromür salbutamol Atc Kodu: R03BB01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
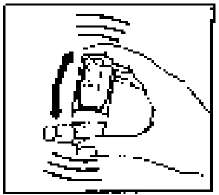 (Şekil 1)
(Şekil 1) (Şekil 2)
(Şekil 2)