Kaletra 200 mg/50 mg Film Tablet Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Sistemik Antiviral İlaçlar » Virüslere Karşı Direkt Etkili İlaçlar » Proteaz inhibitörleri » Lopinavir KISA URUNBILGISI1.BEŞERI TıBBı ÜRÜNÜNADIKALETRA® (200 mg/50 mg) film tablet2.KALITATIF VE KANTİTATIF BİLEŞİMHer bir film tablet, farmakokinetik güçlendirici olarak 50 mg ritonavir ile birlikte formüle edilmiş olan 200 mg lopinavir içerir.Yardımcı maddeler için Bölüm 6.1'e bakınız. 3.FARMASÖTIK FORMUFilm TabletSarı renklidir. 'Abbott' logosu ve "KA" harfleri basılıdır. 4.KLINIK ÖZELLIKLERI4.1Terapötik endikasy onlarKALETRA®, diğer antiretroviral ajanlarla kombine olarak erişkinlerde ve 2 yaşın üzerindeki çocuklarda HIV-1 enfeksiyonu tedavisi için endikedir.KALETRA® ile en çok ürünün antiretroviral tedavinin başındaki hastalarda kullanımından tecrübe elde edilmiştir. Daha önce ağır proteaz inhibitör tedavisi görmüş hastalardaki veriler sınırlıdır. KALETRA® tedavisinde başarısız olunmuş hastalardaki kurtarma tedavisi verileri sınırlıdır. HIV-1 enfeksiyonlu proteaz inhibitör tedavisi geçirmiş hastalarda KALETRA® seçimi, bireysel viral direnç testine ve hastanın tedavi geçmişine göre belirlenmelidir. (bakınız bölüm 44. ve 5.1) 4.2Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:KALETRA®, HIV enfeksiyonu tedavisinde deneyimli doktorlar tarafından reçete edilmelidir.Yetişkinler ve ergenler:Kaletra Tabletler, bütün olarak yutulmalı ve çiğnenmemeli, kırılmamalı ya da ezilmemelidir. Yutma güçlüğü olan hastalar için oral solüsyon mevcuttur.Önerilen oral doz aşağıdaki gibidir: Daha evvel tedavi görmemiş hastalarda: Kaletra Tabletler 400/100 mg (2 Tablet) günde iki kez yemeklerle ya da tek başına Kaletra Tabletler 800/200 mg (4 Tablet) günde bir kez yemeklerle ya da tek başına Daha evvel tedavi görmüş hastalarda: Kaletra Tabletler 400/100 mg (2 Tablet) günde iki kez yemeklerle ya da tek başına Günde bir kez Kaletra uygulaması daha evvel tedavi görmüş hastalarda çalışılmamıştır. Özel Popülasyonlara ilişkin Ek Bilgiler Karaciğer yetmezliğiHafif veya orta dereceli karaciğer yetmezliği olan HIV enfeksiyonlu hastalarda lopinavir maruziyetinde ortalama %30'luk bir artış gözlemlenmiştir ama bunun klinik bir anlamı olması beklenmemektedir (bakınız Bölüm 5.2). Şiddetli karaciğer yetmezliği olan hastalara ilişkin veriler mevcut değildir. KALETRA® bu hastalara verilmemelidir (bakınız Bölüm 4.3. Kontrendikasyonlar).Böbrek yetmezliğiBöbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir. KALETRA® şiddetli böbrek yetmezliği olan hastalarda kullanıldığında dikkatli olunması gerekir (bakınız bölüm 4.4).Pediyatrik popülasyon (2 yaş ve üstü)Pediyatrik hastalarda günde bir kez alınan lopinavir/ritonavir değerlendirilmemiştir. KALETRA® efavirenz, nevirapin veya amprenavir ile eş zamanlı alınmayan yetişkin dozu (günde iki defa 400/100 mg), 35 kg veya üstündeki çocuklarda veya Vücut Yüzey Alanı (BSA)* 1.4 m2 veya daha büyük olan çocuklarda kullanılabilir. Vücut ağırlığı 35 kg veya BSA 0.5 ila 1.4 m2 arasında olan ve tablet yutabilen çocuklar için lütfen aşağıdaki doz tablosuna bakınız. KALETRA® Oral Solüsyon BSA 0.5 m2 den küçük veya güvenle tablet yutamayan çocuklar için uygundur.*Vücut yüzey alanı aşağıdaki denklemden hesaplanabilir: BSA (m2) = V [Boy (cm) x Ağırlık (kg)] / 3600 Aşağıdaki tablo KALETRA® 100/25 mg tabletlerin BSA'ya dayanan doz talimatlarını içermektedir:
Eş zamanlı tedavi:Efavirenz, nevirapin veya amprenavirAşağıdaki tablo çocuklarda efavirenz, nevirapin veya amprenavir ile eş zamanlı alınan ve BSA'ya dayanan 100/25 mg tabletlerin doz talimatını içermektedir:
2 yaşın altındaki çocuklardaGüvenlik ve etkinlik verilerinin yetersiz olması nedeniyle 2 yaşın altındaki çocuklarda KALETRA® kullanımı tavsiye edilmemektedir.Geriatrik popülasyonGenel olarak, sıklıkla düşük karaciğer, böbrek veya kalp fonksiyonları gösteren ve beraberinde hastalığı olan veya diğer ilaç tedavileri gören yaşlı hastaların ilaç alımında ve lopinavir/ritonavirin izlenmesinde gerekli tedbirler alınmalıdır.4.3KontrendikasyonlarLiponavir/ritonavir liponavir, ritonavir veya yardımcı maddelerden birine aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.KALETRA® her ikisi de CYP3A izoformu olan P450 'nin inhibitörleri olan lopinavir ve ritonavir içerir. KALETRA® CYP3A'ya yüksek oranda bağımlı ilaçlarla klerens açısından ve kullanıldığında ciddi ve/veya yaşamı tehdit edebilen yüksek plazma konsantrasyonları yaratan ilaçlarla birlikte verilmemelidir. Bu ilaçlar astemizol, terfenadin, oral midozolam ( parenteral alınan midozolam uyarısı için bölüm 4.5'e bakınız), triazolam, sisaprid, pimozid, amiodaron, ergot alkaloidleri ( ergotamin, dihidroergotamin, ergonovin ve metilergonovin gibi) ve vardenafil. St. John's Wort (Hypericum perforatum)içeren bitkisel preparatlar, plazma konsantrasyonlarında düşme riskine ve lopinavir ile ritonavirin klinik etkisinin azalmasına sebebiyet vermesine bağlı olarak lopinavir ve ritonavir alınırken kullanılmamalıdır. (bakınız bölüm 4.5).4.4Özel kullanım uyarıları ve önlemleriDikkat!KALETRA® Film Tablet, daha önceden kullandığınız KALETRA® Yumuşak Kapsül ile karıştırılmamalıdır. KALETRA® Film Tablet kullanmaya başladıktan sonra aynı ilacı kullanmaya devam ediniz. KALETRA® Film Tablet bir seferde 2 tablet birlikte olmak üzere, 12 saatte bir 2 tablet şeklinde kullanılır. Başladığınız ürünle tedaviye devam ediniz. Detaylı bilgi için doktorunuza veya eczacınıza danışınız. UYARILAR AntimikobakteriyelStandart dozdaki lopinavir/ritonavir, rifampisin ile birlikte uygulanmamalıdır çünkü lopinavir konsantrasyonlarındaki büyük düşüşler, terapötik etkide anlamlı ölçüde azalmaya neden olabilmektedir.KortikosteroidlerLopinavir/ritonavir ve flutikazon propionatın birlikte uygulanması sonucunda flutikazon propionatın plazma düzeyleri anlamlı ölçüde artar ve serum kortizol konsantrasyonları azalır. Ritonavir, inhalasyon yoluyla veya intranazal olarak uygulanan flutikazon propionatla birlikte uygulandığında Cushing sendromu ve adrenal süpresyon dahil sistemik kortikosteroid etkiler bildirilmiştir. Budesonid gibi flutikazona benzer biçimde metabolize edilen diğer inhale kortikosteroidlerle lopinavir/ritonavirin birlikte uygulanması ile rastlanılan benzer bulgular göz ardı edilemez. Bu inhale ya da intranazal olarak uygulanan kortikosteroidler, lopinavir/ritonavir ile birlikte uygulandığında özel dikkat gösterilmelidir.Erektil fonksiyon bozukluğu ilaçlarıLopinavir/ritonavir alan hastalara sildenafil, tadalafil ya da vardenafil reçetelenirken özellikle dikkatli olunmalıdır. Lopinavir/ritonavir ile bu ilaçların birlikte uygulanmasının bu ilaçların konsantrasyonlarını önemli ölçüde artırması beklenir ve hipotansiyon, ve ereksiyonda uzama dahil sildenafil ile bağlantılı advers olaylarda bir artışla sonuçlanabilir (bakınız bölüm 4.5).Bitkisel ilaç etkileşimleriSt. John's Wort(Hypericum perforatum)içeren bitkisel ürünler, proteaz inhibitörlerinin plazma konsantrasyonlarını azaltabileceğinden lopinavir/ritonavir alan hastalar tarafından kullanılmamalıdır. Bu durum lopinavire ya da proteaz inhibitörlerinin terapötik sınıfına direnç gelişimi ve terapötik etkinin kaybı ile sonuçlanabilir (bakınız Bölüm 4.5).HMG-CoA redüktaz inhibitörleriLopinavir/ritonavir ile simvastatin veya lovastatinin bir arada kullanılması önerilmemektedir. Rabdomiyoliz dahil miyopati gibi ciddi reaksiyonlar için potansiyeli artırabileceğinden lopinavir/ritonavir dahil HIV proteaz inhibitörleri, CYP3A4 yolu (örn. atorvastatin) vasıtasıyla metabolize edilen rosuvastatin ya da diğer HMG-CoA redüktaz enzimleri ile eşzamanlı kullanılırsa dikkat edilmelidir (bakınız bölüm 4.5).Tipranavir:Çoklu tedavi görmüş olan HIV - pozitif hastalarda ikili proteaz inhibitör kombinasyon tedavisi uygulanan bir klinik çalışmada, günde iki kere 500 mg tipranavir ile ritonavir (günde iki kez 200 mg) ve günde iki kere lopinavir/ritonavir (400/100 mg)'ın birlikte uygulanması, lopinavir EAA (Eğri Altında kalan Alan) ve Cmin değerlerinde sırasıyla %47 ve %70 azalmayla sonuçlanmıştır. KALETRA® ve düşük doz ritonavirle birlikte tipranavir uygulanması bu nedenle önerilmez.HiperglisemiPazarlama sonrası gözetimlerde proteaz inhibitörleri alan HIV enfeksiyonlu hastalarda yeni başlayan diabetes mellitus, hiperglisemide veya mevcut diabetes mellitusta alevlenme bildirilmiştir. Bu olayların tedavisinde bazı hastalarda ya insüline başlanması ya da dozunun ayarlanması ya da oral hipoglisemik ajanlar gerekmiştir. Bu olguların bazılarında diyabetik ketoasidoz gelişmiştir. Proteaz inhibitörü tedavisini bırakan bu hastalardan bazı vakalarda hiperglisemi kalıcılık göstermiştir. Bu vakalar klinik pratik esnasında gönüllü olarak bildirildiğinden sıklık tahminleri yapılamaz ve proteaz inhibitörü tedavisi ile bu vakalar arasındaki raslantısal ilişki kanıtlanamamıştır.PankreatitKALETRA® alan hastalarda belirgin trigliserid yükselmeleri gelişenler dahil pankreatit olguları bildirilmiştir. Bazı vakalarda ölüm gözlemlenmiştir. Lopinavir/ritonavir ile raslantısal bir ilişkisi kanıtlanmamış olmasına rağmen belirgin trigliserid yükselmesi pankreatit gelişim için bir risk faktörüdür (bkz. 4.4. Lipid yükselmeleri). Lopinavir/ritonavir tedavisi esnasında ileri HIV hastalığı olan hastalarda trigliserid yükselmesi ve pankreatit ve hikayesinde pankreatit olan hastalarda pankreatitin yeniden nüks etmesi riski olabilir .KALETRA® HIV enfeksiyonu veya AIDS için çare değildir. HIV enfeksiyonunun cinsel yolla veya kan temasıyla başkalarına bulaşma riskini azaltmaz. Gerekli önlemler alınmalıdır. KALETRA® kullanan kişiler hala enfeksiyon geliştirebilir veya HIV hastalığı ve AIDS ile ilgili diğer rahatsızlıkları geçirebilirler. ÖNLEMLERKaraciğer yetmezliği:KALETRA®, başlıca olarak karaciğerde metabolize olur. Bu nedenle karaciğer fonksiyon bozukluğu bulunan hastalara uygulandığında dikkat edilmelidir. KALETRA®, şiddetli karaciğer yetmezliğinde çalışılmamıştır. Farmakokinetik veriler orta karaciğer yetmezliği bulunan HIV ve HCV'nin ikisi ile de enfekte olmuş hastalarda lopinavir plazma konsantrasyonlarının yaklaşık %30 artış bunun yanısıra plazma proteinlerine bağlanmada düşüşler olduğunu ileri sürer (bkz. Bölüm 5.2). Altta yatan bir hepatit B ya da C hastalığı ya da tedaviden önce transaminazlarında belirgin ölçüde artışlar görülen hastalar, daha ileri safhada transaminaz yükselmeleri gelişimi bakımından artmış bir risk taşıyabilirler. Bazı ölümler dahil karaciğer fonksiyon bozukluğuna dair pazarlama sonrası bildirimler bulunmaktadır. Bu durum genellikle altta yatan kronik hepatit ya da sirozun tedavisi için çoklu tedavi almakta olan ileri düzeyde HIV hastalığına sahip hastalarda meydana gelmiştir. KALETRA® ile bu vakalar arasındaki raslantısal bir ilişki kanıtlanamamıştır. Bu hastalarda özellikle KALETRA® tedavisinin ilk birkaç ayı boyunca artmış AST/ALT'nin izlenmesi düşünülmelidir.Direnç/Çapraz direnç:Proteaz inhibitörleri arasında çeşitli ölçülerde çapraz direnç gözlemlenmiştir. Proteaz inhibitörlerinin ardışık uygulanmasının etkililiğinde KALETRA® tedavisinin etkisi araştırma altındadır (bkz. Mikrobiyoloji)Hemofili:Proteaz inhibitörleri ile tedavi edilen tip A ve B hemofili hastalarında spontan deri hematomları ve hemartroz dahil kanamalarda artış olduğu bildirilmiştir. Bazı hastalara ilave faktör VIII verilmiştir. Bildirilen olguların yarısından fazlasında proteaz inhibitörleriyle tedaviye devam edilmiş veya tedavi kesilmişse yeniden başlanmıştır. Proteaz inhibörleri ve bu vakalar arasında ne raslantısal bir ilişki ne de bir etki mekanizması kanıtlanmıştır.Yağ redistribüsyonu ve metabolik bozukluklarAntiretroviral tedavi alan hastalarda genel obezite, dorsoservikal bölgede yağ toplanması (buffalo hump), yüzde incelme (facial wasting), göğüs büyümesi ve cushingoid görünüm gözlemlenmiştir. Bu vakaların mekanizması ve uzun dönemdeki neticeleri şu an bilinmemektedir. Bir sebep sonuç ilişkisi kanıtlanmamıştır.Lipid yükselmeleriKALETRA® tedavisi, total kolesterol ve trigliserid konsantrasyonunda artışlarla sonuçlanır. KALETRA® tedavisine başlamadan önce ve tedavi boyunca düzenli aralıklarla kolesterol ve trigliserid testleri yapılmalıdır. Yağ düzensizlikleri klinik açıdan uygun olacak şekilde tedavi edilmelidir.Immün Reaktivasyon SendromuLopinovir/ritonavir dahil olmak üzere kombinasyon antiretroviral tedavi ile tedavi olan HIV infeksiyonlu hastalarda immün rekonstitüsyon sendromu bildirilmiştir. Kombinasyon antiretroviral tedavinin başlangıç aşamasında bağışıklık sistemi yanıt verdiğinde hastalarda, ileri düzeyde değerlendirmeyi ve tedaviyi gerektiren, asemptomatik veya rezidüel fırsatçı enfeksiyonlara (mycobacterium avium enfeksiyonu, sitomegalovirüs, pnömokistik carini pnömonisi ya da tüberkülozis gibi) yanıt olarak bir inflamatuar yanıt gelişebilir.OsteonekrozEtiolojinin çok faktörlü olduğunun düşünülmesine rağmen (kortikostreoid kullanımı, alkol tüketimi, ciddi immunosüpresyon, yüksek vücut kütle indeksi içeren), özellikle ileri derece HIV-hastalığı taşıyan veya uzun süre antiretroviral tedaviye (CART) maruz kalan hastalarda osteonekroz vakaları rapor edilmiştir. Hastalara eklem ağrısı, tutukluk ve hareket etmede zorluk şikayetleri varsa medikal yardım almaları tavsiye edilmelidir.PR aralığında uzama ve ürünle indüklenmiş QT aralığında uzamaLopinavir/ritonavirin bazı hastaların PR aralığında hafif ve semptomatik olmayan uzamaya neden olduğu gösterilmiştir. Lopinavir/ritonavir alan, altında yapısal kalp hastalığı yatan ve önceden var olan iletim sistemi anormallikleri olan hastalarda veya PR aralığını uzattığı bilinen ilaçlar (verapamil veya atazanavir gibi) alan hastalarda seyrek 2. veya 3. derece atriyoventriküler blok bildirilmiştir. KALETRA bu gibi hastalarda dikkatle kullanılmalıdır. (bakınız bölüm 5.1)4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKALETRA®, hemin vitroin vivoCYP3A'nın (sitokrom P450 3A) bir inhibitörüdür. KALETRA® ve primer olarak CYP3A tarafından metabolize edilen ürünlerin (örn. dihidropiridin kalsiyum kanal blokörleri, HMG-CoA redüktaz inhibitörleri, immün sistemi baskılayan ilaçlar ve sildenafil) birlikte uygulanması, diğer ilaçların plazma konsantrasyonlarını yükselterek terapötik etkilerinde ve advers etkilerinde artmaya ya da uzamaya neden olabilir (bkz. Bölüm 4.4). CYP3A tarafından yoğun olarak metabolize edilen ve ilk geçiş etkisine uğrayan ajanlar, KALETRA® ile birlikte uygulandığında EAA'nın artışını büyütür (3 katından daha fazla) gibi görünmektedir. Özellikle etkileşimin büyüklüğü ve ciddi advers olay potansiyeline sahip olmalarından dolayı kontrendike olan ilaçlar Tablo 8'de listelenmiştir (bkz. Bölüm 4.3. Kontrendikasyonlar).KALETRA®, CYP3A tarafından metabolize edilir. KALETRA® ve CYP3A'yı indükleyen ilaçların birlite uygulanması, lopinavir plazma konsantrasyınlarını düşürür ve terapötik etkisini azaltır (bkz. Bölüm 4.4.). Her ne kadar ketokonazolün bildirilmemesine rağmen CYP3A'yı inhibe eden diğer ilaçların KALETRA® (lopinovir/ritonavir) ile birlikte uygulanması lopinavir plazma konsantrasyonlarını artırır. Anti-HIV ajanlar- Nükleozid Ters Transkriptaz İnhibitörleri (NRTI'ler)Stavudin ve Lamivudin: KALETRA® klinik çalışmalarda tek başına ya da stavudin ve lamivudin ile kombine olarak verildiğinde lopinavirin farmakokinetiklerinde bir değişim gözlenmemiştir.Didanosin: Didanosinin boş mideyle alınması önerilmektedir; bu nedenle didanosin KALETRA® Tabletleriyle birlikte tok karnına verilebilir.Zidovudin ve Abakavir:KALETRA® glukuronidasyonu indüklemektedir, bu nedenle KALETRA®, zidovudin ve abacavirin plazma konsantrasyonlarını azaltma potansiyeline sahiptir. Bu potansiyel etkileşimin klinik anlamı bilinmemektedir.Tenofovir:Bir çalışma, KALETRA® nın tenofovir konsantrasyonlarını artırdığını göstermiştir. Bu etkileşimin mekanizması bilinmemektedir. KALETRA® ve tenofovir kullanmakta olan hastalar tenofovire bağlı advers olaylar bakımından izlenmelidir.Tümü:Proteaz inhibitörleri (PIs) özellikle nükleozid olmayan ters transkriptaz inhibitörleri (NRTIs) ile kombine kullanıldığında artmış CPK, miyalji ve nadiren rabdomiyoliz bildirilmiştir.-Nükleozid Olmayan Ters Transkriptaz İnhibitörleri (NNRTI'ler)Nevirapin:Sağlıklı gönüllülerde KALETRA® ile nevirapinin birlikte uygulanması esnasında lopinavirin farmakokinetiğinde hiçbir değişiklik görülmemiştir. HIV-pozitif pediyatrik deneklerdeki bir çalışmanın sonuçları, nevirapin ile birlikte uygulanması esnasında lopinavir derişimlerinde bir düşüş olduğunu açığa çıkarmıştır. HIV-pozitif yetişkinlerde nevirapinin etkisi, pediyatrik deneklerinkine benzerdir ve lopinovir derişimleri düşebilir. Bu farmakokinetik etkileşimin klinik anlamı bilinmemektedir. Günde bir kez KALETRA® uygulaması, nevirapin ile birlikte alınmamalıdır. EfavirenzKALETRA® nın günde bir kez alınan 600 mg efavirenz ile birlikte alındığında uygulan dozu günde iki kez alınan 500/125 mg'a yükseltildiğinde, lopinavir konsantrasyonları günde tek başına iki kez alınan 400/100 mg KALETRA® nınkine aşağı yukarı yakındır. Açığa çıkan lopinavir, tek başına günde iki kere alınan 400/100 mg KALETRA® nınki ile karşılaştırıldığında %6 ila %12 oranında artmıştır. Not: Efavirenz ve nevirapin CYP3A aktivitesini indükler ve bu nedenle KALETRA® ile birlikte kullanıldıklarında diğer inhibitörlerin plazma konsantrasyonlarını düşürme potansiyeline sahiptirler. Günde bir kez KALETRA® uygulaması, efavirenz ile birlikte alınmamalıdır. Delavirdin:Delavirdin, lopinavir plazma konsantrasyonlarını artırma potansiyeline sahiptir. - Diğer HIV proteaz inhibitörleriyle (PI'ler) birlikte uygulama:KALETRA® (günde iki defa 400/100 mg) kararlı durumda kontrollü sağlıklı gönüllülerde yapılan çalışmalarda ritonavir olmadan her bir HIV proteaz inhibitörünün klinik dozlarına relatif olarak azaltılmış amprenavir, indinavir, nelfinavir ve sakinavir ile kombine edilerek araştırılmıştır. Ritonavirle güçlendirilmiş amprenavir ve sakinavir rejimlerine ilişkin yayınlanmış farmakokinetik verilere de karşılaştırmalar yapılmıştır. Ekm olarak, ilave ritonavir lopinavir farmakokinetiği üzerindeki etkisi tartışılmaktadır. Ritonavirle güçlenidirilmiş proteaz inhibitör rejimlerin eski karşılaştırmalarının dikkatle yorumlanması gerektiğine dikkat edin (bakınız aşağıda kombinasyonların ayrıntıları). Güvenlilik ve etkinlik yönünden Klatra ile kombine edilecek uygun HIV proteaz inhibitörü dozları bilnmemektedir. Bu nedenle KALETRA® nın PI'lerle konkomitan olarak uygulanması yakından izlenmelidir. AmprenavirKALETRA® nın ampenavir (günde 2 kez 750 mg ampenavir + KALETRA®, tek başına günde 2 kez 1200 mg ampenavir nazaran artmış EAA, benzer Cmaks ve artmış Cmin yaratır) konsantrasyonlarını artıması beklenir. KALETRA® ve ampenavirin birlikte uygulanması azalmış lopinavir konsantrasyonlarına neden olur (bkz. Pozoloji ve uygulama şekli). Günde bir kez alınan KALETRA® uygulaması amprenavir ile birlikte alınmamalıdır. FosamprenavirBir çalışma, KALETRA® ile fosamprenavirin birlikte uygulanmasının amprenavir ve lopinavir konsantrasyonlarını azalttığını göstermiştir. KALETRA® ve fosamprenavirin uygun dozlarının kombinasyonu güvenlilik ve etkililik bakımından kanıtlanmamıştır. IndinavirKALETRA® nın indinavir (günde 2 kez 600 mg indinavir + KALETRA®, tek başına günde 3 kez 800 mg indinavir nazaran benzer EAA, azalmış Cmaks ve artmış Cmin yaratır) konsantrasyonlarını artıması beklenir. Günde 2 kez 400 mg/100 mg KALETRA® ile birlikte uygulanan indinavir dozunun azaltılması gerekebilir. NelfinavirKALETRA® nın nelfinavir konsantrasyonlarını ve nelfinavir metaboliti M8'i (günde 2 kez 1000 mg nelfinavir + KALETRA®, tek başına günde 2 kez 1250 mg nelfinavire nazaran benzer EAA, benzer Cmaks ve artmış Cmin yaratır) artırması beklenir. KALETRA® ile nelfinavirin birlikte uygulanması, lopinavir konsantrasyonlarının azalması ile sonuçlanır (bkz. Pozoloji ve uygulama şekli). KALETRA®, nelfinavir ile birlikte kombinasyon tedavisinde günde bir kez olarak alınmamalıdır. RitonavirTekbaşına günde iki kez 400/100 mg KALETRA® (üç yumuşak jelatin kapsül) ile karşılaştırıldığı üzere KALETRA® ilave olarak 100 mg ritonavir (günde 2 kez) ile birlikte uygulandığında lopinavir EAA %33 ve Cmin %64 artar. SakinavirKALETRA® nın sakinavir konsantrasyonlarını (günde 2 kez 800 mg sakinavir + KALETRA®, tek başına günde 3 kez 1200 mg sakinavire nazaran artmış EAA, artmış Cmaks ve artmış Cmin yaratır) artırması beklenir. Günde 2 kez 400 mg/100 mg KALETRA® ile birlikte uygulanan sakinavir dozunun azaltılması gerekebilir. Günde bir kez KALETRA® uygulaması, sakinavir ile birlikte çalışılmamıştır. DiğerOmeprazol ve ranitidin:Sağlıklı gönüllülerle yapılan bir çalışmada günde iki kez KALETRA® 400/100 mg omeprazol ile veya ranitidin ile birlikte alındığında klinik olarak ilişkili herhangi bir etkileşim gözlenmemiştir. KALETRA® tabletleri asit düşürücü ajanlarla (omeprazol ve ranitidin) kombinasyonda doz ayarlamasına gerek olmadan kullanılabilir. Antiaritmikler: (amiodaron, bepridil, sistemik lidokain ve kinidin): KALETRA® ile birlikte uygulandığında konsantrasyonları artabilir. Dikkatli olunması ve mümkünse terapötik konsantrasyonun izlenmesi önerilir.Trazodon:Ritonavir ve trazodonun bir arada kullanılması trazodon konsantrasyonlarını artırabilir. Bulantı, baş dönmesi, hipotansiyon ve senkop advers etkileri gözlemlenmiştir. Eğer trazodon, KALETRA® gibi bir CYP3A4 inhibitörü ile birlikte kullanılacaksa, bu kombinasyon dikkatle kullanılmalı ve trazodonun daha düşük bir dozunun kullanılması düşünülmelidir.Digoksin:Bir literatür raporu, ritonavir ve digoksinin birlikte uygulanmasının digoksin düzeylerinin anlamlı ölçüde artması ile sonuçlandığını göstermiştir. KALETRA® ve digoksin birlikte uygulandığında serum digoksin düzeylerinin uygun bir şekilde izlenmesi ile dikkat edilmelidir.Ketokonazol ve itrakonazolün,KALETRA® vasıtasıyla artan serum konsantrasyonları olabilir. Ketokonazol ve itrakonazolün yüksek dozları (200 mg/gün'den daha fazla) önerilmemektedir.Vorikonazol:Bir çalışmada her 12 saatte bir 100 mg ritonavir ile birlikte uygulanan vorikonazolün kararlı durum EAA değerini %39'luk bir ortalama ile düşdüğü gösterilmiştir. Bu nedenle vorikonazol kullanımının hastaya yarar/risk değerlendirmesi ispat edilmeden KALETRA® ve vorikonazolün birlikte uygulanmasından kaçınılmalıdırAnti-infektifler:Kaletra ile birlikte uygulandığında klaritromisin EAA'sında orta düzeyde artışlar beklenmektedir. Böbrek ve karaciğer yetmezliği bulunan hastalarda klaritromisin dozunun azaltılması düşünülmelidir.Buprenorfın: lopinavir/ritonavir (günde iki kez 400/100 mg doz) ile birlikte buprenorfın (günde 16 mg doz) alınması klinik olarak önemli bir etkileşim göstermemiştir. KALETRA® buprenorfin ile birlikte doz ayarlanmasına gerek kalmadan alınabilir.Antimikobakteriyaller:Rifabutin:Rifabutin ve KALETRA® 10 gün birlikte uygulandıklarında, rifabutin (ana ilaç ve aktif 25-O-desasetil metaboliti) Cmaks ve EAA sırasıyla 3.5 ila 5.7 kat artış göstermiştir. Bu verilere dayanarak, KALETRA® ile birlikte verildiğinde rifabutin dozunun %75 oranında azaltılması (gün aşırı veya haftada 3 defa 150 mg) önerilmektedir. Rifabutin dozunun daha fazla azaltılması da gerekebilir.Rifampisin:Rifampisinin standard dozdaki KALETRA® ile birlikte kullanımı, KALETRA®'ya, proteaz inhibitörlerine ya da diğer antiretroviral ajanlara karşı virolojik yanıtta ve olası dirençte kayba neden olabilir. Tek başına günde iki kez 400/100 mg KALETRA® dozu ile karşılaştırıldığında rifampisinin günde iki kez 800/200 mg KALETRA® dozu ile birlikte uygulanması ile lopinovirde %57'ye kadar ve günde iki kez 400/400 mg KALETRA® dozu ile birlikte uygulanması ise %7'ye kadar düşüşe yol açmıştır. Rifampisin ile birlikte uygulanan yüksek dozlardaki KALETRA® ile ALT ve AST yükselmeleri bildirilmiştir ve bu durum doz uygulaması sekansına bağlı olabilir. Birlikte kullanılmaları düşünülüyorsa KALETRA®, rifampisinin eklenmesinden 10 gün önce standart dozda başlanmalıdır. Bundan sonra KALETRA® dozu artırılmalıdır. Karaciğer işlevinin yakın takibi yapılmalıdır.Antiparazitler:KALETRA® birlikte uygulandığında atovakuonun terapötik konsantrasyonlarında artış muhtemeldir. Atovakuonun dozunda artış yapılması gerekebilir. Kortikosteroidler:Deksametazon:Deksametazon, CYP3A4'ü indükleyebilir ve lopinavir konsantrasyonlarını düşürebilir.Flutikazon propionat:Flutikazon propionatla KALETRA®'nın birarada kullanımında lopinavir/ritonavir, flutikazon propionat konsantrasyonlarını artırabilir. Dikkatle kullanılmalıdırlar. Özellikle uzun süreli kullanım için flutikazon propionata alternatifler düşünülmelidir (bkz. Bölüm 4.4. Uyarılar, 'İlaç etkileşimleri' alt başlığı)Dihidropiridin kalsiyum kanal blokörleri: (örn. felodipin, nifedipin, nikardipin): Serum konsantrasyonları KALETRA® ile artabilir.KALETRA® rosuvastatin ile birlikte kullanıldığında dikkatli olunmalıdır. KALETRA® ve pravastatin ile yapılan bir ilaç etkileşim çalışmasının sonuçları klinik olarak anlamlı bir etkileşimin olduğunu göstermemiştir. Pravastatin ve fluvastatin metabolizması CYP3A4'e bağımlı değildir ve KALETRA® ile etkileşim beklenmez. Bir HMG-CoA redüktaz inhibitörüyle tedavi endike olduğunda pravastatin veya fluvastatin önerilmektedir (bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri, 'İlaç etkileşimleri' alt başlığı). Fosfodiesteraz inhibitörleri:Tadanafil ve sildenafil gibi CYP3A4 metabolizmasına bağımlı fosfodiesteraz inhibitörleri, KALETRA® yı da içeren ritonavir tedavisi ile birlikte alınmasının EAA değerlerinde yaklaşık olarak sırasıyla 2 kat ve 11 katı artışla sonuçlanması beklenmektedir. Bu durumda, hipertansiyon, senkop, görsel değişiklikler ve geç ereksiyonu içeren advers etkilerle ilişkili PDE5 inhibitöründe artışa neden olabilir. KALETRA® kullanan hastalara sildenafil ve tadanafil reçetelendirilirken advers etkilerin izlenmesi için özel önlemler alınmalıdır. KALETRA® yı da içeren ritonavir tedavisi ile birlikte vardenafilin eş zamanlı kullanımı vardenafilin EAA değerinde 49 kat artış ile sonuçlanması beklenir. KALETRA® nın vardenafil ile birlikte kullanılması kontrendikedir. Erektil fonksiyon bozukluğu ajanlarıSildenafil:Sildenafil dikkatle ve azaltılmış doz olan her 48 saatte bir 25 mg'ı geçmeyecek şekilde ve advers etkiler bakımından sıkı takiple kullanılmalıdır (bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri, 'İlaç etkileşimleri' alt başlığı).Tadalafil:Tadalafil dikkatle ve azaltılmış doz olan her 72 saatte bir 10 mg'ı geçmeyecek şekilde ve advers etkiler bakımından sıkı takiple kullanılmalıdır (bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri, 'İlaç etkileşimleri' alt başlığı).Vardenafil:Vardenafil dikkatle ve azaltılmış doz olan her 72 saatte bir 2,5 mg'ı geçmeyecek şekilde ve advers etkiler bakımından sıkı takiple kullanılmalıdır (bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri, 'İlaç etkileşimleri' alt başlığı).Siklosporin, sirolimus ve takrolimus:KALETRA® ile birlikte kullanıldığında kontrendikasyonları artabilir. Bu ürünlerin plazma seviyeleri kararlı hale gelene kadar daha sık terapötik konsantrasyon takibi tavsiye edilir.Bitkisel ilaçlarKALETRA kullanmakta olan hastalar St.Johns Wort içeren ürünlerle birarada kullanmamalıdırlar. Zira bu kombinasyon KALETRA®'nın plazma konsantrasyonlarında azalmaya yol açması beklenebilir. Bu etkiler, CYP3A4'ün indüksiyonu yüzünden olabilir ve terapötik etki ve direnç gelişimi ile sonuçlanabilir (bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri, 'İlaç etkileşimleri' alt başlığı). Midazolam: Midazolam yaygın olarak CYP3A4 ile metabolize olur. KALETRA® ile birlikte kullanımı benzodiazepin konsantrasyonunda büyük bir artışa neden olabilir. 14 sağlıklı gönüllüde yapılan bir fenotip kokteyl çalışması EEA'da 13 katı ve parenteral midazolamda 4 katı kadar artış göstermiştir. Bu sebeple KALETRA® oral yolla alınan midazolam ile birlikte kullanılmamalıdır. Bunun yanında parenteral yolla alınan midazolam ile birlikte kullanılırken de dikkatli olunmalıdır. Şayet KALETRA® parenteral yolla alınan midazolam ile birlikte kullanılacaksa, yoğun bakım ünitesinde veya yakın klinik izleme ve solunum depresyonunda ve/veya uzun süreli sedasyonda uygun medikal idare sağlayacak benzer şartlarda verilmelidir. Midazolam için doz ayarlaması, eğer midazolam bir kerede tek dozdan fazla alınırsa özellikle düşünülmelidir.poliproteinin klivajını engelleyerek olgunlaşmamış, enfeksiyöz olmayan virüs üretimine yol açar. |
|||||||||||||||||||||||||||||||||||||||||||
İn vitro antiviral aktivite:in vitro
Tablo 1Başlangıç noktasına göre Lopinavir/ritonavir Duyarlılığı ve Lopinavir/ritonavireazalmış yanıt ile ilişkilendirilen Proteaz Substitüsyonlarının sayısında göre 48. haftada Virolojik Yanıt (HIV RNA < 400 kopya /ml) 1 | |||
|
Başlangıç noktasındaki proteaz inhibitörü mutasyonlarının sayısı1 |
Çalışma 888 (Tek proteaz inhibitörü deneyimli, NNRTI kullanmamış)2 n = 130 |
Çalışma 765 (Tek proteaz inhibitörü deneyimli, NNRTI kullanmamış) 3 n = 56 |
Çalışma 957 (çoklu proteaz inhibitörü deneyimli, NNRTI kullanmamış) 4 n = 50 |
|
0 - 2 |
76/103 (74%) |
34/45 (76%) |
19/20 (95%) |
|
3 - 5 |
13/26 (50%) |
8/11 (73%) |
18/26 (69%) |
|
6 ya da daha fazla |
0/1 (0%) |
- |
1/4 (25%) |
|
1Analizde yer alan substitüsyonlar: L10F/I/R/V, K20M/N/R, L24I, G48V, I54L/T/V, V82A/C/F/S/T ve I84V. 243% indinavir, 42% nelfinavir, 10% ritonavir, 15% sakinavir. 341% indinavir, 38% nelfinavir, 4% ritonavir, 16% sakinavir. 486% indinavir, 54% nelfinavir, 80% ritonavir, 70% sakinavir. |
L33F, M36I, I47V, | ||
Klinik çalışmalar
Önceden proteaz inhibitör tedavisi almış hastalarda KALETRA®'nın antiviral aktivitesi:
Lopinavire karşı
in vitro
duyarlılık azalmasının klinik anlamı, başlangıçtaki viral genotipe ve fenotipe göre Kaletra tedavisine virolojik yanıt değerlendirilerek, daha önce nelfinavir, indinavir, sakinavir ve ritonavirden (Çalışma M98-957) seçilen en az 2 proteaz inhibitörüyle tedaviye rağmen NNRTI kullanmamış ve HIV RNA > 1000 kopya/ml sahip 56 hastadaincelenmiştir. Bu çalışmada hastalar başlangıç olarak efavirenz ve nükleozid ters transkriptaz inhibitörleri ile kombinasyon halinde lopinavir/ritonavirin iki dozundan birini almak için randomize edildi. Lopinavirin başlangıç noktasındaki 56 viral izolata karşı EC50 değeri, yabanıl tipteki HIV'e karşı EC50 değerine göre 0.5 ila 96 kat daha yüksektir. Bu başlangıç noktasındaki izolatların %56'sı (31/56), lopinavire karşı 4 kat daha fazla azalmış duyarlılık göstermiştir. 31 izolatın lopinavir duyarlılığında 27.9 katlık bir ortalama azalma bulunmakta idi.
KALETRA®, efavirenz ve nükleozid ters transkriptaz inhibitörleriyle ile 48 haftalık tedaviden sonra, lopinavire karşı < 10-kat, 10 ila 40-kat arası ve > 40-kat duyarlılık azalması olan hastaların sırasıyla %93 (25/27), %73 (11/15) ve %25'inde (2/8) plazma HIV RNA'nın < 400 kopya/ml olduğu gözlemlenmiştir. Lopinavir duyarlılığı rekombinant fenotipik teknolojisi kullanılarak virolojik olarak test edilmiştir. Genotip de ayrıca virolojik olarak yapılmıştır. Plazma HIV RNA < 50 kopya/ml, sırasıyla yukarıdaki hasta gruplarının %81 (22/27), %60 (9/15) ve %25 (2/8)'inde gözlemlenmiştir
Şu an lopinavir/ritonavir tedavisi gören hastalardaki izolatlarda, lopinavirle ilişkili mutasyon örnekleri aydınlatmak için yeterli veri bulunmamaktadır. Spesifik mutasyon örnekleri ve virolojik yanıt oranları arasındaki ilişkiyi değerlendirmek için daha fazla çalışma gerekmektedir.
Klinik farmakodinamik verilerErişkinlerdeki Kullanımı:
Önceden antiretroviral tedavi almayan hastalar
Çalışma M98-863:
lopinavir/ritonavir günde 2 kez + stavudin + lamivudin ile nelfinavir (günde 3 kez) + stavudin
M98-863 çalışması, daha önce antiretroviral almamış olan 653 hastada nelfinavir (günde üç defa 750 mg) artı stavudin + lamivudinin ile lopinavir/ritonavir (günde iki defa 400/100 mg) artı stavudin + lamivudin tedavisi ile karşılaştırıldığı devam etmekte olan randomize, çift kör, çok merkezli bir çalışmadır. Yaş ortalaması 38 olan (aralık 19 ila 84 arası) hastaların %57'si beyaz ırka mensup ve %80'i erkek idi. Ortalama başlangıç noktasındaki CD4 hücresi sayısı 259 hücre/mm3 (aralık: 2 - 949 hücre/mm3) ve ortalama başlangıç noktasındaki plazma HIV-1 RNA 4.9 log10 kopya/ml (aralık: 2.6 - 6.8 log10 kopya/ml) idi.
Çalışma M97-765:
Günde 2 kez lopinavir/ritonavir + nevirapin + NRTI'
M97-765 çalışması, iki doz düzeyinde (400/100 mg ve 400/200 mg, ikisi de günde iki defa) lopinavir/ritonavir artı nevirapin (günde iki defa 200 mg) ve iki nükleosid ters transkriptaz inhibitörünü, daha evvelden tek proteaz inhibitörü deneyimi olan ve daha önce nükleosid olmayan ters transkriptaz inhibitörü kullanmamış olan 70 hastada değerlendiren randomize, kör, çok merkezli devam etmekte olan bir çalışmadır. Yaş ortalaması 40 olan (aralık 22 ila 66 arası) hastaların %73'i beyaz ırka mensup ve %90'sı erkek idi. Ortalamabaşlangıç noktasındaki CD4 hücre sayısı 372 hücre/mm3 (aralık 72 - 807 hücre/mm3) ve ortalama başlangıç noktasındaki plazma HIV-1 RNA 4.0 log10 kopya/ml (aralık 2.9 -5.8 log10 kopya/ml) olmuştur.
Çalışma 765'te tedavinin 144 haftası boyunca, HIV RNA < 400 (< 50) kopya/ml olan hastaların oranı %54 (%50) [n=70] ve CD4 hücre sayısında buna karşılık gelen ortalama artış 212 hücre/mm3 olmuştur. 27 hasta (%39) çalışmayı bırakmış olup advers olaylar nedeniyle bırakan 9 hasta (%13) ve 2 ölüm (%3) buna dahildir.
Pediyatrik Kullanım
Çalışma M98-940
Çalışma M98-940, 80 mg/ml lopinavir ve 20 mg/ml ritonvir içeren lopinavir/ritonavir oral solüsyonunun farmakokinetik profilini, tolerabilitesini, güvenliliğini ve etkinliğini daha önce antiretroviral kullanmamış (%44) ve antiretroviral deneyimli (%56) 100 pediyatrik hastada değerlendiren açık etiketli, çok merkezli bir çalışmadır. Bütün hastalar daha önce non-nükleozid ters transkriptaz inhibitörü kullanmamış olan hastalardır. Hastalar m2 başına 230 mg lopinavir/57.5 mg ritonavir dozu ya da m2 başına 300 mg lopinavir/75 mg ritonavir dozu alacak şekilde randomize edilmişlerdir. Daha önce kullanmamış hastalara ayrıca nükleosid ters transkriptaz inhibitörleri verilmiştir. Deneyimli hastalar nevirapin artı en fazla iki nükleozid ters transkriptaz inhibitörü almışlardır.
Kırk sekiz haftalık tedavi boyunca <400 kopya/ml'lik bir HIV RNA'yı elde eden ve sürdüren olan hastaların oranı, daha önce antiretroviral kullanmamış hastalar için %84 ve antiretroviral deneyimi olan hastalar için %71 olmuştur. Kırk sekiz hafta boyunca başlangıç noktasındaki CD4 hücre sayısındaki ortalama artış, daha önce antiretroviral kullanmamış hastalar için 404 hücre/mm3 ve antiretroviral deneyimi olan hastalar için 284 hücre/mm3 olmuştur.
5.2 Farmakokinetik Özellikleri
Genel özellikler
Ritonavir ile birlikte verilen lopinavirin farmakokinetik özellikleri sağlıklı yetişkin gönüllülerde ve HIV ile enfekte hastalarda değerlendirilmiştir: iki grup arasında önemli farklar gözlenmemiştir. Lopinavir esasen tümüyle CYP3A tarafından metabolize edilir. Ritonavir, lopinavir metabolizmasını inhibe ederek lopinavirin plazma düzeylerini arttırır. Çalışmalarda lopinavir/ritonavirin günde iki defa 400/100 mg dozunda kullanımı HIV ile enfekte hastalarda ritonavirden 15-20 kat daha yüksek olan ortalama kararlı durum lopinavir plazma konsantrasyonları elde edilmiştir. Ritonavirin plazma düzeyleri, günde iki defa 600 mg ritonavir dozundan sonra elde edilen düzeylerden %7 daha azdır. Lopinavirinin vitro
antiviral EC50 değeri, ritonavirinkinden yaklaşık 10 kat daha düşüktür. Bu nedenle, KALETRA®'nın antiviral aktivitesi lopinavire bağlıdır.
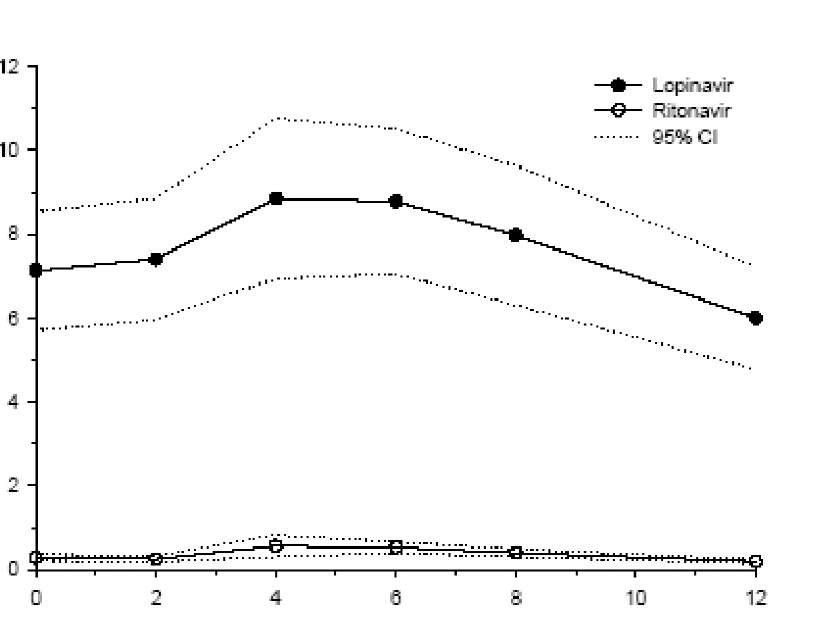
Şekil 1, HIV-enfekteli yetişkin hastalarda (n = 19) yapılan bir farmakokinetik çalışmadaki yemeklerle birlikte üç hafta boyunca günde iki defa 400/100 mg lopinavir/ritonavir uygulaması sonrası lopinavirin ve ritonavirin ortalama kararlı durum plazma konsantrasyonlarını gösterir.
Absorpsiyon
: HIV-pozitif hastalardaki bir farmakokinetik çalışmada, 3 hafta süreyle yemeklerle birlikte günde iki defa 400/100 mg KALETRA® ile çoklu dozlama, uygulamadan ortalama 4 saat sonra gelişen 9.8 ± 3.7 mcg/ml'lik bir ortalama ± SD lopinavir doruk plazma konsantrasyonu (Cmax) meydana getirir. Sabah dozundan önceki ortalama kararlı durum vadi konsantrasyonu 7.1 ± 2.9 mcg/ml ve 12 saatlik bir doz aralığı boyunca lopinavir EAA'sı ortalama 92.6 ± 36.7 ^g^saat/ml olmuştur. Ritonavirle birlikte formüle edilen lopinavirin insanlardaki mutlak biyoyararlanımı belirlenmiş değildir.
Dağılım
: Kararlı durumda, lopinavir plazma proteinlerine yaklaşık %98-99 oranında bağlanır. Lopinavir, alfa-1-asit glikoprotein (AAG) ve albümine bağlanır ama AAG için daha yüksek bir afiniteye sahiptir. Kararlı durumda lopinavirin proteine bağlanması, günde iki defa 400/100 mg KALETRA® dozundan sonra gözlemlenen konsantrasyon aralığı boyunca sabit kalmakta olup sağlıklı gönüllülerde ve HIV-pozitif hastalarda benzer düzeydedir.
Metabolizmain vitro
deneyler, lopinavirin başlıca oksidatif metabolizmaya tabi olduğunu göstermiştir. Lopinavir yaygın olarak karaciğer sitokrom P450 sistemince neredeyse tümüyle CYP3A izoenzimi tarafından metabolize edilir. Ritonavir güçlü bir CYP3A inhibitörü olup lopinavir metabolizmasını inhibe ederek lopinavirin plazma düzeylerini artırmaktadır. İnsanlarda yapılan bir 14C-lopinavir çalışması, tek doz 400/100 mg KALETRA® dozundan sonra plazmadaki radyoaktivitenin %89'unun ana ilaca bağlı olduğunu göstermiştir. İnsanda lopinavirin en az 13 oksidatif metaboliti saptanmıştır. 4-okso ve 4-hidroksimetabolit epimerik çifti antiviral aktiviteye sahip majör metabolitlerdir ama bunlar toplam plazma radyoaktivitesinin yalnızca küçük miktarlarını oluşturmaktadır. Ritonavirin metabolik enzimleri indükleyerek kendi metabolizmasını ve benzer biçimde lopinavir metabolizmasını indüklediği gösterilmiştir. Çoğul doz sırasında doz öncesi lopinavir konsantrasyonları, zamanla düşerek yaklaşık 10 - 16 gün sonra stabilize olmaktadır.
Şekil 1
*HIV-enfekteli Yetişkin Deneklere ait %95 Güven aralıklarına (CV) sahip Ortalama kararlı durum plazma konsantrasyonları (N=19)
n o
n
 Zaman (saat)
Zaman (saat)
Eliminasyon
: 400/100 mg 14C-lopinavir/ritonavir dozunu takiben, uygulanan 14C-lopinavir dozunun sırasıyla yaklaşık %10.4 ± %2.3 ve %82.6 ± %2.5'i, 8 gün sonra idrar ve dışkıda bulunmaktadır. Değişmemiş lopinavir idrar ve dışkıda, verilen dozun sırasıyla %2.2 ve %19.8'i oranında bulunmaktadır. Çoklu dozlardan sonra lopinavir dozunun %3'ten azı değişmeden idrarla atılmaktadır. Lopinavirin görünen oral klerensi (CL/F) 5.98 ± 5.75 L/saat (ortalama ± Standart sapma, N=19) olmuştur.
Günde bir kez doz uygulaması
Günde bir kez lopinavir/ritonavir uygulamasının farmakokinetiği özellikleri HIV-enfekte daha önce antiretroviral tedavi görmemiş hastalarda değerlendirilmiştir. Lopinavir/ritonavir 800/200 mg, günde bir kez doz rejiminin bir parçası olarak emtrisitabin 200 mg ve tenofovir DF 300 mg ile kombinasyon halinde uygulandı. 800/200 mg lopinavir/ritonavirin günde bir kez olarak 4 hafta boyunca yemeklerle birlikte çoklu doz uygulaması (n = 24), uygulamadan yaklaşık 6 saat sonra gelişen 11.8 ± 3.7 ^g/ml'lik bir ortalama ± standart sapma lopinavir doruk plazma konsantrasyonu (Cmaks) oluşturur. Lopinavirin ortalama kararlı durum vadi konsantrasyonu sabah dozundan önce lopinavirin ortalama kararlı durum vadi konsantrasyonu 3.2 ± 2.1 ^g/ml ve bir doz aralığı içerisinde minimum konsantrasyonu 1.7 ± 1.6 ^g/ml'dir. 24 saatlik bir doz aralığı boyunca lopinavir EAA'sı ortalama 154.1 ± 61.4 ^g*h/ml. olmuştur.
Elektrokardiyogram üzerine etkisi:
QTcF aralığı 39 sağlıklı yetişkinde randomize, plasebo ve aktif (moksifloksasin 400 mg QD) kontrollü çapraz çalışmada, Gün 3'de 12 saatin üzerinde 10 ölçüm ile değerlendirilmiştir. Plasebodan gelen QTcF'deki en yüksek ortalama farklılıklar (%95 üst güven sınırı) günde iki kez 400/100 mg ve supraterapötik olarak günde iki kez 800/200 mg LPV/r için sırasıyla 3.6 (6.3) ve 13.1 (15.8) idi.Bu iki doz rejimi Gün 3'de aşağı yukarı tavsiye edilen QD ile birlikte gözlenenden veya kararlı durumda günde iki defa LPV/r'den 1.5 ve 3 kat fazla açığa çıkma ile sonuçlandı. Hiç bir denek temel seviyeden > 60 msaniyenin QTcF'sinde artış veya QTcF aralığında 500 msaniye'lik potansiyel klinik olarak uygun eşik değerinin üstüne çıkma durumunu tecrübe etmemiştir.
PR aralığının hafif uzaması aynı çalışmada Gün 3'de lopinavir/ritonavir alan deneklerde tespit edilmiştir. En yüksek PR aralığı 286 msaniye olup herhangi ikincil veya üçüncül derecede kalp bloğu gözlenmemiştir. (bakınız bölüm 4.4)
Hastalardaki Karakteristik Özellikler
Pediyatrik hastalar:
Günde iki defa 300/75 mg/m2 ve 230/57.5 mg/m2 lopinavir/ritonavir dozlarının farmakokinetiği, yaşları altı ay ile 12 yaş arasında değişen toplam 53 pediyatrik hastada yapılan çalışmalarda incelenmiştir. Nevirapinsiz günde iki defa 230/57.5 mg/m2 rejimi ve nevirapinle günde iki defa 300/75 mg/m2 rejimi, günde iki defa 400/100 mg, (nevirapinsiz) yetişkin hasta rejimindekine benzer lopinavir plazma konsantrasyonları sağlamıştır. Günde bir kez lopinavir/ritonavir uygulaması pediyatrik hastalarda değerlendirilmemiştir.
Günde iki defa 230/57.5 mg/m2 lopinavirle ortalama kararlı durum EAA, Cmax ve Cmin değerleri nevirapin olmadan lopinavir/ritonavirden sonra (n=12) sırasıyla 72.6 ± 31.1mcg*saat/ml, 8.2 ± 2.9 ve 3.4 ± 2.1 mcg/ml ve günde iki defa 300/75 mg/m2 ile (nevirapinle beraber) (n=12) 85.8 ± 36.9 mcg*saat/ml, 10.0 ± 3.3 ve 3.6 ± 3.5 mcg/ml olmuştur. Nevirapin rejimi, günde iki kez 7 mg/kg (6 ay ila 8 yaş arası için) ya da günde iki kez 4 mg/kg'dır (8 yaşın üzeri için).
Altı aydan küçük pediyatrik hastalarda KALETRA®'nın güvenliliği ve farmakokinetik profilleri kanıtlanmamıştır. Bir klinik çalışma esnasında altı ay ile 12 yaş arası HIV-enfekteli hastalarda görülen advers olay profili yetişkin hastalarınkine benzer idi. Klinik çalışmalarda KALETRA®'nın pediyatrik hastalardaki antiviral aktivitesinin değerlendirmesi devam etmektedir. Günde bir kez KALETRA® uygulaması pediyatrik hastalarda değerlendirilmemiştir.
Böbrek yetmezliği:
Lopinavirin farmakokinetiği, böbrek yetmezliği olan hastalarda araştırılmamıştır; ancak, lopinavirin böbrek klerensi ihmal edilebilir olduğundan, böbrek yetmezliği olan hastalarda toplam vücut klerensinde bir azalma olması beklenmemektedir.
Karaciğer yetmezliği:
Lopinavir çoğunlukla karaciğerde metabolize edilir ve atılır. Hafif veya orta dereceli karaciğer yetmezliği olan HIV ve HCV ile kombine enfeksiyonlu hastalarda, günde iki defa lopinavir/ritonavir 400/100 mg ile yapılan çoğul dozlu bir çalışmasında, normal karaciğer fonksiyonuna sahip HIV enfeksiyonlu hastalara kıyasla lopinavirin EAA'sında %30'luk bir artış ve Cmaks'ında %20'lik azalma olmuştur. Buna ek olarak, lopinavirin plazma proteinlerine bağlanması, kontrol grubuna kıyasla hafif ila orta düzeyde karaciğer yetmezliği olanlarda daha azdır (sırasıyla 99.09 'e karşı. 99.31%) (bkz. 4.5.).
Cinsiyet, Yaş, Irk,
Lopinavirin farmakokinetiği, yaşlı hastalarda çalışılmamıştır. Yetişkin hastalarda, yaşa bağlı hiçbir farmakokinetik farklılık gözlemlenmemiştir. Irktan dolayı klinik açıdan ciddi farmakokinetik farklılıklar tanımlanmamıştır.
5.3 Klinik öncesi güvenlilik verileri
Akut, Subakut ve Kronik Toksisite
Kemirgenlerde ve köpeklerdeki yinelenen dozlu toksisite çalışmaları, majör hedef organların karaciğer, böbrek, tiroid, dalak ve dolaşımdaki eritrositler olduğunu göstermiştir. Hepatik değişimler fokal dejenerasyonla birlikte hücre şişmesidir. Bu değişimlere yol açan maruziyet, insandaki klinik maruziyet ile karşılaştırılırken hayvanlardaki dozajlar önerilen klinik dozun 6 katından fazladır. İnsanda önerilen dozun en az iki katını alan farelerde hafif renal tübüler dejenerasyon görülürken sıçanlarda ve köpeklerde böbrekler etkilenmemiştir. Sıçanlarda serum tiroksinindeki azalma, tiroid bezlerinde foliküler hücre hipertrofisi ile sonuçlanan bir TSH salınımı artışına yol açmıştır. Bu değişimler etkin maddenin kesilmesiyle geri dönüşlü olup farelerde ve köpeklerde görülmemiştir. Sıçanlarda Coombs-negatif anizositoz ve poikilositoz gözlenmiş ama farelerde ve köpeklerde gözlenmemiştir. Histiyositoz ile birlikte dalak büyümesi sıçanlarda görülmüş ama diğer türlerde görülmemiştir. Serum kolesterolü kemirgenlerde yükselmiş ama köpeklerde yükselmemi ştir. Trigliseridler yalnızca farelerde yükselmiştir.
6. FARMASÖTİK ÖZELLİKLER 6.1 Yardımcı maddelerin listesi
Tablet içeriği:
Kopovidon Sorbitan laurat Kolloidal anhidr silika Sodyum stearil fumarat
Film kaplama
Hipromelloz Titanyum dioksit
Makrogol tip 400 (Polietilen glikol 400) Hidroksipropil selüloz Talk
Kolloidal anhidr silika Makrogol tip 3350 (Polietilen glikol 335) Sarı demir oksit (E172) Polisorbat 80
6.2Geçimsizlikler
Uygulanamaz.
6.3Raf ömrü
2 yıl.
6.4Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklanmalıdır.
6.5Ambalajın niteliği ve içeriği
Propilen kapaklı yüksek dansiteli polietilen (HDPE) şişeler. Her şişede 120 tablet vardır. Her kutuda 1 şişe (120 tablet) bulunur.
6.6Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler yada atık materyaller 'Tıbbi ürünlerin kontrolü yönetmeliği've 'Ambalaj atıklarının kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir.
7.RUHSAT SAHİBI
Abbott Laboratuarları İth. İhr. ve Tic. Ltd. Şti. Ekinciler Caddesi Hedef Plaza No: 3 34810 Kavacık - Beykoz İstanbul
Tel : 0216 538 74 00 Faks : 0216 425 85 37
8.RUHSAT NUMARASI
125/13
9.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 04.07.2008 Son yenileme tarihi: -
10.KÜB'ÜN YENİLENME TARİHİ
04.07.2008
1 yaş ve üstü çocuklardaki güvenlik profilinin doğası yetişkinlerde görülene benzerdir.
Şekil 1
n o
n
 Zaman (saat)
Zaman (saat)İlaç Bilgileri
Kaletra 200 mg/50 mg Film Tablet
Etken Maddesi: Ritonavir, Lopinavir
Atc Kodu: J05AE06
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.