Zestat 45 mg Ağızda Eriyen Tablet Kısa Ürün BilgisiSinir Sistemi » Psikoanaleptikler » Antidepresanlar » Diğer Antidepresanlar » Mirtazapin KISA ÜRÜN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIZESTAT 45 mg ağızda eriyen tablet2. KALITATIF VE KANTİTATIF BILEŞIMEtkin maddeMirtazapin 45.00 mgYardımcı maddelerAspartam 9.00 mgMannitol 60.00 mgYardımcı maddeler için, bkz. 6.1.3. FARMASÖTIK FORMAğızda eriyen tabletAğızda eriyen ZESTAT tabletler beyaz ve yuvarlaktır; tabletlerin bir yüzünde 38, diğer yüzünde ise A yazılıdır.4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarDepresyon nöbetlerinin tedavisinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji:Başlangıç pozolojisi: Mirtazapin için önerilen başlangıç dozu günlük 15mg/gün'dür. Yapılan klinik çalışmalarda major depresyon tedavisinde Mirtazapin etkin doz aralığı 15-45mg/gün olarak tespit edilmiştir.İdame pozolojisi: Mirtazapin için idame dozu her hastaya göre değişkenlik gösterebildiği için tedavi altındaki hastaların idame tedavisine ihtiyaç duyup duymadıkları ve eğer gerekli ise idame tedavisinin dozu her hasta için ayrıca değerlendirilmelidir.Uygulama sıklığı ve süresi:Mirtazapin uzun yarılanma ömrüyle günde tek doz kullanıma uygundur, ancak gerekli hallerde ikiye bölünmüş dozlar halinde de uygulanabilir. Günde tek doz uygulanacağı zaman dozun akşam alınması önerilmektedir.Tedaviye tercihen 4-6 ay süreyle, hastada semptomlar tamamen kaybolana kadar devam edilmelidir. Daha sonra tedavi aşamalı olarak kesilebilir.Genelde, uygun dozla tedaviye başlandıktan sonra 2-4 hafta içinde tedaviye cevap alınacaktır. Eğer cevap tatmin edici düzeyde değilse, doz maksimum doza yükseltilebilir ve bu dozla tedaviye 2 - 4 hafta daha devam edilir. Eğer bu sürenin sonunda halen herhangi bir cevap alınamamışsa, tedaviye daha fazla devam edilmemesi önerilir.Uygulama şekli:Tabletlerin kırılmaması için, tableti şerit gözünden çıkarırken itmemek gerekir (Şekil A). Her bir şeritte altı adet tablet gözü bulunur; bunlar birbirinden perforasyonlarla ayrılmıştır. Bir tablet gözü perforasyonundan ayrılır (Şekil 1). Folyo dikkatle ve ok işareti bulunan köşeden başlayarak açılır (Şekil 2 ve 3).Tabletler, kabından kuru elle alınmalı ve dil üzerine konmalıdır (Şekil 4). Tablet dağılacaktır ve bunun ardından suyla veya susuz olarak yutulabilir.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Mirtazapin'in klerensi orta dereceli böbrek yetmezliğinde %30 oranında; şiddetli böbrek yetmezliğinde (kreatin klerensi <10ml/dk/1.73m2) ise %50 oranında azalmaktadır.Bu sebeple böbrek yetmezliği olan hastalarda Mirtazapin'in kandaki konsantrasyonunun yükselebileceği göz önünde bulundurulmalıdır.Mirtazapin'in klerensi karaciğer yetmezliğinde %30 oranında oranında azalmaktadır. Bu sebeple karaciğer yetmezliği olan hastalarda Mirtazapin'in kandaki konsantrasyonunun yükselebileceği göz önünde bulundurulmalıdır.Pediyatrik popülasyon:Güvenlik ve etkinliğe ilişkin veri yetersizliği nedeniyle çocuklarda Mirtazapin'in kullanılması tavsiye edilmemektedir.Geriyatrik popülasyon:Yaşlılarda Mirtazapin'in klerensi azalmaktadır: genç erkeklere göre yaşlı erkeklerde Mirtazapin'in klerensi %40 daha düşüktür. Kadınlarda ise yaşa bağlı etkilenme daha azdır: yaşlı kadınlarda gençlere göre klerensteki düşüş %10'dur. Bu sebeple yaşlılarda doz artışları yakın gözlem altında yapılmalıdır.4.3. KontrendikasyonlarMirtazapin'e ya da formülasyonundaki yardımcı maddelerden herhangi birine karşı aşırı duyarlılık.4.4. Özel kullanım uyarıları ve önlemleriAntidepresan ilaçların çocuklar ve 24 yaşına kadar olan gençlerdeki kullanımlarının intihar düşünce ya da davranışlarını artırma olasılığı bulunmaktadır. Bu nedenle, özellikle tedavinin başlangıcı ve ilk aylarında ilaç dozunun artırılma/azaltılma ya da kesilme dönemlerinde hastanın gösterebileceği huzursuzluk, aşırı hareketlilik gibi beklenmedik davranış değişiklikleri ya da intihar olasılığı gibi nedenlerle hastanın gerek ailesi gerekse tedavi edicilerle yakinen izlenmesi gereklidir. Mirtazapin, erişkinlerde depresyon nöbetlerinin tedavisinde endikedir. Güvenlik ve etkinliğe ilişkin veriyetersizliği nedeniyle çocuklarda Mirtazapin'in kullanılması tavsiye edilmemektedir._Diğer antidepresanlarla olduğu gibi Mirtazapin ile de tedaviye başlanacak hastalarda aşağıdaki hususlar dikkate alınmalıdır:Klinik kötüleşme ve intihar riski:Majör depresyonlu hastalarda, tedavi alıp almamalarından bağımsız olarak, depresyonun ağırlaşması, intihar girişimi veya tavırlarda anormal değişiklikler görülebilir.Başta majör depresyon olmak üzere bazı psikiatrik hastalıklarda antidepresan tedavi alan bazı hastaların intiharı daha sık düşündükleri ve daha fazla intihar girişimde bulundukları bildirilmektedir. Bu sebeple antidepresan tedavi alan hastalar özellikle tedavinin ilk birkaç ayında ve doz değişimlerinde klinik kötüleşme ve intihar düşünceleri açısından daha yakından takip edilmelidir.Aradaki ilişki tam olarak belirlenmemiş olmakla birlikte bazı semptomların klinik kötüleşmeye ve intihar riskine işaret ettiği kabul edilmektedir. Bu sebeple antidepresan tedavi alan hastalarda anksiyete, ajitasyon, panik ataklar, uykusuzluk, kindarlık, sinirlilik, düşüncesizce davranışlar gösterme, huzursuzluk gibi şikayetler yakından takip edilmelidir. Bu belirtileri gösteren tedavi rejimi tekrar gözden geçirilmeli ve gerekli hallerde tedavide değişiklik veya tedavinin kesilmesi düşünülmelidir.Bu riskleri azaltmak için tedaviye mümkün olan en düşük doz ile başlanmalı ve hasta yakınları yukarıdaki davranış değişiklikleri gösteren hastaları kontrole getirmeleri konusunda bilgilendirilmelidir.Bipolar bozukluk taraması:Bazen majör depresyon bipolar bozukluğun ilk belirtisi olabilir. Ancak böyle hastalarda yanlışlıkla sadece depresyonun tedavi edilmesinin mikst/manik atakların ortaya çıkışım hızlandırdığı düşünülmektedir.Bu sebeple bir hastaya antidepresan tedavi başlanmadan önce mutlaka bipolar bozukluk açısından yeterli bir tarama yapılmalı ve bipolar bozukluk olmadığından emin olunmalıdır.Agranülositoz:Pazarlama öncesi klinik çalışmalarda Mirtazapin kullanan 2796 hastadan 2'sinde tedavinin 61. ve 9. gününde ateş ve enfeksiyon belirtileriyle agranülositoz, 1'inde ise tedavinin 14.günü herhangi bir semptom olmadan nötropeni gözlenmiştir. Mirtazapin tedavisine son verildikten sonra her üç hastada da kan tablosu normale dönmüştür.Bu verilere göre Mirtazapin'e kullanan hastalarda agranülositoz riski binde 1.1'dir. Ancak çok geniş bir güvenilirlik aralığı bulunmaktadır (onbinde 2.2'den binde 3.1 vakaya).Çok düşük bir risk olsa da Mirtazapin ile tedavi altındaki hastalarda boğaz ağrısı, ateş, stomatit gibi diğer enfeksiyon belirtileri görüldüğünde ve buna total lökosit sayısında düşüş eşlikettiğinde Mirtazapin ile tedaviye son verilmeli ve hasta yakından takip edilmelidir.Bağımlılık riski:Antidepresanlar bağımlılık yapıcı nitelikte olmasa da, ilacın uzun süre kullanılmasının ardından birdenbire kesilmesi halinde bulantı, baş ağrısı ve kırıklık görülebilir.Aşağıda sıralanan rahatsızlıklara sahip hastalarda doz titrasyonu dikkatle uygulanmalı, kontroller düzenli olarak ve dikkatle yapılmalıdır: Epilepsi ve organik beyin hastalıkları;odeneyimler, mirtazapinle tedavi edilen hastalarda bunlarla çok ender olarak karşılaşıldığını göstermektedir; Karaciğer veya böbrek fonksiyon bozuklukları;oSarılık görülmesi durumunda tedavi kesilmelidir. Kalpte ileti bozuklukları, angina pektoris ve miyokard enfarktüsü gibi eş zamanlı kalp hastalıkları;oEşzamanlı olarak kullanılan ilaçlar dikkatle titre edilmelidir. Hipotansiyon. Yaşlı hastalar,Yaşlılar özellikle antidepresanların istenmeyen etkilerine karşı genelde daha hassastır. Klinik araştırmalarda, yaşlı hastalarda istenmeyen etkilerin diğer yaş gruplarına kıyasla daha sık görüldüğü yönünde herhangi bir bulgu elde edilmemiştir, ancak, yine de, bu konudaki deneyimler hala sınırlıdır.Diğer antidepresanların kullanımında olduğu gibi, aşağıdaki rahatsızlıklara sahip hastalarda dikkatle kullanılması tavsiye edilir: İdrar yapma güçlüğü, örneğin, prostat hipertrofisioancak mirtazapinin antikolinerjik etkisi çok düşük olduğundan dolayı, bu tür problemlerle karşılaşılması beklenmez Akut dar açılı glokom, intraoküler basıncın yükselmesiomirtazapinin antikolinerjik etkisinin çok düşük olması sebebiyle, mirtazapinden kaynaklanan bir problem meydana gelmesi riski yine çok azdır Diabetes mellitus.Diğer önlemler: ZESTAT'ın yardımcı maddelerinden birisi, eser miktarda fenilalanin içeren aspartamdır. 45 mg'lık her tablet, 4.5 mg fenilalanin içerir. Bu da, fenilketonürisi olan insanlar için zararlı olabilir.Ayrıca tüm antidepresanlarda olduğu gibi aşağıdaki hususlar dikkate alınmalıdır: Şizofren ve diğer psişik bozukluğu olan hastalarda antidepresan uygulaması ile psişik semptomlarda kötüleşme görülebilir, paranoid düşünceler şiddetlenebilir. Hastalar özellikle yan etkileri açısından antidepresanlara karşı daha hassastırlar, mirtazapinle yapılan klinik çalışmalar sırasında yaşlı hastalarda bildirilen yan etkiler diğer yaş gruplarına oranla daha sık olmamakla beraber bu ana kadar ki tecrübe de sınırlıdır.4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriAşağıdaki etkin maddelerle eşzamanlı kullanılması kontrendikedir: Mirtazapin, MAO inhibitörleriyle (monoamin oksidaz inhibitorleri) kombinasyon halinde veya bu maddelerle tedavinin kesilmesinin ardından iki hafta içinde kullanılmamalıdır.Aşağıdaki etkin maddelerle eşzamanlı kullanıldığında dikkatli olunmalıdır: In vitro araştırmalar,mirtazapinin bazı sitokrom P450 enzimlerinin (CYP1A2, CYP2D6 ve CYP3A) çok zayıf bir kompetitif inhibitörü olduğuna işaret etmektedir. Ayrıca mirtazapin sitokrom P450 enzimleri ile (CYP2D6 ve CYP3A4, ve kısmen CYp1a2) metabolize edilmektedir. CYP3A4 inhibitörünün in vivo ortamda mirtazapinin farmakokinetikleri üzerinde nasıl bir etkisi olduğu bilinmemektedir. Bu sebeple HIV proteaz inhibitörleri, azol içeren antifungal ilaçlar, eritromisin ve nefazodon gibi güçlü CYP3A4 inhibitörleriyle eşzamanlı olarak mirtazapin kullanıldığında, dikkatli olunması önerilir. Mirtazapin, alkolün merkezi sinir sistemi üzerindeki depresan etkisini artırabilir. Bu nedenle, hastalara alkollü içkilerden kaçınmaları tavsiye edilmelidir. Mirtazapin, benzodiazepinlerin sedatif etkisini artırabilir; kombine kullanılmaları halinde dikkatli olunması önerilir.Aşağıdaki etkin maddelerle eşzamanlı kullanılması durumda doz ayarlaması gerekmektedir: CYP3A4'ü indükleyen karbamazepin, mirtazapinin klerensini yaklaşık iki katı artırır, plazma seviyelerini %45-60 oranında azaltır. Mirtazapinle yapılan tedaviye ilaç metabolizmasını endükleyen karbamazepin veya başka bir madde (örneğin, rifampisin veya fenitoin) eklendiğinde mirtazapin dozunu artırmak gerekebilir. Bu maddelerle gerçekleştirilen tedaviye son verildiğinde de mirtazapin dozunu azaltmak gerekebilir. Simetidinle eşzamanlı kullanıldığında, mirtazapinin yararlanımı %50'den fazla bir oranda artabilir. Simetidinle tedavinin başında mirtazapin dozu azaltılmalı, simetidinle tedavinin sonunda ise yeniden artırılmalıdır.Aşağıdaki etkin maddelerle eşzamanlı kullanılması mirtazapinin farmakokinetiğini etkilememektedir: İnsanlarda eşzamanlı mirtazapin ve lityum kullanımında herhangi bir klinik etki yada değişiklik gözlenmemiştir.Pediyatrik popülasyon:Güvenlik ve etkinliğe ilişkin veri yetersizliği nedeniyle çocuklarda Mirtazapin'in kullanılması tavsiye edilmemektedir.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hayvan çalışmalarında mirtazapin ile embriyotoksik etkiler ve yenidoğanın yaşama şansının azaldığı gözlenmiştir. İnsanlara yönelik potansiyel risk bilinmemektedir. Klinikte ise gebe kadınların tedavisiyle ilgili veri olmadığından mirtazapin gebelerde sadece kesin endikasyonunda ve risk/yarar dengesi göz önünde bulundurularak verilebilir.ZESTAT gerekli olmadıkça (faydalarının risklerine kıyasla çok daha fazla olduğundan emin olunmadığı sürece) gebelik döneminde kullanılmalıdır.Gebelik dönemiMirtazapin'in plasentadan fetusa geçip geçmediği bilinmemektedir, ancak düşük molekül ağırlığı sebebiyle fetusa ölçülebilir miktarda transfer beklenmelidir.Mirtazapin'in kullanılmaya başlandığı 1996 yılından beri bu etkin maddenin gebelikte kullanımına bağlı sonuçlar hakkında herhangi bir vaka rapor edilmemiştir.Laktasyon dönemiMirtazapin'in insan ya da hayvan sütü ile atılmasına ilişkin sınırlı bilgi mevcuttur. Emzirilen bebek açısından bir risk olduğu göz ardı edilemez. Emzirmenin durdurulup durdurulmayacağına ya da mirtazapin tedavisinin durdurulup durdurulmayacağına ilişkin karar verirken, emzirmenin bebek açısından faydası ve mirtazapin tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği / FertiliteHayvanlar üzerinde yapılan araştırmalarda mirtazapinin embriyotoksik ve genotoksik etkinin olmadığı gösterilmiş, fertiliteyi etkilemediği gözlenmiştir.4.7. Araç ve makine kullanımı üzerindeki etkilerMirtazapin, konsantrasyon ve reaksiyon kabiliyetini negatif yönde etkileyebilir. Tüm diğer antidepresanlarla tedavi edilen hastalarda olduğu gibi ZESTAT ile de tedavi gören hastalara da araba sürmemeleri ve sürekli konsantrasyon gerektiren, tehlike potansiyeli bulunan faaliyetlerden kaçınmaları uyarısı yapılmalıdır.4.8. İstenmeyen etkilerDepresif hastalarda, hastalığın durumuyla ilişkilendirilen bir dizi semptom görülür. Bu nedenle, bazen, hangi semptomların hastalığın kendisinden kaynaklandığını, hangilerinin Mirtazapinle tedavinin bir sonucu olduğunu belirlemek gerekir.İlaca bağlı olduğu kabul edilen advers reaksiyonlar aşağıda listelenmiştir:Sıklıklar şu şekilde tanımlanır: çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (> 1/10.000 ila <1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Kan ve lenf sistemi bozukluklarıSeyrek: Eozinofili, granülositopeni, agranülositoz, aplastik anemi ve trombositopeni gibi akut kemik iliği bozuklukları (ayrıca bkz, 4.4. Özel kullanım uyarıları ve önlemleri)Psikiyatrik bozukluklarSeyrek: Mani, kabuslar, kişide etki bırakan rüyalarSinir sistemi bozukluklarıÇok yaygın: Aşırı uyku, sedasyon genellikle tedavinin ilk haftaları içinde görülür (dozun azaltılması sedasyonun azalmasına yol açmaz fakat antidepresan etkinliği azaltabilir)Yaygın: Baş dönmesi, baş ağrısı, anormal rüyalar, anormal düşünceler, konvülsiyon atakları, tremor, miyoklonüsVasküler bozukluklarYaygın: Geniş veya lokal ödem ve bunun sonucunda kilo alma Seyrek: (Postüral) hipotansiyonGastrointestinal bozukluklarÇok yaygın: İştah artışı, kilo alma, konstipasyonHepato-bilier bozukluklarSeyrek: Serum transaminaz seviyelerinde yükselmeDeri ve deri altı doku bozukluklarıSeyrek: EkzantemKas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıSeyrek: Eklem ve kas ağrılarıGenel bozukluklarYaygın: Yorgunluk4.9. Doz aşımı ve tedavisiMirtazapinin tek başına aşırı dozda kullanılmasıyla ilgili mevcut deneyimler sınırlıdır; ancak sonuçlar semptomların genelde hafif olduğunu göstermektedir. Taşikardi ve hafif hipertansiyon veya hipotansiyonla bağlantılı merkezi sinir sistemi depresyonu ve beraberinde zaman-mekân bilinci yitimi ile uzun süreli sedasyon gözlenmiştir. Aşırı dozda kullanımhalinde mide lavajı yapılmalı ve yaşamsal işlevler için uygun semptomatik ve destekleyici tedavi uygulanmalıdır.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik Grubu: Antidepresanlar ATC Kodu: N06AX11Mirtazapinin etki mekanizması tam olarak bilinmemektedir. Bununla birlikte antidepresan etkisinin santral presinaptik a2adrenerjik inhibitör reseptörlerin antagonize edilmesinden kaynaklandığı düşünülmektedir. Böylece mirtazapin santral noradrenerjik ve serotonerjik aktiviteyi arttırmaktadır.Mirtazapin aynı zamanda 5-HT2ve 5-HT3reseptörlerinin potent bir antagonistidir. Ancak 5-HT1Ave 5-HT1Breseptörleri üzerine anlamlı bir afinitesi bulunmamaktadır. Bu sebeple serotenerjik sinir iletisi özellikle HT1Ave 5-HT1Breseptörleri üzerinden gerçekleşmektedir.Mirtazapinin santral sinir sisteminde ayrıca histamin H1 reseptörlerini de inhibe ettiği ve mirtazapinin sedatif etkilerinin bu santral H1 antagonizmadan kaynaklandığı bilinmektedir.Mirtazapin muskarinik reseptörler üzerine orta dereceli bir etkiye sahiptir. Bu antikolinerjik yan etkilerin az olmasını açıklamaktadır.Mirtazapinin periferik sinir sistemini de etkilediği gözlenmiştir: periferik aıreseptörlerini bloke edebilmektedir. Buna bağlı olarak tedavi sırasında ortostatik hipotansiyon görülen vakalar rapor edilmiştir.Mirtazapinin iki farklı enantiomeri vardır ve her iki enantiomerin de antidepresan etkiye katkıda bulunduğu düşünülmektedir: S(+) enantiomer aıve 5-HT2reseptörlerinin blokajını, R(-) enantiomer ise 5-HT3reseptörlerinin blokajını sağlar.5.2. Farmakokinetik özellikler Genel özelliklerEmilim:Mirtazapin oral yoldan uygulandığında gastrointestinal kanaldan hızla ve kolayca absorbe edilir; oral biyoyararlanımı yaklaşık %50'dir. Maksimum kan konsantrasyonuna uygulamadan yaklaşık iki saat sonra ulaşır.Dağılım:Plazma proteinlerine yaklaşık %85 oranında bağlanır.Biyotransformasyon:Başlıca demetilasyon, oksidasyon ve bunları takiben konjügasyonla metabolize edilir. İnsan karaciğeri mikrozomlarıyla yapılan in vitro araştırmalarda sitokrom P450 enzimlerinden CYP2D6 ve CYP1A2'in mirtazapinin 8-hidroksi metabolitine dönüşümde görev aldığını göstermiştir; CYP3A4 ise, N-demetil ve N-oksit metabolitlerine dönüşümden sorumlu enzimdir. Demetil metaboliti farmakolojik açıdan aktiftir ve mirtazapinin kendisininkiyle karşılaştırılabilir bir farmakokinetik profile sahiptir.Elimina.syon:Mirtazapin birkaç gün içinde tamamen metabolize edilerek idrarla ve feçesle atılır. Böbrek veya karaciğer yetmezliği neticesinde mirtazapinin klerensi azalabilir. Mirtazapinin ortalama eliminasyon yarı ömrü 20 - 40 saattir. Bazı vakalarda kanda 65 saat sonra eser miktarda bulunduğu gösterilmiştir. Bununla birlikte özellikle genç erkeklerde yarılanma ömrü daha kısa olabilir. Uzun eliminasyon yarı ömrü sayesinde tedavide genellikle günde bir kez uygulama yeterlidir. Yaşlılarda ve erkeklerde; gençlere ve kadınlara göre mirtazapinin klerensi daha düşüktür.Doğrusallık/doğrusal olmayan durum:Mirtazapin önerilen doz aralığında lineer farmakokinetik gösterir. Mirtazapin 3 - 4 gün içinde kararlı kan konsantrasyonuna ulaşır. Bunun ardından herhangi bir birikim olmaz.Mirtazapinin farmakokinetik özellikleri gıda alımından etkilenmez.5.3. Klinik öncesi güvenlilik verileriMirtazapinin kronik kullanımı sıçanlarda ve köpeklerde klinik açıdan ilgili herhangi bir etkiye sebep olmamıştır. Sıçanlarda ve tavşanlarda fertiliteye herhangi bir etki tespit edilmemiştir, embriyotoksik etki gözlenmemiştir. Gen mutasyonları, kromozom ve DNA hasarının incelendiği bir dizi testte mirtazapinin genotoksik olmadığı gösterilmiştir. Sıçanlar ve fareler üzerinde yapılan karsinojenisite araştırmalarında sırasıyla tiroit bezi tümörleri ve hepatosellüler neoplazmalar görülmüştür. Ancak bu durum hepatik enzimleri endükleyen maddelerle uzun süre ve yüksek dozlarda yapılan tedaviyle ilişkilendirilmiş, türe özgü, genotoksik olmayan bir cevap olarak nitelendirilmiştir.Mirtazapin kobay ve tavşanlara önerilen dozun sırasıyla 20 ve 17 katı dozlarda uygulandığında herhangi bir teratojenik etki gözlenmemiştir..6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiKrospovidonMannitolMikrokristalize selüloz AspartamÇilek guarana aroması Nane aroması Kolloidal anhidr silika Magnezyum stearat Saflaştırılmış su6.2. GeçimsizliklerBildirilmemiştir.6.3. Raf ömrü24 ay.6.4. Saklamaya yönelik özel tedbirler250C'nin altındaki oda sıcaklığında ve orijinal ambalajında saklayınız.6.5. Ambalajın niteliği ve içeriğiZESTAT çocuk kilitli, çekilip çıkarılabilir, rijit bir şerit içine ambalajlanmıştır. Şerit, kağıt, plastik film ve alüminyum folyodan oluşan tabakaya iliştirilmiş bir alüminyum folyo ve plastik film tabakasıdır ve ayrıca ısıya duyarlı bir üst tabakaya sahiptir. Tablet bölmeleri, perforasyonlarla ayrılmıştır.Plastik filmlerde şu maddeler kullanılmıştır: PVC (polivinil klorür), poliamid ve polyester.30 tabletlik ambalajlarda sunulmaktadır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.7. RUHSAT SAHIBIAbdi İbrahim İlaç San. ve Tic. A.Ş.Eski Büyükdere Cad. Ayazağa Yolu No:5 34398 Maslak / İSTANBUL Tel: 0212 366 84 00 Faks: 0212 276 20 208. RUHSAT NUMARASI125/739. ILK RUHSAT TARIHI / RUHSAT YENİLEME TARIHIİlk ruhsat tarihi: 26/09/2008 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİŞEKIL 1:Her bir şeritte altı adet tablet gözü bulunur; bunlar birbirinden ayrılabilir olarak yapılmıştır. Bir tablet gözünü yırtarak ayırınız.ŞEKIL A: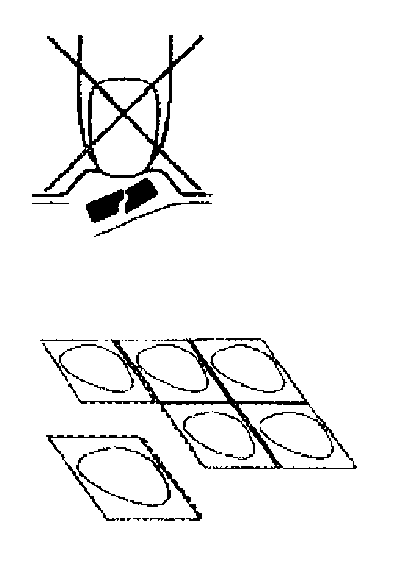
ŞEKIL 2:Tabletlerin kırılmaması için, tableti şerit gözünden çıkarırken itmeyiniz.ŞEKIL 3:Folyoyu ok işareti bulunan köşeden başlayarak açınız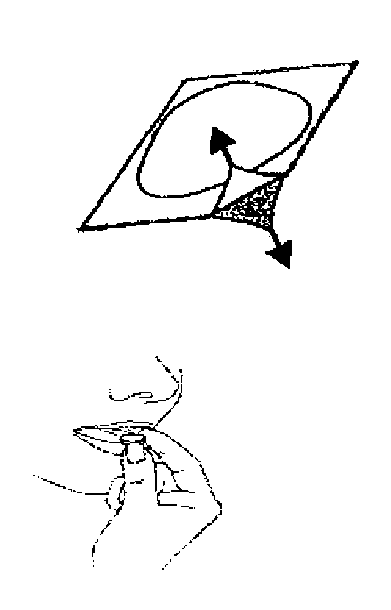  ŞEKIL 4:Tabletleri kabından kuru elle alınız ve dilinizin üstüne koyunuz. Tablet çabucak dağılacaktır. Tabletleri suyla veya susuz olarak yutabilirsiniz. |
İlaç BilgileriZestat 45 mg Ağızda Eriyen TabletEtken Maddesi: Mirtazapin Atc Kodu: N06AX11 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.