Eligard 7.5 mg Enjeksiyonluk Çözelti Için S.C. Toz Içeren Şırınga ve Çözücü Içeren Şırınga Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Hormonal Tedavi İlaçları » Hormonlar » Gonadotropin Salgılatıcı Hormon Analogları » Leuprorelin Asetat KISA ÜRÜN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIELIGARD 7.5 mg enjeksiyonluk çözelti için s.c. toz içeren şırınga ve çözücü içeren şırınga2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Her kullanıma hazır şırınga 9.7 mg Leuprorelin (asetat olarak) içerir.Çözelti hazırlandıktan sonra verilebilen miktar 0.25 ml'lik her bir doz için 7.5 mg leuprorelin asetat'tır.Yardımcı maddeler:Yardımcı maddeler için bölüm 6.1'e bakınız.3. FARMASÖTIK FORMEnjeksiyonluk çözelti için s.c. toz içeren şırınga ve çözücü içeren şırıngaToz beyaz ila kirli beyaz renklidir. Çözelti berrak, açık ila koyu sarımsı kahve renklidir.4. KLİNIK ÖZELLIKLERI4.1 Terapötik endikasyonlarıELIGARD, hormona duyarlı ilerlemiş prostat kanseri tedavisi için endikedir.4.2 Pozoloji ve uygulama şekli Pozoloji / uygulama sıklığı ve süresiYalnızca erişkin erkek hastalar için dozajELIGARD, ayda bir kez derialtı enjeksiyon şeklinde uygulanır. Enjekte edilen solüsyon, bir aylık bir dönem boyunca sürekli leuprorelin asetat salımı sağlayan katı bir depo oluşturur.Kural olarak, ilerlemiş prostat kanserinin ELIGARD ile tedavisi uzun dönemli tedaviyi gerektirmektedir ve remisyon ya da düzelme görüldüğünde bu tedavi kesilmemelidir.ELIGARD, tedaviye verilen yanıtın izlenmesi açısından prostat kanseri tedavisinde deneyimli bir uzman hekim gözetiminde uygulanmalıdır.ELIGARD'a verilen yanıt, klinik parametreler yoluyla ve prostat spesifik antijenin (PSA) serum düzeyleri ölçülerek izlenmelidir. Klinik araştırmalarda, testosteron düzeylerinin orşiektomi uygulanmamış hastaların büyük bir bölümünde tedavinin ilk 3 günü boyunca arttığı ve daha sonra 3-5 hafta içinde tıbbi kastrasyon düzeylerinin altına düştüğü gösterilmiştir. Erişilen kastrasyon düzeyleri, tıbbi ürün tedavisinin sürdürüldüğü dönem boyunca korunmuştur. Eğer hasta suboptimal yanıt verirse, serum testosteron düzeylerinin kastrasyon düzeylerine ulaştığı ya da bu düzeylerde kaldığının doğrulanması önerilir.Uygulama şekliKullanıma hazır olarak sunulan iki steril şırınganın içeriği, ELIGARD'ın derialtı enjeksiyon yoluyla uygulanmasından hemen önce karıştırılmalıdır (Bkz. bölüm 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler).Yanlışlıkla intraarteryel ya da intravenöz enjeksiyondan kesinlikle kaçınılmalıdır.Derialtı enjeksiyon yoluyla uygulanan diğer tıbbi ürünlerde olduğu gibi, enjeksiyon yeri periyodik olarak değiştirilmelidir.Özel popülasyonlara ilişkin ek bilgilerBöbrek / Karaciğer yetmezliği:Böbrek veya karaciğer fonksiyon bozukluğu olan hastalarda klinik araştırma yapılmamıştır. Bu nedenle özel bir uyarı bulunmamaktadır.Pediyatrik popülasyon:Çocuklara uygulanmamaktadır.Geriyatrik popülasyonÖzel bir uyarı bulunmamaktadır.4.3 KontrendikasyonlarELIGARD aşağıda belirtilen durumlarda kontrendikedir: Leuprorelin asetat'a, diğer GnRH agonistlerine ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık halinde. Daha önce orşiektomi uygulanmış olan hastalarda (diğer GnRH agonistleri gibi, ELIGARD cerrahi kastrasyon durumunda serum testosteron düzeylerinde daha fazla düşüşe neden olmaz) Omurilik kompresyonu bulunan ya da spinal metastaz bulguları olan prostat kanseri hastalarında tek başına tedavi olarak (ayrıca, bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri) uygulanması. Kadınlarda ve pediyatrik hastalarda4.4 Özel kullanım uyarıları ve önlemleriLeuprorelin asetat, diğer GnRH agonistleri gibi, tedavinin ilk haftası boyunca testosteron, dihidrotestosteron ve asit fosfatazın serum konsantrasyonlarında geçici bir artışa neden olmaktadır. Hastalarda kemik ağrısı, nöropati, hematüri ya da üretra veya mesane çıkışında obstrüksiyonu içeren yeni semptomlar görülebilir ya da mevcut semptomlarda kötüleşme ortaya çıkabilir (bkz. bölüm 4.8 İstenmeyen etkiler). Tedavi sürdürüldüğünde bu semptomların genellikle azaldığı görülmektedir.Leuprorelin tedavisinden 3 gün önce başlatılan ve tedavinin ilk iki-üç haftası boyunca sürdürülen uygun bir antiandrojenin ilave olarak uygulanması düşünülmelidir. Bu uygulamanın, başlangıçta serum testosteron düzeyinde ortaya çıkan artıştan kaynaklanan sorunları önlediği bildirilmiştir.Cerrahi kastrasyonu takiben, ELIGARD erkek hastaların serum testosteron düzeylerinde daha fazla düşüşe yol açmaz.GnRH agonistleri ile üretra obstrüksiyonu ve omurilik kompresyonu olguları bildirilmiştir; bunlar fatal komplikasyonlarla birlikte ya da bu tür komplikasyonlar olmaksızın ortaya çıkan paralize katkıda bulunabilir. Omurilik kompresyonu ya da böbrek fonksiyon bozukluğu gelişmesi durumunda, bu komplikasyonlar için standart tedaviye başlanmalıdır.Üriner sistem obstrüksiyonu bulunan hastaların yanı sıra, vertebra ve/veya beyin metastazları olan hastalar, tedavinin ilk birkaç haftası boyunca yakından izlenmelidir.Hastaların bir bölümündeki tümörler, hormon manipülasyonuna karşı duyarlı olmayacaktır. Testosteron supresyonunun yeterli olmasına karşın klinik düzelme olmaması bu durumun belirtisidir ve ELIGARD ile daha ileri tedavi hasta için yarar sağlamayacaktır.Tıbbi literatürde, orşiektomi uygulanan ya da GnRH agonistleri ile tedavi edilen erkek hastalarda kemik dansitesinin azaldığı bildirilmiştir (bkz. bölüm 4.8 İstenmeyen etkiler).Antiandrojen tedavisi, osteoporozdan kaynaklanan kırıkların riskini anlamlı ölçüde artırmaktadır. Bu konu hakkında yalnızca sınırlı veriler mevcuttur. 22 aylık farmakolojik androjen baskılama tedavisini takiben hastaların %5'inde, 5 ila 10 yıllık tedaviden sonra hastaların %4'ünde osteoporozdan kaynaklanan kırıklar gözlenmiştir. Osteoporozdan kaynaklanan kırık riski, genellikle patolojik kırıklara kıyasla daha yüksektir.Uzun süreli testosteron eksikliği dışında, ileri yaş, sigara içme ve alkollü içki tüketimi, obezite ve yetersiz egzersiz de osteoporoz gelişimini etkileyebilir.Hayvanlarda yapılan kronik toksisite araştırmalarında, yüksek leuprorelin asetat dozlarının uygulanmasını takiben sıçanlarda hipofiz adenomları saptanmıştır. Bu durum, leuprorelin asetat ile yapılan uzun dönemli klinik araştırmalarda gözlenmemiştir.ÖnlemlerGnRH agonisti tedavisi uygulanan bazı hastalarda glukoz toleransında değişiklikler olduğu bildirilmiştir. ELIGARD tedavisi sırasında diyabetik hastaların daha sık izlenmesi önerilmektedir.4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriELIGARD ile farmakokinetik ilaç-ilaç etkileşimi araştırmaları yapılmamıştır. Leuprorelin asetat ile diğer tıbbi ürünler arasında herhangi bir etkileşime ilişkin bildirim mevcut değildir.4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi : XELIGARD kadınlarda kontrendike olduğundan uygulanamaz.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)ELIGARD kadınlarda kontrendike olduğundan uygulanamaz.Gebelik dönemiELIGARD kadınlarda kontrendike olduğundan uygulanamaz.Laktasyon dönemiELIGARD kadınlarda kontrendike olduğundan uygulanamaz.Üreme yeteneği / (Fertilite)Leuprorelin asetat, doğal olarak ortaya çıkan gonadotropin salgılatıcı hormonun (GnRH) sentetik bir nonapeptid agonistidir ve sürekli olarak uygulandığında hipofizer gonadotropin sekresyonunu inhibe eder ve erkeklerde testiküler steroidogenezi baskılar. Sonuç olarak üreme yeteneği geri dönüşümlü olarak etkilenir.4.7 Araç ve makine kullanımı üzerindeki etkilerELIGARD'ın araç ve makine kullanma yeteneği üzerindeki etkilerine ilişkin araştırmalar yapılmamıştır. Tedavinin olası yan etkileri olan ya da altta yatan hastalıktan kaynaklanan bitkinlik, baş dönmesi ve görme bozuklukları, araç ve makine kullanma yeteneğinin bozulmasına neden olabilir. Bu nedenle hastalar araç ve makine kullanırken dikkatli olmaları konusunda uyarılmalıdır.4.8 İstenmeyen etkilerELIGARD ile görülen advers reaksiyonlar, yani bazı hormon düzeylerindeki artış ve düşüşler, temel olarak leuprorelin asetatın spesifik farmakolojik etkisine bağlıdır. En sık bildirilen advers reaksiyonlar, sıcak basması, yorgunluk ve bitkinlik ile enjeksiyon yerindeki geçici lokal iritasyondur. Hafif sıcak basmaları hastaların yaklaşık %55'inde ortaya çıkmaktadır.İlerlemiş prostat karsinomu olan hastalarda ELIGARD ile yürütülen klinik çalışmalar sırasında aşağıdaki advers olaylar bildirilmiştir. Aşağıdaki advers reaksiyonlar sistem-organ sınıfı ve sıklığa göre şu yaklaşımla rapor edilmiştir:Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)ELIGARD ile yapılan klinik araştırmalarda bildirilen istenmeyen etkilerEnfeksiyonlar ve enfestasyonlar Yaygın olmayanİdrar yolu enfeksiyonuSeyrekLokal deri enfeksiyonuKan ve lenf sistemi hastalıkları YaygınHematolojik değişikliklerMetabolizma ve beslenme hastalıkları Yaygın olmayanDiabetes mellitusta şiddetlenmePsikiyatrik hastalıklar Yaygın olmayanSinir sistemi hastalıkları YaygınHipoesteziYaygın olmayanBaş dönmesi, baş ağrısı, insomnia, tat alma bozukluğu, koku alma bozukluğuSeyrekAnormal istemsiz hareketlerVasküler hastalıklar Çok yaygınSıcak basmasıYaygın olmayanHipertansiyon, hipotansiyonSeyrekSenkop ve kollapsSolunum, göğüs bozuklukları ve mediastinal hastalıkları Yaygın olmayanRinoreGastrointestinal hastalıkları YaygınBulantı, dispepsi, diyareYaygın olmayanKonstipasyon, ağız kuruluğuSeyrekGaza bağlı mide ve bağırsakta şişkinlik, geğirme, gaz sancısıDeri ve deri altı doku hastalıkları Çok yaygınEkimozlar, eritemYaygınPruritusYaygın olmayanCiltte ıslaklık, gece terlemeleri, terleme artışıSeyrekAlopesi, deri döküntüsüKas-iskelet bozuklukları, bağ doku ve kemik hastalıkları YaygınArtraljiYaygın olmayanSırt ağrısı, kas kramplarıBöbrek ve idrar hastalıkları YaygınSeyrek idrara çıkma, idrar yapmada güçlük, dizüri, noktüri, oligüriYaygın olmayanMesane spazmı, hematüri, idrara çıkma sıklığında artış, üriner retansiyonGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok yaygınEnjeksiyon yerinde yanma, enjeksiyon yerinde paresteziYaygınBitkinlik, enjeksiyon yerinde ağrı, enjeksiyon yerinde morarma, rigor, zayıflıkYaygın olmayanEnjeksiyon yerinde kaşıntı, letarji, ağrı, ateşÜreme sistemi ve meme hastalıkları YaygınMeme hassasiyeti, testiküler atrofi, testis ağrısı, infertilite, meme hipertrofisiYaygın olmayanJinekomasti, empotans, testiküler bozuklukSeyrekMeme ağrısıAraştırmalarYaygınKan kreatinin fosfokinaz artışı, uzamış koagülasyon zamanıYaygın olmayanAlanin aminotransferazda artış, kan trigliseridlerinde artış, uzamış protrombin zamanı, kilo artışıPazarlama sonrası deneyim: |
Yanma |
%29 |
Ağrı |
%4,6 |
Eritem |
%2,5 |
Ekimoz |
%2,5 |
Pruritus |
%1,8 |
Sertleşme |
%0,4 |
Ülserasyon |
% 0.1 |
Genel olarak, derialtı enjeksiyonu takiben ortaya çıkan bu lokalize advers olaylar hafiftir ve kısa süreli olarak tanımlanmıştır.
Kemik dansitesindeki değişiklikler
Tıbbi literatürde, orşiektomi uygulanan ya da GnRH agonistleri ile tedavi edilen erkek hastalarda kemik dansitesinin azaldığı bildirilmiştir. Leuprorelin asetat ile uzun dönemli tedavide, osteoporoz belirtilerinde artış gözlenebilmesi beklenebilecek bir durumdur. Osteoporoza bağlı kırık riskindeki artış konusunda bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri.
Hastalığın belirti ve semptomlarının alevlenmesi
Leuprorelin asetat ile tedavi, ilk birkaç hafta boyunca hastalığın belirti ve semptomlarının alevlenmesine neden olabilmektedir. Vertebra metastazları ve/veya üriner obstrüksiyon ya da hematüri gibi sorunların şiddetlenmesi durumunda, zayıflık ve/veya alt ekstremitelerde parestezi gibi nörolojik sorunlar ya da üriner semptomlarda kötüye gidiş ortaya çıkabilir.
4.9 Doz aşımı ve tedavisi
Semptomlar:
ELIGARD ile akut doz aşımının etkilerine ilişkin klinik deneyim bulunmamaktadır.
Tedavi:
Doz aşımı durumunda hasta izlenmeli ve gerekli görüldüğünde uygun destekleyici tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLERİ
5.1 Farmakodinamik özellikleri
Farmakoterapötik grubu: Gonadotropin salgılatıcı hormon analogları ATC kodu: L02A E02.
Etki mekanizması:
Leuprorelin asetat, doğal olarak ortaya çıkan gonadotropin salgılatıcı hormonun (GnRH) sentetik bir nonapeptid agonistidir ve sürekli olarak uygulandığında hipofizer gonadotropin sekresyonunu inhibe eder ve erkeklerde testiküler steroidogenezi baskılar. Bu etki, tıbbi ürün tedavisinin bırakılmasından sonra geri dönüşlüdür. Bu agonist, doğal hormona kıyasla daha büyük bir potense sahiptir.
Leuprorelin asetatın uygulanması ilk olarak dolaşımdaki luteinleştirici hormon (LH) ve folikül stimüle edici hormon (FSH) düzeylerinde bir artışla sonuçlanır ve bu da erkeklerdeki gonadal steroidler, testosteron ve dihidrotestosteron düzeylerinde geçici bir artışa yol açar. Leuprorelin asetatın sürekli olarak uygulanması, LH ve FSH düzeylerinde bir düşüşe neden olur. Erkeklerde testosteron kastrasyon eşiğinden daha düşük bir düzeye inmektedir (< 50 ng/dL). Bu düşüşler, tedavinin başlangıcından sonra üç ila beş hafta içinde ortaya çıkmaktadır. Altıncı aydaki ortalama testosteron düzeyleri 6,1 (± 0,4) ng/dL olarak saptanmıştır ve bu, bilateral orşiektomiyi takiben elde edilen düzeylerle karşılaştırılabilir bulunmuştur. Pivotal klinik araştırmada tüm hastalar 6 haftada kastrat düzeylerine ulaşmış; bu düzey hastaların %94'ünde 28 günde, hastaların %98'inde ise 35 günde elde edilmiştir Hastaların büyük bir çoğunluğunda gözlenen testosteron düzeyleri 20 ng/dL'nin altında kalmış, ancak bu düşük düzeylerin tam yararı henüz saptanmamıştır. PSA düzeyleri altı ayda %94 oranında düşüş göstermiştir.
Uzun dönemli araştırmalarda, tedavinin sürdürülmesinin, yedi yıla varan bir dönem boyunca ve tahminen süresiz olarak kastrasyon düzeyinin altında testosteron sağladığı gösterilmiştir.
Klinik çalışma programı sırasında tümör boyutu direkt olarak ölçülmemiş, ancak ELIGARD için ortalama PSA'da elde edilen %94'lik bir azalma ile dolaylı olarak yararlı bir tümör yanıtının var olduğu saptanmıştır.
5.2 Farmakokinetik özellikleri
Genel özellikler
Emilim:İlerlemiş prostat karsinomu olan hastalarda, ilk enjeksiyonu takiben ortalama serum leuprorelin konsantrasyonları, enjeksiyondan 4-8 saat sonra 25,3 ng/mL'ye (Cmaks) ulaşmaktadır. Her bir enjeksiyonu takiben ortaya çıkan ilk artıştan sonra (her bir dozdan sonraki 2-28. günlerde plato fazı), serum konsantrasyonları nispeten sabit kalmaktadır (0,28-1,67 ng/mL). Tekrarlanan doz uygulamalarında birikime ilişkin herhangi bir bulgu saptanmamıştır.
Dağılım:Sağlıklı erkek gönüllülere uygulanan intravenöz bolus enjeksiyonu takiben
leuprorelinin ortalama kararlı durum dağılım hacmi 27 litre olarak saptanmıştır. İn vitro olarak insan plazma proteinlerine bağlanma oranı %43 ila %49 arasında değişmektedir.
Biyotransformasyon:Hiçbir ilaç metabolizması çalışması yapılmamıştır.
Eliminasyon:Sağlıklı erkek gönüllülerde, intravenöz yolla bolus şeklinde uygulanan 1 mg'lık leuprorelin asetat dozunun ortalama sistemik klerensinin 8,34 L/saat ve iki bölümlü bir model temel alınarak terminal eliminasyon yarılanma ömrünün yaklaşık 3 saat olduğu gösterilmiştir.
İlacın kullanım şekli, subkütanöz yolla derialtı enjeksiyon şeklinde olduğundan, leuprorelin asetat ile atılım araştırmaları yapılmamıştır.
Doğrusallık /doğrusal olmayan durum :Uygulama yöntemi nedeniyle geçerli değildir.
5.3 Klinik öncesi güvenlilik verileri
Leuprorelin asetat ile yapılan klinik öncesi araştırmalarda, bilinen farmakolojik özelliklerine dayanarak üreme sistemi üzerinde beklenen etkiler elde edilmiştir. Leuprorelin asetat teratojenisite göstermemiştir. Tavşanlarda embriyotoksisite/letalite gözlenmiştir.
Karsinojenisite araştırmaları
Karsinoj eni site araştırmaları sıçanlar ve fareler üzerinde yapılmıştır. Sıçanlarda, 0,6 ila 4 mg/kg/gün şeklindeki dozların derialtı yoluyla uygulanmasından sonra, hipofiz adenomlarında dozla bağlantılı bir artış gözlenmiştir. Farelerde bu tip bir etki gözlenmemiştir.
Mutajenisite araştırmaları
Leuprorelin asetat ve ilgili bir aylık ürün ELIGARD, in vitro ve in vivo olarak yürütülen bir dizi analizde mutajenik bulunmamıştır.
6. FARMASÖTİK ÖZELLİKLERİ:
6.1 Yardımcı maddelerin listesi:
Poli (DL-laktik-ko-glikolik asit)
N-Metilpirolidon
6.2 Geçimsizlikler
Şırınga B'de bulunan leuprorelin, yalnızca şırınga A'daki çözücü ile karıştırılmalı ve diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü.
24 aydır.
Tablalardan birinin açılmasını takiben, toz ve çözücü hemen kullanıma hazırlanmalı ve hastaya verilmelidir. Mikrobiyolojik açıdan, steril çözücü ile kullanıma hazırlanan ürün hemen uygulanmalıdır.
6.4 Saklamaya yönelik özel tedbirler
Buzdolabında (2°C-8°C arasındaki sıcaklıklarda) ve orijinal ambalajında saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız.
6.5 Ambalajın niteliği ve içeriği
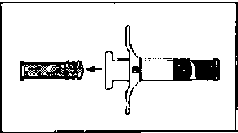
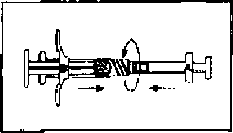
İki polipropilen şırınga vardır; Şırınga A çözücü ve Şırınga B toz içerir. İki şırınga birlikte bir karışım sistemi meydana getirir.
Şırınga A termoplastik kauçuk pistona sahiptir ve polietilen veya polipropilen Luer-Lok kapakla kapatılmıştır. Şırınga B'nin kabı ve iki piston ucu bromobutil kauçuktan imal edilmiştir.
Karton kutu, iki adet termoform tabla bulunan bir kitten oluşur. Bir tabla, kullanıma hazır polipropilen Şırınga A, büyük piston ve desikant poşet içerir. Diğer tabla, kullanıma hazır polipropilen Şırınga B, bir adet 20 ölçek 12.5 mm steril iğne ve bir adet silikon desikant poşet içerir.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.
Kullanıma hazırlama:
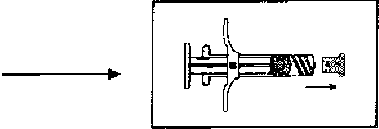
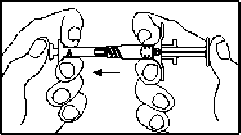
İki steril önceden doldurulmuş şırınga derialtı enjeksiyon yoluyla hastaya uygulanmadan hemen önce karıştırılmalıdır. Karıştırma işlemi aşağıdaki şekilde gerçekleştirilir:
1. Kullanımdan önce ürünün oda sıcaklığına gelmesi beklenir. Dış tabla açılır ve içindekiler temiz bir alana boşaltılır (Şırınga A ve Şırınga B'yi içeren iki tabla).
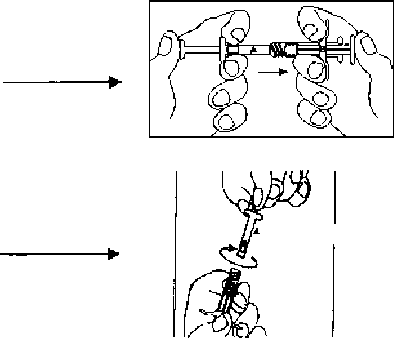
2. Şırınga A ve Şırınga B tablaları açıldıktan sonra, Şırınga B'den (liyofilize leuprorelin asetat) ikincil tıpa ve kısa piston çubuğu çıkarılır. Uzun piston çubuğu diğer Şırınga B tıpasına bağlanır.
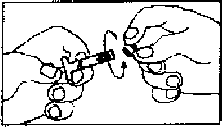
3. Şırınga A'nın (enjeksiyonluk çözelti için çözücü içinde sıvı polimer) başlığı ve şırınga B'nin (liyofilize leuprorelin asetat) başlıkları çıkarılır ve şırıngalar sımsıkı birleştirilir. Şırıngalar arası geçişi sağlamak ve homojen bir çözelti elde etmek için 60 kez ileri ve geri iyice sallayarak karıştırılır. Çözelti, iyice karıştırıldığında berrak, açık ila koyu sarımsı kahverengi renkli bir görünüm alacaktır.
4. İçerik Şırınga B içine aktarılır. Şırınga A pistonuna kuvvetle aşağıya bastırmaya devam ederek şırıngalar birbirinden ayrılır. NOT: Formülasyon içinde küçük hava kabarcıkları kalacaktır. Bu kabul edilebilir bir durumdur ve enjeksiyonu takiben depo oluşumu üzerinde hiçbir negatif etkisi yoktur. Steril iğne, Şırınga B'ye takılır.
5. Ürün, artık derialtı yoluyla hastaya uygulanmaya hazırdır.
6. Karıştırıldıktan hemen sonra uygulanmalıdır.
7. Yalnızca tek kullanım içindir. Kullanılmayan tüm çözelti atılmalıdır.
yr ngaHiArviAi^»ri||p
mam-
Kapak L>'ıçnKro&n
^mCı* S'lUn h*B«anyıı ■.oluna iİ3iUrlbnlıT+^liı İVfc
^'TfL LiiiiKr« nk> J V ^möiaVJnfcı
i. prtnp»
İınr>g« &'nk> maa pampahokM
leuprorelinin ortalama kararlı durum dağılım hacmi 27 litre olarak saptanmıştır. İn vitro olarak insan plazma proteinlerine bağlanma oranı %43 ila %49 arasında değişmektedir.
Biyotransformasyon:Hiçbir ilaç metabolizması çalışması yapılmamıştır.
Eliminasyon:Sağlıklı erkek gönüllülerde, intravenöz yolla bolus şeklinde uygulanan 1 mg'lık leuprorelin asetat dozunun ortalama sistemik klerensinin 8,34 L/saat ve iki bölümlü bir model temel alınarak terminal eliminasyon yarılanma ömrünün yaklaşık 3 saat olduğu gösterilmiştir.
İlacın kullanım şekli, subkütanöz yolla derialtı enjeksiyon şeklinde olduğundan, leuprorelin asetat ile atılım araştırmaları yapılmamıştır.
Doğrusallık /doğrusal olmayan durum :Uygulama yöntemi nedeniyle geçerli değildir.
5.3 Klinik öncesi güvenlilik verileri
Leuprorelin asetat ile yapılan klinik öncesi araştırmalarda, bilinen farmakolojik özelliklerine dayanarak üreme sistemi üzerinde beklenen etkiler elde edilmiştir. Leuprorelin asetat teratojenisite göstermemiştir. Tavşanlarda embriyotoksisite/letalite gözlenmiştir.
Karsinojenisite araştırmaları
Karsinoj eni site araştırmaları sıçanlar ve fareler üzerinde yapılmıştır. Sıçanlarda, 0,6 ila 4 mg/kg/gün şeklindeki dozların derialtı yoluyla uygulanmasından sonra, hipofiz adenomlarında dozla bağlantılı bir artış gözlenmiştir. Farelerde bu tip bir etki gözlenmemiştir.
Mutajenisite araştırmaları
Leuprorelin asetat ve ilgili bir aylık ürün ELIGARD, in vitro ve in vivo olarak yürütülen bir dizi analizde mutajenik bulunmamıştır.
6. FARMASÖTİK ÖZELLİKLERİ:
6.1 Yardımcı maddelerin listesi:
Poli (DL-laktik-ko-glikolik asit)
N-Metilpirolidon
6.2 Geçimsizlikler
Şırınga B'de bulunan leuprorelin, yalnızca şırınga A'daki çözücü ile karıştırılmalı ve diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü.
24 aydır.
Tablalardan birinin açılmasını takiben, toz ve çözücü hemen kullanıma hazırlanmalı ve hastaya verilmelidir. Mikrobiyolojik açıdan, steril çözücü ile kullanıma hazırlanan ürün hemen uygulanmalıdır.
6.4 Saklamaya yönelik özel tedbirler
Buzdolabında (2°C-8°C arasındaki sıcaklıklarda) ve orijinal ambalajında saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız.
6.5 Ambalajın niteliği ve içeriği
İki polipropilen şırınga vardır; Şırınga A çözücü ve Şırınga B toz içerir. İki şırınga birlikte bir karışım sistemi meydana getirir.
Şırınga A termoplastik kauçuk pistona sahiptir ve polietilen veya polipropilen Luer-Lok kapakla kapatılmıştır. Şırınga B'nin kabı ve iki piston ucu bromobutil kauçuktan imal edilmiştir.
Karton kutu, iki adet termoform tabla bulunan bir kitten oluşur. Bir tabla, kullanıma hazır polipropilen Şırınga A, büyük piston ve desikant poşet içerir. Diğer tabla, kullanıma hazır polipropilen Şırınga B, bir adet 20 ölçek 12.5 mm steril iğne ve bir adet silikon desikant poşet içerir.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.
Kullanıma hazırlama:
İki steril önceden doldurulmuş şırınga derialtı enjeksiyon yoluyla hastaya uygulanmadan hemen önce karıştırılmalıdır. Karıştırma işlemi aşağıdaki şekilde gerçekleştirilir:
1. Kullanımdan önce ürünün oda sıcaklığına gelmesi beklenir. Dış tabla açılır ve içindekiler temiz bir alana boşaltılır (Şırınga A ve Şırınga B'yi içeren iki tabla).
2. Şırınga A ve Şırınga B tablaları açıldıktan sonra, Şırınga B'den (liyofilize leuprorelin asetat) ikincil tıpa ve kısa piston çubuğu çıkarılır. Uzun piston çubuğu diğer Şırınga B tıpasına bağlanır.
3. Şırınga A'nın (enjeksiyonluk çözelti için çözücü içinde sıvı polimer) başlığı ve şırınga B'nin (liyofilize leuprorelin asetat) başlıkları çıkarılır ve şırıngalar sımsıkı birleştirilir. Şırıngalar arası geçişi sağlamak ve homojen bir çözelti elde etmek için 60 kez ileri ve geri iyice sallayarak karıştırılır. Çözelti, iyice karıştırıldığında berrak, açık ila koyu sarımsı kahverengi renkli bir görünüm alacaktır.
4. İçerik Şırınga B içine aktarılır. Şırınga A pistonuna kuvvetle aşağıya bastırmaya devam ederek şırıngalar birbirinden ayrılır. NOT: Formülasyon içinde küçük hava kabarcıkları kalacaktır. Bu kabul edilebilir bir durumdur ve enjeksiyonu takiben depo oluşumu üzerinde hiçbir negatif etkisi yoktur. Steril iğne, Şırınga B'ye takılır.
5. Ürün, artık derialtı yoluyla hastaya uygulanmaya hazırdır.
6. Karıştırıldıktan hemen sonra uygulanmalıdır.
7. Yalnızca tek kullanım içindir. Kullanılmayan tüm çözelti atılmalıdır.
yr ngaHiArviAi^»ri||p
mam-
Kapak L>'ıçnKro&n
^mCı* S'lUn h*B«anyıı ■.oluna iİ3iUrlbnlıT+^liı İVfc
^'TfL LiiiiKr« nk> J V ^möiaVJnfcı
i. prtnp»

İınr>g« &'nk> maa pampahokM
İlacın kullanım şekli, subkütanöz yolla derialtı enjeksiyon şeklinde olduğundan, leuprorelin asetat ile atılım araştırmaları yapılmamıştır.
Doğrusallık /doğrusal olmayan durum :Uygulama yöntemi nedeniyle geçerli değildir.
5.3 Klinik öncesi güvenlilik verileri
Leuprorelin asetat ile yapılan klinik öncesi araştırmalarda, bilinen farmakolojik özelliklerine dayanarak üreme sistemi üzerinde beklenen etkiler elde edilmiştir. Leuprorelin asetat teratojenisite göstermemiştir. Tavşanlarda embriyotoksisite/letalite gözlenmiştir.
Karsinojenisite araştırmaları
Karsinoj eni site araştırmaları sıçanlar ve fareler üzerinde yapılmıştır. Sıçanlarda, 0,6 ila 4 mg/kg/gün şeklindeki dozların derialtı yoluyla uygulanmasından sonra, hipofiz adenomlarında dozla bağlantılı bir artış gözlenmiştir. Farelerde bu tip bir etki gözlenmemiştir.
Mutajenisite araştırmaları
Leuprorelin asetat ve ilgili bir aylık ürün ELIGARD, in vitro ve in vivo olarak yürütülen bir dizi analizde mutajenik bulunmamıştır.
6. FARMASÖTİK ÖZELLİKLERİ:
6.1 Yardımcı maddelerin listesi:
Poli (DL-laktik-ko-glikolik asit)
N-Metilpirolidon
6.2 Geçimsizlikler
Şırınga B'de bulunan leuprorelin, yalnızca şırınga A'daki çözücü ile karıştırılmalı ve diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü.
24 aydır.
Tablalardan birinin açılmasını takiben, toz ve çözücü hemen kullanıma hazırlanmalı ve hastaya verilmelidir. Mikrobiyolojik açıdan, steril çözücü ile kullanıma hazırlanan ürün hemen uygulanmalıdır.
6.4 Saklamaya yönelik özel tedbirler
Buzdolabında (2°C-8°C arasındaki sıcaklıklarda) ve orijinal ambalajında saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız.
6.5 Ambalajın niteliği ve içeriği
İki polipropilen şırınga vardır; Şırınga A çözücü ve Şırınga B toz içerir. İki şırınga birlikte bir karışım sistemi meydana getirir.
Şırınga A termoplastik kauçuk pistona sahiptir ve polietilen veya polipropilen Luer-Lok kapakla kapatılmıştır. Şırınga B'nin kabı ve iki piston ucu bromobutil kauçuktan imal edilmiştir.
Karton kutu, iki adet termoform tabla bulunan bir kitten oluşur. Bir tabla, kullanıma hazır polipropilen Şırınga A, büyük piston ve desikant poşet içerir. Diğer tabla, kullanıma hazır polipropilen Şırınga B, bir adet 20 ölçek 12.5 mm steril iğne ve bir adet silikon desikant poşet içerir.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.
Kullanıma hazırlama:
İki steril önceden doldurulmuş şırınga derialtı enjeksiyon yoluyla hastaya uygulanmadan hemen önce karıştırılmalıdır. Karıştırma işlemi aşağıdaki şekilde gerçekleştirilir:
1. Kullanımdan önce ürünün oda sıcaklığına gelmesi beklenir. Dış tabla açılır ve içindekiler temiz bir alana boşaltılır (Şırınga A ve Şırınga B'yi içeren iki tabla).
2. Şırınga A ve Şırınga B tablaları açıldıktan sonra, Şırınga B'den (liyofilize leuprorelin asetat) ikincil tıpa ve kısa piston çubuğu çıkarılır. Uzun piston çubuğu diğer Şırınga B tıpasına bağlanır.
3. Şırınga A'nın (enjeksiyonluk çözelti için çözücü içinde sıvı polimer) başlığı ve şırınga B'nin (liyofilize leuprorelin asetat) başlıkları çıkarılır ve şırıngalar sımsıkı birleştirilir. Şırıngalar arası geçişi sağlamak ve homojen bir çözelti elde etmek için 60 kez ileri ve geri iyice sallayarak karıştırılır. Çözelti, iyice karıştırıldığında berrak, açık ila koyu sarımsı kahverengi renkli bir görünüm alacaktır.
4. İçerik Şırınga B içine aktarılır. Şırınga A pistonuna kuvvetle aşağıya bastırmaya devam ederek şırıngalar birbirinden ayrılır. NOT: Formülasyon içinde küçük hava kabarcıkları kalacaktır. Bu kabul edilebilir bir durumdur ve enjeksiyonu takiben depo oluşumu üzerinde hiçbir negatif etkisi yoktur. Steril iğne, Şırınga B'ye takılır.
5. Ürün, artık derialtı yoluyla hastaya uygulanmaya hazırdır.
6. Karıştırıldıktan hemen sonra uygulanmalıdır.
7. Yalnızca tek kullanım içindir. Kullanılmayan tüm çözelti atılmalıdır.
yr ngaHiArviAi^»ri||p
mam-
Kapak L>'ıçnKro&n
^mCı* S'lUn h*B«anyıı ■.oluna iİ3iUrlbnlıT+^liı İVfc
^'TfL LiiiiKr« nk> J V ^möiaVJnfcı
i. prtnp»

İınr>g« &'nk> maa pampahokM
Kapak L>'ıçnKro&n
^mCı* S'lUn h*B«anyıı ■.oluna iİ3iUrlbnlıT+^liı İVfc
i. prtnp»

İınr>g« &'nk> maa pampahokM
|
i |
nFi |
i |
|
1 |
1 |
M |
7. RUHSAT SAHİBİ:
Astellas Pharma İlaç Ticaret ve Sanayi A.Ş.
Tekstilkent Koza Plaza A Blok Kat: 16 No: 60 34235 Esenler, İstanbul Tel : 0212 440 08 00
Faks : 0212 438 36 71
8. RUHSAT NUMARASI:
12.03.2009 - 127/6
9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ:
İlk ruhsat tarihi: 12.03.2009 Ruhsat yenileme tarihi: -
10. KÜB'ÜN YENİLENME TARİHİ
İlaç Bilgileri
Eligard 7.5 mg Enjeksiyonluk Çözelti Için S.C. Toz Içeren Şırınga ve Çözücü Içeren Şırınga
Etken Maddesi: Leuprorelin asetat
Atc Kodu: L02AE02
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.