Glokoprost %0.005 Göz Damlası Kısa Ürün BilgisiDuyu Organları » Göze Uygulanan İlaçlar » Göz Tansiyonu İlaçları (Glokom) ve Miyotikler » Prostaglandin Analogları » Latanoprost KISA URUN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIGLOKOPROST % 0.005 Göz Damlası2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Her bir mililitrede 50 mikrogram latanoprost.Yardımcı maddeler:Her bir mililitrede 0.2 mg benzalkonyum klorür, 4.6 mg sodyum dihidrojen fosfat monohidrat, 4.74 mg disodyum fosfat anhidr ve 4.1 mg sodyum klorür.Diğer yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTIK FORMGöz damlasıBerrak, renksiz, partikülsüz çözelti4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarGLOKOPROST, açık açılı glokom ve oküler hipertansiyonu olan hastalarda artmış intraoküler basıncın düşürülmesinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresiÖnerilen tedavi şekli günde bir kez, hasta göz(ler)e bir damla damlatılmasıdır.Optimal etki GLOKOPROST akşamları uygulandığında elde edilir.Klinik çalışmalar GLOKOPROST'un tek dozluk tedavisinin etkin olduğunu göstermiştir. Kombine kullanımı ile ilgili klinik çalışmalar tam kesinlik kazanmamış olsa da, 3 aylık bir çalışma, Latanoprost'un beta-adrenerjik antagonistleriyle (Timolol) kombinasyonunun etkili olduğunu göstermiştir. Kısa süreli çalışmalar (1 veya 2 hafta), Latanoprost'un adrenerjik agonistler (Dipivalil,Epinefrin) oral karbonik anhidraz inhibitörleri (Asetazolamid) ile kombinasyonunun aditif, ve kolinerjik agonistlerle (Pilokarpin) ise kısmen aditif etkileri olduğunu düşündürmektedir. Birden fazla oftalmik ilaç tedavisi kullanılması durumunda, tatbik edilecek her iki ilacın göze damlatılmaları arasında en az 5 dakika zaman aralığı olmalıdır.Günde bir defadan daha sık yapılan uygulamaların ilacın intraoküler basıncı düşürücü etkisini azalttığı görüldüğünden, GLOKOPROST'un önerilen günlük tatbik sayısı günde 1 defadan fazla olmamalıdır.Uygulama şekli:Bütün göz damlalarında olduğu gibi, sistemik emilimi azaltmak için, gözün burnun kenarındaki kısmına bastırılarak, gözyaşı kanallarının bir dakika süreyle bloke edilmesi önerilir. Bunun damlanın damlatılmasından hemen sonra yapılması gerekmektedir.İlaç uygulanmadan önce kontakt lensler çıkarılmalıdır. Uygulamadan 15 dakika sonra tekrar takılabilir.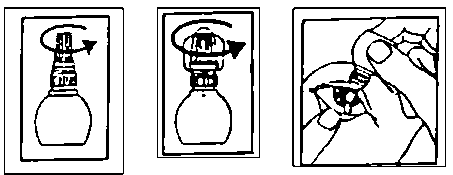 GLOKOPROST'un kullanımı ile ilgili bilgiler1. Şişenin koruyucu dış kapağını çevirerek çıkartınız.2. Şişenin iç kapağını döndürerek açınız.3. Parmağınızın uç bölümünü kullanarak, hasta gözünüzün alt göz kapağını aşağıya doğru yavaşça çekiniz.4. Damlatıcının ucunu gözünüze yaklaştırıp damlatıcıyı yavaşça sıkınız ve gözünüze sadece bir damla damlatınız.5. Şişenin iç kapağı ile şişeyi kapatınız.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Özel bir uygulama gerekmemektedir.Pediyatrik popülasyon:Latanoprostun çocuklardaki etkinlik ve güvenilirliği değerlendirilmemiştir. Bu nedenle çocuklarda kullanımı önerilmez.Geriyatrik popülasyon:Özel bir uygulama gerekmemektedir.4.3. KontrendikasyonlarLatanoprost'a veya GLOKOPROST'un bileşiminde bulunan maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleri Latanoprost iris içindeki kahverengi pigmenti artırarak göz rengini tedricen değiştirebilir. Bu etki özellikle mavi-kahverengi, gri-kahverengi, yeşil-kahverengi veya sarı-kahverengi gibi karma renkli irisleri olanlarda daha çok görülür ve iristeki stromal melanositlerin melanin içeriğinin artmasına bağlıdır. Etkilenen gözde pigmentasyon tipik olarak merkezden perifere doğru olur ve iris daha kahverengi veya daha koyu görünebilir. İki yıl boyunca tedavi gören hastaların katıldığı klinik çalışmalarda, homojen mavi, gri, yeşil veya kahverengi irislerde bu tür değişiklikler nadiren görülmüştür.İrisin rengindeki değişiklik yavaş yavaş meydana gelir ve aylarca veya yıllarca farkına varılamayabilir. Yapılan klinik çalışmalarda, söz konusu renk değişikliği herhangi bir semptom ya da patolojik değişiklikle ilişkilendirilememiştir. Tedavi kesildikten sonra renk değişikliği ilerlememektedir, ancak o ana kadar oluşan değişiklikler kalıcı olabilmektedir.Latanoprost ile yapılan çalışmalarda, iristeki renk değişikliğinin genellikle tedavinin ilk 8 haftası içinde ortaya çıktığı görülmüştür. Nadiren tedavinin iki veya üçüncü yılında görülmüş ve tedavinin dördüncü ve beşinci yıllarında ortaya çıkmamıştır.Uzun süreli çalışmalardan sonuç elde edilene kadar, karma renkli irise sahip hastalarda, Latanoprost ile uygulama ancak diğer göz içi basıncını düşüren ilaçlara tahammülsüzlük gösteren veya yeterli cevap alınamayan vakalarda tavsiye edilir.Tedavi, iristeki ben ya da benekleri etkilemez.Klinik çalışmalarda, ön kamaranın trabeküler ağında ya da başka bir yerinde pigment birikimine rastlanmamıştır, ancak, irisin pigmentasyonu hakkında daha uzun süreli deneyimler elde edilmedikçe, hastalar düzenli olarak kontrol edilmeli ve iris pigmentasyonunda artış olduğunda klinik durum değerlendirilerek gerekirse tedavi kesilmelidir.Tedavi başlatılmadan önce hastalar gözlerinin renginde bir değişiklik olabileceği konusunda bilgilendirilmelidir. Tek taraflı tedavide kalıcı heterokromi oluşabilir.Latanoprostun kronik kapalı açılı glokom, psödofakik hastalardaki açık açılı glokom ve pigmenter glokomda kullanımı ile ilgili deneyim sınırlıdır. Latanoprost enflamatuar ve neovasküler glokom, oküler enflamasyon durumları veya konjenital glokomda denenmemiştir. Latanoprostun pupile etkisi çok az veya hiç yoktur, ancak kapalı açılı glokom krizinde denenmemiştir. Bu nedenle, daha fazla deneyim sağlanana kadar, latanoprostun bu endikasyonlarda dikkatli kullanılması önerilir.Latanoprost ile tedavi sırasında kistoid maküla ödemi de kapsayan, maküler ödem olguları rapor edilmiştir. Bu raporlar esas olarak afakik hastalarda, posterior lens kapsül yırtığı olan psödofakik hastalarda veya maküler ödem için risk faktörü olduğu bilinen hastalarda görülmüştür. Latanoprost bu tip hastalarda dikkatle kullanılmalıdır. Latanoprost göz damlalarında sıklıkla kullanılan bir koruyucu olan benzalkonyum klorür içerir. Bu maddenin keratik çökelti ve/veya toksik keratopatiye neden olabildiği rapor edilmiştir ve gözlerde irritasyona neden olabilir. Ayrıca bu maddenin yumuşak kontakt lenslerin renklerini kaybetmesine neden olduğu bilinmektedir. Göz kuruluğu olan veya korneayı ilgilendiren durumları olan hastalarda latanoprostun sık veya uzun süreli kullanılması durumunda hastanın yakından izlenmesi gereklidir. Benzalkonyum klorür kontakt lensler tarafından absorbe edilebildiğinden, kontakt lensler Latanoprost damlatılmadan önce çıkarılıp, damlatıldıktan en az 15 dakika sonra tekrar kullanılabilir. Katarakt cerrahisinin peri-operatif döneminde latanoprost kullanımı ile ilgili sınırlı veri bulunmaktadır. Latanoprost bu hastalarda dikkatle kullanılmalıdır. İrit veya üveit için predispozan faktörleri olduğu bilinen hastalarda Latanoprost dikkatle kullanılmalıdır. Astım hastalarında kullanımı ile ilgili veriler sınırlıdır, ancak pazarlama sonrası deneyimde bazı vakalarda astım alevlenmesi ve/veya dispne rapor edilmiştir. Bu nedenle, astım hastalarında dikkatli kullanılmalıdır. Latanoprost tedavi edilen göz ve çevresindeki kirpik ve kaşlarda değişimlere neden olabilir. Yavaş yavaş gelişen bu değişimler arasında uzunluk, kalınlık, pigmentasyon, kirpik veya kaşlardaki kıl sayısı ve kirpiklerin doğal olmayan yönlere doğru büyümesi sayılabilir. Bu değişiklikler tedavinin kesilmesinden sonra ortadan kalkar.4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriLatanoprost'un göz içi basıncını düşürücü etkisinin, beta-adrenerjik antagonistler (Timolol), adrenerjik agonistler (Dipivalil, Epinefrin), karbonik anhidraz inhibitörleri (Asetazolamid) ve en azından kısmi olarak da kolinerjik agonistlerle (Pilokarpin) aditif olduğu kısa süreli klinik çalışmalarda gösterilmiştir.Latanoprost bir prostaglandin agonistidir.İki prostaglandin analoğunun birlikte uygulanmasının ardından göz içi basıncında paradoksik yükselmelerin ortaya çıktığını gösteren raporlar mevcuttur. Bu nedenle, iki ya da daha fazla prostaglandin, prostaglandin analoğu veya prostaglandin türevinin birlikte kullanılması önerilmemektedir.İn vitro olarak yapılan çalışmalar, Tiomersal içeren göz damlalarının Latanoprost ile karıştırılması sonucu çökeltiler oluşabileceğini göstermiştir. Bu tür göz damlaları Latanoprost ile birlikte kullanıldığında, damlaların en az 5 dakika aralıklarla uygulanması gerekir.Özel popülasyonlara ilişkin ek bilgilerHerhangi bir etkileşim çalışması yapılmamıştır.Pediyatrik popülasyon:Herhangi bir etkileşim çalışması yapılmamıştır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)GLOKOPROST'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.GLOKOPROST, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Gebelik dönemiLatanoprostun gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.Latanoprost, insanlara uygulanan dozdan yaklaşık 100 misli yüksek dozda, intravenöz olarak tavşanlara uygulandığında, geç rezorpsiyon, düşük ve fetus ağırlığında düşüş gibi anlamlı embriyo-fetal toksisite belirtilerinin artışına neden olabilmektedir. Teratojenik potansiyele sahip olduğu görülmemiştir.Bununla beraber, gebe kadınlarla yapılmış yeterli ve iyi kontrollü çalışma yoktur.GLOKOPROST, gebelikte yalnızca mutlak gerekli olduğu durumlarda (potansiyel yararları, fetusa yönelik potansiyel riskten fazla olduğunda) kullanılmalıdır.Laktasyon dönemiLatanoprostun insanda anne sütüne geçip geçmediğine dair yapılmış yeterli ve iyi kontrollü çalışma olmadığı için emzirme döneminde kullanılmamalıdır.Ureme yeteneği/FertiliteHayvan çalışmalarında latanoprostun erkek veya dişi fertilitesine bir etkisi görülmemiştir. Sıçanlarda intravenöz latanoprost ile (5, 50 ve 250 mcg/kg/gün) embriyotoksik etki ortaya çıkmamıştır. Bununla beraber, latanoprost 5 mcg/kg/gün ve üzerindeki dozlarda tavşanlarda embriyoletal etki oluşturmuştur.4.7. Araç ve makine kullanımı üzerindeki etkilerTüm diğer göz preparatlarında olduğu gibi, GLOKOPROST'un da göze damlatılması geçici görme bulanıklıklarına yol açabilir. Araç veya makine kullanılırken bu durum göz önünde bulundurulmalıdır.4.8. istenmeyen etkilerPotansiyel klinik etkisi bulunan istenmeyen etkiler aşağıda sistem organ sınıfına göre listelenmiştir.Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Göz bozukluklarıÇok yaygın:İriste pigmentasyon artışı, hafif - orta şiddetli konjunktival hiperemi, gözde iritasyon (yanma, batma, kaşıntı ve gözde yabancı cisim hissi), göz kapağı üstündeki ayva tüylerinin koyulaşması, kalınlaşması ve uzaması ve sayısında artışYaygın:Çöküntülü epitel hasarı, blefarit, göz ağrısı Yaygın olmayan:Göz kapağında ödem, göz kuruluğu, keratit, görmede bulanıklık, konjunktivit Seyrek:İritis/uveit, maküler ödem, semptomatik korneal ödem ve erozyonlar, periorbital ödem, yanlış yönlü kirpiklerin göze batarak iritasyona neden olması, distikiyazKardiyak bozukluklarÇok seyrek:Daha önceden hastalığı olan kişilerde anjinanın şiddetlenmesiSolunum, göğüs ve mediyastinal sistemi hastalıklarıSeyrek:Astım, astımın alevlenmesi, akut astım atakları ve dispneDeri ve deri altı doku hastalıklarıYaygın olmayan:Deri döküntüsüSeyrek:Göz kapağında reaksiyon, göz kapağının palpebral derisinin koyulaşmasıGenel bozukluklar ve uygulama bölgesine ilişkin bozukluklar Çok seyrek:Göğüs ağrısıPazarlama sonrası deneyim:Sinir sistemi bozukluklarıSeyrek:Baş ağrısı, baş dönmesiKardiyak bozukluklarSeyrek:PalpitasyonlarKas iskelet sistemi bozukluklarıSeyrek:Miyalji, artralji4.9. Doz aşımı ve tedavisiGLOKOPROST aşırı dozda verildiğinde, göz iritasyonu ve konjunktiva hiperemisi dışında göze ait herhangi bir yan etki oluşturmamaktadır.GLOKOPROST'un yanlışlıkla ağızdan alınması durumunda, aşağıdaki bilgiler faydalı olabilmektedir:Bir şişe GLOKOPROST 125 mcg Latanoprost içerir. Bunun %90'dan fazlası karaciğerden ilk geçişte metabolize olur. Sağlıklı gönüllülere intravenöz olarak verilen 3 mcg/kg Latanoprost her hangi bir belirti oluşturmamıştır, ancak 5.5-10 mcg/kg'lık dozlar, bulantı, karın ağrısı, baş dönmesi, yorgunluk, sıcak basmaları ve terlemeye neden olmuştur.Orta derecede bronşial astımı olan hastalara Latanoprost'un klinik kullanım dozunun 7 katı verildiğinde bile, solunum sistemi, kalp atışı veya kan basıncı üzerine belirgin etkisi olmamıştır. GLOKOPROST'un aşırı dozda alımı söz konusu olduğunda, tedavi semptomatik olmalıdır.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup:Prostaglandin analogları ATC kodu: S01EE01Bir prostaglandin F2a analoğu olan Latanoprost, aköz hümörün dışarıya akışını artırarak göz içi basıncını azaltan selektif bir prostanoid FP reseptör agonistidir. Hayvanlar ve insanlarda yapılan çalışmalar basınç düşürücü etkinin ana mekanizması olarak, uveoskleral dışa akımın artması olduğunu göstermiştir. İnsanlarda yapılan çalışmalarda bu mekanizmaya ek olarak, aköz hümörün dışa akımı kolaylaştırıcı faktörlerin etkisini artırdığı (dışa akım direncinin azalması) gözlenmiştir. İnsanlarda göz içi basıncını düşürücü etkisi 3-4 saatte başlar ve maksimum etki 8-12 saat sonra ortaya çıkar. Basıncı düşürücü etki en az 24 saat süreyle devam eder.Önemli çalışmalar Latanoprost'un tek başına tedavide etkin olduğunu göstermiştir. Kombine kullanımı ile ilgili klinik çalışmalar tam kesinlik kazanmamış olsa da, 3 aylık bir çalışma Latanoprost'un beta-adrenerjik antagonistleriyle (Timolol) kombinasyonunun etkili olduğunu göstermiştir. Kısa süreli çalışmalar (1 veya 2 hafta), Latanoprost'un adrenerjik agonistler (Dipivalil, Epinefrin), oral karbonik anhidraz inhibitörleri (Asetazolamid) ile kombinasyonunun aditif, kolinerjik agonistlerle (Pilokarpin) ise kısmen aditif etkileri olduğunu düşündürmektedir.Klinik çalışmalar, Latanoprost'un aköz hümörun üretiminde herhangi bir etkisinin olmadığını göstermiştir. Latanoprost'un kan-aköz bariyeri üzerine de herhangi bir etkisi söz konusu değildir. Topikal uygulama sırasında az ya da orta derecede bir konjunktival veya episkleral hiperemi ortaya çıkabilmektedir.Psödofakik hastalarda uygulanan kısa süreli Latanoprost tedavisi sonucunda arka segmente herhangi bir fluoresein sızması söz konusu olmamıştır.Klinik dozlarda Latanoprost, kardiyovasküler veya solunum sistemi üzerinde belirgin herhangi bi r farmakolojik etki yaratmamıştır.5.2. Farmakokinetik özellikler Genel özelliklerKimyasal yapısı bir izopropilester olan Latanoprost bir ön ilaçtır, bu hali ile etkili değildir, ancak hidroliz sonucu asit formuna dönüşen Latanoprost biyolojik olarak aktif hale geçer.Emilim:Prodrug Latanoprost, korneadan kolayca absorbe edilir ve aköz hümöre geçen ilacın tamamı, korneayı geçerken hidrolize olur.İnsanlarda yapılan çalışmalar, ilacın, topikal olarak uygulanmasından 2 saat sonra, aköz hümörde maksimum konsantrasyonuna eriştiğini göstermektedir.Dağılım:İnsanlarda, plazma yarı-ömrü 17 dakikadır. Başlıca ön segmentte, konjuktiva ve göz kapaklarında dağılır.Biyotransformasyon:Pratik olarak, Latanoprostun aktif hali olan asit formunun göz içinde herhangi bir metabolizması söz konusu değildir. Asıl metabolizma karaciğerde oluşur.Eliminasyon:Başlıca metabolitleri 1,2-dinor ve 1, 2, 3, 4-tetranordur. Hayvan çalışmalarında, biyolojik aktivitesi olmayan ya da çok az olan başka metabolitleri olduğu ve başlıca idrarla atıldığı gösterilmiştir.Doğrusallık/doğrusal olmayan durum:Herhangi bir çalışma yürütülmemiştir.5.3. Klinik öncesi güvenilirlik verileriLatanoprostun oküler ve sistemik etkileri birçok havyan türünde araştırılmıştır. Genel olarak, latanoprost klinik oküler dozu ve sistemik toksisitesi arasında en az 1000 kat olan güven aralığı ile iyi tolere edilir. Anestezi altında olmayan şempanzelere intravenöz yoldan yüksek doz, doz/vücut ağırlığına göre klinik dozun 100 katı, uygulanmış ve kısa sürede solunum hızının arttığı görülmüştür Bunun olasılıkla bronkokonstrüksiyondan kaynaklandığı düşünülmüştür.Tavşan ve maymunlarda 100 mcg/göz/gün'e varan dozlarda (klinik doz yaklaşık olarak 1.5 mcg/göz/gün'dür) gözlerde bir toksik etki görülmemiştir. Bununla beraber maymunlarda, latanoprostun irisin pigmentasyonunu artırdığı tespit edilmiştir.Pigmentasyonun iristeki melanositlerin melanin üretimlerinin uyarılmasıyla arttığı düşünülmektedir. Proliferatif bir değişiklik gözlenmemiştir. İris rengindeki değişiklik kalıcı olabilir.Kronik oküler toksisite çalışmalarında, 6 mcg/göz/gün latanoprost uygulamasının palpebral fisürün artışını indüklediği görülmüştür. Bu etki geri dönüşümlüdür ve klinik dozların üstünde doz uygulamasıyla ortaya çıkar. İnsanlarda bu etki görülmemiştir.Latanoprost bakterilerde ters mutasyon testinde, fare lenfomasında gen mutasyonu ve fare mikronükleus testlerinde negatif bulunmuştur. İnsan lenfositlerinde in vitro olarak kromozom abresyonları gözlenmiştir. Benzer etkiler doğal bir prostaglandin olan prostaglandin F2a ile de ortaya çıkmıştır ve bunların sınıf etkisi olduğunu göstermektedir.Sıçanlarda yapılan in vitro/in vivo ek mutajenik etki çalışmalarında latanoprostun mutajenik potansiyeli olmadığı görülmüştür. Fare ve sıçanlarda yapılan karsinojenik etki çalışması negatif bulunmuştur.Hayvan çalışmalarında latanoprostun erkek veya dişi fertilitesine bir etkisi görülmemiştir. Sıçanlarda intravenöz latanoprost ile (5, 50 ve 250 mcg/kg/gün) embriyotoksik etki ortaya çıkmamıştır. Bununla beraber, latanoprost 5 mcg/kg/gün ve üzerindeki dozlarda tavşanlarda embriyoletal etki oluşturmuştur.Teratojenik potansiyel gözlenmemiştir.6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiBenzalkonyum klorürMonobazik sodyum fosfat, monohidratDisodyum fosfat, anhidrSodyum klorürEnjeksiyonluk su6.2. GeçimsizliklerGeçerli değil.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirlerAçılmamış şişeler 2-8 °C arasında ışıktan korunarak saklanmalıdır.Şişeler açıldıktan sonra oda sıcaklığında 6 hafta boyunca veya 2-8 °C arasında 3 ay boyunca saklanmalıdır. Bu süre sonunda kullanılmamış ilaç kalmış olsa bile, ilacı atınız.6.5. Ambalajın niteliği ve içeriğiGLOKOPROST % 0.005 göz damlası, 2.5 ml göz damlası çözeltisi içeren ve LDPE damlalık ve HDPE emniyet halkalı vidalı kapaktan oluşan LDPE şişelerde ambalajlanır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖzel bir gereklilik yoktur.Madde 4.2'ye bakınız.Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.7. RUHSAT SAHIBIGENERİCA İLAÇ SAN. VE TİC. LTD. ŞTİ. 34394 Mecidiyeköy-İSTANBUL Tel : 0 212 213 63 25 - 26 Faks: 0 212 213 53 248. RUHSAT NUMARASI(LARI)127/739. ILK RUHSAT TARIHI/RUHSAT YENILEME TARIHIİlk ruhsat tarihi: 13.05.2009 Ruhsat yenileme tarihi: -10. KUB'UN YENILENME TARIHI |
İlaç BilgileriGlokoprost %0.005 Göz DamlasıEtken Maddesi: Latanoprost Atc Kodu: S01EE01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.