Oftomix Göz Damlası Kısa Ürün BilgisiDuyu Organları » Göze Uygulanan İlaçlar » Göz Tansiyonu İlaçları (Glokom) ve Miyotikler » Beta Blokerler » Timolol Maleat Kombinasyonları KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIOFTOMİX göz damlası2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her mL'si, 20 mg dorzolamide eşdeğer 22.26 mg dorzolamid hidroklorür, 5 mg timolole eşdeğer 6.83 mg timolol maleat içerir.Yardımcı maddeler:Her mL'si 0.075 mg benzalkonyum klorür içerir.Sodyum hidroksit ve mannitol için bkz. 4.4. Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMGöz damlası, çözelti.Berrak, renksiz, hafif viskoz çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarOFTOMİX, oküler hipertansiyonu, açık açılı glokomu, psödoeksfolyatif glokomu ya da diğer sekonder açık açılı glokomu olan hastalarda, kombine tedavinin uygun olduğu durumlarda, yükselmiş intraoküler basıncın (İOB) tedavisinde endikedir.4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Etkilenmiş göz(ler)e günde iki kez bir damla OFTOMİX.Başka bir topikal oftalmik ajan kullanılıyorsa, OFTOMİX ve diğer ajan, aralannda en az 10 dakikalık bir süre olacak şekilde uygulanmalıdır. Başka oftalmik antiglokom ajan(lar)m yerine OFTOMİX başlanacağı zaman, diğer ajan(lar) bir günlük uygun dozdan sonra kesilir ve bunu izleyen gün OFTOMİX başlanır. Uygulama şekli:OFTOMİX göze uygulanır.OFTOMİX'i kullanmadan önce ellerinizi yıkayınız. Kullanım için aşağıdaki şekilde hareket ediniz: Kapağı açınız (Şekil 1). İlk uygulamada kapağın altındaki halkayı atınız (Şekil 2). Kapağı tekrar tamamen ve sıkıca vidalayınız (Şekil 3). Böylece damlalıktaki zar delinir ve damlalık akmaya başlar. Şişeyi baş ve orta parmaklannız arasında tutarak ters çeviriniz. Ters çevrilmiş şişenin üzerine işaret parmağınız ile bir kerede uygulayacağınız hafif basınç ile OFTOMİX'in bir damlası akacaktır (Şekil 4). Kafanızı hafifçe geriye doğru yatırınız. Göz kapağı ve gözünüz arasında bir kese oluşacak kadar parmağınızla alt göz kapağınızı aşağı doğru çekiniz. Damlanın oluşan kese içine damlatılması gerekmektedir (Şekil 5). Damlalık ucunu göze yaklaştınnız. Eğer yardımcı olacaksa bir ayna kullanınız. Damlalığı gözünüze, göz kapağınıza, gözünüzün etrafındaki yüzeylere veya diğer yüzeylere değdirmeyiniz. Değdirirseniz, damlalığa mikroorganizmalar bulaşabilir. OFTOMİX'i damlattıktan sonra alt göz kapağınızı yavaşça serbest bırakınız, gözünüzü kapatınız ve göz-burun arası bölgeye bir parmağınız ile hafifçe bastırınız (Şekil 6). Bu önlem OFTOMİX'in vücudun diğer bölgelerine yayılımını önleyecektir. Eğer damlayı iki gözünüze de kullanmanız gerekiyorsa yukandaki adımları diğer gözünüz için de tekrarlayınız. Eğer damla gözünüze gelmezse tekrar deneyiniz. Kullandıktan sonra OFTOMİX'in kapağını sıkıca kapatınız. Gözünüz için kullandığınız başka bir ilaç daha varsa, her iki ilaç uygulaması arasında 10-15 dakikalık ara veriniz. Damlalığın ucu sadece bir damla damlatılması için ayarlanmıştır, damlalığın ucunu genişletmeye çalışmayınız. 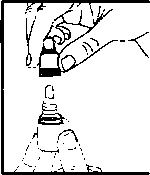 M
M"¦/ Şekil 1 FT^rrm?'  Şekil 5
Şekil 5
Şekil 2
Şekil 6 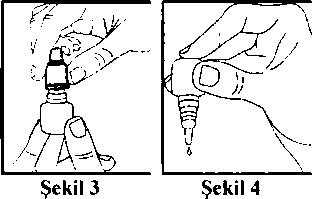 Hastalara aynı zamanda göze uygulanan çözeltiler dikkatli uygulanmadığı takdirde oküler enfeksiyonlara sebep olan sıradan bakterilerle kontamine olabileceği ve sonuçta gözlerde ciddi hasar ve buna bağlı olarak görme kaybı yaşanabileceği hakkında bilgi verilmelidir. Kontakt Lens Kullananlarda;Damlanın göze damlatılmasından önce lensler çıkartılmalı ve damla kullanıldıktan sonra en az 15 dakika yeniden takılmamalıdır. Özel popülasyoniara ilişkin ek bilgiler:Böbrek yetmezliği:OFTOMİX ile ileri derecede böbrek yetmezliği (kreatinin klerensi <30 mL/dk) olan hastalarda çalışma yapılmamıştır. Dorzolamid esas olarak böbrekler yoluyla atıldığından, OFTOMİX bu hastalar için önerilmemektedir.Karaciğer yetmezliği:OFTOMİX ile karaciğer yetmezliği olan hastalarda çalışma yapılmamıştır ve bu nedenle bu hastalarda dikkatle kullanılmalıdır.Pediyatrik popülasyon:Pediyatrik hastalarda etkinlik ile ilgili yapılmış çalışma yoktur. 2 yaş altı pediyatrik hastalarda güvenlilik incelenmemiştir (> 2 ile <6 yaş arası pediyatrik hastaların güvenliliği ile ilgili bilgi için bkz. bölüm 5.1.)Geriyatrik popülasyon:OFTOMİX ile geriyatrik hastalarda yapılmış çalışma yoktur.4.3. KontrendikasyonlarOFTOMİX, Bronşiyal astımı veya bronşiyal astım öyküsü olan ya da şiddetli kronik obstrüktif akciğer hastalığı olan hastalarda, Sinüs bradikardisi, ikinci ya da üçüncü derece atriyoventriküler bloğu, belirgin kalp yetmezliği, kardiyojenik şoku olan hastalarda, Ciddi renal yetmezlik (kreatinin klerensi <30 mL/dk) veya hiperkoloremik asidoz, Bu ürünün herhangi bir bileşenine karşı aşırı duyarlılığı olan hastalarda kontrendikedir. Yukarıda sözü geçen kontrendikasyonlar kombinasyona özgü olmayıp, ürünün bileşenlerine aittir. 4.4. Özel kullanım uyarıları ve önlemleriKardiyo-respiratuvar reaksiyonlarDiğer topikal olarak uygulanan oftalmik ajanlarla olduğu gibi, bu ilaç da sistemik olarak absorbe olabilir. İlacın timolol bileşeni bir beta-blokördür. Bu nedenle beta-blokörlerin sistemik uygulanması sonrasında görülen Prinzmetal anj inanın kötüleşmesi, ciddi periferal ve merkezi dolaşım hastalıklannm kötüleşmesi ve hipotansiyon dahil istenmeyen reaksiyonlar, topikal uygulama sonrasında da ortaya çıkabilir. Timolol maleat bileşeni nedeniyle, OFTOMİX ile tedaviye başlamadan önce kalp yetmezliği uygun bir şekilde kontrol altına alınmış olmalıdır. Şiddetli kalp hastalığı öyküsü olan hastalarda, kalp yetmezliği bulguları açısından dikkatli olunmalı ve nabız kontrol edilmelidir. Timolol maleat uygulanması sonrasında astımlı hastalarda bronkospazma bağlı ölüm ve nadiren kalp yetmezliğiyle ilişkili ölüm dahil olmak üzere respiratuvar ve kardiyak reaksiyonlar bildirilmiştir. İmmünoloji ve aşın duyarlılık Diğer topikal olarak uygulanan oftalmik ajanlarla olduğu gibi, bu ilaç da sistemik olarak absorbe olabilir. İlacın dorzolamid bileşeni bir sülfonamiddir. Bu nedenle sülfonamidlerin sistemik uygulanması sonrasında görülen istenmeyen etkiler (Stevens-Johnson sendromu ve toksik epidermal nekroliz gibi) topikal uygulanma ile ortaya çıkabilir. Ciddi reaksiyonlar ya da aşırı duyarlılık bulguları ortaya çıkarsa, bu preparatm kullanılmasına son verilmelidir. Dorzolamid hidroklorür göz damlası ile benzer lokal oküler istenmeyen etkiler dorzolamid hidroklorür-timolol maleat göz damlası ile de gözlemlenmiştir. Bu tür reaksiyonlar meydana gelirse OFTOMİX uygulamasının sonlandırılması düşünülebilir. Atopi öyküsü olan ya da çeşitli aleıjenlere karşı ileri derecede anafılaktik reaksiyon öyküsü olan hastalar beta-blokör alırlarken, bu alerjenlerle gerek rastlantı eseri, gerekse tanı ya da tedavi amaçlı nedenlerle tekrarlayan karşılaşmalarda daha da reaktif hale gelebilirler. Bu hastalar, anafılaktik reaksiyonlann tedavisinde kullanılan alışılmış adrenalin dozlarına yanıt vermeyebilir. Eş zamanlı tedavi Aşağıdaki eş zamanlı tedaviler önerilmemektedir: Dorzolamid ve oral karbonik anhidraz inhibitörleri Topikal beta-adrenerjik blokör ajanlar Tedavinin kesilmesi Sistemik beta-blokörlerle olduğu gibi, koroner kalp yetmezliği olan hastalarda oftalmik timolol tedavisinin kesilmesine gerek duyulursa, tedavi kademeli olarak kesilmelidir. Beta-blokörlerin diğer etkileri Beta-blokörler ile tedavi, hipoglisemisi veya diabetes mellitusu olan hastalarda hipogliseminin başlıca belirtilerini maskeleyebilir. Beta-blokörler ile tedavi, hipertiroidizmin başlıca belirtilerini maskeleyebilir. Beta-blokör tedavisinin birdenbire kesilmesi belirtilerin daha da kötüleşmesine yol açabilir. Beta-blokörler ile tedavi, miyastenia gravisin belirtilerini kötüleştirebilir. Karbonik anhidraz inhibitörlerinin diğer etkileri Oral karbonik anhidraz inhibitörleriyle tedavi, özellikle daha önceden böbrek taşlan gelişme eğilimi olan hastalarda asit-baz bozukluklanna bağlı olarak ürolitiyazis ile ilişkili bulunmuştur. Dorzolamid hidroklorür-timolol maleat göz damlası ile hiç asit-baz bozukluğu gözlenmemiş olmasına karşın, ürolitiyazis nadiren bildirilmiştir. OFTOMİX sistemik olarak emilen topikal bir karbonik anhidraz inhibitörü içerdiğinden, daha önce böbrek taşı öyküsü olan hastalar OFTOMİX kullanırken ürolitiyazis geçirme riskinde artış yaşanabilir. Diğer Akut açı kapanması glokomu olan hastaların tedavisi, oküler hipotansif ajanlara ek olarak başka terapötik girişimler de gerektirir. Dorzolamid hidroklorür-timolol maleat göz damlası ile akut açı kapanması glokomu olan hastalarda çalışma yapılmamıştır. Daha önceden kronik kornea defektleri olan ve/veya dorzolamid kullanımı sırasında bir intraoküler cerrahi operasyon geçirmiş hastalarda kornea ödemi ve geri dönüşsüz kornea dekompansasyonu bildirilmiştir. Bu tip hastalarda topikal dorzolamid dikkatli kullanılmalıdır. Aköz supresan tedavi uygulamasıyla birlikte fıltrasyon prosedürü sonrasında oküler hipotoni ile birlikte koroid aynlması bildirilmiştir. Diğer antiglokom ilaçlarının kullanımında olduğu gibi, bazı hastalarda uzun süreli tedaviden sonra oftalmik timolol maleata yanıtta azalma bildirilmiştir. Ancak 164 hastanın en az üç yıl takip edildiği klinik çalışmalarda başlangıçtaki stabilizasyondan sonra ortalama intraoküler basınçta anlamlı fark bulunmamıştır. Biyolojik test ile etkileşimler Dorzolamid hidroklorür-timolol maleat göz damlası, klinik olarak anlamlı elektrolit bozukluklarıyla ilişkili bulunmamıştır. Yardımcı maddeler; Sodyum hidroksit: Kullanım yolu (oküler) nedeniyle herhangi bir uyarı gerekmemektedir. Mannitol: Kullanım yolu (oküler) nedeniyle herhangi bir uyarı gerekmemektedir. Benzalkonyum klorür: Gözde irritasyona sebebiyet verebilir. Yumuşak kontakt lenslerle temasından kaçınınız. Uygulamadan önce kontakt lensi çıkartınız ve lensi takmak için en azından 15 dakika bekleyiniz. Yumuşak kontakt lenslerin renklerinin bozulmasına neden olduğu bilinmektedir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriOFTOMİX ile spesifik ilaç etkileşim çalışmaları yapılmamıştır.Klinik çalışmalarda dorzolamid hidroklorür-timolol maleat göz damlası, hiçbir etkileşim olmaksızın sistemik olarak kullanılan aşağıdaki ilaçlarla birlikte kullanılmıştır: ADE-inhibitörleri, kalsiyum kanal blokörleri, diüretikler, aspirin de dahil olmak üzere non-steroid anti-inflamatuvar ilaçlar ve hormonlar (örn. östrojen, insülin, tiroksin). Bununla birlikte, timolol maleat oftalmik çözeltisinin oral kalsiyum kanal blokörleri, katekolamin depolarını boşaltan ilaçlar ya da beta-adrenerjik bloke edici ajanlar, antiaritmikler (amiodaron dahil), digital glikozitleri, parasempatomimetikler, narkotikler ve monoamin oksidaz (MAO) inhibitörleri ile birlikte kullanılması halinde aditif etki ve hipotansiyon ve/veya belirgin bradikardinin oluşma potansiyeli bulunmaktadır. CYP2D6 inhibitörleri (örn. kinidin, SSRIs) ve timolol ile kombine tedavi sırasında, sistemik beta-blokör etkide artış (örn. kalp hızında yavaşlama, depresyon) bildirilmiştir. OFTOMİX tek başına pupilla büyüklüğüne çok az etki eder ya da hiç etmez. Bazen timolol maleat oftalmik çözeltisi ve epinefrin (adrenalin) birlikte kullanımında midriyazis rapor edilmiştir. Beta-blokörler antidiyabetik ajanlann hipoglisemik etkisini arttırabilir. Oral beta-adrenerjik bloke edici ajanlar klonidinin bırakılmasını takiben görülen rebaund hipertansiyonu arttırabilir. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C.Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)OFTOMİX için, gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir.Gebelik dönemiOFTOMİX gebelik dönemi boyunca kullanılmamalıdır.Dorzolamid Gebelik döneminde dorzolamide maruz kalımla ilgili yeterli klinik veri yoktur. Tavşanlarda dorzolamid anne için toksik dozlarda teratojenik etkilere yol açmıştır (bkz, bölüm 5.3.). Timolol Sistemik beta-blokörlerle yapılan iyi kontrollü epidemiyolojik çalışmalar teratojenik etkilere ilişkin hiçbir bulgu göstermemiştir ancak fetuslarda veya yeni doğanlarda bradikardi gibi bazı farmakolojik etkiler gözlenmiştir. OFTOMİX doğuma kadar uygulanırsa, yeni doğan yaşamın ilk birkaç gününde dikkatle takip edilmelidir. Laktasyon dönemiDorzolamidin anne sütüne geçip geçmediği bilinmemektedir. Dorzolamid verilen emziren sıçanlarda yavrunun kilo alımında azalma gözlenmiştir. Timolol anne sütüne geçer. OFTOMİX tedavisi gerekliyse, emzirme önerilmemektedir.Üreme yeteneği/FertiliteHem timolol maleat hem de dorzolamid hidroklorür ile sıçanlarda yapılan üreme ve fertilite çalışmalarında insanda önerilen maksimum oftalmik dozun yaklaşık 100 katı sistemik maruz kalım erkek ve dişi fertilitesi üzerine hiçbir istenmeyen etki göstermemiştir.4.7. Araç ve makine kullanımı üzerindeki etkilerAraç veya makine kullanma becerisine etkileri inceleyen hiçbir çalışma yapılmamıştır. Bulanık görme gibi olası yan etkiler bazı hastaların araç veya makine kullanma becerisini etkileyebilir.4.8. İstenmeyen etkilerKlinik çalışmalarda dorzolamid hidroklorür-timolol maleat göz damlasına spesifik hiçbir istenmeyen olay gözlenmemiştir; istenmeyen olaylar daha önce, dorzolamid hidroklorür ve/veya timolol ile bildirilenlerle sınırlı olmuştur.Klinik çalışmalarda 1035 hasta dorzolamid hidroklorür-timolol maleat göz damlası ile tedavi edilmiştir. Tüm hastaların yaklaşık % 2.4'ü lokal oküler istenmeyen reaksiyonlar nedeniyle tedavisini bırakmıştır; tüm hastalann yaklaşık % l.2'si tedaviyi aleiji veya aşırı duyarlılığı (göz kapağı enflamasyonu ve konjunktivit) gösteren lokal istenmeyen reaksiyonlar nedeniyle bırakmıştır. Aşağıdaki istenmeyen reaksiyonlar klinik çalışmalarda veya pazarlama sonrası deneyimde dorzolamid hidroklorür-timolol maleat göz damlası veya bileşenlerinden biriyle bildirilmiştir: [Çok yaygın (>1/10); yaygın (>l/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10000 ila <1/1000)] Sinir sistemi bozukluklarıDorzolamid hidroklorür göz damlası, çözelti:Yaygın: Baş ağrısı* Seyrek: Baş dönmesi*, parestezi* Timolol maleat göz damlası, çözelti: Yaygın: Baş ağrısı* Yaygın olmayan: Baş dönmesi*, depresyon* Seyrek: Uykusuzluk*, kabus görme*, hafıza kaybı, parestezi*, miyastenia gravis belirtilerinde artış, libidoda düşüş*, serebrovasküler hastalık* Göz bozukluklarıDorzolamid hidroklorür-timolol maleat göz damlası:Çok yaygın: Yanma ve batma hissi Yaygın: Konjunktivada kızarıklık, bulanık görme, kornea erozyonu, gözde kaşıntı, göz yaşarması Dorzolamid hidroklorür göz damlası, çözelti: Yaygın: Göz kapağı iltihaplanması*, göz kapağı irritasyonu* Yaygın olmayan: İridosiklit* Seyrek: Kızarıklık dahil kaşıntı*, ağrı*, göz kapağının kabuk kaplaması*, geçici miyopluk (tedavi kesilince bu yan etki görülmüyor), korneada ödem*, oküler hipotoni*, koroidal ayrılma (filtrasyon cerrahisinin ardından)* Timolol maleat göz damlası, çözelti: Yaygın: Blefarit dahil oküler iltihaplanmanın belirtileri*, keratit*, kornea duyarlılığında azalma ve göz kuruluğu* Yaygın olmayan: Işığın kırılma değişiklikleri dahil görme bozukluklan (bazı vakalarda miyotik tedavilerin kesilmesinden kaynaklanan) Seyrek: Pitozis, diplopi, koroidal aynima (filtrasyon cerrahisinin ardından)* Kulak ve iç kulak hastalıklarıTimolol maleat göz damlası, çözelti:Seyrek: Kulak çınlaması* Kardiyak bozukluklarTimolol maleat göz damlası, çözelti:Yaygın olmayan: Bradikardi*, senkop* Seyrek: Hipotansiyon*, göğüs ağnsı*, çarpıntı*, ödem*, aritmi*, konjestif kalp yetmezliği*, kalp bloğu*, kalp krizi*, serebral iskemi, topallama, Raynaud fenomeni*, ayak ve ellerin soğuması* Solunum, göğüs bozuklukları ve mediastinal hastalıklarıDorzolamid hidroklorür-timolol maleat göz damlası:Yaygın: Sinüzit Seyrek: Nefes darlığı, solunum yetersizliği, rinit Dorzolamid hidroklorür göz damlası, çözelti: Seyrek: Burun kanaması* Timolol maleat göz damlası, çözelti: Yaygın olmayan: Dispne* Seyrek: Bronkospazm (özellikle bronkospastik hastalığa sahip olan hastalarda), öksürük* Gastrointestinal bozukluklarDorzolamid hidroklorür-timolol maleat göz damlası:Çok yaygın: Tat almada bozukluk Dorzolamid hidroklorür göz damlası, çözelti: Yaygın: Bulantı1 Seyrek: Boğazda kaşıntı, ağız kuruluğu* Timolol maleat göz damlası, çözelti: Yaygın olmayan: Bulantı*, dispepsi* Seyrek: Diyare, ağız kuruluğu* Deri ve deri altı doku hastalıklarıDorzolamid hidroklorür-timolol maleat göz damlası:Seyrek: Kontakt dermatit, Stevens-Johnson sendromu*, toksik epidermal nekroliz* Dorzolamid hidroklorür göz damlası, çözelti: Seyrek: Kızarıklık* Timolol maleat göz damlası, çözelti: Seyrek: Alopesi*, psöriyaziform kızanklık veya psöriyazisin şiddetlenmesi Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıTimolol maleat göz damlası, çözelti:Seyrek: Sistemik lupuz eritematozus Böbrek ve idrar hastalıklarıDorzolamid hidroklorür-timolol maleat göz damlası:Yaygın olmayan: Ürolitiyaz Üreme sistemi ve meme hastahklarıTimolol maleat göz damlası, çözelti:Seyrek: Peyronie hastalığı* Genel bozukluklar ve uygulama bölgesine ilişkin bozukluklarDorzolamid hidroklorür-timolol maleat göz damlası:Seyrek: Anjiyoödem dahil sistemik alerjik reaksiyonların belirtileri, ürtiker, pruritus, kızarıklık, anafılaksi, nadiren bronkospazm Dorzolamid hidroklorür göz damlası, çözelti: Yaygın: Asteni/yorgunluk* Timolol maleat göz damlası, çözelti: Yaygın olmayan: Asteni/yorgunluk* 4.9. Doz aşımı ve tedavisiİnsanlarda OFTOMİX'in yanlışlıkla ya da bilerek aşırı dozda ağızdan alındığı durumlara ait veriler mevcut değildir.Semptomlar: Timolol maleat oftalmik çözeltinin dikkatsizlik sonucunda aşırı dozda kullanılmasının, baş dönmesi, baş ağnsı, nefes darlığı, bradikardi, bronkospazm ve kardiyak arest gibi sistemik beta-adrenerjik bloke edici ajanlarla görülen etkilere benzer sistemik etkilerle sonuçlandığına dair bildirimler bulunmaktadır. Dorzolamidin aşırı dozda alınması sonucunda en sık beklenecek semptom ve bulgular; elektrolit dengesizliği, asidoz ve olası merkezi sinir sistemi etkileridir. İnsanlarda dorzolamid hidroklorürün kasıtlı veya kasıtsız alınmasına bağlı doz aşımı hakkında sınırlı bilgiler vardır. Oral kullanımda uyku hali bildirilmiştir. Topikal uygulamada aşağıdaki olaylar bildirilmiştir: Bulantı, baş dönmesi, baş ağrısı, yorgunluk, anormal rüyalar ve disfaji. Tedavi: Tedavi semptomatik ve destekleyici olmalıdır. Serum elektrolit düzeyleri (özellikle potasyum) ve kan pH düzeyleri izlenmelidir. Çalışmalar, timololün iyi diyaliz edilmediğini göstermektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Oftalmik karbonik anhidrazı inhibe eden bir ilaç ile oftalmik beta-blokör bir ilacın kombinasyonudur.ATC kodu: S01ED51 Etki mekanizması OFTOMİX iki bileşenden oluşmaktadır: Dorzolamid hidroklorür ve timolol maleat. Her iki bileşen de aköz hümör salgılanmasını azaltarak yükselmiş intraoküler basıncı azaltır, ancak bu etkilerini farklı etki mekanizmalarıyla gösterir. Dorzolamid hidroklorür, insan karbonik anhidrazı Il'nin güçlü bir inhibitörüdür. Gözün siliyer proseslerindeki karbonik anhidrazın inhibisyonu, olasılıkla sodyum ve sıvı transportunda bir azalma ile sonuçlanacak bikarbonat iyonu oluşmasını yavaşlatarak aköz hümör salgılanmasını azaltır. Timolol maleat nonselektif bir beta-adrenerjik reseptör bloke edici ajandır. Timolol maleatın intraoküler basıncı düşüren kesin etki mekanizması şu anda tam olarak aydınlatılmamıştır ancak bir floresan çalışması ve tonografı çalışmaları baskın etkinin azalmış aköz oluşumuyla ilgili olabileceğini göstermektedir. Bununla birlikte, bazı çalışmalarda dışa akış kolaylığında hafif bir artış da gözlenmiştir. Bu iki ajanın kombine etkileri, her bir bileşenin tek başına, ayn ayrı uygulandığı durumlarla karşılaştırıldığında intraoküler basınçta ek bir azalmayla sonuçlanmaktadır. Topikal uygulama sonrasında, OFTOMİX, glokomla ilişkili olsun ya da olmasın, yükselmiş intraoküler basıncı düşürür. Yükselmiş intraoküler basınç, optik sinir hasarı ve glokoma bağlı görme alanı kaybının patogenezinde majör bir risk faktörüdür. OFTOMİX, gece körlüğü. akomodatif spazm ve pupilla konstriksiyonu gibi, miyotiklerin sık rastlanan yan etkileri olmaksızın intraoküler basıncı düşürür. Farmakodinamisi Klinik etkiler: Günde iki kez (sabah-akşam) uygulanan dorzolamid hidroklorür-timolol maleat göz damlasının intraoküler basıncı düşürücü etkisini, birlikte tedavinin uygun bulunduğu glokomlu ya da oküler hipertansiyonlu hastalarda tek başlarına ya da eş zamanlı uygulanan % 0.5 timolol ve % 2.0 dorzolamid ile karşılaştırmak amacıyla 15 aya kadar süren çalışmalar yürütülmüştür. Burada hem tedavi edilmemiş, hem de timolol monoterapisi ile tam olarak kontrol altına alınamamış hastalar çalışmaya dahil edilmişlerdir. Hastaların büyük bir kısmı çalışmaya katılmadan önce topikal beta-blokör monoterapisi ile tedavi edilmişlerdir. Günde iki kez uygulanan dorzolamid hidroklorür-timolol maleat göz damlasının (koruyucu içeren formülasyon) intraoküler basıncı düşürücü etkisi, günde üç kez uygulanan % 2'lik dorzolamid ya da günde iki kez uygulanan % 0.5'lik timolol monoterapileriyle elde edilen etkilerden daha fazla bulunmuştur. Günde iki kez verilen dorzolamid hidroklorür-timolol maleat göz damlasının (koruyucu içeren formülasyon) intraoküler basıncı düşürücü etkisi, günde iki kez uygulanan dorzolamid ve günde iki kez uygulanan timololün eş zamanlı tedavisiyle görülen etkiye eşdeğerdir. Günde iki kez uygulanan dorzolamid hidroklorür-timolol maleat göz damlasının (koruyucu içeren formülasyon) intraoküler basıncı gün boyunca düşürücü etkisi gösterilmiş ve bu etki uzun süreli uygulama boyunca devam etmiştir. Pediyatrik kullanım % 2'lik dorzolamid hidroklorür oftalmik çözeltisinin 6 yaş altı çocuklardaki güvenliliği 3 aylık kontrollü bir çalışma ile yürütülmüştür. Bu çalışmada, dorzolamid veya timolol ile monoterapide intraoküler basıncı yeterince kontrol edilemeyen 6 yaş altı ve >2 yaşlarında 30 hasta dorzolamid hidroklorür-timolol maleat göz damlasını açık etiketli fazda almıştır. Bu hastalarda etkinlik incelenmemiştir. Bu küçük hasta grubunda; günde 2 defa uygulanan dorzolamid hidroklorür-timolol maleat göz damlası genellikle iyi tolere edilmiş, 19 hasta tedavi sürecini tamamlamış ve 11 hasta operasyon, ilaç tedavisinin değişmesi veya başka nedenlerden dolayı tedaviye devam edememiştir. 5.2. Farmakokinetik özelliklerDorzolamid hidroklorürEmilim:Oral karbonik anhidraz inhibitörlerinin tersine, dorzolamid hidroklorürün topikal yoldan uygulanması, ilacın etkilerini son derece düşük dozlarda doğrudan göz içinde göstermesine ve dolayısıyla sistemik maruz kalmanın daha az olmasına olanak tanımaktadır. Klinik çalışmalarda, bu durum, oral karbonik anhidraz inhibitörlerine özgü elektrolit değişiklikleri veya asit-baz bozuklukları olmaksızın intraoküler basınçta bir azalmaya yol açmıştır. Dağılım:Topikal olarak uygulandığında, dorzolamid sistemik dolaşıma ulaşmaktadır. Topikal uygulamanın ardından sistemik karbonik anhidraz (KA) inhibisyonu potansiyelini belirlemek amacıyla, eritrosit ve plazmadaki ilaç ve metabolit konsantrasyonlan ve eritrositlerdeki karbonik anhidraz inhibisyonu ölçülmüştür. Dorzolamid kronik doz uygulaması sırasında KA-Il'ye selektif bağlanmanın bir sonucu olarak eritrositlerde birikirken, plazmada son derece düşük serbest ilaç konsantrasyonları sağlanmaktadır. Bivotransformasyon:Ana ilaç tek bir N-desetil metaboliti oluşturmaktadır; bu, KA-IPyi ana ilaçtan daha az etkili olarak inhibe etmekle birlikte, daha az aktif olan izoenzimi (KA-I) de inhibe etmektedir. Metabolit de eritrositlerde birikmekte ve temel olarak KA-I'e bağlanmaktadır. Dorzolamidin plazma proteinlerine bağlanması orta düzeydedir (yaklaşık % 33). Eliminasvon:Dorzolamid başlıca idrar yoluyla değişmeden atılır; metaboliti de idrar yoluyla atılır. Doz uygulaması bittikten sonra, dorzolamid eritrositlerden doğrusal olmayan şekilde temizlenir ve bu da başlangıçta ilaç konsantrasyonunda hızlı bir düşüşe yol açar, bunu yaklaşık 4 aylık bir yarılanma ömrü ile daha yavaş bir eliminasyon fazı izler. Dorzolamid uzun süreli topikal oküler uygulamadan sonraki maksimum sistemik maruz kalımı yansıtan şekilde oral yolla uygulandığında kararlı duruma 13 haftada ulaşılmıştır. Bu amaçla plazma ve alyuvarlardaki (RBC) etkin madde ve metabolit konsantrasyonu ile RBC'deki karbonik anhidraz düzeyleri ölçülmüştür. Kararlı durumda plazmada neredeyse hiç serbest etkin madde veya metabolit bulunmamıştır; RBC'lerde KA (karbonik anhidraz) inhibisyonu böbrek fonksiyonu veya solunum üzerinde farmakolojik etki oluşturmak için yeterli olduğu düşünülenden daha azdır. Benzer farmakokinetik sonuçlar dorzolamid hidroklorürün kronik, topikal uygulanmasından sonra da gözlenmiştir. Ancak böbrek fonksiyon bozukluğu olan (hesaplanan kreatin klerensi 30-60 mL/dak) bazı yaşlı hastalann RBC'lerinde metabolit konsantrasyonlan daha yüksektir fakat karbonik anhidraz inhibisyonunda anlamlı farklılık olmadığı gibi klinik yönden anlamlı sistemik yan etkilerin hiçbiri bu bulguyla doğrudan ilişkili değildir. Timolol maleatEmilim:Plazma ilaç konsantrasyonu çalışmalarında, % 0.5'lik timolol maleat oftalmik çözeltisinin günde iki kez uygulanması sonrasında timolole sistemik olarak maruz kalma oranları belirlenmiştir. Sabah dozunu izleyen ortalama doruk plazma konsantrasyonu 0.46 ng/mL ve öğleden sonraki dozu izleyen ortalama doruk plazma konsantrasyonu da 0.35 ng/mL olarak belirlenmiştir. Dağılım:Timolol plazma proteinlerine çok az oranda bağlanmakta olup, plasenta ve süte geçer. Plazma yarı-ömrü 4 saat olarak bildirilmiştir. Sistemik dolaşıma karışan miktarları ile ilgili herhangi bir veri bulunmamaktadır. Bivotransformasyon:Timolol büyük oranda karaciğerde metabolize edilir. Eliminasvon:Metabolitleri bazı değişmemiş timolol ile birlikte idrarla atılır. Timolol hemodiyaliz ile uzaklaştınlamaz. 5.3. Klinik öncesi güvenlilik verileriHer bileşenin oküler ve sistemik emniyet profilleri tamamıyla ortaya konmuştur.Dorzolamid Tavşanlarda dorzolamid anneye toksik dozda verildiğinde metabolik asidozun eşlik ettiği, vertebral bölümde malformasyonlar görülmüştür. Timolol Hayvan çalışmalannda teratojenik etki göstermemiştir. Ayrıca dorzolamid hidroklorür ve timolol maleat oftalmik çözeltisiyle topikal olarak tedavi edilen ya da dorzolamid hidroklorür ve timolol maleatm eş zamanlı uygulandığı hayvanlarda göze ait hiç bir istenmeyen yan etki görülmemiştir. Her bir bileşenle yapılan in vitroin vivoçalışmalar mutajenik potansiyeli göstermemiştir. Bu nedenle, OFTOMİX'in terapötik dozlarıyla, insan güvenliği açısından anlamlı risk beklenmemektedir.6. FARMASÖTİK ÖZELLİKLER6.L Yardımcı maddelerin listesiMannitolHidroksietil selüloz Sodyum sitrat dihidrat Sodyum hidroksit (pH ayarlayıcı) Benzalkonyum klorür (% lO'luk çözeltisi) Enjeksiyonluk su 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında, ışıktan korunarak saklanır. Şişeyi karton ambalajında saklayınız.OFTOMİX, kapağı açıldıktan sonra 4 hafta içinde kullanılmalıdır. 6.5. Ambalajın niteliği ve içeriğiKutuda, beyaz polipropilen kapaklı, kendinden damlalıklı, şeffaf, LDPE şişede 5 mL çözelti ve kullanma talimatı ile birlikte sunulmaktadır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atık Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrol Yönetmeliği ne uygun olarak imha edilmelidir.7. RUHSAT SAHIBIBİLİM İLAÇ SAN. ve TİC. A.Ş.34398 Şişli-İSTANBUL 8. RUHSAT NUMARASI248/409. RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 13.02.2013 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ1Bu istenmeyen etkiler dorzolamid hidroklorür-timolol maleatm pazarlama sonrası deneyimlerinde de görülmüştür. |
İlaç BilgileriOftomix Göz DamlasıEtken Maddesi: Dorzolamid HCl Timolol maleat Atc Kodu: S01ED51 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.