Ferplex Fol Oral Solüsyon Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Anemi (Kansızlık) İlaçları » Demir Eksikliği İlaçları 1. BEŞERI TIBBI ÜRÜNÜN ADIFERPLEX FOL oral solüsyon2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Her bir 15 ml'lik flakon etken madde olarak 40 mg. Fe1+ (üç değerlikli demir)'e eşdeğer demir proteinsüksinilat ve rezervuarlı kapak içerisinde, bastırmakla çözelti içerisine giren (0.185 mg. folinik asit'e eşdeğer) 0.235 mg. kalsiyum folinat pentahidrat içerir.Yardımcı maddeler:Sorbitol E420 1.400 mgSodyum sakarin 0.015 g Metil parahidroksibenzoat sodyum tuzu E219 0.045 g Propil parahidroksibenzoat sodyum tuzu E217 0.015 g Mannitol E421 99.8 mg Propilen g likol 1000 mgYardımcı maddeler için 6.1.'e bakınız. 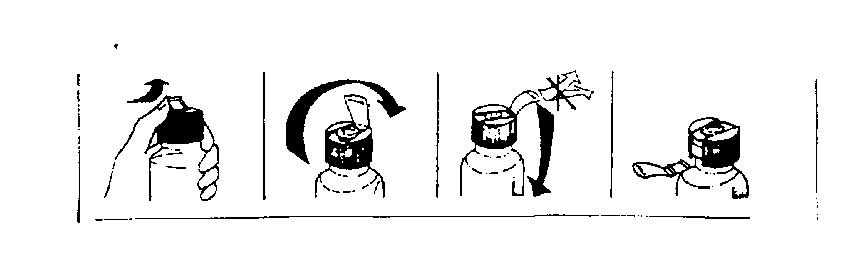
Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:
Flakon üzerindeki koruyucu kapak kuvvetlice ileriye itilip kaldırıldıktan sonra kapağın tam ortasındaki hazneli kısım kuvvetlice aşağıya bastırılır ve flakon iyice çalkalanır. Daha sonra kapak açılıp su ile ya da direkt olarak flakondan içilir. FERPLEX, ciddi karaciğer ve böbrek hastalıklarında kullanılmamalıdır. Pediyatrik popülasyonBaşka bir şeklide önerilmediği takdirde 1.5 ml/kg/gün (4 mg/kg/gün Fe3+ ve 0.0235 mg kalsiyum folinate eşdeğer) günden iki veya üç seferde verilebilir.Geriyatrik popülasyonYaşlılardaki uygulama aynen erişkinlerdeki gibidir.4.3. Kontrendikasyonlarİçerdiği maddelerden herhangi birine karşı aşırı duyarlılıkta; hemosiderozis; aplastik, hemolitik veya sideroakrestik anemilerde; kronik pankreatit, hemokromatozisde ve karaciğer sirozunda kullanılmamalıdır. Pernisiyöz anemide eğer B12 vitamini ile beraber uygulanmıyorsa, kullanılmamalıdır.FERPLEX FOL içeriğinde 1.4 mg sorbitol bulunmaktadır. Nadir kalıtımsal früktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.4. Özel kullanım uyarıları ve önlemleriÇocukların ulaşabileceği yerden uzak tutunuz.Demir eksikliği veya demir eksikliği anemisinin temelinde yer alabilecek hastalıklar tespit edilmeli ve bu hastalıklar uygun şekilde tedavi edilmelidir. Ürünün süt proteini içermesinden dolayı, alerjik reaksiyon geliştirebilecek, süt-proteini intoleransi olan bireylerde dikkatle kullanılmalıdır. Tolerans veya bağımlılık riski açısından özel bir uyarı yoktur. Sürekli kanama, menoraji veya hamilelik durumları haricinde tedavi süresi 6aydan uzun olmamalıdır.FERPLEX FOL oral solüsyon içeriğinde, gecikmiş alerjik reaksiyona neden olabilecek parabenler (metil - p - hidroksibenzoat sodyum tuzu, propil - p - hidroksi benzoat sodyum tuzu) bulunmaktadır. Aşağıdaki durumlarda kullanımı dikkatle değerlendirilmelidir : Alkolizm, hepatit, aktif enfeksiyonlar, enterit, kolit, divertikülit ve ülseratif kolit gibi intestinal sistemin inflamatuvar hastalıkları, pankreatit ve peptik ülser. Dışkıda kan aranması için yapılan testler Ferplex Fol kullanımı sırasında yapıldığında yanıltıcı olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDemir türevleri tetrasiklinler, bisfosfonatlar, kinolon grubu antiinfektif ilaçlar, penisilamin, tiroksin, levadopa, karbodopa, alfa-metildopa gibi ajanların emilimini ve biyoyararlanımını azaltabilir. Bu ilaçlar Ferplex Fol uygulamasından en az 2 saat önce veya sonra uygulanmalıdır.Demir emilimi, 200 mg'ın üzerinde askorbik asitin eş zamanlı uygulaması ile artabilmekte veya antiasid kullanımı ile azalabilmektedir. Kloramfenikol demir tedavisine terapötik yabıtı geciktirebilir. H2-reseptör antagonistleri ile eş zamanlı kullanımı sırasında farmakolojik etkileşim rapor edilmemiştir. Bitkiler, süt, kahve ve çay içerisinde yer alan ve demir ile kompleks yapan ajanlar (fosfat, fitat, oksalat gibi) demir emilimini baskılar. Bu tür yiyecek ve içecekler Ferplex Fol uygulamasından en az 2saat önce veya sonra uygulanmalıdır.Bazı antineoplastik ve antilösemik ilaçlar (aminopterin, metotreksat ve diğer pterinik türevleri) folik asidin kompetitif antagonistleri olarak rol oynarlar. Bu nedenle folik asit veya folinik bazlı tüm preparatlar gibi Ferplex Fol uygulanması da neoplastik hastalıklar veya lösemi gibi antifolinik ilaçlarla tedavi gören hastalarda kullanılmamalıdır. Etkinliğin azalmasına yol açabileceğinden sülfamid ve trimetoprim gibi antibakteriyel ajanlarla aynı zamanda uygulanmaması gerekir. Süt ve yumurta ile birlikte kullanılması durumunda demirin emilimi engellenir.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi A' dır.Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)İyi yönetilmiş epidemiyolojik çalışmalar etkin maddenin gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olmadığını göstermektedir.Hamilelikte demir desteği olarak kullanılır. Gebelik dönemiFerplex Fol'un gebelikte kullanımında sakınca yoktur.Laktasyon dönemiFerplex Fol'un emzirme döneminde kullanımında sakınca yoktur.Üreme yeteneği/ FertiliteÜreme yetenegi üzerine herhangi bir etkisi bulunmamaktadır.4.7. Araç ve makine kullanımı üzerindeki etkilerFerplex Fol'ün, araç ve makine kullanımı üzerine etkisi bildirilmmiştir.4.8. İstenmeyen etkilerİlaca bağlı olduğu kabul edilen advers reaksiyonlar aşağıda listelenmiştir:Yaygınlık şu şekilde tanımlanır: çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 11.0001100110.00011000110000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Bağışıklık sistemi hastalıklarıBilinmiyor: Alerjik belirtilerGastrointestinal hastalıklarSeyrek: Diyare, bulantı, epigastrik ağrıDemir ürünleri dışkı renginin siyah veya koyu griye dönüşmesine neden olabilir. Bu yan etkiler dozun azaltılması veya tedavinin sonlandırılmasıyla geçer. 4.9. Doz aşımı ve tedavisiAkut toksisite çalışmalarında demir proteinsüksinilatın çok iyi tolere edildiği gösterilmiştir; fare ve sıçanlarda oral uygulama sonrası LD50değerleri 4000 mg./kg. üzerindedir.Demirin yüksek dozda alınımını izleyen 6-8saat süresinde hastada abdominal ağrı, bulantı, kusma, diyare ve hematemez görülebilir. Bu semptomlara uyku hali, sararma siyanoz, şok ve koma hali de eşlik edebilir.Ipeka şurubu ile emesis oluşturulur; hasta komatoz ise sodyum bikarbonatla lavaj yapılır. Sıvı ve elektrolit dengesinin sağlanması ve asidoz için i.v. sodyum bikarbonat uygulanır. Antidotu deferoksamindir. Şiddetli vakalarda yavaş i.v. enjeksiyon şeklinde uygulanır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: :Folik asit ile kombine oral demir preparatı; Antianemik ilaç.ATC kodu : B03AD Demir, hemoglobin oluşumunda rol alan, etkin bir eritropoez ve kanın oksijen taşıma kapasitesi için yeterli miktarda alınması gereken esansiyel bir elemandır. Ayrıca, miyoglobulin üretiminde de benzer bir fonksiyona sahip olan demir, birçok esansiyel enzim için de bir kofaktördür. Demir proteinsüksinilat, demir III iyonlarının proteik bir taşıyıcı olan kazeine bağlı olduğu, yarı sentetik bir bileşiktir. Asit ortamda çözünmediğinden demir iyonlarının midede serbest hale geçmesi söz konusu değildir. Bu özelliği ile diğer demir preparatlarından farklı olarak gastrik tolerans önemli ölçüde artmış olup, mukozanın tahrişine bağlı olarak ortaya çıkabilecek bulantı, mide yanması gibi yan etkilerin görülme insidansı son derece düşüktür. Demir proteinsuksinilatın çözünürlüğü pH = 6.5'in üzerine çıkması ve duodenumdaki pankreatik enzimlerin proteik kompleksi parçalaması ile oluşur ve serbest hale geçen demir absorbe olur. 5.2. Farmakokinetik özellikler Genel özelliklerDemir:Emilim:Demir proteinsüksinilatın protein kısmı gastrointestinal sıvılarla sindirilince demir serbestleşerek emilir. Demir proteinsuksinilat başlıca duodenumdan absorbe olur. Demir eksikliği olmayan bireylerde alınan demirin % 3 ile 10'u absorbe olurken, demir eksikliğinde bu oran, yetersizlikle orantılı olarak, % 20 - 30'lara erişir. Dağılım:Hemoglobin'e bağlanma oranı yüksektir. Elimina.syon:Demirin itrahı için herhangi bir fizyolojik sistem bulunmamakla bir likte deri, saç ve tırnaklardan; feçes, terleme, anne sütü (0.5 - 1 mg./gün), menstruel kan ve idrarla, düşük miktarlarda bir kayıp söz konusudur. Ortalama günlük kayıp, erkekler ve postmenopozal kadınlarda 1 mg.; premenopozal kadınlarda ise 1.5 mg.'dır.Folik Asit:Emilim:Serbest folik asit ince barsağın tümü boyunca absorbe edilir. Bununla beraber mideden sonraki ilk 1/3 bölümünde absorpsiyon diğer bölümlerde olduğundan daha hızlıdır. Elimina.syon:Atılım karaciğerden ve böbreklerden olur. Safra içinde barsağa gelen folik asidin bir kısmı reabsorbsiyona uğrar. 5.3. Klinik öncesi güvenlilik verileriAkut Toksisite:50 mL/kg Ferplex Fol oral Solüsyon (2000 mL/kg demir proteinsüksinilat ve 1000 ^g/kg kalsiyum folinat) verilen ratlarda dispne, depresyon, hareketsizliğe yatkınlık belirtileri gözlenmiş ve bu belirtilerin ilacın bırakılmasından 120dakika sonra kaybolduğu bildirilmiştir.Ratlarda LD 50'nin 50 mL/kg (2000 mL/kg demir proteinsüksinilat ve 1000 ^g/kg kalsiyum folinat)'ın üzerinde olduğu gözlenmiştir. Kronik Toksisite:Kronik toksisite çalışmaları 3 grup rat üzerinde yürütülmüştür. 1. grup: 2.5 mL/kg (100 mg demir proteinsüksinilat ve 50 ^g/kg kalsiyum folinata eşdeğer) 2. grup: 1.25 mL/kg ( 50 mg demir proteinsüksinilat ve 50 ^g/kg kalsiyum folinata eşdeğer) 3. grup: kontrol İlaç verilen grup ile kontrol grubu arasında vücut ağırlığı ve genel durum açısından bir farklılık gözlenmemiştir. Ayrıca nekropside ve laboratuvar çalışmalarında her iki grup arasında bir farklılık bulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSorbitolSodyum sakarin Metil parahidroksibenzoat sodyum tuzu Propil parahidroksibenzoat sodyum tuzu Mannitol Propilen glikol Vişne Tadı Sodyum sakarin Saf su 6.2 GeçimsizliklerBilinen bir geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4 Saklamaya yönelik özel tedbirler30 0 C'nin altındaki oda sıcaklığında saklayınız.6.5 Ambalajın niteliği ve içeriği10 x 15 ml. flakonlarda sunulur.6.6 Tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemlerKullanılmamış olan ürünler yada atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİITALFARMACO S.p.A. İtalya lisansı ile,Abdi İbrahim İlaç San. ve Tic. A.Ş. Reşitpaşa mahallesi, Eski Büyükdere Cad. No:4 34467 Maslak /Sarıyer/ İstanbul Tel: 0212 366 84 00 Faks: 0212 276 20 20 8. RUHSAT NUMARASI203/409. İLK RUHSAT TARIHI / RUHSAT YENILEME TARIHIilk ruhsat tarihi: 12.11.2003 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARIHI:1FARMASÖTIK FORMOral solüsyonpH'ı 6.5 ila 8.5 olan berrak, kahverengi çözelti. |
İlaç BilgileriFerplex Fol Oral SolüsyonEtken Maddesi: Demir proteinsüksinilat,kalsiyum folinat Atc Kodu: B03AD Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.