Relenza Rotadisk Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Sistemik Antiviral İlaçlar » Virüslere Karşı Direkt Etkili İlaçlar » Neuraminidaz İnhibitörleri » Zanamivir KISA URUN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIRELENZA Rotadisk2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Her inhalasyonda;Zanamivir (INN)...............................5 mg Yardımcı maddeler:Laktoz monohidrat............................25mgDiğer yardımcı maddeler için (bkz. 6.1) 3. FARMASÖTIK FORMİnhalasyon için toz4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlar Influenza tedavisi:Zanamivir yetişkinlerde ve çocuklarda (7 yaşında veya daha büyük) influenza A ve B'nin her ikisinin de tedavisinde endikedir.Profilaksi:Zanamivir yetişkinlerde ve çocuklarda (5 yaşında veya daha büyük) influenza A ve B'nin her ikisinin de profilaksisinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi: influenza tedavisi: Yetişkinler;Önerilen zanamivir dozu, günlük toplam 20 mg doz inhale edilmesini sağlayacak şekilde beş gün boyunca, günde iki kez ikişer inhalasyondur (2x5mg). Maksimum faydanın sağlanabilmesi için, tedaviye, belirtiler görülmeye başladıktan sonra mümkün olduğu kadar çabuk (tercihan iki gün içinde) başlanmalıdır. Profilaksi: YetişkinlerÖnerilen zanamivir dozu günlük toplam 10 mg doz inhale edilmesini sağlayacak şekilde 10 gün boyunca günde 1 kez iki inhalasyondur (2x5mg). Eğer maruz kalma riski periyodu on günden daha uzun sürecekse uygulama süresi bir aya kadar uzatılabilir. Tam doz profilaksi tedavisi reçete edildiği gibi tamamlanmalıdır. Uygulama şekli:Zanamivir, verilen Diskhaler cihazı kullanılarak sadece oral inhalasyon yolu ile solunum yoluna uygulanır.Zanamivir ile aynı zamanda hızlı etkili bronkodilatörler gibi inhale ilaçları almaları programlanan hastalarda, bu ilacın zanamivirden önce uygulanması önerilmektedir. Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği:Doz modifikasyonu gerekli değildir(bkz.Farmakokinetik özellikler).Karaciğer yetmezliği:Doz modifikasyonu gerekli değildir(bkz.Farmakokinetik özellikler).Pediyatrik popülasyon:Doz modifikasyonu gerekli değildir(bkz.Farmakokinetik özellikler).Geriyatrik popülasyon:Doz modifikasyonu gerekli değildir(bkz.Farmakokinetik özellikler).4.3. KontrendikasyonlarPreparatın bileşenlerinden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir(bkz.Kalitatif ve kantitatif bileşim).4.4. Özel kullanım uyarıları ve önlemleriİnfluenza enfeksiyonuna solunum yollarındaki aşırı yanıt verme artışı eşlik edebilir. İnfluenza tedavisi gören ve bazılarının geçmişinde solunum hastalığı hikayesi bulunmayan hastalarda çok nadir olarak zanamivir kullanımını takiben bronkospazm ve/veya solunum fonksiyonlarında azalma bildirilmiştir. Böyle hastalar zanamivir almayı kesmeli ve medikal değerlendirmeye tabi tutulmalıdır. Solunum hastalığı olan hastalar zanamivir alırken hızlı etkili bir bronkodilatörü hazır bulundurmalıdır(bkz.Pozoloji ve uygulama şekli).Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. influenza, çeşitli nörolojik ve davranışsal semptomlarla ilgili olabilir. Üç post-marketing raporda (çoğunlukla Japonya'dan ve çocuk hastalarda), İnfluenzası olan ve zanamivir alan hastalarda, nöbet, deliryum, halüsinasyonlar ve normal olmayan davranışlar bildirilmiştir. Bu olaylar genellikle hastalığın erken dönemlerinde gözlenmiştir ve sıklıkla ani başlangıç ve hızla sakinleşme şeklindedir. Zanamivirin bu olaylara katkısı tespit edilmemiştir. Eğer nöropskiyatrik semptomlar varsa, tedavinin devam ettirilmesinde her bir hasta için yararların ve risklerin değerlendirilmesi gerekmektedir. 5 yaşın altındaki çocuklarda kullanılmamalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriZanamivir proteinlere bağlanmaz ve karaciğer tarafından metabolize edilmez ya da değişikliğe uğramaz. Klinik olarak anlamlı ilaç etkileşmeleri olası değildir.Özel popülasyonlara ilişkin ek bilgilerVeri yoktur.Pediyatrik popülasyon:Veri yoktur.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C'dirÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelisim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.RELENZA gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gebelik dönemiZanamivirin gebelik sırasında güvenli kullanımı tespit edilmemiştir.Sıçanlar ve tavşanlar üzerinde yapılan reprodüksiyon çalışmaları zanamivirin plasentayı geçtiğini göstermiştir. Sıçanlar üzerinde yapılan çalışmalarda zanamivir uygulamasını takiben teratojenite, fertilite bozukluğu veya klinik olarak anlamlı perinatal veya postnatal gelişim bozukluğu ile ilgili herhangi bir kanıta rastlanmamıştır. Bununla birlikte insanda plasental geçiş konusunda bilgi yoktur. Zanamivir özellikle ilk trimesterde hastaya sağlayacağı olası yararı fetüse olan olası riskinden fazla değilse gebelikte kullanılmamalıdır. Laktasyon dönemiSıçanlarda zanamivirin süt ile atıldığı gösterilmiştir. Bununla birlikte anne sütüne geçmesiyle ilgili veri bulunmamaktadır.Deneyimler sınırlı olduğundan hastaya sağlayacağı olası yararı fetüse olan olası riskinden fazla değilse emziren annelerde zanamivir kullanılmamalıdır. Üreme yeteneği / FertiliteBilinmemektedir.4.7. Araç ve makine kullanımı üzerindeki etkilerBilinmemektedir.4.8. istenmeyen etkiler Klinik çalışma verileriZanamivir oral inhalasyon yoluyla uygulandığında iyi tolere edilmektedir. Yüksek risk altındaki hastalar (yaşlılarda ve kronik bazı tıbbi hastalıkları olan hastalarda) üzerinde yapılan çalışmalar dahil klinik çalışmalarda bildirilen advers olaylar zanamivir ve plasebo grupları arasında benzerdir.Pazarlama sonrası verilerAşağıdaki olaylar zanamivirin ruhsatlandırma sonrası influenza tedavisi için kullanıldığı sırada belirlenmiştir.Sıklık sınıflandırması aşağıdaki gibidir: Çok yaygın >1/10 Yaygın >1/100 ve <1/10 Yaygın olmayan >1.000 ve <1/100 Seyrek >1/10.000 ve <1/1.000 Çok seyrek <1/10.000. Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Bağışıklık sistemi hastalıklarıÇok seyrek: Yüzde veya orofarinkste ödem dahil alerjik tipte reaksiyon.Solunum, göğüs bozuklukları ve mediastinal hastalıklarıÇok seyrek: Bronkospazm, dispne.Deri ve derialtı doku hastalıklarıÇok seyrek: Döküntü, ürtiker.Çok seyrek: Eritema multiformeyi de içeren ciddi deri reaksiyonları, Stevens-Johnson sendromu, toksik epidermal nekroliz 4.9. Doz aşımı ve tedavisiSemptomlar ve BelirtilerZanamivirin sunum şeklinin fiziksel sınırlamaları, uygulama yolu ve oral biyoyararlanımının zayıf oluşu (%2-3) nedeniyle yanlışlıkla aşırı dozda alınması olası değildir. Zanamivirin 64 mg/gün'e kadar olan dozlarının (tavsiye edilen günlük dozun yaklaşık 3 katı) oral inhalasyon şeklinde uygulanmasıyla (nebülizer ile) yan etki görülmemiştir. Ayrıca, beş gün boyunca 1200 mg/gün'e kadar i.v. yolla yapılan sistemik uygulamada da yan etki görülmemiştir. TedaviBilinmemektedir. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: nöraminidaz inhibitörleri ATC Kodu: J05A H01Etki MekanizmasıZanamivir, influenza virüsünün yüzey enzimi olan nöraminidazın güçlü ve yüksek derecede seçici bir inhibitörüdür. Viral nöraminidaz, enfekte hücrelerden yeni oluşan virüs parçalarının ayrılmasına yardım eder ve viral enfeksiyonun diğer hücrelere geçmesini sağlayacak şekilde virüsün mukustan epitel hücre yüzeylerine girişini kolaylaştırabilir. Bu enzimin inhibisyonu influenza A ve B virüs replikasyonuna karşı in vitroin vivoaktivite şeklinde kendini gösterir ve influenza A virüslerinin bilinen tüm nöraminidaz alt tiplerini kapsar.Zanamivir, etkisini hücre dışında gösterir. Bulaşıcı influenza virionlarının solunum sistemi epitel hücrelerinden salıverilmesini inhibe ederek hem influenza A hem de B virüslerinin üremesini azaltır. İnfluenza viral replikasyonu solunum sisteminin yüzeyel epiteliyle sınırlanır. Zanamivirin bu bölgeye topikal uygulamadaki etkinliği klinik çalışmalarda kanıtlanmıştır. Klinik çalışma verileri, akut influenza enfeksiyonun zanamivirle tedavisinin, plaseboyla kıyaslandığında, zanamivire duyarlılıkta saptanabilir bir azalma gelişmeksizin solunum sisteminden virüs geçişinde azalmaya neden olduğunu göstermiştir. Farmakodinamik EtkiBilinmemektedir. 5.2. Farmakokinetik özellikler Genel özelliklerEmilim:
İnsandaki farmakokinetik çalışmalarda ilacın mutlak oral biyoyararlılığı düşük (ortalama % 2) bulunmuştur. Oral olarak inhale edilen zanamivir ile yapılan benzer çalışmalarda, serum konsantrasyonunun 1-2 saat içinde doruk noktasına ulaşacak şekilde dozun yaklaşık % 10-20'sinin sistemik dolaşıma geçtiği saptanmıştır. İlacın emiliminin zayıf olması sistemik konsantrasyonunun düşük olmasına neden olur, bu yüzden de oral inhalasyon sonrası zanamivir sistemik olarak önemli bir oranda alınmamış olunur. Tekrarlayan oral inhalasyon şeklindeki uygulamadan sonra, kinetiğinde bir değişiklik olduğuna dair kanıt bulunmamaktadır.Biyotransformasyon:Zanamivirin metabolize olmadan değişmemiş halde böbreklerden atıldığı ve metabolize olmadığı gösterilmiştir. Eliminasyon:
Zanamivirin oral inhalasyon sonrası serum yarılanma ömrü 2.6 ila 5.05 saat arasında değişir. Tamamı değişmemiş halde idrarla atılır. Üriner klerensten total klerensin 2.5 ile 10.9 I/saat arasında olduğu tahmin edilmektedir. Renal eliminasyon 24 saatte tamamlanır. |
İlaç BilgileriRelenza RotadiskEtken Maddesi: Zanamivir Atc Kodu: J05AH01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
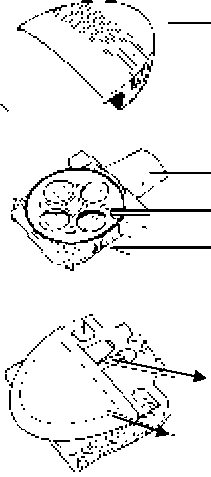
► Ağızlık Kapağı
► Ağızlık
► Tekerlek Parmakla kavranan çıkıntılar
RELENZA DİSKHALER'i kullanmak için basamaklar
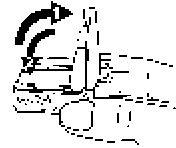
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
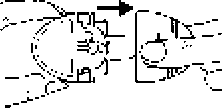 İç ve dış kısımlarının temiz olduğundan emin olunuz.
İç ve dış kısımlarının temiz olduğundan emin olunuz.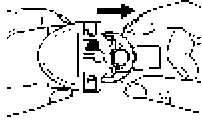 3. Baş ve işaret parmağınızı bu çıkıntıların üzerine yerleştiriniz, içeri doğru bastırınız ve tablayı ana gövdeden dışarı doğru çekiniz.
3. Baş ve işaret parmağınızı bu çıkıntıların üzerine yerleştiriniz, içeri doğru bastırınız ve tablayı ana gövdeden dışarı doğru çekiniz.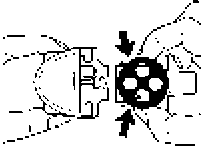 Beyaz gövde kolayca dışarı çekilecektir.
Beyaz gövde kolayca dışarı çekilecektir.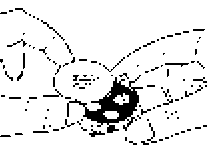 Blisterin yazılı kısmının yukarıda, yüzünün ise aşağı gelecek şekilde yerleştiğinden emin olun.
Blisterin yazılı kısmının yukarıda, yüzünün ise aşağı gelecek şekilde yerleştiğinden emin olun.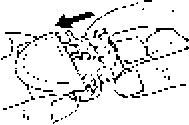
 DİSKHALER'i yatay tutunuz.
DİSKHALER'i yatay tutunuz. Bir sonraki blister görünene kadar, tekerleği çeviriniz.
Bir sonraki blister görünene kadar, tekerleği çeviriniz.