Zoronic 4mg/5ml IV İnfüzyon İçin Konsantre Çözelti İçeren Flakon Kısa Ürün BilgisiKas İskelet Sistemi » Kemik » Kemik İlaçları » Bisfosfonatlar » Zoledronik Asit 1. BEŞERİ TIBBİ ÜRÜNÜN ADIZORONİC 4 mg/5 mİ I.V. infllzyon için konsantre çözelti içeren flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM5 mİ konsantre çözeltide;Etkin madde:Zoledronik asit.............4 mg (4.264 mg zoledronik asit monohidrat)Yardımcı maddeler:Trisodyum sitrat dihidrat............24 mgYardımcı maddeler için 6.1'e bakımz. 3. FARMASÖTİK FORMİnfuzyon için konsantre çözelti içeren flakon Renksiz, berrak çözelti.4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarRadyolojik yöntemlerle litik lezyon gösterilmiş olan multiple myelomalı hastalarda ve kemik metastazı olan ileri evre kanserli hastalarda iskeletle ilişkili komplikasyonlann (patolojik kınk, omurilik sıkışması, radyasyon tedavisi, kemiğe yönelik cerrahi müdahale veya hiperkalsemi) önlenmesi ve maligniteye bağlı hiperkalsemi tedavisinde kullamlır.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Kemik tutulumu olan ileri evre kanserli hastalarda iskeletle ilişkili olayların önlenmesiErişkinler ve yaslılarKemik tutulumu olan ileri evre kanserli hastalarda iskeletle ilişkili olaylann önlenmesinde önerilen doz 4 mg zoledronik asittir. Konsantre çözelti 100 mİ a^ % 0.9 sodyum klorür veya a/h % 5 glukoz çözeltisi ile seyreltilmeli ve her 3 ila 4 haftada bir en az 15 dakika devam eden bir intravenöz infuzyon ile verilmelidir. Aynı zamanda hastalara günde 500 mg oral kalsiyum ve 400 lUD vitamini takviyesi yapılmalıdır.Maligniteye bağlı hiperkalsemi tedavisiErişkinler ve yaslılarHiperkalsemide (albumin-düzeltilmiş serum kalsiyumu >12.0 mg/dl veya 3.0 mmol/1) önerilen doz 4 mg zoledronik asittir. Konsantre çözelti 100 mİ a/h %0.9 sodyum klorür veya a/h %5 glukoz çözeltisi ile seyreltilmeli, en az 15 dakikalık tek bir intravenöz infuzyon ile verilmelidir. ZORONİC uygulanmadan önce ve uygulandıktan sonra hastaların yeteri kadar hidrate olması sağlanmalıdır. Uygulama şekli:ZORONİC sadece intravenöz uygulama içindir.ZORONİC, kalsiyum ya da Ringer Laktat çözeltisi gibi iki değerlikli katyon içeren diğer infuzyon solüsyonları ile karıştırılmamalıdır ve diğer tüm ilaçlardan ayrı olarak, tek bir kerede, tek bir intravenöz solüsyon şeklinde uygulanmalıdır. Düşük doz ZORONİC dozlarının hazırlanma talimatıGereken hacimde sıvı konsantreyi, aşağıdaki gibi enjektöre çekin:4.4 mİ...........3.5 mg'lık doz için 4.1 mİ...........3.3 mg'lık doz için 3.8 mİ...........3.0 mg'lık doz için Çekilen miktardaki sıvı konsantre, 100 mİ, steril a/h %0.9 sodyum klorür solüsyonu veya a/h %5 glukoz solüsyonu kullanılarak daha da seyreltilmelidir. Doz, 15 dakikadan daha kısa sürmeyecek tek bir intravenöz infuzyon şeklinde verilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Maligniteye bağlı hiperkalsemi tedavisi:Maligniteye bağlı hiperkalsemisi (HCM) ve şiddetli böbrek bozukluğu olan hastalarda ZORONİC tedavisi yalnızca, bu tedavinin riskleri ve faydaları değerlendirildikten sonra düşünülmelidir. Serum kreatinin düzeyi >400 |imol/litre veya >4.5 mg/dl olan hastalar, klinik çalışmalara alınmamıştır. Serum kreatinin düzeyi <400 ^ımol/1 ya da <4.5 mg/dl olan maligniteye bağlı hiperkalsemi tedavisi gören hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Kemik tutulumu olan ileri evre kanserli hastalarda iskeletle ilişkili olayların önlenmesi: Multiple miyeloması veya solid tümörlerin metastatik kemik lezyonlan olan hastalarda ZORONİC tedavisine başlanırken, serum kreatinin düzeyleri ve kreatinin klerensi (CLcr) ölçülmelidir. Kreatinin klerensi, Cockfort-Gault formülü kullamlarak, serum kreatinin düzeylerinden hesaplanır. Tedaviye başlamadan önce, kreatinin klerensi <30 ml/dak olarak saptanan, ciddi böbrek bozukluğu olan hastalara ZORONİC verilmesi önerilmemektedir. Serum kreatinin düzeyi >265 |imol/l veya >3.0 mg/dl olan hastalar, ZORONİC ile yapılan klinik çalışmalara dahil edilmemiştir. Kemik metastazları olan ve tedavinin başlatılmasmdan önce hafıf-orta şiddette böbrek bozukluğu (kreatinin klerensi 30-60 ml/dakika) olan hastalarda, aşağıdaki ZORONİC dozlannın kullanılması önerilir (bkz Bölüm 4.4 Özel kullanım uyanları ve önlemleri):
Klinik çalışmalarda böbrek fonksiyonunun kötüleşmesi, aşağıdaki şekilde tanımlanmıştır: - Serum kreatinin düzeyi normal olan hastalar için (< 1.4 mg/dL), >0.5 mg/dL yükselme - Serum kreatinin düzeyi anormal olan hastalar için (> 1.4 mg/dL), >1.0 mg/dL yükselme Klinik çalışmalarda kreatinin seviyesi başlangıç değerinin %10 limiti dahiline döndüğü durumlarda zoledronik asit tekrar kullanılmıştır (bkz. Bölüm 4.4 Özel kullanım uyanlan ve önlemleri). ZORONİC tedavisine tedavinin kesintiye uğramasından önceki dozla devam edilmelidir. Karaciğer yetmezliği:Ağır karaciğer yetmezliği olan hastalardaki klinik veriler sınırlı olduğundan, bu hasta popülasyonu için spesifik önerilerde bulunmak mümkün değildir.Pediyatrik popülasyon:Zoledronik asidin pediyatrik hastalardaki güvenlilik ve etkinliği belirlenmemiştir.Geriyatrik popülasyon:Yaşlı hastalar için herhangi bir doz ayarlamasına gerek yoktur.4.3. KontrendikasyonlarZORONİC, gebelik ve emzirmede, zoledronik aside veya diğer bifosfonatlara ya da yardımcı maddelerden herhangi birine karşı klinik olarak anlamlı aşın duyarlılığı olan hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriHastalar, ZORONİC uygulamasından önce yeterince hidrate olmaları açısından değerlendirilmelidirler.Kalp yetmezliği riski olan hastalarda aşın hidrasyondan sakını İmalıdır. ZORONİC tedavisine başlandıktan sonra, serum kalsiyum, fosfat ve magnezyum düzeyleri, serum kreatinin gibi standart hiperkalsemi ile ilişkili metabolik parametreler dikkatle izlenmelidir. Hipokalsemi, hipofosfatemi ya da hipomagnezemi oluşursa, kısa vadeli destek tedavisi gerekli olabilir. Tedavi edilmemiş hiperkalsemili hastalarda genellikle bir derece böbrek bozukluğu mevcut bulunduğundan, böbrek fonksiyonunun dikkatle izlenmesi düşünülmelidir. ZORONİC ile tedavi edilen hastalar zoledronik asit içeren başka bir ilaçla eşzamanlı olarak tedavi edilmemelidir. Böbrek yetmezliği: Maligniteye bağlı hiperkalsemi bulunan ve böbrek fonksiyonunda bozulma kanıtı gösteren hastalar ZORONİC ile tedaviye devam edilmesinin olası yararlannm, ortaya çıkabilecek riskleri aşıp aşmadığı da göz önüne alınarak uygun bir şekilde değerlendirilmelidir. Kemik metastazlan olan hastalarda iskeletle ilişkili olaylann önlenmesi amacıyla tedavi karan verilirken, tedavinin etkisinin 2-3 ayda başlayacağı düşünülmelidir. Bifosfonatlann böbrek fonksiyon bozukluğu raporlanyla ilişkisi vardır. Böbrek fonksiyonunda kötüleşme potansiyelini arttırabilecek faktörler, dehidrasyon, önceden mevcut böbrek yetmezliği, çoğul zoledronik asit siklüsler veya diğer bisfosfonat siklüsleri, nefrotoksik ilaç kullanımı ya da halen önerilmekte olandan daha kısa süreli bir infuzyonun kullanılması gibi faktörlerdir. 4 miligramlık zoledronik asit dozunun 15 dakikadan daha kısa sürmeyen bir infüzyonla verilmesi risk azalması sağlarsa da, böbrek fonksiyonu yine de kötüleşebilir. Başlangıç dozunda veya tek doz zoledronik asit kullanımından sonra hastalarda, böbrek fonksiyonunda kötüleşme, böbrek yetmezliğinde ilerleme ve diyaliz gereksinimi rapor edilmiştir. Serum kreatinin düzeyleri, iskeletle ilişkili olayların önlenmesi amacıyla önerilen dozlarla kronik zoledronik asit tedavisi uygulanan hastalarda da, daha seyrek olsa da yükselebilir. Hastalardaki serum kreatinin düzeyleri, her ZORONİC dozundan önce değerlendirilmelidir. Hafıf-orta şiddette böbrek yetmezliğiyle birlikte kemik metastazları olan hastalarda tedaviye başlandığında, daha düşük ZORONİC dozlarının kullanılması önerilir. Tedavi sırasında böbrek fonksiyonları kötüye giden hastalarda ZORONİC tedavisine ancak, serum kreatinin düzeyleri başlangıç değerinden en fazla %10 yüksek olması durumunda tekrar başlanmalıdır (bkz Bölüm 4.2 Pozoloji ve uygulama şekli). Zoledronik asit dahil bisfosfonatlarm böbrek fonksiyonu üzerindeki potansiyel etkileri; ayrıca şiddetli böbrek yetmezliği (klinik çalışmalarda tanımlandığı üzere tedavi başlangıcındaki serum kreatinin düzeyleri maligniteye bağlı hiperkalsemi vakalarında >400 |imol/l veya >4.5 mg/dl; kanser ve kemik metastazı olan hastalarda sırasıyla >265 |amol/l veya >3.0 mg/dl) olan hastalarda geniş kapsamlı klinik güvenlilik verilerinin bulunmaması ve başlangıçta şiddetli böbrek fonksiyon bozukluğu (kreatinin klerensi <30 ml/dakika) olan hastalardaki farmakokinetik verilerin sınırlı olması nedeniyle; şiddetli böbrek yetmezliği olan hastalarda ZORONİC kullanılması önerilmez. Karaciğer yetmezliği: Ağır karaciğer yetmezliği olan hastalardaki klinik veriler smırlı olduğundan, bu hasta popülasyonu için spesifik önerilerde bulunmak mümkün değildir. Çene kemiğinde osteonekroz: Zoledronik asit de dahil olmak üzere bifosfonat içeren tedavi kürü alan kanserli hastalarda çene kemiğinde osteonekroz bildirilmiştir. Bu hastalann çoğu kemoterapi ve kortikosteroid de alan hastalardır. Birçok hastada osteomiyelitin de dahil olduğu lokal enfeksiyon semptomları görülmüştür. Pazarlama sonrası deneyim ve literatür, çene kemiğinde osteonekroz bildirimlerinin büyük bir kısmımn tümör tipine (ilerlemiş meme kanseri, multipl miyelom) ve dental duruma (diş çekimi, periodontal hastalık, zayıf bir şekilde monte edilmiş talana dişleri içeren lokal travma) dayandığını ileri sürmektedir. Kanser hastalan, iyi oral hijyeni korumalı ve bifosfonatlarla tedaviye başlamadan önce koruyucu diş hekimliği ile diş muayenesi olmalıdırlar. Bu hastalar, tedavi süresince, eğer mümkün ise invaziv dental uygulamalardan uzak durmalıdırlar. Bifosfonat tedavisi esnasında, çene kemiğinde osteonekroz gelişen hastalarda, diş ameliyatları durumu kötüleştirebilir. Dental uygulamalara gereksinim duyan hastalarda, bifosfonat tedavisinin kesilmesinin çene kemiğinin osteonekroz riskini azaltıp azaltmadığına dair hiçbir veri bulunmamaktadır. Tedavi eden doktorun klinik görüşü, yarar/risk değerlendirmesine dayanarak her hastanın tedavi planını yönlendirmelidir. Kas iskelet ağrılan: Pazarlama sonrası deneyimde, bifosfonat alan hastalarda şiddetli ve seyrek olarak güçten düşürücü kemik, eklem ve/veya kas ağnsı bildirilmiştir. Ancak bu raporlar seyrek olmuştur. Bu ilaç kategorisi zoledronik asiti de içermektedir. Semptomlann başlamasına kadar geçen süre tedaviye başladıktan sonra bir gün ile aylar arasında değişmiştir. Tedavi kesildikten sonra hastaların çoğunda semptomlar ortadan kalkmıştır. Aynı ilaç ya da başka bir bifosfonat ile yeniden tedaviye başlandığında bir grupta semptomlar tekrarlamıştır. Bu tıbbi ürün her 5 ml'de 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani sodyum içermediği kabul edilebilir. Bu miktar, düşük sodyum veya kontrollü sodyum diyetinde olan hastalar için bir risk oluşturmaz. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriNefrotoksik olan ilaçlarla birlikte kullanımında dikkatli olunmalıdır. Klinik çalışmalarda, zoledronik asit, klinikte görünür etkileşmeler meydana gelmeksizin yaygın olarak kullanılan antikanser ajanlar, diüretikler, antibiyotikler ve analjezikler ile bir arada uygulanmıştır. Zoledronik asit plazma proteinlerinein vitrobelirgin bağlanma göstermez ve insan P450 enzimlerini inhibe etmez (bkz. Bölüm 5.2 Farmakokinetik özellikler), ancak resmi boyutta klinik etkileşme çalışmaları yapılmamıştır. Zoledronik asit gibi bifosfonatlar aminoglikozidler ile birlikte uygulandıklarında, her iki ilacın da additif etkisinin olabileceği ve bunun sonucunda gerekenden daha uzun süre daha düşük serum kalsiyum düzeyi oluşabileceği göz önüne alınarak dikkatli olunması önerilir. Diğer nefrotoksik ilaçlarla birlikte kullanıldığında da dikkatli olunmalıdır. Tedavi sırasında hipomagnezemi gelişme ihtimaline karşı da dikkatli olunmalıdır.Multipl miyelom hastalannda, zoledronik asit gibi intravenöz bifosfonatlar talidomid ile birlikte kullanıldığında böbrek fonksiyon bozukluğu riski artabilir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir klinik etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir klinik etkileşim çalışması yürütülmemiştir.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: DÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Zoledronik asidin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır.ZORONİC, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gebelik dönemiHayvan üreme çalışmalarında zoledronik asit sıçanlara ve tavşanlara subkutan olarak uygulanmıştır. Sıçanlarda 0.2 mg/kg vücut ağırlığına eşit ve üzerindeki dozlarda teratojenik olduğu saptanmıştır. Tavşanlarda ise ne teratojenite ne de fetotoksisite bulunmamış ancak matemal toksisite saptanmıştır. ZORONİC, gebelik sırasında kullanılmamalıdır.Laktasyon dönemiZoledronik asitin insan ya da hayvan sütü ile atıldığına ilişkin yetersiz/sınırlı bilgi mevcuttur. Zoledronik asitin süt ile atılmasına yönelik fizikokimyasal ve eldeki farmakodinamik/toksikolojik veriler nedeniyle memedeki çocuk açısından bir risk olduğu göz ardı edilemez. ZORONİC, emzirme döneminde kullanılmamalıdır.Üreme yeteneği/FertiliteZoledronik asit, sıçanda 0.2 mg/kg'a eşit ve üzerindeki subkutan dozlarda teratojeniktir. Tavşanda teratojenite ya da fetotoksisite görülmedi ise de matemal toksisite bulunmuştur.4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma yeteneği üzerine etkileri ile ilgili herhangi bir çalışma yapılmamıştır.4.8. İstenmeyen etkilerZoledronik asit 4 mg için advers reaksiyonların sıklığı temel olarak kronik tedaviden elde edilen verilere dayanmaktadır. Zoledronik asit ile advers etkiler genellikle hafif ve geçicidir ve diğer bifosfonatlar ile bildirilenlere benzerdir. Zoledronik asit ya da pamidronat 90 mg alan hastaların yaklaşık üçte birinde bu reaksiyonların oluşması beklenebilir. İntravenöz uygulamada en sık grip-benzeri bir sendrom ortaya çıkmış, hastalann yaklaşık %9'unda kemik ağnsı, ateş, yorgunluk ve rigor ile seyreden bu durum saptanmıştır. Hastaların yaklaşık %3'ünde seyrek artralji ve miyalji vakalan bildirilmiştir.Sıklıkla, böbrekle kalsiyum atılımmdaki azalma, hastaların yaklaşık %20'sinde serum fosfat düzeylerinde asemptomatik ve tedavi gerektirmeyen bir düşüş oluşturmaktadır. Hastaların yaklaşık %3'ünde serum kalsiyumu asemptomatik hipokalsemik düzeylere düşebilir. Zoledronik asit intravenöz infüzyonunu takiben, bulantı (%5.8) ve kusma (%2.6) gibi gastrointestinal reaksiyonlar bildirilmiştir. Hastaların %1'inden daha azında infüzyon yerinde nadiren kızarıklık veya şişme ve/veya ağn gibi lokal reaksiyonlar da gözlemlenmiştir. Zoledronik asit 4 mg ile tedavi edilen hastalann %1.5'inde anoreksi bildirilmiştir. Az sayıda döküntü ya da kaşıntı vakası gözlenmiştir (%1'den az). Diğer bifosfonatlarla olduğu gibi, yaklaşık %1'inde konjonktivit vakaları bildirilmiştir. Kemik metastazı görülen popülasyonda böbrek fonksiyonunun bozulmasıyla ilgili bazı raporlar vardır (%2.3), bununla birlikte, bu hasta popülasyonundaki diğer risk faktörleri de bu duruma yol açmış olabilirler. Plasebo kontrollü çalışmalann toplu olarak değerlendirildiği verilere göre, zoledronik asit 4 mg alan hastalann %5.2'sinde buna karşılık plasebo alanlann %4.2'sinde şiddetli anemi (Hb<8.0 g/dl) bildirilmiştir. Aşağıda sıralanan advers ilaç reaksiyonları, daha çok zoledronik asit ile kronik tedavi uygulanmış klinik çalışmalardan elde edilmiştir: Advers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklanna göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır. Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Kan ve lenf sistemi hastalıklarıYaygın: AnemiYaygın olmayan: Trombositopeni, lökopeni Seyrek: Pansitopeni. Bağışıklık sistemi hastalıklarıYaygın olmayan: Aşın duyarlılık reaksiyonu Seyrek: Anjiyonörotik ödem.Psikiyatrik hastalıklarYaygın olmayan: Anksiyete, uyku bozukluğu Seyrek: Konfüzyon.Sinir sistemi hastalıklarıYaygın: BaşağnsıYaygın olmayan: Baş dönmesi, parestezi, tat alma bozuklukları, hipoestezi, hiperestezi, tremor. Göz hastalıklarıYaygın: KonjonktivitYaygın olamayan: Bulanık görme Çok seyrek: Üveit, episklerit Kardiyak hastalıklarYaygın olmayan: Hipertansiyon, hipotansiyon Seyrek: Bradikardi.Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Dispne, öksürük.Gastrointestinal hastalıklarYaygın: Bulantı, kusma, anoreksiYaygın olmayan: Diyare, konstipasyon, karın ağrısı, dispepsi, stomatit, ağız kuruluğu. Deri ve deri altı doku hastalıklarıYaygın olmayan: Kaşıntı, döküntü (eritematöz ve maküler döküntüler dahil), terleme artışı.Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Kemik ağnsı, miyalji, artralji, genel ağrı Yaygın olmayan: Kas krampları.Böbrek ve idrar hastalıklarıYaygın: Böbrek bozukluğuYaygın olmayan: Akut böbrek yetmezliği, hematüri, proteinüri. Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Ateş, grip benzeri sendrom (yorgunluk, rigor, keyifsizlik ve ateş basması dahil) Yaygın olmayan: Asteni, periferik ödem, enjeksiyon bölgesi reaksiyonlan (ağn, iritasyon, şişme, sertleşme dahil), göğüs ağnsı, kilo artışı.Araştırmalar:Çok yaygın: HipofosfatemiYaygın: Kan kreatinini ve kan üresinde artış ve hipokalsemi Yaygın olmayan: Hipomagnezemi, hipokalemi Seyrek: Hiperkalemi, hipematremi. Zoledronik asit ile gözlemlenmemiş olsa da, diğer bifosfonatlar, asetilsalisilik aside duyarlı astım hastalannda bronkokonstriksiyon ile ilişkilendirilmişlerdir. Postmenopozal osteoporoz (PMO) tedavisinde yılda 5 mg zoledronik asidin etkililik ve güvenliliğinin plaseboya karşı değerlendirildiği 3 yıl süren, randomize, çift-kör kontrollü bir çalışmada, atriyal fıbrilasyonun tüm insidansı 5 mg zoledronik asit ve plasebo alan hastalarda sırasıyla %2.5 (3862 hastanın 96'sında) ve %1.9 (3852 hastanın 75'inde) olarak tespit edilmiştir. Atriyal fıbrilasyon ciddi advers etkilerinin oranı 5 mg zoledronik asit ve plasebo alanlarda, sırasıyla %1.3 (3862 hastanın 51'inde) ve % 0.6 (3852 hastamn 22'sinde)'dır. Bu çalışmada gözlemlenen dengesizlik, kanser hastalannda her 3-4 haftada bir 4 mg zoledronik asit ile yapılanlar da dahil olmak üzere zoledronik asit ile yapılan diğer çalışmalarda gözlemlenmemiştir. Bu tek bir kere yapılan klinik çalışmada atriyal fıbrilasyonun insidansmda görülen artışın arkasındaki mekanizma bilinmemektedir. Pazarlama sonrası deneyim: Zoledronik asidin onay sonrası kullanımı sırasında aşağıdaki istenmeyen etkiler bildirilmiştir. Bu bildirimler büyüklüğü kesin olarak bilinmeyen bir popülasyondan edinildiği ve karışık faktörlere sebep olduğu için, sıklıklarının güvenilir biçimde tahmin edilmesi ya da ilaç maruziyeti ile nedensel bir ilişki belirlenmesi mümkün değildir. Özellikle kanser bulunan ve zoledronik asit de dahil olmak üzere (seyrek) bifosfonatlarla tedavi edilen hastalarda, osteonekroz vakalan (başlıca çene) bildirilmiştir. Bu hastaların çoğunda osteomiyelitin de dahil olduğu lokal enfeksiyon semptomları görülmüştür ve kanser hastalanyla ilgili raporlann çoğunda diş çekimi veya diğer diş ameliyatları yer almaktadır. Çene osteonekrozunun, kanser teşhisi, eşlik eden tedaviler (örn: kemoterapi, radyoterapi, kortikosteroidler) ve eşlik eden durumlan (örn: anemi, koagülopati, enfeksiyon, önceden var olan oral hastalıklar) kapsayan iyi dökümante edilmiş risk faktörleri mevcuttur. Nedensellik ilişkisi tayin edilmemiş olmakla beraber, iyileşme sürecini uzatabileceğinden dolayı, diş ameliyatlarının yapılmaması konusunda ihtiyatlı olunmalıdır (Bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Eldeki veriler çene kemiğinde osteonekroz bildirimlerinin büyük bir kısmının tümör tipine (ilerlemiş meme kanseri, multipl miyelom) dayandığını ileri sürmektedir. Çok nadir vakalarda, özellikle atriyal fıbrilasyon, somnolans, bronkokonstriksiyon, anafılaktik reaksiyon/şok, ürtiker, sklerit ve göz çukurunda iltihap gibi altta yatan risk faktörleri bulunan hastalarda hipotansiyon, senkop ya da dolaşım kollapsma neden olmuştur. 4.9. Doz aşımı ve tedavisiZoledronik asidin akut doz aşımıyla ilgili klinik deneyimi sınırlıdır. Böbrek fonksiyon bozukluğu (böbrek yetmezliği dahil) ve serum elektrolit (kalsiyum, fosfor ve magnezyum dahil) anormallikleri gözlenmiş olduğundan, önerilenden daha yüksek doz uygulanmış olan hastalar dikkatle izlenmelidirler. Hipokalsemi gözlendiği takdirde, klinik endikasyona uygun olarak kalsiyum glukonat infiizyonlan uygulanmalıdır.5. FARMAKOLOJİK ÖZELLİKLER5.L Farmakodinamik özeililderFarmakoterapötik grup: Bifosfonatlar ATC kodu: M05BA08Zoledronik asit, bifosfonatlarm başlıca kemik üzerine etkili, yeni ve oldukça güçlü bir sınıfının üyesidir. Bugüne kadar bilinen en güçlü osteoklastik kemik rezorpsiyonu inhibitörlerinden biridir. Bifosfonatlann kemiğe selektif etkisi mineralize kemiğe yüksek afmitelerine dayanır, ancak osteoklastik aktivitenin inhibisyonunu sağlayan esas moleküler mekanizma halen açık değildir. Uzun süreli hayvan çalışmalarında, zoledronik asit kemik rezorbsiyonunu, kemiğin formasyon, mineralizasyon veya mekanik özelliklerini olumsuz etkilemeksizin inhibe ettiği gösterilmiştir. Kemik rezorpsiyonunun çok güçlü bir inhibitörü olmasının yanı sıra, zoledronik asit, metastatik kemik hastalığının tedavisinde genel etkinliğini oluşturan çeşitli anti-tümör özelliklerine de sahiptir. Preklinik çalışmalarda şu özellikler ortaya konmuştur: In vivo:osteoklastik kemik rezorpsiyonunun inhibisyonu kemik iliğindeki mikroortamı tümör büyümesine daha az uygun hale getirir. Anti-anjiyojenik aktivite ve analjezik aktivite. In viiro:osteoblast proliferasyonunun inhibisyonu, tümör hücreleri üzerinde direkt sitostatik ve pro-apoptotik aktivite, diğer anti-kanser ilaçlarıyla sinerj istik sitostatik etki, anti-adezyon/invazyon aktivitesi.Kemik tutulumu olan ileri evre kanserli hastalarda iskeletle ilişkili olaylarm önlenmesinde klinik çalışma sonuçları:Prostat kanseri hastalannda (4 mg zoledronik asit alan 214 erkeğe karşı plasebo alan 208 erkek) zoledronik asit, iskeletle İlişkili Olaylar (SRE'ler) açısından plasebo ile karşılaştınimıştır. Tedavinin ilk 15 ayından sonra, 186 hasta, 9 ay daha devam ederek 24 aylık çift kör tedavinin total süresini tamamlamıştır. En az bir SRE yaşayan hastalann oranı (zoledronik asit ile % 38'e karşı, plasebo ile % 49, p=0.028) ve ilk SRE'y® kadar geçen medyan süre (plasebo için 321 güne karşı 4 mg zoledronik asit için 488, p=0.009) açısından 4 mg zoledronik asit, plasebo karşısında anlamlı bir avantaj sağlamıştır ve hasta başına düşen iskelet morbidite oranının yıllık sıklığı azalmıştır (4 mg zoledronik asit için 0.77, plasebo için 1.47, P=0.005). Plasebo ile karşılaştırılan zoledronik asit grubundaki iskelet ile ilişkili olaylarda, çoklu olay analizleri % 36 risk azalması göstermiştir (p=0.002). Başlangıçta ağn ölçülmüş ve çalışma süresince periyodik olarak ölçüme devam edilmiştir. Zoledronik asit alan hastalarda, plasebo grubundakilere göre daha az ağrı artışı kaydedilmiş ve farklar 3, 9, 21 ve 24. aylarda önemli seviyeye ulaşmıştır. Daha az sayıdaki zoledronik asit hastasında bir patolojik kınk yakınması ortaya çıkmıştır. Tedavi etkileri blastik lezyonlan olan hastalarda daha az belirgin olmuştur. Etkinlik sonuçlan. Tablo l'de gösterilmektedir.
**İskelete bağlı tüm olaylann sayısı, çalışma süresince ortaya çıkan her bir olayın toplam sayısı NR Elde edilemedi NA Uygulanamadı İkinci bir çalışmada, zoledronik asit iskelet ile ilişkili olaylann sayısım azaltmış ve kemiği de içeren diğer solid tümörleri olan ve daha önceki medyan olarak yaşam süreleri sadece 6 ay olan hasta popülasyonunda SRE sayısını azaltmış ve bir SRE'ye kadar olan medyan süreyi 2 ay uzatmıştır. NSCLC (küçük hücreli olmayan akciğer kanseri) bulunan 134 ve diğer solid tümörleri olan 123 hasta zoledronik asit ile, NSCLC bulunan 130 ve diğer solid tümörleri olan 120 hasta plasebo ile tedavi edilmiştir. Tedavinin ilk 9 ayından sonra, 101 hasta 12 ay uzatılmış çalışmaya girmiş ve 26'sı, çalışmanın 21 ayını tamamlamıştır. 4 mg zoledronik asit iskelet ile ilişkili olayları olan hasta oranını (4 mg zoledronik asit için %39, plasebo için %48, p= 0.039), ilk SRE'ye kadar geçen medyan süreyi (4 mg zoledronik asit için 236 gün, plasebo için 155 gün, p=0.009) ve hasta başına düşen iskelet morbidite oranının yıllık sıklığı azalmıştır (4 mg zoledronik asit için 1.74, plasebo için 2.71, p=0.012). Plasebo ile karşılaştırılan zoledronik asit grubundaki iskelet ile ilişkili olaylarda, çoklu olay analizleri %30.7 risk azalması göstermiştir (p=0.003). Küçük hücreli olmayan akciğer kanseri hastalarındaki tedavi etkisi, diğer solid tümörleri olan hastalardakinden daha az görünmektedir. Etkinlik sonuçları Tablo 2'de gösterilmektedir. Tablo 2; Etkinlik sonuçlan (Meme veya prostat kanseri dışındaki solid tümörler)
**iskelete bağlı tüm olaylann sayısı, çalışma süresince ortaya çıkan her bir olayın toplam sayısı NR Elde edilemedi NA Uygulanamadı 4 mg zoledronik asit ile pamidronat 90 mg'ı karşılaştıran bir Faz III randomize, çift-kör çalışmada, en az 1 kemik lezyonu olan muhipl miyelom ya da meme kanserli 1222 hasta (564
4 mg zoledronik asit, 558 pamidronat 90 mg), her 3 ila 4 haftada 4 mg zoledronik asit ile ya da 90 mg pamidronat ile tedavi edilmiştir. İyi klinik uygulamalanna uyum gösterememesinden dolayı 8 hasta etkinlik analizlerine dahil edilmemiştir. 606 hasta 12 ay süren, çift-kör uzatılmış faza alınmıştır. Total tedavi 24 ay sürmüştür. Sonuçlarda 4 mg zoledronik asidin, iskelete bağlı olaylardan korunmada 90 mg pamidronat ile karşılaştınlabilir etkinlik gösterdiği saptanmıştır. Çoklu olay analizleri, 4 mg zoledronik asit ile tedavi edilen hastalarda %16'hk önemli bir risk azalması (p=0.030) olduğunu göstermiştir. Etkinlik sonuçlan Tablo 3'te görülmektedir. Tablo 3; Etkinlik Sonuçları (Meme Kanseri ve Multipl Miyelom Hastaları)Herhangi bir SRE(+HCM)Kırıklar*Kemikte radyasyon tedavisi
4mg ZoledronikasitPlasebo
4mg ZoledronikasitPlasebo
4mg ZoledronikasitPlasebo
N
561
555
561
561
555
555
SRE'1er bulunan hastalann oranı (%)
48
52
37
39
19
24 P-Degeri
0.19
0.653
0.037
SRE'ye kadar geçen medyan süre (gün)
376
356
NR
714
NR
NR P-Değeri
0.15
0.672
0.026
İskelet Morbiditesi Oranı
1.04
1.39
0.53
0.60
0.47
0.71 P-Değeri
0.084
0.614
0.015
Çeşitli olaylardan zarar görme riskinin azalması (%)
16
NA
NA
NA
NA P-Değeri
0.030
NA
NA
* Omurlara ait ve omurga dışı kınklar dahil **İskelete bağlı tüm olaylann sayısı, çalışma süresince ortaya çıkan her bir olayın toplam sayısı NR Elde edilemedi NA Uygulanamadı
Kemik metastazları ya da osteolitik lezyonları olan hastalarla gerçekleştirilen klinik çalışmalarda, tüm tedavi gruplan arasındaki (zoledronik asit 4 mg, ve pamidronat 90 mg ve plasebo) genel güvenlilik profili, tip ve şiddet açısından benzer olmuştur. Zoledronik asit aynı zamanda, toplam iskeletle ilişkili olayların (SRE) sayısının (hiperkalsemi hariç ve daha önce geçirilmiş kınk açısından düzeltilmiş) toplam risk dönemine bölünmesiyle elde edilen SRE oramnm etkisini belirlemek için, meme kanserine bağlı kemik metastazları olan 228 hasta ile çift-kör, randomize, plasebo kontrollü bir çalışmada değerlendirilmiştir. Hastalar 1 yıl süreyle 4 haftada bir 4 mg zoledronik asit ya da plasebo almışlardır. Hastalar eşit olarak zoledronik asit ve plasebo ile tedavi edilen gruplara bölünmüştür. Bir yıldaki SRE oranı 0.61 olmuş, bu durum zoledronik asit ile tedavinin plaseboya kıyasla SRE'lerin oluşum oranını %39 düşürdüğünü göstermiştir (p=0.027). En az bir SRE bulunan (hiperkalsemi hariç) hastalann oranı zoledronik asit ile tedavi edilen grupta %29.8 olurken, plasebo grubunda %49.6 olmuştur (p=0.003). Çahşmanm sonunda, zoledronik asit ile tedavi edilen kolda ilk SRE'nin başlamasına kadar geçen ortalama süreye ulaşılamamış ve plaseboya kıyasla anlamlı olarak daha uzun bulunmuştur (p=0.007). Zoledronik asit, plaseboya kıyasla bir çoklu olay analizinde (risk oranı=0.59, p=0.019) SRE'lerin riskini %41 oranında azaltmıştır. Zoledronik asit ile tedavi edilen grupta, başlangıca göre ağrı skorlanndaki azalma (Kısa Ağrı Envanterine göre, BPI) çalışmanın 4. haftasında başlayarak daha sonraki her zaman noktasında devam etmiş, plasebo grubundaki ağrı skoru ise başlangıca göre değişmeden kalmış ya da artmıştır (Şekil 1). Zoledronik asit, analjezik skorundaki kötüleşmeyi plaseboya göre daha fazla inhibe etmiştir. Aynca, zoledronik asit ile tedavi edilen hastalann %71.8'inin son gözlemde ECOG performans skorunun düzeldiği ya da değişmediği görülürken, plasebo hastalannda bu oran % 63.1 olmuştur. Şekil 1: Tedavi grubu ve çalışmadaki zamana göre başlangıca göre Kısa Ağrı Envanteri (BPI) ağn skorundaki ortalama değişim. 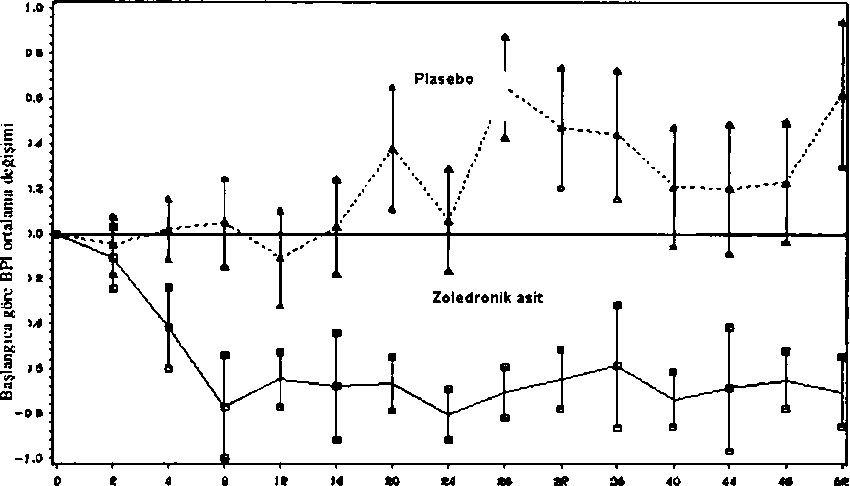 Çalınmadaki zaman (hafta)
Çalınmadaki zaman (hafta)Maligniteye bağlı hiperkalsemi tedavisinde klinik çalışma sonuçları:Maligniteye bağlı hiperkalsemideki klinik çalışmalarda zoledronik asidin etkisinin serum kalsiyumu ve idrarda kalsiyum atılımmda azalma ile karakterize olduğu gösterilmiştir.Zoledronik asidin etkilerinin pamidronat 90 mg ile karşılaştırmalı değerlendirilmesi amacı ile maligniteye bağlı hiperkalsemisi olan hastalarda yapılan iki temel çok merkezli çalışmamn sonuçları, önceden planlanmış bir analizle birleştirilmiştir. Sonuçlar zoledronik asit 4 mg ve 8 mg'm, 7. günde ve 10. günde tam yanıt verenlerin oram açısından pamidronat 90 mg'dan istatistiksel açıdan üstün olduğunu göstermiştir. Düzeltilmiş serum kalsiyumunun normalizasyonun zoledronik asit 8 mg ile 4. günde ve zoledronik asit 4 mg ve 8 mg ile 7. günde olmak üzere daha hızlı olduğu gözlenmiştir. Aşağıdaki yanıt oranları gözlemlenmiştir: Tablo 4: Maligniteye bağlı hiperkalsemi birleştirilmiş çalışmalarında tam yanıt verenlerin oranı:10. Gün4. Gün7. Gün
Zoledronik asit 4 mg (N=86)_
% 45.3 (p=0.104)
% 82.6 (P=0.005r%88.4(p=0.002)*
Zoledronik asit 8 mg (N=90)_
% 55.6 (p=0.021)*
% 83.3 (p=0.010)*
% 86.7 (p-0.015)*
Pamidronat 90 mg (N-99)_
% 33.3
% 63.6
% 69.7 *p-değerleri pamidronattan istatistiksel üstünlüğü temsil ederNormokalsemiye kadar geçen medyan süre 4 gündür. 10. günde yanıt oram pamidronat 90 mg ile %70 iken zoledronik asit tedavi grubımda %87-88 olmuştur. Nükse (albümin-düzeltilmiş serum kalsiyımıunun >2.9 mmol/l'ye tekrar yükselmesi) kadar geçen medyan süre, zoledronik asit ile tedavi gören hastalarda 30 ila 40 gün iken pamidronat 90 mg tedavisi alanlarda 17 gün olduğu gözlenmiştir. Sonuçlar, nükse kadar geçen sürede her iki zoledronik asit dozunun da istatistiksel olarak pamidronat 90 mg'dan üstün olduğunu göstermiştir. İki zoledronik asit dozu arasında istatistiksel anlamlı fark yoktur. Maligniteye bağlı hiperkalsemi bulunan hastalarla gerçekleştirilen klinik çalışmalarda, üç tedavi grubu arasındaki (zoledronik asit 4 mg ve 8 mg ve pamidronat 90 mg) genel güvenlilik profili, tip ve şiddet açısından benzer olmuştur. 5.2. Farmakokinetik özelliklerGenel özelliklerZoledronik asit monohidrat, beyaz, kristal, kokusuz bir tozdur. 0.1 M sodyum hidroksitte çözünür; suda ve 0.1 M hidroklorik asitte az çözünür; etanol ve metanolde hemen hemen hiç çözünmez.Emilim:Kemik metastazı olan 64 hastada, 2, 4, 8 ve 16 mg zoledronik asidin tek ve çoklu dozda 5- ve 15- dakikalık infuzyonlan, aşağıdaki, doza bağımlı olmadığı saptanan farmakokinetik verilerin ortaya konmasını sağlamıştır. Zoledronik asit infüzyonuna başlandıktan sonra, ilacın plazma konsantrasyonları hızla artmış, infiizyon periyodunun sonunda doruk düzeyine ulaşmış, ardından 4 saat sonra doruk düzeyinin <%10'una ve 24 saat sonra da <%l'ine inecek şekilde hızlı bir azalma göstermiştir. Daha sonra, 28. günde ikinci ilaç infiizyonu uygulanıncaya kadar doruk düzeyinin /oO.l'ini aşmayacak şekilde oldukça düşük bir konsantrasyonda uzun bir süre seyretmiştir. Dağılım:Zoledronik asit kanın hücresel bileşenlerine bir afinite göstermez. Zoledronik asidin plazma proteinlerine bağlanma oranı düşüktür (yaklaşık %56). Bu olaylar zoledronik asit konsantrasyonundan bağımsızdır. Bivotransformasvon:Zoledronik asit metabolize olmaz ve değişmeden böbrekten atılır. İlk 24 saatte, uygulanan dozun %39 ± 16'sı idrarda bulunur, kalanı ise başlıca kemik dokuya bağlanır. Kemik dokusundan çok yavaş bir şekilde sistemik dolaşıma geri serbestlenir ve böbrekten atılır. Toplam vücut klerensi 5.04 ± 2.5 litre/saattir, dozdan bağımsızdır, cinsiyet, yaş, ırk ve vücut ağırlığından etkilenmez. Eliminasvon:İntravenöz uygulanan zoledronik asit trifazik bir işlem ile elimine edilir: tı/2a 0.24 ve tı/2p 1.87 saatlik yarılanma ömürleri ile, sistemik dolaşımdan hızlı bifazik kaybolma ve bunu izleyen tı/2Y 146 saatlik terminal eliminasyon yarılanma ömrü ile uzun eliminasyon evresi. Her 28 günde bir verilen ilacın tekrarlanan dozlarından sonra ilaç birikimi olmamıştır. Doğrusallık / DoSrusal olmayan durum:infüzyon süresinin 5 dakikadan 15 dakikaya çıkarılması, infüzyon sonunda zoledronik asit konsantrasyonunda %30 azalmaya sebep olur, ancak plazma konsantrasyonu-zaman eğrisi altında kalan alanı etkilemez. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Zoledronik asitin renal klerensi, kreatinin klerensiyle anlamlı ve olumlu yönde bir ilişki göstermiştir. Renal klerens kreatinin klerensinin %75 ± 33'ünü yansıtmış ve çalışılan 64 kanser hastasında ortalama 84 ± 29 ml/dak (sınırlar 22 ila 143 ml/dak) olmuştur. Popülasyon analizi, kreatinin klerensi 20 ml/dak (ağır böbrek yetmezliği) ya da 50 ml/dak (orta düzeyde böbrek yetmezliği) olan bir hasta için öngörülen zoledronik asit klerensi, 84 ml/dak'lık bir kreatinin klerensi gösteren hastanın sırasıyla %37 ya da %72'si olacaktır. Ağır böbrek yetmezliği olan hastalarla (kreatinin klerensi <30 ml/dak) ilgili olarak oldukça sınırlı farmakokinetik veri vardır. Hiperkalsemi va da Karaciğer yetmezliği:Hiperkalsemisi olan hastalarda ya da karaciğer yetmezliği olan hastalarda zoledronik asidin farmakokinetik verileri mevcut değildir. Zoledronik asit, insan P450 enzimlerini in vitroinhibe etmez, biyotransformasyon göstermez ve hayvan çalışmalarında uygulanan dozun %3'ünden azı feçeste bulımur ki bu zoledronik asit farmakokinetiğinde karaciğer fonksiyonımun geçerli bir rolü olmadığını gösterir.5.3. Klinik öncesi güvenlilik verileriAkut toksisiteÖlümcül olmayan en yüksek tek intravenöz doz farelerde 10 mg/kg vücut ağırlığı, sıçanlarda 0.6 mg/kg olmuştur.Subkronik ve kronik toksisiteZoledronik asit sıçanlara subkutan, köpeklere intravenöz olarak 4 hafta boyunca günde 0.02 mg/kg'a kadar dozlarda uygulandığında iyi tolere edilmiştir. Sıçanlara 0.001 mg/kg/gün subkutan ve köpeklere 0.005 mg/kg/gün intravenöz 52 haftaya kadar uygulama da iyi tolere edilmiştir.Üreme toksisitesiZoledronik asit, sıçanda 0.2 mg/kg'a eşit ve üzerindeki subkutan dozlarda teratojeniktir. Tavşanda teratojenite ya da fetotoksisite görülmedi ise de matemal toksisite bulunmuştur.Mutajenite ve karsinojenik potansiyelZoledronik asit, yapılan mutajenite testlerinde mutajenik değildir ve karsinojenite testlerinde herhangi bir karsinojenik potansiyel kanıtına rastlanmamıştır.Lokal toleransTavşandaki lokal tolerans testleri, intravenöz uygulamanın iyi tolere edildiğini göstermiştir.6. FARMASÖTİK ÖZELLİKLER6.L Yardımcı maddelerin listesiMannitolTrisodyum sitrat dihidrat Enjeksiyonluk su 6.2. GeçimsizliklerÖnceden %0.9 a/h (ağırlık/hacim) sodyum klorür çözeltisi veya %5 a/h glukoz çözeltisi ile doldurulmuş Mediflex infuzyon torbalan veya cam şişeler ile yapılaın çalışmalarda, ZORONİC ile bir geçimsizlik saptanmamıştır.Muhtemel geçimsizlikleri önlemek için, ZORONİC konsantre çözeltisi %0.9 a/h sodyum klorür çözeltisi veya %5 a/h glukoz çözeltisi ile seyrehilmelidir. ZORONİC konsantre çözeltisi, kalsiyum ya da Ringer Laktat çözeUisi gibi iki değerlikli katyon içeren diğer infuzyon solüsyonlan ile karıştırılmamalıdır ve diğer tüm ilaçlardan ayrı olarak, tek bir kerede, tek bir intravenöz solüsyon şeklinde uygulanmalıdır. 6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında ve ambalajında saklanır.100 mİ serum fizyolojik veya %5 a/h glukoz çözeltisi ile seyreltilen ZORONİC çözeltisi 2-8°C'de 24 saat stabildir. Aseptik olarak seyreltilmesinden sonra, hemen uygulanması tercih edilir. Hemen kullamlmadığı takdirde, kullanımdan önceki süre ve muhafaza şartları bakımı üstlenen kişinin sorumluluğundadır. Seyreltme, 2-8°C'de buzdolabında saklama ve uygulama arasındaki süre toplam 24 saati geçmemelidir. 6.5. Ambalajın niteliği ve içeriğiZORONİC 4 mg/5 mİ i.v. inflizyon için konsantre çözelti, 1 adet flakon içeren paketler halinde sunulmuştur.Şeffaf flip-off kapaklı, kaplı, kauçuk tıpalı, 8 ml'lik tip I renksiz cam flakon 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerZORONİC 4 mg/5 mİ i.v. inflizyon için konsantre çözelti sadece intravenöz uygulama içindir. Uygulamadan önce, bir flakondaki 5.0 mİ veya ihtiyaç duyulan hacim konsantre çözelti 100 mİ kalsiyum içermeyen infuzyon çözeltisi (%0.9 a/h sodyum klorür çözeltisi veya %5 a/h glukoz çözeltisi) ile seyreltilir. Buzdolabmda muhafaza edildiği takdirde, uygulamadan önce çözeltinin oda sıcaklığma erişmesi için bir süre bekletilmelidir. Ayrıca bkz. Bölüm 4.2. Pooloji ve uygulama şekli.Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNOBEL İLAÇ PAZARLAMA VE SANAYİİ LTD. ŞTİ.İnkılap Mah. Akçakoca Sok. No; 10 34768 Ümraniye / İSTANBUL Tel: (216) 633 60 00 Fax: (216) 633 60 01-02 8. RUHSAT NUMARASI236/279. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 27.10.2011 Ruhsat yenileme tarihi:10.KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriZoronic 4mg/5ml IV İnfüzyon İçin Konsantre Çözelti İçeren FlakonEtken Maddesi: Zoledronik asit monohidrat Atc Kodu: M05BA08 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.