Triaxon 500 Mg Iv Enjeksiyonluk Toz ve Çözücü Kısa Ürün BilgisiKISA ÜRÜN BİLGİLERİ1. BEŞERİ TIBBİ ÜRÜNÜN ADITRİAXON 500 mg I.V. enjeksiyonluk toz ve çözücü 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeYardımcı madde:Yardımcı madde içermemektedir.Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti tozu Beyaz ya da beyazımsı kristalize toz 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarTRİAXON'a duyarlı patojenlerin neden olduğu enfeksiyonlar: - Sepsis, - Menenjit, - Dissemine Lyme borreliosis'i (hastalığın erken ve geç evreleri), - Abdominal enfeksiyonlar (peritonit, safra ve gastrointestinal sistem enfeksiyonları), - Kemik, eklem, yumuşak doku, cilt ve yara enfeksiyonları, - İmmün sistem bozukluğuna bağlı enfeksiyonlar, - böbrek ve idrar yolları enfeksiyonları, - Solunum yolları enfeksiyonları, özellikle pnömoni, kulak-burun-boğaz enfeksiyonları, akutbakteriyel komplike olmayan otitis media, - Gonore dahil olmak üzere genital enfeksiyonlar, - Preoperatif enfeksiyon profilaksisi. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresiDoktor tarafından başka şekilde tavsiye edilmediği takdirde; 1 / 19 Standart doz Yetişkinler ve 12 yaşından büyük çocuklar: Normal olarak günde tek doz 1-2 g (24 saatte bir) TRİAXON'dur. Ağır vakalarda veya orta derecede duyarlı organizmaların neden olduğu enfeksiyonlarda günde tek doz, 4 g'a çıkabilir. Tedavi süresi: Tedavi süresi hastalığın seyrine göre değişir. Genellikle bütün antibiyotik tedavilerinde olduğu gibi, hastanın ateşi düştükten veya bakteriyel eradikasyon sağlandıktan sonra en az 48-72 saat TRİAXONtedavisine devam edilmelidir. Kombine tedavi: Deneysel koşullar, birçok gram-negatif bakterilere karşı TRİAXON ile aminoglikozidler arasında sinerji olduğunu göstermektedir. Bu tür kombinasyonlarda aktivite artışı her zaman kesin olmasa da,Pseudomonas aeruginosa gibi patojenlerin neden olduğu ciddi ve hayatı tehdit eden enfeksiyonlardaTRİAXON ile aminoglikozidler kombine edilebilinir. Ancak bu iki ilaç, aralarındaki fizikselgeçimsizlik nedeniyle önerilen dozlarda ayrı ayrı uygulanmalıdır. Menenjit:Bebek ve çocuklardaki bakteriyel menenjitte tedaviye günde tek doz 100 mg/kg (4 g aşılmamalıdır) ile başlanır. Etken organizmalar belirlenip duyarlılık testleri yapıldıktan sonra, gerekirsedoz azaltılabilir. En iyi tedavi sonuçları aşağıdaki tedavi sürelerinde elde edilmiştir:Neisseria meningitidis: 4 gün Haemophilus influenzae: 6 günStreptococcus pneumoniae: 7 gün Lyme borreliosis:Çocuk ve yetişkinlerde, 14 gün boyunca günde tek doz olarak 50 mg/kg ile en fazla 2 g arasında uygulanır.Gonore:Gonore (penisilinaz üreten ve üretmeyen suşlar) tedavisinde i.m. olarak 250 mg tek doz TRİAXON önerilir.Preoperatif profilaksi:Enfeksiyon riskine bağlı olarak operasyondan 30-90 dakika önce 1-2 g'lık tek doz TRİAXON uygulaması önerilir. Kolorektal cerrahide, TRİAXON'in tek başına veyaornidazol gibi 5-nitroimidazol türevinin birlikte (ayrı ayrı verilerek) uygulanmasının etkili olduğu2 / 19 Uygulamaekli:TRİAXON çözeltisi hazırlandıktan hemen sonra kullanılmalıdır. İntravenöz enjeksiyon: IV enjeksiyon için, TRİAXON 500 mg 5 ml, TRİAXON 1 g ise 10 ml steril enjeksiyonluk suda çözünür. İntravenöz uygulama 2-4 dakika içinde gerçekleştirilmelidir. İntravenöz infüzyon İnfüzyon en az 30 dakika süreyle verilmelidir. İntravenöz infüzyon için, 2 g TRİAXON aşağıdaki kalsiyum içermeyen çözeltilerden birinde 40 ml'de çözülür: Sodyum klorür%0,9, Sodyum klorür %0,45 + dekstroz %2,5, dekstroz %5, dekstroz %10, dekstran %6, %5 dekstroziçinde, hidroksi etil nişasta %6-10, enjeksiyonluk su. TRİAXON çözeltileri muhtemelgeçimsizliklerden dolayı diğer antimikrobiyal ilaçları içeren çözeltilerle veya yukarıda listenenlerdenfarklı çözücülerle karıştırılmamalıdır. Çökelti oluşabileceğinden; TRİAXON flakonları sulandırmak veya sulandırılmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içerençözücüler kullanmayınız. Ayrıca, TRİAXON aynı IV uygulama hattında kalsiyum içeren çözeltilerlekarıştırıldığında da seftriakson-kalsiyum çökeltisi meydana gelebilir. TRİAXON bir Y-bölgesindenparenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmak üzere eş zamanlı olarakkalsiyum içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak, neonatlar dışındaki hastalarda,TRİAXON ve kalsiyum içeren çözeltiler infüzyonlar arasında infüzyon hatlarının uygun bir sıvıylaçok iyi yıkanması şartı ile birbirinin ardından sıralı olarak uygulanabilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Sadece böbrek fonksiyon bozukluğu olan, karaciğer fonksiyonları normal hastalarda TRİAXON dozunu azaltmaya gerek yoktur. Ancak preterminal safhada böbrekyetmezliği olanlarda (kreatinin klirensi < 10 ml/dakika) TRİAXON dozu günde 2 g'ı aşmamalıdır.Sadece karaciğer hasarı olan, böbrek fonksiyonları normal hastalarda TRİAXON dozunu azaltmayagerek yoktur.Ciddi böbrek ve karaciğer fonksiyon bozukluklarının bir arada görüldüğü vakalarda, seftriakson 3 / 19 plazma konsantrasyonları düzenli olarak kontrol edilmeli ve gerektiğinde doz ayarlaması yapılmalıdır. Diyalize alınan hastalara diyaliz sonrasında supleman olarak ilave dozlara gerek yoktur. Ancak buhastalarda eliminasyon oranı değişmiş olabileceğinden, doz ayarlamasının gerekli olup olmadığınıbelirlemek için serum konsantrasyonları kontrol edilmelidir. Pediyatrik popülasyon:Yenidoğan, bebek ve 12 yaşından küçük çocuklarda: Aşağıda belirtilen doz şeması günde tek dozda uygulanır. Yenidoğanlar (14 günlüğe kadar): Günde tek doz 20-50 mg/kg vücut ağırlığı; günlük doz 50 mg/kg'ı aşmamalıdır. Prematüre ve matür bebekler için farklı uygulama gerekli değildir. Seftriakson ve intravenöz kalsiyum içeren ürünlerin eş zamanlı olarak yeni doğanlarda (<28 gün) kullanımı kontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya bu ürünleri kullanmasıbeklenen) yeni doğanlarda TRİAXON kullanılmamalıdır (Bkz: 4.3. Kontrendikasyonlar). Bebek ve çocuklar (15 günlükten 12 yaşına kadar): Günde tek doz 20-80 mg/kg. Vücut ağırlığı 50 kg veya üstünde olan normal çocuklarda normal yetişkin dozu kullanılmalıdır. Akut bakteriyel komplike olmayan otitis media tedavisi için 50 mg/kg dozunda (1g'ı aşmamakkoşuluyla) tek uygulama önerilmektedir (single-shot therapy). Geriyatrik popülasyon:Geriatrik hastalarda, yetişkinler için önerilen dozlar kullanılır. 4.3. KontrendikasyonlarTRİAXON sefalosporin sınıfı antibiyotiklere karşı aşırı hassasiyeti olan hastalarda kontrendikedir. Penisiline karşı aşırı hassas hastalarda çapraz alerjik reaksiyonların görülebileceği unutulmamalıdır.Seftriakson veya ilacın içerdiği diğer yardımcı maddelerden herhangi birine karşı aşırı duyarlılığıolduğu bilinen hastalarda TRİAXON kullanımı kontrendikedir. Hiperbilirubinemili yeni doğanlar veprematüre yeni doğanlar seftriakson ile tedavi edilmemelidir. İn vitro çalışmalar seftriaksonunbilirubini serum albumininden ayırabildiğini ve bu hastalarda bilirubin ensefalopatisi gelişebileceğinigöstermiştir. Seftriakson ve intravenöz kalsiyum içeren ürünlerin eş zamanlı olarak yenidoğanlarda(<28 gün) kullanımı kontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya bu ürünleri 4 / 19 kullanması beklenen) yenidoğanlarda seftriakson kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriDiğer sefalosporinlerde olduğu gibi, sefalosporinlere karşı alerjisi olduğu bilinmeyen ya da daha önceden alerjik reaksiyon geçirmeyen kişilerde dahi ölümcül olabilen anafilaktik reaksiyonlarbildirilmiştir. TRİAXON gibi sefalosporin sınıfı antibakteriyel ilaç kullanan çocuk ve yetişkin hastalarda immün-sistem aracılı hemolitik anemi olguları gözlenmiştir. Seftriakson tedavisi sırasında anemi görülürse sefalosporine bağlı anemi tanısı göz önünde bulundurulmalıdır ve hastalığın etyolojisi tespit edilene kadar tedavi durdurulmalıdır. Clostridium difficile-kaynaklı diyare (CDAD) TRİAXON dahil hemen hemen tüm antibakteriyel ajanların kullanımı ile bildirilmiştir. Antibakteriyel maddelerle tedavi kolonun normal florasınıdeğiştirerek C.difficile'nin aşırı çoğalmasına yol açmaktadır. C.difficile, CDAD gelişime katkıda bulunan A ve B toksinlerini meydana getirmektedir. Bu enfeksiyonlar antimikrobiyal tedaviye dirençliolduğundanve kolektomi yapılmasını gerektirebildiğinden, C.difficile'in aşırı toksin üreten suşları artan morbidite ve mortaliteye neden olabilmektedir. Antibiyotik kullanımının ardından diyare görülen tüm hastalarda CDADdüşünülmelidir. CDAD'ın antimikrobiyal maddelerin uygulanmasının ardından iki aya kadargörülebildiği bildirildiğinden, dikkatli tıbbi anamnez önemlidir. Eğer CDAD'dan şüpheleniliyor veya bu durum doğrulanmış ise, doğrudan C. difficile'ye yönelik olmayan antibiyotik tedavisinin kesilmesi gerekebilir. Klinik olarak gerekli olması durumunda gereklisıvı ve elektrolit yönetimi, protein desteği, antibiyotikle C. difficile tedavisi ve cerrahi değerlendirmeyapılmalıdır. Antibiyotik ilişkili diyare, kolit veya psödomembranöz vakaları seftriakson kullanımında bildirilmiştir. Ciddi veya kanlı diyare görüldüğünde tedavi sonlandırılmalıdır. Gastrointestinal bir hastalığı olanveya daha önce kolit hikayesi olan hastalarda dikkatli olunmalıdır. Diğer sefalosporinlerde gözlendiğigibi seftriaksonun uzun süre kullanılması duyarlı olmayan organizmaların (EnterococcusCandidatürleri gibi) gelişmesine yol açabilir.5 / 19 Günümüzde bilimsel veriler, seftriakson veya kalsiyum içeren çözeltilerle veya diğer kalsiyum içeren ürünlerle tedavi edilen neonatlar haricindeki hastalarda herhangi bir intravasküler çökeltibildirimi olmamıştır. Ancak, seftriakson farklı infüzyon yollarından olsa dahi hiçbir hastaya kalsiyumiçeren çözeltilerle birlikte veya bunlarla karıştırılarak verilmemelidir (Bkz. 4.2 Kontrendikasyonlar)Diğer antibakteriyel ilaçlarda olduğu gibi, duyarlı olmayan mikroorganizmaların neden olduğu süperenfeksiyonlarla karşılaşılabilinir. Önerilenden daha yüksek doz uygulanan vakalarda, safra kesesi ultrasonografisinde safra taşını düşündüren gölgeler belirlenmiştir. Bu gölgeler TRİAXON tedavisinin tamamlanması veya araverilmesi sonucu kaybolan kalsiyum seftriakson çökeltileridir. Bu bulgulara, nadiren semptomlar daeşlik edebilir. Semptomatik vakalarda, cerrahi olmayan, konservatif tedavi önerilmektedir. Semptomatik vakalarda TRİAXON tedavisinin sonlandırılmasına hekim karar verir. TRİAXON ile tedavi gören hastalarda safra tıkanmasına bağlı olması muhtemel pankreatit vakaları nadirenbildirilmiştir. Hastaların çoğunda, daha önceden uygulanmış majör bir tedavi, şiddetli hastalık vetam parenteral beslenme gibi safra stazı ve safra tortusu gibi durumlar oluşturabilecek risk faktörleribulunmakta idi. Safra çökmesiyle ilgili olarak, TRİAXON'un başlangıç etkisi yaratıcı veya kofaktörrolü gözardı edilmemelidir. Yenidoğan, bebek ve çocuklarda TRİAXON'un güven ve etkinliği Kullanım Şekli ve Dozu bölümünde açıklanan dozlarla belirlenmiştir. Çalışmalar, diğer sefalosporinlerin olduğu gibi,seftriaksonun da bilirubini serum albümininden ayırabildiğini göstermiştir. Bu nedenlehiperbilirubinemili yenidoğanların TRİAXON ile tedavisi sırasında bu noktaya dikkat edilmelidir.Bilirubin ensefalopatisi gelişme riski bulunan yenidoğanlarda (özellikle prematürelerde) TRİAXONkullanılmamalıdır. Uzun süreli tedavilerde kan tablosu düzenli olarak kontrol edilmelidir. Duyarlıkişilerde aşırı duyarlılık reaksiyonları gelişebilir. Tanı testleri üzerindeki etkisi: TRİAXON tedavisi gören hastalarda Coombs testi nadiren de olsa yalancı pozitiflik verebilir. Diğer antibiyotiklerde olduğu gibi TRİAXON' da galaktozemi testinde yalancı pozitif sonuca neden olabilir.Benzer şekilde, idrarda glikoz tayini için kullanılan enzimatik olmayan testlerde de yalancı pozitifsonuç alınabilir. Bu nedenle, TRİAXON tedavisi sırasında idrarda glikoz tayini enzimatik testlerle 6 / 19 yapılmalıdır. Pediyatri: Term ve preterm bebeklerin akciğer ve böbreklerinde ölümcül olan seftriakson- kalsiyum çökeltileri bildirilmiştir. 28 günden büyük hastalarda seftriakson ve kalsiyum içeren ürünler ardışık olarakkullanılabilir. Bu durumda infüzyon yolu uygun sıvılar verilerek iyice yıkanmalıdır. Seftriakson hiçbir yaş grubunda intravenöz kalsiyum içeren solüsyonlarla aynı anda bir ''Y-seti'' kullanılarak verilmemelidir.Seftriakson Ringer ve Hartmann solusyonu gibi kalsiyum içeren solüsyonlarla veya kalsiyum içerenparenteral beslenme solüsyonu ile sulandırılmamalı veya karıştırılmamalıdır. İntravenöz seftriakson veoral kalsiyum içeren ürünler arasında veya intramusküler seftriakson ile intravenöz veya oralkalsiyum içeren arasındaki etkileşim konusunda henüz yeterli bilgi bulunmamaktadır. Bu tıbbi ürün her bir flakonda 41,47 mg sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olan hastalar göz önünde bulundurulmalıdır. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriŞimdiye kadar, yüksek doz TRİAXON ile güçlü diüretiklerin (örneğin, furosemid) aynı anda uygulanması sonucu herhangi bir böbrek fonksiyon bozukluğuna rastlanmamıştır. TRİAXON'un, aminoglikozidlerin renal toksisitesini artırdığına ilişkin bir bulgu yoktur. TRİAXON uygulamasının ardından alkol alındığında disülfiram benzeri etkiler gözlenmemiştir. Seftriaksonun kimyasal yapısında diğer bazı sefalosporinlerde bulunan, etanol intoleransı ve kanama sorunlarına neden olabilen N-metiltiotetrazol bulunmaz. TRİAXON'un eliminasyonu probenesid ile etkilenmez. In vitro bir çalışmada, kloramfenikol ve seftriakson kombinasyonunun antagonist etki gösterdiği saptanmıştır. Literatür raporlarına göre, seftriakson amsakrin, vankomisin, flukonazol ve aminoglikozidlerle geçimsizdir. Çökelti oluşabileceğinden; TRİAXON flakonları sulandırmak veya sulandırılmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içeren 7 / 19 çözücüler kullanmayınız. Ayrıca, TRİAXON aynı IV uygulama hattında kalsiyum içeren çözeltilerle karıştırıldığında da seftriakson-kalsiyum çökeltisi meydana gelebilir. TRİAXON bir Y-bölgesindenparenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmak üzere eş zamanlı olarakkalsiyum içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak, neonatlar dışındaki hastalarda,TRİAXON ve kalsiyum içeren çözeltiler infüzyonlar arasında infüzyon hatlarının uygun bir sıvıylaçok iyi yıkanması şartı ile, birbirinin ardından sıralı olarak uygulanabilir. TRİAXON tedavisi gören hastalarda Coombs testi nadiren de olsa yalancı pozitiflik verebilir. Diğer antibiyotiklerde olduğu gibi TRİAXON de galaktozemi testinde yalancı pozitif sonuca neden olabilir.Benzer şekilde, idrarda glikoz tayini için kullanılan enzimatik olmayan testlerde de yalancı pozitifsonuç alınabilir. Bu nedenle, TRİAXON tedavisi sırasında idrarda glikoz tayini enzimatik testlerleyapılmalıdır. Seftriakson hormonal kontraseptiflerin etkinliğini istenmeyen biçimde etkileyebilirler. Sonuç olarak, tedavi sırasında veya tedaviyi takip eden ilk ay destekleyici ve hormonal olmayan kontraseptifönlemlerin kullanılması önerilmelidir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda TRİAXON kullanımına ilişkin klinik veri mevcutdeğildir.Ancak, seftriaksonun hormonal kontraseptif ilaçların etkinliği üzerinde ters etki gösterme olasılığı bulunmaktadır. Bu nedenle, hastalara seftriakson tedavisi sırasında veya tedaviyi takip eden ilk aydestekleyici ve hormonal olmayan kontraseptif önlemlerin kullanılması önerilmektedir. Gebelik dönemiSeftriakson plasenta engelini aşar. İnsanda gebelikte kullanımının güvenirliliği henüz kesinleşmemiştir. Hayvanlarda yürütülen üreme çalışmaları embriyotoksisite, fetotoksisite, teratojenisite veya doğumda, perinatal ve postnatal gelişimde erkek veya dişi fertilitesinde olumsuzetkiler göstermemiştir. Primatlarda embriyotoksisite veya teratojenisite gözlenmemiştir. 8 / 19 Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemiSeftriakson anne sütüne küçük miktarlarda da olsa geçtiği için, emziren annelerde bu durumun göz önünde bulundurulması önerilmektedir. Üreme yeteneği /Fertilite:İntravenöz yolla uygulanan ve 586 mg/kg/gün' e kadar olan seftriakson dozu sıçanlarda üreme yeteneğini bozmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkilerKişinin motorlu taşıt ve makine kullanma yetisi üzerinde olumsuz etkisi olduğuna dair bir veri bulunmamaktadır. TRİAXON, bazen sersemlik veya baş dönmesine yol açabildiği için motorlu taşıtkullanımını veya makine kullanımını etkileyebilir. 4.8. İstenmeyen etkilerÇok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). TRİAXON kullanımı sırasında kendiliğinden veya ilacın kesilmesiyle ortadan kalktığı gözlenen yan etkiler aşağıda belirtilmiştir. Enfeksiyonlar ve enfestasyonlarSeyrek: Genital bölgede mikoz Değişik bölgelerde maya, mantar veya diğer dirençli organizmalarla görülen süperenfeksiyonlar. Kan ve lenf sistemi hastalıklarıSeyrek: Nötropeni, eozinofili, lökopeni, granülositopeni, hemolitik anemiyi de içeren anemi, trombositopeni, protrombin zamanında hafif uzama. Çok seyrek: Koagülasyon bozuklukları Çoğunluğu 10 günlük tedavi sonucunda ve toplam 20 g veya daha yüksek dozların uygulanmasından 9 / 19 3 sonra bazı tek tük agranülositoz vakaları (< 500/mm ) bildirilmiştir. Bağışıklık sistemi hastalıklarıSeyrek: Anafilaktik (örn. bronkospazm) veya anafilaktoid reaksiyonlar Sinir sistemi hastalıklarıSeyrek: Baş ağrısı ve baş dönmesi Gastrointestinal hastalıklarıYaygın: Yumuşak dışkı ya da ishal, bulantı, kusma Seyrek: Stomatit ve glossit. Bu yan etkiler genellikle hafiftir ve tedavi sırasında veya tedavinin sonlamasının ardından çoğunlukla kaybolurlar. Çok seyrek (izole vakalar): Psödomembranöz kolit (çoğunlukla Clostridium difficile'nin neden olduğu),Hepato-bilier hastalıklarıSeyrek: Karaciğer enzimlerinde artış (AST, ALT, alkalin fosfataz) Özellikle önerilen stardart dozun üzerinde ilaç alan kişilerde seftriakson-kalsiyum tuzu çökelmesi gözlemlenmiştir. Prospektif çalışmalar, çocuklarda iv uygulama ile çökelme insidansında değişkenlikgöstermiştir ve yavaş infüzyon yöntemi ile (20-30 dk) çökelme insidansının azalması beklenmektedir.Genelde asemptomatik olan bu olaya nadiren ağrı, bulantı, kusma gibi klinik semptomlarda eşliketmiştir. Seftriakson tedavisi sonlandırıldığında çökelme ortadan kalkmaktadır. Deri ve deri altı doku hastalıklarıYaygın olmayan: Makülopapülar raş, ekzantem gibi alerjik deri reaksiyonları veya, alerjik dermatit, kaşıntı, ürtiker, ödem. Çok seyrek: İzole vakalarda, eritema multiforme, Stevens Johnson sendromu veya Lyell's sendromu / toksik epidermal nekroliz 10 / 19 Böbrek ve idrar hastalıklarıSeyrek: Serum kreatininde artış, oligüri, glikozüri, hematüri. Çok seyrek: İzole raporlarda, çoğunluğu 3 yaşından büyük, yüksek doz (örn. >80mg/kg/gün) veya toplam 10 g'ı aşan dozlarda tedavi gören ve diğer risk faktörlerini gösteren (örn. sıvı kısıtlamaları,yatağa bağımlılık, vs) çocuklarda renal presipitasyon bildirilmiştir. Ancak, ilaç kesildiği taktirdepresipitasyon ortadan kalkar. Bu olaya böbrek yetmezliği ve anürinin eşlik ettiği gözlenmiştir. Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıSeyrek: Ateş, rigor, flebilit ve İV uygulamaya bağlı olarak enjeksiyon bölgesinde ağrı. Ağrı, en az 2-4 dk sürede ve yavaş enjeksiyon uygulaması ile minimum düzeye indirilebilir. Lidokain çözeltisi olmadan intramüsküler enjeksiyon ağrılıdır. Araştırmalar4.9. Doz aşımı ve tedavisiDoz aşımında, bulantı, kusma veya diyare görülebilir. İlaç konsantrasyonu hemodiyaliz veya periton diyaliziyle azaltılamaz. Spesifik bir antidot bulunmamaktadır. Doz aşımı tedavisi semptomatikolmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diğer beta-laktam antibiyotikleri (3. Kuşak sefalosporinler) ATC kodu: J01DD04 Seftriakson, hücre duvarı sentezini inhibe ederek bakterisid etki gösterir. Seftriakson, gram-negatif ve gram-pozitif mikroorganizmaların büyük bir kısmında in vitro etkilidir. Seftriakson, gram-pozitif vegram-negatif bakterilerin penisilinaz ve sefalosporinazlarına, P-laktamazların çoğuna karşı yüksekoranda stabildir. Seftriakson aşağıdaki mikroorganizmalara karşı in vitro ve klinik enfeksiyonlardaetkilidir (Endikasyonları bölümüne bakınız). 11 / 19 Gram-pozitif aeroblar:Metisiline duyarlı StaphylococcusS. epidermisStreptococcus pyogenes (AStreptococcus agalactiaeStreptococcus bovis, Streptococcus pneumoniae11: Hem in vitro,in vivoStaphylococcusEnterococcus faecalisEnterococcus faeciumListeria monocytogenesde dirençlidir.Metisiline dirençli koagülaz negatif Staphylococcus(S. epidermidisgibi) doğal olarak dirençli organizmalardır.Gram-negatif aeroblar:+Acinetobacter türleri (Acinetobacter lwoffi, Acinetobacter anitratusA. baumanii]*, Acinetobacter calcoaceticus)1, Aeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans,AlcaligenesBorrelia burgdorferi, CapnocytophagaCitrobactertürleri(Citrobacter diversus [C. amalonaticusCitrobacter freundii**), Escherichia coli1, +Enterobacter aerogenes1*, +Enterobacter cloacae1*, +Enterobacter türleri (diğer)1*, Haemophilus ducreyi,Haemophilus influenzae (beta- laktamaz pozitif izolatları1 dahil), Haemophilus parainfluenzae1,Hafnia alvei, Klebsiella(Klebsiella oxytoca, Klebsiella pneumoniae**), Moraxella catarrhalis 1(Branhamella catarrhalis), Moraxella osloensis, MoraxellaMorganella morganii1,Neisseria gonorrhoea1Neisseria meningitidis1, Pasteurella multocida,Plesiomonas shigelloides, Proteus(Proteus mirabilis1, Proteus penneri*, Proteus vulgaris1Pseudomonas fluorescens*, PseudomonasProvidentia rettgeri*, ProvidentiaSalmonella typhi, SalmonellaSerratia(Serratiamarsescens*), SerratiaShigellaVibrioYersinia enterocolitica, Yersiniatürleri (diğer)1: Hem in vitroin vivoolarak seftriaksona duyarlılık göstermiş olan türler* Bu türlerin izole edilen bazı suşları, özellikle kromozomal P-laktamaz üreterek seftriaksona direnç göstermektedir. 12 / 19 ** Bu türlerin izole edilen bazı suşları, özellikle genişletilmiş spektrumlu ve plazmide bağlı P-laktamaz üreterek seftriaksona direnç göstermektedir. +: Bir veya birden fazla Avrupa Birliği bölgesinde yüksek direnç oranlarının gözlendiği türler, mikroorganizmaların duyarlı olup olmama olasılığı konusunda tahmini bir kılavuz niteliğitaşımaktadır. Not: Yukarıdaki organizmaların, amino- ve üreido-penisilinler, eski sefalosporinler ve aminoglikozidler gibi diğer antibiyotiklere karşı multipl direnç gösteren birçok suşu, seftriaksona duyarlıdır. Treponema pallidum,P. Aeruginosa +suşları seftriaksonadirençlidir.Listeria monocytogenes, MycoplasmaStenotrophomanas maltophilia, Ureplasmaurealyticum, Chlamydiatürleri de seftriaksona doğal olarak dirençli organizmalardır.Anaerob organizmalar:BacteroidesClostridium türleri1 (C. difficile (C. difficilegrubu hariç),Fusobacterium nucleatumFusobacteriumGaffkia anaerobica (peptococcus), Peptostreptococcustürleri1.1: Hem in vitro,in vivoolarak seftriaksona duyarlılık göstermiş olan türler * Bu türlerin izole edilen bazı suşları, P-laktamaz üreterek seftriaksona direnç göstermektedir.Not: P-laktamaz üreten BacteroidesB. fragilis)dirençlidir.Clostridium difficiledirençlidir.Sınır değerleri:Seftriaksona duyarlılık tayini, disk difüzyon testi, agar veya besiyeri dilüsyon testi gibi, National Committee for Clinical Laboratory Standards (NCCLS) (Klinik Laboratuvar Standartları UlusalKomitesi tarafından önerilen standart teknikler kullanılarak yapılabilir. Aşağıdaki seftriakson duyarlılıkkriterleri NCCLS tarafından bildirilmiştir: 30 mg/L'lık ilaç konsantrasyonu kullanılarak bildirilen değerler mg/L (MIC testi) veya mm'dir (disk difüzyon testi) 13 / 19 Klinik Laboratuvar Standartları Ulusal Komitesi (NCCLS)-(M100-S12)
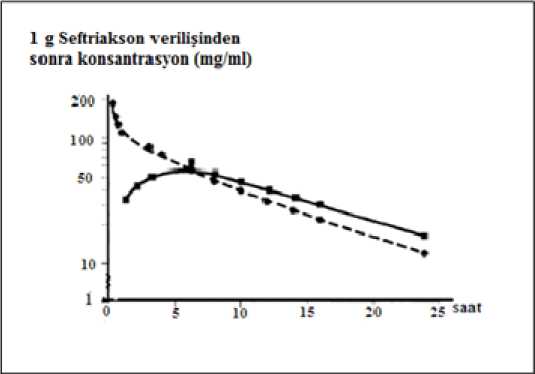
* 2002 S. pneumoniaesınır değerleri (NCCLS M100-S12), non-menenjit örnekler için <1 (Duyarlı), 2 (Orta derece) ve >4 (Dirençli) olarak ve menenjit örnekleri için >0.5 (Duyarlı), 1 (Ortaderece), ve> 2 (Dirençli) olarak belirlenmiştir.** 2002 Streptococcus viridansgrubu sınır değerleri (NCCLS M100-S12) <1 (Duyarlı), 2 (Orta derece), ve >4 (Dirençli) olarak belirlenmiştir.Duyarlılık testleri seftriakson diskleri ile yapılmalıdır, çünkü sefalosporin sınıfı disklerle yapılan in vitro testlerde dirençli olduğu bilinen suşlara karşı TRİAXON'in etkili olduğu görülmüştür. NCCLSkriterlerinin kullanılmadığı ülkelerde alternatif olarak DIN, ICS veya diğer standart ve yorumlanabilirduyarlılık testleri kullanılabilir. 14 / 19 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:İntramüsküler, tek doz 1 g'lık uygulamadan sonraki 2-3 saat içinde ulaşılan maksimum plazma konsantrasyonu 81 mg/litre'dir.Bolus intravenöz enjeksiyondan sonra ortalama pik konsantrasyonlar, 500 mg'lık dozu takiben yaklaşık olarak 120 mg/l ve 1 gramlık dozu takiben yaklaşık olarak 200 mg/l'dir; 30 dakikalık 2 gramlık infüzyondan sonra ortalama 250mg/l'lık düzeyler elde edilir. %1,06'lık lidokainde 500 mg TRİAXON'un intramüsküler enjeksiyonu, 1 saat içinde 40-70 mg/l'lık ortalama pik plazma konsantrasyonları oluşturur. İntramüsküler enjeksiyondan sonra biyoyararlanım%100'dür. Dağılım: Seftriaksonun dağılım hacmi 7-12 litredir. Seftriakson 1-2 g'lık dozdan sonra akciğer, kalp, safra yolu/karaciğer, tonsillalar, orta kulak ve nazal mukoza, kemik, serebrospinal, plevra, prostatve sinovyal sıvılarının da dahil olduğu 60'ın üzerinde doku ve vücut sıvısında, etken patojenlerinçoğunun minimum inhibisyon konsantrasyonunun üzerinde ve 24 saatten uzun sürelerle mükemmelpenetrasyon sağlamaktadır.İntravenöz uygulamada, seftriakson interstisyel sıvıya süratle difüze olur ve duyarlı organizmalara karşı 24 saat süren bakterisid konsantrasyonlar sağlanır (şekle bakınız). TRİAXON'un farmakokinetiği,büyük ölçüde konsantrasyona bağlı olarak serum albüminine bağlanması ile belirlenir. İnsanda ilacınplazmada serbest (bağlı olmayan) fraksiyonu, terapötik konsantrasyon aralığının çoğu için yaklaşıkolarak %5'tir ve 300 mg/l'lik konsantrasyonlarda %15'e yükselir. Seftriakson albümine geri dönüşümlü olarak bağlanır ve bağlanma oranı ilacın kandaki konsantrasyonu yükseldikçe azalır; örneğin, 100 mg/litre'den düşük plazmakonsantrasyonlarında %95, 300 mg/litre'likplazma konsantrasyonlarında ise %85 bağlanma görülür. Düşük albümin miktarına bağlı olarakinterstisyel sıvıdaki serbest seftriakson oranı plazmadakine göre daha yüksektir. 15 / 19 Seftriakson, yenidoğan, bebek ve çocuklarda enflamasyonlu meninkslere penetre olur. Bebek ve çocuklarda 50-100 mg/kg i.v. TRİAXON enjeksiyonunu izleyen 24 saat içinde,serebrospinal sıvıdaseftriakson konsantrasyonu 1,4 mg/litre'nin üstündedir. Serebrospinal sıvıda ortalama 18 mg/l olandoruk konsantrasyona i.v. enjeksiyondan yaklaşık 4 saat sonra ulaşılır. Ortalama serebrospinal sıvıdüzeyleri, bakteriyel menenjitte plazma konsantrasyonunun %17'si, aseptik menenjitte ise %4'ükadardır. Menenjitli erişkinlerde 50 mg/kg'lık uygulamayla 2-24 saat süreyle elde edilenserebrospinal sıvı konsantrasyonları, menenjitte en sık rastlanan etken patojenlerin MİK değerlerininbirkaç kat üzerindedir. Seftriakson plasentadan geçer ve anne sütünde düşükkonsantrasyonlarda bulunur. Biyotransformasyon:Seftriakson sistematik olarak metabolize edilmez, fakat bağırsak florası tarafından inaktif metabolitlere dönüştürülür.Eliminasyon:TRİAXON esas olarak değişmeden atılır. Seftriaksonun %50-60'ı değişmemiş olarak idrarla (tamamına yakını glomerüler filtrasyon ile), %40-50'si ise değişmemiş olarak safrayla vebağırsaklarla atılır.Seftriaksonun total plazma klerensi 10-22 ml/dakika'dır. Renal klerens 5-12 ml/dakikadır. Yetişkinlerde eliminasyon yarı-ömrü yaklaşık 8 saattir ve yarı ömür, doz, uygulama yolu veyatekrarlanan uygulamalardan büyük ölçüde etkilenmez. Doğrusallık/ doğrusal olmayan durum: Seftriaksonun farmakokinetiği lineer değildir. Toplam ilaç16 / 19 konsantrasyonu bazında eliminasyon yarı-ömrü hariç, tüm temel farmakokinetik parametreler doza bağımlıdır. Hastalardaki karekteristik özellikler:Yaşlı hastalar:75 yaşın üstündeki yaşlı hastalarda ortalama eliminasyon yarı ömrü genç yetişkinlerle karşılaştırıldığında genellikle 2-3 kez daha uzundur. Tüm sefalosporinlerde olduğu gibi, yaşlıhastalarda böbrek fonksiyonundaki azalma, yarı ömürde uzamaya yol açabilir. Ancak, seftriaksonlailgili bugüne kadar toplanan bulgular, doz rejiminde değişiklik yapılmasının gerekli olmadığınıgöstermektedir.Yeni doğanlar:Yeni doğan bebeklerde ilk hafta dozun % 80'i idrarla atılır. Sekiz günlükten küçük bebeklerde ortalama eliminasyon yarı-ömrü genç erişkinlerle karşılaştırıldığında 2-3 kez daha uzundur.Böbrek ve karaciğer yetmezliği olan hastalar:Böbrek veya karaciğer yetmezliği olan hastalarda, seftriaksonun farmakokinetik özelliklerinde çok az değişiklik gözlenir ve eliminasyon yarı ömrü hafifdüzeyde uzar. Tek başına böbrek fonksiyonlarında bozukluk varsa seftriaksonun safra yoluyla atılımıve tek başına karaciğer fonksiyonlarında bozukluk varsa böbrek yoluyla atılımı artar.Beyin omurilik sıvısı: TRİAXON inflamasyonlu ve inflamasyonsuz meninkslerden geçer (eş zamanlı plazma konsantrasyonunun %4-17'si düzeyinde bir konsantrasyona ulaşır). 5.3. Klinik öncesi güvenlilik verileriİnsanlarda üreme çalışmaları embriyotoksisite, fetotoksisite, teratojenisite veya doğumda, perinatal ve postnatal gelişimde erkek veya dişi fertilitesinde olumsuz etkiler göstermemiştir. Primatlardaembriyotoksisite veya teratojenisite gözlenmemiştir. 6. FARMASÖTK ÖZELLİKLER6.1. Yardımcı maddelerin listesiTRİAXON 0,5 g i.v. enjeksiyonluk çözelti hazırlamak için toz içeren flakon herhangi bir yardımcı madde içermemektedir. 17 / 19 6.2. GeçimsizliklerTRİAXON içeren çözeltiler diğer ajanlar ile karıştırılmamalı veya diğer ajanlara eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örneğin Ringer çözeltisi veya Hartman çözeltisi) seftriaksonflakonlarını rekonstitüe etmek için veya rekonstitüe edilmiş bir flakonu IV uygulama için daha fazlaseyreltmek için kullanılmamalıdır, çünkü çökelti oluşabilir. Seftriakson ve kalsiyum içeren çözeltilerkarıştırılmamalı veya aynı anda uygulanmamalıdır. 6.3. Raf ömrü24 ay. 6.4. Saklamaya yönelik özel tedbirler30°C altındaki oda sıcaklığında saklayınız. Işıktan korumak için flakonu dış kartonun içerisinde tutunuz. 6.5. Ambalajın niteliği ve içeriğiTRİAXON 0,5 g i.v. flakon, 1 adet + 5 ml steril enjeksiyonluk su içeren ampul, 1 adet 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler'Tıbbi atıkların kontrolü yönetmeliği ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmelikleri ne uygun olarak imha edilmelidir Kural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmalıdır. Çözeltilerin renkleri, konsantrasyon ve saklanma sürelerine bağlı olarak açık sarı ile bal rengi arasında değişir. Solüsyonun renginin değişmesi ilacın etki ve toleransını etkilemez. Intravenöz uygulama için 500 mg Triaxon, 5 ml enejksiyonluk su ile sulandırılır, iyice çalkalanır ve 2 -4 dakika içinde direkt olarak intravenöz yoldan enjekte edilir. İntravenöz infüzyon için Triaxon yukarıda belirtilen şekil ve miktarlarda sulandırıldıktan sonra 40 ml uygun ve kalsiyum içermeyen bir infüzyon sıvısı (% 0,9 sodyum klorür, % 0,45 NaCl + % 2,5dekstroz, % 5 ve % 10 dekstroz, % 5 levuloz, dekstroz içinde % 6 dekstran, enjeksiyonluk su) içinekonur ve 30 dakikalık bir süre içinde infüzyon şeklinde uygulanır. 18 / 19 7. RUHSAT SAHİBİKOÇAK FARMA İLAÇ VE KİMYA SANAYİ A.Ş. Bağlarbaşı, Gazi Cad. No: 40 Üsküdar/İSTANBULTel. : 0216 492 57 08Faks : 0216 334 78 88 8. RUHSAT NUMARASI221/28 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİRuhsat tarihi: 16.10.2009 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ19 / 19 |
İlaç BilgileriTriaxon 500 Mg Iv Enjeksiyonluk Toz ve ÇözücüEtken Maddesi: Seftriaxon Disodyum Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.