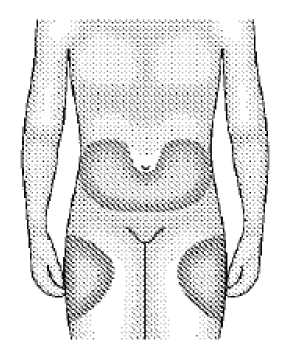
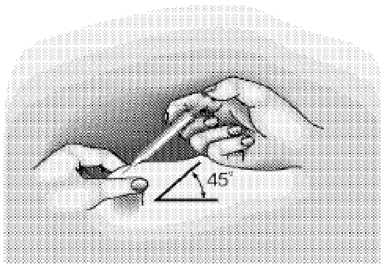
Ocladra 2 Mg / Ml Enjeksiyonluk Çözelti İçeren Flakon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIOCLADRA 2 mg / ml enjeksiyonluk çözelti içeren flakon Steril, sitotoksik 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Kladribin Her bir flakon, 5 mL çözelti içinde 10 mg kladribin içerir. Yardımcı maddeler:Sodyum klorür.................9,0 mg/mL Sodyum hidroksit..............k.m. Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti içeren flakon Berrak, renksiz çözelti 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarOCLADRA tüylü hücreli lösemi tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji / uygulama sıklığı ve süresi:Önerilen doz, 5 gün süreyle günde bir kez tek seferde sub kutan bolus enjeksiyon yoluyla uygulanan 0,14 mg/kg vücut ağırlığıdır. Uygulama şekli:Önerilen doz bir şırınga ile çekilir ve seyreltilmeden, sub kutan bolus enjeksiyon yoluyla enjekte edilir. OCLADRA, uygulama öncesinde oda sıcaklığına getirilmelidir. Hasta tarafından kendi kendine ilaç uygulamasıOCLADRA'yı hasta kendi kendine uygulayabilir. Hastalara uygun şekilde bilgi verilmeli ve hastalar eğitilmelidir. Ayrıntılı talimatlar kullanma talimatında yer almaktadır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek / Karaciğer yetmezliği:Böbrek veya karaciğer yetmezliği olan hastalarda OCLADRA kullanımına ilişkin veri bulunmamaktadır. OCLADRA, orta ila şiddetli derecede böbrek yetmezliği (kreatinin klerensi< 50 mL/dakika) veya orta ila şiddetli derecede karaciğer yetmezliği (Child-Pugh skoru >6)olan hastalarda kontrendikedir (Bkz. Bölüm 4.3, 4.4 ve 5.2). Pediyatrik popülasyon:OCLADRA'nın 18 yaş altındaki hastalarda kullanımı kontrendikedir (Bkz. Bölüm 4.3). Sayfa 1 / 14 Geriyatrik popülasyon:OCLADRA'nın 65 yaş üstü hastalarda kullanımına dair deneyim sınırlıdır. Yaşlı hastalarda kullanım öncesi hasta değerlendirilmeli ve kullanım süresince hastanın kan sayımı, böbrek vekaraciğer fonksiyonları dikkatle izlenmelidir. Her bir hasta için risk değerlendirilmelidir.(Bkz. Bölüm 4.4). 4.3. KontrendikasyonlarOCLADRA aşağıdaki durumlarda kontrendikedir: Etkin madde veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık durumunda Gebelik ve laktasyonda 18 yaş altındaki hastalarda Orta ila şiddetli derecede böbrek yetmezliği (kreatinin klerensi < 50 mL/dakika) veyaorta ila şiddetli derecede karaciğer yetmezliği (Child-Pugh skoru >6) olan hastalarda(Bkz. Bölüm 4.4). Eş zamanlı olarak diğer miyelosupresif ilaçlar kullanıldığında. 4.4. Özel kullanım uyarıları ve önlemleriKladribin; miyelo- ve immüno-supresyon, uzun süren lenfositopeni ve fırsatçı enfeksiyonlar gibi kayda değer toksik advers reaksiyonları tetikleyebilen antineoplastik ve immünosupresifbir maddedir. Kladribin tedavisi gören hastalar hematolojik ve non-hematolojik toksisiteleraçısından yakından izlenmelidir. Şüpheli veya ortaya çıkmış olan böbrek ve karaciğer yetmezliği olan hastalarda, ayrıca yüksek enfeksiyon riski, kemik iliği yetmezliği veya infiltrasyonu, miyelosupresif ön tedavilerinuygulandığı hastalarda kladribin uygulaması düşünülüyorsa özel önlem alınmalı veriskler/yararlar dikkatle değerlendirilmelidir. Aktif enfeksiyonlu hastalar, kladribin ile tedaviöncesinde altta yatan durumlar için tedavi almalıdırlar. Genellikle anti-infektif profilaksiönerilmemekle birlikte, kladribin ile tedavi öncesinde immünitesi zayıflamış veya öncedenvar olan agranülositozu olan hastalar için faydalı olabilir. Şiddetli toksisite meydana gelirse, şiddetli komplikasyonlar çözülene kadar hekim tedaviyi ertelemeyi veya kesmeyi değerlendirmelidir. Enfeksiyon durumunda, gerektiği takdirdeantibiyotik tedavisi başlatılmalıdır. Kladribin alan hastaların, transfüzyon ile ilişkili graft-versus-host hastalığının (Ta-GVHD) önlenmesi için ışınlanmış hücresel kan bileşenleri/ürünleri almaları önerilmektedir. Sekonder Kötü Huylu TümörlerDiğer nükleozid analogları gibi kladribin ile tedavi de miyelosupresyon, etkili ve uzamış immünosupresyonla ilişkilidir. Bu ajanlarla tedavi, sekonder kötü huylu tümörlerin meydanagelmesi ile ilişkilendirilir. Sekonder kötü huylu tümörlerin, tüylü hücreli lösemili hastalardaortaya çıkması beklenir. Sıklıkları %2 ila %21 gibi geniş bir aralıkta değişmektedir. Pik riski,40 ila 66 ay arasında ortalama teşhis sonrasındaki 2 yılda görülmektedir.. İkinci kötü huylutümörlerin kümülatif görülme sıklığı; tüylü hücreli lösemi teşhisinden sonraki 5, 10 ve 15 yılıtakiben, sırasıyla %5, %10-12 ve %13-14'tür. Kladribini takiben, 2,8 ila 8,5 yıl arasındadeğişen gözlem periyodu sonrasında ikincil kötü huylu tümör insidansı %0 ila %9,5 arasındadeğişmektedir. Kladribin tedavisi sonrasında ikincil kötü huylu tümör sıklığı, 10 yıllık bir Sayfa 2 / 14 periyotta tedavi edilen tüm 232 tüylü hücreli lösemi hastalarının %3,4'üdür. Kladribin ile en yüksek ikincil kötü huylu tümör insidansı 8,4 yıllık bir medyan takip sonrasında %6,5'tir. Bunedenle kladribin ile tedavi edilen hastalar dikkatle izlenmelidir. Hematolojik toksisiteTedaviyi takip eden ilk ay boyunca miyelosupresyon göze çarpar ve alyuvar ve trombosit transfüzyonlarına gerek duyulabilir. Kemik iliği fonksiyonunun daha ileri supresyonununöngörülmesi için, kemik iliği depresyonu belirtileri görülen hastalar dikkatle tedaviedilmelidir. Aktif veya şüpheli enfeksiyonu olan hastalarda terapötik riskler ve yararlardikkatle değerlendirilmelidir. Şiddetli miyelotoksisite ve uzun süren immünosupresyon riski,hastalıkla ilişkili kemik iliği infiltrasyonu olan hastalarda veya önceden miyelosupresif tedavialmış olan hastalarda yüksektir. Bu tür durumlarda dozun azaltılması ve hastanın düzenliolarak izlenmesi gerekmektedir. Pansitopeni normalde geri döndürülebilirdir ve kemik iliğiaplazi yoğunluğu doza bağlıdır. Kladribin ile tedavi sırasında ve sonrasındaki 6 ay içindefırsatçı enfeksiyon insidansında artış beklenir. Potansiyel advers reaksiyonları ve bununsonucunda gelişen komplikasyonları (anemi, nötropeni, trombositopeni, enfeksiyonlar,hemoliz veya kanamalar) belirlemek ve hematolojik iyileşmeyi ölçmek için, tedavi sırasındave takip eden 2 ila 4 ay içinde periferik kan sayımının dikkatli ve düzenli olarak izlenmesiesastır. Kaynağı bilinmeyen ateş, tüylü hücreli lösemi tedavisi alan hastalarda sıklıklameydana gelir ve ağırlıklı olarak tedavinin ilk 4 haftasında ortaya çıkar. Febril olaylarınkaynağı uygun laboratuvar ve radyolojik testlerle araştırılmalıdır. Febril olayların üçtebirinden daha azı belgelenen bir enfeksiyon ile ilişkilidir. Enfeksiyonlarla ilişkili ateş veyaagranülositoz durumunda antibiyotik tedavisi gerekir veya önerilir. Progresif multifokal lökoensefalopati (PML)Kladribin kullanımıyla PML olgularının yanısıra ölüm vakaları da bildirilmiştir. PML, kladribinle tedavinin 6.ayından birkaç yıl sonrasına kadar rapor edilmiştir. Bu olgularınbazılarında uzamış lenfopeni ile ilişki gözlenmiştir. Hekimler, yeni veya kötüleşen nörolojik,bilişsel veya davranışsal belirti ve bulguları olan hastalar için PML'yi göz önündebulundurmalıdır. Önerilen PML değerlendirmesi nörolojik konsültasyon, beynin manyetikrezonans görüntülenmesi ve JC virüs için serebrospinal sıvının polimeraz zincir reaksiyonuyla(PCR) analizi veya beyin biyopsisiyle JC virüs bakılması ile olabilir. PCR'ın negatif çıkmasıPML'yi ekarte etmez. Alternatif bir tanı koyma yapılamıyorsa ek takipler ve değerlendirmeleryapılmalıdır. PML şüphesi olan hasta sonraki kladribin tedavilerini de almamalıdır. Böbrek ve karaciğer yetmezliğiBöbrek ve karaciğer yetmezliği olan hastalarda kladribin kullanımı üzerine veri bulunmamaktadır. Klinik deneyim çok sınırlıdır ve kladribinin bu hastalarda güvenliliği iyibelirlenmemiştir (Bkz. Bölüm 4.3 ve 5.2). Bilinen veya şüpheli böbrek veya karaciğeryetmezliği olan hastalarda dikkatli tedavi gerekmektedir. Kladribin ile tedavi edilen tümhastalar için, klinik olarak belirtildiği şekilde böbrek ve karaciğer fonksiyonlarının periyodikdeğerlendirmesi önerilir. Sayfa 3 / 14 YaşlılarYaşlı hastalarda kullanım öncesi hasta değerlendirilmeli ve kullanım süresince hastanın kan sayımı, böbrek ve karaciğer fonksiyonları dikkatle izlenmelidir. Her bir hasta için riskdeğerlendirilmelidir. (Bkz. Bölüm 4.2). Tümör lizis sendromunun önlenmesiTümör yükü yüksek olan hastalarda, serum ürik asit seviyelerini kontrol etmek için, kemoterapinin başlatılmasından 24 saat önce yeterli veya artırılmış hidrasyonla birlikteprofilaktik allopürinol tedavisi başlatılmalıdır. 2 haftalık periyot için 100 mg'lık günlük oralallopürinol dozu önerilmektedir. Serum ürik asitin normal aralığın üstünde birikimidurumunda allopürinol dozu 300 mg/gün'e çıkarılabilir. FertiliteKladribin ile tedavi edilen erkeklere, tedaviden sonraki 6 aya kadar çocuk sahibi olmamaları ve kladribinle tedaviye bağlı olarak infertilite ihtimali nedeniyle tedavi öncesinde spermkriyoprezervasyonu hakkında bilgi almaları önerilmelidir (Bkz. Bölüm 4.6 ve 5.3). Bu tıbbi ürün her flakonda 1 mmol'den daha fazla sodyum içerir. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriHematolojik toksisite ve kemik iliği supresyonunda potansiyel artış nedeniyle kladribin, diğer miyelosupresif tıbbi ürünlerle eş zamanlı olarak kullanılmamalıdır. Kladribinin diğerantineoplastik ajanların etkinliği üzerine etkisi in vitroin vivoin vitroin vivoçapraz-reaksiyon tanımlamıştır.Benzer intraselüler metabolizmaya bağlı olarak, fludarabin veya 2'-deoksikoformisin gibi diğer nükleozid analogları ile çapraz-direnç meydana gelebilir. Bu nedenle, nükleozidanaloglarının kladribin ile eş zamanlı uygulanması önerilmez. Kortikosteroidlerin, kladribin ile kombine olarak kullanıldıklarında şiddetli enfeksiyon riskini artırdığı gösterilmiştir; bu nedenle kladribin ile eş zamanlı olarak verilmemelidirler. Antiviral ajanlar gibi intraselüler fosforilasyona uğrayan tıbbi ürünler veya adenozin alım inhibitörleri ile etkileşimler beklenebileceğinden, bu ilaçların kladribin ile eş zamanlıkullanımı önerilmez. Özel popülasyonlara ilişkin ek bilgiler:Özel popülasyonlara ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir. Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: D Sayfa 4 / 14 Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlar, tedavi süresince ve tedavinin ardından 6 aya kadar etkili doğum kontrolü uygulamak zorundadırlar. Gebelik dönemiOCLADRA'nın gebelik ve/veya fetüs/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. OCLADRA gebelik döneminde kontrendikedir.. OCLADRA gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açmaktadır. Laktasyon dönemiKladribinin insan sütüne geçip geçmediği bilinmemektedir. Emzirilen bebeklerde olası ciddi advers etkiler nedeniyle, OCLADRA ile tedavi sırasında ve son kladribin dozundan sonraki 6ay içinde laktasyon kontrendikedir. Üreme yeteneği / FertiliteKladribinin fertilite üzerine etkisi hayvanlarda çalışılmamıştır. Ancak, sinomolgus maymunları üzerinde yürütülen bir toksisite çalışması kladribinin, testiküler hücreler dahilhızla üreyen hücrelerin olgunlaşmasını baskıladığını göstermiştir. İnsan fertilitesi üzerine etkibilinmemektedir. Kladribin gibi, DNA, RNA ve protein sentezini engelleyen antineoplastikajanların insan gametogenezi üzerinde advers etkiye sahip olmaları beklenebilir (Bkz. Bölüm5.3). OCLADRA ile tedavi edilen erkeklere, tedaviden sonraki 6 aya kadar çocuk sahibi olmamaları ve OCLADRA ile tedaviye bağlı olarak infertilite ihtimali nedeniyle tedaviöncesinde sperm kriyoprezervasyonu hakkında bilgi almaları önerilmelidir (Bkz. Bölüm 4.4). 4.7. Araç ve makine kullanımı üzerindeki etkilerOCLADRA araç ve makine kullanımını üzerinde önemli bir etkisi vardır. Performans üzerinde potansiyel etkisi olan belirli advers reaksiyonların olması durumunda (örn; çokyaygın olan baş dönmesi, anemiye bağlı olarak gelişen ve yaygın görülen uyuşukluk gibi)hastalar araç ve makine kullanmamaları konusunda uyarılmalıdırlar. 4.8. İstenmeyen etkilerÇeşitli endikasyonlar için tedavi edilen 279 hasta ve tüylü hücreli lösemili (THL) 62 hastada kladribin ile en ilgili üç klinik çalışma süresince çok yaygın görülen advers reaksiyonlar;miyelosupresyon, özellikle şiddetli nötropeni (%41 (113/279), THL %98 (61/62)), şiddetlitrombositopeni (%21 (58/279), THL %50 (31/62)), şiddetli anemi (%14 (21/150), THL %55(34/62)), şiddetli immünosupresyon/lenfopeni (%63 (176/279), THL %95 (59/62)),enfeksiyonlar (%39 (110/279), THL %58 (36/62)) ve ateştir (%64'e kadar). Kladribin tedavisini takiben kültür-negatif ateş, tüylü hücreli lösemili hastaların %10-40'ında meydana gelir ve diğer neoplastik hastalıkları olan hastalarda nadir görülmektedir. Cilttedöküntüler (%2-31), cilt döküntüsüne neden olduğu bilinen, eş zamanlı uygulanan diğer tıbbiürünleri (antibiyotikler ve/veya allopürinol) kullanan hastalarda esas olarak tanımlanır.Kladribin tedavisi sırasında; yorgunluk (%2-48), baş ağrısı (%1-23) ve iştah azalması (%1-22) Sayfa 5 / 14 yanı sıra bulantı (%5-28), kusma (%1-13) ve diyare (%3-12) gibi gastrointestinal advers reaksiyonlar bildirilmiştir. Kladribinin alopesiye neden olması muhtemel değildir, tedavisırasında 4/523 hastada birkaç gün için hafif ve geçici alopesi gözlenmiş, ancak bu kladribinlenet bir şekilde ilişkilendirilmemiştir. Bildirilen advers reaksiyonlar sıklık kategorisi ve sistem-organ sınıfına göre aşağıdaki tabloda listelenmektedir. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (>1/10), yaygın (>1/100ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek(<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarÇok yaygın: Enfeksiyonlar* (pnömoni*, septisemi*) (Kist ve polipler dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalarYaygın: İkincil kötü huylu tümörler * Seyrek: Tümör lizis sendromu Kan ve lenf sistemi hastalıklarıÇok yaygın: Pansitopeni/miyelosupresyon *, nötropeni, trombositopeni, anemi, lenfopeni. Yaygın olmayan: Hemolitik anemiSeyrek: HipereozinofiliÇok seyrek: Amiloidoz Bağışıklık sistemi hastalıklarıÇok yaygın: İmmünosupresyon Seyrek: Graft-versus-host hastalığı Metabolizma ve beslenme hastalıklarıÇok yaygın: İştah azalması Yaygın olmayan: Kaşeksi Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı, baş dönmesi Yaygın: İnsomnia, anksiyete Yaygın olmayan: Somnolans, parestezi, letarji, polinöropati, konfüzyon, ataksi. Seyrek: Apopleksi, konuşma ve yutmada nörolojik hasarlar Çok seyrek: Depresyon, epilepsi nöbeti. Göz hastalıklarıYaygın olmayan: Konjunktivit Çok seyrek: Blefarit Kardiyak hastalıklarYaygın: Taşikardi, kalp hırıltısı, hipotansiyon, burun kanaması, miyokard iskemisi Seyrek: Kalp yetmezliği, atriyal fibrilasyon, kalp dekompensasyonu. Vasküler hastalıklarÇok yaygın: Purpura Yaygın: Peteşi, kanamalar* Yaygın olmayan: Flebit Solunum, göğüs bozuklukları ve mediastinal hastalıklarSayfa 6/14 Yaygın olmayan: Farenjit Çok seyrek: Akciğer embolisi Gastrointestinal hastalıklarÇok yaygın: Bulantı, kusma, kabızlık, diyare Yaygın: Gastrointestinal ağrı, şişkinlikSeyrek: İleus Hepato-biliyer hastalıklarYaygın: Bilirubin ve transaminazlarda tersinir ve çoğunlukla hafif artışlar Seyrek: Karaciğer yetmezliğiÇok seyrek: Kolesistit Deri ve deri altı doku hastalıklarıÇok yaygın: Döküntü, bölgesel ekzantem, diyaforez.Yaygın: Prürit, cilt ağrısı, eritem, ürtiker Seyrek: Stevens-Johnson sendromu/Lyell sendromu Kas iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Miyalji, artralji, artrit, kemik ağrısı Böbrek ve idrar hastalıklarıSeyrek: Böbrek yetmezliği Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Enjeksiyon bölgesi reaksiyonları, ateş, yorgunluk, üşüme, asteni Yaygın: Ödem, kırıklık, ağrı *aşağıdaki açıklayıcı bölüme bakınız. Hematolojik olmayan advers reaksiyonlarHematolojik olmayan advers reaksiyonlar genellikle şiddet olarak hafif ila orta derecelidir. Bulantı, antiemetiklerle tedavi edilecek kadar önemli değildir. Deri ve subkutan doku ile ilgiliadvers reaksiyonlar çoğunlukla hafif veya orta derecelidir ve genellikle 30 günlük bir siklusaralığında çözülmekte olup geçicidir. Kan sayımıAktif bir tüylü hücreli lösemisi olan hastalarda çoğunlukla düşük kan sayımı, özellikle de düşük nötrofil sayımı gösterdiği için, vakaların %90'ından fazlası geçici şiddetli nötropenileresahiptir (< 1,0 x 109/L). Hematopetik büyüme faktörlerinin kullanımı, nötrofil sayımınıniyileşmesini arttırmaz veya ateş insidansını düşürmez.. Tüm hastaların yaklaşık %20 ila%30'unda şiddetli trombositopeniler (< 50 x 109/L) gözlenmektedir. Aylarca sürenlenfositopeni ve artmış enfeksiyon riski ile birlikte immünosupresyon beklenmektedir.Sitotoksik T-lenfositleri ve doğal öldürücü hücrelerin geri kazanılması 3 ila 12 ay içindegerçekleşmektedir. T-yardımcı hücreleri ve B-lenfositlerinin tam geri kazanımı 2 yıl kadar Sayfa 7/14 sürebilir. Kladribin, CD4+ ve CD8+ T-lenfositlerinin şiddetli ve uzamış azalmasını uyarır. Bu immünosupresyonun muhtemel uzun dönemli sonuçları ile ilgili deneyim mevcut değildir. EnfeksiyonlarŞiddetli uzun dönemli, ancak geç enfeksiyöz komplikasyonlarla ilişkili olmayan lenfositopeniler seyrek bildirilmiştir. Bazı durumlarda fatal sonuçları olan çok yaygın şiddetlikomplikasyonlar, fırsatçı enfeksiyonlardır (Pneumocystis carinii, Toxoplasma gondii,listeriya, kandida, herpes virüsleri, sitomegalovirüs ve atipik mikobakteri). Her bir siklusta 0,7mg/kg vücut ağırlığı dozunda kladribin ile tedavi edilen hastaların %40'ı enfeksiyongeçirmiştir. Bunlar, her bir siklusta azaltılmış 0,5 mg/kg vücut ağırlığı doz alan tüm hastaların%27'sinde ortaya çıkan enfeksiyonlardan ortalama olarak daha şiddetlidir. Tüylü hücrelilösemili hastaların %43'ü standart doz rejiminde enfeksiyöz komplikasyonlardeneyimlemiştir. Bu enfeksiyonların üçte biri şiddetli olarak değerlendirilmiştir (septisemi,pnömoni gibi). Akut otoimmün hemolitik anemili en az 10 vaka bildirilmiştir. Tüm hastalar,kortikosteroidlerle başarılı bir şekilde tedavi edilmiştir.Nadir görülen ciddi advers reaksiyonlarİleus, şiddetli karaciğer yetmezliği, böbrek yetmezliği, kalp yetmezliği, atriyal fibrilasyon, kalp dekompansasyonu, apopleksi, konuşma ve yutmada nörolojik hasarlar, akut böbrekyetmezliği ile birlikte tümör lizis sendromu, transfüzyon ile ilişkili graft versus host hastalığı,Stevens Johnson sendromu / Lyell sendromu (toksik epidermal nekroz), hemolitik anemi,hipereozinofili (eritemli cilt döküntüsü, prürit ve yüzde ödem ile birlikte) gibi ciddi adversreaksiyonlar nadirdir. Fatal sonuçlarMüstahzar ile ilişkili ölümlerin çoğunluğu enfeksiyöz komplikasyonlar nedeniyledir. Kladribin kemoterapisi ile ilişkili olarak bildirilen ve ölümcül sonuç veren ileri nadir vakalar;ikincil kötü huylu tümör, serebro veya kardiyovasküler enfarktüs, ışınlanmamış kanın çoklutransfüzyonlarının neden olduğu graft versus host hastalığı, hiperürisemi ile birlikte tümörlizis sendromu, metabolik asidoz ve akut renal yetmezliktir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08, faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiSıklıkla gözlenen doz aşımı semptomları; bulantı, kusma, diyare, şiddetli kemik iliği depresyonu (anemi, trombositopeni, lökopeni ve agranülositoz dahil), akut böbrek yetmezliği,geri dönüşümsüz nörolojik toksisite (paraparezi, kuadriparezi), Guillain-Barre sendromu ve Sayfa 8 / 14 Brown-Sequard sendromudur. Tüylü hücreli lösemi için önerilen dozdan >4 kat daha yüksek dozla tedavi edilen hastalarda, akut, geri dönüşümsüz nöro- ve nefro-toksisite tanımlanmıştır. Spesifik bir antidot bulunmamaktadır. Kladribin için belirtilen doz aşımı tedavisi; tedavinin hemen kesilmesi, dikkatli gözlemleme ve uygun destekleyici tedbirlerin (kan transfüzyonları,diyaliz, hemofiltrasyon, anti-enfeksiyöz tedavi vs.) başlatılmasıdır. Aşırı dozda kladribin alanhastalar, en az dört hafta boyunca hematolojik olarak izlenmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Pürin analogları ATC kodu: L01BB04 Kladribin, antimetabolit gibi davranan bir pürin nükleozid analoğudur. Hidrojenin pozisyon 2'de klor için tek substitüsyonu, kladribini doğal benzeri 2'-deoksiadenozinden ayırmakta vemolekülü adenozin deaminaz ile deaminasyona karşı dirençli hale getirmektedir. Etki mekanizması:Kladribin, parenteral uygulama sonrasında hızla hücrelere alınan bir ön ilaçtır ve deoksisitidin kinaz (dCK) ile intraselüler olarak aktif nükleotid olan 2-klorodeoksiadenozin-5'-trifosfata(CdATP) fosforile olur. Ağırlıklı olarak yüksek dCK aktivitesi olan ve düşükdeoksinükleotidaz aktivitesi olan hücrelerde, özellikle lenfositlerde ve diğer hematopoietikhücrelerde aktif CdATP birikimi gözlenir. Kladribinin sitotoksisitesi doza bağlıdır.Hematolojik olmayan dokular etkilenmiyor görünmektedir. Bu da kladribinin düşük non-hematopoietik toksisite insidansını açıklamaktadır. Diğer nükleozidlerden farklı olarak, dinlenim hücrelerinde olduğu kadar hızla çoğalan hücrelerde de toksiktir. Solid tümörlerin hücre hatlarında kladribinin sitotoksik etkisigözlenmemektedir. Kladribinin etki mekanizması, CdATP'nin DNA dizilerine kaynaşmasınadayandırılmaktadır; bölünen hücrelerde yeni DNA sentezi bloke edilir ve DNA onarımmekanizması inhibe edilir. Bu da, dinlenim hücrelerinde bile DNA dizi kırıklarının birikimive NAD (nikotinamid adenin dinükleotid) ve ATP konsantrasyonunda düşüşler ile sonuçlanır.Ayrıca; CdATP, ribonükleotidlerin deoksiribonükleotidlere dönüşümünden sorumlu enzimolan ribonükleotid redüktazı inhibe eder. Enerjinin tükenmesi ve apoptoz nedeniyle hücreölümleri gerçekleşir. Klinik etkililikSubkutan olarak kladribinin kullanıldığı klinik çalışmada tüylü hücreli lösemili 63 hasta (33'ü yeni teşhis konulan hasta, 30'u nüks görülen veya hastalığı ilerleyen hasta) tedavi edildi.Uzun süreli remisyon ve dört yıllık takip süresi sonunda hastaların %73'ünün tam remisyondakalması ile tüm yanıt oranı %97'dir. 5.2 Farmakokinetik ÖzelliklerGenel ÖzelliklerEmilim:Sayfa 9/14 Kladribin, parenteral uygulama sonrasında tam biyoyararlanım gösterir; zamana karşı plazma konsantrasyon eğrisi altında kalan ortalama alan (EAA), sürekli veya kesikli 2 saatlikintravenöz infüzyon sonrasında ve subkutan enjeksiyon sonrasında karşılaştırılabilirdir. Dağılım:0,14 mg/kg kladribin dozunda subkutan bolus enjeksiyon sonrasında, yalnızca ortalama 20 dakika sonra Cmaks: 91 ng/mL değerine ulaşılır. 0,10 mg/kg vücut ağırlığı/gün dozununkullanıldığı bir başka çalışmada, sürekli intravenöz infüzyon sonrasında maksimum plazmakonsantrasyonu Cmaks 5,1 ng/mL olmuştur (tmaks: 12 saat). Subkutan bolus enjeksiyonsonrasında bu değer 51 ng/mL'dir (t maks: 25 dakika). Kladribinin intraselüler konsantrasyonu, plazma konsantrasyonunu 128 ila 375 kat aşmaktadır. Kladribinin ortalama dağılım hacmi 9,2 L/kg'dır. Kladribinin plazma proteinlerine bağlanması, geniş bir bireyler arası dağılım (%5-50) ile ortalama %25'tir. Biyotransformasyon:Bir ön ilaç olan kladribin, intraselüler olarak ağırlıklı şekilde deoksisitidin kinaz aracılığı ile, daha sonra nükleozid monofosfat kinaz aracılığıyla difosfata ve nükleozid difosfat kinazaracılığıyla aktif metaboliti olan 2-klorodeoksiadenozin-5'-trifosfata (CdATP) fosforile olan2-klorodeoksiadenozin-5'-monofosfata metabolize olur. Eliminasyon:İnsanlar üzerinde yapılan farmakokinetik çalışmalar, kladribinin plazma konsantrasyon eğrisinin, 35 dakika ve 6,7 saatlik ortalama a ve P yarı ömürler ile 2 veya 3 kompartımanlımodele uymaktadır. Subkutan enjeksiyon sonrasında kladribin serum konsantrasyonunun bi-eksponansiyal düşüşü, sırasıyla yaklaşık 2 saat ve 11 saatlik başlangıç ve terminal yarıömürler ile 2 saatlik intravenöz infüzyon sonrasındaki eliminasyon parametreleri ilekarşılaştırılabilirdir. Kladribin nükleotidlerinin in vivoolarak intraselüler tutulma süresi,plazmadaki tutulma süresine kıyasla net bir şekilde uzamıştır. Lösemik hücrelerde başlangıçta15 saatlik ve daha sonra 30 saatten daha uzun olan yarı ömürler t1/2 ölçülmüştür.Kladribin esas olarak böbrekler aracılığı ile atılır. Metabolize olmamış kladribinin böbrekler yoluyla atılımı 24 saat içinde gerçekleşir ve 2 saatlik intravenöz infüzyon ve subkutanuygulama sonrasında sırasıyla dozun %15 ve %18'ine karşılık gelir. Geri kalan miktarındurumu bilinmemektedir. Ortalama plazma klerensi 0,10 mg/kg vücut ağırlığı/gün dozunda,intravenöz infüzyon sonrasında 794 mL/dakika ve subkutan bolus enjeksiyon sonrasında 814mL/dakika'dır. Doğrusallık/doğrusal olmayan durumHastalardaki karakteristik özelliklerBöbrek ve Karaciğer Yetmezliği:Böbrek ve karaciğer yetmezliği olan hastalarda kladribin ile yapılmış çalışma mevcut değildir (Bkz. Bölüm 4.2 ve Bölüm 4.4). Klinik deneyim sınırlıdır ve bu hastalarda kladribinin Sayfa 10 / 14 güvenliliği iyi belirlenmemiştir. Kladribin, orta ila şiddetli derecede böbrek yetmezliği veya orta ila şiddetli derecede karaciğer yetmezliği olan hastalarda kontrendikedir (Bkz. Bölüm4.3). Pediyatrikpopülasyon:Çocuklarda kladribin kullanımı araştırılmamıştır (Bkz. Bölüm 4.2). Geriyatrik popülasyon:65 yaş üstü hastalarla deneyim sınırlıdır. Yaşlı hastalarda, bireysel değerlendirme ve kan sayımlarının, böbrek ve karaciğer fonksiyonlarının dikkatli izlenmesi ile tedavi edilmelidir. 5.3 Klinik öncesi güvenlilik verileriKladribin, intraperitoneal yolla farelere 150 mg/kg bir LD50 ile orta derecede akut olarak toksiktir. Sinomolgus maymunlarında 7 ila 14 günlük sürekli intravenöz infüzyon çalışmalarında hedef organlar; immün sistem (>0,3 mg/kg/gün), kemik iliği, cilt, mukoz membranlar, sinir sistemive testisler (>0,6 mg/kg/gün) ve böbreklerdir (>1 mg/kg/gün). Ölümcül olmadığı sürece, buetkilerin çoğunun veya tamamının belirtileri, maruziyetin ortadan kaldırılması üzerineyavaşça eski haline dönebilmektedir. Kladribin farelerde teratojeniktir (gebeliğin 6-15 günlerinde verilen 1,5-3,0 mg/kg/gün dozlarında). Sternal osifikasyon üzerine etkileri 1,5 ve 3,0 mg/kg/gün dozlarında görülmüştür.3.0 mg/kg/gün dozunda, rezorpsiyonlarda artış, canlı yavru büyüklüklerinde azalma, düşükfetal ağırlıklar ve kafa, gövde ve apendajlardaki fetal malformasyonlar artış gözlenmiştir.Tavşanlarda kladribin 3,0 mg/kg/gün dozlarında teratojeniktir (gebeliğin 7-19 günlerindeverilen). Bu dozda, ortalama fetal ağırlıkta önemli bir düşüş yanı sıra şiddetli kolanormallikleri görülmüştür. 1,0 mg/kg/gün dozunda osifikasyonda düşüş gözlenmiştir. Karsinojenisite/MutajenisiteKladribinin karsinojenik potansiyelini değerlendirmek üzere hayvanlarda uzun dönemli çalışmalar yürütülmemiştir. Mevcut verilere dayanarak, kladribinin insanlarda karsinojenikriskine dair değerlendirme yapılamamaktadır. Kladribin kültürlenmiş memeli hücrelerine karşı mutajenik olan sitotoksik bir tıbbi üründür. Kladribin, DNA dizileri ile birleşerek DNA sentezini ve onarımını inhibe eder. Kladribinemaruziyet, çeşitli normal ve lösemik hücrelerde ve 5 nM ila 20 pM konsantrasyonlarındakihücre hatlarında DNA fragmantasyonunu ve hücre ölümünü uyarır. FertiliteKladribinin fertilite üzerine etkileri hayvanlar üzerinde çalışılmamıştır. Ancak sinomolgus maymunları ile yürütülen bir toksisite çalışması, testiküler hücreler de dahil hızla üreyenhücrelerin olgunlaşmasını baskıladığını göstermiştir. İnsan fertilitesi üzerine etkisibilinmemektedir. Kladribin gibi, DNA, RNA ve protein sentezini engelleyen antineoplastikajanların insan gametogenezi üzerinde advers etkiye sahip olmaları beklenebilir. Sayfa 11 / 14 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum klorür Sodyum hidroksit (pH ayarı için) Hidroklorik asit (pH ayarı için) Enjeksiyonluk su 6.2. GeçimsizliklerOCLADRA diğer tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrü48 ay Mikrobiyolojik açıdan, ürünün açılması mikrobiyolojik kontaminasyon riskini engellemediği sürece, ürün derhal kullanılmalıdır. Hemen kullanılmadığı takdirde, kullanım sırasındakisaklama süresi ve koşulları kullanıcının sorumluluğundadır. 6.4. Saklamaya yönelik özel uyarılar2-8°C arasında buzdolabında saklayınız. Dondurmayınız. 6.5. Ambalajın niteliği ve içeriğiTip I cam flakon, kauçuk tıpa (bromobütil) ve flip-off alüminyum kapak. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerAntineoplastik tıbbi ürünlerin uygun kullanımı ve imhası için prosedürler kullanılmalıdır. Sitotoksik tıbbi ürünler dikkatle ele alınmalıdır. Hamile kadınlarla temasından kaçınılmalıdır.OCLADRA'nın kullanılması ve uygulanmasında tek kullanımlık eldiven ve koruyucu giysikullanımı önerilir. Eğer OCLADRA cilt veya mukoz membranlar ile temas ederse, o alanhemen bol miktarda su ile yıkanmalıdır. Parenteral ürünler kullanım öncesinde, partikül içerip içermediği veya renk değişikliği bakımından görsel olarak incelenmelidir. Flakonlar tek kullanımlıktır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının KontrolüYönetmeliğine uygun olarak imha edilmelidir. Enjeksiyon için talimatlarEnjeksiyon için nelere ihtiyaç vardır?Kendinize subkutan enjeksiyon yapmak için şunlara ihtiyacınız vardır: - Bir flakon OCLADRA (veya 5 mL'den fazla enjekte etmeniz gerekiyorsa iki flakon) Flakon zarar görmüş ya da çözelti berrak değil veya partikül içeriyor ise ürünü kullanmayınız. - Bir adet steril şırınga (örn; 10 mL şırınga) Sayfa 12 / 14 - Bir adet steril enjektör iğnesi (örn; 0,5 x 19 mm, 25 G x %) - Alkollü mendil - Kullanılan şırınganın imhası için bir adet delinmeye dayanıklı kap. Enjeksiyonu nasıl hazırlanır? OCLADRA enjekte edilmeden önce şunlar yapılmalıdır: 1. OCLADRA flakonundaki koruyucu kapağı çıkarınız. Kauçuk tıpayı çıkarmayınız. Alkollübir mendil ile flakonun üstündeki kauçuk kısmı temizleyiniz. Ucuna dokunmadan şırıngayıambalajından çıkarınız. Enjektör iğnesini ambalajdan çıkarınız ve şırınganın ucuna sıkıcatakınız. İğneye dokunmadan iğne kapağını çıkarınız. 2. İğneyi flakonun kauçuk kapağının içine doğru itiniz. Şırınga ve flakonu aşağı doğru tersçeviriniz. İğnenin ucunun çözeltinin içinde olduğundan emin olunuz. 3. Doğru hacimde OCLADRA'yı, şırınganın pistonu yardımı ile çekiniz. (Doktorunuz kaç mLOCLADRA enjekte etmeniz gerektiğini size söyleyecektir.) 4. İğneyi flakondan çıkarınız. 5. Şırıngada hava kalmadığından emin olunuz: iğneyi yukarı doğru tutup havayı dışarı itiniz. 6. Doğru hacmi alıp almadığınızı kontrol ediniz. 7. Hemen enjekte ediniz. Enjeksiyonu nereye yapılmalıdır? OCLADRA'yı enjekte etmeniz gereken en uygun yer şekilde gösterilmiştir: uyluklarınüst kısmı ve göbeğin etrafındaki alan hariç olmak üzere karın. Eğer enjeksiyonu yapan bir başkasıise, üst kollarınızın dış yüzeyini ve kalçanızı da kullanabilir. Enjeksiyon nasıl yapılmalıdır? Sayfa 13 / 14 1. Alkollü mendil ile cildinizi dezenfekte ediniz, alanın kuruması için bekleyiniz ve cildinizibaş ve işaret parmağınızla ezmeden sıkıştırınız. 2. İğneyi, şekilde görüldüğü gibi, yaklaşık 45°C'lik bir açı ile tam olarak cilde yerleştiriniz 3. Şırınganın pistonunu hafifçe çekerek, bir kan damarını delmediğinizi kontrol ediniz.Şırıngada kan görürseniz, iğneyi çekip, başka bir yerden yeniden uygulayınız. 4. Sıvıyı yaklaşık bir dakika içinde, cildi sürekli sıkılı tutarak yavaş ve dengeli bir şekildeenjekte ediniz. 5. Sıvıyı enjekte ettikten sonra iğneyi çekiniz. 6. Kullanılan şırıngayı delmeye dayanıklı kaba koyunuz. Her bir enjeksiyonda yeni bir şırıngave iğne kullanınız. Flakonlar tek kullanımlıktır. Kullanımdan sonra kalan miktarı, uygun imhaiçin doktorunuza veya eczacınıza veriniz. 7. RUHSAT SAHİBİBiem İlaç San. ve Tic. A.Ş. Anıttepe Mah. Turgut Reis Cad. No: 21 Tandoğan / Çankaya - Ankara Tel: 0312 230 29 29 Faks: 0312 230 68 00 e-mail: [email protected] 8. RUHSAT NUMARASI2014/638 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 28 / 08 / 2014 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİSayfa 14 / 14 |
İlaç BilgileriOcladra 2 Mg / Ml Enjeksiyonluk Çözelti İçeren FlakonEtken Maddesi: Kladribin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.