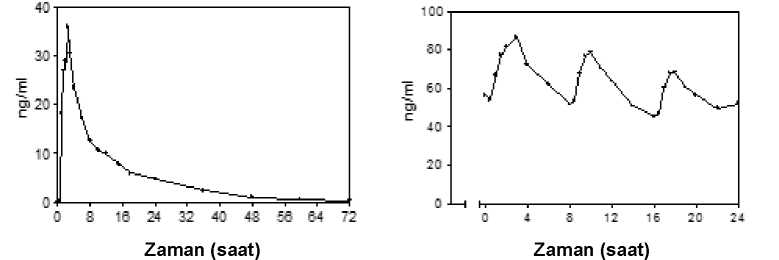
Eccury 15 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIECCURY® 15 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her film kaplı tablet etkin madde olarak 13,64 mg propiverine eşdeğer 15 mg propiverin hidroklorür içerir. Yardımcı maddeler:Laktoz monohidrat (sığır kaynaklı) 69 mg Ponso 4R lak (E124) 0,3635 mg Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet Pembe bikonveks, yuvarlak film kaplı tablet. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarECCURY®, gerek idiyopatik detrüsör aşırı aktivitesi (aşırı aktif mesane) gerekse omurilik yaralanmalarına bağlı nörojenik detrüsör aşırı aktivitesi (detrüsör hiperrefleksi), örneğintransvers lezyon paraplejisi olan hastalarda ani idrar sıkışması ve sık idrara çıkma ve/veyaidrar tutamama problemlerinin tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji /uygulama sıklığı ve süresiDoktor tarafından başka şekilde tavsiye edilmediği takdirde tavsiye edilen günlük dozlar aşağıdaki gibidir: Yetişkinlerde:Standart doz olarak; günde iki defa bir kaplı tablet (= 15 mg propiverin hidroklorür) alınması tavsiye edilmektedir. Bu doz günde üç defaya kadar çıkartılabilir. Bazı hastalar günlük 15 mg'lıkbir doza da cevap verebilmektedir. Nörojenik detrüsör aşırı aktivitesi için, günde üç defa bir doz kaplı tablet tavsiye edilir. Maksimum günlük doz 45 mg 'dır. Uygulama sıklığı ve süresi:ECCURY® günde iki veya üç kere tercihen yemeklerden önce alınmalıdır. ECCURY® uzun süreli kullanıma uygundur. 1/1 1Uygulama şekli:ECCURY®'nin yemeklerden önce alınması önerilir (Bkz. Bölüm 5.2). Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Hafif veya orta şiddetli böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir; ancak bu hasta gruplarının tedavisinde dikkatli olunmalıdır. Şiddetli böbrek yetmezliği olanhastalarda (kreatinin klerensi<30 ml/dak) maksimum günlük doz 30 mg'dır. Karaciğer yetmezliği:Hafif derecede karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmemektedir; ancak bu hasta gruplarının tedavisinde dikkatli olunmalıdır. Orta şiddetli veya ciddi karaciğer yetmezliğiolan hastalarda ise, bu tip hasta grubunda propiverin uygulanmasının incelendiği herhangi birçalışma gerçekleştirilmediğinden ECCURY® kullanımı önerilmez. Pediyatrik popülasyon:Güvenlilik ve/veya etkinliğe ilişkin veri yetersizliği nedeniyle çocuklarda ECCURY® kullanılmamalıdır. Geriyatrik popülasyon:Bu yaş grubu için doz ayarlaması gerekmemektedir (Bkz. Bölüm 5.2). Metimazolle kombine halde CYP 3A4'ün potent inhibitörleri olan ilaçlarla eşzamanlı tedavi alan hastalarPotent CYP 3A4/5 inhibitörleriyle metimazol gibi potent Flavin Monooksijenazlar (FMO) inhibitörlerini kombine kullanan hastalarda, tedavi 15 mg/gün dozu ile başlamalıdır. Dozsonra daha yüksek bir doza yükseltilebilir. Ancak dikkatli kullanılmalıdır ve doktorlarhastaları yan etkiler açısından dikkatlice izlemelidir (Bkz. Bölüm 4.5, 5.2). Çok yağlı yiyecekler, propiverinin biyoyararlanımını arttırmaktadır. Bu nedenle özellikle böbrek veya karaciğer yetmezliği olan hastalar, ECCURY®'u yemeklerden önce almalıdır (Bkz.Bölüm 5.2). 4.3. KontrendikasyonlarECCURY®, - Etkin maddeye ya da kaplı tablet bileşiminde yer alan yardımcı maddelerden herhangibirine aşırı duyarlılığı bilinen kişilerde, - Bağırsak obstrüksiyonu, - Üriner retansiyonun meydana gelebileceği önemli dereceli mesane çıkışı obstrüksiyonu, - Miyastenia gravis, - İntestinal atoni, - Ciddi ülseratif kolit, 2/ 1 1- Toksik megakolon, - Kontrol edilememiş kapalı açılı glokom, - Orta şiddetli ya da şiddetli karaciğer yetmezliği, - Taşiaritmide, kontrendikedir 4.4. Özel kullanım uyarıları ve önlemleriİlaç aşağıdaki rahatsızlıktan şikayetçi hastalarda dikkatli bir şekilde kullanılmalıdır: Otonomik nöropati Böbrek yetmezliği (Bkz. Bölüm 4.2) Karaciğer yetmezliği (Bkz. Bölüm 4.2) Aşağıdaki hastalıkların semptomları, ilaç alımını takiben şiddetlenebilir: Ciddi konjestif kalp yetmezliği (NYHA Evre IV) Prostat hipertrofisi Reflü özofajit ile beraber seyreden hiatus hernisi Kardiyak aritmi Taşikardi Diğer antikolinerjikler gibi, propiverin, midriyazis'e neden olabilir. Bundan dolayı, propiverinin, ön kamaradaki açının darlaşabileceği yetişkinlerdeki akut kapalı açılı glokombaşlatma riski artabilmektedir. Propiverin de dahil olmak üzere, bu sınıfa ait ilaçların, akut kapalı açılı glokoma neden olduğu ya da başlattığı rapor edilmiştir. Tedaviden önce böbrek hastalığına ve konjestif kalp yetmezliğine bağlı pollaküri ve noktüri ve ayrıca organik mesane hastalıkları (ör: idrar yolları enfeksiyonları, malignite) ekarteedilmelidir. ECCURY®, sığır kaynaklı laktoz monohidrat içerir. Bu nedenle, nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olanhastaların bu ilacı kullanmamaları gerekir. ECCURY®, Ponso 4R lak (E124) içerdiğinden alerjik reaksiyona sebep olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTrisiklik antidepresanlar (örn.: imipramin), trankilizanlar (örn.:benzodiazepinler), antikolinerjikler (sistemik uygulandığında), amantadin, nöroleptikler (örn.: fenotiyazinler) ve beta-adrenoseptör agonistler (beta-sempatomimetikler) ile birlikte kullanıldığındapropiverinin etkisi artar. Kolinerjik ilaçlarla birlikte kullanıldığında propiverinin etkisi azalır.İzoniyazid ile tedavi edilen hastalara propiverin uygulandığında, kan basıncında azalma görülür.Propiverin, metoklopramid gibi prokinetiklerin etkisini azaltabilir. 3/ 1 1Sitokrom P450 3A4 (CYP 3A4) tarafından metabolize edilen diğer ilaçlar ile farmakokinetik etkileşimler olasıdır. Ancak, klasik enzim inhibitörleri ile (ör: ketokonazol ya da greyfurtsuyu) karşılaştırıldığında propiverinin etkileri az olduğundan bu tip ilaçların konsantrasyonlardabelirgin bir artış beklenmemektedir. Propiverin, zayıf bir CYP 3A4 inhibitörü olarakdüşünülebilir. Eş zamanlı olarak, azol antifungaller (ör: ketokonazol, itrakonazol) ya da makrolid antibiyotikler (örn.: eritromisin, klaritromisin) gibi güçlü CYP 3A4 inhibitörlerini alan hastalar üzerindefarmakokinetik çalışmalar yapılmamıştır. Metimazolle kombine halde CYP3A4'ün potent inhibitörleri olan ilaçlarla eşzamanlı tedavi alan hastalarPotent CYP 3A4/5 inhibitörleriyle metimazol gibi potent flavin-içeren monoksijenaz (FMO) inhibitörlerini kombine kullanan hastalarda, tedavi 15 mg/ gün dozu ile başlamalıdır. Dozdaha sonra yükseltilebilir. Ancak dikkatli kullanılmalıdır ve doktorlar hastaları yan etkileraçısından dikkatlice izlemelidir (Bkz. Bölüm 4.2, 5.2). 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Herhangi bir veri bulunmamaktadır. Gebelik dönemiECCURY®'nin hamile kadınlarda kullanımına ilişkin veri bulunmamaktadır. Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Propiverin kullanımı hamilelik süresince önerilmemektedir. Laktasyon dönemiPropiverinin veya metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Hayvan çalışmalarından elde edilen mevcut farmakodinamik/toksikolojik veriler propiverin veyametabolitlerinin süte geçtiğini göstermiştir. Yeni doğanda veya infantta bu risk göz ardıedilemez. Emzirmenin çocuğa yararları ile hastanın tedaviden göreceği yarar dikkate alınarakemzirmenin veya propiverin tedavisinin durdurulması yönünde bir karar verilmesigerekmektedir. Üreme yeteneği/FertilitePropiverinin insan fertilitesi üzerine etkilerine dair veri bulunmamaktadır. Hayvan çalışmaları fertilite üzerine doğrudan ya da dolaylı zararlı etkiler göstermemektedir (Bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı kabiliyeti üzerine herhangi bir çalışma yapılmamıştır. Propiverin, uyuşukluğa ve bulanık görüşe neden olabilir. Bu durum makine ya da motorlu 4/ 1 1araç kullanımı ya da tehlikeli işlerde çalışılması gibi mental dikkat gerektiren aktivitelerin yapılma kabiliyetini etkileyebilir. Sedatif ilaçlar, propiverin hidroklorür kullanımına bağlı uyuşukluk durumunu artırıcı etki gösterirler. 4.8. İstenmeyen etkilerPropiverin ile ilişkili olası istenmeyen etkiler sistem organ sınıfına ve aşağıdaki sıklık sıralamasına göre listelenmiştir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor) İstenmeyen etkilerin tümü geçicidir ve dozun azaltılması ya da tedavinin sonlandırılmasından sonraki, en fazla 1-4 gün içinde kaybolur. Bağışıklık sistemi hastalıklarıSeyrek: Hipersensitivite Psikiyatrik hastalıklarÇok seyrek: Konfüzyon, huzursuzluk Bilinmiyor: Halüsinasyon Sinir sistemi hastalıklarıYaygın: Baş ağrısı Yaygın olmayan: Baş dönmesini de içeren sersemlik hali, titreme, tat alma duyusunda değişiklikler Bilinmiyor: Konuşma bozuklukları Göz hastalıklarıYaygın: Akomodasyon bozuklukları, görüş anormallikleri Kardiyak hastalıklarSeyrek: Taşikardi Çok seyrek: Palpitasyon Vasküler hastalıklarYaygın olmayan: Kızarıklık, uyuşuklukla beraber seyreden düşük kan basıncı Gastrointestinal hastalıklarÇok yaygın: Ağız kuruluğu Yaygın: Karın ağrısı, konstipasyon, dispepsi Yaygın olmayan: Bulantı, kusma 5/ 1 1Deri ve deri altı doku hastalıklarıYaygın olmayan: Kaşıntı Seyrek: Döküntü Böbrek ve idrar yolu hastalıklarıYaygın olmayan: Üriner retansiyon, mesane ve üretral semptomlar Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Yorgunluk Uzun süreli tedavi esnasında, nadir vakalarda karaciğer enzimlerinde geri dönüşümlü değişiklikler oluşabileceğinden, karaciğer enzimleri izlenmelidir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected];4.9. Doz aşımı ve tedavisiSemptomlar:Muskarinik reseptör antagonisti olan propiverin ile doz aşımı potansiyel olarak şiddetli antikolinerjik etkiler oluşturabilir. Aşağıda yer alan periferik ve merkezi sinir sistemi bozuklarımeydana gelebilir: - Şiddetli ağız kuruluğu - Bradikardi (sonraki dönemde taşikardiye yol açabilir) - Midriyazis ve akomodasyon bozukluğu - Üriner retansiyon - Bağırsak motilitesinin inhibisyonu - Huzursuzluk, konfüzyon, halusinasyon, konfabülasyon - Baş dönmesi, bulantı, konuşma bozukluğu, kas güçsüzlüğü Tedavi:- Propiverin ile doz aşımı durumunda hasta bol miktarda su ile birlikte aktif kömürsüspansiyonu ile tedavi edilmelidir. - Gastrik lavaj sadece koruyucu intübasyon ile birlikte göz önünde bulundurulmalı; (mukozakuruluğu hesaba katılmalı) yağlı tüp kullanılarak, propiverin vücuda alındıktan sonraki 1 saatiçinde uygulanmalıdır. Kusma indüklenmemelidir. - Renal eliminasyonu arttırmada zorlu diürez veya hemodiyaliz etkili değildir. - Halusinasyon veya belirgin eksitasyon gibi şiddetli merkezi antikolinerjik etkiler meydanagelirse fizostigmin ile antidot tedavisi uygulanabilir. - Konvülsiyon veya belirgin eksitasyon oluşursa: benzodiazepinler ile tedavi 6/ 1 1- Solunum yetmezliği meydana gelirse: yapay solunum ile tedavi - İdrar retansiyonu meydana gelirse: kateterizasyon ile tedavi - Midriyazis meydana gelirse: pilokarpin göz damlası ile tedavi ve/veya hastanın odasınınkaranlık hale getirilmesi 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: / Ürolojikler / Sık işeme ve üriner inkontinans tedavisinde kullanılan ilaçlar ATC Kodu: G04BD06 Etki mekanizmasıPropiverin, kalsiyumun içeri alımını inhibe eder ve muskulotropik spazmolize neden olan mesane düz kas hücrelerinde hücre içi kalsiyumun modülasyonunu engeller. Propiverin antikolinerjik etkiye bağlı olarak pelvik sinirin efferent bağlantısını da inhibe eder. Farmakodinamik etkilerHayvan modellerinde propiverin hidroklorür, intravezikal basınçta doza bağlı azalmaya ve mesane kapasitesinde artışa neden olur. Bu etki propiverinin ve ayrıca insan ve hayvan kaynaklı izole detrusor şeritlerde gösterilen üç aktif üriner metabolitinin, farmakolojik özelliklerinin toplamına dayanmaktadır. 5.2. Farmakokinetik özelliklerGenel özellikler:Etkin maddenin genel özellikleriPropiverin'in gastrointestinal sistem tarafından hemen hemen tamamı absorbe edilir. Büyük oranda ilk geçiş metabolizmasına uğrar. Mesane düz kas hücreleri üzerindeki etkileri anabileşene ve aynı zamanda idrara hızla atılan üç aktif metabolitine bağlıdır. Emilim:Oral alımını takiben propiverin, 2,3 saatten sonra ulaşılan maksimum plazma konsantrasyonları ile birlikte gastrointestinal sistem tarafından hızla absorbe edilir. ECCURY®ortalama mutlak biyoyararlanımı %40,5'tir (EAA 0-® (p.o) /EAA0-® (i.v) için aritmetik ortalamadeğer).Yiyecek alımı propiverinin biyoyararlanımını arttırır (ortalama artış 1,3 kat), ancak propiverinin ya da onun ana metaboliti olan propiverin-N-oksitin maksimum plazma konsantrasyonlarınıönemli ölçüde etkilemez. Biyoyararlanımdaki bu farklılık klinik olarak anlamlı değildir fakatböbrek ve karaciğer yetmezliği olan hastalarda gıda alımı ile ilişkili olarak doz ayarlamasıyapmak gerekebilir. Bu nedenle ilacın yemeklerden önce alınımı önerilmektedir. Dağılım:7/ 1 1ng/ml). 21 sağlıklı gönüllüde intravenöz propiverin hidroklorür uygulaması sonrasında dağılım hacmi 125-473 litre (ortalama 279 litre) olarak tahmin edilmiştir. Bu da propiverinhidroklorürün büyük bir kısmının periferal komponantlere ulaştığını göstermektedir. Plazmaproteinlerine bağlanma, ana bileşen için %%60'tır.16 sağlıklı gönüllüye Eccury 'nin tek doz ve tekrarlayan dozlarla uygulanması (6 gün süreyle günde 3 defa) sonrasında, propiverin plazma konsantrasyonları:
16 sağlıklı gönüllüye Eccury 'nin çoklu-doz uygulanması (6 gün süreyle günde 3 defa) sonrasında, propiverin kararlı durum karakteristikleri:
Biyotransformasyon:Propiverin, bağırsak ve karaciğer enzimleri tarafından büyük oranda metabolize edilir. Başlıca metabolik yol, piperidil-N'in oksidasyonunu içerir. Piperidinil-N'inoksidasyonu, CYP 3A4 ve flavin-içeren monoksijenaz (FMO) 1 ve 3 ile yürütülür ve buoksidasyonun sonucunda daha az etkili olan N-oksit oluşur. N-oksitin plazma konsantrasyonuana metabolitinkinden fazladır. İdrarda dört metabolit tanımlanmıştır: bunlardan üçüfarmakolojik olarak aktiftir ve ECCURY® terapötik etkinliğine katkıda bulunabilmektedir.Terapötik plazma konsantrasyonlarının 10 ila 100 katı üzerine çıkıldığında in vitro olarak CYP 3A4 ve CYP 2D6 enzimlerinin hafif inhibisyonu tespit edilmiştir (Bkz. Bölüm 4.5). Eliminasyon:8/ 1 1ilacın kullanılmasından sonraki 12 gün içinde dışkı ile vücuttan atılır. Bir oral dozun %1'den daha az bir kısmı idrarla değişime uğramadan atılmaktadır. Tek bir 30 mg doz alımındansonra ortalama toplam klerens 371 ml/dk'dır (191-870 ml/dk). Toplam 37 sağlıklı gönüllüüzerinde yapılan üç çalışmanın sonucunda tespit edilen ortalama yarılanma ömürleri sırasıyla 14,1, 20,1 ve 22,1 saattir. Doğrusallık/Doğrusal olmayan durum:Oral yolla 10-30 mg propiverin hidroklorüruygulanmasını takiben propiverin ve propiverin-N-oksitin farmakokinetik parametreleri doza bağlı olarak doğrusaldır. Tek doz uygulama ile karşılaştırıldığında kararlı durum sırasındakifarmakokinetiğinde değişiklik olmamıştır. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Kreatinin klerensi <30 ml/dak olan 12 hasta üzerinde yapılan tek doz çalışmadan çıkarılan sonuca göre, ciddi böbrek yetmezliği, propiverin ve propiverin ana metaboliti propiverin N-oksit'in dispozisyonunu belirgin şekilde değiştirmez. Toplam günlük doz 30 mg'ı geçmediğisürece (örn.: günde 2 kere ECCURY®) doz ayarlaması önerilmez. Yüksek doz uygulamasınınyapılması gerektiği durumlarda (örn.:45 mg), antikolinerjik etkilerin tolere edilebilirlik belirtisiolduğu göz önünde bulundurularak dozun dikkatli şekilde titrasyonu önerilir. Karaciğer yetmezliği:Karaciğer yağlanmasına bağlı olarak hafif veya orta derecede karaciğer yetmezliği olan 12 hastanın kararlı durum farmakokinetikleri 12 sağlıklı kontrol ile karşılaştırıldığında benzerbulunmuştur. Ciddi karaciğer yetmezliği ile ilgili veri mevcut değildir. Pediyatrik hastalarPediyatrik popülasyonda farmakokinetik bilgi mevcut değildir. Geriyatrik hastalarKararlı durumda (28 gün boyunca günde 3 kez uygulanan ECCURY®) vadi plazma konsantrasyonları karşılaştırıldığında yaşlı hastalar (60-85 yaş; yaş ortalaması 68) ve gençsağlıklı gönüllüler arasında fark görülmemiştir. Ana ilacın metabolite oranı yaşlı hastalardadeğişmeden kalmıştır. Bu durum propiverinin ana metaboliti olan propiverin-N-oksidemetabolik dönüşümünün yaşa bağlı ya da atılımı sınırlandırıcı bir aşama olmadığınıgöstermektedir. Glokomlu hastalarAçık açılı glokomlu hastalarda ve tedavi altındaki (kontrollü) kapalı açılı glokomlu hastalarda intraoküler basıncın ECCURY®'nin günde 3 defa uygulanması ile artmadığı, iki plasebo-kontrollü çalışma ile gösterilmiştir. 9/ 1 15.3. Klinik öncesi güvenlilik verileriİki memeli türünde yapılan uzun süreli oral doz çalışmalarında ana tedavi ile ilişkili etki olarak karaciğerdeki değişimler (karaciğer enzimlerinde artış gibi) tespit edilmiştir.Karaciğerdeki değişimler, karaciğer hipertrofisi ve yağ dejenerasyonu olarak tanımlanmıştır.Yağ dejenerasyonu, tedavinin kesilmesi ile geri dönüşlü olmuştur. Hayvan çalışmalarında, propiverin gebe dişilere oral yolla yüksek dozlarda uygulandığında, yavrularda iskelet gelişiminde gerileme gözlenmiştir. Emziren memelilerde propiverin annesütüne geçmektedir. Mutajenite ile ilgili herhangi bir kanıt yoktur. Erkek farelerde yapılan yüksek doz karsinojenite çalışmalarında hepatoselüler adenom ve karsinom insidansında artış meydana gelmiştir.Sıçanlar üzerinde yapılan karsinojenite çalışmasında, yüksek doz alan erkek sıçanlardahepatoselüler adenoma, böbrek adenomu ve mesane papillomu görülürken, dişi sıçanlardayüksek doz seviyelerinde endometriyal stromal polipler artmıştır. Hem sıçan hem de faretümörlerinin türe spesifik olduğu düşünüldüğü için klinik ile ilişkili olmadığına karar verilmiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz monohidrat (sığır kaynaklı) Mikrokristalin selüloz Kroskarmelloz sodyumPrejelatinize nişastaKolloidal silikon dioksit (E171) Magnezyum stearat Polivinil alkolPolietilen glikolTitanyum dioksitTalk Ponso 4R lak (E124) Kinolin sarısı alüminyum lak 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği yoktur. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25 °C'nin altındaki oda sıcaklığında saklayınız. 10/ 1 16.5. Ambalajın niteliği ve içeriğiECCURY® 15 mg film kaplı tablet, 56 tabletlik PVC/Alu blister ambalajlarda, kullanma talimatı ile birlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Ürünlerin Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİSanta Farma İlaç San. A.Ş. Okmeydanı, Boruçiçeği Sok. No:16 34382 Şişli - İSTANBULTel: 0212 220 64 00Faks: 0212 222 57 59 8. RUHSAT NUMARASI (LARI)2018/534 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsatlandırma tarihi: 26.09.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ11/1 1 |
İlaç BilgileriEccury 15 Mg Film Kaplı TabletEtken Maddesi: Propiverin Hidroklorür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.