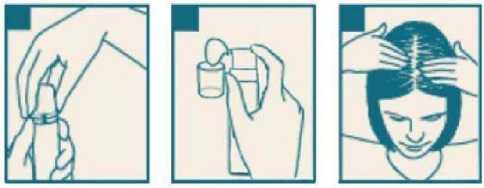
Foamix %2 Çözelti Köpük Kısa Ürün BilgisiDermatolojik İlaçlar » Diğer Dermatolojik İlaçlar » Diğer Dermatolojik Ürünler » Diğer » Minoksidil KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FOAMİX %2 çözelti köpük 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her 1 ml köpük içerisinde; 20 mg Minoksidil bulunmaktadır. Yardımcı maddeler: Monopropilen glikol 549,4 mg. Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMU Çözelti Köpük. Her 1 ml 20 mg Minoksidil içerir. Beyaz veya sarı renkli, kristalize partiküllü olabilen çözelti 4. KLİNİK ÖZELLİKLERİ FOAMİX, kellik (androgenetik alopesi)'in uzun süreli tedavisinde, saç dökülmesinin önlenmesi ve saç büyümesinin uyarılmasında kullanılır. 4.2 Pozoloji ve uygulama şekliPozoloji/ uygulama sıklığı ve süresi FOAMİX topikal uygulamasından önce saç ve saç derisinin tamamen kuru olduğundan emin olmak gerekir. Uygulama yapılacak olan saç derisinin tüm bölgesine günde 2 kez FOAMIX topikalköpükten 1 ml'yi (ölçü kapakta işaretli yeri) aşmayacak şekilde uygulanmalıdır. Günlük olaraktoplamda 2 ml'lik doz aşılmamalıdır. İlacın uygulanmasını kolaylaştırmak için parmak uçlarınızıkullandıysanız ellerinizi uygulama sonrasında iyice yıkayınız. Saç büyümesi 8 hafta veya daha fazla süreyle günde iki seferlik uygulama sonrası gözlenebilir. FOAMİX'i kullanmaya başladıktan 16 hafta sonra hiçbir fayda görülmez ise kullanımıbırakılmalıdır. Saç çıkması durumunda, saç büyümesinin devam edebilmesi için günde 2 kez yapılan uygulamalara devam edilmelidir. FOAMİX'in 16 haftadan sonraki etkililik ve güvenliliği kanıtlanmamıştır. Uygulama şekli: FOAMİX topikal uygulama içindir. Köpüğü parmak uçlarınızla tüm uygulama bölgesine yayınız. Uygulama sonrası eller iyice yıkanmalıdır. Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:Böbrek ve/veya karaciğer yetmezliği olan hastalarda özel bir doz ayarlamasına gerek yoktur. Pediyatrik popülasyon:18 yaşından küçüklerde FOAMİX'in etkililik ve güvenliliği kanıtlanmamıştır, dolayısıyla kullanımı önerilmemektedir. Geriyatrik popülasyon:49 yaşından büyüklerde FOAMİX'in etkililik ve güvenliliği kanıtlanmamıştır, dolayısıyla kullanımı önerilmemektedir. 4.3. KontrendikasyonlarFOAMİX aşağıdaki durumlarda kontraendikedir: Minoksidil, monopropilen glikol, etil alkole duyarlılığı olan kişilerde, Hipertansiyonu olanlarda (hipertansiyon olma ihtimaline karşı kontrol edilmelidir), Kafa derisinde herhangi bir anomalisi olan kişilerde (Sedef hastalığı ve güneş yanığı dahil), Saç derisi tıraşlı kişilerde, Kapalı pansumanı ya da diğer topikal medikal ürünleri kullanan kişilerde. 4.4 Özel kullanım uyarıları ve önlemleriFOAMİX kullanımına başlamadan önce, kullanıcının saç derisinin sağlıklı ve normal olup olmadığı belirlenmelidir. Topikal minoksidil iltihaplı, enfekte, yaralı ya da ağrılı saç derisineuygulanmamalıdır (Bkz. Bölüm 4.3.). Minoksidil sadece androgenetik alopesi tedavisinde endikedir. Başka hiçbir tip saç dökülmesi ve kellikte kullanılmamalıdır (ailesinde saç dökülmesi öyküsü bulunmayanlar, ani ve yamalı saçdökülmesi olanlar, doğuştan saç dökülmesi olanlar veya sebebi bilinmeyen saç dökülmeleri gibi).Hipotansiyon, göğüs ağrısı, hızlı kalp atışı, baygınlık, baş dönmesi, ani ve açıklanamayan kiloartışı, el ve ayaklarda şişme, kalıcı lokal kızarıklık, döküntü veya herhangi başka birbeklenmedik sorun yaşayan hastalar FOAMİX kullanımını bırakıp doktora görünmelidir (Bkz.Bölüm 4.8.). Hastanın bilinen bir kardiyovasküler hastalığı veya kardiyak aritmisi var ise FOAMİX kullanmadan önce hastalık değerlendirilmelidir. Bazı hastalar FOAMİX kullanımı sonucunda saç rengi ve/veya saç dokusu değişimleri yaşamışlardır. FOAMİX harici kullanım içindir. Kafa derisi dışında vücudun diğer bölgelerine uygulamayınız. Tavsiye edilen dozdan daha fazla veya daha sık kullanmak daha iyi sonuçlar almanızısağlamayacaktır. Saç derisi dışındaki vücudun diğer bölgelerine teması halinde istenmeyentüylenmeye sebep olabilir. 2 FOAMİX uygulaması sonrası eller iyice yıkanmalıdır. Bazı kullanıcılar FOAMİX kullanımına başladıktan sonra saç dökülmelerinin arttığını bildirmişlerdir. Bu durum, Minoksidilin saç büyüme döngüsünde değişime yol açmasındankaynaklanır. Saçlar telojen fazdan anojen faza geçer. Yeni saçlar büyüdükçe eskiler dökülür. Bugeçici saç dökülmesi genellikle FOAMİX kullanımına başladıktan 2 ile 6 hafta arasındagörülmeye başlar ve birkaç hafta içinde gerilemeye başlar. Eğer saç dökülmesi 2 haftadan dahauzun süre devam ederse, FOAMİX kullanmayı bıraktırınız. FOAMİX'in uzun süreli kullanımında kanıtlanamamış olmasına rağmen bireysel olarak değişkenlik göstermekle birlikte, aşırı hassasiyet, deride inflamasyon ya da hastalık (kafaderisinin eksfoliasyonu veya kafa derisinde sedef gibi) süreçlerinin sebep olduğu epidermalbariyer bütünlüğünde azalma gibi etkiler görülebilir. Kazayla yutulması durumunda ciddi kardiyak advers olaylara neden olabilir. Bu nedenle, bu ürün çocukların ulaşamayacağı yerlerde tutulmalıdır. FOAMİX, yardımcı madde olarak 549,4 mg monopropilen glikol içermesi sebebiyle deride irritasyona neden olabilir. lıkla hassas yüzeylere (göz, aşınmış deri ve mukoza zarı gibi)temas etmesi durumunda bu bölge bol su ile yıkanmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBu ürün eş zamanlı olarak kafa derisi üzerine topikal olarak uygulanan diğer ilaçlar ile birlikte kullanılmamalıdır (Bkz. Bölüm 4.3.). Kortikosteroidler, tretinoin, ditranol veya vazelin gibi stratum korneum bariyerini değiştirebilen topikal ilaçlar ile eş zamanlı olarak kullanıldığında, minoksidil emiliminde artışa sebep olabilir.Klinik olarak kanıtlanmamış olmasına rağmen, minoksidilin emilen miktarının periferikvazodilatör kaynaklı ortostatik hipotansiyonu güçlendirme teorik olasılığı söz konusudur.Guanetidilin, minoksidilin oral formülasyonları ile etkileşiminin hızlı ve belirgin kan basıncıdüşüklüğüne sebep olduğu rapor edilmiştir. Teorik olarak topikal minoksidil ile Guanetidin'inde etkileşme olasılığı bulunmaktadır. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon: 18 yaşından küçüklerde FOAMİX'in etkililik ve güvenliliği kanıtlanmamıştır, dolayısıyla kullanımı önerilmemektedir. Geriyatrik popülasyon:49 yaşından büyüklerde FOAMİX'in etkililik ve güvenliliği kanıtlanmamıştır, dolayısıyla kullanımı önerilmemektedir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C Çocuk doğurma potansiyeli olan kadınlar/ Doğum kontrolü (Kontrasepsiyon)FOAMİX gebe kadınlarıda kullanımı kontraendikedir. Bu nedenle çocuk doğurma potansiyeli bulunan kadınlar kullanmamalıdır. Gebelik dönemiMinoksidil'in gebe kadınlarda kullanımına ilişkin yeterli çalışma mevcut değildir. Yapılan 3hayvan çalışmaları insan çalışmalarına oranla fetüsün daha fazla maruz kaldığını göstermiştir. İnsanlarda potansiyel fetal zarar riski bulunmaktadır (Bkz. Bölüm 5.3). Laktasyon dönemiMinoksidil'in topikal uygulamada süte geçtiği bilinmektedir. Potansiyel yan etkilerinden dolayı emzirme döneminde kullanılmamalıdır. Üreme yeteneği/Fertilite Farelerde 9 mg/kg'dan daha fazla (insan maruziyetinin en az 25 katı) subkutan olarak uygulanan minoksidilin gebelik, gebe kalma oranını ve yaşayan yavru sayısını azalttığı ileilişkilendirilmiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerMinoksidil'in farmakodinamik ve genel güvenlilik profiline dayanarak, araç ya da makine kullanımı üzerine herhangi bir etkisi beklenmemektedir. 4.8. İstenmeyen etkilerAdvers reaksiyonların sıklığı aşağıdaki gibi sıralanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerle tahminedilemiyor). Bağışıklık sistemi hastalıkları Yaygın : Aşırı duyarlılık reaksiyonları (yüz ödemi, yaygın kızarıklık, genel kaşıntı, yüzde şişlik, boğaz sıkışması dahil) Yaygın olmayan : Anjiyoödem (dudakta ödem, dudakta şişlik, ağızda ödem, orofaringeal şişlik, boğazda ödem, dilin şişmesi ve dil ödemi dahil) Sinir sistemi hastalıklarıÇok yaygın : Baş ağrısı Yaygın olmayan : Baş dönmesi Göz hastalıklarıYaygın olmayan : Gözde iritasyon Vasküler hastalıklarıYaygın olmayan : Hipotansiyon Kardiyak hastalıklarıYaygın : Göğüs ağrısı Yaygın olmayan : Çarpıntı, Nabız artışı Solunum, göğüs bozuklukları ve mediastinal bozukluklarYaygın olmayan : Solunum güçlüğü Deri ve deri altı doku hastalıklarıYaygın : Hipertrikoz (kadınlarda yüz bölgesinde istenmeyen tüylenme), kaşıntı (uygulama yerinde kaşıntılı döküntü ve gözde kaşıntı), kızarıklık (uygulama bölgesinde püstüler, papülergenelleştirilmiş vestibüler ve maküler döküntü), dermatit (uygulama bölgesinde alerjik, atopikve seboreik dermatit). 4Yaygın olmayan : Geçici saç dökülmesi (Bkz. Bölüm 4.4.), saç rengi ve saç dokusunda değişim, ciltte pul pul dökülme (uygulama bölgesinde, eksfoliatif döküntü ve dermatit eksfoliyatif), akne(akne gibi döküntüler) ve ciltte kuruluk (uygulama yeri dahil olmak üzere kuruluk). Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın : Periferik ödem, kilo artışı Yaygın olmayan : Uygulama bölgesinde tahriş (ciltte tahriş) uygulama bölgesinde eritem (eritem ve eritematöz döküntü) (Bazen kulaklar ve yüz gibi kafa derisi yakınındaki yapılardagenellikle kaşıntı, tahriş, ağrı, kızarıklık, ödem, kuru cilt, kızarıklık, döküntü ve bazen dahaşiddetli eksfoliasyon, dermatit, kabarma, kanama ve ülser oluşabilir). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacım yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0312 218 35 99). 4.9. Doz aşımı ve tedavisiFOAMİX vücudun daha geniş bölgelerine ya da kafa derisinin diğer bölgelerine önerilen dozdan fazla uygulandığında, minoksidil'in emilim potansiyeli artabilir. FOAMİX'in minoksidil konsantrasyonu sebebiyle, kazara yutulması ilacın farmakolojik etkisine bağlı olarak sistemik etkileri üretme potansiyeline sahiptir (2 ml FOAMİX 40 mgMinoksidil içerir; bu da hipertansiyon tedavisi için önerilen oral Minoksidil uygulaması içintavsiye edilen maksimum yetişkin dozuna tekabül etmektedir). Minoksidil'in doz aşımı belirtileri ve semptomları başta sodyum ve su tutulması olmak üzere, taşikardi ve hipotansiyon ile ilişkili kardiyovasküler etkiler olacaktır. Taşikardi, hipotansiyon,baş dönmesi ve uyuşukluk da oluşabilir. TedaviMinoksidil'in doz aşımı tedavisi semptomatik ve destekleyici olmalıdır. Sıvı retansiyonu uygun bir diüretik tedavi ile yönetilebilir. Klinik olarak anlamlı taşikardi beta-adrenerjik bloke edicibir ajan ile kontrol edilebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diğer dermatolojik preparatlar ATC kodu: D11AX01 Minoksidil'in saç büyütme mekanizması tam olarak anlaşılmış değildir, fakat aşağıda durumlar açısından Minoksidil androgenetik alopesi saç dökülmesi sürecini tersine çevirebilmektedir: saç çapında artış uyarıcı anagen büyümesi uzayan anagen faz telogen fazlarından uyarıcı anagen iyileşmesi Periferik damar genişletici olarak Minoksidil saç köklerinin mikro dolaşımı arttırır. Vasküler Endotelyal Büyüme Faktörü (Vascular Endothelial Growth Factor-VEGF) Minoksidil ile 5uyarılır ve Vasküler Endotelyal Büyüme Faktörü yüksek metabolik aktivite gösteren, anagen fazında gözlemlenen artmış kapiller fenestrasyon için muhtemel sorumludur. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:FOAMİX ile tedavi sırasında sistemik etkilere ilişkin kanıt tespit edilememesi, normal sağlam deriden topikal uygulanan minoksidilin emiliminin düşük olduğunu gösterir. Topikal olarakuygulanan minoksidilin sistemik emilimi toplam dozun %1 ile %2'si aralığındadır. Dağılım:Minoksidil'in insan plazma proteinlerine tersinir bağlandığına dair yapılan in vitroin vivoolarak meydana gelen plazmaproteinine bağlanma derecesi, klinik açıdan önemsiz olacaktır. İntravenöz uygulamadan sonraminoksidil dağılım hacmi 70 litre olarak tahmin edilmiştir.Biyotransformasyon:Minoksidil,Topikal uygulama sonrası öncelikle karaciğerde Minoksidil glukuronide metabolize edildikten sonra yaklaşık olarak %60'ı absorbe edilir. Eliminasyon:Minoksidil ve metabolitlerinin tamamına yakını idrarla ve az bir miktarda feçes yolu ile atılır. Kullanımı bıraktıktan dört gün sonra topikal olarak uygulanan Minoksidil'in yaklaşık olarak%95'i atılır. Doğrusallık/Doğrusal olmayan durum:Minoksidil doğrusal bir farmakokinetik profil gösterir. 5.3. Klinik öncesi güvenlilik verileriMutajensiteYapılan in vitro ve in vivo deneylerde minoksidil mutajenik ve genotoksik hiçbir potansiyel kanıt göstermemiştir. KanserojeniteFarelerde ve sıçanlarda yüksek oranda hormon aracılı tümörler gözlemlenmiştir, Bu tümörler, reserpine benzer bir mekanizma ile sadece aşırı dozlarda kemirgenlerde görülen ikincilhormonal (hiperprolaktinemi) etkilere bağlıdır. Topikal minoksidil uygulaması kadınlardahormonal durum üzerinde herhangi bir etki göstermemiştir. Bu nedenle, hormonal aracılıktıtümörler minoksidil tarafından yükselmesi insanlar için bir kanserojenik riski temsil etmez. TeratojeniteSıçanlarda ve tavşanlarda yapılan hayvan üreme toksisite çalışmaları insan çalışmalarına oranla çok daha fazla fetüs maruziyetini ve maternal toksisiteyi göstermiştir. Düşük de olsa, insanlardafetal zarar riski vardır. FertiliteFarelerde 9 mg/kg'dan daha fazla (insan maruziyetinin en az 25 katı) subkutan olarak uygulanan minoksidilin gebelik, gebe kalma oranını ve yaşayan yavru sayısını azalttığı ileilişkilendirilmiştir. 6 6. FARMASÖTİK ÖZELLİKLERİ 6.1 Yardımcı Maddelerin Listesi Monopropilen glikol Oleth-20 (PEG-20 Oleyl Ether) Lauryl glucoside Laktik asitEtil alkolDistile su Novamint Fresh Peppermint 506038T 6.2 Geçimsizlikler Bilinen bir geçimsizliği bulunmamaktadır. 6.3 Raf ömrü 24 ay 6.4. Saklamaya yönelik özel tedbirler FOAMİX'i 25°C'nin altındaki sıcaklıklarda ve orijinal ambalajında saklayınız. Güneş ışığından koruyunuz. 6.5 Ambalajın niteliği ve içeriği 100 ml HDPE şişe, köpük yapıcı dispenser pompa, ölçülü kapak ve kullanma talimatı ile birlikte sunulmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri" ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ Meditek İlaç ve Kozmetik İth. İhr. San. ve Tic. Ltd. Şti. Gümüşpala Mah. Kaynata Sok. No:2 / 7 Avcılar/İstanbul 8. RUHSAT NUMARASI 2018/263 9. İLK RUHSAT TARİHİ 18.04.2018 10. KÜB'ÜN YENİLENME TARİHİ 7 |
İlaç BilgileriFoamix %2 Çözelti KöpükEtken Maddesi: Minoksidil Atc Kodu: D11AX01
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.