Tracrium 25 Mg/2.5 Ml Enjeksiyonluk/infüzyonluk Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADITRACRİUM 25 mg/2.5 ml Enjeksiyonluk/İnfüzyonluk Çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir 2.5 mL'lik ampulde; Atrakuryum besilat......25 mg Her 1 mL çözelti ; Atrakuryum besilat......10 mg Yardımcı maddeler:Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMAmpul Berrak cam ampul içinde soluk sarı, steril çözelti. pH=3.2-3.7 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarTRACRİUM, cerrahi girişimlerde veya kontrollü ventilasyon sırasında trakeal entübasyonu sağlamak ve iskelet kaslarını gevşetmek ve yoğun bakım ünitelerindeki (YBÜ) hastalardamekanik ventilasyonu kolaylaştırmak amacıyla genel anesteziye ek olarak uygulanır. Son dereceselektif, kompetitif veya non-depolarizan bir nöromüsküler blokördür. 4.2. Pozoloji ve uygulama şekliİzleme:TÜM NÖROMÜSKÜLER BLOKÖRLERDE OLDUĞU GİBİ, TRACRİUM UYGULAMASI SIRASINDA BİREYSEL DOZ İHTİYACINI BELİRLEMEK İÇİNNÖROMÜSKÜLER FONKSİYONUN İZLENMESİ ÖNERİLİR.Pozoloji/uygulama sıklığı ve süresi:Erişkinler; Enjeksiyon şeklinde;Erişkinlerde doz (gereken tam blok süresine bağlı olarak) 0,3-0,6 mg/kg'dır ve 15-35 dakika süre ile yeterli gevşeme sağlar. Endotrakeal entübasyon genellikle10,5-0,6 mg/kg'lık dozun i.v. enjeksiyonundan sonraki 90 saniye içinde gerçekleştirilebilir. Tam blok süresi, gerektikçe 0,1-0,2 mg/kg'lık ek dozların uygulanması ile uzatılabilir. Artardauygulanan ek dozlar birikmeye neden olmaz. Tam blok sonunda kendiliğinden düzelme, tetanik cevabın normal nöromüsküler fonksiyonun %95'ine ulaşması ölçü olarak alındığında, yaklaşık35 dakikada gerçekleşir. TRACRİUM'un oluşturduğu nöromüsküler blok, öncesinde ya dabirlikte atropin uygulanan, standart dozlarda neostigmin ve edrofonyum gibi antikolinesterazilaçlarla, hiçbir rekürarizasyon belirtisi olmaksızın hızla geri döndürülebilir. İnfüzyon şeklinde:TRACRİUM, uzun süren cerrahi girişimlerde, bolus olarak uygulanan 0,30,6 mg/kg'lık ilk dozdan sonra nöromüsküler blokun sürdürülmesi için 0,3-0,6 mg/kg/saat hızında sürekli infüzyon şeklinde uygulanabilir. TRACRİUM önerilen infüzyon hızında kardiyopulmonerbypass ameliyatlarında infüzyon şeklinde uygulanabilir. Vücut ısısının, oluşturulan hipotermi ile,25o-26 oC'ye düşürülmesi atrakuryumun inaktivasyonunu yavaşlatır, bu nedenle düşük ısılardanormal infüzyon hızının yaklaşık yarısı ile tam nöromüsküler blok sürdürülebilir. TRACRİUMaşağıdaki infüzyon solüsyonları ile aşağıda belirtilen sürelerde geçimlidir:İnfüzyon solüsyonu Stabilite süresi Sodyum klorür intravenöz infüzyon BP (%0,9 a/h) 24 saat Glukoz intravenöz infüzyon BP (%5 a/h) 8 saat Ringer solüsyonu USP 8 saat Sodyum klorür (%0,18 a/h) ve glukoz (%4 a/h) intravenöz infüzyon BP 8 saat Bileşik sodyum laktat intravenöz infüzyon BP (Hartmann solüsyonu)4 saat 0,5 mg/ml ve üzerinde atrakuryum besilat konsantrasyonları verecek şekilde bu solüsyonlarla seyreltilme yapıldığında elde edilen solüsyonlar gün ışığında ve 30oC'ye kadar olan ısıderecelerinde belirtilen sürelerde stabil kalır. Uygulama şekli:TRACRİUM i.v. enjeksiyon yoluyla uygulanır. Nöromusküler bloğun sürdürülmesi için sürekli TRACRİUM infüzyonu uygulanmalıdır. TRACRİUM kesinlikle intramüsküler uygulanmamalıdır.BU İLAÇ SADECE HASTANEDE VE BİR ANESTEZİ UZMANI DENETİMİNDE KULLANILMALIDIR. 2Özel popülasyonlara ilişkin ek bilgiler:Böbrek/ Karaciğer yetmezliği:TRACRİUM son dönem yetmezliği de içeren her düzeyde böbrek ve karaciğer yetersizliği olan hastalarda standart dozlarda uygulanabilir. Pediyatrik popülasyon:1 aydan daha büyük çocuklar için gerekli doz, vücut ağırlığına göre hesaplanan erişkin dozları ile aynıdır. 1 aydan daha küçük yenidoğanlarda ilacın güvenliliği ile ilgili veri yetersizdir. Bu nedenlekullanımı önerilmez (bkz. Bölüm 5.1). Geriyatrik popülasyon:TRACRİUM, yaşlı hastalarda standart dozlarda uygulanabilir. Ancak başlangıç dozunun yavaş uygulanması ve doz aralığının düşük bölümünden seçilmesi önerilir. Diğer:Kardiyovasküler hastalığı olan hastalar:Klinik olarak önemli kardiyovasküler hastalığı olan hastalarda TRACRİUM'un başlangıç dozu 60 saniyeden daha uzun bir süredeuygulanmalıdır.Yoğun bakım ünitesindeki (YBÜ) hastalar:0,3-0,6 mg/kg'lık TRACRİUM'un tercih edilen başlangıç bolus dozundan sonra, TRACRİUM nöromüsküler bloku devam ettirmek için 11-13mikrogram/kg/dak (0,65-0,78 mg/kg/saat) hızlarında sürekli infüzyon şeklinde uygulanabilir,fakat doz gereksinmelerinde hastalar arasında genişdeğişkenlikler olabilir. Dozgereksinmeleri zaman ile değişebilir. Bazı hastalarda 4,5 mikrogram/kg/dak (0,27 mg/kg/saat) kadar az veya 29,5 mikrogram/kg/dak (1,77 mg/kg/saat) kadar yüksek infüzyon hızlarınagerek olabilir. YBÜ hastalarına TRACRİUM'un infüzyon olarak uygulanmasından sonranöromüsküler bloktan kendiliğinden düzelme hızı, uygulama süresinden bağımsızdır. Spontandüzelmeden dörtlü uyarı oranı > 0,75'e (train-of-four ratio, dörtlü uyarıda dördüncüseğirmenin yüksekliğinin birincisine oranı) dönüşün yaklaşık 60 dakika içinde gerçekleşmesibeklenir. Klinik çalışmalarda 32-108 dakika arasında gözlenmiştir. 4.3. KontrendikasyonlarTRACRİUM, atrakuryum, sisatrakuryum ya da benzensülfonik aside aşırı duyarlı olduğu bilinen hastalara uygulanmamalıdır. 34.4. Özel kullanım uyarıları ve önlemleriBÜTÜN NÖROMÜSKÜLER BLOKÖRLER GİBİ, TRACRİUM DA DİĞER İSKELET KASLARI İLE BİRLİKTE SOLUNUM KASLARINDA FELÇ OLUŞTURUR, ANCAKŞUUR ÜZERİNE HERHANGİ BİR ETKİSİ YOKTUR. TRACRİUM SADECEUYGUN GENEL ANESTEZİ İLE BİRLİKTE VE DENEYİMLİ BİR ANESTEZİSTTARAFINDAN VEYA ONUN YAKIN DENETİMİ ALTINDA,ENDOTRAKEALENTÜBASYON VE YAPAY SOLUNUM İÇİN UYGUN OLANAKLARIN MEVCUDİYETİNDE UYGULANMALIDIR.TRACRİUM uygulaması sırasında, duyarlı hastalarda histamin salınım potansiyeli mevcuttur. Histaminin etkilerine daha fazla hassasiyet gösteren hastalara TRACRİUM uygulanırken dikkatliolunmalıdır. Özellikle alerji ve astım öyküsü olan hastalarda bronkospazm meydana gelebilir. Nöromüsküler bloke edici ajanlarda yüksek oranlarda çapraz duyarlılık bildirilmiştir. Bu nedenle mümkün olduğu hallerde atrakuryum uygulanmadan önce diğer bloke edici ajanlara aşırıduyarlılık dışlanmalıdır. Atrakuryum duyarlı hastalarda ancak gerekli ise kullanılmalıdır. Genelanestezi altında aşırı bir duyarlılık deneyimleyen hastalar sonradan diğer nöromüsküler blokeedici ajanlara karşı aşırı duyarlılık açısından test edilmelidir. Yoğun bakım ünitelerinde yüksek doz kortikosteroidler ve nöromüsküler bloke edici ajanlar verilen astımlı hastalarda, seri kreatinin fosfat (cpk) değerlerinin izlenmesi düşünülmelidir. TRACRİUM'un önerilen dozlarda anlamlı bir vagal veya gangliyon blokör etkisi yoktur. Bu nedenle, TRACRİUM önerilen dozlarda kalp hızı üzerine klinik olarak anlamlı bir etki göstermez.Ameliyat sırasındaki vagal stimülasyon veya birçok anestezik ilacın neden olduğu bradikardiyiönlemez. Miyastenia gravis, diğer nöromüsküler hastalıklar ve ciddi elektrolit dengesizliğiolan hastalarda diğer non-depolarizan nöromüsküler blokörler gibi TRACRİUM'a da artmış yada azalmış hipersensitivite görülebilir. Diğer non-depolarizan nöromüsküler blokörlerde olduğugibi, hipofosfatemi iyileşme süresinin uzamasına neden olabilir. Hipofosfatemi düzeltilerek busüreç hızlandırılabilir. TRACRİUM, arteriyel kan basıncı düşmelerine çok hassas olanhastalarda (örn. hipovolemik hastalarda), 60 saniyeden daha uzun bir sürede uygulanmalıdır.TRACRİUM yüksek pH'da inaktive olduğu için, tiyopenton veya herhangi bir alkali ajan ilebirlikte aynı şırıngada karıştırılmamalıdır. 4TRACRİUM uygulaması için ince bir damar seçilmişse, uygulama sonrası serum fizyolojik ile damar yıkanmalıdır. Diğer anestezik ilaçların da TRACRİUM'la aynı iğne ya da kanüldenuygulanması halinde her ilacın yeterli hacimde serum fizyolojik ile yıkanması çok önemlidir.TRACRİUM hipotoniktir ve kan transfüzyonunun infüzyon yolundan uygulanmamalıdır. Malignhipertermiye duyarlı hayvanlardaki (domuz) çalışmalar ve malign hipertermiye duyarlıhastalarda yapılan klinik çalışmalarda, TRACRİUM'un bu sendromun oluşmasını kolaylaştırıcıetki göstermediği saptanmıştır. Diğer non-depolarizan nöromüsküler blokörlerde olduğu gibiyanıklı hastalarda direnç gelişebilir. Bu hastalarda yanıktan beri geçen süre ve yanığınbüyüklüğüne göre doz artırılması gerekebilir. Yoğun bakım ünitesi (YBÜ) hastaları:4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriHalotan, izofluran ve enfluran gibi inhalasyon anesteziklerinin birlikte uygulanması ile TRACRİUM'un oluşturduğu nöromüsküler blok uzayabilir. Diğer non-depolarizan nöromüsküler blokörlerle olduğu gibi, TRACRİUM ile birlikte uygulandıklarında aşağıdaki ilaçlar non-depolarizan nöromüsküler blokun derinliğini ve/veyasüresini artırabilirler: Antibiyotikler (aminoglikozidler, polimiksinler, spektinomisin, tetrasiklinler, linkomisin veklindamisin) Antiaritmik ilaçlar (propranolol, kalsiyum kanal blokörleri, lidokain, prokainamid vekinidin) Diüretikler (furosemid ve muhtemelen mannitol, tiazid diüretikleri ve asetazolamid) Magnezyum sülfat Ketamin Lityum tuzları Gangliyon blokörleri (trimetafan, hekzametonyum) Nadiren bazı ilaçlar latent miyastenia gravisi maskeleyebilir, kötüleştirebilir veya miyastenik sendromu indükleyebilir. Böyle bir gelişme, TRACRİUM'a artmış bir duyarlılığa neden olabilir. 5Bu ilaçlar şunlardır: Çeşitli antibiyotikler, beta-blokörler (propranolol, oksprenolol), antiaritmik ilaçlar (prokainamid, kinidin), antiromatizmal ilaçlar (klorokin, D-penisilamin), trimetafan,klorpromazin, steroidler, fenitoin ve lityum. Kronik antikonvülsan tedavi uygulananhastalarda non-depolarizan nöromüsküler blok başlaması için geçen süre uzayabilir ve blok süresikısalabilir. TRACRİUM ile birlikte diğer non-depolarizan nöromüsküler blokörlerin uygulanması halinde, uygulanan TRACRİUM'un eşdeğer etkili toplam dozlarından beklenenden çok daha fazlanöromüsküler blokaj oluşabilir. Farklı ilaç kombinasyonlarında görülebilecek sinerjik etkilerdeğişkendir. Süksametonyum klorür gibi depolarizan kas gevşeticiler, atrakuryum gibi nondepolarizan ajanların nöromüsküler blok etki sürelerini uzatmak amacıyla uygulanmamalıdır, çünkü buantikolinesteraz ilaçlarla geri döndürülmesi zor olabilen, uzamış ve kompleks bir bloka yolaçabilir. Genellikle Alzheimer hastalığının tedavisinde kullanılan antikolinesteraz ilaçlar (örn. donazepil) ile tedavi, atrakaryumun nöromüsküler blokaj süresini kısaltabilir ve derinliğini azaltabilir. Özel popülasyonlara ilişkin ek bilgilerVeri bulunmamaktadır. Pediyatrik popülasyon:Veri bulunmamaktadır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)TRACRİUM'un doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiHayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermistir (bkz. bölüm 5.1). İnsanlara yönelik potansiyel risk bilinmemektedir. Diğer bütün nöromüsküler blokör ajanlarda olduğu gibi TRACRİUM hamilelikte anneye 6beklenen yararları fetüs üzerine muhtemel risklerinden fazla olduğuna inanılan durumlarda kullanılmalıdır. TRACRİUM sezaryen ameliyatlarında kas gevşemesini sürdürmek içinuygundur; çünkü atrakuryum önerilen dozları takiben plasentadan klinik açıdan anlamlımiktarda geçmez. TRACRİUM gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiTRACRİUM'un anne sütüne geçip geçmediği bilinmemektedir. Üreme yeteneği/FertiliteTRACRİUM'un üreme yeteneği ve fertilite üzerindeki etkisine dair çalışma yapılmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkilerTRACRİUM'un araç ve makine kullanımı üzerine etkisi bilinmemektedir. TRACRİUM, her zaman bir genel anestezik ile birlikte kullanılacaktır ve bu nedenle genel anestezi sonrasında araçve makine kullanımı ile ilgili standart önlemler geçerlidir. 4.8. İstenmeyen etkilerTedavi sırasında en yaygın sıklıkla bildirilen advers reaksiyonlar hipotansiyon (hafif, geçici) ve deride kızarıklıktır; bu olaylar histamin salınımı ile ilişkilendirilmektedir. Çok seyrek sıklıkla, birveya daha fazla anestezik ajan ile birlikte atrakuryum uygulanan hastalarda şiddetli anafilaktoidveya anafilaktik reaksiyonlar bildirilmiştir. Advers reaksiyonlar aşağıda sistem organ sınıfı ve sıklığa göre listelenmektedir. Sıklıklar şu şekilde tanımlanmaktadır: çok yaygın (> 1/10), yaygın (>1/100 ve < 1/10), yaygın olmayan(>1/1000 ve < 1/100), seyrek (>1/10,000 ve < 1/1000), çok seyrek (< 1/10,000), bilinmiyor (eldekiverilerden haraketle tahmin edilemiyor). Çok yaygın, yaygın ve yaygın olmayan sıklıklar klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek sıklıklar genellikle spontan verilerden çıkarılmıştır. Bilinmiyor şeklindeki sıklıksınıflandırması, eldeki verilerden sıklığın tahmin edilemediği reaksiyonlar için kullanılmıştır. Klinik Çalışma Verileri Vasküler hastalıklarYaygın: Hipotansiyon (hafif, geçici)#, Deride kızarıklık # 7Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Bronkospazm# Pazarlama Sonrası Veriler Bağışıklık sistemi hastalıklarıÇok seyrek: Anafilaktik reaksiyon, şok, dolaşım yetmezliği ve kardiyak arrest dahil anafilaktoid reaksiyon Çok seyrek sıklıkla, bir veya daha fazla anestezik ajan ile birlikte atrakuryum uygulanan hastalarda şiddetli anafilaktoid veya anafilaktik reaksiyonlar bildirilmiştir. Sinir sistemi hastalıklarıBilinmiyor: NöbetlerAtrakuryum ile beraber çeşitli başka ilaç alan YBÜ hastalarında nöbetlere ilişkin bildirimler alınmıştır. Ancak bu hastalarda genellikle nöbetleri tetikleyen bir veya daha fazla medikal durumsöz konusu olmuştur (Örn: kraniyel travma, serebral ödem, viral ensefalit, hipoksik ensefalopati,üremi). Bu nöbetlerin laudanozin ile nedensel ilişkisi saptanmamıştır. Klinik çalışmalarda, plazmalaudanozin konsantrasyonu ile nöbetlerin ortaya çıkışı arasında herhangi bir korelasyongörülmemiştir. Deri ve deri altı doku hastalıklarıSeyrek: Ürtiker Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıBilinmiyor: Miyopati, kas güçsüzlüğü YBÜ'ndeki ağır hastalarda kas gevşeticilerin uzun süreli kullanımı sonrasında kas güçsüzlüğü ve/veya miyopati ile ilgili bazı raporlar mevcuttur. Bu hastaların birçoğu aynı zamandakortikosteroidde kullanan hastalardır. TRACRİUM kullanımı sırasında bu semptomlar nadirengörülmektedir ve aralarında nedensel bir ilişki saptanmamıştır. Histamin salınımı ile ilişkilendirilmiş olan olaylar kare işareti (#) ile belirtilmektedir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye 8Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiBelirtiler:Uzamış kas paralizi ve bunun sonuçları aşırı dozajın ana belirtisidir.Tedavisi:5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup:KAS GEVŞETİCİLER, PERİFERİK ETKİLİ AJANLAR - Diğer kuaterner amonyum bileşikleriATC-kodu: M03AC04 Atrakuryum yüksek derecede selektif, kompetitif veya non-depolarizan nöromüsküler blokör ilaçtır. (Non-depolarizan nöroblokerler, motor son-plaktaki reseptörlere bağlanarak asetilkolininetkisini antagonize ederler. Atrakuryum cerrahi girişimlerde ve kontrollü ventilasyonunkolaylaştırılmasında yaygın olarak kullanılır.) Pediyatrik popülasyon: Yenidoğanlarda literatür raporlarından elde edilen kısıtlı veriler, çocuklarla karşılaştırıldığında bu popülasyonundaki atrakuryumun başlangıç süresinin ve etkigösterdiği sürenin değişkenlik gösterdiğini belirtmektedir. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Atrakuryum farmakokinetiği 0,3-0,6 mg/kg doz aralığında doğrusaldır. Eliminasyon yarı ömrü yaklaşık 20 dakikadır. Dağılım:Dağılım hacmi 0,16 L/kg'dır. Atrakuryumun plazma proteinlerine bağlanma oranı %82'dir. Metabolitlerin konsantrasyonu böbrek ve/veya karaciğer fonksiyonu anormal YBÜ hastalarında 9daha yüksektir (bkz. Özel Kullanım Uyarıları ve Önlemleri). Bu metabolitler nöromüsküler bloğa katkıda bulunmaz. Biyotransformasyon:Atrakuryum spontan bir şekilde, ağırlıklı olarak plazma pH ve vücut sıcaklığı değerlerinde gerçekleşen ve inaktif olan bozunma ürünleri veren enzimatik olmayan bir dekompozisyonprosesi (Hofmann eliminasyonu) ile parçalanır. Yıkım ayrıca spesifik olmayan esteraz ile katalizeolan ester hidroliziyle de oluşur. Atrakuryumun eliminasyonu böbrek ya da karaciğerfonksiyonuna bağlı değildir. Eliminasyon:Başlıca yıkım ürünleri laudanozin ve bir monokuarterner alkol olup ikisi de nöromüsküler bloke edici aktiviteye sahip değildir. Monokuarterner alkol, Hofmann eliminasyonu ile spontan yıkımauğrar ve böbrek tarafından atılır. Laudanozin böbrek yoluyla atılır ve karaciğerde metabolize olur.Laudanozinin yarılanma ömrü normal böbrek ve karaciğer fonksiyonuna sahip hastalarda 3-6saattir. Böbrek yetmezliğinde yaklaşık 15 saat ve böbrek ve karaciğer yetmezliğinde yaklaşık 40saattir. Laudanozinin maksimum plazma düzeyi en yüksek böbrek veya karaciğer fonksiyonundanyoksun hastalardadır ve geniş ölçüde değişken olmakla birlikte ortalama 4 mcg/mL'dir. Hastalardaki karakteristik özelliklerYoğun bakım ünitesindeki hastalar: Anormal böbrek ve/veya karaciğer fonksiyonu olan yoğun bakım ünitesi (YBÜ) hastalarında metabolitlerin konsantrasyonu daha yüksektir (Bkz. Özel kullanım uyarıları ve önlemleri).Ancak bu metabolitlerin nöromüsküler bloke edici etkisi yoktur. 5.3. Klinik öncesi güvenlilik verileriKarsinojenite çalışması yapılmamıştır. Diğer bölümlerde belirtilen veriler haricinde klinik öncesi güvenlik verisi bulunmamaktadır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesipH ayarı için benzen sülfonik asit çözeltisi Distile su 106.2. GeçimsizliklerTRACRİUM yüksek pH'da inaktive olduğu için, herhangi bir alkali ajan ile birlikte aynı şırıngada karıştırılmamalıdır. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler2°- 8°C arasında buzdolabında saklayınız. Işıktan koruyunuz. Dondurmayınız. Sadece taşıma veya soğuk depo dışında geçici depolama için 30°C'ye kadar sıcaklık derecelerinde kısa sürelerde tutulmasına izin verilebilir. TRACRİUM'un 30°C'de bir ay depolanması ile %5etki kaybı olacağı hesaplanmaktadır.Açılmış ampullerdeki kullanılmamış TRACRİUM atılmalıdır. 6.5. Ambalajın niteliği ve içeriğiKutuda 2.5 ml, 5 adet ampul 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir.Ampul açma talimatları:Ampuller OPC (Tek Kırma Noktası) açma sistemi ile donatılmıştır ve aşağıdaki talimatlar doğrultusunda açılmalıdır: Resim 1'de gösterildiği gibi ampulü alt kısmından tutunuz. Resim 2'de gösterildiği gibi diğer elinizin başparmağını ampuldeki renkli noktaya bastırınız. 11Şekil 2
Şekil 1 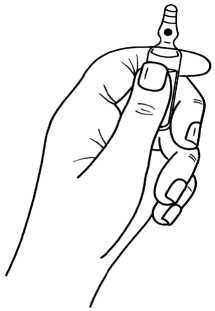 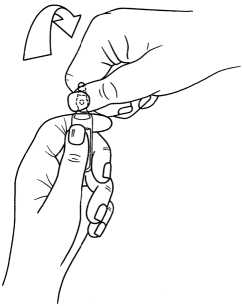 7. RUHSAT SAHİBİVLD Danışmanlık, Tıbbi Ürünler ve Tanıtım Hizmetleri A.Ş. Büyükdere Cad. No: 127 Astoria İş Merkezi A Blok K8 Esentepe, Şişli- İstanbul Tel no : 0 212 340 76 84 8. RUHSAT NUMARASI2018/141 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk Ruhsat Tarihi: 12/03/2018 Ruhsat Yenileme Tarihi: 10. KÜB'ÜN YENİLENME TARİHİ12 |
İlaç BilgileriTracrium 25 Mg/2.5 Ml Enjeksiyonluk/infüzyonluk ÇözeltiEtken Maddesi: Atrakuryum Besilat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.