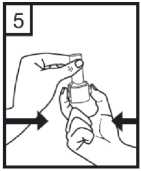
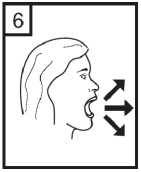
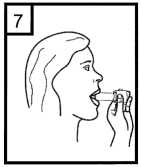
Fixhaler 12 Mcg/250 Mcg İnhalasyon Tozu, Sert Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFİXHALER 12 mcg / 250 mcg inhalasyon tozu, sert kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir inhalasyon kapsülü içinde (ağız parçasından çıkan doz) Formoterol fumarat dihidrat 12 mcg Flutikazon propiyonat 250 mcg Her uygulamadan sonra hastaya ulaşan doz; formoterol fumarat dihidrat için 10 mcg, flutikazon propiyonat için 220 mcg'dır. Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon tozu, sert kapsül Beyaz ya da beyazımsı toz içeren, renksiz şeffaf kapak ve renksiz şeffaf gövdeli kapsül 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:FİXHALER sadece inhalasyon yolu ile uygulanır. Hastalar, belirtileri olmasa dahi optimum fayda için FİXHALER'i düzenli olarak kullanmaları gerektiği konusunda uyarılmalıdır. Hastaların düzenli olarak doktor kontrolünde bulundurularak aldıkları FİXHALER dozunun optimum düzeyde kalması sağlanmalı ve sadece doktor önerisi ile değiştirilmelidir. Doz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde 2 kez uygulanan FİXHALER ile belirtilerin kontrolü sağlandığında, doz semptomların etkinkontrolü sağlandğı en düşük doza titre edilmelidir. FİXHALER en düşük dozu ile astım kontrolüsağlandığında tedavi tekrar değerlendirilmeli ve gerekirse tek başına inhale kortikosteroid içerentedaviye geçilmelidir. KOAH hastalarında FİXHALER kullanımı ile ilgili bir veri mevcut değildir. KOAH hastalarında kullanılmamalıdır. 1 Eğer hasta yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilemiyorsa tedavinin terapötik olarak eşdeğer kortikosteroid dozunda FİXHALER ile değiştirilmesi astımkontrolünde düzelme sağlayabilir. Astımı yalnız inhale kortikosteroid tedavisi ile yeterliderecede kontrol edilebilen hastalarda tedavinin FİXHALER ile değiştirilmesi astımkontrolünü sürdürürken kortikosteroid dozunun azaltılmasını sağlayabilir. Tavsiye Edilen Dozlar:12 yaş ve üzeri adolesanlar ve yetişkinlerGünde 2 kez 1 inhalasyon FKHALER 12 mcg / 250 mcg inhalasyon tozu, sert kapsül Uygulama şekli:FİXHALER sadece inhalasyon yoluyla kullanılır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Karaciğer veya böbrek yetmezliği olan hastalarda FİXHALER kullanımı ile ilgili bir veri mevcut değildir. Bu hastalar, semptomların etkin kontrolünü sağlayacak en düşük doza titreettirmek üzere düzenli olarak hekim tarafından izlenmelidir. Sistemik dolaşıma geçenformoterol ve flutikazon fraksiyonlarının primer olarak karaciğer yolu ile metabolizeedildiğinden ciddi karaciğer yetmezliği olan hastalarda artmış bir maruziyet beklenebilir. Pediatrik popülasyon:12 yaşından küçük çocuklarda FİXHALER kullanımı ile ilgili bilgi yoktur. İnhale kortikosteroidler ile uzun süreli tedavi uygulanan çocuklarının boyunun düzenli olarak izlenmesi önerilir. Büyüme yavaşlarsa, inhale kortikosteroid dozunun mümkünse etkili astımkontrolünün sağlandığı en düşük doza azaltılması amacıyla tedavi değerlendirilmelidir. Ayrıca,hastanın bir pediyatrik solunum uzmanına sevk edilmesi düşünülmelidir. 12 yaşından küçük çocuklarda FİXHALER kullanımına ilişkin sadece sınırlı veriler bulunmaktadır. Daha fazla veriye ulaşılana dek, FİXHALER kullanımı 12 yaşından küçükçocuklarda önerilmemektedir. Geriyatrik popülasyon:Doz modifikasyonu gerekli değildir. 4.3 KontrendikasyonlarFİXHALER, bileşenlerinden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir (bkz. 6.1 Yardımcı Maddeler Listesi). 4.4 Özel kullanım uyarıları ve önlemleriNormalde, astım tedavisi basamaklı bir programı izlemelidir ve hastaların yanıtları klinik olarak ve akciğer fonksiyon testleri ile izlenmelidir. FİXHALER, hızlı ve kısa sürede etki gösteren bir bronkodilatör gereken akut astım semptomlarının tedavisi için kullanılmamalıdır. Hastalara, akut astım krizlerinin giderilmesiiçin ilaçlarını her zaman yanlarında bulundurmaları önerilmelidir. 2 Egzersiz astımında FİXHALER'in profilaktik kullanımı üzerinde çalışılmamıştır. Bu kullanım için, hızlı etki gösteren başka bir bronkodilatör düşünülmelidir. Hastalara, semptom olmayan zamanlarda bile FİXHALER dozunu reçetelendirilen şekilde almaları hatırlatılmalıdır. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. FIXHALER tedavisi sırasında astıma bağlı ciddi advers olaylar ve alevlenmeler gerçekleşebilir. Hastalardan tedaviye devam etmeleri, ancak FİXHALER başlandıktan sonra astım semptomlarıkontrolsüz olarak kalırsa veya kötüleşirse tıbbi yardım almaları istenmelidir. FİXHALER, astım hastalığının başlangıç tedavisi için önerilmez. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Astımı yatıştırmak için kısa etki süreli bronkodilatörlerin kullanımında artış gerekiyorsa, kısa etki süreli bronkodilatörler daha az etkili olmaya başladıysa veya etkisizse veya astımsemptomları sürüyorsa, bunlar astım kontrolünün kötüleşme göstermesinin ve tedavinindeğişmesinin bir işareti olabileceğinden, hasta doktoru tarafından mümkün olan en kısa süredemuayene edilmelidir. Astım kontrolünde ani ve ilerleyen kötüleşme potansiyel olarak yaşamı tehdit edici olabilir ve hasta acil tıbbi değerlendirmeye girmelidir. Kortikosteroid tedavisinin artırılmasıdüşünülmelidir. Ayrıca, geçerli FİXHALER dozu yeterli astım kontrolü sağlayamadığındahasta tıbbi açıdan incelenmelidir. Ek kortikosteroid tedavisi düşünülmelidir. Astım semptomları kontrol edildiğinde, FİXHALER dozunun giderek azaltılması düşünülmelidir. Tedavide basamaklar azaltıldıkça hastaların düzenli şekilde incelenmesiönemlidir. Etkili olan en düşük FİXHALER dozu kullanılmalıdır (bkz. bölüm 4.2). FİXHALER tedavisi, alevlenme riski nedeniyle astım hastalarında aniden durdurulmamalıdır. Tedavi hekimin gözetimi altında titre edilerek azaltılmalıdır. Astımın klinik semptomlarının alevlenmesi akut solunum yolu bakteriyel enfeksiyonu nedeniyle oluşabilir ve tedavisi uygun antibiyotikler, inhale kortikosteroidlerin artırılması vekısa süreli bir oral kortikosteroid kürü gerektirebilir. Kurtarma ilacı olarak hızlı etkili inhale birbronkodilatör kullanılmalıdır. Kortikosteroid içeren tüm inhale ilaçlarda olduğu gibi,FİXHALER pulmoner tüberküloz, inaktif tüberküloz veya solunum yolunun fungal, viral veyadiğer enfeksiyonları bulunan hastalara dikkatle uygulanmalıdır. FİXHALER kullanılıyorsa, butür enfeksiyonlar her zaman yeterli ölçüde tedavi edilmelidir. Formoterol, astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.3 FKHALER, tirotoksikoz, feokromositoma, diabetes mellitus, hipokalemi bulunan hastalar veya düşük serum potasyum düzeylerine eğilimli hastalar, hipertrofik obstrüktifkardiyomiyopati, idiopatik subvalvuler aortik stenoz, şiddetli hipertansiyon, anevrizma veyaiskemik kalp hastalığı, kardiyak aritmiler veya şiddetli kalp yetmezliği gibi diğer şiddetlikardiyovasküler bozukluklara yatkın hastalarda dikkatle kullanılmalıdır. Potansiyel olarak, ciddi hipokalemi yüksek dozda beta agonisti nedenli olabilir. Beta agonistlerinin hipokalemi oluşturabilen veya hipokalemi etkisini güçlendirebilen ilaçlarla (örn.ksantin türevleri, steroidler ve diüretikler) birlikte eşzamanlı tedavisi beta agonistinin olasıhipokalemi etkisine katkıda bulunabilir. Kurtarma bronkodilatörlerinin çeşitli kullanımlarıbulunan, stabil olmayan astımda, ilişkilendirilen riskin hipoksi ile artırılabilecek olmasınedeniyle akut şiddetli astımda ve hipokalemi advers etkilerinin arttığı diğer rahatsızlıklardaözel dikkat önerilir. Bu durumlar sırasında serum potasyum düzeylerinin izlenmesi önerilir. İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzunetkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. QT aralığının uzadığı hastalar tedavi edilirken dikkatli olunmalıdır. Formoterolün kendisi QT aralığını uzatabilir. Tüm beta agonistleri için, diyabetik hastalarda kan şekeri için ek kontroller düşünülmelidir. Özellikle geçmiş sistemik steroid tedavisi nedeniyle adrenal fonksiyonunun azaldığınıdüşündürecek bir durum varsa, hastalar FİXHALER tedavisine geçirilirken dikkatliolunmalıdır. Diğer inhalasyon tedavilerinde olduğu gibi, dozlamadan sonra hırıltılı solunum ve nefes yetmezliğinde hızlı bir artışla paradoksik bronkospazm gerçekleşebilir. Paradoksikbronkospazm hızlı etkili inhale bronkodilatörlere yanıt verir ve hemen tedavi edilmeli,FİXHALER kullanımı hemen bırakılmalı, hasta değerlendirilmeli ve gerekirse alternatif tedavibaşlatılmalıdır. Özellikle uzun süreli olarak yüksek dozlarda kullanılan herhangi bir inhale kortikosteroid ile sistemik etkiler oluşabilir. Bu etkilerin oluşmasının olasılığı oral kortikosteroidlere göre dahaazdır. Olası sistemik etkiler, Cushing sendromu, Cushingoid özellikler, adrenal baskılanması,çocuklarda ve ergenlerde büyüme geriliği, kemik mineral yoğunluğunda azalma, kataraktglokomu ve daha nadir şekilde, psikomotor hiperaktivitesi, uyku bozuklukları, anksiyete,depresyon veya agresyon (özellikle çocuklarda) dahil olmak üzere bir dizi psikolojik vedavranışsal etkileri içerir. Bu nedenle hastanın düzenli şekilde incelenmesi ve inhalekortikosteroid dozunun astımın etkili kontrolünün sağlandığı en düşük doza azaltılmasıönemlidir. Yüksek dozda inhale kortikosteroidlerle hastaların uzun süreli tedavisi adrenal baskılanması ve akut adrenal kriz ile sonuçlanabilir. Yüksek dozda flutikazon propiyonat (tipik olarak >1000mikrogram/gün) kullanan 16 yaşın altındaki çocuklar ve ergenler özel olarak risk altındaolabilir. 500- 1000 mikrogram flutikazon propiyonat dozları ile çok nadir olarak adrenalbaskılanması ve akut adrenal kriz olguları tanımlanmıştır. Potansiyel olarak akut adrenal krizitetikleyebilecek durumlar, travma, ameliyat, enfeksiyon veya dozda hızlı azalmaları içerir.Semptomlarının anlaşılması genellikle güçtür ve anoreksi, karın ağrısı, kilo verme, yorgunluk,baş ağrısı, mide bulantısı, kusma, hipotansiyon, bilinç kaybı, hipoglisemi ve nöbetleri içerebilir. 4 Stres sırasında ve elektif cerrahi gerçekleştirilecek zamanlarda ek sistemik kortikosteroid tedavisi düşünülmelidir. İnhale flutikazon propiyonat tedavisinin faydaları oral steroid ihtiyacını en aza indirgemelidir, ancak oral steroidlerden geçiş yapan hastalar belirli bir süre adrenal rezerv bozukluğu riskialtında olabilir. Geçmişte yüksek dozda acil kortikosteroid tedavisi gerektiren hastalar da riskaltında olabilir. Bu reziduel bozukluk olasılığı, stres oluşturması olası acil ve elektifdurumlarda her zaman akılda tutulmalı ve uygun kortikosteroid tedavisi düşünülmelidir.Adrenal bozukluk boyutu elektif prosedürlerden önce uzman tavsiyesi gerektirebilir. Adrenalfonksiyon bozukluğu olması olası durumlarda, hipotalamik pitüiter adrenokortikal (HPA) aksfonksiyonu düzenli şekilde izlenmelidir. Flutikazon propiyonatın güçlü CYP3A4 inhibitörleri ile kombinasyonunda sistemik yan etkilerin riskinde artış bulunmaktadır (bkz. bölüm 4.5). Hasta sabit dozlu kombinasyon inhalerinin profilaktik bir tedavi olduğunun ve bu nedenle optimum fayda alınması için asemptomatik zamanlarda bile düzenli kullanılması gerektiğininfarkında olmalıdır. Sistemik dolaşıma ulaşan flutikazon ve formoterol fraksiyonlarının birincil olarak hepatik metabolizma ile elimine edilmesi nedeniyle, şiddetli karaciğer yetmezliği olan hastalardamaruziyette artış beklenebilir. KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmalann tamamında kesin olarakgösterilmemiştir. Kortikosteroid içeren inhale ilaçlannın pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalannda olası pnömoni gelişimine karşı, enfeksiyonlann klinik özellikleri ile KOAH semptomlarırun alevlenme durumunun karışması ihtimali dolayısıyla dikkatliolmalıdırlar. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriFİXHALER ile ilaç etkileşimi çalışmaları gerçekleştirilmemiştir. FİXHALER'in bir bileşeni olan flutikazon propiyonat bir CYP 3A4 substratıdır. Güçlü CYP 3A4 inhibitörlerinin (örn. ritonavir, atazanavir, klaritromisin, indinavir, itrakonazol, nelfinavir,sakuinavir, ketokonazol, telitromisin) FİXHALER ile kısa süreli birlikte kullanımının etkileriminör klinik öneme sahiptir, ancak uzun süreli tedavide dikkatli olunmalıdır ve mümkünse builaçlarla birlikte kullanımından kaçınılmalıdır. Faydasının sistemik glukokortikoid yan etkilerinriskindeki artıştan daha fazla olmadığı sürece, özellikle ritonavir ile birlikte uygulamadankaçınılmalıdır. İnhale flutikazon propiyonat için bu etkileşim hakkında bilgi bulunmamaktadır,ancak flutikazon propiyonat plazma düzeylerinde belirgin bir artış beklenmektedir. Cushingsendromu ve adrenal baskılanma olguları raporlanmıştır. Potasyum tutucu olmayan diüretiklerin (lup veya tiyazid diüretikleri gibi) uygulanması nedenli olabilecek EKG değişiklikleri ve/veya hipokalemi, özellikle önerilen beta agonist dozu 5 aşıldığında akut olarak beta agonistleri ile kötüleşebilir. Bu etkilerin klinik anlamlılığı bilinmiyor olsa da, potasyum tutucu olmayan diüretikler ile beta agonistin birlikte uygulanmasısırasında dikkatli olunması önerilir. Ksantin türevleri ve glukokortikosteroidler betaagonistlerin olası hipokalemi etkisine katkıda bulunabilir. L-Dopa'ya ek olarak, L-tiroksin, oksitosin ve alkol de P2 sempatomimetiklerine karşı kardiyak toleransı düşürebilir. Furazolidon ve prokarbazin gibi benzer özelliklere sahip maddeler dahil olmak üzere monoamin oksidaz inhibitörleri ile eşzamanlı tedavi hipertansif reaksiyonlara zeminhazırlayabilir. Halojenli hidrokarbonlar ile eşzamanlı anestezi alan hastalarda aritmi riski artışı bulunmaktadır. Diğer beta adrenerjik ilaçların eşzamanlı kullanımının potansiyel olarak ek bir etkisi bulunabilir. Digitalis glikozidleri ile tedavi edilen hastalarda hipokalemi, aritmi riskini artırabilir. Diğer beta agonistleri ile olduğu gibi, formoterol fumarat, trisiklik antidepresanlar veya monoamin oksidaz inhibitörleri ile tedavi sırasında ve bırakılmalarının hemen ardından ikihaftalık süre boyunca veya QT aralığını uzattığı bilinen antipsikotikler (fenotiyazinler dahil),kinidin, disopiramid, prokainamid ve antihistaminler gibi diğer ilaçlar ile tedavi edilen hastalaradikkatle uygulanmalıdır. QT aralığını uzattığı bilinen ilaçlar ventriküler aritmi riskini artırabilir(bkz. bölüm 4.4). Herhangi bir yoldan ek adrenerjik ilaçlar uygulanacaksa, formoterolün farmakolojik olarak öngörülebilir sempatik etkilerinin güçlenebilecek olması nedeniyle dikkatle kullanılmalıdır.Beta adrenerjik reseptör antagonistleri (beta blokörler) ve formoterol fumarat eşzamanlı olarakuygulandığında birbirinin etkisini inhibe edebilir. Beta blokörler ayrıca astımlı hastalardaşiddetli bronkospazm oluşturabilir. Bu nedenle, astımlı hastalar normalde beta blokörler iletedavi edilmemelidir ve bu duruma glokom tedavisi için göz damlası olarak kullanılan betablokörler dahildir. Ancak, belirli koşullar altında (örn. kalp krizinin ardından koruma amaçlıolarak), astımlı hastalarda beta blokörlerinin kullanımı yerine kabul edilebilir alternatifbulunmayabilir. Bu durumda, dikkatle uygulanması gerekse de kardiyoselektif beta blokörlerdüşünülmelidir. Özel popülasyonlara ilişkin ek bilgilerBildirilmemiştir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)FİXHALER' in doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Bu dönemdeki kadınlar bu ilacı kullanacaklarsa etkili bir doğum kontrol yöntemi uygulamalıdır. Gebelik dönemiGebelikte kullanım ile ilgili yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. kısım 5.3). İnsanlara yönelikpotansiyel risk bilinmemektedir. 6 İlaç kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. Uterus kontraktilitesi üzerine beta agonistin etkisi olduğundan, FfXHALER'm doğum sırasında kullanımı faydanın risklere ağır geldiği hastalar ile sınırlı olmalıdır. Laktasyon dönemiFlutikazon propiyonat veya formoterol fumaratın insanlarda anne sütü ile atılıp atılmadığı bilinmemektedir. Emzirilen bebek için risk göz ardı edilemez. Bu nedenle, emzirmenin bebekiçin faydası ve tedavinin kadın için faydası göz önüne alınarak, emzirmeyi bırakma veyaFİXHALER tedavisini bırakma konusunda bir karar verilmelidir. Üreme yeteneği/FertiliteFİXHALER uygulamasının ardından fertilite üzerindeki etkilere ilişkin veri bulunmamaktadır. Hayvan çalışmalarında, her bir etkin maddenin klinik açıdan ilişkili dozlarda uygulanmasınınardından fertilite üzerine etki görülmemiştir (bkz. bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerFİXHALER' in araç ve makine kullanımı üzerinde etkisi bulunmamakta veya ihmal edilebilir düzeydedir. 4.8 İstenmeyen etkilerSıklıklar şu şekilde tanımlanır: çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000),bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Pnömoni (KOAH'lı hastalarda) Seyrek: Ağızda kandidiyaz, oral fungal enfeksiyonlar, sinüzit Metabolizma ve beslenme hastalıklarıSeyrek: Hiperglisemi Psikiyatrik hastalıklarYaygın olmayan: İnsomnia dahil uyku bozuklukları Seyrek: Anormal rüyalar, ajitasyon Bilinmiyor: Psikomotor hiperaktivite, anksiyete, depresyon, agresyon, davranışsal değişiklikler (ağırlıklı olarak çocuklarda) Sinir sistemi hastalıklarıYaygın olmayan: Baş ağrısı, titreme, baş dönmesi Seyrek: Disguzi Kulak ve iç kulak hastalıklarıSeyrek: Vertigo Kardiyak hastalıklarYaygın olmayan: Çarpıntı, ventriküler ekstrasistol 7 Seyrek: Angina pektoris, taşikardi Vasküler hastalıklarıSeyrek: Hipertansiyon Solunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Astım alevlenmesi, disfoni, boğaz tahrişi Seyrek: Dispne, öksürük Gastrointestinal hastalıklarıYaygın olmayan: Ağız kuruluğu Seyrek: Diyare, dispepsi Deri ve deri altı doku hastalıklarıYaygın olmayan: Döküntü Seyrek: Kaşıntı Kas-iskelet bozuklukları, bağdoku ve kemik hastalıklarıSeyrek: Kas spazmları Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıSeyrek: Periferik ödem, asteni Diğer inhalasyon tedavilerinde olduğu gibi, dozlamadan sonra hırıltılı solunum ve nefes yetmezliğinde hızlı bir artışla paradoksik bronkospazm gerçekleşebilir. Paradoksikbronkospazm hızlı etkili inhale bronkodilatörlere yanıt verir ve hemen tedavi edilmeli,FIXHALER kullanımı hemen bırakılmalı, hasta değerlendirilmeli ve gerekirse alternatif tedavibaşlatılmalıdır. FİXHALER'in flutikazon propiyonat ve formoterol fumarat içermesi nedeniyle, bu maddeler için raporlananlar ile aynı istenmeyen etki paterni gerçekleşebilir. Aşağıda belirtilenistenmeyen etkiler flutikazon propiyonat ve formoterol fumarat ile ilişkilendirilmiştir. Flutikazon propiyonat: Ürtiker, pruritus, anjiyoödem (temel olarak yüz ve orofaringeal), anafilaktik reaksiyonlar dahil hipersensitivite reaksiyonları. Özellikle uzun süreli olarakreçetelendirilen yüksek dozlarda inhale kortikosteroidlerin sistemik etkileri oluşabilir. BunlarCushing Sendromu, Cushingoid özellikler, adrenal baskılanması, çocuklarda ve ergenlerdebüyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt ve glokom, kontüzyon, ciltatrofisi ve enfeksiyonlara yatkınlığı içerebilir. Strese adapte olma yeteneği azalabilir. Ancak,inhale kortikosteroidlerle birlikte tanımlanan sistemik etkilerin oluşma olasılığı oralkortikosteroidlerden daha azdır. Yüksek dozda inhale kortikosteroidlerle uzun süreli tedaviklinik açıdan anlamlı adrenal baskılanması ve akut adrenal kriz ile sonuçlanabilir. Stresdurumlarında ek sistemik kortikosteroid tedavisi gerekli olabilir (travma, ameliyat, enfeksiyon). Formoterol fumarat: Hipersensitivite reaksiyonları (hipotansiyon, ürtiker, anjiyonörotik ödem, prurit, ekzantem), QT aralığının uzaması, hipokalemi, mide bulantısı, miyalji, kan laktatdüzeylerinde artış. Formoterol gibi beta agonistleriyle tedavi insulin, serbest yağ asidi, gliserolve keton cisimciklerinin kan düzeylerinde artış ile sonuçlanabilir. 8 FİXHALER'e karşı hipersensitivite reaksiyonu oluşması durumunda, herhangi bir hipersensitivite reaksiyonu için standart tedaviye uygun şekilde tedavi başlatılmalı, bu tedaviantihistamin ve gereken şekilde başka tedavilerin kullanımım içerebilir, FİXHALER'in hemenbırakılması gerekebilir ve alternatif bir astım tedavisi başlatılması gerekebilir. Disfoni ve kandidiyaz, ürünün kullanımının ardından gargara yapılarak veya ağız suyla çalkalanarak veya dişler fırçalanarak giderilebilir. Semptomatik kandidiyazis, FİXHALER iletedaviye devam edilirken topikal anti-fungal ile tedavi edilebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.trposta:[email protected];4.9 Doz aşımı ve tedavisiFİXHALER ile doz aşımına ilişkin veri bulunmamaktadır, ancak, her iki etken madde ile doz aşımına ilişkin veriler aşağıda verilmiştir: Formoterol fumarat:Formoterol doz aşımının beta agonistleri için tipik olan etkilerin şiddetlenmesine yol açması olasıdır; bu durumda angina, hipertansiyon veya hipotansiyon, çarpıntı, taşikardi, aritmi, QTuzaması, baş ağrısı, titreme, sinirlilik, kas krampları, ağız kuruluğu, insomnia, yorgunluk,halsizlik, nöbetler, metabolik asidoz, hipokalemi, hiperglisemi, mide bulantısı ve kusma gibibelirtiler gözlenebilir. Formoterol doz aşımı tedavisi ilacın bırakılması ile birlikte uygun semptomatik ve/veya destekleyici tedavilerin başlatılmasından oluşur. Bu ilaçların bronkospazm oluşturabileceği gözönünde tutularak, kardiyoselektif beta blokörlerinin makul ölçüde kullanımı düşünülebilir.Formoterol aşırı dozu durumunda diyalizin faydalı olup olmadığını belirlemek için yetersizkanıt bulunmaktadır. Kardiyak izleme önerilmektedir. FİXHALER tedavisinin ilacın beta agonisti bileşeninin doz aşımından ötürü bırakılması gerekiyorsa, uygun replasman steroid tedavisinin sağlanması düşünülmelidir. Hipokalemioluşabileceği için serum potasyum düzeyleri izlenmelidir. Potasyum replasmanıdüşünülmelidir. Flutikazon propiyonat:Flutikazon propiyonat ile akut doz aşımı genellikle klinik bir sorun oluşturmaz. Yüksek miktarda ilacın kısa sürede solunmasının ardından tek zararlı etki hipotalamik pitüiteradrenokortikal (HPA) aks fonksiyonunun baskılanmasıdır. HPA aks fonksiyonu, plazmakortizol ölçümleri ile doğrulanan şekilde, genellikle birkaç gün içerisinde geri kazanılır. İnhalekortikosteroid ile tedavi astımı kontrol etmek için önerilen dozda sürdürülmelidir. Seyrek akut adrenal kriz olgularına ait raporlar bulunmaktadır. Yüksek dozda flutikazon propiyonat kullanan 16 yaşın altındaki çocuklar ve ergenler (tipik olarak >1000mikrogram/gün) özel risk altında olabilir. Gösterilen semptomlar belirsiz olabilir (anoreksi,karın ağrısı, kilo kaybı, yorgunluk, baş ağrısı, mide bulantısı, kusma ve hipotansiyon). Tipikadrenal kriz semptomları bilinç kaybı, hipoglisemi ve/veya nöbetlerdir. 9 Çok yüksek dozların kronik kullanımının ardından, bir miktar adrenal korteks atrofisi ve HPA aks baskılanması oluşabilir. Adrenal rezerv izlenmesi gerekli olabilir. Olası sistemik etkilerCushing Sendromu, Cushingoid özellikler, adrenal baskılanması, çocuklarda ve ergenlerdebüyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt ve glokomu içerir. (bkz. bölüm4.4) Kronik doz aşımı tedavisinde, oral veya sistemik kortikosteroidler stres durumunda gerekli olabilir. Kronik doz aşımı olarak değerlendirilen tüm hastaların, steroid bağımlılığı varsa,sistemik bir kortikosteroidin uygun bir idame dozu ile tedavi edilmesi gerekir. Stabilizeedildiklerinde, tedavi semptom kontrolü için önerilen dozda inhale kortikosteroid ile devamettirilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grubu: Kortikosteroidler ya da diğer ilaçlarla kombine adrenerjikler -Antikolinerjikler hariç ATC Kodu: R03A K11 Etki mekanizmasıFIXHALER farklı etki mekanizmalarına sahip formoterol ve flutikazon propiyonat içerir. Formoterol belirtilere karşı korurken, flutikazon propiyonat akciğer fonksiyonlarını düzeltir vealevlenmeleri önler. FİXHALER eşzamanlı olarak beta-agonist ve inhale kortikosteroidtedavisi uygulanan hastalar için daha uygun bir rej im sunabilir. Her iki ilacın da etkimekanizmaları aşağıda verilmiştir: Flutikazon propiyonatFlutikazon propiyonat inhalasyon yoluyla tavsiye edilen dozlarda verildiğinde akciğerlerde güçlü bir glukokortikoid anti-enflamatuvar etki göstererek astım belirtilerini ve alevlenmelerini azaltır. Formoterol fumaratFormoterol güçlü, seçici bir beta2-adrenerjik uyarıcıdır. Geri dönüşlü soluk yolu tıkanmaları olan hastalarda bronkodilatör bir etki gösterir. Etkisi çabuk (1-3 dakika içinde) başlar veinhalasyondan 12 saat sonra hala belirgindir. Terapötik dozlarda kardiyovasküler etkileriönemsizdir ve ara sıra görülür. Formoterol, pasif olarak duyarlı hale getirilen insan akciğerlerinden lökotrienlerin ve histaminin salıverilmesini inhibe eder. Hayvanlarda yapılan deneylerde; ödemin ve iltihaphücrelerinin toplanmasının inhibisyonu gibi bazı antiinflamatuvar özellikler gözlenmiştir.Kobay trakeasındaki in vitro çalışmalar; rasemik formoterolün ve bunun (R,R)- ve (S,S)-enantiomerlerinin, ileri derecede selektif beta2-adrenoseptör agonistleri olduklarınıgöstermiştir. (R,R)-enantiomerden 800-1000 kat daha az potent olan (S,S)-enantiomeri, (R-R)-enantiomerin trakea düz kası üzerindeki aktivitesini etkilemez. Enantiomerlerden herhangibirinin rasemik karışıma tercih edilmesini gerektirecek herhangi bir farmakolojik neden yoktur.İnsanda inhale edilen alerjenlerin, egzersizin, soğuk hava, histamin veya metakolinin nedenolduğu bronkospazmı önlemede formoterolün etkili olduğu gösterilmiştir. 5.2 Farmakokinetik özellikler10 Hayvanlarda veya insanlarda inhalasyon yoluyla birlikte uygulanan formoterol ve flutikazon propiyonatın birbirlerinin farmakokinetiğini etkilediğine dair herhangi bir bulgu yoktur. Bu nedenle farmakokinetik açıdan her iki bileşen ayrı ayrı düşünülebilir. Flutikazon propiyonatEmilim:Astım ya da KOAH hastalarında flutikazon propiyonata sistemik maruziyetin daha az derecede olduğu görülmüştür. Sistemik absorpsiyon başlıca akciğerlerden gerçekleşir ve başlangıçta hızlıolup daha sonra yavaşlamaktadır. Kalan inhale doz yutulabilir, fakat yutulan kısım sudaki düşükçözünürlüğü ve %1'den daha az oral biyoyararlanımla sonuçlanan sistemik absorpsiyon öncesimetabolizmasından dolayı sistemik maruziyete çok az katkıda bulunmaktadır. İnhale dozunartırılmasıyla sistemik maruziyette doğrusal artış olur. Dağılım:Flutikazon propiyonat kararlı durumda geniş bir dağılım hacmine (yaklaşık 300 L) sahiptir. Plazma proteinlerine bağlanma oranı orta derecede yüksektir (%91). Biyotransformasyon:Flutikazon propiyonat başlıca sitokrom P450 enzimi olan CYP3A4 tarafından inaktif karboksilik asit metabolitine metabolize olarak sistemik dolaşımdan çok hızlı temizlenir.Flutikazon propiyonatın sistemik maruziyetinde artış potansiyeli olduğundan bilinen CYP3A4inhibitörleri birlikte uygulanırken dikkat edilmelidir. Eliminasyon:Flutikazon propiyonatın dispozisyonu yüksek plazma klerensi (1150 ml/dak) ve yaklaşık 8 saat olan terminal yarılanma ömrü ile karakterizedir. Flutikazon propiyonatın renal klerensi ihmaledilebilir düzeydedir (%0.2'den az) ve metabolit olarak %5'ten azdır. Formoterol fumaratFormoterolün terapötik doz aralığı günde iki kez 12-24 mikrogramdır. Formoterolün plazma farmakokinetiği verileri sağlıklı gönüllülerde önerilen doz aralığından daha yüksek dozlar veKOAH hastalarında terapötik dozların inhale edilmesi ile derlenmiştir. İdrarda saptanan vesistemik maruziyetin dolaylı bir göstergesi olarak kullanılan değişime uğramamış formoteroldüzeyleriyle, plazmadaki ilaç farmakokinetiği verileri arasında korelasyon vardır. İdrar veplazma için hesaplanan eliminasyon yarı ömürleri birbirine yakındır. Emilim:Sağlıklı gönüllülerde formoterol fumaratın 120 mikrogramlık tek bir doz inhalasyonunu takiben, formoterol hızla plazmaya geçerek inhalasyonu izleyen 5 dakika içerisinde, maksimumkonsantrasyon olan 266 pmol/l'ye ulaşmıştır. 12 hafta boyunca günde iki defa 12 veya 24mikrogram formoterol fumarat ile tedavi edilen KOAH hastalarında inhalasyondan 10 dakika,2 saat ve 6 saat sonraki ortalama plazma formoterol konsantrasyonları; sırasıyla 11.5-25.7 ve23.3-50.3 pmol/l arasında değişmiştir. Formoterolün ve/veya (R,R) ve (S,S) enantiomerlerinin kümülatif üriner itrahını araştıran çalışmalar, dolaşımdaki formoterol miktarının inhale edilen doz ile orantılı olarak arttığınıgöstermiştir (12-96 mikrogram). 11 12 hafta süreyle günde 2 defa 12 mikrogram veya 24 mikrogram inhalasyonundan sonra idrarlaatılan, değişikliğe uğramamış formoterol düzeyleri, astım hastalarında %63 ve %73 (ilk dozlason doz karşılaştırıldığında), KOAH hastalarında %19 ve %38 arasında değişen oranlardayükselmiştir. Bu veriler, tekrarlanan dozlarda kullanılan formoterolün plazmada sınırlı olarakbiriktiği izlenimini vermektedir. Tekrarlayan dozlardan sonra enantiomerlerden birinin,diğerinden daha fazla biriktiğine tanık olunmamıştır. İnhale edilen diğer ilaçlar için bildirildiği üzere inhaler aracılığıyla kullanılan formoterol dozunun çok büyük bölümü yutulmakta ve daha sonra gastrointestinal kanaldan emilmektedir.3 H ile işaretlenmiş 80 mikrogram formoterolün, iki gönüllüye oral olarak verilmesininardından dozun en az %65'i emilmiştir. Dağılım:Formoterolün plazma proteinlerine bağlanma oranı %61-64'tür. Bunun önemli bir kısmı (%34) insan serum albüminine bağlanır. Terapötik dozlar ile erişilen konsantrasyon aralığındabağlanma yerlerinde doyma olmaz. Biyotransformasyon:Formoterol başlıca metabolizma ile elimine edilir; doğrudan glukuronidasyon biyotransformasyonun ana yoludur. Glukuronidasyonun izlediği O-demetilasyon, diğer birbiyotransformasyon yoludur. Formoterolün sülfat konjügasyonu ve ardından yine sülfatkonjügasyonun gerçekleştiği deformilasyon, minör metabolik yollardır. Formoterolünglukuronidasyonunda (UGT1A1, 1A3, 16, 1A7, 1A8, 1A9, 1A10, 2B7 ve 2B15) ve O-demetilasyonunda (CYP2D6, 2C19, 2C9 ve 2A6) çok sayıda izoenzimin katalizör rolünüoynuyor olması; formoterol metabolizmasındaki spesifik bir izoenzimin inhibisyonu üzerindenilaç-ilaç etkileşim potansiyelinin düşük olduğu izlenimini vermektedir. Terapötik dozlarla eldeedilen konsantrasyonlardaki formoterol, sitokrom P450 izoenzimlerini inhibe etmemiştir veyaindüklememiştir.Eliminasyon:12 hafta boyunca günde 2 defa 12 veya 24 mikrogram formoterol fumaratla tedavi edilen astım ve KOAH hastalarında, verilen dozun sırasıyla yaklaşık %10'u ve %7'si değişikliğe uğramamışolarak idrarda saptanmıştır. İdrardaki, değişikliğe uğramamış formoterolün; 12-120 mikrogramarasında değişen tek dozların verildiği sağlıklı gönüllülerdeki ve tek ve tekrarlanan dozlarkullanan astım hastalarındaki %40'ının (R-R), %60'ının (S,S)-enantiomeri olduğu görülmüştür.İlaç ve metabolitleri vücuttan tamamen atılırlar; bir oral dozun yaklaşık 2/3'si idrarla ve 1/3'ifeçesle atılır. Kandaki formoterolün renal klerensi 150 ml/dakikadır. Sağlıklı gönüllülerde 120 mikrogram tek doz formoterol fumarat inhalasyonundan sonra, idrarla atılma oranlarından hesaplanan, plazmadaki eliminasyon yarı-ömrü, formoterolde 10saat; (R,R) ve (S,S)- enantiomerlerinde ise sırasıyla 13.9 ve 12.3 saat ölçülmüştür. 5.3 Klinik öncesi güvenlilik verileriKombinasyon halinde birlikte veya ayrı ayrı uygulanan formoterol fumarat ve flutikazon propiyonat ile gerçekleştirilmiş hayvan çalışmalarında gözlenen toksisite, temel olarak aşırıfarmakolojik aktivite ile ilişkilendirilmiş etkilerden oluşmuştur. Kardiyovasküler sistemüzerindeki etkiler formoterol uygulaması ile ilişkilidir ve hiperemi, taşikardi, aritmi ve miyokartlezyonlarını içermektedir. Kombinasyonun uygulanması ile toksisitede artış veya beklenmeyenbulguların gerçekleştiği gözlenmemiştir. Sıçanlar ve tavşanlar üzerinde formoterol-flutikazon kombinasyonuile gerçekleştirilen üreme toksisitesi çalışmaları fetüste büyüme geriliği, eksik ossifikasyon, embriyo letalitesi, yarık12 damak, ödem ve iskeletsel değişkenlikler dahil olmak üzere iki bileşenin bilinen embriyo-fetal etkilerini doğrulamıştır. Bu etkiler klinik maksimum önerilen doz kullanılarak öngörülendendaha düşük maruziyetlerde gözlenmiştir. Erkek sıçanlarda formoterole çok yüksek sistemikmaruziyette bir miktar fertilite azalması gözlenmiştir. Standart in vitro ve in vivo2agonisti dozlarına uzun süreli maruziyetin ardından bir sınır etkisi olarak gözlenmiştirve insanlarda potansiyel karsinojenisite riski göstermemektedir.HFA 227 ile klinik öncesi çalışmalar, tekrarlı-doz toksisitesi, genotoksisite, karsinojenisite ve üreme toksisitesi çalışmalarına dayanılarak insanlar için özel tehlike açığa çıkarmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSusuz laktoz (sığır sütü) Fine laktoz monohidrat (sığır sütü) 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler25°C' nin altındaki oda sıcaklığında saklanmalıdır. Kuru bir yerde saklanmalıdır. 6.5 Ambalajın niteliği ve içeriği60 kapsüllük Alüminyum-Alüminyum blister ve Monodoz inhalasyon cihazı içeren karton kutularda satılmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. FKHALER akciğerlere inhale edilen bir toz salıvermektedir. Monodoz inhaler inhalasyon cihazının kullanımı doktor ve eczacı tarafından hastaya gösterilmelidir. Kapsüllerin kesinlikle ağız içine alınarak yutulmaması ve kesinlikle inhaler içineyerleştirildikten sonra soluk alma yolu ile kullanılması gerektiği konusunda hastabilgilendirilmelidir. Jelatin kapsülün parçalanabileceği ve inhalasyondan sonra ağız ve boğazaküçük jelatin parçacıklarının ulaşabileceği hastaya anlatılmalıdır. Bu olasılık kapsülün birdenfazla delinmemesi ile en aza indirilir. 13 Monodoz inhaler cihazı, koruma kapağı çıkarılarak açılır ve kullanıma hazırlanır. Ağızlık ağıza yerleştirilir ve dudaklar etrafını saracak şekilde kapatılır. Bundan sonra doz inhaleedilebilir ve koruma kapağı tekrar kapatılabilir. Monodoz inhaler cihazının kullanım talimatları1- Monodoz inhaler cihazının kapağını çekerek çıkarın. 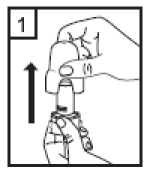 2- Bir elinizle Monodoz inhaler cihazının alt kısmını tutarak diğer elinizle ağızlık kısmınıok yönünde çevirerek açın. 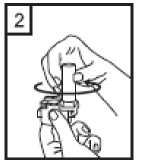 3- Bir kapsülü Monodoz inhaler cihazının içindeki boşluğa yerleştirin. Kapsülü ambalajından kullanmadan hemen önce çıkartın. 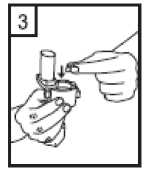 4- Ağızlık kısmını çevirerek kapatın. 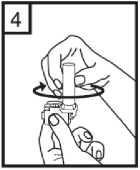 5- Monodoz inhaler cihazını dik tutun, kenardaki düğmelere sadece bir kez tam olarakbasın ve bırakın. Kapsül her iki ucundan delinecektir. Nefes almanız sırasında küçük jelatin kapsül parçaları ağzınıza gelebilir. Jelatin parçaları zararsızdır ve yutulduktan sonra sindirileceklerdir. Küçük jelatin parçalarının oluşma riskikapsülün blister ambalajından çıkarılır çıkarılmaz hemen kullanılması ve düğmelere sadecebir kez basılması ile azalır.14 6- Nefesinizi kuvvetlice dışarı verin. 7- Ağız parçasını ağzınıza yerleştirin ve başınızı hafifçe arkaya doğru eğin. Ağızlıketrafında dudaklarınızı sıkıca kapatın ve olabildiğince hızlı ve derin bir nefes alın. 8- Monodoz inhaler cihazını ağzınızdan çıkarın ve rahatsız olmadan olabildiğince uzunsüre nefesinizi tutun. Sonra normal şekilde soluk alıp verin. Monodoz inhaler cihazını tekraraçın ve kapsül içerisinde toz kalıp kalmadığına bakın. Kapsül içerisinde toz kalmış ise 6,7 ve8 numaralı basamakları tekrar edin. 9- Sonrasında, ağzınızı su ile çalkalayınız ve tükürünüz. 10- Kullanımdan sonra, boş kapsülü atın ve ağızlık kısmını kapatın. UNUTMAYINIZ!Monodoz inhaler cihazınızı kuru tutunuz. Kullanılmadığı zaman kapalı tutunuz. Monodoz inhaler cihazının içine asla nefes vermeyiniz. Hareket kolunu sadece ilacı almaya hazır olduğunuzda itiniz. Söylenen dozdan daha fazla almayınız. 7. RUHSAT SAHİBİAbdi İbrahim İlaç San. ve Tic. A.Ş. Reşitpaşa Mahallesi Eski Büyükdere Cad. No:4 34467 Maslak / Sarıyer / İstanbulTel: 0212 366 84 00Faks: 0212 276 20 20 15 8. RUHSAT NUMARASI2019/469. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 24.01.2019 10. KÜB'ÜN YENİLENME TARİHİ
16 |
İlaç BilgileriFixhaler 12 Mcg/250 Mcg İnhalasyon Tozu, Sert KapsülEtken Maddesi: Formoterol Fumarat Dihidrat, Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.