Esmobloc 10 Mg/ml I.v. İnfüzyon İçin Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIESMOBLOC 10 mg/ml I.V. infüzyon için çözelti Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin Madde:Esmolol hidroklorür: 10 mg/mL (Her bir 250 mL'lik torba 2500 mg esmolol hidroklorür içerir). Yardımcı maddeler:100 ml'de; Sodyum klorür 0,59 g Sodyum asetat trihidrat 0,28 g Bu tıbbi ürün her bir torbasında yaklaşık 30,45 mmol (ya da 700 mg) sodyum içerir. Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnfüzyon için çözelti. Berrak, renksiz ila açık sarı renkte çözelti. Çözeltinin pH'sı 4,5 - 5,5 arası ve ozmolaritesi yaklaşık 312 mOsm/l'dir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarSupraventriküler taşikardi veya kompanse olmamış sinüs taşikardisiESMOBLOC perioperatif, postoperatif ya da kısa sürede etkili bir preparatla ventrikül hızının hızlı kontrolünün istendiği diğer acil girişim gereken durumlarda ortaya çıkan atriyalfibrilasyon ya da atriyal flutter durumlarında endikedir. ESMOBLOC ayrıca hekim tarafından hızlanmış kalp hızının özel bir girişimle düzeltilmesi kararı verilmişse kompanse olmamış sinüs taşikardisi durumunda da endikedir. ESMOBLOC kısa süreli kullanıma yöneliktir. İntraoperatif ve postoperatif taşikardi ve/veya hipertansiyonESMOBLOC endotrakeal entübasyon, anestezi indüksiyonu, cerrahi prosedür devam ederken, anesteziden çıkarken ve postoperatif dönemde görülen taşikardi ve hipertansiyonda hekimtarafından böyle özel bir girişimle düzeltilmesi kararı verilmişse endikedir. ESMOBLOC'un, böyle durumların oluşmasını engellemek amacıyla kullanımı önerilmemektedir. 1/17 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresiSupraventriküler taşikardi veya kompanse olmamış sinüs taşikardisinin tedavisinde dozlamaESMOBLOC devamlı intravenöz infüzyonla yükleme dozu ile birlikte veya yükleme dozu olmaksızın uygulanır. İstenilen ventriküler yanıta göre ilave yükleme dozları ve/veya idameinfüzyonun (basamaklı dozlama) titrasyonu gerekli olabilir.
Yükleme dozu uygulanmadığı durumlarda sabit konsantrasyonda uygulanan esmololün farmakokinetik ve farmakodinamik açıdan sabitlenmiş konsantrasyonlarına yaklaşık 30dakikada ulaşılmaktadır. Etkili idame dozu, devamlı ve basamaklı dozlama için 25 mikrogram/kg/dk kadar düşük dozların yeterli olmasına karşın 50 ila 200 mikrogram/kg/dk'dır. 200 mikrogram/kg/dk'danyüksek dozlar, etkisini azaltarak kalp atış hızında küçük bir artışa sebep olmakta ve adversreaksiyonların oranını arttırmaktadır. İdame infüzyon 48 saate kadar devam ettirilebilir. İntraoperatif ve postoperatif taşikardi ve/veya hipertansiyonBu kullanımda terapötik etki için yavaşça titre edilmesi her zaman önerilmez. Bu yüzden iki dozlama seçeneği sunulmaktadır: hemen kontrol ve basamaklı kontrol. 1. Hemen kontrol sağlamak için doz önerisi Bolus doz olarak 30 saniye içerisinde 1 mg/kg ardından gerekliyse 150mikrogram/kg/dk infüzyonla uygulanır. İstenilen kalp atış hızı ve kan basıncını idame ettirmek için infüzyon hızı gerektiğişekilde ayarlanır. Aşağıdaki Maksimum Önerilen Dozlar kısmına bakınız. 2. Basamaklı titrasyon için doz önerisi Bolus doz olarak 1 dakika içerisinde 500 mikrogram/kg ardından 4 dakika içinde 50mikrogram/kg/dk idame infüzyonla uygulanır. Elde edilen yanıta bağlı olarak, supraventriküler taşikardi için belirlenen dozlamayadevam edilir. Aşağıdaki Maksimum Önerilen Dozlar kısmına bakınız. 2/17 Maksimum önerilen dozlar Taşikardinin tedavisi için 200 mikrogram/kg/dk'dan yüksek idame dozlarıönerilmemektedir. 200 mikrogram/kg/dk'dan yüksek dozlar, etkisini azaltarak kalp atışhızında küçük bir artışa sebep olmakta ve advers reaksiyonların oranını arttırmaktadır. Hipertansiyon tedavisi için daha yüksek idame infüzyon dozları (250-300mikrogram/kg/dk) gerekebilir. 300 mikrogram/kg/dk'nın üzerindeki dozlarıngüvenilirliği çalışılmamıştır. ESMOBLOC tedavisinden alternatif ilaçlara geçişHastalarda kalp hızında yeterli kontrol ve stabil bir klinik tablo sağlandıktan sonra alternatif antiaritmik ilaçlara geçiş yapılabilir. ESMOBLOC tedavisinden alternatif ilaçlara geçileceği zaman hekim seçilen alternatif ilacın kullanma talimatlarını dikkatli şekilde incelemeli ve ESMOBLOC dozunu aşağıdaki şekildeazaltmalıdır: Alternatif ilacın ilk dozundan sonraki 30 dakika içerisinde ESMOBLOC infüzyon hızıyarıya (%50) düşürülür. Alternatif ilacın ikinci dozunun uygulanmasından sonra hastanın yanıtı izlenir ve ilksaatte yeterli kontrol sağlanırsa ESMOBLOC infüzyonu kesilir. Uygulama şekli:ESMOBLOC kullanıma hazır bir çözelti olduğundan, seyreltilmeden intravenöz yoldan kullanılır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda ESMOBLOC asit metaboliti böbrekler tarafından değişmemiş formda atıldığından infüzyonla ESMOBLOC uygulandığında dikkatli olunmasıgerekir. Asit metabolitin atılımı son evre böbrek hastalığı olan kişilerde anlamlı şekildeazalmakta olup eliminasyon yarı ömrü normalin yaklaşık on katına artmış ve plazmadüzeyleri ciddi şekilde yükselmiştir. Karaciğer yetmezliği:Kırmızı kan hücrelerindeki esterazlar ESMOBLOC metabolizmasında temel bir rol oynadığından karaciğer yetmezliği durumunda özel önlemler gerekli değildir. Pediyatrik popülasyon:ESMOBLOC'un 18 yaş altı çocuklarda kullanımdaki etkinliği ya da güvenliliği henüz kanıtlanmamıştır. Mevcut veriler bölüm 5.1 ve 5.2'de tanımlanmaktadır ancak bu verilerdenpozoloji hakkında bir öneri sunulamaz. Geriyatrik popülasyon:Yaşlılarda tedaviye düşük dozdan başlanarak, uygulama dikkatle yapılmalıdır. 3/17 Yaşlılarda özel çalışmalar yürütülmemi ştir. Ancak 65 yaş üzeri 252 hastadan elde edilmiş verilerin analizi, oluşan farmakodinamik etkiler açısından 65 yaş altındakilerle herhangi birfarklılık olmadığını göstermektedir. 4.3. Kontrendikasyonlar Etkin maddeye, yardımcı maddelerden herhangi birine, diğer maddelere veya diğer betablokörlere (beta blokörler arası çapraz duyarlılık mümkündür) aşırı duyarlılık durumu, Ağır sinüs bradikardisi (dakikada 50 vurumdan az), Hasta sinüs sendromu; ağır AV düğümü ileti bozuklukları (pacemaker olmayan); ikinciveya üçüncü dereceden kalp blokları, Kardiyojenik şok, Ciddi hipotansiyon, Dekompanse kalp yetmezliği, Eşzamanlı ya da yakın zamanda intravenöz yoldan verapamil kullanımı. ESMOBLOC,verapamil kesilmesinden sonraki 48 saat içinde uygulanmamalıdır (bölüm 4.4'e bakınız), Tedavi edilmemiş feokromositoma, Pulmoner hipertansiyon, Akut astım atağı, Metabolik asidoz. 4.4. Özel kullanım uyarıları ve önlemleriESMOBLOC tedavisi gören tüm hastalarda kan basıncı ve EKG'nin sürekli olarak izlenmesi önerilmektedir. Hastada hemodinamik bozukluk bulunduğunda veya hasta aşağıda parametrelerin birini veya tümünü azaltan diğer ilaçları kullanıyorsa, supraventriküler aritmili hastalarda ventrikülyanıtının kontrolü için ESMOBLOC kullanımı sırasında dikkatli olunmalıdır: Periferik direnç,miyokardiyal dolum, miyokardiyal kontraktilite veya miyokardiyumda elektriksel impulspropagasyonu. ESMOBLOC etkilerinin hızlı başlaması ve sonlanmasına karşın bilinç kaybı,kardiyojenik şok, kardiyak arrest gibi şiddetli reaksiyonlar gelişebilir. Esmolol hidroklorürün ventrikül hızını kontrol etmek için kullanıldığının varsayıldığı kompleks klinik koşullarda birkaç ölüm vakası bildirilmiştir. En sık görülen yan etki dozla ilişkili olan, ancak her dozda da görülebilen hipotansiyondur. Hipotansiyon şiddetli olabilmektedir. Bir hipotansif epizod yaşanması durumunda infüzyonhızı düşürülmeli veya gerekirse infüzyon kesilmelidir. Hipotansiyon genellikle geriyedönüşebilir niteliktedir (ESMOBLOC uygulamasına son verildikten sonraki 30 dakikaiçinde). Bazı vakalarda kan basıncını normal değerlerine yükseltebilmek için ek girişimleregerek duyulabilir. Sistolik kan basıncı düşük hastalarda dozun ayarlanması ve idameinfüzyonu sırasında özel dikkat gerekir. 4/17 Esmolol hidroklorür kullanımı sırasında ağır bradikardi dahil bradikardi ve kardiyak arrest meydana gelmiştir. ESMOBLOC, tedavi öncesinde kalp hızı düşük olanlarda özel bir dikkatleve ancak olası yararları, riskine ağır basıyorsa kullanılmalıdır. Önceden ağır sinüs bradikardisi olan hastalarda ESMOBLOC kullanımı kontrendikedir (bölüm 4.3'e bakınız). Nabzın istirahatteyken dakikada 50-55 vurunun altına düştüğü vehastada bradikardiye ilişkin semptomlar görülürse dozaj azaltılmalı ya da uygulamaya sonverilmelidir. Konjestif kalp yetmezliğinde dolaşım fonksiyonunun desteklenmesi için sempatik aktivite gereklidir. Beta blokajının miyokard depresyonunu arttırarak yetmezliği daha da ağırlaştırmariski bulunmaktadır. Belirli bir süreden uzun sürelerle beta blokörlerle miyokarddepresyonunun devam ettirilmesi, bazı vakalarda kalp yetmezliğine yol açabilir. Kardiyak fonksiyonları bozulmuş hastalarda ESMOBLOC kullanılırken dikkatli olunması gerekir. Kalp yetmezliğinin ilk belirti ve semptomları görülür görülmez ESMOBLOCtedavisine son verilmelidir. Her ne kadar eliminasyon yarı ömrünün kısa olması nedeniyle,ESMOBLOC'un kesilmesi yeterli olsa da ayrıca spesifik tedavi uygulanması da düşünülebilir(bölüm 4.9'a bakınız). ESMOBLOC dekompanse kalp yetmezliği olan hastalardakontrendikedir (bölüm 4.3'e bakınız). Kalpteki ileti süresi üzerindeki negatif etkileri nedeniyle beta blokör ilaçlar birinci derece kalp bloğu veya diğer kalp ileti bozukluğu olan hastalarda ancak dikkatle verilmelidir (bölüm 4.3'ebakınız). ESMOBLOC feokromositomalı hastalarda ancak alfa-reseptör blokörleriyle ön tedavi görmüş olmak kaydıyla ve dikkatle kullanılmalıdır (bölüm 4.3'e bakınız). Hipotermiyle uyarılmış hipertansiyonun tedavisinde ESMOBLOC kullanımında dikkatli olunması gerekir. Genel olarak bronkospastik hastalıkları olanlar beta blokör kullanmamalıdır. Beta-1 reseptörlere nispeten selektif olması ve kullanım sırasında titre edilebilir olması nedeniyleESMOBLOC bu hastalarda dikkatle kullanılabilir. Ancak beta-1 selektifliği mutlakolmadığından ESMOBLOC, olası etkili en düşük dozu elde etmek için dikkatle titreedilmelidir. Bronkospazm durumunda infüzyon derhal durdurulmalı ve gerektiğinde beta-2agonist bir preparat uygulanmalıdır. Hasta zaten bir beta-2-reseptör stimülan ajan kullanıyorsa, bu ajanın dozunun yeniden değerlendirilmesi gerekebilir. ESMOBLOC hırıltılı solunum ya da astım hikayesi olan hastalarda dikkatli kullanılmalıdır. 5/17 ESMOBLOC diyabetik hastalarda ya da edinsel hipoglisemisi olduğundan kuşkulanılanlarda dikkatli uygulanmalıdır. Beta blokörler hipogliseminin taşikardi gibi prodromalsemptomlarını maskeleyebilir. Ancak sersemlik hali ve terleme etkilenmeyebilir. Betablokörlerle antidiyabetik ajanların eşzamanlı kullanımı antidiyabetik ajanların hipoglisemiketkisinde artışa yol açabilir (bölüm 4.5'e bakınız). Esmolol hidroklorür kullanımına bağlı olarak infüzyon bölgesinde reaksiyonlar meydana gelmiştir. Bu reaksiyonlar arasında iritasyon ve enflamasyon bulunabildiği gibi özellikleekstravazasyon ile ilişkili trombofilebit, nekroz ve deride blisterlenme gibi daha ciddireaksiyonlar da bulunur (bölüm 4.8'e bakınız). Küçük venlerden veya kelebek kateterleyapılacak uygulamalardan kaçınılmalıdır. Lokal bir infüzyon yeri reaksiyonu oluştuğunda,alternatif bir infüzyon bölgesi kullanılmalıdır. Beta blokörler, karşılanmamış alfa-reseptör kökenli koroner arter vazokonstriksiyonuna bağlı olarak Prinzmetal anjinası olan hastalarda anjina ataklarının sıklık ve süresini arttırabilir. Butür hastalarda selektif olmayan beta blokörler kullanılmamalı; beta-1 selektif olan blokörlerise yalnızca son derece dikkatli şekilde kullanılmalıdır. ESMOBLOC hipovolemik hastalarda refleks taşikardiyi zayıflatabilir ve dolaşım kollapsı riskini arttırabilir. Bu nedenle bu tür hastalarda ESMOBLOC dikkatli kullanılmalıdır. Beta blokörler periferik dolaşım bozukluklarının (Raynaud hastalığı veya sendromu, intermittan kladikasyon) bulunduğu hastalarda son derece dikkatli uygulanmalıdır. ESMOBLOC dahil, özellikle intravenöz olarak uygulanan bazı beta blokörler, serum potasyum düzeylerinde yükselme ve hiperkalemi ile ilişkilendirilmiştir. Bu risk böbrekyetmezliği ve hemodiyaliz tedavisi görme gibi risk faktörlerinin bulunduğu hastalarda artar. Beta blokörler hem alerjenlere duyarlılığı, hem de anafilaktik reaksiyonların şiddetini arttırır. Beta blokör kullanan hastalar anafilaktik ya da anafilaktoid reaksiyonların tedavisindekullanılan olağan dozlarda epinefrine yanıt vermeyebilir (bölüm 4.5'e bakınız). Beta blokörlerin psöriyazis ya da psöriyazis benzeri döküntülere yol açabileceği ve mevcut bir psöriyazis hastalığını ağırlaştırabileceği bildirilmiştir. Özgeçmiş ya da soygeçmişindepsöriyazis bulunanlarda beta blokörler ancak tedaviden beklenen fayda ile olası riskleridikkatle değerlendirildikten sonra kullanılmalıdır. Propranolol ve metoprolol gibi beta blokörler hipertiroidinin belirli klinik işaretlerini (taşikardi gibi) maskeleyebilir. Tirotoksikoz gelişim riski ya da kuşkusu olan hastalarda betablokörlerle devam etmekte olan tedavinin aniden kesilmesi tiroid krizini hızlandırabilir ve butür hastalar yakından izlenmelidir. Bu ürün 250 ml'lik bir torbasında 30,45 mmol sodyum içerir. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 6/17 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriESMOBLOC diğer antihipertansif ajanlar veya bradikardiye neden olabilen diğer ilaçlarla birlikte kullanıldığında daima dikkatli olunmalıdır:ESMOBLOC'un etkileri veya hipotansiyon veya bradikardi yan etkileri şiddetlenebilir. Verapamil gibi kalsiyum antagonistleri ve daha düşük düzeyde diltiazem kontraktilitede ve AV iletiminde negatif bir etkiye sahiptir. Bu kombinasyon iletim anomalileri olan hastalarauygulanmamalı ve ESMOBLOC verapamil kesildikten sonraki 48 saatte verilmemelidir (bkzbölüm 4.3). Dihidropiridin türevi (örn. nifedipin) kalsiyum antagonistleri hipotansiyon riskini arttırabilir. Kalp yetmezliği için kalsiyum antagonisti ile tedavi gören hastalara beta blokör uygulanmasıkalp yetmezliğine neden olabilir. ESMOBLOC'un dikkatle titre edilerek uygun hemodinamikmonitorizasyon önerilir. ESMOBLOC ve Sınıf I anti-aritmik ilaçların (örn; dizopiramid, kinidin) ve amiodaronun eşzamanlı kullanımı atriyal-iletim süresinde güçlendirici etkiye sahip olabilir ve negatifinotropik etkiye neden olabilir. ESMOBLOC ve insülin veya oral anti-diyabetik ilaçların eşzamanlı kullanımı kan şekeri düşürücü etkiyi artırabilir (özellikle selektif olmayan beta-blokörler). Beta- adrenerjik blokajıhipoglisemi belirtilerinin (taşikardi) gözlenmesini engelleyebilir ancak baş dönmesi /sersemlik ve terleme gibi diğer belirtiler maskelenmeyebilir. Anestezi ilaçları: Hastaların hacim durumunun belirsiz olduğu veya eşzamanlı antihipertansif ilaçların kullanıldığı durumlarda refleks taşikardide azalma veya hipotansiyon riskinde artışgörülebilir. Beta-blokaja devam edilmesi indüksiyon ve entübasyon sırasında aritmi riskiniazaltır. Hastaya ESMOBLOC'a ek olarak bir beta-blokör ajan verilirken anestezistbilgilendirilmelidir. İnhalasyon anestezi ajanlarının hipotansif etkileri ESMOBLOCvarlığında artabilir. Her bir ajanın dozu istenen hemodinamik parametrelerin korunması içindeğiştirilebilir. ESMOBLOC ile gangliyon bloke edici ilaçların kombinasyonu hipotansif etkiyi arttırabilir. Steroid olmayan anti-enflamatuvar ilaçlar (NSAİİ) ile birlikte kullanıldıklarında beta blokörlerin hipotansif etkileri azalır. Beta-blokörlerle eşzamanlı olarak floktafenin veya amisulprid kullanılırken özellikle dikkatli olunmalıdır. Trisiklik antidepresanların (imipramin ve amitriptilin gibi), barbitüratların ya da fenotiyazinler (klorpromazin gibi) yanında diğer antipsikotik ajanların (klozapin gibi) birlikteuygulanımı kan basıncını azaltıcı etkiyi arttırabilir. Beklenmeyen bir hipotansif durumdankaçınmak için birlikte kullanımda ESMOBLOC dozu azaltılmalıdır. 7/17 Beta-blokörler kullanılırken anafilaktik reaksiyon riski olan hastalarda alerjen maruziyetine (kazara, diagnostik veya terapötik) reaksiyon gözlenebilir. Beta blokör kullanan hastalar,anafilaktik reaksiyonların tedavisinde kullanılan mutad epinefrin dozlarına yanıt vermeyebilir(bkz bölüm 4.4). ESMOBLOC'un etkileri eşzamanlı uygulandığında beta-adrenerjik agonist aktiviteye sahip sempatomimetik ilaçlara bağlı olarak azalabilir. Her bir ajanın dozunun hasta yanıtına göreayarlanması veya alternatif terapötik ajanların kullanımının düşünülmesi gerekebilir. Katekolamin boşalmasına yol açan ilaçlar (örn; rezerpin) beta-blokör ilaçlarla birlikte verildiğinde aditif bir etki gösterebilirler. ESMOBLOC ile eşzamanlı olarak katekolaminboşalmasına yol açan ilaç tedavisi alan hastalar vertigo, senkop veya postüral hipotansiyon ilesonuçlanabilen hipotansiyon ve önemli bradikardi belirtileri açısından yakından izlenmelidir. Beta blokörlerin, moksonidin veya alfa-2-agonistleriyle (klonidin gibi) bir arada kullanımı çekilmeye bağlı rebound hipertansiyon riskini arttırır. Klonidin veya moksonidin bir betablokörle birlikte kullanılacaksa ve daha sonra her iki ilaç da kesilecekse, ilk olarak betablokör, klonidin veya moksonidin birkaç gün sonra kesilmelidir. Beta blokörlerin ergo türevleriyle birarada kullanımı ciddi periferik vazokonstrüksiyon ve hipertansiyonla sonuçlanabilir. Esmolol hidroklorür ile varfarin arasındaki bir etkileşim olup olmadığını belirlemek için yapılan bir çalışmadaki veriler, esmolol hidroklorür ve varfarinin birlikte uygulanmasının,varfarinin plazma düzeylerini değiştirmediğini göstermiştir. Buna rağmen varfarin ile birlikteuygulanan esmolol hidroklorürün konsantrasyonları daha yüksek olarak bulunmuştur. Esmolol hidroklorür ve digoksin sağlıklı gönüllülerde intravenöz yoldan birlikte uygulandığında, bazı zaman noktalarında digoksinin kandaki düzeylerinde %10-20'lik biryükselme olduğu bildirilmiştir. Dijital glikozitleriyle esmolol hidroklorür kombinasyonu AVileti süresini uzatabilir. Digoksin, esmolol hidroklorürün farmakokinetik özelliklerinietkilememiştir. İntravenöz morfin ve esmolol hidroklorür sağlıklı gönüllülere eşzamanlı olarak uygulandığında morfinin kan düzeylerinde herhangi bir değişiklik olmadığı görülmüştür.Morfin varlığında esmolol hidroklorürün kararlı durum kan düzeylerinin %46 oranında arttığıancak diğer farmakokinetik parametrelerden hiçbirinin değişmediği saptanmıştır. Esmolol hidroklorürün suksametonyum klorür ve mivakuryum ile uyarılan nöromüsküler blokajın süresi üzerine etkisi cerrahi girişimde bulunulan hastalarda incelenmiştir. Esmololhidroklorür, suksametonyum klorür ile indüklenen nöromüsküler blokajın başlamasınıetkilememektedir, ancak nöromüsküler blokajın süresi 5 dakikadan 8 dakikaya çıkmıştır.Esmolol hidroklorür, mivakuryumun klinik süresini (%18,6) ve geri kazanım indeksini (%6,7)kısmen uzatmıştır. 8/17 Varfarin, digoksin, morfin, suksametonyum klorür veya mivakuryum ile yapılan çalışmalarda gözlenen etkileşimler klinik açıdan çok önemli olmamakla birlikte ESMOBLOC eşzamanlıolarak varfarin, digoksin, morfin, suksametonyum klorür veya mivakuryum uygulananhastalarda titrasyon dikkatli yapılmalıdır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C / D (2. ve 3. trimester) Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlar tedavi süresince etkili doğum kontrolü uygulamak zorundadırlar. Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. Hayvanlarüzerinde esmolol hidroklorürle yapılan çalışmalarda üreme toksisitesi görülmüştür (bkz.Kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. gebelik döneminde önerilmez.Farmakolojik etkileri nedeniyle gebeliğin geç döneminde fetus ve yenidoğan üzerindeki yan etkileri (özellikle hipoglisemi, hipotansiyon ve bradikardi) dikkate alınmalıdır. Gebelikte ESMOBLOC tedavisi gerekli olursa, ancak potansiyel yararı, fetus üzerindeki toksisiteden fazla ise kullanılmalıdır ve uteroplasental kan akımı ve fötal büyümeizlenmelidir. Yenidoğan bebeğin yakından izlenmesi gerekir. Laktasyon dönemiEsmolol hidroklorür emzirme döneminde kullanılmamalıdır. Emziren kadınlarda esmolol hidroklorürün anne sütüne geçip geçmediği bilinmemektedir. Yenidoğan bebeklere/bebeklere potansiyel bir risk gözardı edilemez. Üreme yeteneği / FertiliteEsmololün insanlarda üreme yeteneği / fertilite üzerindeki etkisini araştıran bir çalışma bulunmamaktadır. 4.7. Araç ve makine kullanımı üzerine etkilerAraç ve makine kullanımı sırasında ESMOBLOC'un kullanımı mümkün olmadığından bu konudaki etkisi bilinmemektedir. 4.8. İstenmeyen etkiler9/17 İstenmeyen etkilerin görülmesi durumunda ESMOBLOC'un dozu azaltılabilir ya da uygulamaya son verilebilir. Görülen advers etkilerin çoğu hafif ve geçici nitelikte olarak bildirilmiştir. En önemlisi hipotansiyondur. Advers etkilerin görülme sıklığı, aşağıdaki kriterler kullanılarak değerlendirilmiştir: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek(>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Metabolizma ve beslenme hastalıklarıYaygın: Anoreksi. Bilinmiyor: Hiperkalemi, metabolik asidoz. Psikiyatrik hastalıklarYaygın: Depresyon, anksiyete Yaygın olmayan: Anormal düşünce Sinir sistemi hastalıklarıYaygın: Baş dönmesi / sersemlik hali1, uykuya meyil, başağrısı, parestezi, dikkat bozukluğu, konfüzyonel durum, ajitasyon. Yaygın olmayan: Senkop, konvülsiyon, konuşma bozukluğu. Göz hastalıklarıYaygın olmayan: Görmede bozulma. Kardiyak hastalıklarYaygın olmayan: Bradikardi, atriyoventriküler blok, pulmoner arteriyel basınçta yükselme, kalp yetmezliği, ventriküler ekstrasistoller, nodal ritim, anjina pektoris. Çok seyrek: Sinüs durması, asistol. Bilinmiyor: Akselere idiyoventrikülerritim, koronerarteriyospazm, kardiyak arest. Vasküler hastalıklarÇok yaygın: Hipotansiyon. Yaygın olmayan: Periferik iskemi,solukluk, yüzve boyunbölgesinde kızarma. Çok seyrek: Trombofilebit2 Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Dispne, pulmoner ödem, bronkospazm, hırıltılı solunum, nazal konjesyon, akciğer seslerinde ronkus ve raller. Gastrointestinal hastalıklar10/17 Yaygın: Bulantı, kusma. Yaygın olmayan: Disguzi, dispepsi, kabızlık, ağızda kuruma, karında ağrı. Deri ve deri altı doku hastalıklarıÇok yaygın: Diaforez.1 Yaygın olmayan: Ciltte renk kaybı2, eritem.2
2
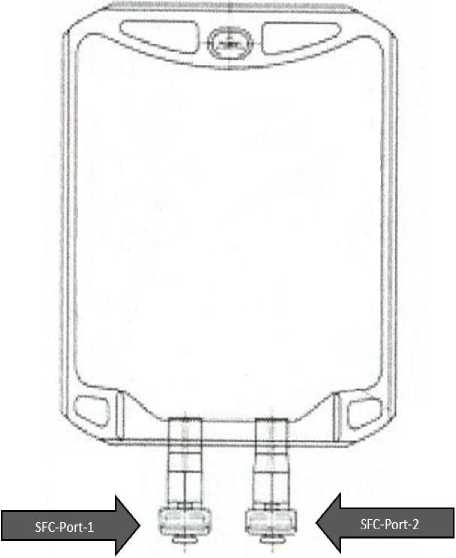
Çok seyrek: Deri nekrozu (ekstravazasyona bağlı). Bilinmiyor: Psoriyazis3, anjiyoödem, ürtiker. Kas-iskelet bozuklukları, bağ doku ve iskelet hastalıklarıYaygın olmayan: Kas-iskelet ağrısı.4 Böbrek ve idrar yolu hastalıklarıYaygın olmayan: Üriner retansiyon Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:Yaygın: Asteni, halsizlik, enjeksiyon yeri reaksiyonu, infüzyon bölgesi reaksiyonu, infüzyon bölgesi inflamasyonu, infüzyon bölgesi endürasyonu. Yaygın olmayan: Titremeler, ateş yükselmesi, ödem2, ağrı2, infüzyon bölgesinde yanma, infüzyon bölgesinde ekimoz. Bilinmiyor: İnfüzyon bölgesinde filebit, infüzyon bölgesinde veziküller, infüzyon bölgesinde blisterlenme.2 1. Baş dönmesi/sersemlik hali ve diyaforez semptomatik hipotansiyonla birlikte görülmüştür. 2. Enjeksiyon ve infüzyon bölgesi reaksiyonlarıyla ilişkili reaksiyonlardır. 3. Beta blokörler sınıf reaksiyonu olarak bazı durumlarda psoriyazise ya da psoriyazistekötüleşmeye neden olabilir. 4. Midskapular ağrı ve kostokondrit dahil. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)' ne bildirmeleri gerekmektedir. ([email protected]. Doz aşımı ve tedavisiKonsantre esmolol hidroklorür solüsyonları ile kazara büyük doz aşımı vakaları meydana gelmiştir. Bu doz aşımlarının bazıları ölüme yol açarken, diğerleri kalıcı işlev kaybına nedenolmuştur. Preparatın 625 mg - 2,5 g arasındaki bolus dozları (12,5 - 50 mg/kg) ölümlesonuçlanmıştır. 11/17 Doz aşımının semptomlarıDoz aşımı durumunda aşağıdaki belirtiler oluşabilir: Şiddetli hipotansiyon, sinüs bradikardisi, atriyoventriküler blok, kalp yetmezliği, kardiyojenik şok, kardiyak arrest, bronkospazm,solunum yetmezliği, komaya ilerleyebilen bilinç kaybı, havaleler, bulantı, kusma, hipoglisemive hiperkalemi. Doz aşımında tedaviKısa eliminasyon yarı ömrü nedeniyle (yaklaşık 9 dakika) toksisite tedavisinde ilk basamak ESMOBLOC infüzyonunun durdurulmasıdır. Doz aşımı sonrasında semptomların kaybolmasıiçin gereken süre uygulanan ESMOBLOC miktarına bağlı olacaktır. Bu süre ESMOBLOC'unterapötik doz düzeyinde ilaç kesildikten sonra 30 dakikadan uzun sürebilir. Suni solunumgerekebilir. Daha sonra gözlenen klinik etkilere göre aşağıdaki tedaviler uygulanabilir: Bradikardi:Atropin ya da diğer bir antikolinerjik ilaç intravenöz yoldan uygulanır. Bradikardinin yeterince tedavi edilemediği durumlarda pacemaker gerekli olabilir. Bronkospazm:Nebülize beta-2-sempatomimetikler uygulanmalıdır. Bu yeterliolmazsa beta-2-sempatomimetikler ya da aminofilinin intravenöz yoldan uygulanmasıdüşünülmelidir. Semptomatik hipotansiyon:İntravenöz yoldan sıvılar ve/veya pressör ajanlarverilmelidir. Kardiyovasküler depresyon veya kardiyak şok:Diüretik veya sempatomimetikleruygulanabilir. Uygulanacak sempatomimetiklerin (semptoma göre dobutamin,dopamin, noradrenalin, isoprenalin) dozu terapötik etkiye bağlıdır.Daha ileri tedavi gerektiğinde, klinik duruma ve tedaviyi yürüten hekimin kararına göre aşağıdaki ilaçlar intravenöz yoldan verilebilir. - Atropin, - İnotropik ajanlar, - Kalsiyum iyonları. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup:ATC kodu:C07AB09Esmolol hidroklorür bir beta selektif (kardiyoselektif) adrenerjik reseptör blokaj ajanıdır. Terapötik dozlarda anlamlı bir intrensek sempatomimetik aktivite (ISA) ya da membranstabilizan etkinliği yoktur. ESMOBLOC'un etkin maddesi olan esmolol hidroklorür kimyasal olarak beta blokörlerin fenoksi propanolamin sınıfındandır. Farmakolojik özelliklerine bağlı olarak esmolol hidroklorürün etkisi hızla başlar ve dozunun hızlıca ayarlanabilmesine olanak verecek şekilde kısa sürer. 12/17 Uygun yükleme dozu kullanıldığında, kandaki kararlı durum düzeylerine 5 dakikada ulaşılır. Ancak terapötik etkiye stabil plazma konsantrasyonundan daha kısa sürede erişilir. Dahasonra istenen farmakolojik etkinin elde edilmesi için infüzyon oranı ayarlanabilir. Esmolol hidroklorür beta blokörlerin bilinen hemodinamik ve elektrofizyolojik etkilerine sahiptir: İstirahat halinde ve egzersiz sırasında kalp hızında azalma; İzoprenalin azalması sonucunda kalp hızında artış; Sinoatriyal (SA) düğümün recovery süresinde uzama; Atriyoventriküler (AV) iletide gecikme; Atriyoventriküler (AV) aralığının normal sinüs ritmi ile ve His-Purkinje dokusundagecikme olmadan atrium stimülasyonu sırasında uzama; PQ süresinde uzama, evre II atriyoventriküler blok indüksiyonu; Atriyum ve ventriküllerin fonksiyonel refraktör periyodunda uzama; Azalmış ejeksiyon fraksiyonu ile negatif inotropik etki; Kan basıncında azalma. Pediyatrik popülasyonSupraventriküler taşikardisi olan yaşları 2 ile 16 arasındaki 26 pediyatrik hastada kontrollü bir farmakokinetik/etkinlik çalışması yürütülmüştür. 1000 mikrogram/kg'lık bir esmololhidroklorür yükleme dozu uygulandıktan sonra devamlı infüzyonla dakikada 300mikrogram/kg'lık dozla idame tedavisine geçilmiştir. Esmolol başlandıktan sonraki 5dakikada hastaların %65'inde supraventriküler taşikardi sonlanmıştır. Randomize olan ancak kontrolsüz bir doz karşılaştırması çalışmasında, yaşları 1 ile 7 arasındaki 116 pediyatrik hastanın aorta koarktasyonu düzeltildikten sonra gelişenhipertansiyonda etkinlik araştırılmıştır. 125 mikrogram/kg'lık, 250 mikrogram/kg'lık ve 500mikrogram/kg'lık esmolol hidroklorür yükleme dozu uygulanan hastalarda daha sonradevamlı infüzyonla sırasıyla dakikada 125 mikrogram/kg, 250 mikrogram/kg ve 500mikrogram/kg'lık dozlarla idame tedavisine geçilmiştir. Her üç dozaj grubunda hipotansif etkiaçısından anlamlı bir fark görülmemiştir. Hastaların toplamda %54'ünde yeterli kan basıncıkontrolü sağlanması için esmolol hidroklorür dışında başka bir ilaç kullanılması gerekmiştir.Değişik doz gruplarında bu açıdan bir farklılık görülmemiştir. 5.2. Farmakokinetik özelliklerEmilim:İntravenöz uygulama sonrası maksimum plazma konsantrasyonuna süratle ulaşılır. Dağılım:Esmolol hidroklorürün dağılım yarılanma süresi yaklaşık 2 dakika gibi çok kısadır. Dağılım hacmi 3,4 L/kg'dır. Biyotransformasyon:13/17 Esmolol hidroklorür esterazlar tarafından bir asit metaboliti (ASL-8123) ve metanole metabolize olur. Bu metabolizasyon, ester bağlarının eritrositlerin sitozollerindeki esterazlartarafından hidrolizi yoluyla gerçekleşir. Esmolol hidroklorürün metabolizması dozunun 50 ile 300 mikrogram/kg/dakika olduğunda dozdan bağımsızdır. Esmolol hidroklorürün insan plazma proteinlerine %55 oranında bağlandığı, asit metabolitinin ise sadece %10 oranında bağlandığı gösterilmiştir. Eliminasyon:İntravenöz uygulama sonucu eliminasyon yarı ömrü yaklaşık 9 dakikadır. Toplam klerensi 285 ml/kg/dakikadır; toplam klerens karaciğer veya diğer organların dolaşımından bağımsızdır. Esmolol hidroklorür böbreklerden kısmen değişmeden (uygulananmiktarın %2'sinden azı) kısmen de zayıf bir beta blokör etkinliğe sahip asit metaboliti olarak(uygulanan miktarın %0,1'inden azı) atılır. Asit metabolit idrarla atılır ve eliminasyon yarıömrü yaklaşık 3,7 saattir. Doğrusallık / doğrusal olmayan durum:Sağlıklı erişkinlerde esmolol kinetiği doğrusaldır. Bir yükleme dozu uygulanmazsa 50-300 mikrogram/kg/dakikalık dozlarda uygulandığında, plazma sabitlenmiş düzeylerine ulaşımsüresi dozla doğrusaldır. Hastalardaki karekteristik özelliklerPediyatrik popülasyon:Yaşları 3 ile 16 arasında olan 22 pediyatrik hastada bir farmakokinetik çalışma gerçekleştirilmiştir. 1000 mikrogram/kg'lık bir esmolol hidroklorür yükleme dozuuygulandıktan sonra devamlı infüzyonla dakikada 300 mikrogram/kg'lık dozla idame tedavisiuygulanmıştır. Çalışmada çocuklardaki esmolol hidroklorür kinetiğinin erişkinlerdekindenfarklı olmadığına işaret edecek şekilde ortalama toplam vücut klerensi 119 ml/kg/dakika,ortalama dağılım hacmi 283 ml/kg ve ortalama terminal eliminasyon yarılanma ömrü 6,9dakika olarak gözlenmiştir. Ancak, çocuklarda bireysel değişkenliğin fazla olduğugözlenmiştir. 5.3. Klinik öncesi güvenlik verileriHayvan çalışmalarında teratojenik etki gözlenmemiştir. Tavşanlarda olasılıkla esmolol hidroklorürün neden olduğu embriyotoksik bir etki (fötal rezorpsiyonda artış) gözlenmiştir.Bu etki terapötik dozun en az 10 katı yüksek dozlarda gözlenmiştir. Esmolol hidroklorürün fertilite üzerindeki etkileri ile perinatal ve postnatal etkilerini araştıran bir çalışma gerçekleştirilmemiştir. Esmolol hidroklorürün birkaç in vitroin vivotestsistemlerinde mutajenik olmadığı bulunmuştur. Esmolol hidroklorürün güvenilirliği uzunsüreli çalışmalarla incelenmemiştir.14/17 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum asetat trihidrat Glasiyel asetik asitSodyum klorür Sodyum hidroksit ve/veya hidroklorik asit - pH ayarı için Enjeksiyonluk su 6.2. GeçimsizliklerGeçimlilik çalışmaları bulunmadığından, bu ilaç diğer ilaçlarla veya sodyum bikarbonat çözeltileriyle karıştırılmamalıdır. 6.3. Raf ömrü24 ay. Açılan ürün 2-8°C arasında saklandığında 24 saat süreyle fizikokimyasal olarak stabildir. Mikrobiyolojik açıdan ürün torbası açıldıktan sonra hemen kullanılmalıdır. Hemen kullanılamadığı durumlarda, kullanılmaya başlamadan önceki saklama süre ve koşullarıkullanıcının sorumluluğundadır. Bu süre 2-8°C arasında torbanın kontrollü ve valide edilmişaseptik koşullarda açılmadığı durumlarda normalde 24 saatten uzun olamaz. 6.4. Saklamaya yönelik özel tedbirler25°C'nin altında oda sıcaklığında saklanmalıdır. Buzdolabında saklanmamalı ya da dondurulmamalıdır. Çözeltinin saklama koşulları için bölüm 6.3'e bakınız. 6.5. Ambalajın niteliği ve içeriğiAlüminyum dış torba içinde çift portlu 250 ml'lik 1 adet PP torba. Ürün setli ve setsiz formda piyasaya sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. TORBA KULLANIM TALİMATIESMOBLOC 10 mg/ml I.V. infüzyon için çözelti, 250 ml'lik PP-6280 torbalarda (biri torbaya ilaç uygulama için, diğeri torbadaki ilacın hastaya verilmesi için olan iki SFC çıkışlı non-lateks polipropilen torba) sunulmaktadır. ESMOBLOC 10 mg/ml I.V. infüzyon için çözeltinin torbasındaki ilaç uygulama için seçilen uç yalnızca torbadan ilk bolus uygulama için kullanılmalıdır; tekrarlanan bolusuygulaması için değildir. Bolus dozunu çekerken aseptik teknik kullanılmalıdır.ESMOBLOC 10 mg/ml I.V. infüzyon için çözeltiye hiçbir ilave ilaç eklenmemelidir.Hertorba tek hastada kullanım içindir. İlaç uygulama çıkışının mühürü kırıldıktan ve torbadan 15/17 ilacın çekilmesinden sonra torbanın 24 saat içinde kullanılması gerekir. Çözeltinin kullanılmayan bölümü ve torbası yerel uygulamalar doğrultusunda imha edilmelidir. Kısmenkullanılmış torbaları yeniden kullanmayınız.
DİKKATPlastik torbalan seri bağlamalar için kullanmayınız. Bu tip kullanım ikinci kaptaki sıvının uygulanması tamamlanmadan önce birinci kaptan rezidüel havanın çekilmesine bağlıemboliye neden olabilir. AÇMAK İÇİNKullanımdan hemen öncesine kadar dış ambalajından (dış torba) çıkarılmamalıdır. Dış torba daha önceden açılmışsa ya da hasar görmüşse kullanılmamalıdır. Dış torba nemi önlemeamacını taşır. İç torba çözeltinin sterilitesini korur. Dış torba çentikli yerinden açılarak premiks torba çıkarılır. Bu aşamada plastik torba üzerinde görülebilen opasiteler, sterilizasyon prosesi sırasındaki nem absorbsiyonuna bağlıdır veçözeltinin kalitesini veya güvenilirliğini etkilemez. Opaklık giderek azalacaktır. İç torba sıkıştırılarak küçük sızıntılar olup olmadığı kontrol edilir. Sızıntı varsa sterilizasyon etkilenmiş olacağından çözelti atılmalıdır. Uygulamadan önce partiküler madde ve renkdeğişikliği için solüsyon görsel olarak incelenir. Yalnızca berrak ve renksiz veya açık sarırenkli çözeltiler kullanılmalıdır. 16/17 ESMOBLOC 10 mg/ml I.V. infüzyon için çözelti'ye hiçbir ekstra madde eklenmemelidir. İNTRAVENÖZ UYGULAMA İÇİN HAZIRLIKLAR (aseptik teknik kullanılmalıdır)1. Premiks torba, asma yerinden bir askıya asılır. 2. Torbanın alt tarafındaki uygulama çıkışından plastik koruyucu çıkartılır. 3. Uygulama seti takılır; setle birlikte verilen talimata uyularak uygulamaya başlanır. 7. RUHSAT SAHİBİPOLİFARMA İlaç San. ve Tic. AŞ. Vakıflar OSB Mahallesi, Sanayi Caddesi, No:22/1 Ergene/TEKİRDAĞ Tel: 0 282 675 14 04Faks: 0 282 675 14 05 8. RUHSAT NUMARASI2016/89 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk Ruhsat Tarihi: 17.02.2016 Ruhsat Yenileme Tarihi: 10. KÜB'ÜN YENİLENME TARİHİ17/17 |
İlaç BilgileriEsmobloc 10 Mg/ml I.v. İnfüzyon İçin ÇözeltiEtken Maddesi: Esmolol Hidroklorür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.