Beriate 500 Iu Iv Enjeksiyonluk/infüzyonluk Liyofilize Toz ve Çözücü Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIBERIATE 500 IU I.V. enjeksiyonluk/infüzyonluk liyofilize toz ve çözücüsü Steril, Apirojen 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir flakon, İnsan Koagülasyon Faktör VIII (FVIII: C- Faktör VIII Aktivitesi) 500 IU (100 IU/1 mL) içerir. BERIATE'in spesifik aktivitesi yaklaşık olarak 400 IU/mg protein'dir.* *Faktör VIII'in potensi (IU) Avrupa Farmakopesi'nde yer alan kromojenik analiz yöntemi ile hesaplanır. Yardımcı maddeler:Sodyum klorür 22.5-35 mg Sodyum hidroksit (az miktarda pH ayarlamak için) Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk veya infüzyonluk çözelti için liyofilize toz ve çözücüsü Çözelti renksiz, berrak ila hafif opalesan. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarHemofili A (konjenital Faktör VIII eksikliği) olan hastaların kanamalarının profilaksisinde ve tedavisinde kullanılır. BERIATE sonradan edinilmiş Faktör VIII eksikliğinin tedavisinde kullanılabilir. 1 BERIATE farmakolojik olarak etkili olacak Von Willebrand Faktör içermez. Bundan dolayı Von Willebrand hastalığında endike değildir.4.2. Pozoloji ve uygulama şekliUygulanacak doz; hastanın klinik durumuna, kanamanın şiddetine, ölçülen FVIII eksikliğinin derecesine göre, bu konuda uzman doktorlar tarafından belirlenmelidir. Pozoloji:Uygulanacak FVIII seviyesi miktarı uluslararası birim (IU) olarak belirlenir ve FVIII ürünleri için güncel WHO standardı ile hesaplanır. Plazmadaki FVIII aktivitesi (FVIII-C) ya yüzdeolarak (normal insan plazması) ile ilgili olarak ya da IU (plazmadaki FVIII için belirlenenuluslararası standarda göre) ifade edilir. 1 IU FVIII-C normal insan plazmasındaki 1 mL FVIII miktarına eşdeğerdir. Gerekli FVIII miktarı hesaplanırken deneysel bulgular temel alınır. Vücut ağırlığının her 1 kg için 1 IU FVIII plazmadaki FVIII aktivitesini normal aktivitenin %2 oranında artırır (2 IU/ kg). Gereken dozaj aşağıdaki formüle göre belirlenebilir: Başlangıç dozu: Gereken ünite = Vücut ağırlığı (kg) X İstenilen F VIII artışı (% ya da IU/ dL) X 0,5 Uygulama sıklığı ve süresi:Uygulama sıklığı ve süresi bireyin klinik durumuna göre kişisel olarak belirlenir. Aşağıdaki tabloda belirtilen hemoraji vakalarında FVIII düzeyi, ilgili bölümde belirtilen plazmaaktivitesi düzeyinin (normalin %' si olarak ya da IU/ dL) altına düşmemelidir. Uygulanacak doz ve infüzyon sıklığına, ölçülen FVIII seviyesine göre karar verilir. Özellikle büyük cerrahi operasyonlarda koagülasyon analizi ile (plazma FVIII-C) tedavinin yakındantakibi gereklidir. FVIII uygulamasına hastanın cevabı, in vivo geri kazanım ve yarılanmaömrü, hastadan hastaya farklılık gösterir. 2 Ciddi Hemofili A hastalığı olanlarda kanamaya karşı uzun süreli profilaksi için 2 ile 3 günlük aralıklarla, vücut ağırlığının her kg için 20- 40 IU Faktör VIII verilmelidir. Eğer gerekiyorsabaşka tedavi önlemleri de alınmalıdır. Aşağıdaki tablo; kanama olaylarında ve cerrahi müdahalelerde uygulanabilecek miktarlar
Hastalar, faktör VIII inhibitörlerinin gelişimi açısından izlenmelidir. Eğer beklenen faktör VIII aktivite plazma seviyesi elde edilemezse ya da uygun doz ile kanama kontrol altınaalınmazsa faktör VIII inhibitörlerinin varlığına karar vermek için test yapılmalıdır. Hastadayüksek seviyede inhibitör varlığında, faktör VIII tedavisi etkisiz olabilir ve diğer tedaviyöntemleri göz önünde bulundurulmalıdır. Bazı hastaların tedavisi hemofili ile ilgili 3 deneyimleri fazla olan hekimler tarafından yürütülmelidir. Bakınız Bölüm 4.4.''Özel kullanım uyarıları ve önlemleri ''Uygulama şekli:BERIATE intravenöz yolla uygulanır. Ürünü Bölüm 6.6.Beşeri Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler başlığı altında tarif edildiği şekilde hazırlayınız. Enjeksiyon: Ürün uygulanmadan önce oda sıcaklığına veya vücut sıcaklığına getirilmelidir. Hastanın rahat olacağı hızda damar içine enjekte edilir veya infüzyon şeklinde verilir. İnfüzyonun verilmehızı veya enjeksiyon hızı dakikada 2 mL' yi geçmemelidir. Herhangi bir acil müdahale için hasta sürekli gözlem altında tutulmalıdır. BERIATE uygulanması ile ilgili herhangi bir reaksiyon oluşursa, hastanın gerekli klinik koşullaragelebilmesi için infüzyon oranı azaltılabilir ya da tamamen kesilebilir. Bakınız Bölüm 4.4.'Özel kullanım uyarıları ve önlemleri''Özel popülasyonlara ilişkin ek bilgiler:Böbrek/ Karaciğer yetmezliği:BERIATE'in böbrek/karaciğer yetmezliği olan hastalarda kullanımı ile ilgili yapılan bir klinik çalışma yoktur. Bu nedenle BERIATE'in bu hastalarda kullanımında tedbirli olunmalı vehasta açısından yarar/ zarar değerlendirmesi yapıldıktan sonra kullanılmalıdır. Pediyatrik popülasyon:BERIATE'in çocuklarda doz ayarlaması ile ilgili yapılan bir klinik çalışma yoktur. Bu nedenle BERIATE'in çocuklarda kullanımında tedbirli olunmalı ve çocuk açısından yarar/zarar değerlendirmesi yapıldıktan sonra kullanılmalıdır. Geriyatrik popülasyon:BERIATE'in yaşlı hastalarda kullanımı ile ilgili yapılan bir klinik çalışma yoktur. Bu nedenle BERIATE'in yaşlı hastalarda kullanımında tedbirli olunmalı ve hasta açısından yarar/ zarardeğerlendirmesi yapıldıktan sonra kullanılmalıdır. 4 4.3. KontrendikasyonlarEtkin maddeye veya yardımcı maddelerden herhangi birine aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriVirüs GüvenliğiBERIATE insan plazmasından elde edilmektedir. İnsan plazmasından elde edilen ilaçlar, virüsler ve teorik olarak Varyant Creutzfeldt-Jacob (v-CJD) gibi, çeşitlihastalıklara yol açabilen enfeksiyon yapıcı ajanlar içerebilirler. BERIATE' da VaryantCreutzfeldt-Jacob hastalığının bulaşma riski teorik olarak minimumken, klasikCreutzfeldt-Jacob hastalığının bulaşma riski hiçbir kanıtla desteklenmez. Alınanönlemlere rağmen, bu tür ürünler halen potansiyel olarak hastalık bulaştırabilir.Bu tip ürünlerin enfeksiyon yapıcı ajanları bulaştırma riski, plazma verenlerin belirli virüslere önceden maruz kalıp kalmadığının izlenmesi, belirli virüs enfeksiyonlarınınhalihazırda varlığının test edilmesi ve belirli virüslerin yok edilmesi ve/veyainaktivasyonu ile azaltılmıştır. Bütün bu önlemlere rağmen, bu ürünler hala potansiyelolarak hastalık bulaştırabilirler. Ayrıca, henüz bilinmeyen enfeksiyon yapıcı ajanlarınbu ürünlerin içerisinde bulunma ihtimali mevcuttur.HIV, HBV, HCV gibi zarflı virüsler ve HAV gibi zarflı olmayan virüslerin etkisi için önlemlerin alınmasına dikkat edilmelidir. Parvovirus B19 gibi zarflı olmayan virüslerekarşı alınan tedbirler sınırlı sayıda olabilir. Parvovirus B19 enfeksiyonu, gebelikte (fetalinfeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretiminde artış olanhastalarda tehlikeli olabilir (hemolitik anemi gibi).Bu nedenle: Düzenli ve tekrarlanan sürelerle BERIATE kullanılması gerekiyorsa, hastalık yapıcıetkenlerin hastalara bulaşmasını önlemek için uygun aşıların (Hepatit A ve Hepatit Başıları) hastalara yaptırılması önerilebilir. BERIATE'in her kullanımında doktor tarafından ilacın alınış tarihi, seri numarası veenjekte edilen ilaç hacmi kayıt altına alınmalıdır. 5 Plazma türevli ürünlerin intravenöz infüzyonunda aşırı duyarlı alerjik tip reaksiyonlar görülebilir. Hastalar aşırı duyarlılık reaksiyonlarının neden olacağı; ürtiker, göğüs sıkışması,göğüste hırıltı, hipotansiyon ve anafilaksi hakkında bilgilendirilmelidir. Bu semptomlargörüldüğü takdirde hasta ilacın kullanımı derhal kesmeli ve doktoruna başvurmalıdır. Hastaşoka girerse; şok tedavisinde geçerli olan tıbbi standart tedaviler uygulanmalıdır. İnhibitörler Faktör VIII'e karşı nötralize edici antikor (inhibitörler) oluşumu, hemofili A hastalarının tedavisinde bilinen bir komplikasyondur. Bu inhibitörler genellikle faktör VIII prokoagülanaktiviteye yönelik olan IgG immünoglobülinleridir ve modifiye tetkik kullanılarak her mlplazmada Bethesda Ünitesi (BU) olarak ölçülür. İnhibitör gelişme riski, faktör VIII'emaruziyetin yanı sıra hastalığın şiddeti ile ilişkilidir ve bu risk ilk 50 maruziyet gününde enyüksek seviyededir; ancak risk yaygın görülmemesine rağmen yaşam boyu devam eder.İnhibitör gelişiminin klinik önemi inhibitör titresine bağlı olacaktır; düşük titrenin teşkil ettiğiyetersiz klinik yanıt riski, yüksek titreli inhibitörlere kıyasla daha az olacaktır. Genel olarak,koagülasyon faktörü VIII ürünleri ile tedavi edilen tüm hastalar, uygun klinik gözlem velaboratuvar testleri ile inhibitörlerin gelişimi açısından dikkatle izlenmelidir. Eğer beklenenfaktör VIII aktivitesinin plazma düzeylerine ulaşılamazsa veya yeterli doz ile kanama kontrolaltına alınamazsa faktör VIII inhibitörü varlığı açısından test yapılmalıdır. İnhibitör düzeyleriyüksek olan hastalarda faktör VIII tedavisi etkili olmayabilir ve diğer tedavi seçenekleridikkate alınmalıdır. Böyle hastaların tedavisi hemofili ve faktör VIII inhibitörleri tedavisikonusunda deneyimli hekimler tarafından yönlendirilmelidir. Bu tıbbi ürün her 500 IU de 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. Daha yüksek dozlar 1 mmol ya da daha fazla sodyum ihtiva edebilir. Budurum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriİnsan koagülasyon faktör VIII ile diğer tıbbi ürünler arasında bilinen bir etkileşim bulunmamaktadır. Fakat yine de BERIATE diğer tıbbi ürünler ile karıştırılmamalıdır. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir. 6 Pediyatrik popülasyonPediyatrik popülasyona ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolüBERIATE'in çocuk doğurma potansiyeli bulunan kadınlarda kullanıldığında üreme kapasitesini etkileyip etkilemediği bilinmemektedir. Bu nedenle çocuk doğurma potansiyelibulunan kadınlarda planlanmış bir gebelikten önce uygun bir alternatif tedaviye geçilmelidir. Gebelik dönemiBERIATE'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir ve insanlara yönelikpotansiyel risk bilinmemektedir. Bu nedenle BERIATE gerekli olmadıkça gebelik dönemindekullanılmamalıdır. Buna rağmen, BERIATE tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, BERIATE'in anne açısındanfaydası dikkate alınmalıdır. Laktasyon dönemiBERIATE'in anne sütüyle atılıp atılmadığı bilinmemektedir. Buna rağmen, emzirmenin durdurulup durdurulmayacağına ya da BERIATE tedavisinin durdurulupdurdurulmayacağına/ tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken,emzirmenin çocuk açısından faydası ve BERIATE tedavisinin emziren anne açısından faydasıdikkate alınmalıdır. Üreme yeteneği/FertiliteBERIATE'in fertilite üzerinde doğrudan veya dolaylı olarak zararlı etkilerinin olduğu hakkında yeterli veri bulunmamaktadır. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanmaya etkisi yoktur. 7 4.8. İstenmeyen etkilerGüvenlilik profili özeti Aşırı duyarlılık ya da alerjik reaksiyonlar (bunlar arasında anjiyoödem, infüzyon bölgesinde yanma ve batma, titreme, sıcak basması, yaygın ürtiker, baş ağrısı,kurdeşen, kan basıncında düşme, letarji, bulantı, huzursuzluk, taşikardi, göğüstesıkışma hissi, karıncalanma, kusma, hırıltılı solunum yer alabilir) nadirengözlenmiştir ve bazı olgularda şiddetli anafilaksiye kadar ilerleyebilir (şok dahil). BERIATE de dahil olmak üzere faktör VIII ile tedavi edilmiş hemofili A hastalarında nötralize edici antikorlar (inhibitörler) gelişebilir (bkz. bölüm 5.1). Butür inhibitörler oluşursa, durum, yetersiz klinik yanıt şeklinde kendini gösterebilir.Bu gibi durumlarda uzman hemofili merkezleriyle bağlantı kurulması önerilmektedir.Advers reaksiyonların tablolaştırılmış listesi Aşağıda verilen tablo, MedDRA sistem organ sınıflandırmasına (SOC ve Tercihli Terim Düzeyi) uygundur. Görülme sıklıkları şu yaklaşıma göre değerlendirilmiştir: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Advers reaksiyonlar her bir sıklık grubunda azalan ciddiyet sırasına göre verilmiştir.
Şüpheli advers reaksiyonların raporlanması Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye 8 Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08, faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiİnsan pıhtılaşma Faktör VIII'e ait doz aşımı belirtileri bildirilmemiştir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antihemorajikler: Koagülasyon Faktör VIII ATC kodu: B02BD02 Etki MekanizmasıBERIATE, insan vücudunda bulunan endojen FVIII ile aynı etkileri gösterir. Hemofilik hastalara infüzyon yapıldığı zaman FVIII hastanın dolaşımındaki VWF' e bağlanır. Aktive edilmiş Faktör VIII, aktive edilmiş Faktör IX kofaktörü gibi davranarak, Faktör X' un aktive edilmiş Faktör X' a dönüşmesini hızlandırır. Aktive olan Faktör X, protrombinitrombin haline çevirir. Daha sonra trombin fibrinojeni fibrine dönüştürür ve pıhtılaşmagerçekleştirilir. Hemofili A, cinsiyet ile bağlantılı, FVIII seviyesinin kanda düşmesi sonucu oluşan kan koagülasyon bozukluğunun görüldüğü kalıtsal bir hastalıktır. Eklem yerlerinde, kaslarda ya daiç organlarda spontan olarak ya da bir kaza veya cerrahi bir müdahale sonucundadurdurulamayan aşırı kanama oluşur. Yerine koyma tedavisi ile Faktör VIII seviyesiyükseltilir. Tedavi faktör eksikliğinde geçici düzelme sağlar ve kanama durdurulur. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Uygulama yeri açısından (intravenöz) ilaç direkt kana karışır. Dağılım:Plazma konsantrasyon-zaman eğrisinin altında kalan alan 0.4 saat x kg/mL (standart sapma 0.2). Ortalama tutulma zamanı (MRT) 17 saattir (standart sapma 5.5 saat) Biyotransformasyon:9 Plazma Faktör VIII aktivitesi mono veya biekspotensiyel bozulmayla azalır. Eliminasyon:Eliminasyon yarılanma ömrü ortalama 12 saat olmakla birlikte, 5-22 saat arasında değişir. Ortalama değer yaklaşık 12 saattir. Ortalama klerans 3 mL/saat/ kg'dır (standart sapma 1.5 mL/saat/kg) Doğrusallık/ Doğrusal olmayan durum:Bilgi bulunmamaktadır. 5.3. Klinik öncesi güvenlilik verileriGenel Toksisite Tekrarlanan doz ile toksisite çalışmaları heterelog proteinlere karşı geliştirilen antikorlar nedeniyle yapılamamıştır. İnsanlar için vücut ağırlığındaki kilogram başına tavsiye edilendozun birkaç katı laboratuar hayvanlarında denenmiş ve bir toksisite oluşmamıştır. Mutajenite Klinik deneyler insan plazma pıhtılaştırma Faktörü VIII için hiçbir tümörojenik veya mutajenik etki bildirmediğinden, özellikle heterolog türler üzerine deneysel çalışmalaryapılması zorunlu değildir. 6. FARMASOTIK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSakkaroz Aminoasetik asit (glisin) Kalsiyum klorür Sodyum klorürSodyum hidroksitEnjeksiyonluk su 6.2. GeçimsizliklerBu tıbbi ürün, çözücüsü ve seyreltilmiş olarak diğer tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrü36 ay. 10 6.4. Saklamaya yönelik özel tedbirlerBERIATE +2 °C - +8°C arasında buzdolabında saklayınız. Dondurmayınız. Donmuş ürünü çözüp kullanmayınız. Isı ve ışıktan koruyunuz. Işıktan korumak için orijinal ambalajında saklayınız. Flakonu direk ısıdan koruyunuz. Flakon vücut sıcaklığından (37°C) daha fazla ısıtılmamalıdır. Sulandırılan ürün dondurulmamalıdır. Ürün açıldıktan sonra kimyasal ve fiziksel stabilitesini 25 °C' de 8 saat korur. Ürünün mikrobiyolojik kontaminasyona karşı korunması için hemen kullanılmalıdır. Eğer hemen kullanılmayacaksa ürün oda sıcaklığında 8 saatten fazla tutulmamalıdır. BERIATE 36 aylık raf ömrü içinde toplamda 1 aylık saklama periyodunu aşmamak kaydıyla +25°C' de saklanabilir. +25°C'deki saklama süreleri toplamda 1 aylık saklama periyodunuaşmamak için tek tek not edilmelidir. 6.5. Ambalajın niteliği ve içeriğiTip I camdan yapılmış renksiz enjeksiyonluk flakonlar vakum altında kauçuk tıpa, alüminyum kapak ve plastik disk ile kapatılmıştır. BERIATE 500 IU Liyofilize toz içeren 1 adet flakon 5 mL enjeksiyonluk su içeren 1 adet flakon 1 adet transfer seti 1 adet disposable filtre iğnesi 6.6. Beşeri Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerGenel talimatlar: Çözelti berrak veya hafif opak olmalıdır. Hazırlanan ürünler filtre/çekme işleminden sonra (aşağıya bakınız) ve uygulama öncesinde herhangi bir partikül varlığı veya renk değişimiaçısından görsel olarak incelenmelidir. Bulanık veya kalıntılar (birikinti/partikül) içerençözeltileri kullanmayınız. 11 Hazırlama: Çözücüyü oda sıcaklığına getiriniz. Toz ve çözücü flakonlarının kapaklarının çıkarıldığından ve stoperlerin aseptik bir solüsyonla silinerek Mix2Vial paketinin açılmasından öncekendiliğinden kuruduğundan emin olunuz. 
1 1.Kapağı soyarak Mix2Vial paketini açınız. Mix2Vial' i blister paketinden çıkarmayınız. 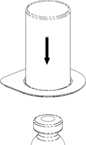
 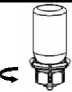 
2. Çözücü flakonu düz ve temiz bir yüzey üzerineyerleştiriniz ve flakonu sıkıca tutunuz. Blister paketi ilebirlikte aldığınız Mix2Vial setinin mavi adaptör ucununtepe noktasını çözücü flakonun stoperinin üzerine doğruitiniz. 3. Kenarından tutarak ve dikey şekilde yukarıya doğruçekerek, blister paketini Mix2Vial setinden dikkatliceçıkarınız. Sadece blister paketini çekerek çıkardığınızdanve Mix2Vial setini çıkarmadığınızdan emin olun. 4. Toz flakonunu düz ve sağlam bir zemin üzerine yerleştiriniz. Çözücü flakonunu takılı olan Mix2Vialsetiyle birlikte ters çevirin ve saydam adaptör ucununtepe noktasını, toz flakonun stoperinden aşağıya doğrubastırınız. Çözücü otomatik olarak toz flakonunun içineakacaktır. 5. Bir elinizle Mix2Vial setinin ürün tarafını, diğer elinizle de çözücü tarafını tutunuz ve ürünün çözülmesisırasında aşırı köpük oluşmasını önlemek için setidikkatli bir şekilde iki parçaya ayırınız. Çözücüflakonunu mavi Mix2Vial adaptörü takılı şekilde atınız.
12 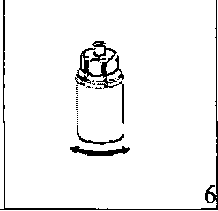 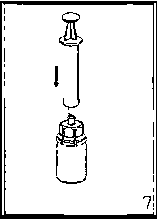 
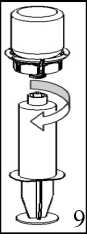 6. Tozun tamamen çözündüğünden emin oluncaya kadar ürün flakonunu saydam adaptör takılı şekilde hafifçesağa sola çeviriniz. Çalkalamayınız. 7. Boş, steril bir şırıngaya hava çekiniz. Ürün flakonu yukarıya doğru iken, şırıngayı Mix2Vial'ın Luer Lockbağlantı parçasına bağlayınız. Ürün flakonuna havaenjekte ediniz. 8. Şırınganın pistonunu basılı tutarak sistemi baş aşağı çeviriniz ve konsantreyi, pistonu yavaşça geriye çekerekşırıngaya alınız. 9. Çözelti şırıngaya aktarıldıktan sonra, şırınganın gövdesini sıkıca tutunuz (şırınganın sapını aşağıyabakacak şekilde tutarak) ve saydam Mix2Vialadaptörünü şırıngadan ayırınız. Solüsyonu hemen yavaş intravenöz enjeksiyonla veya infüzyonla uygulayınız Ürünle dolu şırıngaya kan girmemesine son derece dikkat edilmelidir. Herhangi bir kullanılmamış ürün veya atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarakimha edilmelidir. 7. RUHSAT SAHİBİCSL Behring Biyoterapi İlaç Dış Ticaret Anonim ŞirketiBüyükdere Cad. Apa Giz Plaza 13 No:191 K:14 Levent 34394, İstanbul 8. RUHSAT NUMARASI2015/688 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 31.08.2015 Ruhsat yenileme tarihi: 10. KÜB' ÜN YENİLENME TARİHİ14 |
İlaç BilgileriBeriate 500 Iu Iv Enjeksiyonluk/infüzyonluk Liyofilize Toz ve ÇözücüEtken Maddesi: Insan Koagülasyon Faktör Viii Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.