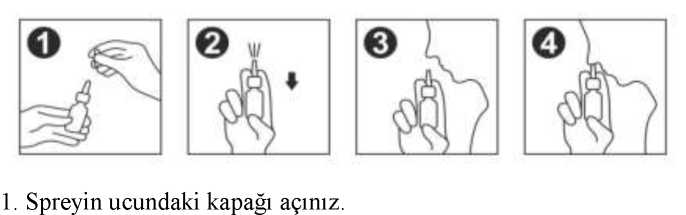
Nasowell 1 Mg/ml + 50 Mg/ml Burun Spreyi, Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADINASOWELL 1 mg/ml + 50 mg/ml burun spreyi, çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeHer 1 ml'de; Ksilometazolin hidroklorür 1 mg Dekspantenol 50 mg Yardımcı maddelerBenzalkonyum klorür 0,2 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMNazal sprey Berrak renksiz çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarNazal konjesyona neden olan alerjik rinit, rinit ve sinüzitin semptomatik tedavisinde, septoplasti ve endoskopik sinüs cerrahisinden sonra konjesyon ve enflamasyonungiderilmesinde kullanılır. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Yetişkinler ve 12 yaş üstü çocuklar; Tavsiye edilen doz her bir burun deliğine günde 1-3 kez birer püskürtmedir. Doktorunuz tarafından faklı bir tedavi uygulanmadıkça 7 günden fazla kullanılmamalıdır. Kullanım tekrarıancak birkaç gün ara verildikten sonra başlatılabilir. 1 / 10 Uygulama şekli:NASOWELL sadece intranazal olarak uygulanır. Nazal mukozada fazla mukus sekresyonu ve ödem olduğunda ilaç etkisini göstereceği yere ulaşamayabilir. Bu bakımdan nazal spreyikullanmadan önce burun iyice temizlenmelidir. 2. İlk uygulamadan önce, sprey bir defa havaya dağılana kadar, birkaç pompalama hareketiyaparak pompayı kullanıma hazır hale getiriniz. 3. İleriye doğru hafifçe eğiliniz ve başlığı burun deliğine yerleştiriniz. 4. Spreyin en uygun şekilde dağılmasını sağlamak için, pompayı bastırırken aynı anda nefesalınız. Şişeyi dikey tutularak her iki burun deliğine sıkınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:NASOWELL'in böbrek ya da karaciğer yetmezliği olan hastalarda kullanımı ile ilgili veri bulunmamaktadır. Pediyatrik popülasyon:6 yaşın altında kontrendikedir. 6-12 (6 yaş ve üstü-12 yaş altı aralığı) yaş grubundaki çocuklarda kullanılmamalıdır Geriyatrik popülasyon:NASOWELL'in geriyatrik popülasyonda kullanımı ile ilgili veri bulunmamaktadır. 4.3. KontrendikasyonlarNASOWELL, aşağıdaki durumlarda kontrendikedir: İçeriğinde bulunan etkin maddelere veya yardımcı maddelere veya diğer adrenerjikilaçlara karşı aşırı duyarlılık Rinitis sicca 2 / 10 Diğer vazokonstrüktörler gibi transfenoidal hipofızektomi ya da materin açığaçıkmasına neden olan ameliyat geçirmiş hastalar 6 yaşın altındaki çocuklarda 4.4. Özel kullanım uyarıları ve önlemleriNASOWELL aşağıdaki durumlarda fayda risk değerlendirilmesi yapılarak kullanılmalıdır. Kardiyovasküler sistem hastalıkları Monoamino oksidaz inhibitörleri (MAOİ) veya trisiklik antidepresanlar (TSA) ile eşzamanlı kullanım Diabetes Mellitus Hipertansiyon Glokom Feokromasitom Prostat hipertrofisi Porfiri Tiroid fonksiyon bozukluklarında kullanımdan kaçınılmalıdır. Kronik rinit tedavisinde doktor kontrolü altında kullanılmalıdır. Diğer sempatomimetik ilaçlarda olduğu gibi, adrenerjik maddelere şiddetli reaksiyongösteren kişilerde uykusuzluk, sersemlik, titreme, kardiyak aritmiler ya da tansiyonartışına neden olabileceğinden dikkatle kullanılmalıdır. Geri tepme etkisinden dolayı solunum yollarının daralmasına ve hastanın kullanmasüresinden fazla kullanma ihtiyacı hissetmesine sebep olabilir. Bunun sonuçları kronikşişlikler (Rhinitis medicamentosa) hatta burun mukozası atrofisi olabilir. Ağır olmayan vakalarda sempatomimetik ilk önce bir burun deliğinde durdurulabilir,şikayetlerin azalması sonrası diğer taraf ile en azından burundan nefes alımının birkısmını korumak için değiştirilebilir. Önerilen doz aşılmamalıdır. Ardışık 7 günden daha uzun süre kullanılmamalıdır. Semptomlar devam edersedoktora danışılmalıdır. Hamile veya diğer ilaçları kullananlarda veya doktor kontrolünde olanlarNASOWELL almadan önce doktora danışmalıdır. 3 / 10 Çapraz kontaminasyonu önlemek için NASOWELL sadece bir kişi tarafından kullanılmalıdır. Yakın zamanda sinir ameliyatı geçirenlerde kullanılmamalıdır. Duyarlı nazal yollara sahip bazı hastalarda ürün uygulandığında lokal rahatsızlıkhissedilebilir. Doktor tarafından yarar/risk değerlendirmesi yapılması koşuluyla çocuklarda uygunyaş gruplarında kullanılabilir. NASOWELL, verilen doz başına 10 mg'dan daha az benzalkonyum klorür içerir. Bu miktarın bronkospazma neden olması beklenmemektedir. Benzalkonyum klorür, deride tahrişe nedenolabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBütün sempatomimetikler gibi ksilometazolinin de sistemik etkilerinin, monoaminooksidaz inhibitörleri, trisiklik veya tetrasiklik antidepresanlarla birlikte kullanıldığı zaman, özellikledoz aşımı söz konusu olduğunda şiddetlenme olasılığı, göz önünde bulundurulmalıdır.Dekspantenol'un diğer tıbbi ürünler ile etkileşimleri ile ilgili veri bulunmamaktadır. Özel popülasyonlara ilişkin ek bilgilerVeri bulunmamaktadır. Pediyatrik popülasyonVeri bulunmamaktadır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Ksilometazolinin gebe kadınlarda kullanımına ilişkin veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/embriyonal/fetal gelişim/ve-veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. 4 / 10 NASOWELL, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gebelik dönemiNASOWELL, olası sistemik vazokonstriktör etkileri nedeniyle gebelik süresince kullanılmamalıdır. Laktasyon dönemiNASOWELL'in emzirilen çocuk üzerinde herhangi bir advers etkisi olduğuna dair kanıt bulunmamaktadır. Bununla birlikte ksilometazolinin insan sütüyle atılıp atılmadığıbilinmediğinden dikkatli olunmalıdır. NASOWELL emzirme döneminde yalnız doktorgözetimi altında kullanılmalıdır. Üreme yeteneği /FertiliteKsilometazolinin fertilite üzerine etkisi için yeterli çalışma bulunmamaktadır ve hayvan çalışmaları da mevcut değildir. Ancak ksilometazoline sistemik maruziyet çok düşük olduğuiçin fertilite üzerinde etki olasılığı çok düşüktür. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine bilinen herhangi bir etkisi yoktur. 4.8. İstenmeyen etkilerİstenmeyen etkiler aşağıda sistem organ sınıf ve sıklıklarına göre verilmiştir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıÇok seyrek: Aşırı duyarlılık reaksiyonları (anjiyoödem, döküntü, kaşıntı) Sinir sistemi hastalıklarıÇok seyrek: Baş ağrısı, huzursuzluk, uykusuzluk, yorgunluk, halüsinasyon 5 / 10 Göz hastalıklarıÇok seyrek: Geçici görme bozukluğu Kardiyak hastalıklarıSeyrek: Çarpıntı, taşikardi, hipertansiyon Çok seyrek: Aritmi Solunum, göğüs bozuklukları ve mediastinal hastalıklarıÇok seyrek: Burun mukozasında şişlik, burun kanaması Yaygın: Burun mukozasında yanma hissi, kuruluk veya rahatsızlık Gastrointestinal hastalıklarYaygın: Bulantı Kas ve iskelet sistemi hastalıklarıÇok seyrek: Konvülsiyon (özellikle çocuklarda) Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Uygulama yerinde yanma hissi Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiÇocuklarda ender olarak kaza sonucu görülen ksilometazolin zehirlenmelerinde, başlıca hızlı ve düzensiz nabız, yüksek kan basıncı ve bazen bilincin bulanıklaşması gibi belirtilerdenoluşan klinik tablo ortaya çıkar. Spesifik bir tedavi yoktur. Uygun destekleyici tedaviye başlanmalıdır ve doktor kontrolü altında semptomatik tedavi uygulanmalıdır. 6 / 10 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Dekonjestan ve diğer nazal topikal preparatlar, Sempatomimetiklerin kortikosteroid olmayanlarla kombinasyonlarıATC kodu: R01AB06 Etki mekanizması Ksilometazolin, alfa adrenerjik reseptörlere etki eden sempatomimetik bir ajandır. Buruna uygulandıktan sonra, burundaki kan damarlarını daraltarak burun mukozasında ve komşufarenks bölgelerinde dekonjesyon sağlar. Bu sayede burun geçitlerinde dekonjesyon eldeedildiğinden, burnu tıkalı olan hasta, burun yoluyla daha rahat soluk alıp verebilir.Dekspantenol, hücrelerde hızlı bir şekilde pantotenik aside dönüştürülür ve dolayısıylavitamin ile aynı etkilere sahiptir. Bununla birlikte, dekspantenol topikal yolla uygulandıktansonra daha kolay emilme avantajına sahiptir. Pantotenik asit, temel koenzim A'nın (CoA) bir bileşenidir. Asetilkoenzim A formunda CoA, tüm hücrelerin metabolizmasında merkezi bir rol oynar. Dolaysıyla pantotenik asit cilt vemukoza oluşumu ve rejenerasyonu açısından vücut için vazgeçilmez bir maddedir. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerKsilometazolin Emilim:Lokal nazal uygulamayı takiben ksilometazolinin plazma konsantrasyonu çok düşüktür ve ölçülebilme limitlerine yakındır. Dağılım:Ksilometazolinin etkisi birkaç dakika içinde başlar ve 12 saate kadar uzayabilen süreler boyunca devam eder. Soğuk algınlığı olan hastalarla yapılan çift kör, kontrollü (salinsolüsyonu) bir çalışmada rinomometre ile yapılan ölçümlerde ksilometazolinin dekonjestanetkisi salin solüsyonuna göre anlamlı derecede (p< 0.0001) yüksek bulunmuştur. Tedaviden 5dakika sonra salin solüsyonu ile karşılaştırıldığında burun tıkanıklığına etkisi iki kat dahahızlıdır. 7 / 10 Biyotransformasyon:Veri bulunmamaktadır. Eliminasyon:Veri bulunmamaktadır. Doğrusallık / doğrusal olmayan durum:Veri bulunmamaktadır. Dekspantenol Emilim:Dekspantenol hızlı bir şekilde emilir. Ardından hemen pantotenik aside dönüştürülür ve bu vitamin endojen havuzuna eklenir. Dağılım:Pantotenik asit kanda plazma proteinlerine bağlanır (öncelikli olarak P-globulinler ve albümin). Sağlıklı yetişkinlerde tam kan ve serumda sırasıyla yaklaşık 500 - 1000pg/L ve100pg/L konsantrasyonlar bulunmaktadır. Biyotransformasyon:Pantotenik asit insan vücudunda metabolize olmaz ve bu nedenle değişmeden atılır. Eliminasyon:Oral dozun %60-70'i idrarla, geri kalanı da dışkıyla atılmaktadır. Yetişkinler idrarla günde 27 mg, çocuklar ise 2-3 mg atmaktadır.Doğrusallık / doğrusal olmayan durum:Veri bulunmamaktadır. Hastalardaki karakteristik özelliklerVeri bulunmamaktadır. 8 / 10 5.3. Klinik öncesi güvenlilik verileriKöpeklere tekrar tekrar nazal ksilometazolin hidroklorür verilerek yapılan toksisite çalışmaları sonunda, insanlar için güvenlilik riski oluşmadığı görülmüştür. Bakterilerin genmutasyonu için yapılan in vitroaraştırması negatif sonuçlanmıştır. Kanserojenliği hakkındaveri bulunmamaktadır. Fare ve tavşanlara subkutan yoldan uygulandığı bir çalışmadateratojenik etki görülmemiştir. Terapötik miktarından yüksek dozajlar embriyoletal olup,fetüsün büyümesini yavaşlatmıştır. Farelerde süt üretimi engellenmiştir. Doğurganlık üzerindeolumsuz belirtiler görülmemiştir.Dekspantenol, pantotenik asit ve tuzları toksik olmayan maddeler olarak tanımlanmaktadır. Oral olarak alınan dekspantenolün LD50'si farelerde 6,25 g/kg'dir. Mutajenik, karsinojenik veteratojenik etkileri üzerinde veri yoktur. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiDisodyum hidrojen fosfat heptahidrat Sodyum dihidrojen fosfat monohidratBenzalkonyum klorürSaf su 6.2. GeçimsizliklerBilinen bir geçimsizliği yoktur. 6.3. Raf ömrü24 ay. Açıldıktan sonra 12 hafta içerisinde kullanılmalıdır. 6.4. Saklamaya yönelik özel tedbirler25 °C'nin altındaki oda sıcaklığında ve ambalajında saklanmalıdır. 6.5. Ambalajın niteliği ve içeriğiKarton kutu içerisinde beyaz renkli plastik sprey aplikatör ile kapatılmış 10 ml'lik amber renkli cam şişe. 9 / 10 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri "'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİWorld Medicine İlaç San. ve Tic. A.Ş. Bağcılar/İstanbul 8. RUHSAT NUMARASI2018/173 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 29.03.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ10 / 10 |
İlaç BilgileriNasowell 1 Mg/ml + 50 Mg/ml Burun Spreyi, ÇözeltiEtken Maddesi: Ksilometazolin Hidroklorür, Dekspantenol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.