Emeset 8mg/4ml Im/iv Enjeksiyonluk Çözelti İçeren Ampul Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIEMESET 8 mg / 4 ml İ.M./İ.V. enjeksiyonluk çözelti içeren ampul Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:1 ml çözelti 2 mg Ondansetron'a eşdeğer 2,4945 mg Ondansetron hidroklorür dihidrat içerir. Herbir 4 ml çözelti içeren ampul 8 mg Ondansetron'a eşdeğer 9,978 mg Ondansetron hidroklorürdihidrat içerir. Yardımcı maddeler:Sodyum sitrat.............................................1 mg Sodyum klorür............................................36 mg Diğer yardımcı maddeler için 6.1'e bakınız 3. FARMASÖTİK FORMAmpulEnjeksiyon veya infüzyon için renksiz, berrak çözelti 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarEMESET, sitotoksik kemoterapi ve radyoterapinin neden olduğu bulantı ve kusmaların tedavisinde, ayrıca post-operatif bulantı ve kusmanın önlenmesi ve tedavisinde de endikedir. 4.2 Pozoloji ve uygulama şekli Pozolojiuygulama sıklığı ve süresi:Yetişkinlerde: Kemoterapi ve radyoterapi sonucu oluşan bulantı ve kusma:Kanser tedavisinin emetojenik potansiyeli, uygulanan kemoterapi kombinasyonlarının dozlarına ve kullanılan radyoterapirejimlerine göre değişir. EMESET'in aynı zamanda uygulama ve dozaj esnekliği sağlayan oraltablet formları da mevcuttur. Kemoterapi ile indüklenmiş bulantı ve kusması olan yetişkinlerdedüşük IV doz rejimi (4 saat aralıklarla üç kere 0,15 mg/kg) kullanılabilir. Fakat QT uzamariskinden dolayı tek doz IV ondansetron hidroklorür dihidrat dozu 16 mg'ı aşmamalıdır.Emetojenik kemoterapi ve radyoterapi:Emetojenik kemoterapi ve radyoterapi alan hastalara EMESET oral veya intravenöz enjeksiyon şeklinde verilebilir. Düşük IV doz rejimi (4 saataralıklarla üç kere 0,15 mg/kg) kullanılabilir; 30 saniyeden az olmamak üzere tedaviden hemenönce yavaş intravenöz enjeksiyon şeklindedir. Fakat QT uzama riskinden dolayı tek doz IVondansetron hidroklorür dihidrat dozu 16 mg'ı aşmamalıdır. İlk 24 saatten sonraki gecikmişveya uzamış emezisten korunmak için, ilk gün uygulanan tedaviyi takiben, oral ondansetronhidroklorür dihidrat tedavisi önerilir.1 / 17Yüksek derecede emetojenik kemoterapi:Yüksek dozda sisplatin gibi aşırı emetojenik kemoterapi uygulanan hastalara EMESET kemoterapiden hemen önce düşük IV doz rejimi (4 saat aralıklarlaüç kere 0,15 mg/kg) kullanılabilir. Fakat QT uzama riskinden dolayı tek doz IV ondansetronhidroklorür dihidrat dozu 16 mg'ı aşmamalıdır. 8 mg'dan yüksek dozlar verilecekse 50-100 mlserum fizyolojik veya diğer geçimli olduğu infüzyon sıvıları ile seyreltilmeli ve 15 dakikadan azolmamak üzere infüzyon şeklinde verilmelidir.Yüksek derecede emetojenik kemoterapinin yönetimi için, 30 saniyeden az olmamak üzere kemoterapiden hemen önce uygulanan 8 mg'lık yavaş intravenöz enjeksiyonu veya intramüskülerenjeksiyonu takiben 2 ila 4 saat ara ile ilave iki 8 mg'lık intravenöz doz veya 24 saate kadar 1mg/saat devamlı infüzyon şeklinde verilebilir. Dozaj rejiminin seçimi uygulanan tedavininemetojenik potansiyeline (kusma ve bulantı meydana getirme şiddetine) göre yapılmalıdır. Aşırıderecede emetojenik kemoterapide, EMESET'in etkisi kemoterapiden önce 20 mg'lık tek birintravenöz deksametazon sodyum fosfat dozunun ilavesiyle artırılabilir. İlk 24 saatten sonrakigecikmiş veya uzamış emezisten korunmak için, ilk gün uygulanan tedaviyi takiben oral EMESETtedavisi önerilir. Postoperatif bulantı ve kusma:Post-operatif bulantı ve kusmayı önlemek için EMESET oral, intramüsküler veya yavaş intravenöz enjeksiyon şeklinde verilebilir. Önerilen EMESETenjeksiyon dozu anestezi indüksiyonunda intramüsküler veya yavaş intravenöz enjeksiyonşeklinde tek doz 4 mg'dır. Başlamış post-operatif bulantı ve kusmanın tedavisinde tek doz 4 mgintramüsküler veya yavaş intravenöz enjeksiyon şeklinde uygulanır.Tüm yetişkin hastalarda (yaşlılar dahil) tekrarlayan dozlarda:Tekrarlayan intravenöz ondansetron hidroklorür dihidrat dozları en az 4 saat araylauygulanmalıdır.75 yaşından küçük yetişkin hastalar:16 mg'ıUygulama şekli:İntramüsküler veya intravenöz yolla verilir (Ayrıca bakınızÖzel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Günlük dozaj, dozaj sıklığı ve uygulama yolunda değişiklik yapmaya gerek yoktur. Karaciğer yetmezliği:Orta derecede şiddetli veya şiddetli karaciğer fonksiyon bozukluğu olan hastalarda ondansetron hidroklorür dihidrat klerensi önemli derecede azalır ve serum yarılanma ömrü önemli derecedeuzar. Böyle hastalarda günlük toplam doz 8 mg'ı aşmamalıdır. Pediyatrik popülasyon:KNBK (sitotoksik kemoterapinin neden olduğu bulantı ve kusma- 6 aydan 17 yaşa kadar) için doz, vücut yüzey alanı (VYA) ya da ağırlığa göre hesaplanabilir. Pediyatrik klinik çalışmalarda,ondansetron hidroklorür dihidrat 25-50 ml serum fizyolojik ya da diğer geçimli infüzyonsıvılarında seyreltilerek infüzyon ile verilmiş ve infüzyon en az 15 dakikada yapılmıştır. 2 / 17VYA ile dozlamaOndansetron hidroklorür dihidrat 5 mg/m i.v. tek doz olarak kemoterapiden hemen önce uygulanmalıdır. i.v. doz 8 mg'ı geçmemelidir. Oral doz 12 saat sonra başlatılabilir ve 5 günekadar sürdürülebilir (Tablo 1). Yetişkin dozları aşılmamalıdır.
Vücut ağırlığına göre doz hesaplamaOndansetron hidroklorür dihidrat 0,15 mg/kg i.v. tek doz olarak kemoterapiden hemen önce uygulanmalıdır, i.v. doz 8 mg'ı aşmamalıdır. Birinci gün, dozu 4 saatlik ara ile 2 i.v. dozverilebilir. Oral doz 12 saat sonra başlatılabilir ve 5 güne kadar sürdürülebilir (Tablo 2). Yetişkindozları aşılmamalıdır.
Postoperatif bulantı ve kusma (1 aydan 17yaşa kadar):İki yaşın altındaki çocuklarda post-operatif bulantı ve kusmanın tedavisinde EMESET'in kullanımı ile ilgili bir veri bulunmamaktadır. Pediyatrik hastalarda post-operatif bulantı ve kusmanın önlenmesinde genel anestezi altındaki cerrahi uygulamalarda, ondansetron hidroklorür dihidrat yavaş i.v. enjeksiyonu olarak (30saniyeden az değil) maksimum 4 mg'a kadar 0,1 mg/kg dozunda anestezi başlangıcından önceya da sonra veya cerrahi operasyon sonrasında uygulanabilir. Geriyatrik popülasyon:Emetojenik kemoterapi ve radyoterapi:65 yaş ve üzerindeki yaşlı hastalarda dilüsyon hazırlanması ve uygulanması:Tüm intravenöz dozlar 50-100 mL serum fizyolojik veya başka bir geçimli sıvı içinde seyreltilmeli ve en az 15 dakika boyunca infüzyonla uygulanmalıdır.3 / 1775 yaş ve üzerindeki yaşlı hastalar:8 mg'ıgeçmemelidir (en az 15 dakikaboyunca infüzyonla).Postoperatif bulantı ve kusma:Yaşlılarda, post-operatif bulantı ve kusmanın önlenmesinde ve tedavisinde ondansetron hidroklorür dihidratın kullanımı ile ilgili sınırlı sayıda çalışma vardır. Diğer:Zayıf spartein/debrisokin metabolizması olan hastalar:4.3 Kontrendikasyonlarİlacın bileşimindeki maddelerden herhangi birine aşırı duyarlılık durumunda kullanılmamalıdır (bkz. Bölüm 6.1) Ondansetron hidroklorür dihidratın apomorfin hidroklorür ile eşzamanlı kullanımı şiddetli hipotansiyon ve bilinç kaybı bildirimleri nedeniyle kontrendikedir (bkz. Bölüm 4.5). 4.4 Özel kullanım uyarıları ve önlemleriDiğer selektif 5-HT3 reseptör antagonistlerine karşı aşırı duyarlılık gösteren hastalarda aşırı duyarlılık reaksiyonları rapor edilmiştir. Solunum reaksiyonları semptomatik olarak tedaviedilmelidir ve klinisyenler bu reaksiyonlara hipersensitivite reaksiyonlarının öncüleri olaraközellikle dikkat etmelidirler. Ondansetron hidroklorür dihidrat, doza bağlı bir şekilde QT aralığını uzatmaktadır (bkz. Bölüm 5.1) Ayrıca, ondansetron hidroklorür dihidrat kullanan hastalarda pazarlama sonrası Torsades dePointes vakaları bildirilmiştir. Konjenital uzun QT sendromu bulunan hastalarda ondansetronhidroklorür dihidrat kullanımından kaçınınız. Ondansetron hidroklorür dihidrat, elektrolitanomalileri, konjestif kalp yetmezliği, bradiaritmisi bulunan hastalarda, QT uzaması olan veyaQT uzaması gelişebilecek hastalarda veya QT uzamasına ya da elektrolit anomalilerine sebepolan diğer tıbbi ürünleri kullanan hastalarda dikkatli şekilde uygulanmalıdır. Hipokalemi ve hipomagnezemi, ondansetron hidroklorür dihidrat uygulaması öncesinde düzeltilmelidir. Ondansetron hidroklorür dihidrat ve diğer serotonerjik ilaçların (selektif serotonin geri alım inhibitörleri (SSRI) ve serotonin noradrenalin geri alım inhibitörleri (SNRI'lar) dahil)eşzamanlı kullanımını takiben serotonin sendromu (mental durumda değişiklik, otonomikinstabilite ve nöromusküler anormallikler dahil) tarif edilmiştir (bkz. Etkileşimler).Ondansetronhidroklorür dihidrat ve diğer serotonerjik ilaçlarla eşzamanlı tedavi klinik olarak gerekliolduğunda, hastaları yakın izlem altına almak tavsiye edilmektedir.Ondansetron hidroklorür dihidratın kalın bağırsaktan geçiş süresini uzattığı bilindiğinden, subakut bağırsak obstrüksiyonu belirtileri olan hastalar ondansetron hidroklorür dihidratuygulamasından sonra izlenmelidir. 4 / 17Adenotonsillektomi ameliyatları olan hastalarda bulantı ve kusmaları ondansetron hidroklorür dihidrat ile önlemek gizli kanamaları maskeleyebilir. Bundan dolayı, böyle hastalarondansetron hidroklorür dihidrat sonrası dikkatle takip edilmelidir. Pediyatrik popülasyon:Hepatotoksik kemoterapi gören pediyatrik hastalarda ondansetron hidroklorür dihidrat kullanılırken hepatik işlevler yakından izlenmelidir. Kemoterapi sonucu oluşan bulantı ve kusma(CINV): mg/kg bazında doz hesaplanır ve 4 saat aralıklarla üç doz uygulanırken toplam günlük doz, 5 mg/m2'lik tek bir doz ve arından bir oraldozun verilmesi ile karşılaştırıldığında daha yüksek olacaktır. Bu iki farklı doz uygulamarejiminin karşılaştırmalı etkililiği klinik çalışmalarda araştırılmamıştır. Çalışmalar arasıkarşılaştırma iki rejim için benzer etkililiği göstermektedir (bkz. Bölüm 5.1).Her 4 ml'de 23 mg'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez. Bu dozda sodyuma bağlı herhangi bir yan etki beklenmemektedir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriYaygın olarak birlikte uygulandığı ilaçların metabolizmasını artırdığına veya önlediğine dair herhangi bir kanıt bulunmamaktadır. Spesifik çalışmalar ondansetron hidroklorür dihidratınalkol, temazepam, furosemid, tramadol, alfentanil, morfin, lidokain, tiyopental ve propofol ilebirlikte uygulandığında farmakokinetik olarak etkileşmediğini göstermektedir. Ondansetron hidroklorür dihidrat multipl hepatik sitokrom P-450 enzimleri CYP3A4, CYP2D6 ve CYP1A2 tarafından metabolize olur. Bu metabolik enzimlerin ondansetron hidroklorürdihidratı metabolize etmedeki çeşitliliğinden dolayı, enzim inhibisyonu ya da bir enzimin düşükaktivitesi (örn, CYP2D6 genetik bozukluğu) normal olarak diğer enzimler tarafından telafiedilmektedir ve ondansetron hidroklorür dihidrat atılımında veya doz gereksiniminde çok azdeğişikliğe neden olmakta ya da herhangi bir değişikliğe neden olmamaktadır. Ondansetron hidroklorür dihidratın, QT aralığını uzatan ve/veya elektrolit anomalilerine sebep olan ilaçlarla eş zamanlı olarak uygulanması sırasında dikkatli olunmalıdır (bkz. Bölüm4.4). EMESET ile QT uzamasına yol açan ilaçların birlikte kullanılması QT uzamasına katkıda bulunur. EMESET ile birlikte kardiyotoksik ilaçların (örn. doksurubisin ve daunorubisin gibiantrasiklinler ya da trastuzumab), antibiyotiklerin (örn. eritromisin), antifungallerin (örn.ketakonazol), antiaritmikler (örn. amiodaron) ve beta blokörler (örn. atenolol veya timolol)kullanılması aritmi riskini artırabilir (bkz. Bölüm 4.4). Serotonerjik İlaçlar (örn; SSRI'lar ve SNRI'lar) Eşzamanlı ondansetron hidroklorür dihidrat ve seçici serotonin geri alım inhibitörleri (SSRI'lar) ve serotonin noradrenalin geri alım inhibitörleri (SNRI'lar) dahil olmak üzere diğer serotonerjikilaçları takiben serotonin sendromu (değişmiş ruhsal durum, otonom instabilite ve nöromüsküleranomaliler) tarif edilmiştir (bkz. Bölüm 4.4) ApomorfinOndansetron hidroklorür dihidratın apomorfin hidroklorür ile eşzamanlı kullanımı şiddetli hipotansiyon ve bilinç kaybı bildirimleri nedeniyle kontrendikedir. 5 / 17Fenitoin, Karbamazepin ve RifampisinCYP3A4'ün potent indükleyicileri (örn, fenitoin, karbamazepin ve rifampisin) ile tedavi edilen hastalarda, ondansetron hidroklorür dihidratın klerensi artmıştır ve ondansetron hidroklorürdihidratın kan konsantrasyon düzeyleri azalmıştır. TramadolKüçük ölçekli çalışmalardan elde edilen veriler ondansetron hidroklorür dihidratın tramadolün analjezik etkisini azalttığını belirtmektedir. Özel popülasyonlara ilişkin ek bilgiler Veri yoktur. Pediyatrik popülasyon Veri yoktur. 4.6 Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi: Gebeliğin l.trimesterında: D Gebeliğin 2.ve 3.trimesterında: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Gebelik testi: Çocuk doğurma potansiyeli bulunan kadınlarda ondansetron tedavisine başlamadan önce gebelik durumu doğrulanmalıdır. Kontrasepsiyon: Üreme potansiyeli olan kadınlar ondansetronun gelişmekte olan fetüse zarar verebileceği konusunda bilgilendirilmelidir. Cinsel olarak aktif üreme potansiyeli olan kadınların, tedavisırasında ve ondansetron ile tedaviyi bıraktıktan sonraki iki gün boyunca etkili doğum kontrolü(% 1'den daha az gebelik oranıyla sonuçlanan yöntemler) kullanmaları önerilir. Gebelik dönemi Epidemiyolojik çalışmalardan elde edilen insan deneyimine göre, ondansetronun, gebeliğin birinci trimesterında kullanıldığında, orofasiyal malformasyonlara neden olduğundanşüphelenilmektedir. 1,8 milyon gebeliğin dahil olduğu bir kohort çalışmada, ondansetronun birinci trimesterda kullanımı oral yarık riskinde (tedavi edilen her 10.000 kadın için 3 ilave vaka; düzeltilmişgöreceli risk 1,24 (%95 GA 1,03-1,48) artışla ilişkiliydi. Kardiyak malformasyonlara ait mevcut epidemiyolojik çalışmalar çelişkili sonuçlar göstermiştir. Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesi ile ilgili olarak doğrudan veya dolaylı zararlı etkiler göstermemektedir. Ondansetron, gebeliğin birinci trimesterinde kullanılmamalıdır. Gebeliğin ikinci ve üçüncü trimesterında ondansetron kullanımı önerilmemektedir. 6 / 17Sıçanlarda ve tavşanlarda yapılan üreme çalışmaları, fetüse zarar verdiğine dair kanıt göstermemiştir (bkz. Hayvan verileri). İnsan verileriABD'de yapılan üç epidemiyolojik çalışmada gebeliğin birinci trimesterında ondansetrona maruz kalan annelerin bebeklerinde orofasiyal yarıklar ve kardiyak malformasyonlar dahil spesifikkonjenital anomali riskleri değerlendirilmiştir. Ondansetrona maruz kalan 88.467 gebe kadında yapılan bir kohort çalışmasında kardiyak malformasyonlarda belirgin bir artış bulunmaksızın oral yarıklar riskinde (tedavi edilen her10.000 kadın için 3 ek vaka, düzeltilmiş göreceli risk (RR) 1,24 (%95 GA 1,03 - 1,48) artışgöstermiştir. İntravenöz yoldan ondansetrona maruz kalan 23.877 gebe kadında ayrı olarakyayımlanan bir alt grup analizinde, oral yarıklar veya kardiyak malformasyonların riskinde birartış bulunmamıştır. İki veri setindeki 23.200 vakayı içeren popülasyon-temelli doğum defektleri kayıtlarının kullanıldığı bir vaka kontrol çalışmasında bir veri setinde damak yarığı riski artarken, diğer verisetinde risk artışı gösterilmemiştir. Bu çalışmada kardiyak malformasyon riski artmamıştır. Ondansetrona maruz kalan 3.733 gebe kadında yapılan ikinci kohort çalışmasında ayarlanmış RR 1,7 (% 95 GA 1,0 - 2,9) ile ventriküler septal defekt riskinde artış bulunurken kardiyakmalformasyon riskinde istatistiksel olarak anlamlı bir artış bulunmamıştır. Hayvan verileriSıçanlarda ve tavşanlarda gerçekleştirilen embriyo-fetal gelişim çalışmalarında, gebe hayvanlara organogenez döneminde sırasıyla 15 mg/kg/gün ve 30 mg/kg/gün'e kadar oral ondansetrondozları uygulanmıştır. Tavşanlarda maternal vücut ağırlığı artışında hafif bir azalma dışında,ondansetronun maternal hayvanların veya yavruların gelişimi üzerinde önemli bir etkisiolmamıştır. Sıçanlarda 15 mg/kg/gün ve tavşanlarda 30 mg/kg/gün dozlarındaki maternal dozvücut yüzey alanına bağlı olarak sırasıyla önerilen maksimum 24 mg/gün insan oral dozununyaklaşık 6 ve 24 katı idi. Doğum öncesi ve sonrası gelişimsel toksisite çalışmasında gebesıçanlara gebeliğin 17. gününden yavrulamanın 21. gününe kadar 15 mg/kg/gün'e kadar oralondansetron verildi. Maternal vücut ağırlığında hafif bir düşüş dışında gebe sıçanlar ve çiftleşmişF1 jenerasyonunun üreme performansı dahil yavruların doğum öncesinde ve sonrasındakigelişimi üzerinde herhangi bir etkisi bulunmamıştır. Sıçanlarda 15 mg/kg/gün dozunda maternaldoz BSA'ya göre önerilen maksimum 24 mg/gün insan oral dozunun yaklaşık 6 katı idi. Laktasyon dönemiOndansetronun anne sütüne geçip geçmediği bilinmemektedir. Ondansetronun emzirilen çocuk üzerindeki etkileri veya ondansetronun süt üretimi üzerindeki etkileri hakkında veribulunmamaktadır. Bununla birlikte, ondansetronun emziren hayvanların (sıçanların) sütünegeçtiği gösterilmiştir. Bu nedenle, ondansetron kullanan anneler bebeklerini emzirmemelidir. Üreme yeteneği /FertiliteOndansetronun insan fertilitesi üzerindeki etkileri hakkında bilgi bulunmamaktadır. 4.7 Araç ve makine kullanımı üzerindeki etkilerPsikomotor testlerde ondansetron performansı etkilememiş ve sedasyona neden olmamıştır. 7 / 17Bu tür aktivitelerde ondansetronun farmakolojisinden beklenen zararlı etkiler gözlenmemiştir. 4.8 İstenmeyen etkilerSıklık sınıflandırması aşağıdaki gibidir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1.000 ila < 1/100), seyrek (>1/10.000 ila < 1/1.000), çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Çok yaygın, yaygın ve yaygın olmayan olaylar genellikle klinik deney çalışmalarından hesaplanmıştır. Plasebolardaki insidans hesaba katılmıştır. Seyrek ve çok seyrek olaylargenellikle satış sonrası spontan verilerden hesaplanmıştır. Aşağıdaki sıklıklar, endikasyon ve formülasyona göre ondansetron hidroklorür dihidratın önerilen standart dozlarında hesaplanmıştır. Çocuklarda ve yetişkinlerdeki advers olay profilleriyetişkinlerde görülenlerle karşılaştırılabilirdir. Bağışıklık sistemi hastalıklarıSeyrek: Bazen ağır olabilen ani aşırı duyarlılık reaksiyonları (anaflaksi dahil) Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı Yaygın olmayan: Nöbetler ve hareket bozuklukları (kalıcı klinik sekel kanıtı olmayan, distonik reaksiyonlar, okülojirik krizler ve diskinezi gibi ekstrapiramidal reaksiyonlar dahil)1Seyrek: Hızlı i.v. uygulama sırasında görülen sersemlik (birçok durumda infüzyon süresiuzatılarak önlenen veya düzelen) Göz hastalıklarıSeyrek: Ağırlıklı olarak i.v. uygulaması sırasında görülen geçici görme bozuklukları (Örn;bulanık görme)Çok seyrek: Ağırlıklı olarak intravenöz ondansetron hidroklorür dihidrat uygulaması sırasında geçici körlük2 Kardiyak hastalıklarYaygın olmayan: Aritmiler, göğüs ağrısı (ST segment depresyonu ile birlikte olan veya olmayan), bradikardi Seyrek: QT uzaması (Torsades de Pointes dahil) Vasküler hastalıklarYaygın: Hararet veya sıcak basması hissi Yaygın olmayan: Hipotansiyon Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Hıçkırık Gastrointestinal hastalıklarYaygın: Konstipasyon Hepatobiliyer hastalıklarYaygın olmayan: Karaciğer fonksiyon testlerinde asemptomatik artışlar3 8 / 17Deri ve deri altı doku hastalıklarıÇok seyrek: Toksik epidermal nekroliz dahil toksik deri döküntüsü Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Lokal i.v. enjeksiyon yeri reaksiyonları 1. Kalıcı klinik sekel yönünde istikrarlı kanıt olmaksızın gözlenmiştir.2. Bildirilen körlük vakalarının büyük kısmı ilk 20 dakika içerisinde kaybolmuştur. Çoğu hasta öncesindesisplatin dahil kemoterapi ajanları almıştır. Bazı geçici körlük olgularının kökende kortikal olduğubildirilmiştir.3. Bu olaylar yaygın olarak sisplatin ile kemoterapi gören hastalarda gözlemlenmiştir.Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9 Doz aşımı ve tedavisiBelirti ve semptomlarOndansetron hidroklorür dihidratın aşırı dozajı hakkında sınırlı bilgi vardır. Vakaların büyük çoğunluğundaki belirtiler, önerilen dozları alan hastalarda bildirilen belirtilere benzerdir(bkz. Bölüm 4.8). Görüş bozulması, şiddetli kabızlık, hipotansiyon ve geçici ikinci derece AVblok vazovagal vaka içeren belirtiler rapor edilmiştir. Ondansetron hidroklorür dihidrat, doza bağlı bir şekilde QT aralığını uzatmaktadır. Doz aşımı halinde, EKG ile izlenmesi önerilmektedir. Küçük çocuklarda oral doz aşımından sonra serotonin sendromu ile uyumlu vakalar bildirilmiştir. TedaviOndansetron hidroklorür dihidrat için spesifik bir antidot bulunmamaktadır, bu nedenle tüm şüpheli doz aşımı durumlarında uygun olduğu şekilde semptomatik ve destekleyici tedaviverilmelidir. Ek tedavi, klinik durum gerektirdiği ya da mevcut olduğu yerlerde ulusal zehir merkezi tarafından önerildiği şekilde olmalıdır. Ondansetron hidroklorür dihidrat ile doz aşımında, ondansetron hidroklorür dihidratın anti-emetik etkisi nedeniyle hastaların yanıt vermeleri olası olmadığından altınkökü kullanımı önerilmez. Pediyatrik popülasyonBebeklerde ve 12 ay ila 2 yaş arası çocuklarda kaza sonucu oral ondansetron hidroklorür dihidrat doz aşımlarından (4 mg/kg tahmini alımın üzerinde) sonra serotonin sendromu ile uyumlupediyatrik vakalar bildirilmiştir. 9 / 175. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antiemetikler ve bulantıyı önleyici ilaçlar, Selektif 5-HT3 reseptör antagonisti ATC kodu: A04AA01 Ondansetron hidroklorür dihidrat; güçlü, yüksek derecede selektif 5-HT3 reseptör antagonistidir. Kusma ve bulantıyı kontrol altına almaktaki etki mekanizması tam olarak bilinmemektedir.Kemoterapötik ajanlar ve radyoterapi incebağırsakta serotonin (5-HT) salıverilmesine nedenolarak 5-HT3 reseptörleri yoluyla vagal afferentleri aktive etmek suretiyle kusma refleksinibaşlatırlar. Ondansetron hidroklorür dihidrat bu refleksin başlamasını bloke eder. Vagal afferentlerin aktivasyonu, dördüncü ventrikül tabanına yerleşmiş area postrema bölgesinde de 5-HT salıverilmesine neden olabilir ve bu da merkezi mekanizmayla bulantıyı artırabilir.Bundan dolayı, ondansetron hidroklorür dihidratın sitotoksik kemoterapi ve radyoterapinedeniyle meydana gelen bulantı ve kusmayı kontrol altına almadaki etkisi muhtemelenperiferik ve merkezi sinir sisteminin her ikisinde de bulunan nöronlardaki 5-HT3 reseptörlerinibloke etmesinden ileri gelmektedir. Post operatif kusma ve bulantıdaki etki mekanizması bilinmemektedir fakat sitotoksik ajanlarla indüklenen bulantı ve kusma ile ortak bir yolu olabilir. Ondansetron hidroklorür dihidrat plazma prolaktin konsantrasyonlarını değiştirmez. Ondansetron hidroklorür dihidratın, opiat kaynaklı emezdeki rolü henüz kesinleştirilmemiştir. QT Uzaması Ondansetron hidroklorür dihidratın QTc aralığı üzerindeki etkisi, 58 sağlıklı yetişkin erkek ve kadın üzerinde gerçekleştirilen çift kör, randomize, plasebo ve pozitif (moksifloksasin) kontrollübir çapraz geçişli çalışmada değerlendirilmiştir. Ondansetron hidroklorür dihidrat dozları, 15dakikalık intravenöz infüzyonla uygulanan 8 mg ve 32 mg şeklinde idi. Test edilen en yüksekdozda (32 mg), başlangıca göre düzeltmenin ardından plaseboya kıyasla QTcF'de maksimumortalama fark (%90 CI üst sınırı) 19,6 (21,5) msn idi. Test edilen en düşük dozda (8 mg),başlangıca göre düzeltmenin ardından plaseboya kıyasla QTcF'de maksimum ortalama fark(%90 CI üst sınırı) 5,8 (7,8) msn idi. Bu çalışmada, 480 msn'den büyük bir QTcF ölçümü ve60 msn'den büyük bir QTcF uzaması oluşmamıştır. Klinik Çalışmalar Pediyatrik popülasyonKNBK Ondansetron hidroklorür dihidratın kanser kemoterapisi ile indüklenen kusma ve bulantının kontrolündeki etkililiği, 1 ila 18 yaşındaki 415 hastada yürütülen çift kör, randomize çalışmadadeğerlendirilmiştir (S3AB3006). Kemoterapi gününde, hastalar ya 5 mg/m IV ondansetronhidroklorür dihidrat ve 8 ila 12 saat sonra oral yolla 4 mg ondansetron hidroklorür dihidrat yada 0,45 mg/kg IV ondansetron hidroklorür dihidrat ve 8 ila 12 saat sonra oral yolla plasebo 10 / 17almıştır. Kemoterapi sonrası her iki grup da 3 gün boyunca günde iki kez 4 mg ondansetron hidroklorür dihidrat şurup kullanmıştır. Kemoterapinin en kötü gününde tam kusma kontrolü%49 (5 mg/m IV ve 4 mg oral ondansetron hidroklorür dihidrat) ve %41'dir (0,45 mg/kg IVve oral plasebo). Kemoterapi sonrası her iki grup da 3 gün boyunca günde iki kez 4 mgondansetron hidroklorür dihidrat şurup kullanmıştır. İki tedavi grubu arasında adversolayların genel insidansı veya yapısı açısından bir fark yoktur. 1 ila 17 yaşındaki 438 hastada yürütülen çift kör randomize plasebo kontrollü bir çalışma (S3AB4003) kemoterapinin en kötü gününde aşağıdaki oranlarda tam kusma kontrolügöstermiştir: Ondansetron hidroklorür dihidrat 2 ila 4 mg oral deksametazon ile birlikte 5 mg/m2'likIVdozda intravenöz yolla uygulandığında hastaların %73'ü. Ondansetron hidroklorür dihidrat kemoterapi günlerinde 2 ila 4 mg'lık oral deksametazonile birlikte 8 mg'lık bir dozda şurup olarak uygulandığında hastaların %71'i. Kemoterapi sonrasında her iki grup da 2 gün boyunca günde iki kez 4 mg ondansetron hidroklorür dihidrat şurup kullanmıştır. İki tedavi grubu arasında advers olayların insidansıveya yapısı açısından bir fark yoktur. 6 ila 48 aylık 75 çocukta ondansetron hidroklorür dihidratın etkililiği, açık etiketli, karşılaştırmalı olmayan, tek kollu bir çalışmada araştırılmıştır (S3A40320). Tüm çocuklarkemoterapi başlatılmadan önce 30 dakikada ve ilk dozdan 4 ve 8 saat sonra yeniden IV yollauygulanan 0,15 mg/kg'lık üç doz ondansetron hidroklorür dihidrat almıştır. Tam kusmakontrolü hastaların %56'sında elde edilmiştir. Bir diğer açık etiketli, karşılaştırmalı olmayan, tek kollu çalışmada (S3A239) <12 yaşındaki çocuklar için 4 mg ve >12 yaşındaki çocuklar için oral 8mg'lık iki doz ondansetron hidroklorürdihidrat takiben ettiği 0,15 mg/kg'lık bir IV ondansetron hidroklorür dihidrat dozunun etkililiğiaraştırılmıştır (toplam çocuk sayısı n = 28). Tam kusma kontrolü hastaların %42'sinde eldeedilmiştir. Postoperatif bulantı ve kusma Ameliyat sonrası bulantı ve kusmanın önlenmesinde tek doz ondansetron hidroklorür dihidrat etkililiği, 1 ila 24 aylık 670 çocukta yürütülen randomize, çift kör, plasebo kontrollü birçalışmada araştırılmıştır (kavrama yeteneği elde edildikten sonraki yaş >44 hafta, kilo >3 kg).Dahil edilen gönüllülere genel anestezi altında elektif ameliyat randevusu verilmiş olup, ASAdurumu <III'tür. Anestezinin başlatılmasını takiben beş dakika içinde 0,1 mg/kg'lık tek bir dozondansetron hidroklorür dihidrat uygulanmıştır. 24 saatlik değerlendirme periyodu sırasında(ITT) en az bir kusma epizodu yaşayan gönüllü oranı, plasebo kullananlarda ondansetronhidroklorür dihidrat kullananlardan daha yüksektir (%11'e karşı %28, p<0,0001). Genel anestezi yaptıran 1469 erkek ve kadın hastada (2 ila 12 yaş) dört çift kör, plasebo kontrollü çalışma yürütülmüştür. Hastalar ya tekli ondansetron hidroklorür dihidrat dozlarına (40kg ya da daha düşük ağırlıktaki pediyatrik hastalar için 0,1 mg/kg, 40 kg'dan fazla pediyatrikhastalar için 4 mg; hasta sayısı = 735)) ya da plaseboya (hasta sayısı = 734) randomizeedilmiştir. Çalışma ilacı anestezinin başlatılmasından hemen önce ya da sonra en az 30 saniyedeuygulanmıştır. Ondansetron hidroklorür dihidrat bulantı ve kusmanın önlenmesindeplasebodakinden anlamlı olarak daha etkilidir. Bu çalışmaların bulguları Tablo 3'teözetlenmektedir. 11 / 17Tablo 3 Pediyatrik hastalarda postoperatif bulantı ve kusmanın önlenmesi ve tedavisi -24 saatte tedavi yanıtı
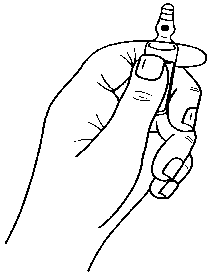
5.2. Farmakokinetik özellikler Genel ÖzelliklerEmilim:Ondansetron hidroklorür dihidratın intramüsküler veya intravenöz uygulamasını takiben sistemik maruz kalma düzeyleri eşdeğerdir. Oral uygulama sonrasında ondansetron hidroklorür dihidrat, gastrointestinal sistemden pasif bir şekilde ve tam olarak absorbe olur ve ilk geçiş metabolizmasına tabidir. 8 mg'lık bir dozdanyaklaşık 1,5 saat sonra yaklaşık 30 ng/mL pik plazma konsantrasyonları elde edilir. 8 mg'ınüzerindeki dozlar için ondansetron hidroklorür dihidratın doz ile sistemik maruziyetindeki artış,oransaldan daha yüksektir; bu durum daha yüksek oral dozlarda ilk geçiş metabolizmasında birmiktar azalma olduğunu gösteriyor olabilir. Sağlıklı gönüllülerde 8 mg tabletlerin oraluygulamasını takiben ortalama biyoyararlanım yaklaşık %55 ila %60'dır. Biyoyararlanım, oraluygulama sonrasında yiyecek ile hafif artar fakat antiasit ilaçlardan etkilenmez. Sağlıklı yaşlıgönüllülerdeki çalışmalar ondansetron hidroklorür dihidratın gerek biyoyararlanımında (%65)gerekse yarılanma ömründe (5 saat) hafif fakat klinik açıdan anlamlı, yaşla ilişkili artışlargöstermiştir. Dağılım:Oral, intravenöz ve intramüsküler dozlardan sonra ondansetron hidroklorür dihidratın dizpozisyonu, yaklaşık 3 saatlik terminal yarılanma ömrü ve yaklaşık 140 L'lik kararlı durumdağılım hacmi ile benzerdir. Ondansetron hidroklorür dihidratın intramüsküler ve intravenözuygulanmasından sonra eşdeğer sistemik maruziyet elde edilir. Ondansetron hidroklorür dihidratın 5 dakika süreyle verilen 4 mg'lık intravenöz infüzyonu, yaklaşık 65 ng/ml'lik pik plazma konsantrasyonları verir. Ondansetron hidroklorür dihidratınintramüsküler uygulamasını takiben, enjeksiyondan sonraki 10 dakika içerisinde yaklaşık 25ng/ml'lik pik plazma konsantrasyonları elde edilir. Biyotransformasyon:Ondansetron hidroklorür dihidrat sistemik dolaşımdan, çeşitli enzimatik yolaklar aracılığıyla başlıca hepatik metabolizma ile uzaklaştırılır. CYP2D6 enzimi eksikliğinin (debrisokinpolimorfizmi) ondansetron hidroklorür dihidratın farmakokinetiğine etkisi yoktur. 12 / 17Eliminasyon:Ondansetron hidroklorür dihidrat yüksek oranda (%70-76) proteine bağlanmaz. Ondansetron hidroklorür dihidrat sistemik dolaşımdan çoklu enzimatik yolak aracılığıyla ağırlıklı olarakhepatik metabolizma yoluyla temizlenir. Emilen dozun %5'inden azı değişmeden idrarla atılır.CYP2D6 enziminin yokluğu (debrisokuin polimorfizmi), ondansetronun farmakokinetiğinietkilemez. Ondansetron hidroklorür dihidratın farmakokinetik özellikleri tekrarlı dozlarladeğişmez. Hastalardaki karekteristik özelliklerCinsiyet:Ondansetron hidroklorür dihidrat dağılımında cinsiyette farklılıklar gösterilmiş olup, kadınlarda oral dozu takiben emilim daha hızlı ve fazladır; sistemik klerens ve dağılım hacmi (ağırlık içinayarlanan) azdır. Çocuklar ve Gençler (1 aydan 17 yaşa kadar):1-4 aylık pediyatrik hastalarda (n=19) yapılan cerrahi, ağırlığa bağlı klerens 5-24 aylık (n=22) hastalardakinden, yaklaşık %30 daha azdır fakat 3-12 yaşlarındaki hastalarla karşılaştırılabilirdir.1-4 aylık hasta popülasyonundaki yarı ömür 5-24 aylık hastalardaki 2,9 saat ve 3-12 yaşaralığı ile karşılaştırıldığında ortalama 6,7 saat olarak rapor edilmiştir. 1-4 aylık hastapopülasyonundaki farmakokinetik parameterelerdeki farklılıklar ve ondansetron hidroklorürdihidrat gibi suda çözünebilen ilaçlar için yüksek dağılım hacmi, yenidoğanlardaki vebebeklerdeki total vücut suyunun yüksek yüzdesi ile açıklanabilir. Genel anestezi altında elektif cerrahi uygulanan 3-12 yaş arası hastalarda ondansetron hidroklorür dihidratın klerensinin ve dağılım hacminin mutlak değerleri yetişkin hastalarlakarşılaştırıldığında azalmıştır. Kilo ve 12 yaş ile iki parametre de lineer olarak artmış, değerlergenç yetişkinlerinkine yaklaşmıştır. Klerens ve dağılım hacmi değerleri vücut ağırlığıylanormale döndürüldüğünde, bu parametreler için değerler farklı yaş grubu popülasyonlarıarasında benzer olmuştur. Yaşa bağlı değişiklikleri kiloya bağlı doz uygulaması kompanse ederve pediyatrik hastalarda sistemik maruziyeti normalize etmede etkilidir. Popülasyon farmakokinetik analizleri ondansetron hidroklorür dihidratın i.v. uygulamasını takiben 1 ay-44 yaş arası 428 kişide (kanser hastaları, cerrahi hastaları ve sağlıklı gönüllüler)uygulanmıştır. Bu analize dayanarak, oral ya da i.v. dozu takiben 1-4 aylık bebekler hariç,çocuklarda ve yetişkinlerdeki ondansetron hidroklorür dihidratın sitemik maruziyeti (EAA)yetişkinlerinkiyle kıyaslanabilirdir. Dağılım hacmi yaşa bağlıdır ve yetişkinlerde bebeklere veçocuklara oranla daha düşüktür. Klerens kiloya bağlıdır fakat 1-4 aylık bebekler haricinde yaşabağlı değildir. 1-4 aylık bebeklerde yaşa bağlı klerenste ek bir azalma olup olmadığı veya kişisayısının azlığına bağlı doğal bir değişkenlik olduğu konusunda bir sonuca varmak zordur. 6aydan küçük yaştaki hastalar CSBK (Cerrahi sonrası bulantı ve kusma)'da sadece tek dozondansetron hidroklorür dihidrat alacağından, klinik olarak bağlantılı olan düşük klerens olasıdeğildir. Yaşlılar:Sağlıklı yaşlı gönüllülerde yürütülen erken Faz I çalışmalar, klerenste bir miktar yaşla ilişkili azalma ve ondansetron hidroklorür dihidratın yarılanma ömründe bir artış göstermiştir. Bununlabirlikte, gönüllüler farklı yaş gruplarından seçilmiştir: Genç (<65 yaşındaki) ve yaşlı gönüllüler 13 / 17(>65 yaş) arasında farmakokinetik parametrelerde dikkate değer bir çalışma ile sonuçlanmış olup, KNBK klinik çalışmalarına kaydedilen genç ve yaşlı kanser hastaları arasında güvenlilikveya etkililikte yaşlılar için farklı bir doz uygulama önerisini destekleyecek genel farklargözlenmemiştir. Daha güncel ondansetron hidroklorür dihidrat plazma konsantrasyonları ve maruziyet-yanıt modellemesine dayalı olarak, genç yetişkinlere kıyasla >75 yaşındaki hastalarda QTcF üzerindedaha büyük bir etki öngörülmektedir. 65 yaş ve 75 yaş üzerindeki hastalarda intravenöz dozlamaiçin spesifik doz uygulama bilgileri sunulmaktadır (bkz. Bölüm 4.2 - Kemoterapi ve Radyoterapiile İndüklenen Bulantı ve Kusma Bölümü - Yaşlılar).BöbrekYetmezliği:Böbrek yetmezliği (kreatinin klerensi 15-60 ml/dakika) olan hastalarda, ondansetron hidroklorür dihidratın i.v. uygulamasından sonra hem sistemik klerens hem de dağılım hacmi azalmakta, buda eliminasyon yarılanma ömründe hafif klinik açıdan anlamlı olmayan bir artış ilesonuçlanmaktadır (5,4 saat). Düzenli hemodiyaliz gerektiren şiddetli böbrek bozukluğu olanhastalar ile gerçekleştirilen bir çalışma (diyalizler arası çalışma) ondansetron hidroklorürdihidratın farmakokinetiğinin intravenöz uygulama sonrasında temelde değişmediğinigöstermektedir. Karaci ğerY etmezli ği:Şiddetli karaciğer bozukluğu olan hastalarda oral, intravenöz veya intramüsküler uygulama sonrasında ondansetron hidroklorür dihidratın sistemik klerensi, uzayan eliminasyon yarılanmaömürleri (15-32 saat) ve pre-sistemik metabolizma nedeniyle %100'e yaklaşan oralbiyoyararlanım ile belirgin şekilde azalır. 5.3 Klinik öncesi güvenlilik verileriKopyalanmış insan kardiyak iyon kanallarındaki bir çalışmada ondansetron hidroklorür dihidratın klinik olarak ilgili konsantrasyonlarda hERG potasyum kanallarını bloke ederekkardiyak repolarizasyonu etkileme potansiyeli olduğu gösterilmiştir. İnsan gönüllülerdeyürütülen kapsamlı QT çalışmasında doza bağımlı QT uzaması gözlenmiştir (bkz., Bölüm 5.1 -QT uzaması).Üreme toksisitesi: Bkz. Bölüm 4.6 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSodyum klorür Sitrik asitSodyum sitratEnjeksiyonluk su 6.2 GeçimsizliklerOndansetron hidroklorür dihidrat enjeksiyonu başka herhangi bir ilaçla beraber aynı şırınga veya infüzyon ile uygulanmamalıdır. Ondansetron hidroklorür dihidrat enjeksiyonu sadece tavsiye edilen solüsyonlarla karıştırılarak yapılmalıdır. 14 / 176.3 Raf ömrü24 ay Seyreltilen çözelti 2-8 °C'de buzdolabında saklanması koşulu ile 24 saat içinde kullanılmalıdır. 6.4 Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Işıktan koruyunuz 6.5 Ambalajın niteliği ve içeriğiKutuda; şeffaf, renksiz, steril 4 mL çözelti içeren 5 ml kırmızı OPC'li- siyah halkalı Tip I şeffaf cam ampul, 1 adet 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. Özel hazırlama talimatlarıAmpul formülasyonları korumalı değildir ve sadece bir kez kullanılmalıdır, açtıktan hemen sonra enjekte ya da dilüe edilmelidir, beklemiş çözeltiler dökülmelidir. Ondansetron hidroklorür dihidrat enjeksiyon ampulleri otoklav işlemine tabi tutulmamalıdır. Intravenöz sıvılarla geçimliliği:Ondansetron hidroklorür dihidrat enjeksiyon ancak tavsiye edilen infüzyon sıvıları ile karıştırılmalıdır. İntravenöz çözeltiler "iyi farmasötik pratik"usullerine uygun olarak infüzyon zamanında hazırlanıp bekletilmeden kullanılmalıdır. Bununlaberaber, ondansetron hidroklorür dihidrat enjeksiyonun oda temperatüründe (25°C'nin altında),fluoresan ışığı altında veya bir soğutucuda aşağıdaki intravenöz infüzyon çözeltileri ile birlikte 7gün stabil olduğu gösterilmiştir:Sodyum Klorür İntravenöz İnfüzyonu BP %0,9 a/h,Glukoz İntravenöz İnfüzyonu BP % 5 a/h, Mannitol İntravenöz İnfüzyonu BP % 10 a/h, Ringers İntravenöz İnfüzyonu, Potasyum Klorür % 0,3 a/h ve Sodyum Klorür % 0,9 a/h İntravenöz İnfüzyonu BP, Potasyum Klorür % 0,3 a/h ve Glukoz % 5 a/h İntravenöz İnfüzyonu BP. Polivinil klorür infüzyon torbaları ve polivinil klorür uygulama setleri ile geçimlilik çalışmaları yapılmıştır. Polietilen infüzyon torbalarında ve tip 1 cam şişelerde de yeterli stabilite sağlanacağıdüşünülmektedir. Ondansetron hidroklorür dihidrat çözeltilerinin % 0,9 a/h sodyum klorürdeveya % 5 a/h glukoz çözeltilerinde polipropilen şırıngalarda stabil olduğu gösterilmiştir. Geçimliolduğu diğer infüzyon çözeltileri ile seyreltilmiş ondansetron hidroklorür dihidrat infüzyonununpolipropilen şırıngalarda stabil olacağı düşünülmektedir. Not:İnfüzyon sıvıları ile EMESET enjektabl karışımları hazırlandıktan sonra uzun süre saklanmak istendiğinde, karıştırma işlemi uygun aseptik koşullarda yapılmalıdır.Diğer ilaçlarla geçimliliği:Ondansetron hidroklorür dihidrat bir infüzyon torbası veya şırınga pompasıyla 1 mg/saat dozunda intravenöz infüzyon şeklinde verilebilir. Aşağıdaki ilaçlarondansetron hidroklorür dihidrat verme setinin Y- kısmından ondansetron hidroklorürdihidratın 16-160 mikrogram/ml (örn. sırasıyla; 8 mg/500 ml ve 8 mg/50 ml) konsantrasyonları15 / 17ile beraber verilebilir. Sisplatin:5-fluorourasil:Karboplatin:Etoposid:Seftazidim:Siklofosfamid:Doksorubisin:Deksametazon:Deksametazon sodyum fosfat 20 mg yavaşintravenöz enjeksiyon şeklinde 2-5 dakika süreyle geçimli olduğu 50-100 ml infüzyon sıvısındaseyreltilmiş 8 veya 16 mg ondansetron hidroklorür dihidratı yaklaşık 15 dakikada vereninfüzyon setinin Y kısmından verilebilir. Deksametazon sodyum fosfat ve ondansetronhidroklorür dihidratın geçimliliği, bu ilaçları aynı verme setinden 32 mikrogram-2,5 mg/mldeksametazon sodyum fosfat ve 8 mikrogram-1 mg/ml ondansetron hidroklorür dihidratkonsantrasyonlarında verilerek gösterilmiştir.Ampul açma talimatlarıAmpuller OPC (Tek Kırma Noktası) açma sistemi ile donatılmışlardır ve aşağıdaki talimatlar doğrultusunda açılmalıdırlar: Ampulü, resim 1 'de gösterildiği gibi alt kısmından tutunuz. Resim 2'de gösterildiği gibi diğer elinizin başparmağını ampuldeki renkli noktaya bastırınız.
Şekil 2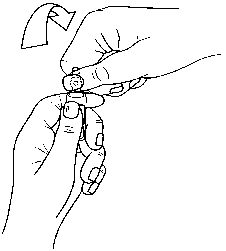 16 / 177. RUHSAT SAHİBİKoçak Farma İlaç ve Kimya Sanayi A.Ş. Mahmutbey Mah. 2477. Sok. No:23 Bağcılar / İstanbulTel: (0212) 410 39 50Faks: (0 212) 447 61 65 8. RUHSAT NUMARA SI(LARI)2015/797 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 30.09.2015 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ17 / 17 |
İlaç BilgileriEmeset 8mg/4ml Im/iv Enjeksiyonluk Çözelti İçeren AmpulEtken Maddesi: Ondansetron Hidroklorür Dihidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.