Depakin % 20 Oral Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8. Şüpheli advers reaksiyonların raporlanması. 1. BEŞERİ TIBBİ ÜRÜNÜN ADIDEPAKİN % 20 oral çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:100 ml çözeltide: Sodyum valproat 20 g Yardımcı madde(ler):Sodyum hidroksit km (pH ayarı için) Yardımcı maddeler için 6.1'e bakınız 3. FARMASÖTİK FORMOral çözelti Kokusuz, renksiz veya çok hafif sarı renkte berrak sıvı 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarJeneralize veya fokal nöbetler: - Jeneralize nöbetler: Absans nöbetleri, jeneralize tonik-klonik nöbetler, miyokloniknöbetler, - Fokal nöbetler: Basit veya kompleks nöbetler, - Sekonder jeneralize nöbetler, - Mikst nöbetlerde tek başına veya diğer antiepileptik ilaçlar ile kombinasyon halinde kullanılmalıdır. - Bipolar bozukluk manik epizodlarının tedavisinde endikedir. Manik epizod sonrası tedaviyecevap veren hastalarda sürdürüm tedavisi olarak kullanılabilir. 4.2. Pozoloji ve uygulama şekliKız çocukları ve çocuk doğurma potansiyeli olan kadınlar:Valproat tedavisi epilepsi ya da bipolar bozukluk tedavisinde deneyimli bir uzman doktor tarafından başlatılmalı ve izlenmelidir. Valproat, diğer tedaviler etkisiz değilse ve tolere edilebiliyorsa, kız çocukları ve çocuk doğurma potansiyeli olan kadınlarda kullanılmamalıdır. Böyle bir durumda valproat,Valproat Gebelik Önleme Programı doğrultusunda reçete edilerek kullanılır (Bkz.Bölüm 4.3 ve 4.4). 1/22 Pozoloji/ uygulama sıklığı ve süresi:Günlük doz hastanın yaşı ve vücut ağırlığı dikkate alınarak düzenlenmelidir ve kişiden kişiye değişen cevap göz önünde bulundurulmalıdır. Günlük doz, serum konsantrasyonu ve terapötiketki arasında net bir ilişki kurulamadığından ,optimum doz klinik cevaba göre saptanmalıdır.Eğer nöbetlerin kontrolü yeterli düzeyde değilse veya advers etkilerden şüphe ediliyorsa,klinik takibe ek olarak valproik asidin plazma düzeyinin saptanması düşünülebilir. Bildirilenetkili plazma düzeyi genelde 40-100 mg/litre (300-700 pmol/litre)'dir.Sodyum valproat tedavisine başlama (oral uygulama): - Başka bir antiepileptik uygulanmayan hastalarda doz 2-3 gün aralarla artırılarak bir haftaiçinde optimum doza ulaşılır. - Bir başka antiepileptik ile tedaviden sodyum valproat tedavisine geçerken, iki hafta içindeyavaş yavaş sodyum valproat dozunu artırarak optimum doz ayarlanmalı ve diğer preparatlarlatedavi azaltılarak kesilmelidir. - Eğer gerekiyorsa başka bir antiepileptik ilavesi yavaş yavaş doz artırılarak yapılmalıdır (Bkz.Bölüm 4.5). Pozoloji:Başlangıç dozu genellikle günde 10-15 mg/kg olup, daha sonra optimum dozaja kadar çıkılır (bakınız "Sodyum valproat tedavisine başlama"). 24 saatlik ortalama doz: - Süt çocukları ve çocuklarda 30 mg/kg; (oral çözelti formu tercih edilmelidir) ; - Ergenlik çağındaki çocuklar ve erişkinlerde 20-30 mg/kg (enterik kaplı tablet, Chrono formutercih edilmelidir). Bipolar bozukluklara bağlı maninin önlenmesi ve tedavisinde:Tavsiye edilen başlangıç dozu günde 20 mg/kg sodyum valproattır. İstenilen klinik etkinliği sağlayacak minimum terapötik doza ulaşmak için doz mümkün olduğunca çabuk artırılmalıdır. Bipolar bozuklukların idame tedavisi için tavsiye edilen doz günde 1000 mg ila 2000 mg arasındadır. İstisnai durumlarda, doz günde 3000 mg'dan fazla olmayacak şekilde artırılabilir.Dozlar bireysel klinik cevaba göre ayarlanmalıdır. Profilaktik tedavi en düşük etkin doz ile kişiye özel olarak uygulanmalıdır. Depakin Oral Çözeltinin ambalajında dereceli bir dozaj enjektörü mevcuttur. Dozaj enjektörünün toplam hacmi 2 ml'dir. 2 ml, 400 mg doza karşılık gelmektedir. Enjektör mg (50-100-150-200-250-300-350-400 mg) olarak dozları gösterecek şekilde derecelendirilmiştir. Dozaj enjektörü Depakin Oral Çözelti için spesifik olarak derecelendirildiğinden başka ilaç tedavilerinde kullanılmamalıdır. Uygulama şekli:Oral çözelti sadece kutuda yer alan pembe pistonlu dozaj enjektörü ile uygulanır. Günlük doz tercihen yemeklerle verilmelidir. - 1 yaşından küçük hastalarda 2 defada - 1 yaşından büyük hastalarda 3 defada Çözelti suyla veya meyve suyuyla (gazlı olmayan içeceklerle) karıştırılarak içilmelidir. 2/22
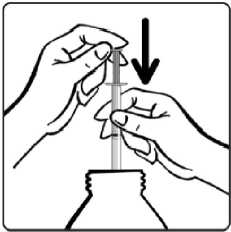
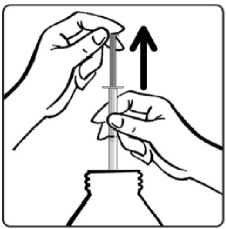
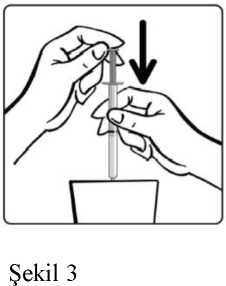
Şişenin kapağını açınız. Dereceli dozajenjektörünü şişenin içinedaldırınız.Dereceli dozaj enjektörünü doldurunuz.Enjektörün pistonunu, reçetede (miligram olarak)yazılı doza ayarlanacakşekilde itiniz.Günlük dozlardan birinin yanlışlıkla atlandığı, her zamanki uygulama saatinden kısa süre sonra farkedilirse, atlanan doz hemen alınabilir. Ancak dozun atlandığı, bir sonraki dozdankısa süre önce farkedilmişse, atlanan dozu telafi etmek için, dozun iki katı alınmamalıdır.Birden fazla dozun atlanması halinde ise, hemen doktora başvurulmalıdır. Tedavi düzenli olarak sürdürülmeli, doktora danışılmadan herhangi bir değişiklik yapılmamalı veya kesilmemelidir. Tedavinin kademeli olarak kesilmesi gerekir. Tedavinin birdenbirebırakılması (veya dozun büyük oranda azaltılması), nöbetlerin yeniden ortaya çıkmasına nedenolabilir. Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:Aynı metabolik yolu kullandıkları için DEPAKİN ve salisilatlar aynı anda kullanılmamalıdır (Bkz. Bölüm 4.4 ve Bölüm 4.8). Valproik asidin de tedavilerine dahil olduğu hastalarda, ölümle sonuçlanabilen karaciğer yetmezliği dahil, karaciğer fonksiyon bozukluğu ortaya çıkmıştır (Bkz. Bölüm 4.3 ve Bölüm4.4). Salisilatlar 16 yaşın altındaki çocuklarda kullanılmamalıdır (Bkz. Aspirin/salisilat ürün bilgisi - Reye Sendromu). Bunun yanı sıra, 3 yaşın altındaki çocuklarda DEPAKİN ile birliktekullanım, karaciğer toksisitesi riskini artırabilir. Böbrek yetmezliği:Dozajın azaltılması gerekebilir. Plazma konsantrasyonlarının takibi yanıltıcı olabileceğinden, dozaj klinik takibe göre ayarlanmalıdır (Bkz. Bölüm 5.2) Pediyatrik popülasyon:11 yaşın altındaki çocuklarda kullanıma en uygun oral form, oral solüsyondur. Kompleks parsiyel nöbetlerde 10 yaş ve yukarısı için kullanılmalıdır. 3/22 Bipolar bozukluklara bağlı maninin önlenmesi ve tedavisi: Valproatın bipolar bozukluklara bağlı maninin önlenmesi ve tedavisindeki güvenliliği ve etkililiği 18 yaşın altındaki hastalarda değerlendirilmemiştir. Geriyatrik popülasyon:Yaşlılarda sodyum valproatın farmakokinetiği değişiyorsa da klinik önemi sınırlıdır ve dozaj nöbetlerin kontrolüne göre düzenlenmelidir. 4.3. KontrendikasyonlarDEPAKİN'in aşağıdaki durumlarda kullanımı kontrendikedir: - Uygun bir alternatif tedavinin mevcut olması durumunda hamilelikte (Bkz. Bölüm 4.4 ve4.6) - Gebelik Önleme Programı koşulları yerine getirilmediği takdirde çocuk doğurmapotansiyeli olan kadınlarda (Bkz. Bölüm 4.4 ve 4.6) - Valproat, valproat semisodyum, valpromid veya ilaç içindeki yardımcı maddelere karşıaşırı duyarlılık hikayesi olanlarda - Akut hepatit - Kronik hepatit - Kişide veya ailede özellikle ilaca bağlı ağır hepatit hikayesi (Child Pugh C) - Hepatik porfiri - Üre döngüsündeki enzim eksikliği (Bkz. Bölüm 4.4) - Mitokondrial enzim polimeraz y (POLG) enzimini kodlayan nükleer gende mutasyonunneden olduğu mitokondrial hastalığı (örneğin, Alpers-Huttenlocher Sendromu) olanhastalarda ve POLG ile ilişkili bozukluk şüphesi olan 2 yaşından küçük çocuklarda (Bkz.Bölüm 4.4) - St. John's Wort (Sarı kantaron) ile birlikte kullanımı kontrendikedir (Bkz. Bölüm 4.5). 4. 4. Özel kullanım uyarıları ve önlemleriÖzel uyarılarGebelik Önleme ProgramıValproat, yüksek teratojenik potansiyele sahiptir ve uterusta valproata maruz kalan çocuklarda konjenital malformasyon ve nörogelişimsel bozukluk riski yüksektir (Bkz.bölüm 4.6). Valproat, kız çocuklarında ve çocuk doğurma potansiyeli bulunan kadınlardayalnızca diğer tedaviler etkisiz olduğunda ya da tolere edilemediğinde kullanılmalıdır.Başka bir tedavi imkanı yoksa, aşağıdaki Gebelik Önleme Programı'na uyulmalıdır. DEPAKİN aşağıdaki durumlarda kontrendikedir: - Uygun bir alternatif tedavinin mevcut olması durumunda gebelikte (Bkz. Bölüm 4.3 ve4.6) - Gebelik Önleme Programı koşulları yerine getirilmediği sürece çocuk doğurmapotansiyeli bulunan kadınlarda (Bkz. Bölüm 4.3 ve 4.6) Gebelik Önleme Programının KoşullarıBu ilacı reçete edenler aşağıdakileri sağlamalıdır:- Her olguda hastayı da tartışmaya dahil ederek hastanın katılımını garanti etmek, tedavi seçeneklerini ele almak ve hastanın riskleri ve bu riskleri azaltmak için 4/22 gereken önlemleri anlamasını sağlamak için bireysel koşullar değerlendirilmelidir. - Tüm kadın hastalar için gebelik potansiyeli değerlendirilmelidir. - Hasta, konjenital malformasyon ve nörogelişimsel bozukluk riskini ve bu risklerinuterusta valproata maruz kalan çocuklardaki etkisini anlamalı ve kabul etmelidir. - Hasta, gerektiği şekilde tedaviden önce ve tedavi sırasında gebelik testi yaptırmasıgerektiğini bilmelidir. - Hastaya doğum kontrolü hakkında tavsiyede bulunulmalı ve hasta valproat ileyapılan tüm tedavi süresince kesintisiz olarak etkili bir doğum kontrolü yöntemi(daha fazla ayrıntı için bu uyarı kutusunun doğum kontrolüne ilişkin alt bölümünebakınız) kullanma zorunluluğuna uyabilmelidir. - Hasta, epilepsi yönetiminde deneyimli bir uzman tarafından tedavinin düzenli (enaz yılda bir) olarak incelenmesi gerektiğini bilmelidir. - Hasta, konunun zamanında ele alınması için ve gebe kalmadan ve doğum kontrolübırakılmadan önce alternatif tedavi seçeneklerine geçilebilmesi amacıyla gebelikplanlar planlamaz doktoruna danışması gerektiğini bilmelidir. - Hasta, gebelik durumunda derhal doktoruna danışması gerektiğini bilmelidir. - Hasta, hasta bilgilendirme kılavuzu almalıdır. - Hasta, valproat kullanımı ile ilgili tehlikeleri ve alınması gereken önlemlerianladığını onaylamalıdır (Yıllık Risk Onaylama Formu) Yukarıdaki koşullar aynı zamanda, reçete edenlerin gebelik riski bulunmadığını gösterecek çok güçlü nedenler mevcut olduğunu söylemedikleri sürece, cinsel olarak aktif olmayankadınlar için de geçerlidir. Kız çocukları- Reçete edenler, kız çocuklarının ebeveynlerinin/bakıcılarının valproat kullanançocuklarında menarş görüldüğü takdirde bir uzmanla görüşmeleri gerektiğinianlamalarını sağlamalıdır. - Reçete edenler, menarş görülen kız çocuklarının ebeveynlerine/bakıcılarınakonjenital malformasyon ve nörogelişimsel bozukluk riskleri ve bu risklerinvalproata uterusta maruz kalan çocuklardaki etkisi üzerine kapsamlı bilgiverilmesini sağlamalıdır. - Menarş görülen hastalarda, reçete yazan uzman valproat tedavisi gerekliliğini heryıl tekrar değerlendirmeli ve alternatif tedavi seçeneklerini düşünmelidir. Tekuygun tedavi valproat tedavisi ise, etkili bir doğum kontrol yöntemi gerekliliği veGebelik Önleme Programının diğer tüm şartları tartışılmalıdır. Ergenliğe veyayetişkinliğe girmeden önce uzman tarafından kız çocuklarının alternatif birtedaviye geçirilmesi için her türlü çaba gösterilmelidir. Gebelik testiValproat ile tedaviye başlamadan önce gebelik dışlanmalıdır. Gebelikte istenmeyen kullanımdan kaçınmak için en az 25 mIU / ml'lik bir duyarlılıktaki plazma gebeliktestinden sağlık mesleği mensubu tarafından doğrulanmış negatif bir sonuç alınmadığıtakdirde çocuk doğurma potansiyeli olan kadınlarda valproat ile tedaviye başlanmamalıdır. Bu gebelik testi, tedavi sırasında düzenli aralıklarla tekrarlanmalıdır._
5/22 Doğum kontrolüValproat reçete edilmiş çocuk doğurma potansiyeli olan kadınlar, valproat ile tedavi sırasında ara vermeden etkili bir doğum kontrol yöntemi kullanmalıdır. Bu hastalara,gebeliğin önlenmesi hakkında kapsamlı bilgi sunulmalı ve etkili bir doğum kontrolyöntemi kullanmıyorlarsa bir doğum kontrol yöntemi tavsiyesinde bulunulmalıdır. En azbir etkili doğum kontrol yöntemi (tercihen spiral veya implant gibi kullanıcıdan bağımsızbir form) veya bariyer yöntemi dahil iki tamamlayıcı doğum kontrol yöntemikullanılmalıdır. Doğum kontrol yöntemine karar verirken her olguda hastayı da tartışmayadahil ederek hastanın katılımını ve üzerinde karara varılan önlemlere uyacağını garantietmek için bireysel koşullar değerlendirilmelidir. Regl görülmüyor olsa bile etkili doğumkontrolü ile ilgili tüm tavsiyelere uyulmalıdır. Östrojen içeren ilaçlarÖstrojen içeren hormonal kontraseptifler dahil östrojen içeren tıbbi ürünlerle eş zamanlı kullanım, potansiyel olarak valproat etkililiğini azaltabilir (Bkz. Bölüm 4.5). İlacı reçeteeden hekimler, östrojen içeren tıbbi ürünleri başlatırken veya durdururken, klinik yanıtıtakip etmelidir (epilepsi kontrolü). Bu durumun tersine, valproat hormonal kontraseptiflerin etkililiğini azaltmaz. Uzman tarafından yapılacak yıllık tedavi incelemesiUzman, en az yılda bir kez valproatın hasta için en uygun tedavi olup olmadığını değerlendirmelidir. Ayrıca her yıllık incelemenin başında ve yıllık inceleme sırasındayıllık risk onaylama formunu ele almalı ve hastanın bu formun içeriğini anladığından eminolmalıdır. Risk onaylama formu, reçete eden ve hasta (ya da yasal temsilcisi) tarafındandoldurulmalı ve imzalanmalıdır. Gebelik _ planlamaBir kadın gebe kalmayı planladığında epilepsi yönetiminde deneyimli bir uzman valproat tedavisi tekrar değerlendirmeli ve alternatif tedavi seçeneklerini düşünmelidir. Gebekalmadan ve doğum kontrolü bırakılmadan önce alternatif tedavi seçeneklerinegeçilebilmesi için her türlü çaba sarf edilmelidir (Bkz. Bölüm 4.6). Böyle bir geçişmümkün değilse, gebe kalmayı planlayan kadına, aile planlaması hakkında bilinçli kararvermesine destek olmak için valproatın doğmamış çocuk için risklerine ilişkin ektavsiyelerde bulunulmalıdır. Gebelik durumundaValproat kullanan bir kadın gebe kalmayı planladığında, valproat ile tedavinin tekrar değerlendirilmesi ve alternatif seçeneklerin ele alınması için vakit kaybetmeden biruzmana başvurmalıdır. Gebeliği sırasında valproata maruz kalan hastalar ve partnerleri,maruziyet görülen gebelik hakkında değerlendirme ve tavsiye için teratoloji alanındadeneyimli bir uzmana başvurmalıdır (Bkz. Bölüm 4.6). Hekimler aşağıdakileri sağlamalıdır:- Her valproat verildiğinde beraberinde bir hasta kartı da verilmeli ve hastanın bukartın içeriğini anladığından emin olunmalıdır. - Hastalara, planlı ya da şüpheli gebelik durumunda valproat almayı durdurmaları vevakit kaybetmeden bir uzmana başvurmaları tavsiye edilmelidir.
6/22 Eğitim materyalleriSağlık mesleği mensuplarına ve hastalara gebelik sırasında valproata maruziyetten kaçınmada yardımcı olmak amacıyla Ruhsat Sahibi, valproatın teratojenisitesi (konjenitalmalformasyonlar) ve fetotoksisitesi (nörogelişimsel bozukluklar) hakkındaki uyarılarıpekiştirmek, çocuk doğurma potansiyeli olan kadınlarda valproat kullanımına ilişkinkılavuz sağlamak ve Gebelik Önleme Programının detaylarını sunmak için eğitimmateryalleri sağlamıştır. Valproat kullanan çocuk doğurma potansiyeli olan tüm kadınlarabir hasta kılavuzu ve hasta kartı sağlanmalıdır. Yıllık risk onaylama formunun, tedavi başlangıcında ve valproat tedavisinin her yıllık gözden geçirmesi sırasında uzman ve hasta (ya da yasal temsilcisi) tarafından usulüne uygun olarak doldurulup imzalanması gerekir._Nöbetlerin alevlenmesi Diğer antiepileptiklerle olduğu gibi, valproat uygulaması, iyileşme yerine nöbetlerin sıklığı ve şiddetinde (status epileptikus dahil) geri dönüşlü alevlenmelere veya yeni tipte bir nöbetinbaşlamasına yol açabilir. Hastalara eğer nöbet alevlenmeleri meydana gelirse derhalhekimlerine danışmaları önerilmelidir (Bkz. Bölüm 4.8). Bu nöbetler farmakokinetik bir etkileşmeden (Bkz. Bölüm 4.5), bir toksisite durumundan (karaciğer hastalığı veya ensefalopati (Bkz. Bölüm 4.4 ve 4.8) ya da doz aşımından ilerigelebilen nöbetlerden ayrıştırılmalıdır. Bu tıbbi ürün vücutta valproik aside dönüştürüldüğünden, olası bir valproik asit doz aşımını önlemek için, aynı şekilde dönüşüme uğrayan diğer tıbbi ürünlerle (örneğin divalproat,valpromid) birlikte kullanılmamalıdır. Karaciğer Yetmezliği (Hepatopati) Oluşma şartları: Bazen fatalite ile de sonuçlanabilen, ciddi karaciğer bozukluğu vakaları çok nadir olarak bildirilmiştir. Şiddetli epilepsisi olan bebekler ve 3 yaşın altındaki çocuklar, özellikle beyin hasarı, zeka geriliği ve/veya konjenital bir genetik metabolik veya dejeneratif hastalık ilişkili epilepsisiolanlar en fazla risk altında olan hastalardır. 3 yaşından sonra görülme sıklığı anlamlı olarakazalmakta ve risk yaş ilerledikçe giderek düşmektedir. Vakaların büyük bölümünde karaciğer hasarı tedavinin ilk 6 ayında, daha çok 2. ve 12. haftalar arasında ve genellikle antiepileptiklerle çoklu tedavi sırasında görülmektedir. Belirtiler: Erken teşhis için klinik bulgular önemlidir. Sarılık öncesi görülebilecek aşağıdaki iki grup belirtiler, özellikle risk altındaki hastalarda (Bkz. Oluşma şartları) dikkate alınmalıdır. - İlk olarak, spesifik olmayan ve genellikle ani ortaya çıkan ve bazen sürekli kusma ve karınağrısının eşlik ettiği asteni, anoreksi, yorgunluk hali ve baş dönmesi - İkinci olarak, uygun tedaviye rağmen epilepsi nöbetlerinin tekrarlaması Bu tip klinik belirtilerin görülmesi halinde hastanın derhal doktora başvurması gerektiği bilinmelidir. Hasta çocuksa aynı uyarı ailesine yapılmalıdır. Klinik muayene ve karaciğer 7/22 fonksiyonunun biyolojik değerlendirilmesini içeren incelemeler derhal gerçekleştirilmelidir. Takip: Tedaviden önce karaciğer fonksiyon testi yapılmalı ve daha sonra tedavinin ilk 6 ayında karaciğer fonksiyonu periyodik olarak kontrol edilmelidir. Bilinen incelemeler içinde protein sentezini, özellikle PT (protrombin zamanı) gösteren testler önemlidir. Eğer anormal derecede düşük PT değerleri saptanırsa ve özellikle diğer laboratuvarbulguları da mevcutsa (fibrinojen ve pıhtılaşma faktörlerinde önemli azalma, bilirubindüzeyinde yükselme ve transaminazlarda yükselme - Bkz. Bölüm 4.4), DEPAKİN tedavisidurdurulmalıdır ve bir tedbir olarak aynı metabolik yolu kullandıkları için, DEPAKİN ilebirlikte veriliyorsa salisilat türevlerinin kullanımı da kesilmelidir. Karaciğer fonksiyon testleri özellikle riskli hastalarda (Bkz. Bölüm 4.4) tedaviden önce (Bkz. Bölüm 4.3) ve tedavinin ilk 6 ayında periyodik olarak yapılmalıdır. Pek çok antiepileptikle olduğu gibi, özellikle tedavinin başlangıcında, karaciğer transaminazlarının klinik belirti olmadan, geçici hafif bir yükselişi görülebilir. Bu hastalarda daha geniş laboratuvar araştırması (protrombin düzeyi dahil) önerilir, gerekiyorsa doz ayarlanmalı ve parametrelerdeki değişikliklere bağlı olarak testlertekrarlanmalıdır. Pankreatit Bazen fatal sonuçlanan ağır pankreatit vakaları çok nadir olarak bildirilmiştir. Bu komplikasyon tüm yaş gruplarında tüm tedavi süresince görülebilir. Özellikle küçükçocuklarda bu risk daha da artmaktadır. İstenmeyen sonuçlu pankreatit genelde küçük çocuklarda veya ciddi epilepsi nöbetleri veya beyin hasarı olan veya çoklu antikonvülsan tedavi kullanan hastalarda gözlenir. Pankreatite eşlik eden karaciğer yetmezliği fatalite riskini arttırır. Akut karın ağrısı olan veya bulantı, kusma ve anoreksi gibi gastrointestinal şikayetleri olan hastalarda pankreatit düşünülmelidir ve eğer pankreatik enzim düzeyleri artmışsa tedavikesilmeli ve uygun olan alternatif tedavi verilmelidir. İntihar riski Çeşitli endikasyonlarda antiepileptiklerle tedavi edilen hastalarda intihar düşünceleri ve intihar davranışı bildirilmiştir. Antiepileptik ilaçlar ile randomize, plasebo kontrollü klinikçalışmaların meta-analiz verisi de intihar düşünceleri ve intihar davranışı riskinde hafif birartış göstermiştir. Bu riskin nedeni bilinmemektedir ve eldeki verilerle valproat ile artmış riskigöz ardı etmek mümkün değildir. Bu nedenle hastalar intihar düşüncesi ve davranışı açısından yakından izlenmeli ve uygun tedavi değerlendirilmelidir. İntihar düşüncesi ve davranışı ortaya çıktığında, hasta ve hastayakınının tıbbi destek alması önerilmelidir. 8/22 Bilinen ya da şüpheli mitokondrial hastalığı olan hastalar: Valproat mitokondrial DNA ve mitokondrial enzim polimeraz y (POLG) enzimini kodlayan nükleer gende mutasyonların neden olduğu altta yatan mitokondrial hastalıkların klinikbelirtilerini tetikleyebilir ya da kötüleştirebilir. Özellikle, POLG geninde mutasyonların neden olduğu herediter nörometabolik sendromları (örn. Alpers-Huttenlocher Sendromu) olan hastalarda valproat ile tetiklenen akut karaciğeryetmezliği ve karaciğer ile ilişkili ölümler daha yüksek bir oranda raporlanmıştır. POLG ile ilişkili bozukluklar aile öyküsü olan ya da POLG ile ilişkili bozukluğu düşündürecek semptomları (açıklanamayan ensefalopati, dirençli epilepsi (fokal, miyoklonik),başlangıçta status epileptikus, gelişme geriliği, psikomotor gerilik, aksonal sensorimotornöropati, miyopati serebellar ataksi, oftalmopleji ya da oksipital auralı komplike migren) olanhastalarda düşünülmelidir. Bu bozuklukların tanısal değerlendirmesine yönelik güncel klinikuygulamalar doğrultusunda POLG mutasyon testi yapılmalıdır (Bkz. Bölüm 4.3). Diğer tıbbi ürünlerle etkileşim Lamotrojin ve penemlerle kombine kullanımı önerilmez (Bkz. Bölüm 4.5). Kognitif veya ekstrapiramidal bozukluklar Kognitif veya ekstrapiramidal bozukluklar, serebral atrofinin görüntüleme bulguları ile ilişkili olabilir. Bu nedenle ilaca bağlı ortaya çıkan klinik tablo, demans veya Parkinson hastalığı ilekarıştırılabilir. Ancak bu tür ilaca bağlı kognitif veya ekstrapiramidal bozukluklar tedavikesildiğinde ortadan kalkar (bkz. Bölüm 4.8). Tedaviye başlamadan önce karaciğer fonksiyon testleri gerçekleştirilmelidir (Bkz. Bölüm 4.3) ve daha sonra, özellikle riskli hastalarda ilk 6 ay için periyodik olarak tekrarlanmalıdır (Bkz.Bölüm 4.4). Özellikle tedavinin başlangıcında olmak üzere, birçok antiepileptikte olduğu gibi herhangi bir klinik belirti olmaksızın, transaminaz seviyelerinde izole ve geçici olarak orta seviyede birartış gözlenebileceği vurgulanmalıdır. Böyle bir durum söz konusu olduğunda, daha kapsamlıbir laboratuvar çalışması yapılması (özellikle protrombin zamanı), gerektiği takdirdedozlamanın yeniden değerlendirilmesi, ve parametrelerdeki değişikliklere bağlı olarak testlerintekrar edilmesi önerilmektedir. Hematolojik Tedaviye başlamadan önce, 15 gün sonra ve tedavi sonunda, ve aynı zamanda cerrahi girişim öncesi, spontan kanama veya hematom (Bkz Bölüm 4.8) durumunda kan kontrolleri(trombosit sayımı dahil kan sayımı, kanama zamanı ve koagülasyon testleri) yapılmalıdır. Çocuklar 3 yaşın altındaki çocuklarda DEPAKİN uygulanacaksa monoterapi önerilir, ancak tedaviye başlamadan önce sodyum valproatın potansiyel yararına karşılık karaciğer harabiyeti veyapankreatit riski bu gruptaki hastalarda iyi değerlendirilmelidir (Bkz. Bölüm 4.4). Çocuklardaaynı zamanda salisilat kullanımı, karaciğer toksisitesi (Bkz. Bölüm 4.4) ve kanama riskinedeniyle önerilmemelidir. 9/22 Hiperamoniyemi Üre siklusunda enzim defekti bulunan hastalarda, sodyum valproat kullanımı kontrendikedir. Bazı hastalarda stupor veya koma ile birlikte birkaç hiperamoniyemi vakası görülmüştür (Bkz.Bölüm 4.3). Sebebi açıklanamayan hepatogastrointestinal semptomlar (anoreksi, kusma, akut sitoliz krizi), letarji epizodları veya koma, mental gerilik öyküsü olan ya da ailesinde yenidoğan ya da çocukölümleri görülen çocuklarda, her türlü sodyum valproat tedavisinden önce, metabolik tetkiklerve özellikle aç karnına ve yemekten sonra kandaki amonyak düzeylerine bakılmalıdır. Sistemik lupus eritematozus Her ne kadar sodyum valproat kullanımı sırasında immün bozukluklar çok ender görülmüşse de, sistemik lupus eritematozuslu hastalarda kullanımı için potansiyel yararı ile riski iyideğerlendirilmelidir. Kilo artışı Hastalar tedaviye başlarken kilo artışı riski konusunda uyarılmalı ve bu riski azaltmak için, çoğunlukla diyetle ilgili olmak üzere, gerekli düzenlemeler yapılmalıdır. Rabdomiyoliz Karnitin palmitoiltransferaz (CPT) tip II eksikliği olan hastalar valproat kullanırken rabdomiyoliz riskinin daha yüksek olduğu konusunda uyarılmalıdır. Alkol kullanımı Sodyum valproatla tedavi sırasında alkol kullanımı önerilmez. Böbrek yetmezliği Böbrek yetmezliği olanlarda valproik asidin serbest serum konsantrasyonlarının artabileceği göz önünde bulundurulmalı ve doz uygun şekilde azaltılmalıdır. Diyabetik hastalar Kısmen keton cisimcikleri şeklinde, başlıca böbrekler yoluyla elimine edildiğinden, diyabet şüphesi olanlarda idrar testinde yanlış pozitif sonuç verebilir. Sodyum Bu tıbbi ürün her 100 mg sodyum valproat dozu başına 13,88 mg sodyum içermektedir. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKontrendike olan kombinasyonlar:- St. John's Wort (Sarı Kantaron):Azalmış plazma konsantrasyonu riski ve antikonvülsan etkililikte azalma. Önerilmeyen kombinasyonlar:Lamotrijin:Ciddi deri reaksiyonları (toksik epidermal nekroliz) riskinde artış. 10/22 Ayrıca, lamotrijin plazma konsantrasyonlarında artış meydana gelebilir (sodyum valproat ile azalmış hepatik metabolizma) Eğer birlikte uygulanması gerekli görülürse, yakından klinik takip gereklidir. -Penemler:Valproik asit plazma konsantrasyonlarında belirlenemeyebilen hızlı bir düşüşe bağlı nöbet riski. Kullanımda önlem alınmasını gerektiren kombinasyonlar:-Asetazolamid:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. -Aztreonam:Valproik asit plazma konsantrasyonunda düşmeye bağlı nöbet riski. Bu antibiyotikle tedavi sırasında ve sonrasında klinik takip, plazma miktar tayini ve olası antikonvülsan doz ayarlaması. -Karbamazepin:Aşırı doz belirtileri ile karbamazepinin aktif metabolitinin artmış plazma konsantrasyonları. İlaveten, karbamazepin ile artmış hepatik metabolizmaya bağlı olarak azalmış valproik asitplazma konsantrasyonu. Klinik takip, plazma miktar tayini ve her iki antikonvülsanın dozunun ayarlanması. - Felbamat:Doz aşımı riski ile birlikte serum valproik asit konsantrasyonlarında yükselme. Felbamat ile kombine tedavi sırasında ve kombine tedavi kesildikten sonra, klinik takip, laboratuvar parametrelerinin takibi ve valproik asit dozunun ayarlanması gerekebilir. -Östrojen içeren hormonal kontraseptifler dahil östrojen içeren ilaçlar:Östrojenler, valproat glukoronidasyonuna dahil olan UDP- glukuronozil transferaz (UGT) izoformlarının indükleyicileridirler ve valproatın klerensini arttırabilirler, dolayısıyla valproatserum konsantrasyonlarında bir düşüşe neden oldukları ve potansiyel olarak valproatetkililiğini azalttıkları düşünülmektedir (Bkz. Bölüm 4.4). Valproat serum seviyelerinin takipedilmesi dikkate alınmalıdır. Bunun tersine, valproat enzim indükleyici etkiye sahip değildir; bunun sonucu olarak valproat, hormanal kontraseptif alan kadınlarda östro-progestatif ajanların etkililiğini azaltmaz. - Nimodipin (oral kullanım ve parenteral yol ekstrapolasyonu):Plazma nimodipin konsantrasyonlarında %50 artış riski. Bu yüzden, hipotansif hastalarda nimodipin dozunun azaltılması gerekebilir. - Fenobarbital ve primidon ekstrapolasyonu:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. 11/22 Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. -Fenitoin ve fosfenitoin ekstrapolasyonu:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. -Rufnamid:Özellikle 30 kg altı çocuklarda, rufinamid konsantrasyonunda olası yükselme. 30 kg'dan hafif çocuklarda: doz titrasyonundan sonra, toplam günlük doz olarak 600 mg aşılmamalıdır. - Rifampisin:Valproik asidin karaciğerde metabolize olma oranının rifampisin tarafından arttırılmasına bağlı olarak nöbet riski. Klinik takip ve laboratuvar parametrelerinin takibi ve rifampisin ile tedavi sırasında ve sonrasında olası antikonvülsan doz ayarlamaları. - Topiramat:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. -Propofol:Kanda propofol seviyelerini artırması muhtemeldir. Valproat ile birlikte uygulandığında, propofol dozunda azaltma düşünülmelidir. - Zidovudin:Metabolize olma oranının valproik asit tarafından azaltılmasına bağlı olarak, başlıca hematolojik etkiler olmak üzere, zidovudinin istenmeyen etki riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. Kombinasyonun ilk iki ayı sırasında anemi durumunu test etmek için kan sayımıgerçekleştirilmelidir. - Zonisamid:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. Diğer etkileşmeler:- Lityum:DEPAKİN Chrono BT'nin serum lityum düzeyleri üzerine etkisi yoktur. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin bir etkileşim çalışması bulunmamaktadır. 12/22 Pediyatrik popülasyonPediyatrik popülasyona ilişkin bir etkileşim çalışması bulunmamaktadır. 4.6. Gebelik ve laktasyonValproat, aşağıdaki durumlarda kontrendikedir (Bkz. Bölüm 4.3 ve 4.4): - Epilepsiyi tedavi edecek uygun bir alternatifin mevcut olduğu sürece gebelik sırasında - Gebelik Önleme Programının koşulları yerine getirilmediği sürece çocuk doğurma _ potansiyeli olan kadınlardaGenel tavsiye:Gebelik kategorisi: D Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)DEPAKİN, çocuk doğurma potansiyeli bulunan kadınlarda yalnızca diğer tedaviler etkisiz olduğunda ya da tolere edilemediğinde kullanılmalıdır. DEPAKİN tedavisine, özellikleaşağıdakilere olmak üzere, yalnızca Gebelik Önleme Programına uyulduğu takdirdebaşlanabilir (bkz. bölüm 4.4): - Gebelik yoksa (tedavinin başında ve tedavi sırasında düzenli aralıklarla en az 25mIU/ml hassasiyetli plazma gebelik testinde negatif sonuç) - En az bir etkili doğum kontrol yöntemi kullanılıyorsa - Gebelik sırasında valproat kullanımı riskleri hakkında bilgilendirme yapıldıysa Çocuk doğurma potansiyeli olan kadınlarda, fayda-risk dengesi tedavi sırasında düzenli aralıklarla (en az yılda bir kez) dikkatlice tekrar tekrar değerlendirilmelidir. Gebelik dönemiUygun bir alternatif tedavi bulunduğu sürece, gebelikte epilepsi tedavisi olarak valproat kullanımı kontrendikedir (bkz. bölüm 4.3 ve 4.4). Valproat kullanan bir kadın gebe kaldığında, alternatif tedavi seçeneklerinin değerlendirilmesi için vakit kaybetmeden bir uzmana başvurmalıdır. Gebelik sırasında, maternal tonik klonik nöbetler ve hipoksiyle birlikte status epileptikus anne ve doğmamış çocuk için özel bir ölüm riski taşıyabilir. Gebelikte valproatın bilinen risklerine rağmen ve alternatif tedavinin dikkatli bir şekilde değerlendirilmesinden sonra, istisnai durumlarda gebe bir kadının epilepsi için valproat almasıgerekir: - En düşük etkili doz kullanılmalıdır - Günlük valproat dozu, gün boyunca alınacak birkaç küçük doza bölünmelidir. Yüksekpik plazma konsantrasyonlarından kaçınmak için diğer tedavi formülasyonlarındanziyade uzun salınımlı formülasyon kullanımı tercih edilebilir (bkz. bölüm 4.2). Gebeliğinde valproata maruz kalmış tüm hastalar ve partnerleri, maruziyet görülen gebelik hakkında değerlendirme ve tavsiye için teratoloji alanında deneyimli bir uzmanabaşvurmalıdır. 13/22 - Nöral tüp defektlerinin veya diğer malformasyonların olası oluşumunu tespit etmek için özel prenatal izlem yapılmalıdır. Teratojenisite ve nörogelişimsel etkiler Valproatın hem monoterapisi hem de politerapisi anormal gebelik sonlanımları ile ilişkili olabilir. Mevcut veriler valproatı içeren antiepileptik politerapisinin konjenital malformasyonriskinin valproat monoterapisine göre daha fazla olduğunu ileri sürmektedir. Valproatın hemhayvan türlerinde hem de insanlarda plasenta bariyerini geçtiği gösterilmiştir (Bkz. Bölüm5.2). Konjenital malformasyonlar Bir meta analizden (kayıt çalışmaları ve kohort çalışmaları) elde edilen veriler gebelik sırasında valproat monoterapisi uygulanmış epileptik kadınlar tarafından dünyaya getirilençocukların %10.73'ünde konjenital malformasyonlar ortaya çıktığını (%95 GA: 8.16 -13.29)ve majör malformasyon riskinin bu popülasyonda arttığını (genel popülasyona oranla yaklaşık%2-3) göstermektedir. Risk doza bağlı olup altındaki dozlarda riskin olmadığı bir eşik dozbelirlenememektedir. Mevcut veriler minör ve majör malformasyon insidansının arttığını göstermektedir. En yaygın malformasyon tipleri nöral tüp defektleri (yaklaşık %2 ila %3) , fasiyel dismorfizm, yarıkdudak ve damak, kraniostenoz, kardiyak, renal ve ürogenital defektler (özellikle hipospadias),ekstremite defektleri (bilateral radius aplazisi dahil) ve vücudun çeşitli sistemlerini tutan çokluanomalileri içermektedir. Uterus içi valproata maruz kalmak ayrıca kulak ve / veya burun malformasyonları (ikincil etki) nedeniyle işitme bozukluğu / kaybına ve / veya işitme fonksiyonu üzerinde doğrudantoksisiteye neden olabilir. Vakalar hem tek taraflı hem de iki taraflı sağırlığı veya işitmebozukluğunu tanımlar. Tüm vakalar için sonuçlar bildirilmemiştir. Sonuçlar rapor edildiğinde,vakaların çoğu çözülmemiştir. Nörogelişimsel bozukluklar Veriler uterusta valproata maruziyetin çocukların mental ve fiziksel gelişimi üzerinde advers etkileri olabileceğini göstermiştir. Risk doza bağımlı görülmekle birlikte , mevcut verilerleriskin olmadığı eşik altındaki doz tespit edilememektedir. Bu etkiler için gebeliğin hangidöneminin riskli olduğu tam olarak belli değildir ve tüm gebelik boyunca bir risk olasılığıdışlanamamaktadır. Uterusta valproata maruz kalmış okul öncesi çocuklarda yapılan çalışmalar bu çocukların %30-40'a varan bir bölümünde daha geç konuşma ve geç yürüme, zihinsel becerilerin düşükdüzeyde kalması, dil becerisinde yetersizlik (konuşma ve anlama) ve bellek sorunları gibierken dönme gelişiminde gecikmeler ortaya çıktığını göstermektedir. Uterusta valproata maruz kalmış okul çağındaki çocuklarda ( 6 yaş) ölçülen zeka katsayısının (IQ) diğer antiepileptiklere maruz kalmış çocuklarınkinden ortalama 7-10 puan düşükbulunmuştur. Karıştırıcı faktörlerin rolü dışlanamamakla birlikte, valproata maruz kalançocuklarda zihinsel bozukluk riskinin maternal IQ'dan bağımsız olabileceğine ilişkin kanıtmevcuttur. Uzun dönemdeki sonuçlara ilişkin veriler sınırlıdır. Mevcut veriler, genel çalışma popülasyonu ile karşılaştırıldığında uterusta valproata maruz kalmış çocuklarda otistik spektrum bozukluğu (yaklaşık 3 kat) ve çocukluk çağı otizmi(yaklaşık 5 kat) riskinde artış olduğunu göstermektedir. 14/22 Bugüne kadar elde edilen sınırlı veriler uterusta valproata maruz kalmış çocuklarda dikkat eksikliği/hiperaktivite bozukluğu (DEHB) semptomları gelişme olasılığının daha yüksekolduğunu düşündürmektedir. Östrojen içeren ilaçlarÖstrojen içeren hormonal kontraseptifler dahil östrojen içeren tıbbi ürünler valproatın klerensini arttırabilirler, dolayısıyla valproat serum konsantrasyonlarında bir düşüşe nedenoldukları ve potansiyel olarak valproat etkililiğini azalttıkları düşünülmektedir (Bkz. Bölüm4.4 ve 4.5). Bir kadın gebelik planladığında:Bir kadın gebe kalmayı planladığında, epilepsi yönetiminde deneyimli bir uzman valproat tedavisini tekrar değerlendirmeli ve alternatif tedavi seçeneklerini düşünmelidir. Gebekalmadan ve doğum kontrolü bırakılmadan önce alternatif tedavi seçeneklerine geçilebilmesiiçin her türlü çaba sarf edilmelidir (bkz. bölüm 4.4). Böyle bir geçiş mümkün değilse, gebekalmayı planlayan kadına aile planlaması hakkında bilinçli karar vermesine destek olmak içinvalproatın doğmamış çocuk için risklerine ilişkin ek tavsiyelerde bulunulmalıdır. Gebelik öncesi ve gebelik sırasında folik asit takviyesi, tüm gebeliklerde meydana gelebilecek nöral tüp defekti riskini azaltabilir. Doğum öncesi:Doğumdan önce anneye özellikle trombosit sayımı, fibrinojen seviyeleri ve koagülasyon zamanı (aktive edilmiş parsiyel tromboplastin zamanı: aPTT) dahil olmak üzere koagülasyontestleri yapılmalıdır. Yeni doğandaki riskler: Gebelik sırasında valproat kullanmış annelerden doğan yenidoğanlarda çok seyrek olarakhemorajik sendrom bildirilmiştir. Bu hemorajik sendrom trombositopeni, hipofibrinojenemive/veya diğer koagülasyon faktörlerinin azalması ile ilişkilidir. Afibrinojenemi de bildirilmiştirve ölümcül olabilir. Bununla birlikte, bu sendrom fenobarbital ve enzim indüksiyonu yapandiğer ajanlarla tetiklenen vitamin K faktörlerinin azalmasından ayırt edilmelidir. Annedekinormal hemostaz test sonuçları, yenidoğan bebekte hemostaz anormalliklerinin göz ardıedilmesini olası kılmaz. Bu nedenle yenidoğanda trombosit sayımı, fibrinojen plazma düzeyi,koagülasyon testleri ve koagülasyon faktörleri araştırılmalıdır. Anneleri gebeliğin üçüncü trimestrinde valproat kullanmış olan yenidoğanlarda hipoglisemiolguları bildirilmiştir. Anneleri gebelik sırasında valproat kullanmış olan yenidoğanlarda hipotiroidizm olgularıbildirilmiştir. Anneleri gebeliğin son trimestrinde valproat kullanmış olan yenidoğanlarda geri çekilmesendromu (özellikle ajitasyon, irritabilite, hipereksitabilite, gerginlik, hiperkinezi, tonusbozuklukları, tremor, konvulziyonlar ve beslenme sorunları gibi) ortaya çıkabilir. Post-natal izleme/çocukların izlenmesi:Gebelik sırasında valproata maruz kalan çocuklarda nörogelişimsel davranış yakından izlenmeli ve gerektiğinde mümkün olduğunca erken şekilde uygun tedaviye başlanmalıdır. 15/22 Laktasyon dönemiValproat anne sütünde maternal serum düzeyinin %%10'u arasında salgılanmaktadır. Tedavi edilen annelerin emzirdiği yenidoğan ve bebeklerde hematolojik bozukluklargösterilmiştir (Bkz. Bölüm 4.8).Emzirmenin bebek için yararı ve tedavinin anne için yararı dikkate alınarak emzirmenin kesilmesi ya da valproat tedavisinin kesilmesi/bırakılmasına kararı verilmelidir. Üreme yeteneği/FertiliteValproat kullanan kadınlarda amenore, polikistik over ve testosteron düzeyinde artış bildirilmiştir (Bkz. Bölüm 4.8). Valproat uygulaması erkeklerde fertiliteyi bozabilir (özellikle spermmotilitesinde azalma) (Bkz. Bölüm 4.8). Olgu bildirimleri fertilite disfonksiyonunun tedavikesildikten sonra geri dönüşlü olduğunu göstermektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç veya makine kullanan hastalar, özellikle antikonvülsan politerapisi alıyorsa veya sersemlik halini arttırabilecek diğer ilaçlar ile birlikte bu ilacı kullanıyorsa, sersemlik haliyapabileceği riskine karşı uyarılmalıdır. 4.8. İstenmeyen etkilerAşağıda sıralanan istenmeyen etkilerin sıklığına ilişkin bilgiler şöyle tanımlanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10000 ila <1/1000); çok seyrek (<1/10000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). (Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalar:Seyrek: Miyelodisplastik sendrom Kan ve lenf sistemi hastalıkları:Yaygın: Anemi, trombositopeni Genelde sistematik olarak fark edilen ve klinik belirti vermeyen, doza bağlı trombositopeni vakaları bildirilmiştir. Trombositopeninin asemptomatik olması durumunda, eğer trombositmiktarı uygun ve epileptik hastalığın kontrolü mümkünse, yalnızca sodyum valproatpozolojisinin azaltılmasıyla, genellikle bu trombositopeninin düzelmesi sağlanabilir. Yaygın olmayan: Pansitopeni, lökopeni Seyrek: Kemik iliği aplazisi veya saf kırmızı kan hücresi aplazisi, agranülositoz, makrositik anemi, makrositoz. Endokrin hastalıklar:Yaygın olmayan:Uygunsuz antidiüretik hormon salgılanması sendromu (IADHS), hiperandrojenizm (hirsutizm, virilizm, akne, erkek tipi alopesi ve/veya androjen hormonseviyesinde artış).Seyrek: Hipotiroidizm (Bkz. Bölüm 4.6). Metabolizma ve beslenme hastalıkları:Yaygın: Hiponatremi Seyrek: Hiperamoniyemi* (Bkz. Bölüm 4.4), obezite 16/22 * Sıklıkla karaciğer fonksiyon testlerinde değişikliğe neden olmayan özellikle birden fazla ilaçile tedavi esnasında izole ve orta derecede hiperamoniyemi ortaya çıkabilmektedir. Bu durumtedavinin kesilmesini gerektirmez. Nörolojik semptomların eşlik ettiği hiperamoniyemi (komaya kadar giden) de bildirilmiştir. Bu vakalarda daha ileri tetkiklere başvurulmalıdır (Bkz. Bölüm 4.4). Psikiyatrik hastalıklar:Yaygın: Konfüzyonel durum, halüsinasyonlar, agresyon*, ajitasyon*, dikkat bozukluğu* Seyrek: Anormal davranış*, psikomotor hiperaktivite*, öğrenme bozukluğu* * Bu yan etkiler daha çok pediyatrik popülasyonda gözlenir. Sinir sistemi hastalıkları:Çok yaygın: Tremor Yaygın: Ekstrapiramidal bozukluk**, stupor*, sedasyon, konvülsiyon*, bellek bozukluğu, baş ağrısı, nistagmus, bulantı veya baş dönmesi. Yaygın olmayan: Koma*, ensefalopati*, letarji*, geri dönüşümlü parkinsonizm**, ataksi, parestezi Seyrek: Diplopi, tedavinin kesilmesini takiben birkaç hafta ya da birkaç ay içinde geriye dönebilen sinsi ve yavaş başlangıçlı kognitif bozukluklar** (demansın tüm klinik özelliklerinigösterebilen) bildirilmiştir. *Tedavi sırasında bazen geçici komaya/ensefalopatiye kadar gidebilen stupor ve letarji, tek başına veya konvülziyonlarda paradoksal artışla birlikte görülmüştür ve tedavidurdurulduğunda veya doz azaltıldığında, azalmıştır. Bu etkiler genellikle birden fazla ilaçlatedavi sırasında (özellikle fenobarbital veya topiramat) ve valproat dozu birden artırıldığındaortaya çıkar. **Bu semptomlar serebral atrofinin görüntüleme bulguları ile ilişkili olabilir Kulak ve iç kulak hastalıkları:Yaygın: Sağırlık Vasküler hastalıklar:Yaygın: Hemoraji (Bkz. Bölüm 4.4 ve 4.8) Yaygın olmayan: Kutanöz vaskülit, özellikle lökositoklastik vaskülit Solunum, göğüs bozuklukları ve mediastinal hastalıklar:Yaygın olmayan: Plevral efüzyon Gastrointestinal hastalıklar:Çok yaygın: Bulantı Yaygın: Bazı hastalarda tedavinin ilk günlerinde sıklıkla sindirim sistemine ait yan etkiler (kusma, esas olarak ginjival hiperplazi olmak üzere ginjival bozukluklar, stomatit, üst karınağrısı, diyare) görülebilir, bunlar çoğunlukla tedaviyi durdurmaya gerek kalmadan bir kaç güniçinde kendiliğinden ortadan kalkar .17/22 Yaygın olmayan: Bazen fatal olabilen, tedavinin erken kesilmesine ihtiyaç duyulabilecek pankreatit (Bkz. Bölüm 4.4). Hepato-bilier hastalıklar:Yaygın: Karaciğer hastalığı (Bkz. Bölüm 4.4). Deri ve deri altı dokusu hastalıkları:Yaygın: Geçici ve/veya doza bağlı alopesi, tırnak ve tırnak yatağı bozuklukları Yaygın olmayan: Anjiyoödem, deri reaksiyonları, saç bozuklukları (saç yapısı anormallikleri, saç rengi değişiklikleri, saç uzama anormallikleri gibi). Seyrek: Toksik epidermal nekroliz, Stevens-Johnson sendromu ve eritema multiforme, DRESS Sendromu (eozinofili ve sistemik semptomların görüldüğü ilaç reaksiyonu) veya ilaç aşırı duyarlılık reaksiyonu. Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları:Yaygın olmayan: DEPAKİN'le uzun süre tedavi gören hastalarda kemik mineral yoğunluğunda azalma, osteopeni, osteoporoz ve kırıklar. DEPAKİN'in kemik metabolizmasınıetkileme mekanizması henüz belirlenememiştir. Seyrek: Akut sistemik lupus eritematosus (Bkz. Bölüm 4.4), rabdomiyoliz (Bkz. Bölüm 4.4). Böbrek ve idrar yolu hastalıkları:Yaygın: Üriner inkontinans Yaygın olmayan: Renal yetmezlik Seyrek: Enürezis, üriner inkontinans, tubulointerstisyel nefrit,geri dönüşümlü Fanconi sendromu Üreme sistemi hastalıkları ve meme hastalıkları:Yaygın: Menstrüel düzensizlikler Yaygın olmayan: Amenore Seyrek: Spermatogenez üzerine etki (özellikle sperm motilitesinde azalma) (Bkz. Bölüm 4.6), polikistik over Çok seyrek: jinekomasti Konjenital ve kalıtımsal/genetik hastalıklar:Konjenital malformasyonlar ve nörogelişimsel bozukluklar (Bkz. Bölüm 4.4 ve 4.6). Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:Yaygın olmayan: Hipotermi, şiddetli olmayan periferik ödem Araştırmalar:Yaygın: Kilo artışı* Seyrek: Koagülasyon faktörlerinde azalma (en az birinde), koagülasyon testlerinde anormallik (protrombin zamanında uzama, aktive parsiyel tromboplastin zamanında uzama, trombinzamanında uzama, INR'de uzama gibi) (Bkz. Bölüm. 4.4 ve 4.6), vitamin B8 (biotin)eksikliği/biotinidaz eksikliği. 18/22 *Kilo artışı polikistik over sendromu için bir faktör olduğundan dikkatlice izlenmelidir (Bkz. Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirilmesi gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiAkut, ağır doz aşımının belirtileri; bir dereceye kadar derin olabilen hafif koma hali dahil, müsküler hipotoni, hiporefleksi, miyozis, metabolik asidoz, solunum fonksiyonlarınınbozulması, hipotansiyon ve dolaşım kollapsı/kardiyovasküler şoktur. Az sayıda serebral ödeme bağlı intrakraniyal hipertansiyon vakası bildirilmiştir. Doz aşımının hastanedeki tedavisi: Alımından 10-12 saat sonrasına kadar yararlı olabilecek gastrik lavaj; etkili diürezin idamesi; kalp ve solunum fonksiyonlarının takibi. Çok ciddi vakalarda eğer gerekirse renal diyaliz yapılabilir. Bu tip zehirlenmede prognoz genelde olumludur. Ancak, birkaç ölüm raporlanmıştır. Valproat formülasyonundaki sodyum doz aşımında hipernatremiye yol açabilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antiepileptik ATC kodu: N03AG01 Etki mekanizması: Valproat etkisini esas olarak merkezi sinir sistemi üzerinde oluşturur. İnsanda birçok değişik nöbet tiplerinde ve hayvanlarda birçok farklı konvülsiyon tiplerinde antikonvülsan etki göstermektedir. Valproatın en olası etki mekanizması beyinde gama amino bütirik asit (GABA) sentezi veya metabolizması üzerine etkiyerek GABA'nın inhibitör etkisinin güçlendirilmesidir. Valproatın etki mekanizmasının, GABA metabolizmasına presinaptik etkiyle ve/veya nöron zarındaki iyon kanallarına doğrudan postsinaptik etkiyle, GABA'nın aracılık ettiğiinhibisyonun güçlendirilmesine bağlı olduğu kabul edilmektedir. Farmakodinamik etkiler: Valproat üzerinde yapılan deneysel ve klinik çalışmalar iki tip antikonvülsan etkinin olduğunu öne sürmektedir. Klinik etkililik: Birincisi, valproatın plazma ve beyindeki konsantrasyonlarına bağlı direkt farmakolojik etkidir. İkincisi ise, muhtemelen beyinde bulunan valproatın metabolitlerine,nörotransmiterlerin değişimlerine veya doğrudan membran etkilerine bağlı olduğu gözüken 19/22 dolaylı etkidir. Bu hipotez genellikle valproat kullanımından sonra artan konsantrasyonlardaki gama - aminobütirik asit (GABA) nedeniyle ortaya atılmıştır. Yavaş dalga uykusunun artması sonucunda uyku ara fazının sürekliliği valproat ile azalır. Sodyum valproatın bazı in vitro5.2. Farmakokinetik özelliklerEmilim:- Sodyum valproatın oral ve IV uygulama sonrasındaki biyoyararlanımı %100'e yakındır. - Oral uygulama sonrasında hızla absorbe olur ve sabit plazma yoğunluğuna 3-4 gündeulaşılır. Enjektabl form ile sabit konsantrasyonlara birkaç dakikada ulaşılır ve bukonsantrasyon intravenöz infüzyon ile korunur. Dağılım:- Dağılım hacmi esas olarak kanla ve hareketli hücre dışı sıvılarla sınırlıdır. Valproat BOS ve beyine geçer. - Terapötik etki için gerekli olan minimum serum konsantrasyonu 40-50 mg/l olup aralık 40mg/l - 100 mg/l arasındadır. Eğer daha yüksek plazma seviyelerinin gerekli olduğu tespitedilirse, beklenen faydalara karşı, özellikle doza bağımlı etkiler olmak üzere yan etki oluşmariski değerlendirilmedir. Bununla beraber, 150 mg/l'nin üstündeki düzeyleri sürdürmek içindoz azaltılması gereklidir. Plasenta transferi (Bkz. Bölüm 4.6): Valproat, hayvan türlerinde ve insanlarda plasenta bariyerini geçer: o hayvan türlerinde valproat plasentayı insanlarda olduğu gibi aşıyor, o insanlarda, çeşitli yayınlar doğumda yenidoğanların göbek kordonundaki valproatkonsantrasyonunu değerlendirmiştir. Göbek kordonundaki valproat serumkonsantrasyonu, fetüslerde annelerinkine benzer veya biraz daha yüksek olduğunugöstermiştir. Biyotransformasyon:- Valproatın sitokrom P450 metabolik sisteminde enzim indükleme etkisi bulunmamaktadır.Diğer antiepileptiklerin aksine, kendinin ve diğer ilaçların (örneğin östroprogestojen ve oralantikoagülan) metabolizmasını artırmaz. - Sodyum valproat, glukuronidasyon ve beta-oksidasyon yoluyla metabolize olduktan sonraesas olarak idrarla (% 3'ü değişmeden) atılır. - Diğer tıbbi ürünlerle (örn. primidon, fenitoin, fenobarbital ve karbamazepin gibi) birliktekullanımda, enzim indüksiyonuna bağlı olarak yarılanma ömrü 4-9 saate düşebilir. Eliminasyon:- Yarılanma ömrü yaklaşık 15-17 saattir. - Valproat molekülü diyaliz edilebilir fakat hemodiyaliz sadece valproatın kandaki serbestformunu etkiler (yaklaşık % 10). 20/22 Hastalardaki karakteristik özelliklerPediatrik popülasyon: Yeni doğanlarda ve 18 aydan küçük bebeklerde plazma yarılanma ömrü 10-67 saat arasında değişir. En uzun yarılanma ömrü değerleri doğumdan hemen sonra kaydedilmiştir. 2 aylıktanbüyük bebeklerde sonuçlar giderek erişkinlere yaklaşır. Geriyatrik popülasyon: Yaşlılarda sodyum valproatın farmakokinetiği değişiyorsa da klinik önemi sınırlıdır ve dozaj nöbetlerin kontrolüne göre düzenlenmelidir. Gebelik: Gebeliğin üçüncü trimestrinde dağılım hacminin artmasıyla, hepatik ve renal klerens artar ve sabit doz uygulanmasına rağmen serum konsantrasyonlarında düşüş görülebilir. Gebelik döneminde plazma proteinlerine bağlanmada değişiklik olabileceği ve serbest (terapötik olarak aktif) valproat düzeylerinin artabileceği de göz önünde bulundurulmalıdır. Karaciğer bozukluğu olan hastalar: Karaciğer bozukluğu olan hastalarda yarılanma ömrü uzar. Doz aşımı halinde, 30 saatin üzerine çıkan yarılanma ömrü değerleri gözlenmiştir. Böbrek bozukluğu olan hastalar: Böbrek bozukluğu olan hastalarda yarılanma ömrü uzar. 5.3. Klinik öncesi güvenlilik verileriAkut toksisite Valproatla farklı hayvan türlerinde gerçekleştirilen akut toksisite testlerinde saptanan LD50 değerleri, oral uygulama sonrasında 1.200-1.600 mg/kg, intravenöz uygulama sonrasında 750950 mg/kg olarak bulunmuştur. Tekrarlanan doz toksisitesi Oral uygulamada toksik olmayan doz, sıçanlarda 150-200 mg/kg/gün (diyetle) ve köpeklerde 90 mg/kg/gün'dür. Bu yüksek dozlarda sıçanlarda ve köpeklerde, testis dejenerasyonu, lenfoidfoliküllerde atrofi ve nörolojik bozukluklar (sedasyon, ataksi, tremor) gözlenmiştir. Mutajenik ve karsinojenik potansiyel In vitroin vivomutajenisite testlerinin bazıları negatif bulunmuştur.Sıçanlarda ve farelerde yapılan karsinojenisite çalışmaları, tolere edilen maksimum doza yakın dozlarda uygulanan valproatın karsinojenik potansiyelinin olmadığını göstermiştir. Sprague Dawley sıçanlarına ve ICR (HA/ICR) farelerine 2 yıl boyunca oral yoldan 80-170 mg/kg/gün dozunda valproik asit uygulanmıştır. Her iki türde de farklı neoplazmlargözlenmiştir. Başlıca bulgular, yüksek dozda valproik asit alan erkek sıçanlarda, subkütanfibrosarkomaların insidansında istatistiksel açıdan anlamlı bir artış ve valproik asit alan erkekfarelerde, selim akciğer adenomları için istatistiksel açıdan anlamlı bir doza-bağlı eğilimdi. Bubulguların insanlar için önemi bilinmemektedir. Hayvan çalışmaları, uterus içine valproat maruziyetinin, sıçan ve farelerin işitsel sistemlerinde fiziksel ve fonksiyonel anormalliklerle sonuçlandığını göstermiştir. 21/22 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiÜre Sodyum hidroksit Distile su 6.2. GeçimsizliklerYeterli veri yoktur. 6.3 Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirlerOda sıcaklığında (25°C'nin altında) direkt güneş ışığından uzakta saklayınız. Dondurmayınız. 6.5. Ambalajın niteliği ve içeriği40 ml'lik amber renkli cam şişede, 2 ml'lik derecelendirilmiş enjektör damlalıkla beraber ambalajlanmıştır. Dilüe edilerek kullanılmalıdır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi atıkların kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİSanofi Sağlık Ürünleri Ltd. Şti. Esentepe Mah. Büyükdere Cad. 193 Apt No:193/11 Şişli - İstanbulTel: 0212 339 10 00Faks: 0212 339 11 99 8. RUHSAT NUMARASI221/10 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ:İlk ruhsatlandırma tarihi: 14.10.2009 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ22/22 |
İlaç BilgileriDepakin % 20 Oral ÇözeltiEtken Maddesi: Sodyum Valproat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.