Kovipir 200 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'a bildirmeleribeklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonların raporlanması. 1. BEŞERİ TIBBİ ÜRÜNÜN ADIKOVİPİR 200 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİFBİLEŞİMEtkin madde:Her bir film kaplı tablet 200 mg favipiravir içerir. Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet Sarımsı, yuvarlak, bombeli film kaplı tabletler 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarıYeni veya yeniden ortaya çıkan influenza virüs enfeksiyonları (diğer anti-influenza virüs ajanlarının etkili olmadığı veya yetersiz olduğu olgularla sınırlıdır) tedavisinde endikedir. 4.2. Pozoloji ve uygulamaekliPozoloji/Uygulama sıklıı ve süresi:Erişkinlerde doz aşağıdaki şekilde verilir; 1. gün: sabah 1600 mg (8 tablet) ve akşam 1600 mg (8 tablet) olmak üzere günde iki kez 2-5. günler: sabah 600 mg (3 tablet) ve akşam 600 mg (3 tablet) olmak üzere günde iki kez verilir. Kullanım süresi 5 gündür. Uygulamaekli:KOVİPİR oral olarak alınır. Özel popülasyonlara ilişkin ek bilgilerBöbrek yetmezlii:Belge DoinböbiekyetM(ezlifr:üzerfnejetkfsi olupolmadiğ^dbili,fiffi/ewekted^'rPovtr/sagiik-titck-ebys 1/17 Ancak gut hastaları veya gut öyküsü olan hastalar ve hiperürisemi hastaları dikkatli kullanmalıdır. (Bkz: Bölüm 4.4) Karaciğer yetmezliği:Karaciğer fonksiyon bozukluğu olan hastalarda favipiravirin plazma düzeylerinde artışı bildirilmiştir. (Bkz. Bölüm 5.2) Pediyatrik popülasyon:KOVİPİR'in etkililiği ve güvenliliği konusunda pediatrik hastalarda herhangi bir çalışma yapılmamıştır. Geriyatrik popülasyon:KOVİPİR, yaşlılarda fizyolojik işlevlerini azalttığından, hastanın genel koşulları izlenerek dikkatle uygulanmalıdır. 4.3. KontrendikasyonlarFavipiravire veya ilacın formülasyonunda bulunan herhangi bir içeriğe karşı aşırı duyarlı olduğu bilinen kişilerde kullanılmamalıdır. Gebe ya da gebelik şüphesi olan kadınlarda kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriHayvan çalışmalarında erken embriyonik ölümler ve teratojenisite gözlenmesi sebebiyle gebe ya da gebelik şüphesi olan kadınlarda favipiravir kullanılmamalıdır (Bkz. Bölüm 4.3 ve 4.6). Çocuk doğurma potansiyeli bulunan kadınlara favipiravir uygulamadan önce negatif gebelik testi onaylanmalıdır. Tedavi sırasında ve tedavi sonlanımından sonraki 7 gün süresince en etkilikontrasepsiyon metodunun kullanılması ve tüm riskler konusunda hasta bilgilendirilmelidir(Bkz. Bölüm 4.6). Tedavi sırasında gebelik şüphesi olur ise tedavi derhal kesilmeli ve doktorabaşvurulmalıdır. Favipiravir sperm içerisinde dağılır. Bu tıbbi ürün erkek hastalara uygulanırken tedavi sırasında ve tedavi sonlanımından sonraki 7 gün süresince en etkili kontrasepsiyon metodunun (erkeklerkondom kullanmalıdır) kullanılması ve tüm riskler konusunda hasta bilgilendirilmelidir. Ayrıcagebe kadınlar ile cinsel ilişkiye girmemesi konusunda hasta bilgilendirilmelidir (Bkz. Bölüm4.6). Tedaviden önce hasta ve aile bireylerine etkililik ve riskler (fetüs maruziyeti riski de dahil) açıklanmalıdır. Kullanımdan önce favipiravir kullanımının gerekliliği dikkatli bir şekilde incelenmelidir. Favipiravir yalnızca yeni ya da yeniden ortaya çıkan bir influenza virüs salgınında diğer anti-influenza virüs ajanlarının yetersiz ya da etkisiz kaldığı durumlarda ve devletin influenza ..i i..iiBubelge, 2üvenlı*elektronik imza ile imzalanmıştır. itJ.i invirüs tee/terşhöl.m ^ak-m Aibi -rünü kull&psma1aaLouJ-lanıkırrc >tıbbıBelge Ddğrul
2/17 ürün uygulanırken, influenza virüsleri gibi virüslere karşı önlem ile ilişkili devlet talimatı içeren güncel bilgi sağlanmalıdır ve yalnızca uygun hastalara reçete edilmelidir. Favipiravir bakteriyel enfeksiyonlara karşı etkili değildir. Favipiravirin çocuklarda kullanımı mevcut değildir. Tedavi, influenza benzeri semptomların görülmesinden hemen sonra başlatılmalıdır. Favipiravir yeni veya yeniden ortaya çıkan influenza virüsü enfeksiyonları için kullanılmamıştır. Bu kısa ürün bilgisinde verilen advers reaksiyonlar ve klinik çalışma sonuçları hakkında bilgi,onaylanmış dozajdan daha düşük doz seviyeleri ve diğer ülkelerde yapılan klinik çalışmalarlaJaponya klinik çalışmalarına dayanmaktadır. Gut hastaları ya da gut öyküsü olan hastalarda ve hiperürisemili hastalarda kan ürik asit seviyesi artabilir ve semptomlar ağırlaşabilir. Bu hastalarda dikkatli kullanılmalıdır. Favipiravirin onaylanmış dozaj ile etkinliğini ve güvenliliğini incelemek için herhangi bir klinik çalışma yapılmamıştır. Onaylanmış dozaj, influenza virüsü enfeksiyonu olan hastalarda plasebokontrollü bir faz I/II klinik çalışmasının sonuçları ve Japonya ve diğer ülkelerde yapılançalışmalardan elde edilen farmakokinetik veriler temel alınarak tahmin edilmiştir. Japonya dışında yapılan farmakokinetik çalışmada karaciğer fonksiyon bozukluğu olan hastalarda favipiravir plazma düzeylerinde artış bildirilmiştir. Nedensel ilişki bilinmemekle birlikte,favipiravir dahil anti-influenza virüs ajanlarının uygulanmasından sonra anormal davranış gibipsikonörotik semptomlar bildirilmiştir. İnfluenza virüsü enfeksiyonu bakteriyel enfeksiyonlarla komplike olabilir veya influenza benzeri semptomlarla karıştırılabilir. Bakteriyel enfeksiyon durumunda veya bakteriyel enfeksiyonolduğundan şüpheleniliyorsa, anti-bakteriyel ajanların uygulanması gibi uygun önlemleralınmalıdır. Çocukların ve reşit olmayanların tedavisi için, düşme gibi anormal davranışlardan kaynaklanan bir kaza durumunda önleyici bir yaklaşım olarak, hastalara / ailelerine, anti- influenza virüsajanları ile tedaviye başladıktan sonra anormal davranış gelişebildiği ve dolayısıyla ebeveynlerinçocukların / reşit olmayanların evde tedavi edildiklerinde en az 2 gün boyunca yalnızbırakılmamaları gerektiği konusunda bilgilendirilmelidir. İnfluenza ensefalopatisi ile ilişkilibenzer semptomlar bildirildiğinden, yukarıdaki ile aynı talimat verilmelidir. 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriFavipiravir, sitokrom P-450 (CYP) ile metabolize edilmez; çoğunlukla aldehid oksidaz (AO) tarafından ve kısmen de ksantin oksidaz (XO) tarafından metabolize edilir. Favipiravir AO veCYP2C8'i inhibe eder, ancak CYP'yi uyarmaz (Bkz Bölüm 5.2). Favipiravir, aşağıdaki ilaçlarla birlikte uygulandığında dikkatli kullanılmalıdır.
3/17
In vitroİlaç-İlaç Etkileşimi Klinik Çalışmalar:Birlikte uygulanan ilaçların favipiravirin farmakokinetiği üzerine etkileriFavipiravir için parametre oranı(%90 CI)(Birlikte uygulanan /tek başına uygulanan)Birlikte kullanılan ilaç ve dozajDozlamazamanıFavipiravir dozunCmaksAUC
Teofilin, 1-9 günde, günde iki kez 200mg, 10. günde, günde bir kez 200mg_1,27 [1,15, 1,40] 1,33 [1,19, 1,48]
6.gün 6.gün, günde iki kez 600 mg, 7 ila 10. gün, günde bir kez 600 mg_
10 1,03 [0,92, 1,15] 1,17 [1,04, 1,31]
7gün Oseltamivir, 1 - 5 günde, günde iki 1,01 [0,91, 1,11] 'S aglik-tit ek-ebys0,98 [0,87, 1,10] /www. tnrkiye.gov.
10 5.gün, 600 mg günde iki kez, AlOlySITY3 YnUyak 1 Uak 1U-6.gün lanmıştır.Belge Takip Adresi:lıttpskezJimugf.Belge Do'ZW56ZW56Zmf
4/17
5/17
Özel popülasyonlara ilikin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: X Çocuk dourma potansiyeli bulunan kadınlar/ Doum kontrolü (Kontrasepsiyon)KOVİPİR'i çocuk doğurma potansiyeli olan kadınlara uygularken, tedaviye başlamadan önce negatif gebelik testi sonucunu onaylanmalıdır. Tedavi sırasında hamilelikten şüpheleniliyorsa,tedaviyi derhal bırakılmalıdır. Tedavi sırasında ve tedavi sonlanımından sonraki 7 gün boyunca etkili doğum kontrol yöntemleri kullanılmalıdır. Gebelik dönemiKOVİPİR, gebe veya gebelik şüphesi olan kadınlara uygulanmaz. Klinik maruziyete benzer veya daha düşük maruziyet düzeylerine sahip hayvan çalışmalarında erken embriyonik ölümler(sıçanlar) ve teratojenisite (maymunlar, fareler, sıçanlar ve tavşanlar) gözlemlenmiştir.
6/17 Favipiravir'in gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açtığından şüphelenilmektedir. Favipiravir gebelik döneminde kontrendikedir. Laktasyon dönemiHidroksillenmiş bir form olan favipiravirin ana metabolitinin anne sütüne dağıldığı gösterilmiştir. Bu nedenle emziren kadınlarda KOVİPİR uygulanırken emzirme durdurulmalıdır. Üreme yetenei/FertiliteFavipiravir sperm içerisinde dağılır. Bu tıbbi ürün erkek hastalara uygulanırken tedavi sırasında ve tedavi sonlanımından sonraki 7 gün süresince en etkili kontrasepsiyon metodunun (erkeklerkondom kullanmalıdır) kullanılması gerekliliği ve tüm riskler ile ilgili hasta bilgilendirmelidir. Hayvan çalışmalarında, sıçanlarda (12 haftalık) ve genç köpeklerde (7 ila 8 aylık) testiste histopatolojik değişiklikler ve farelerde (11 haftalık) anormal sperm bulguları bildirilmiştir. İlaçkesildikten sonra bu çalışmalarda iyileşme veya iyileşme eğilimi gözlenmiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerFavipiravir dahil anti-influenza virüs ajanlarının uygulanmasından sonra anormal davranış gibi psikonörötik semptomlar bildirildiğinden ve bulanık görmeye de neden olabileceğindenhastalar araç veya makine kullanırken dikkatli olmaları konusunda uyarılmalıdırlar. 4.8. İstenmeyen etkilerTüm ilaçlarda olduğu gibi, KOVİPİR'in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Favipiravir hiçbir zaman onaylanmış dozaj ile verilmemiştir. Japon klinik çalışmalarında ve global faz III çalışmasında (onaylanan dozajdan daha düşük doz seviyeleri ile yapılan çalışmalar),güvenlik açısından değerlendirilen 501 hastanın 100'ünde (%19,96) (anormal laboratuvar testdeğerleri dahil) advers reaksiyonlar gözlenmiştir. Başlıca advers 24 hastada (%4,79) kan ürik asit seviyesinin artması, 24 hastada (%4,79) ishal, 9 hastada (%1,80) nötrofil sayısında azalma, 9 hastada (1,80) AST (GOT) artışını içermiştir. %), 8hastada (%1,60) ALT (GPT) artışı olarak belirtilmiştir. Diğer anti-influenza virüsü ajanları (benzer ilaçlar) ile aşağıdaki klinik olarak anlamlı advers reaksiyonlar bildirilmiştir. Hastalar dikkatle izlenmeli ve herhangi bir anormallik gözlenirsetedavi kesilmeli ve uygun önlemler alınmalıdır. Kan ve lenf sistemi hastalıkları:güvenli elektronik imza ile imzalanmıştır.Belge DoyorızBeyaz(kaHxhöcresk:saytsMHa ıâzalma,Bn#trofii Afeyisı®d/a,azatma,- strombösi^sayfsında 7/17 azalma Bağışıklık sistemi hastalıkları:Bilinmiyor: Şok, anafilaksi Psikiyatrik hastalıklar:Bilinmiyor: Nörolojik ve psikiyatrik belirtiler (bilinç bozukluğu, anormal davranış, delirium, halüsinasyon, sanrı, konvülsiyon vb.) Solunum, göğüs bozuklukları ve mediyastinal hastalıklar:Bilinmiyor: Zatürre Gastrointestinal hastalıklar:Bilinmiyor: Hemorajik kolit Hepatobiliyer hastalıklar:Bilinmiyor: Hepatit fulminan, karaciğer fonksiyon bozukluğu, sarılık Deri ve deri altı doku hastalıkları:Bilinmiyor: Toksik epidermal nekroliz (TEN), okülomukokutanoz sendrom (Stevens- Johnson Sendromu) Böbrek ve idrar yolu hastalıkları:Bilinmiyor: Akut böbrek hasarı Aşağıda yer alan advers reaksiyonlar, Japon klinik çalışmalarında ve küresel faz III klinik çalışmalarda gözlenen advers reaksiyonlardır (onay dozundan daha düşük doz seviyeleriyleyapılan çalışmalar). Bu advers reaksiyonlar meydana gelirse, semptomlara göre uygun önlemleralınmalıdır. Kan ve lenf sistemi hastalıkları:Yaygın: Nötrofil sayısında azalma, beyaz kan hücresi sayısında azalma Yaygın olmayan: Beyaz kan hücresi sayısında artış, retikülosit sayısında azalma, monosit artışı Göz hastalıkları:Yaygın olmayan: Bulanık görme, göz ağrısı Kulak ve kulak içi hastalıkları:Yaygın olmayan: Vertigo Kardiyak hastalıklar:Yaygın olmayan: Supraventiküler ekstrasistoller Metabolizma ve beslenme hastalıkları:Yaygın: Kanda ürik asit artışı, kan trigliserit artışı Yaygın olmayan: İdrarda glikoz varlığı, kan potasyumunda azalma
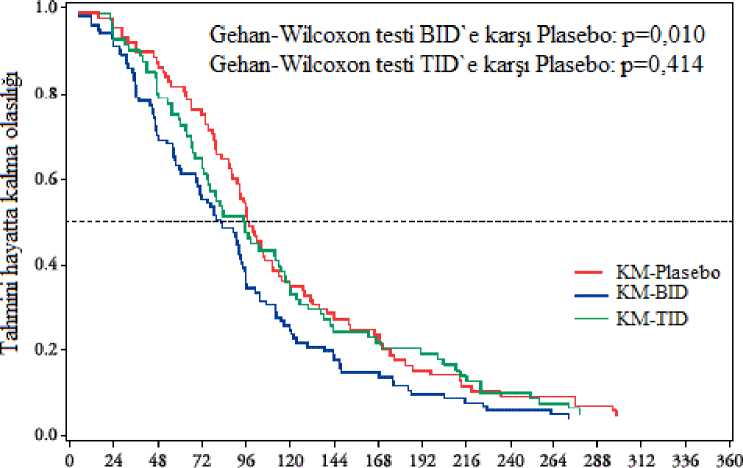
8/17 Solunum, göğüs bozuklukları ve mediyastinal hastalıklar:Yaygın olmayan: Astım, orofaringeal ağrı, rinit, nazofarenjit, tonsilde polip Gastrointestinal hastalıklar:Yaygın: İshal (%4,79) Yaygın olmayan: Bulantı, kusma, karın ağrısı, karın rahatsızlığı, duodenum ülseri, hematokezya, gastrit, disguzi Hepatobiliyer Hastalıklar:Yaygın: AST (GOT) artışı, ALT (GPT) artışı, y-GTP artışı Yaygın olmayan: Kan ALP artışı, kan bilirubin artışı Deri ve deri altı doku hastalıkları:Yaygın olmayan: Pigmentasyon, morarma, döküntü, egzama, kaşıntı Araştırmalar:Yaygın olmayan: İdrarda kan, kan CPK düzeylerinde artış Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aımı ve tedavisiAşırı dozda alınması durumunda toksik yan etkilere yol açabilir. Özel bir antidotu olmadığından semptomatik tedavi yapılmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Sistemik kullanım için antiviraller, direkt etkili antiviraller ATC kodu: J05AX27 Etki mekanizması:Favipiravirin hücrelerde bir ribosil trifosfat formuna (favipiravir RTP) metabolize olduğu ve favipiravir RTP'nin influenza viral replikasyonunda yer alan RNA polimerazı seçici olarak inhibeettiği düşünülmektedir. İnsan DNA polimerazları a, P, y'ya karşı aktivite ile ilgili olarak,favipiravir RTP (1000 pmol/l) a üzerinde inhibitör etki göstermez, a üzerinde %9,1- 13,5inhibitör etki ve y üzerinde % 11,7-41,2 inhibitör etki gösterir. İnsan RNA polimeraz II üzerindekifavipiravir RTP'nin inhibitör konsantrasyonu (IC 50) 905 pmol/l'dir. In vitroantiviral aktivite:Bu belgeBelge Dtfavipravir1 zttp6ZA56vex?tipFBHMiluferizaakvH-üs laborat^¥a^d§®şi,Srı:nıâw'01'0¥4-0;55saipiğ/ml-eEC 50 9/17 değerlerinde antiviral aktivite göstermiştir. Adamantanlara (amantadin, rimantadin), oseltamire veya zanamivire direçli suşlar da dahil olmak üzere mevsimsel tip A ve tip B influenza virüslerine karşı EC 50 değerleri sırasıyla 0,03-0,94 ve0,09-0,83 gg/ml idi. Yüksek patojenik suşları da (H5N1 ve H7N9) kapsayacak şekilde domuz orijinli ve kuş orijinli tip A influenza virüslerine (adamantan, oseltamivir veya zanamivire dirençli suşlar dahil olmaküzere) karşı EC 50 değerleri 0,06-3,53 gg/ml idi. Adamantanlara, oseltamivire ve zanamivire dirençli tip A ve tip B influenza virüslerine karşı EC 50 değerleri 0,09-0,47 gg/ml idi ve herhangi bir çapraz direnç gözlenmemiştir. Direnç:Favipiravir varlığında 30 pasajdan sonra A tipi influenza virüslerinin favipiravire duyarlılığında herhangi bir değişiklik gözlenmemiş ve dirençli virüs seçilmemiştir. Global faz III çalışması dadahil olmak üzere klinik çalışmalarda favipiravir dirençli influenza virüsleri oluşması ile ilgilibilgi elde edilmemiştir. Klinik Çalışmalar:Japon olmayan popülasyona ait sonuçlar: A tipi veya B tipi influenza hastalarında plasebo kontrollü bir faz I/II çalışması yapılmıştır. (1800 mg/800 mg günde iki kez (BID), 1 gün boyunca günde iki kez favipiravir 1800 mg oraluygulama, ardından 4 gün boyunca günde iki kez 800 mg; 2400 mg/600 mg günde üç kez (TID),1 gün boyunca 2400 mg + 600 mg + 600 mg favipiravir oral uygulaması, ardından 4 gün boyuncagünde üç kez 600 mg) Birincil influenza semptomunu (öksürük, boğaz ağrısı, baş ağrısı, burun tıkanıklığı, vücut ağrıları ve ağrılar, yorgunluk) ve vücut sıcaklığını hafifletmek için gereken süre ilgili olarak, favipiravir1800 mg/800 mg BID (101 hasta), influenza semptomlarını hafifletmede plaseboya kıyaslaönemli bir farklılık göstermiştir (88 hasta) (p = 0,01, Gehan-Wilcoxon testi), ancak favipiravir2400 mg / 600 mg (TID) (82 hasta) önemli farkı gösteremedi (p = 0,414, Gehan Wilcoxon testi).
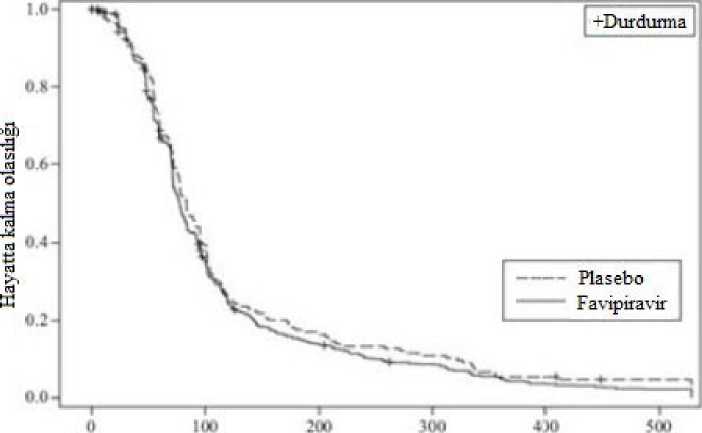
10/17 Takip edilen zaman (saat) Şekil 1.Gehan-Wilcoxon testi BID'e karşı plasebo ve TID'e karşı plasebo grafiğiA tipi veya B tipi influenza hastalarında iki plasebo kontrollü faz III çalışması (1 gün boyunca günde iki kez favipiravir 1800 mg oral uygulama, ardından 4 gün boyunca günde iki kez 800 mg[1800 mg / 800 mg (BID)]) primer influenza semptomlarını hafifletmek için gereken süre (Çalışma 1.(Çalışma 2.tüminfluenza semptomlarının hiç olmaması veya hafif olması ve ateşin her ikisi de en az 21,5 saatkorunarak düzelmesi olarak tanımlanmıştır.) tanımlanması için yapılmıştır.
11/17 İOO 400 I.UDurdurma>Elı-a
rt QcdMS 1J -i -i
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Favipiravirin Farmakokinetik Parametreleri | ||||||||||||||||||
|
13/17
|
1600 mg;'ĞÛ[> mg (BID) |
 |
Zaman (saat)
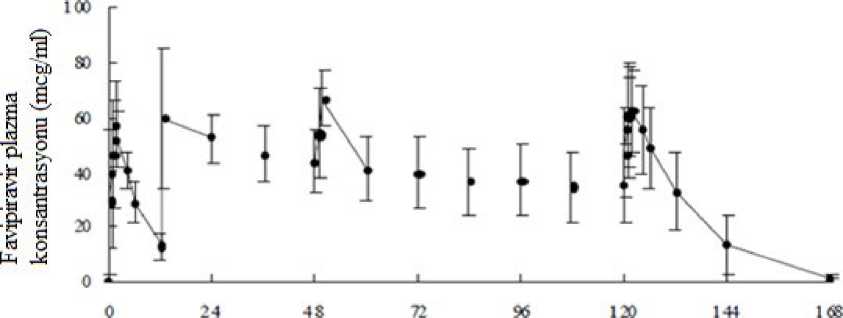
Şekil 4.
Favipiravir'in plazma konsantrasyonu - zaman çizelgesiAldehit oksidaz (AO) aktivitesinin az olduğu görülen sağlıklı bir yetişkine 7 gün boyunca birden fazla oral uygulamadan sonra, değişmemiş ilacın tahmini EAA değeri 1. günde 1452,73|ig.saat/mL ve 7. günde 1324,09 |ig-saat/ml olmuştur.
Dağılım:
Japon olmayan popülasyona ait sonuçlar:
Favipiravir, 20 sağlıklı yetişkin erkek deneğe 1 gün boyunca günde iki kez 1200 mg, ardından 4 gün boyunca günde iki kez 800 mg (1200 mg / 800 mg BID) uygulandığında, semendeki ilacıngeometrik ortalama konsantrasyonu 18,341 idi. 3. günde mcg/ml ve tedaviden sonraki ikincigünde 0,053 mcg/ml olarak bulundu. Sperm seviyeleri tedavinin bitiminden sonraki 7 gün içindetüm deneklerde nicelik sınırının (0,02 mcg/ml) altına düştü. Spermada ilaç konsantrasyonununplazmadakine ortalama oranı 3. günde 0,53 ve tedaviden sonraki ikinci günde 0,45 idi.
Serum protein bağlanma oranı 0,3 ila 30 mcg/ml'de %53,4 ila 54,4 (in vitro, santrifüj ultrafiltrasyon) idi.
Hayvan verileri:
Tek bir 14C-favipiravir dozu maymunlara oral olarak uygulandığında, dokularda geniş bir şekilde dağıtıldı. Her dokunun radyoaktivitesi uygulamadan 0,5 saat sonra zirve yaptı ve plazmadaradyoaktiviteye paralel olarak değişti. Akciğer dokularındaki radyoaktivitenin, plazmadakineoranı uygulamadan 0,5 saat sonra 0,51 idi ve ilaç hızla enfeksiyon bölgesi olarak kabul edilensolunum dokularına dağıtıldı. Böbrek radyoaktivitesi 2,66 oranıyla plazmadan daha yüksekti.Kemikler hariç her dokudaki radyoaktivite, uygulamadan sonraki 24 saat içinde zirvenin %2,8'inedüştü.
Biyotransformasyon:
Favipiravir sitokrom P-450 (CYP) ile metabolize edilmez, çoğunlukla aldehid oksidaz (AO) ile metabolize edilir ve kısmen ksantin oksidaz (XO) ile hidroksillenmiş bir formda metabolize olur.
Bdge Doksan Ikarafiiğefzmikrox5omyaiın^Ykuyllananuçalışm§]ırda,1p^derso:ks^laiwowluuşuymguovAsOgHa-k4ivjbtyessinde
14/17
bireyler arası maksimum 12 kat değişim ile 3,98 ila 47,6 pmol/mg protein/dakika arasında değişmektedir. Hidroksilatlı formdan farklı bir metabolit olarak insan plazması ve idrarında birglukuronat konjugatı gözlenmiştir.
Eliminasyon:
Favipiravir esas olarak hidroksillenmiş bir form olarak idrar ile atılır ve az miktarda değişmemiş ilaç gözlenir. 6 sağlıklı yetişkinle yapılan bir 7 günlük oral çoklu doz çalışmasında*, sonuygulamadan sonraki 48 saat boyunca değişmemiş ilacın ve hidroksillenmiş formun kümülatifidrar atılım oranı sırasıyla %0,8 ve %53,1 olmuştur.
* 1.günde 1200 mg + 400 mg, daha sonra 2. ve 6. günlerde günde iki kez 400 mg, ardından 7. günde bir kez 400 mg. Onaylanmış favipiravir dozu, ''1 gün boyunca günde iki kez 1600 mgoral, ardından 4 gün boyunca günde iki kez 600 mg oraldir''.
Doğrusallık/doğrusal olmayan durum:
Veri yoktur.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Favipiravir, hafif ve orta derecede karaciğer fonksiyon bozukluğu olan (Child-Pugh sınıflaması A ve B, her biri 6 hasta) 1 gün boyunca günde iki kez 1200 mg, ardından 4 gün boyunca günde ikikez 800 mg (1200 mg/800 mg) olan hastalara oral olarak uygulandığında) sağlıklı yetişkindeneklerle karşılaştırıldığında, 5. günde Cmaks ve EAA hafif karaciğer fonksiyon bozukluğuolanlarda sırasıyla yaklaşık 1,6 kat ve 1,7 kat ve orta derecede karaciğer fonksiyon bozukluğuolan hastalarda sırasıyla 1,4 kat ve 1,8 kat olmuştur.
Favipiravir şiddetli karaciğer fonksiyon bozukluğu olan (Child-Pugh sınıflaması C, 4 denek) 1 gün boyunca günde iki kez 800 mg ardından 2 gün boyunca günde iki kez 400 mg (800 mg/400 mgBID) oral yoldan verildiğinde, sağlıklı yetişkin deneklerle karşılaştırıldığında, 3. günde Cmaks veAUC sırasıyla yaklaşık 2,1 kat ve 6,3 kat olmuştur.
Karaciğer fonksiyon bozukluğu olan hastalarda favipiravirin plazma düzeylerinde artışı bildirilmiştir.
5.3. Klinik öncesi güvenlilik verileri
İnfluenza virüsleri A, (H7N9), A (H1N1) pdm09 veya A (H3N2 ile aşılanmış fare enfeksiyon modellerinde <60 mg/kg/gün dozunda favipiravirin 5 günlük oral uygulama ile, akciğerdokularında virüs titrelerinin azalması gözlenmiştir. İnfluenza virüsleri A ile (H3N2) veya A(H5N1), aşılanmış fare enfeksiyon modellerinde terapötik etki bir Favipiravirin 5 günlük oralyolla 30 mg/kg/gün doz uygulanmıştır. İnfluenza ile virüs A (H3N2) aşılanmış bir SCID fareenfeksiyon modelinde, favipiravirin 30 mg/kg/gün dozunda oral uygulaması terapötik etki 14 güngözlenmiştir.
Hayvan çalışmalarında klinik maruziyete benzer ve ondan daha düşük düzeylerde maruziyet Belge Dqgurumurfâd zerkew 5(emgryıönik3ölürmı(f&flâr) ve Btera^ofeAis!tett(may,m,ü*ı7efaf,ö,/s£raf-tve- tavşan)
15/17
gözlenmiştir.
Jüvenil köpeklerde (8 haftalık) yapılan 1 aylık çalışmada letal dozdan daha düşük dozda (60 mg/kg/gün) verilmesinden 20 gün sonra ölüm vakaları gözlenmiştir. Jüvenil hayvanlarda (6günlük ratlar ve 8 haftalık köpeklerde) anormal yürüyüş, iskelet sistemi ve kas sistemi liflerindeatrofi ve papiler kaslarda dejenerasyon/nekroz/mineralizasyon bildirilmiştir.
Hayvan çalışmalarında ratlarda (12 haftalık) ve küçük köpeklerde (7-8 aylık) testislerde histopatolojik değişiklikler ve farelerde (11 haftalık) spermlerinde anormal bulgular bildirilmiştir.Uygulama sonlandırıldıktan sonra iyileşme veya iyileşmeye eğilim gözlenmiştir.
6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesi
Çekirdek tablet:
Prejelatinize mısır nişastası Krospovidon CL-FKolloidal silika 200 susuzKopovidon VA 64Krospovidon CLSodyum Stearil FumaratSaf Su
Film kaplama:
Opadry KB Low Viscosity 310A180023 White (Macrogol (PEG) Polyvinyl alcohol graft copolymer, Titanyum dioksit, Kaolin, Copolyvidone, Sodium Lauryl Sulfate)
Opadry KB Low Viscosity 310A120019 Yellow (Macrogol (PEG) Polyvinyl alcohol graft copolymer, Titanyum dioksit, Kaolin, Iron Oxide Yellow, Copolyvidone, Sodium Lauryl Sulfate)
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında ve ambalajında saklayınız.
6.5. Ambalajın nitelii ve içerii
PE'li alüminyum formatura-PE'li alüminyum folyo blisterlerde karton kutu içinde kullanıma
sunulmaktadır. Bu belge
16/17
6.6. Beeri tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller ''Tıbbi Atıkların Kontrolü Yönetmeliği'' ve ''Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
NOBEL İLAÇ SANAYİ VE TİCARET AŞ.
Saray Mah. Dr. Adnan Büyükdeniz Cad. No:14 34768 Ümraniye / İSTANBULTel : (216) 633 60 00Faks : (216) 633 60 01
8. RUHSAT NUMARASI
2021/386
9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 20.10.2021 Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
17/17
İlaç Bilgileri
Kovipir 200 Mg Film Kaplı Tablet
Etken Maddesi: Favipiravir
Kullanma talimatı ve kısa ürün bilgileri
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.