Temomid 250 Mg Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADITEMOMİD 250 mg Kapsül Sitotoksik 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Temozolomid 250 mg Yardımcı madde:Laktoz anhidröz (sığır sütü kaynaklı) 172 mg Yardımcı maddeler için-6.1'e bakınız. 3. FARMASÖTİK FORMSert kapsül Sert kapsüller opak beyaz gövdeli ve opak beyaz kapaklı olup, açık pembe renkli toz içerir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarTEMOMİD, birinci basamakta yeni tanı konmuş glioblastoma multiforme tedavisinde radyoterapi ile birlikte ve sonrasında endikedir. TEMOMİD, standart tedaviden sonra nükseden veya progresyon gösteren glioblastoma multiforme veya anaplastik astrositoma gibi malign glioma hastalarında endikedir. TEMOMİD, metastatik malign melanomlu hastaların tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:TEMOMİD sadece beyin tümörleri konusunda uzman doktorlar tarafından reçetelendirildiği zaman kullanılmalıdır. TEMOMİD yemekten en az bir saat önce, aç karnına verilmelidir. Uygulamadan önce veya sonra anti-emetik tedavisi uygulanabilir. TEMOMİD tedavisi hastalığın ilerlemesine kadar maksimum 2 yıl sürdürülebilir. 1/18 Yeni teşhis edilen glioblastoma multiformeli erişkin hastalar:Eşzamanlı faz:TEMOMİD, radyoterapi (30 fraksiyonda verilen 60 Gy) ile eş zamanlı olarak, 42 gün süreyle günde 75 mg/m2 dozunda ve takibinde 6 kür adjuvan tedavi olarak oral yoldan verilir. Dozazaltılması önerilmez; ama hastanın toleransına göre doza ara verilebilir. Aşağıdaki koşullarıntümü sağlanır ise, TEMOMİD ile eş zamanlı dönem 42 günden 49 güne kadar sürdürülebilir: - mutlak nötrofil sayısı > 1,5 x 109 /l; - trombosit sayısı > 100 x 109 /l; - genel toksisite kriterleri (CTC) hematolojik olmayan toksisite <evre 1 (alopesi, bulantı ve kusmadışında). Tedavi sırasında her hafta tam kan sayımı yapılmalıdır. Eşzamanlı fazdaki TEMOMİD dozuna, Tablo 1'de belirtilen hematolojik ve hematolojik olmayan toksisite kriterlerine göre ara verilmeliveya doz kesilmelidir.
a Eşzamanlı TMZ tedavisi aşağıdaki durumların tümü sağlandığı takdirde sürdürülebilir: mutlak nötrofil sayısı >1,5 x 109/l; trombosit sayısı >100 x 109/l; CTC hematolojik olmayantoksisite <evre 1 (alopesi, bulantı ve kusma dışında). TMZ = TEMOMİD; CTC = Ortak Toksisite Kriterleri. Adjuvan faz (monoterapi)TEMOMİD + Radyoterapi fazı tamamlandıktan 4 hafta sonra, TEMOMİD adjuvan tedavi olarak 6 kür daha uygulanır. 1. kürdeki doz (adjuvan) 5 gün süreyle günde bir defa 150 mg/m2 verilmesinitakiben 23 gün tedavi uygulanmamasıdır. 2. kürün başlangıcında, eğer 1. kür için CTChematolojik-olmayan toksisite evre <2 (alopesi, bulantı ve kusma dışında), mutlak nötrofil sayısı(ANC) > 1,5 x 109/l ve trombosit sayısı > 100 x 109/l ise doz 200 mg/m2'ye yükseltilir. 2. kürdedoz yükseltilmemişse sonraki kürlerde doz yükseltilmemelidir. Toksisite oluşmazsa, sonraki herkürün ilk 5 günü için günlük doz 200 mg/m2 olarak kalır. Adjuvan faz sırasındaki doz azaltmaları Tablo 2 ve 3'e göre uygulanmalıdır.Tedavi sırasında 22. günde tam kan sayımı yapılmalıdır (ilk TEMOMİD dozundan 21 gün sonra). TEMOMİD dozu Tablo 3'e göre azaltılmalı veya kesilmelidir.
a TMZ doz düzeyleri Tablo 2'de sıralanmıştır. b Doz 100 mg/m2'ye düşürüldüğünde halen kabul edilemeyen toksisite gerçekleşiyorsa, veya dozun azaltılmasından sonra aynı evre 3 hematolojik olmayan toksisite (alopesi, bulantı, kusmadışında) oluşursa TMZ kesilmelidir. TMZ = TEMOMİD; CTC = Ortak Toksisite Kriterleri. Rekürran veya progresif glioması veya malign melanomu olan erişkin hastalar: TEMOMİD oral yoldan 28 günde bir tekrarlanan kürler halinde uygulanır. Önceden kemoterapi uygulanmamış hastalarda 5 gün süreyle günde bir defa 200 mg/m2 dozunda verilir. Öncedenkemoterapi uygulanmış hastalarda başlangıç dozu günde bir defa 150 mg/m2 olup ikinci kürdeeğer hematolojik toksisite yoksa bu doz günde 200 mg/m2'ye yükseltilir. Sonraki kürün birincigününde mutlak nötrofil sayısının (MNS) 1,5 x 109/l'ye eşit veya bundan büyük olması vetrombosit sayısının 100 x 109/l'ye eşit veya bundan büyük olması gerekir. TEMOMİD içintoksisitiye bağlı doz değişikliklerinin, en düşük mutlak nötrofil ve platelet sayılarına göre yapılmasıgerekmektedir. Rekürran veya progresif glioması olan pediyatrik hastalar: Üç yaş ve daha büyük hastalarda TEMOMİD oral yoldan 28 günde bir tekrarlanan kürlerde, 5 gün süreyle 200 mg/m2 dozunda verilir. Önceden kemoterapi uygulanmış pediyatrik hastalardabaşlangıç dozu 5 gün süreyle günde bir defa 150 mg/m2 olmalı ve hematolojik toksisite yoksadoz bir sonraki kürde 5 gün süreyle günde bir defa 200 mg/m2'ye yükseltilmelidir. Rekürran veya progresif malign glioma veya malign melanomda doz değişiklikleri için laboratuar parametreleri: İlacın dozunu ayarlamadan önce, aşağıdaki laboratuar parametrelerinin mevcutolması gerekir: Mutlak nötrofil sayısı (MNS) > 1,5 x 109/L ve trombosit > 100 x 109/L. 22. günde(ilk dozdan 21 gün sonra) veya bu günü takiben 48 saat içinde tam kan sayımı yapılmalıdır vemutlak nötrofil sayısı 1,5 x 109/L ve trombosit sayısı 100 x 109/L' nin üzerine çıkana dek haftadabir tekrarlanmalıdır. Eğer herhangi bir tedavi kürü sırasında mutlak nötrofil sayısı < 1,0 x 109/Lveya trombosit sayısı < 50 x 109/L altına düşerse, takip eden kürde doz düzeyi bir basamak (50mg/m2) azaltılmalıdır. Doz düzey basamakları, 100 mg/m2, 150 mg/m2 ve 200 mg/m2'dir. Önerilen endüşük doz 100 mg/m2'dir. Uygulama şekli:Kapsüller oral yolla alınmalıdır. TEMOMİD verilmesini takiben kusma olursa, aynı gün içinde ikinci bir doz verilmemelidir. 3/18 TEMOMİD aç karnına alınmalıdır (Yemekten en az bir saat önce). Kapsüller bir bardak su ile yutulmalıdır. Kapsüller açılmamalı veya çiğnenmemelidir. Doz mümkün olan minimum sayıda kapsül ile sağlanmalıdır. Kapsülün tahrip olması halinde, cilt ya da muköz membranların kapsülün toz içeriği iletemasından kaçınılmalıdır. Temas olduğu tadirde bölge iyice yıkanmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Normal hepatik fonksiyonu olan hastalar ve hafif ya da orta dereceli hepatik disfonksiyonu olan hastalarda temozolomidin farmakokinetiği karşılaştırılabilir düzeydedir. Ağır karaciğer fonksiyon bozukluğu olan (Child-Pugh Sınıflaması: Kategori C) veya böbrek fonksiyon bozukluğu olan hastalarda TEMOMİD uygulanmasına ilişkin veriler mevcut değildir.Temozolomidin farmakokinetik özelliklerine dayanarak ağır karaciğer bozukluğu veya herhangiderece böbrek fonksiyon bozukluğu olan hastalarda doz azaltımına gerek duyulmamaktadır. Ancak,TEMOMİD bu hastalara verilirken dikkatli olunmalıdır. Pediyatrik popülasyon:3 yaşın altındaki çocuklarda temozolomid kullanımına ilişkin klinik deneyim yoktur. 3 yaş üzerindeki çocuklarda deneyim sınırlıdır. 18 yaşın altındaki malign melanom hastalarındakullanımına ilişkin klinik deneyim yoktur (bkz. Bölüm 4.4 ve 5.1). 3 yaşın altındaki çocuklarda etkililik ve güvenliliği kanıtlanmamıştır. Geriyatrik popülasyon:19-78 yaş arasındaki popülasyondaki farmakokinetik analizlere göre temozolomid klerensi yaştan etkilenmez. Bununla birlikte, 70 yaş üstündeki yaşlı hastalarda genç hastalara göre nötropeni vetrombositopeni riski daha fazladır (bkz. Bölüm 4.4). Bu yüzden, yaşlı hastalarda TEMOMİDkullanımında dikkatli olunmalıdır. 4.3. KontrendikasyonlarTEMOMİD, - Etkin maddeye veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırıduyarlılığı, - Dakarbazine (DTIC) karşı aşırı duyarlılığı, - Ağır miyelosupresyonu olan hastalarda kontrendikedir (bkz. Bölüm 4.4). 4.4. Özel kullanım uyarıları ve önlemleriFırsatçı enfeksiyonlar ve enfeksiyonların reaktivasyonuTEMOMİD ile tedavi sırasında fırsatçı enfeksiyonlar (Pneumocystis jiroveciipnömonisi gibi) ve enfeksiyonların reaktivasyonu (hepatit B virüsü (HBV), sitomegalovirüs (CMV) gibi) gözlenmiştir(bkz. Bölüm 4.8).4/18 Pneumocystis jiroveciipnömonisiBir pilot çalışmada uzatılmış 42 günlük şemayla eşzamanlı olarak temozolomid ve radyoterapi alan hastaların Pneumocystis jiroveciipnömonisi (PCP) gelişimi yönünden özel bir riske sahipoldukları gösterilmiştir. Bu nedenle, 42 günlük (maksimum 49 günlük) rejimde eş zamanlıTEMOMİD ve radyoterapi alan bütün hastalara lenfosit sayısı ne olursa olsun PCP için profilaksiuygulanması gerekir. Lenfopeni ortaya çıkarsa, hastalar lenfopeni Evre <1'e gerileyinceye kadarprofilaksiye devam etmelidir.Temozolomidin, daha uzun süreli bir dozaj rejiminde kullanılması durumunda PCP görülme sıklığı artabilir. Ancak, temozolomid alan tüm hastalar, özellikle de steroid kullanan hastalar, dozrejimine bakılmaksızın PCP açısından yakından izlenmelidir. Özellikle deksametazon veya diğersteroidlerle birlikte temozolomid kullanan hastalarda ölümcül solunum yetmezliği vakaları raporedilmiştir. HBVÖlümle sonuçlanan bazı vakalarda, hepatit B virüsü (HBV) reaktivasyonuna bağlı hepatit rapor edilmiştir. Pozitif hepatit B serolojisi olan hastalarda (aktif hastalığı olanlar da dahil) tedaviyebaşlanmadan önce karaciğer hastalığında uzmanlara danışılmalıdır. Tedavi sırasında hastalarizlenmeli ve uygun şekilde tedavi edilmelidir. Herpetik meningoensefalitPazarlama sonrası vakalarda, eş zamanlı steroid kullanan vakalar dahil, radyoterapi ile birlikte temozolomid alan hastalarda herpetik meningoensefalit (ölümle sonuçlanan vakalar dahil)görülmüştür. HepatotoksisiteTemozolomid ile tedavi edilen hastalarda ölümcül karaciğer yetmezliği dahil olmak üzere karaciğer hasarı bildirilmiştir (bkz. Bölüm 4.8). Tedaviye başlamadan önce karaciğer fonksiyon testleriyapılmalıdır. Bu testler anormal ise, hekimler temozolomide başlamadan önce ölümcül karaciğeryetmezliği potansiyeli dahil risk/yarar oranını değerlendirmelidir. 42 günlük tedavi kürü alanhastalarda, karaciğer fonksiyon testleri bu kürün ortalarında tekrarlanmalıdır. Tüm hastalarda, herbir tedavi küründen sonra karaciğer fonksiyon testleri yapılmalıdır. Anlamlı karaciğer fonksiyonanormallikleri saptanan hastalarda hekimler tedaviye devam edilmesinin risk/yarar oranınıdeğerlendirmelidir. En son temozolomid tedavisinden birkaç hafta sonra veya daha sonra karaciğertoksisitesi meydana gelebilir. MalignitelerÇok nadir olarak miyeloid lösemi dahil olmak üzere miyelodisplastik sendrom ve sekonder malignite vakaları bildirilmiştir (bkz. Bölüm 4.8). Anti-emetik tedaviBulantı ve kusma temozolomid tedavisiyle çok yaygın şekilde görülür. TEMOMİD uygulanmadan önce veya uygulandıktan sonra anti-emetik tedavi uygulanabilir. Yeni teşhis edilen glioblastoma multiformeli erişkin hastalar için:Eş zamanlı fazın başlangıç dozundan önce anti-emetik profilaksisi önerilir ve monoterapi fazında 5/18 anti-emetik profilaksisi kuvvetle önerilir. Rekürran veya _progresif malign glioması olan hastalar:Önceki tedavi kürlerinde şiddetli (evre 3 veya 4) kusma yaşayan hastalarda anti-emetik tedavi gerekebilir. Laboratuvar parametreleriTEMOMİD ile tedavi edilen hastalar uzun süren pansitopeni dahil miyelosupresyon yaşayabilir; bu durum bazı vakalarda ölümle sonuçlanan aplastik anemiye neden olabilir. Bazı vakalardakarbamazepin, fenitoin ve sülfametoksazol/trimetoprim gibi aplastik anemiyle ilişkili tıbbi ürünlereeş zamanlı maruz kalım değerlendirmeyi karmaşıklaştırır. Tedaviden önce aşağıdaki laboratuvarparametreleri karşılanmalıdır: MNS > 1,5 x 109/l ve trombosit sayısı > 100 x 109/l. İlk dozdan 21gün sonra (22. günde) veya o günden sonraki 48 saat içinde tam kan sayımı yapılmalı ve MNS 1,5x 109/l' nin üzerine ve trombosit sayısı 100 x 109/l'nin üzerine çıkıncaya kadar haftada bir tamkan sayımı yapılmalıdır. Herhangi bir kürde MNS 1,0 x 109/l'nin altına veya trombosit sayısı 50 x109/l'nin altına düşerse bir sonraki kürde 1 doz düzeyi azaltılmalıdır (bkz. Bölüm 4.2). Dozdüzeyleri 100 mg/m2, 150 mg/m2 ve 200 mg/m2'dir. Önerilen en düşük doz 100 mg/m2'dir. Pediyatrik kullanım: Üç yaşın altındaki çocuklarda TEMOMİD kullanımına ilişkin klinik deneyim yoktur. Daha büyük yaştaki çocuklarda ve ergenlerde deneyim çok sınırlıdır (bkz. Bölüm 4.2 ve 5.1). 18yaşın altındaki malign melanom hastalarında kullanımına ilişkin klinik deneyim yoktur. Yaşlı hastalarda kullanım (70 yaş üzeri): Yaşlı hastalarda genç hastalara göre nötropeni ve trombositopeni riski daha fazladır. Bu nedenle, yaşlı hastalarda TEMOMİD kullanımında dikkatli olunmalıdır. Erkek hastalar: TEMOMİD ile tedavi edilen erkeklerin son dozu aldıktan sonraki 6. aya kadar çocuk sahibi olmamaları ve tedaviden önce spermlerin dondurularak korunması konusunda tavsiye almalarıönerilir (bkz. Bölüm 4.6). Diğer: TEMOMİD 68,19 mg laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriAyrı bir faz I çalışmada, ranitidinle birlikte temozolomid uygulaması temozolomidin emilim derecesinde ya da onun aktif metaboliti monometil triazenoimidazol karboksamide (MTIC) maruzkalımda değişikliklere yol açmamıştır. Temozolomid yemekle birlikte uygulandığında Cmax'daki %33'lük azalma ve EAA'da %9'luk azalma görülmüştür. Cmax'daki değişimin klinik anlamlılığı bertaraf edilemeyeceğinden,temozolomid yemekle birlikte uygulanmamalıdır. Faz II çalışmalardaki popülasyon farmakokinetiği üzerinde yapılan bir analize dayanarak 6/18 deksametazon, proklorperazin, fenitoin, karbamazepin, ondansetron, H2 reseptör antagonistleri veya fenobarbital ile birlikte uygulanması, temozolomidin klerensini değiştirmemektedir. Valproik asit ilebirlikte uygulanması durumunda temozolomid klerensinde küçük fakat istatistiksel olarak anlamlıbir azalma meydana gelmektedir. Temozolomidin diğer tıbbi ürünlerin metabolizması ya da eliminasyonu üzerindeki etkilerini belirlemek amacıyla hiçbir çalışma yapılmamıştır. Bununla beraber temozolomid karaciğerdemetabolize edilmediği ve proteinlere düşük oranda bağlandığı için, diğer tıbbi ürünlerinfarmakokinetiğini etkilemesi muhtemel değildir (bkz. Bölüm 5.2). Temozolomid ile diğer miyelosupresif ajanların kombine kullanımı, miyelosupresyon olasılığını artırabilir. Özel popülasyonlara ilişkin ek bilgilerHerhangi bir veri yoktur. Pediyatrik popülasyonEtkileşim çalışmaları yalnızca erişkinlerde yapılmıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: D Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlara TEMOMİD kullanımı sırasında gebeliği önlemek için etkili kontrasepsiyon kullanmaları tavsiye edilmelidir. Gebelik dönemiTEMOMİD'in gebe kadınlarda kullanımına ilişkin veri mevcut değildir. 150 mg/m2 temozolomid alan fare ve tavşanlarda yapılan klinik öncesi çalışmalarda teratojenite ve/veya fetal toksisitegösterilmiştir (bkz. Bölüm 5.3). TEMOMİD, gebe kadınlara verilmemelidir. Gebelikte kullanılmasıdüşünülüyorsa, hasta fetusa yönelik potansiyel risk konusunda bilgilendirilmelidir. Laktasyon dönemiTemozolomidin anne sütüne geçip geçmediği bilinmediğinden TEMOMİD emziren kadınlarda kullanılmamalıdır. Üreme yeteneği/fertiliteSıçan ve köpeklerde erkek üreme sisteminde toksisite gösterilmiştir (bkz. Bölüm 5.3). Erkek fertilitesiTemozolomidin genotoksik etkileri olabilir. Bu nedenle temozolomid ile tedavi edilen erkeklere son dozu aldıktan sonra 6 aya kadar çocuk sahibi olmamaları ve temozolomid tedavisine bağlı geridönüşsüz infertilite olasılığı nedeniyle tedaviden önce spermlerini dondurarak saklamaları(kriyokonservasyon) önerilmelidir. 7/18 4.7. Araç ve makine kullanımı üzerindeki etkilerTEMOMİD bitkinlik ve uyku hali nedeniyle araç ve makine kullanma becerisi üzerinde hafif bir etki gösterebilir (bkz. Bölüm 4.8). 4.8. İstenmeyen etkilerGüvenlik profilinin özetiKlinik çalışma deneyimiKlinik çalışmalarda temozolomid ile tedavi edilen hastalarda bildirilen en yaygın advers reaksiyonlar bulantı, kusma, konstipasyon, anoreksi, baş ağrısı, yorgunluk, konvülsiy onlar vedöküntüdür. Hematolojik advers reaksiyonların çoğu yaygın şekilde raporlanmıştır; derece 3-4laboratuvar bulgularının sıklığı Tablo 4'den sonra sunulmaktadır. Rekürren ve progresif gliomalı hastalarda bulantı (%43) ve kusma (%36) genellikle derece 1 veya 2'dir (24 saatte 0 - 5 kusma episodu) ve kendini sınırlayan tarzdadır veya standart antiemetiktedaviyle kolayca kontrol altına alınabilmiştir. Şiddetli bulantı ve kusma insidansı %4'dür. Advers reaksiyonların tablolaştırılmış listesiKlinik çalışmalarda gözlenen ve temozolomidin pazarlama sonrası kullanımı sırasında bildirilen advers reaksiyonlar Tablo 4'de listelenmektedir. Bu reaksiyonlar Sistem Organ Sınıfı ve sıklığa göre sınıflanmaktadır. Sıklık gruplamaları aşağıdaki standart oranlara göre tanımlanmaktadır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (<1/10.000); bilinmiyor: eldeki verilerden hareketle tahmin edilemiyor. Her bir sıklık gruplamasındaistenmeyen etkiler azalan ciddiyet sırasıyla sunulmaktadır.
8/18
9/18
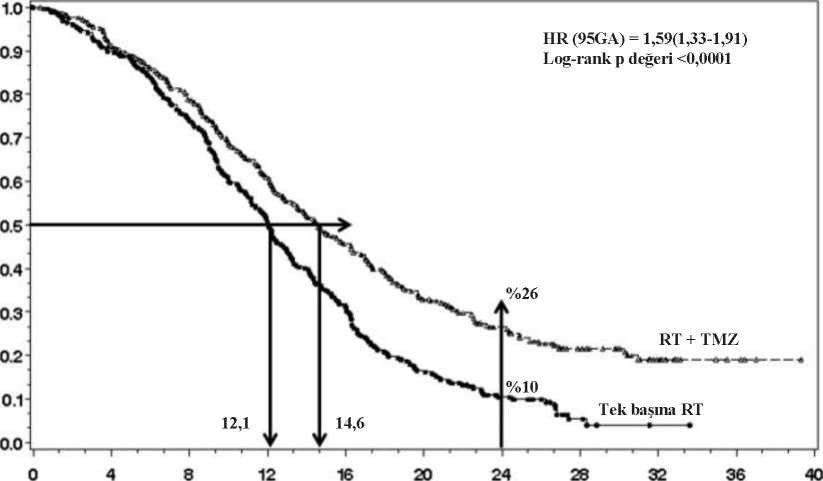
a Farenjit, nazofaringeal farenjit ve Streptokokal farenjiti içerir b Gastroenterit ve viral gastroenteriti içerirc Cushingoid ve Cushing sendromunu içerir d Nöropati, periferik nöropati, polinöropati, periferik duyusal nöropati ve periferik motor nöropatiyi içerir e Görme bozukluğu ve göz hastalığını içerir f Sağırlık, çift taraflı sağırlık, sensorinöral sağırlık ve tek taraflı sağırlığı içerir g Kulak ağrısı ve kulak rahatsızlığını içerir h Abdominal ağrı, alt abdominal ağrı, üst abdominal ağrı ve abdominal rahatsızlığı içerir i Periferik ödem ve periferik şişliği içerir j Karaciğer fonksiyon testinde artış, alanin aminotransferaz artışı, aspartat aminotransferaz artışı ve karaciğer enzimlerinde artışı içerirk Radyasyon hasarını ve radyasyona bağlı cilt hasarını içerir^ Ölümle sonuçlanan vakaları içerir Yeni teşhis edilen glioblastoma multiformeli hastalar:Laboratuvar sonuçları:Temozolomid dahil çoğu sitotoksik ajan için doz kısıtlayıcı olduğu bilinen miyelosupresyon (nötropeni ve trombositopeni) gözlemlenmiştir. Eş zamanlı ve monoterapi tedavi fazları içinlaboratuvar anormallikleri ve advers olaylar kombine edildiğinde, nötropenik olaylar dahil evre 3veya evre 4 nötrofil anormallikleri hastaların %8'inde gözlenmiştir. Trombositopenik olaylardahil evre 3 veya evre 4 trombosit anormallikleri Temozolomid alan hastaların %14'ündegözlenmiştir. Rekürran veya progresif malign gliomalı hastalar:Laboratuvar sonuçları:Evre 3 veya 4 trombositopeni ve nötropeni malign glioma için tedavi edilen hastaların sırasıyla %19 ve %17'sinde görülmüştür. Bu durum hastaların sırasıyla %8 ve %4'ünde temozolomidtedavisinin kesilmesini ve/veya hospitalizasyonu gerektirmiştir. Miyelosupresyon tahmin edilebilirolup (genellikle ilk birkaç kürde, en düşük noktası 21 ve 28. günler arasında görülmüş), düzelmehızlı ve genellikle 1-2 hafta içinde olmuştur. Kümülatif miyelosupresyona ilişkin kanıtlar 11/18 gözlenmemiştir. Trombositopeni varlığı kanama riskini arttırabilir ve nötropeni veya lökopeni varlığı enfeksiyon riskini arttırabilir. Cinsiyet: Klinik çalışma deneyiminin popülasyon farmakokinetik analizinde 101 kadın ve 169 erkek hastadaki en düşük mutlak nötrofil sayısı ve 110 kadın ve 174 erkek hastadaki en düşük mutlaktrombosit sayısı kaydedilmiştir. Evre 4 nötropeni, (MNS <500 hücre/mikrolitre), tedavinin 1.küründe kadınlarda %12, erkeklerde %5, trombositopeni (< 20,000 hücre/mikrolitre) ise kadınlarda%9 erkeklerde %3 olarak saptanmıştır. 400 rekürran gliomalı hastayı içeren veri setinde, tedavinin ilkküründe Evre 4 nötropeni kadınların % 8, erkeklerin % 4'ünde gelişirken, Evre 4 trombositopenikadınların %8, erkeklerin ise %3'ünde gelişmiştir. Yeni glioblastoma multiforme tanısı konmuş 288hastayı içeren bir çalışmada, tedavinin ilk küründe Evre 4 nötropeni kadınların % 3'ündegörülürken erkeklerde bu oran % 0'dır. Evre 4 trombositopeni ise kadınların % 1'inde görülürkenerkeklerde bu oran % 0'dır.Pediyatrik popülasyonOral temozolomid nüks eden beyin sapı glioması veya nüks eden yüksek dereceli astrositoması olan pediyatrik hastalarda (3-18 yaş arası) 28 günde bir 5 gün boyunca uygulanan bir rejimdeçalışılmıştır. Veriler sınırlı olmakla birlikte, çocuklardaki toleransın erişkinlerdekiler ile aynı olmasıbeklenir. Üç yaşın altındaki çocuklarda temozolomidin güvenliliği belirlenmemiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlıkmesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr;[email protected];4.9. Doz aşımı ve tedavisiHastalarda 500, 750, 1000 ve 1250 mg/m2'lik (5 gün boyunca kür başına toplam doz) dozlar klinik olarak incelenmiştir. Doz kısıtlayıcı toksisite hematolojik toksisitedir ve birçok dozdabildirilmiştir, fakat yüksek dozlarda daha şiddetli olması beklenir. Bir hastada 10,000 mg'lık (5gün boyunca tek bir kürde toplam doz) doz aşımı yaşanmıştır. Bildirilen yan etkiler; pansitopeni,pireksi, çoklu organ yetmezliği ve ölümdür. 5 günden uzun (64 güne kadar) tedavide önerilendozu almış hastalarda enfeksiyon ile birlikte ya da enfeksiyonsuz kemik iliği supresyonubildirilmiş ve bazı vakalarda şiddetli ve uzun süreli olmuş ve ölüm ile sonuçlanmıştır. Dozaşımı durumunda hematolojik inceleme gerekmektedir. Gerektiği takdirde destekleyici tedaviuygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajanlar - Diğer alkilleyici ajanlar ATC Kodu: L01AX03 12/18 Etki mekanizmasıTemozolomid fizyolojik pH'da hızlı bir kimyasal dönüşüm göstererek aktif bileşen olan monometil triazenoimidazol karboksamide (MTİK) dönüşen bir triazendir. MTİK'ninsitotoksisitesinin, primer olarak guaninin O6 pozisyonunun alkilasyonundan ve ilaveten N7pozisyonunda alkilasyonundan ileri geldiği düşünülmektedir. Bunu takiben gelişen sitotoksiklezyonların, metil katılımının anormal onarımı ile ilgili olduğu düşünülmektedir. Klinik etkililik ve güvenlilikYeni teşhis edilen glioblastoma multiformeToplam 573 hasta temozolomid + RT (n=287) veya tek başına RT (n=286) almak üzere randomize edilmiştir. Temozolomid + RT kolundaki hastalar RT'nin ilk gününden itibaren RT'nin son gününekadar 42 gün süreyle (maksimum 49 gün) günde bir kez eş zamanlı temozolomid (75 mg/m2)almıştır. Bunu RT'nin bitiminden sonraki 4 haftadan başlayarak 6 küre kadar, 28 günlük her birkürün 1-5. günlerinde verilen temozolomid monoterapisi (150- 200 mg/m2) izlemiştir. Kontrolkolundaki hastalar yalnızca RT almıştır. RT ve kombine temozolomid tedavisi süresince Pnemocytis jiroveciipnömonisine (PCP) yönelik profilaksi gerekmiştir.Tek başına RT kolundaki 282 hastadan 161'i (% 57) ve temozolomid + RT kolundaki 277 hastadan 62'sine (% 22) takip döneminde kurtarıcı tedavi olarak temozolomid uygulanmıştır. Genel sağkalım için tehlike oranı (HR) 1,59'dur (HR için % 95 güven aralığı (GA) =1,33 - 1,91) ve log-rank p değeri temozolomid kolunun lehine < 0,0001'dir. Hesaplanan 2 yıl veya daha uzun sürehayatta kalma olasılığı (% 26'ya karşı % 10) RT + temozolomid kolunda daha yüksektir. Yeniteşhis edilmiş glioblastoma multiformeli hastaların tedavisinde RT'ye eş zamanlı temozolomideklenmesi ve ardından temozolomid monoterapisi tek başına RT'ye kıyasla genel sağkalımda (OS)istatistiksel olarak anlamlı iyileşme göstermiştir (Şekil 1). 13/18
Randomizasyondan sonra geçen süre (ay)Şekil 1. Genel sağkalım için Kaplan-Meier eğrileri (ITT (tedavi amaçlı) popülasyon)Çalışmanın sonuçları performans durumu kötü olan bir hasta alt grubunda (WHO PS=2, n=70) tutarlı değildir ve bu alt grupta genel sağkalım ve progresyona kadar geçen süre her iki koldabenzerdir. Ancak bu hasta grubunda kabul edilemez risklerin mevcut olmadığı anlaşılmaktadır. Nüks eden veya ilerleyen malign gliomaCerrahiden ve RT'den sonra ilerleyen veya nüks eden glioblastoma multiformeli hastalarda (Karnofski performans durumu [KPS] > 70) klinik etkinlik verileri oral temozolomid ile yürütüleniki klinik çalışmaya dayanmaktadır. Bunlardan biri 138 hastada (% 29'u daha önce kemoterapialmıştı) yürütülen karşılaştırmasız bir çalışma, diğeri ise toplam 225 hastada (% 67'si daha öncenitrozoüreye dayalı kemoterapi almıştı) yürütülen, temozolomidin prokarbazin ile karşılaştırıldığırandomize, aktif-kontrollü bir çalışmadır. Her iki çalışmada, birincil son nokta manyetik rezonansgörüntülemesi veya nörolojik kötüleşme ile tanımlanan progresyonsuz sağkalımdır (PFS).Karşılaştırmasız çalışmada 6 ayda PFS % 19, progresyonsuz medyan sağkalım süresi 2,1 ay vemedyan genel sağkalım 5,4 aydır. MR görüntülemelerine dayanan objektif yanıt oranı (ORR)%8'dir. Randomize, aktif-kontrollü çalışmada temozolomid ile 6 ayda PFS prokarbazine göre anlamlı olarak daha fazladır (% 21'e karşı % 8 - ki-kare p = 0,008) ve medyan PFS sırasıyla 2,89 ay ve 1,88aydır (log sıra p = 0,0063). Temozolomid ve prokarbazin için medyan sağkalım süresi sırasıyla 7,34ay ve 5,66 aydır (log sıra p = 0,33). Altı ayda, temozolomid kolunda hayatta kalan hastaların oranı(% 60) prokarbazin koluna kıyasla (% 44) anlamlı olarak daha yüksektir (ki-kare p = 0,019). Dahaönce kemoterapi almış hastalarda yarar KPS > 80 olan hastalarda gösterilmiştir. Nörolojik durumda kötüleşmeye kadar geçen süreye ilişkin veriler ve performans durumunda 14/18 kötüleşmeye kadar geçen süreye ilişkin veriler prokarbazine göre temozolomid lehinedir (KPS'nin <70'e gerilemesi veya en az 30 puan azalma). Bu son noktalarda progresyona kadar geçen medyansüreler prokarbazine kıyasla temozolomid ile 0,7 - 2,1 ay daha uzundur (log sıra p = < 0,01 - 0,03). Nüks eden anaplastik astrositomaAnaplastik astrositomalı hastaların ilk relapstaki tedavisinde oral temozolomidin güvenliliğini ve etkililiğini değerlendiren çok-merkezli, ileriye dönük bir faz II çalışmada, 6 ayda PFS %46 vemedyan PFS 5,4 aydır. Medyan genel sağkalım süresi 14,6 aydır. Merkezi gözden geçirmeyi yapanaraştırmacının değerlendirmesine dayanan yanıt oranı tedavi amaçlı popülasyonda (ITT) (n=162)%35'dir (13 tam yanıt ve 43 kısmi yanıt). 43 hastada stabil hastalık bildirilmiştir. ITTpopülasyonunda 6 aylık olaysız sağkalım oranı %44 ve medyan olaysız sağkalım süresi 4,6 aydır;bu rakamlar progresyonsuz sağkalım sonuçlarıyla benzerdir. Uygun nitelikteki histolojipopülasyonunda etkinlik sonuçları benzerdir. Radyolojik objektif yanıta ulaşılması veyaprogresyonsuz durumun korunması yaşam kalitesinin korunması veya iyileşmesiyle güçlü biçimdeilişkili bulunmuştur.Pediyatrik hastalar: Oral temozolomid, 28 günde bir 5 gün boyunca günlük olarak uygulanmış bir rejimde nüks eden beyin sapı glioması ya da nüks eden yüksek evreli astrositomu olan pediyatrik hastalarda (3-18 yaşarası) incelenmiştir. Temozolomide tolerans erişkinlerdekine benzerdir. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerTemozolomid fizyolojik pH'de esas olarak aktif tür olan 3-metil-(triazen-1-il)imidazol-4-karboksamide (MTİK) kendiliğinden hidrolize olur. MTİK, pürin ve nükleik asit biyosentezinde bilinen bir ara madde olan 5-amino-imidazol-4-karboksamide (AİK) ve aktif alkilleyici türolduğuna inanılan metilhidrazine kendiliğinden hidrolize olur. MTİK sitotoksisitesinin, esas olarakguaninin O6 ve N7 pozisyonlarında olmak üzere DNA alkillenmesinden kaynaklandığıdüşünülmektedir. Temozolomid EAA'sına kıyasla MTİK ve AİK'ye maruz kalım sırasıyla ~%2,4ve %23'tür. İn vivokoşullarda MTİK'in t^'si temozolomidinkine (1,8 saat) benzerdir.Emilim:Erişkin hastalarda oral yoldan uygulandıktan sonra temozolomid hızla emilmekte ve dozdan sonra 20 dakika gibi kısa bir sürede doruk konsantrasyona ulaşmaktadır (ortalama süre 0,5 ile 1,5 saat).14C ile işaretlenmiş temozolomid oral yolla uygulandıktan sonra 14C'nin dozdan sonra 7 günboyunca feçes ile ortalama atılım oranı % 0,8 bulunmuştur; bu oran tam emilimi gösterir. Dağılım:Temozolomid proteinlere düşük oranda bağlanır (% 10-% 20) ve proteine yüksek oranda bağlanan maddelerle etkileşmesi beklenmez. Klinik öncesi veriler ve insanlarda yapılan PET çalışmaları, temozolomidin kan beyin bariyerini hızla geçtiğini ve beyin-omurilik sıvısında (BOS) bulunduğunu düşündürmektedir. Beyin omuriliksıvısına penetrasyonu 1 hastada doğrulanmıştır ve temozolomidin eğri altında kalan alanına göre 15/18 BOS maruz kalımı plazmadakinin yaklaşık % 30'u kadardır; bu bulgu hayvan verileriyle paraleldir. Biyotransformasyon:Oral uygulamayı takiben dozun ortalama % 5-% 10'u 24 saat içinde idrarla değişmeden ve geriye kalanı ise temozolomid asidi, 5-aminoimidazol-4-karboksamid (AİK) veya tanımlanmamış polarmetabolitler şeklinde atılmaktadır. Plazma konsantrasyonları doza-bağımlı bir tarzda artmaktadır. Eliminasyon:Plazma yarılanma ömrü (t1/2) yaklaşık 1,8 saattir. 14C'nin eliminasyonu esas olarak böbreklerde gerçekleşir. Doğrusallık/Doğrusal olmayan durum:Plazma konsantrasyonları doza bağlı olarak artar. Plazma klerensi, dağılım hacmi ve yarılanma ömrü dozdan bağımsızdır. Özel popülasyonlara ilişkin ek bilgilerTemozolomidin popülasyon bazlı farmakokinetik analizi sonucunda plazma temozolomid klerensinin yaş, böbrek fonksiyonu veya tütün kullanımından bağımsız olduğu bulunmuştur. Diğerbir farmakokinetik çalışmada hafif ilâ orta dereceli hepatik disfonksiyonu bulunan hastaların,normal hepatik fonksiyonu olan hastalar ile benzer plazma farmakokinetik profilleri olduğugözlenmiştir. Pediyatrik hastalarda eğri altında kalan alan (EAA) daha büyüktür; ancak, maksimum tolere edilebilen doz (MTD) hem çocuklar hem de erişkinlerde kür başına 1000 mg/m2'dir. 5.3. Klinik öncesi güvenlilik verileriSıçanlarda ve köpeklerle tek kürlük (5 günlük dozaj, 23 günlük tedavisiz dönem), üç ve altı kürlük toksisite çalışmaları yürütülmüştür. Toksisitenin primer hedefleri kemik iliği, lenforetikülersistem, testisler ve gastrointestinal kanaldı ve daha yüksek dozlarda (test edilen sıçanların veköpeklerin % 60-100'ünde ölümcül olmuştur) retina dejenerasyonu gözlenmiştir. Erkek üremesistemi ve retina dejenerasyonunu içeren istenmeyen olaylar hariç, toksisitenin büyük kısmı geridönüşlü olma bulguları sergilemiştir. Ancak retina dejenerasyonundan sorumlu tutulan dozlarölümcül doz aralığında olduğundan ve klinik çalışmalarda benzer bir etki gözlenmediğinden, bubulgunun klinik yönden önemli olduğu düşünülmemiştir. Temozolomid embriyotoksik, teratojenik ve genotoksik alkilleyici ajandır. Temozolomid sıçan ve köpeklerde insanlara göre daha toksiktir ve klinik doz sıçan ve köpeklerde minimum ölümcüldoza yakındır. Lökositlerin ve trombositlerin doza bağlı olarak azalmaları, toksisitenin duyarlıbirer göstergesidir. Altı kürlük sıçan çalışmasında meme karsinomları, deride keratoakantoma vebazal hücreli adenomu içeren çeşitli neoplazmlar gözlenmiş ancak köpek çalışmalarında tümörlerveya preneoplastik değişiklikler gözlenmemiştir. Sıçanların temozolomidin onkojenik etkilerineözellikle duyarlı olduğu anlaşılmaktadır ve ilk tümörler dozaja başlandıktan sonra 3 ay içindegörülmüştür. Bu latent dönem bir alkilleyici ajan için bile çok kısadır. Ames/Salmonella ve İnsan Periferik Kan Lenfositi (HPBL) kromozom aberasyonu testlerinin 16/18 sonuçlarında pozitif bir mutajenik yanıt görülmüştür 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz anhidröz (sığır sütü kaynaklı) Sodyum nişasta glikolat Kolloidal anhidröz silikaKroskarmelloz sodyumFumarik asitStearik asit Jelatin (sığır kaynaklı) Titanyum dioksit 6.2. GeçimsizliklerUygulanamaz. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriğiKutuda, beyaz plastik kapaklı renkli cam şişede 5 ve 20 kapsül. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKapsüller açılmamalıdır. Kapsülün tahrip olması halinde, cilt ya da muköz membranların kapsülün toz içeriği ile temasından kaçınılmalıdır. Temas olduğu takdirde bölge su ve sabunla hemen ve iyiceyıkanmalıdır. Herhangi bir kullanılmamış ürün ya da atık materyal, yerel düzenlemelere uygun olarak atılmalıdır. Hastalara kapsülleri çocukların göremeyeceği ve erişemeyeceği bir yerde, tercihen kilitli bir dolaptasaklamaları söylenmelidir. Kazara yutulmaları özellikle çocuklarda ölüme sebebiyet verebilir. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. Sitotoksik ve sitostatik beşeri tıbbi ürünlerin kullanımları sonucu boşalan iç ambalajlarının atıkları TEHLİKELİ ATIKTIR ve bu atıkların yönetimi 2/4/2015 tarihli ve 29314 sayılı Resmi Gazetedeyayımlanan Atık Yönetimi Yönetmeliğine göre yapılır. 17/18 7. RUHSAT SAHİBİKoçak Farma İlaç ve Kimya Sanayi A.Ş. Mahmutbey Mah. 2477. Sok. No: 23 Bağcılar / İSTANBULTelefon: (0 212) 410 39 50Faks: (0 212) 447 61 65 8. RUHSAT NUMARASI232/76 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 24.06.2011 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ18/18 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.