Valpomax 50 Mg/ml Pediatrik Şurup Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'a bildirmeleribeklenmektedir. Bakınız Bölüm 4.8 Şüpheli advers reaksiyonların raporlanması. 1. BEŞERİ TIBBİ ÜRÜNÜN ADIVALPOMAX 50 mg/ml pediatrik şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:1 ml şurup 50 mg sodyum valproat içerir. Yardımcı maddeler (1 ml'de):Sodyum hidroksit 12,04 mg Sodyum klorür 0,4 mg Metil-4-hidroksi benzoat (E218) 1 mg Propil-4-hidroksi benzoat (E216) 0,4 mg Lycasin (maltitol çözeltisi) 800 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMŞurup Ahududu ve şeftali aromalı, renksiz-hafif sarı çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarJeneralize veya fokal nöbetler: - Jeneralize nöbetler: Absans nöbetleri, jeneralize tonik-klonik nöbetler, miyoklonik nöbetler, - Fokal nöbetler, - Mikst nöbetlerde tek başına veya diğer antiepileptik ilaçlar ile kombinasyon halinde kullanılmalıdır. - Bipolar bozukluk manik epizodlarının tedavisinde endikedir. Manik epizod sonrası tedaviye cevapveren hastalarda sürdürüm tedavisi olarak kullanılabilir.
1/23 4.2. Pozoloji ve uygulama şekliKız çocukları ve çocuk doğurma potansiyeli olan kadınlarValproat tedavisi epilepsi ya da bipolar bozukluk tedavisinde deneyimli bir uzman doktor tarafından başlatılmalı ve izlenmelidir. Valproat, diğer tedaviler etkisiz değilse ve tolere edilebiliyorsa, kız çocukları ve çocuk doğurma potansiyeli olan kadınlarda kullanılmamalıdır. Böyle bir durumda valproat, Valproat Gebelik Önleme Programı doğrultusunda reçete edilerek kullanılır (Bkz. Bölüm 4.3 ve 4.4). Pozoloji/uygulama sıklığı ve süresi:Günlük doz hastanın yaşı ve vücut ağırlığı dikkate alınarak düzenlenmelidir ve kişiden kişiye değişen cevap göz önünde bulundurulmalıdır. Günlük doz, serum konsantrasyonu ve terapötik etki arasında netbir ilişki kurulamadığından, optimum doz klinik cevaba göre saptanmalıdır. Eğer nöbetlerin kontrolüyeterli düzeyde değilse veya advers etkilerden şüphe ediliyorsa, klinik takibe ek olarak valproik asidinplazma düzeyinin saptanması düşünülebilir. Bildirilen etkili plazma düzeyi genelde 40-100 mg/litre(300-700 |imol/litre)'dir. Ortalama günlük doz: Başlangıç dozu genellikle günde 10-15 mg/kg olup, daha sonra optimum dozaja kadar çıkılır (Bkz "Sodyum valproat tedavisine başlama"). - Yenidoğan, bebek ve çocuklarda: 30 mg/kg - Adolesan ve yetişkinlerde: 20 - 30 mg/kg (tablet ve uzun salımlı tablet formları tercih edilmelidir) Bipolar bozukluklara bağlı maninin önlenmesi ve tedavisinde:Tavsiye edilen başlangıç dozu günde 20 mg/kg sodyum valproattır. İstenilen klinik etkinliği sağlayacak minimum terapötik doza ulaşmak için doz mümkün olduğunca çabuk artırılmalıdır. Bipolar bozuklukların idame tedavisi için tavsiye edilen doz günde 1000 mg ila 2000 mg arasındadır. İstisnai durumlarda, doz günde 3000 mg'dan fazla olmayacak şekilde artırılabilir. Dozlar bireysel klinikcevaba göre ayarlanmalıdır. Profilaktik tedavi en düşük etkin doz ile kişiye özel olarak uygulanmalıdır.
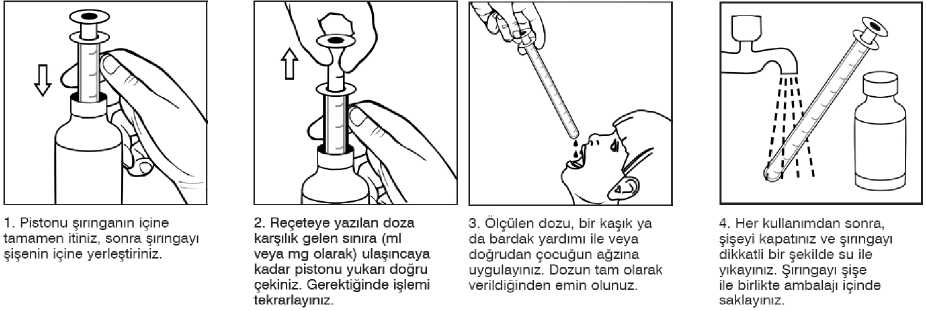
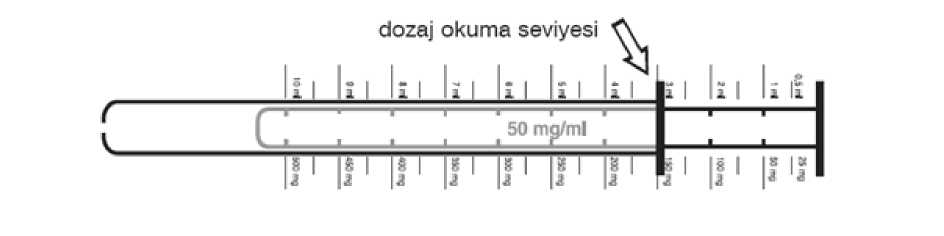
2/23 Uygulama şekli:Şurup sadece kutuda yer alan pistonlu dozaj şırıngası ile uygulanır. Günlük doz tercihen yemeklerle verilmelidir. - 1 yaşından küçük hastalarda 2 defada - 1 yaşından büyük hastalarda 3 defada Sodyum valproat tedavisine başlama (oral uygulama): - Başka bir antiepileptik uygulanmayan hastalarda doz 2-3 gün aralarla artırılarak bir hafta içindeoptimum doza ulaşılır. - Bir başka antiepileptik ile tedaviden sodyum valproat tedavisine geçerken, iki hafta içinde yavaşyavaş sodyum valproat dozunu artırarak optimum doz ayarlanmalı ve diğer preparatlarla tedaviazaltılarak kesilmelidir. - Eğer gerekiyorsa başka bir antiepileptik ilavesi yavaş yavaş doz artırılarak yapılmalıdır(Bkz. Bölüm 4.5). Günlük dozlardan birinin yanlışlıkla atlandığı, her zamanki uygulama saatinden kısa süre sonra fark edilirse, atlanan doz hemen alınabilir. Ancak dozun atlandığı, bir sonraki dozdan kısa süre önce farkedilmişse, atlanan dozu telafi etmek için, dozun iki katı alınmamalıdır.Birden fazla dozun atlanmasıhalinde ise, hemen doktora başvurulmalıdır.
3/23 Tedavi düzenli olarak sürdürülmeli, doktora danışılmadan herhangi bir değişiklik yapılmamalı veya kesilmemelidir. Tedavinin kademeli olarak kesilmesi gerekir. Tedavinin birdenbire bırakılması (veyadozun büyük oranda azaltılması), nöbetlerin yeniden ortaya çıkmasına neden olabilir. Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği: Aynı metabolik yolu kullandıkları için VALPOMAX ve salisilatlar aynı anda kullanılmamalıdır (Bkz. Bölüm 4.4 ve Bölüm 4.8). Valproik asidin de tedavilerine dahil olduğu hastalarda, ölümle sonuçlanabilen karaciğer yetmezliği dahil, karaciğer fonksiyon bozukluğu ortaya çıkmıştır (Bkz. Bölüm 4.3 ve Bölüm 4.4). Salisilatlar 16 yaşın altındaki çocuklarda kullanılmamalıdır (Bkz. Aspirin/salisilat ürün bilgisi - Reye Sendromu). Bunun yanı sıra, 3 yaşın altındaki çocuklarda VALPOMAX ile birlikte kullanım, karaciğertoksisitesi riskini artırabilir. Böbrek yetmezliği:Dozajın azaltılması gerekebilir. Plazma konsantrasyonlarının takibi yanıltıcı olabileceğinden, dozaj klinik takibe göre ayarlanmalıdır (Bkz. Bölüm 5.2). Pediyatrik popülasyon:11 yaşın altındaki çocuklarda kullanıma en uygun oral form şurup ve oral solüsyondur. Kompleks parsiyel nöbetlerde 10 yaş ve yukarısı için kullanılmalıdır. Bipolar bozukluklara bağlı maninin önlenmesi ve tedavisi: Valproatın bipolar bozukluklara bağlı maninin önlenmesi ve tedavisindeki güvenliliği ve etkililiği 18 yaşın altındaki hastalarda değerlendirilmemiştir. Geriyatrik popülasyon:Yaşlılarda sodyum valproatın farmakokinetiği değişiyorsa da klinik önemi sınırlıdır ve dozaj nöbetlerin kontrolüne göre düzenlenmelidir. 4.3. KontrendikasyonlarVALPOMAX'in aşağıdaki durumlarda kullanımı kontrendikedir: - Uygun bir alternatif tedavinin mevcut olması durumunda hamilelikte (Bkz. Bölüm 4.4 ve 4.6)
4/23 - Gebelik Önleme Programı koşulları yerine getirilmediği takdirde çocuk doğurma potansiyeli olan kadınlarda (Bkz. Bölüm 4.4 ve 4.6) -Valproat, valproat semisodyum, valpromid veya ilaç içindeki yardımcı maddelere karşı aşırı duyarlılık hikayesi olanlarda-Akut hepatit-Kronik hepatit -Kişide veya ailede özellikle ilaca bağlı ağır hepatit hikayesi (Child Pugh C) -Hepatik porfiri -Üre döngüsündeki enzim eksikliği olanlarda (Bkz. Bölüm 4.4) -Mitokondrial enzim polimeraz y (POLG) enzimini kodlayan nükleer gende mutasyonun neden olduğu mitokondrial hastalığı (örneğin, Alpers-Huttenlocher Sendromu) olan hastalarda ve POLG ile ilişkilibozukluk şüphesi olan 2 yaşından küçük çocuklarda (Bkz. Bölüm 4.4) -St. John's Wort (Sarı kantaron) ile birlikte kullanımı kontrendikedir (Bkz. Bölüm 4.5). 4.4. Özel kullanım uyarıları ve önlemleriÖzel uyarılar Gebelik Önleme ProgramıValproat, yüksek teratojenik potansiyele sahiptir ve uterusta valproata maruz kalan çocuklarda konjenital malformasyon ve nörogelişimsel bozukluk riski yüksektir (Bkz. bölüm 4.6). Valproat, kız çocuklarında veçocuk doğurma potansiyeli bulunan kadınlarda yalnızca diğer tedaviler etkisiz olduğunda ya da tolereedilemediğinde kullanılmalıdır. Başka bir tedavi imkanı yoksa, aşağıdaki Gebelik Önleme Programı'nauyulmalıdır. VALPOMAX aşağıdaki durumlarda kontrendikedir: - Uygun bir alternatif tedavinin mevcut olması durumunda gebelikte (Bkz. Bölüm 4.3 ve 4.6) - Gebelik Önleme Programı koşulları yerine getirilmediği sürece çocuk doğurma potansiyeli bulunankadınlarda (Bkz. Bölüm 4.3 ve 4.6) Gebelik Önleme Programının KoşullarıBu ilacı reçete edenler aşağıdakileri sağlamalıdır: -Her olguda hastayı da tartışmaya dahil ederek hastanın katılımını garanti etmek, tedavi seçeneklerini elealmak ve hastanın riskleri ve bu riskleri azaltmak için gereken önlemleri anlamasını sağlamak için bireyselkoşullar değerlendirilmelidir.- Tüm kadın hastalar için gebelik potansiyeli değerlendirilmelidir. - Hasta, konjenital malformasyon ve nörogelişimsel bozukluk riskini ve bu risklerin uterusta valproatamaruz kalan çocuklardaki etkisini anlamalı ve kabul etmelidir. -Hasta, gerektiği şekilde tedaviden önce ve tedavi sırasında gebelik testi yaptırması gerektiğini bilmelidir. - Hastaya doğum kontrolü hakkında tavsiyede bulunulmalı ve hasta valproat ile yapılan tüm tedavi
5/23 süresince kesintisiz olarak etkili bir doğum kontrolü yöntemi (daha fazla ayrıntı için bu uyarı kutusunun doğum kontrolüne ilişkin alt bölümüne bakınız) kullanma zorunluluğuna uyabilmelidir. - Hasta, epilepsi yönetiminde deneyimli bir uzman tarafından tedavinin düzenli (en az yılda bir) olarakincelenmesi gerektiğini bilmelidir. - Hasta, konunun zamanında ele alınması için ve gebe kalmadan ve doğum kontrolü bırakılmadan öncealternatif tedavi seçeneklerine geçilebilmesi amacıyla gebelik planlar planlamaz doktoruna danışmasıgerektiğini bilmelidir. - Hasta, gebelik durumunda derhal doktoruna danışması gerektiğini bilmelidir. - Hasta, hasta bilgilendirme kılavuzu almalıdır. - Hasta, valproat kullanımı ile ilgili tehlikeleri ve alınması gereken önlemleri anladığını onaylamalıdır(Yıllık Risk Onaylama Formu). Yukarıdaki koşullar aynı zamanda, reçete edenlerin gebelik riski bulunmadığını gösterecek çok güçlü nedenler mevcut olduğunu söylemedikleri sürece, cinsel olarak aktif olmayan kadınlar için de geçerlidir. KIZ ÇOCUKLARı-Reçete edenler, kız çocuklarının ebeveynlerinin/bakıcılarının valproat kullanan çocuklarında menarşgörüldüğü takdirde bir uzmanla görüşmeleri gerektiğini anlamalarını sağlamalıdır.- Reçete edenler, menarş görülen kız çocuklarının ebeveynlerine/bakıcılarına konjenital malformasyon venörogelişimsel bozukluk riskleri ve bu risklerin valproata uterusta maruz kalan çocuklardaki etkisi üzerinekapsamlı bilgi verilmesini sağlamalıdır. - Menarş görülen hastalarda, reçete yazan uzman valproat tedavisi gerekliliğini her yıl tekrardeğerlendirmeli ve alternatif tedavi seçeneklerini düşünmelidir. Tek uygun tedavi valproat tedavisi ise,etkili bir doğum kontrol yöntemi gerekliliği ve Gebelik Önleme Programının diğer tüm şartlarıtartışılmalıdır. Ergenliğe veya yetişkinliğe girmeden önce uzman tarafından kız çocuklarının alternatif birtedaviye geçirilmesi için her türlü çaba gösterilmelidir. Gebelik testiValproat ile tedaviye başlamadan önce gebelik dışlanmalıdır. Gebelikte istenmeyen kullanımdan kaçınmak için en az 25 mIU / ml'lik bir duyarlılıktaki plazma gebelik testinden sağlık mesleği mensubu tarafındandoğrulanmış negatif bir sonuç alınmadığı takdirde çocuk doğurma potansiyeli olan kadınlarda valproat iletedaviye başlanmamalıdır. Bu gebelik testi, tedavi sırasında düzenli aralıklarla tekrarlanmalıdır. Poşum kontrolüValproat reçete edilmiş çocuk doğurma potansiyeli olan kadınlar, valproat ile tedavi sırasında ara vermeden etkili bir doğum kontrol yöntemi kullanmalıdır. Bu hastalara, gebeliğin önlenmesi hakkındakapsamlı bilgi sunulmalı ve etkili bir doğum kontrol yöntemi kullanmıyorlarsa bir doğum kontrol yöntemitavsiyesinde bulunulmalıdır. En az bir etkili doğum kontrol yöntemi (tercihen spiral veya implant gibikullanıcıdan bağımsız bir form) veya bariyer yöntemi dahil iki tamamlayıcı doğum kontrol yöntemikullanılmalıdır. Doğum kontrol yöntemine karar verirken her olguda hastayı da tartışmaya dahil ederekhastanın katılımını ve üzerinde karara varılan önlemlere uyacağını garanti etmek için bireysel koşullardeğerlendirilmelidir. Regl görülmüyor olsa bile etkili doğum kontrolü ile ilgili tüm tavsiyelereuyulmalıdır. Östrojen içeren ilaçlarÖstrojen içeren hormonal kontraseptifler dahil östrojen içeren tıbbi ürünlerle eş zamanlı kullanım, potansiyel olarak valproat etkililiğini azaltabilir (Bkz. Bölüm 4.5). İlacı reçete eden hekimler, östrojen
6/23 içeren tıbbi ürünleri başlatırken veya durdururken, klinik yanıtı takip etmelidir (epilepsi kontrolü). Bu durumun tersine, valproat hormonal kontraseptiflerin etkililiğini azaltmaz. Uzman tarafından yapılacak yıllık tedavi incelemesiUzman, en az yılda bir kez valproatın hasta için en uygun tedavi olup olmadığını değerlendirmelidir. Ayrıca her yıllık incelemenin başında ve yıllık inceleme sırasında yıllık risk onaylama formunu ele almalıve hastanın bu formun içeriğini anladığından emin olmalıdır. Risk onaylama formu, reçete eden ve hasta(ya da yasal temsilcisi) tarafından doldurulmalı ve imzalanmalıdır. Gebelik _ planlamaBir kadın gebe kalmayı planladığında epilepsi yönetiminde deneyimli bir uzman valproat tedavisi tekrar değerlendirmeli ve alternatif tedavi seçeneklerini düşünmelidir. Gebe kalmadan ve doğum kontrolübırakılmadan önce alternatif tedavi seçeneklerine geçilebilmesi için her türlü çaba sarf edilmelidir (Bkz.Bölüm 4.6). Böyle bir geçiş mümkün değilse, gebe kalmayı planlayan kadına aile planlaması hakkındabilinçli karar vermesine destek olmak için valproatın doğmamış çocuk için risklerine ilişkin ektavsiyelerde bulunulmalıdır. Gebelik durumundaValproat kullanan bir kadın gebe kalmayı planladığında, valproat ile tedavinin tekrar değerlendirilmesi ve alternatif seçeneklerin ele alınması için vakit kaybetmeden bir uzmana başvurmalıdır. Gebeliği sırasındavalproata maruz kalan hastalar ve partnerleri, maruziyet görülen gebelik hakkında değerlendirme vetavsiye için teratoloji alanında deneyimli bir uzmana başvurmalıdır (Bkz. Bölüm 4.6). Hekimler aşağıdakileri sağlamalıdır:-Her valproat verildiğinde beraberinde bir hasta kartı da verilmeli ve hastanın bu_kartın içeriğinianladığından emin olunmalıdır.- Hastalara, planlı ya da şüpheli gebelik durumunda valproat almayı durdurmaları ve vakit kaybetmedenbir uzmana başvurmaları tavsiye edilmelidir. Eğitim materyalleriSağlık mesleği mensuplarına ve hastalara gebelik sırasında valproata maruziyetten kaçınmada yardımcı olmak amacıyla Ruhsat Sahibi, valproatın teratojenisitesi (konjenital malformasyonlar) ve fetotoksisitesi(nörogelişimsel bozukluklar) hakkındaki uyarıları pekiştirmek, çocuk doğurma potansiyeli olan kadınlardavalproat kullanımına ilişkin kılavuz sağlamak ve Gebelik Önleme Programının detaylarını sunmak içineğitim materyalleri sağlamıştır. Valproat kullanan çocuk doğurma potansiyeli olan tüm kadınlara bir hastakılavuzu ve hasta kartı sağlanmalıdır. Yıllık risk onaylama formunun, tedavi başlangıcında ve valproat tedavisinin her yıllık gözden geçirmesi sırasında uzman ve hasta (ya da yasal temsilcisi) tarafından usulüne uygun olarak doldurulup imzalanmasıgerekir. Nöbetlerin alevlenmesi Diğer antiepileptiklerle olduğu gibi, valproat uygulaması, iyileşme yerine nöbetlerin sıklığı ve şiddetinde (status epileptikus dahil) geri dönüşlü alevlenmelere veya yeni tipte bir nöbetin başlamasına
7/23 yol açabilir. Hastalara eğer nöbet alevlenmeleri meydana gelirse derhal hekimlerine danışmaları önerilmelidir (Bkz. Bölüm 4.8). Bu nöbetler farmakokinetik bir etkileşmeden (Bkz. Bölüm 4.5), bir toksisite durumundan (karaciğer hastalığı veya ensefalopati (Bkz. Bölüm 4.4 ve 4.8) ya da doz aşımından ileri gelebilen nöbetlerdenayrıştırılmalıdır. Bu tıbbi ürün vücutta valproik aside dönüştürüldüğünden, olası bir valproik asit doz aşımını önlemek için, aynı şekilde dönüşüme uğrayan diğer tıbbi ürünlerle (örneğin divalproat, valpromid) birliktekullanılmamalıdır. Karaciğer Yetmezliği (Hepatopati): Oluşma şartları: Bazen fatalite ile de sonuçlanabilen, ciddi karaciğer bozukluğu vakaları çok nadir olarak bildirilmiştir. Şiddetli epilepsisi olan bebekler ve 3 yaşın altındaki çocuklar, özellikle beyin hasarı, zeka geriliğive/veya konjenital bir genetik metabolik veya dejeneratif hastalık ilişkili epilepsisi olanlar en fazla riskaltında olan hastalardır. 3 yaşından sonra görülme sıklığı anlamlı olarak azalmakta ve risk yaşilerledikçe giderek düşmektedir. Vakaların büyük bölümünde karaciğer hasarı tedavinin ilk 6 ayında, daha çok 2. ve 12. haftalar arasında ve genellikle antiepileptiklerle çoklu tedavi sırasında görülmektedir. Belirtiler: Erken teşhis için klinik bulgular önemlidir. Sarılık öncesi görülebilecek aşağıdaki iki grup belirtiler, özellikle risk altındaki hastalarda (Bkz. "Oluşma şartları") dikkate alınmalıdır. - İlk olarak spesifik olmayan ve genellikle ani ortaya çıkan ve bazen sürekli kusma ve karın ağrısınıneşlik ettiği asteni, anoreksi, yorgunluk hali ve baş dönmesi - İkinci olarak uygun tedaviye rağmen epilepsi nöbetlerinin tekrarlaması Bu tip klinik belirtilerin görülmesi halinde hastanın derhal doktora başvurması gerektiği bilinmelidir. Hasta çocuksa aynı uyarı ailesine yapılmalıdır. Klinik muayene ve karaciğer fonksiyonunun biyolojikdeğerlendirilmesini içeren incelemeler derhal gerçekleştirilmelidir. Takip: Tedaviden önce karaciğer fonksiyon testi yapılmalı ve daha sonra tedavinin ilk 6 ayında karaciğer fonksiyonu periyodik olarak kontrol edilmelidir. Bilinen incelemeler içinde protein sentezini, özellikle PT (protrombin zamanı) gösteren testler önemlidir. Eğer anormal derecede düşük PT saptanırsa ve özellikle diğer laboratuvar bulguları damevcutsa (fibrinojen ve pıhtılaşma faktörlerinde önemli azalma, bilirubin düzeyinde yükselme vetransaminazlarda yükselme - kullanım için Bkz. "Bölüm4.4), VALPOMAX tedavisi durdurulmalıdırve bir tedbir olarak aynı metabolik yolu kullandıkları için, VALPOMAX ile birlikte veriliyorsasalisilat kullanımı da kesilmelidir. Karaciğer fonksiyon testleri özellikle riskli hastalarda (Bkz. Bölüm 4.4) tedaviden önce (Bkz. Bölüm 4.3) ve tedavinin ilk 6 ayında periyodik olarak yapılmalıdır. Pek çok antiepileptikle olduğu gibi, özellikle tedavinin başlangıcında, karaciğer transaminazlarının klinik belirti olmadan, geçici hafif bir yükselişi görülebilir.
8/23 Bu hastalarda daha geniş laboratuvar araştırması (protrombin düzeyi dahil) önerilir, gerekiyorsa doz ayarlanmalı ve parametrelerdeki değişikliklere bağlı olarak testler tekrarlanmalıdır. Pankreatit Bazen fatal sonuçlanan ağır pankreatit vakaları çok nadir olarak bildirilmiştir. Bu komplikasyon tüm yaş gruplarında tüm tedavi süresince görülebilir. Özellikle küçük çocuklarda bu risk daha daartmaktadır. İstenmeyen sonuçlu pankreatit genelde küçük çocuklarda veya ciddi epilepsi nöbetleri veya nörolojik hasar veya çoklu antikonvülzan tedavi risk faktörleri olabilir. Pankreatite eşlik eden karaciğer yetmezliği fatalite riskini arttırır. Akut karın ağrısı olan veya bulantı, kusma ve anoreksi gibi gastrointestinal şikayeti olan hastalarda pankreatit düşünülmelidir. Eğer pankreatik enzim düzeyleri artıyorsa tedavi kesilmeli ve uygun olanalternatif tedavi verilmelidir. İntihar Riski Çeşitli endikasyonlarda antiepileptiklerle tedavi edilen hastalarda intihar düşünceleri ve intihar davranışı bildirilmiştir. Antiepileptik ilaçlar ile randomize, plasebo kontrollü klinik çalışmaların meta-analiz verisi de intihar düşünceleri ve intihar davranışı riskinde hafif bir artış göstermiştir. Bu riskinnedeni bilinmemektedir ve eldeki verilerle valproat ile artmış riski göz ardı etmek mümkün değildir. Bu nedenle hastalar intihar düşüncesi ve davranışı açısından yakından izlenmeli ve uygun tedavi değerlendirilmelidir. İntihar düşüncesi ve davranışı ortaya çıktığında, hasta ve hasta yakınının tıbbidestek alması önerilmelidir. Bilinen ya da şüpheli mitokondrial hastalığı olan hastalar: Valproat mitokondrial DNA ve mitokondrial enzim polimeraz y (POLG) enzimini kodlayan nükleer gende mutasyonların neden olduğu altta yatan mitokondrial hastalıkların klinik belirtilerinitetikleyebilir ya da kötüleştirebilir. Özellikle, POLG geninde mutasyonların neden olduğu herediter nörometabolik sendromları (örn. Alpers-Huttenlocher Sendromu) olan hastalarda valproat ile tetiklenen akut karaciğer yetmezliği vekaraciğer ile ilişkili ölümler daha yüksek bir oranda raporlanmıştır. POLG ile ilişkili bozukluklar aile öyküsü olan ya da POLG ile ilişkili bozukluğu düşündürecek semptomları (açıklanamayan ensefalopati, dirençli epilepsi (fokal, miyoklonik), başlangıçta statusepileptikus, gelişme geriliği, psikomotor gerilik, aksonal sensorimotor nöropati, miyopati serebellarataksi, oftalmopleji ya da oksipital auralı komplike migren) olan hastalarda düşünülmelidir. Bubozuklukların tanısal değerlendirmesine yönelik güncel klinik uygulamalar doğrultusunda POLGmutasyon testi yapılmalıdır (Bkz. Bölüm 4.3). Diğer tıbbi ürünlerle etkileşim Lamotrojin ve penemlerle kombine kullanım önerilmez. (Bkz.Bölüm 4.5). Kognitif veya ekstrapiramidal bozukluklar Kognitif veya ekstrapiramidal bozukluklar, serebral atrofinin görüntülenme bulguları ile ilişkili olabilir. Bu nedenle ilaca bağlı ortaya çıkan klinik tablo, demans veya Parkinson hastalığı ilekarıştırılabilir.Ancak bu tür ilaca bağlı kognitif veya ekstrapiramidal bozukluklar tedavi kesildiğindeortadan kalkar. (bknz. Bölüm 4.8).
9/23 Tedavi başlamadan önce karaciğer fonksiyon testleri gerçekleştirilmelidir(Bknz.Bölüm 4.3) ve daha sonra, özellikle riskli hastalarda ilk 6 ay için periyodik olarak tekrarlanmalıdır (Bknz. Bölüm 4.4). Özellikle tedavinin başlangıcında olmak üzere, birçok antiepileptikte olduğu gbi herhangi bir klinik belirti olmaksızın, transaminaz seviyelerinde izole ve geçici olara orta seviyede bir atış gözlenebileceğivurgulanmalıdır. Böyle bir durum söz konusu olduğunda, daha kapsamlı bir laboratuvar çalışmasıyapılması (özellikle protombin zamanı), gerektiği takdirde dozlamanın yeniden değerlendirilmesi, veparametrelerdeki değişikliklere bağlı olarak testlerin tekrar edilmesi önerilmektedir. Hematolojik: Tedaviye başlamadan önce, 15 gün sonra ve tedavi sonunda, ve aynı zamanda cerrahi girişim öncesi,spontan kanama veya hematom(Bkz. Bölüm 4.8) durumunda kan kontrolleri(trombosit sayımıdahil kan sayımı, kanama zamanı ve koagülasyon testleri) yapılmalıdır. Çocuklar: 3 yaşın altındaki çocuklarda VALPOMAX uygulanacaksa monoterapi önerilir, ancak tedaviye başlamadan önce sodyum valproatın potansiyel yararına karşılık karaciğer harabiyeti veya pankreatitriski bu gruptaki hastalarda iyi değerlendirilmelidir (Bkz. Bölüm 4.4). Çocuklarda aynı zamandasalisilat kullanımı, karaciğer toksisitesi (Bkz. Bölüm 4.4) ve kanama riski nedeniyle önerilmemelidir. Hiperamoniyemi: Üre siklusunda enzim defekti bulunan hastalarda, sodyum valproat kullanımı kontrendikedir. Bazı hastalarda stupor veya koma ile birlikte birkaç hiperamoniyemi vakası görülmüştür (Bknz. Bölüm4.3). Sebebi açıklanamayan hepatogastrointestinal semptomlar (anoreksi, kusma, sitoliz krizi), letarji epizodları veya koma, mental gerilik öyküsü olan ya da ailesinde yenidoğan ya da çocuk ölümlerigörülen çocuklarda, her türlü sodyum valproat tedavisinden önce, metabolik tetkikler ve özellikle açkarnına ve yemekten sonra kandaki amonyak düzeylerine bakılmalıdır. Sistemik lupus eritematozus Her ne kadar sodyum valproat kullanımı sırasında immün bozukluklar çok ender görülmüşse de, sistemik lupus eritematozuslu hastalarda kullanımı için potansiyel yararı ile riski iyideğerlendirilmelidir. Kilo artışı Hastalar tedaviye başlarken kilo artışı riski konusunda uyarılmalı ve bu riski azaltmak için, çoğunlukla diyetle ilgili olmak üzere, gerekli düzenlemeler yapılmalıdır. Rabdomiyoliz Karnitin palmitoiltransferaz (CPT) tip II eksikliği olan hastalar valproat kullanırken rabdomiyoliz riskinin daha yüksek olduğu konusunda uyarılmalıdır. Alkol kullanımı Sodyum valproatla tedavi sırasında alkol kullanımı önerilmez. Böbrek yetmezliği: Böbrek yetmezliği olanlarda Valproik asidin serbest serum konsantrasyonlarının artabileceği göz önünde bulundurulmalı ve doz uygun şekilde azaltılmalıdır. Diyabetik hastalar:
10/23 Kısmen keton cisimcikleri şeklinde, başlıca böbrekler yoluyla elimine edildiğinden, diyabet şüphesi olanlarda idrar testinde yanlış pozitif sonuç verebilir. Diyabetik hastalar için bilgi:VALPOMAX şurup, yapay tatlandırıcı içermektedir ve bu nedenle diyabetik hastalar tarafından kullanılabilir. Ancak, şurubun her ml'sinde 0.05 BU'luk (diyet ünitesi)karbonhidrat içeriği hesaba katılmalıdır.VALPOMAX şurup sıvı maltitol içerir. Nadir kalıtımsal fruktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. VALPOMAX şurup her 1 ml'sinde 7,5 mg sodyum ihtiva eder. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. VALPOMAX şurup metil ve propil hidroksi benzoat içermektedir, bunlara bağlı alerjik reaksiyonlara (muhtemelen gecikmiş) sebebiyet verebilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKontrendike olan kombinasyonlar:- St. John's Wort (Sarı Kantaron):Azalmış plazma konsantrasyonu riski ve antikonvülsan etkililikte azalma. Önerilmeyen kombinasyonlar: Lamotrijin:Ciddi deri reaksiyonları (toksik epidermal nekroliz) riskinde artış. Ayrıca, lamotrijin plazma konsantrasyonlarında artış meydana gelebilir (sodyum valproat ile azalmış hepatik metabolizma) Eğer birlikte uygulanması gerekli görülürse, yakından klinik takip gereklidir. - Penemler:Valproik asit plazma konsantrasyonlarında belirlenemeyebilen hızlı bir düşüşe bağlı nöbet riski. Kullanımda önlem alınmasını gerektiren kombinasyonlar:- Asetazolamid:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. - Aztreonam:Valproik asit plazma konsantrasyonunda düşmeye bağlı nöbet riski. Bu antibiyotikle tedavi sırasında ve sonrasında klinik takip, plazma miktar tayini ve olası antikonvülsan doz ayarlaması. -Karbamazepin:Aşırı doz belirtileri ile karbamazepinin aktif metabolitinin artmış plazma konsantrasyonları. İlaveten, karbamazepin ile artmış hepatik metabolizmaya bağlı olarak azalmış valproik asit plazma konsantrasyonu. Klinik takip, plazma miktar tayini ve her iki antikonvülsanın dozunun ayarlanması.
11/23 -Felbamat:Doz aşımı riski ile birlikte serum valproik asit konsantrasyonlarında yükselme. Felbamat ile kombine tedavi sırasında ve kombine tedavi kesildikten sonra, klinik takip, laboratuvar parametrelerinin takibi ve valproik asit dozunun ayarlanması gerekebilir. - Östrojen içeren hormonal kontraseptifler dahil östrojen içeren ilaçlar:Östrojenler, valproat glukoronidasyonuna dahil olan UDP- glukuronozil transferaz (UGT) izoformlarının indükleyicileridirler ve valproatın klerensini arttırabilirler, dolayısıyla valproat serumkonsantrasyonlarında bir düşüşe neden oldukları ve potansiyel olarak valproat etkililiğini azalttıklarıdüşünülmektedir (Bkz. Bölüm 4.4). Valproat serum seviyelerinin takip edilmesi dikkate alınmalıdır. Bunun tersine, valproat enzim indükleyici etkiye sahip değildir; bunun sonucu olarak valproat, hormanal kontraseptif alan kadınlarda östro-progestatif ajanların etkililiğini azaltmaz. - Nimodipin (oral kullanım ve parenteral yol ekstrapolasyonu):Plazma nimodipin konsantrasyonlarında %50 artış riski. Bu yüzden, hipotansif hastalarda nimodipin dozunun azaltılması gerekebilir. - Fenobarbital ve primidon ekstrapolasyonu:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. -Fenitoin ve fosfenitoin ekstrapolasyonu:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. - Rifampisin:Valproik asidin karaciğerde metabolize olma oranının rifampisin tarafından arttırılmasına bağlı olarak nöbet riski. Klinik takip ve laboratuvar parametrelerinin takibi ve rifampisin ile tedavi sırasında ve sonrasında olası antikonvülsan doz ayarlamaları. - Rufnamid:Özellikle 30 kg altı çocuklarda, rufinamid konsantrasyonunda olası yükselme. 30 kg'dan hafif çocuklarda: doz titrasyonundan sonra, toplam günlük doz olarak 600 mg aşılmamalıdır. - Topiramat:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. - Propofol:Kanda propofol seviyelerini artırması muhtemeldir. Valproat ile birlikte uygulandığında, propofol dozunda azaltma düşünülmelidir.
12/23 - Zidovudin:Metabolize olma oranının valproik asit tarafından azaltılmasına bağlı olarak, başlıca hematolojik etkiler olmak üzere, zidovudinin istenmeyen etki riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. Kombinasyonun ilk iki ayı sırasında anemi durumunu test etmek için kan sayımı gerçekleştirilmelidir. - Zonisamid:Artan ensefalopati riski ile birlikte, hiperamoniyemi riskinde artış. Düzenli olarak klinik takip ve laboratuvar parametrelerinin takibi yapılmalıdır. Diğer etkileşmeler:- Lityum:VALPOMAX'in serum lityum düzeyleri üzerine etkisi yoktur. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin bir etkileşim çalışması bulunmamaktadır. Pediyatrik popülasyonPediyatrik popülasyona ilişkin bir etkileşim çalışması bulunmamaktadır. 4.6. Gebelik ve laktasyonValproat, aşağıdaki durumlarda kontrendikedir (Bkz. Bölüm 4.3 ve 4.4): - Epilepsiyi tedavi edecek uygun bir alternatifin mevcut olduğu sürece gebelik sırasında - Gebelik Önleme Programının koşulları yerine getirilmediği sürece çocuk doğurma potansiyeli olan kadınlarda.Genel tavsiyeGebelik kategorisi: D Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)VALPOMAX , çocuk doğurma potansiyeli bulunan kadınlarda yalnızca diğer tedaviler etkisiz olduğunda ya da tolere edilemediğinde kullanılmalıdır. VALPOMAX tedavisine, özellikleaşağıdakilere olmak üzere, yalnızca Gebelik Önleme Programına uyulduğu takdirde başlanabilir (bkz.bölüm 4.4): - Gebelik yoksa (tedavinin başında ve tedavi sırasında düzenli aralıklarla en az 25 mIU/mlhassasiyetli plazma gebelik testinde negatif sonuç) - En az bir etkili doğum kontrol yöntemi kullanılıyorsa - Gebelik sırasında valproat kullanımı riskleri hakkında bilgilendirme yapıldıysa Çocuk doğurma potansiyeli olan kadınlarda, fayda-risk dengesi tedavi sırasında düzenli aralıklarla (en az yılda bir kez) dikkatlice tekrar tekrar değerlendirilmelidir. Gebelik dönemiUygun bir alternatif tedavi bulunduğu sürece, gebelikte epilepsi tedavisi olarak valproat kullanımı kontrendikedir (bkz. bölüm 4.3 ve 4.4).
13/23 Valproat kullanan bir kadın gebe kaldığında, alternatif tedavi seçeneklerinin değerlendirilmesi için vakit kaybetmeden bir uzmana başvurmalıdır. Gebelik sırasında, maternal tonik klonik nöbetler ve hipoksiyle birlikte status epileptikus anne ve doğmamış çocuk için özel bir ölüm riski taşıyabilir. Gebelikte valproatın bilinen risklerine rağmen ve alternatif tedavinin dikkatli bir şekilde değerlendirilmesinden sonra, istisnai durumlarda gebe bir kadının epilepsi için valproat alması gerekir: - En düşük etkili doz kullanılmalıdır. - Günlük valproat dozu, gün boyunca alınacak birkaç küçük doza bölünmelidir. Yüksek pik plazmakonsantrasyonlarından kaçınmak için diğer tedavi formülasyonlarından ziyadeuzun salınımlıformülasyon kullanımı tercih edilebilir (bkz. bölüm 4.2). Gebeliğinde valproata maruz kalmış tüm hastalar ve partnerleri, maruziyet görülen gebelik hakkında değerlendirme ve tavsiye için teratoloji alanında deneyimli bir uzmana başvurmalıdır. - Nöral tüp defektlerinin veya diğer malformasyonların olası oluşumunu tespit etmek için özelprenatal izlem yapılmalıdır. Teratojenisite ve nörogelişimsel etkiler Valproatın hem monoterapisi hem de politerapisi anormal gebelik sonlanımları ile ilişkili olabilir. Mevcut veriler valproatı içeren antiepileptik politerapisinin konjenital malformasyon riskinin valproatmonoterapisine göre daha fazla olduğunu ileri sürmektedir. Valproatın hem hayvan türlerinde hem deinsanlarda plasenta bariyerini geçtiği gösterilmiştir (Bkz. Bölüm 5.2). Konjenital malformasyonlar Bir meta analizden (kayıt çalışmaları ve kohort çalışmaları) elde edilen veriler gebelik sırasında valproat monoterapisi uygulanmış epileptik kadınlar tarafından dünyaya getirilen çocukların%10.73'ünde konjenital malformasyonlar ortaya çıktığını (%95 GA: 8.16 -13.29) ve majörmalformasyon riskinin bu popülasyonda arttığını (genel popülasyona oranla yaklaşık %2-3)göstermektedir. Risk doza bağlı olup altındaki dozlarda riskin olmadığı bir eşik dozbelirlenememektedir. Mevcut veriler minör ve majör malformasyon insidansının arttığını göstermektedir. En yaygın malformasyon tipleri nöral tüp defektleri (yaklaşık %2 ila %3), fasiyel dismorfizm, yarık dudak vedamak, kraniostenoz, kardiyak, renal ve ürogenital defektler (özellikle hipospadias), ekstremitedefektleri (bilateral radius aplazisi dahil) ve vücudun çeşitli sistemlerini tutan çoklu anomalileriiçermektedir. Uterus içi valproata maruz kalmak ayrıca kulak ve / veya burun malformasyonları (ikincil etki) nedeniyle işitme bozukluğu / kaybına ve / veya işitme fonksiyonu üzerinde doğrudan toksisiteye nedenolabilir. Vakalar hem tek taraflı hem de iki taraflı sağırlığı veya işitme bozukluğunu tanımlar. Tümvakalar için sonuçlar bildirilmemiştir. Sonuçlar rapor edildiğinde, vakaların çoğu çözülmemiştir. Nörogelişimsel bozukluklar Veriler uterusta valproata maruziyetin çocukların mental ve fiziksel gelişimi üzerinde advers etkileri olabileceğini göstermiştir. Risk doza bağımlı görülmekle birlikte, mevcut verilerle riskin olmadığı eşik
14/23 altındaki doz tespit edilememektedir. Bu etkiler için gebeliğin hangi döneminin riskli olduğu tam olarak belli değildir ve tüm gebelik boyunca bir risk olasılığı dışlanamamaktadır. Uterusta valproata maruz kalmış okul öncesi çocuklarda yapılan çalışmalar bu çocukların %30-40'a varan bir bölümünde daha geç konuşma ve geç yürüme, zihinsel becerilerin düşük düzeyde kalması, dilbecerisinde yetersizlik (konuşma ve anlama) ve bellek sorunları gibi erken dönme gelişimindegecikmeler ortaya çıktığını göstermektedir. Uterusta valproata maruz kalmış okul çağındaki çocuklarda (6 yaş) ölçülen zeka katsayısının (IQ) diğer antiepileptiklere maruz kalmış çocuklarınkinden ortalama 7-10 puan düşük bulunmuştur. Karıştırıcıfaktörlerin rolü dışlanamamakla birlikte, valproata maruz kalan çocuklarda zihinsel bozukluk riskininmaternal IQ'dan bağımsız olabileceğine ilişkin kanıt mevcuttur. Uzun dönemdeki sonuçlara ilişkin veriler sınırlıdır. Mevcut veriler, genel çalışma popülasyonu ile karşılaştırıldığında uterusta valproata maruz kalmış çocuklarda otistik spektrum bozukluğu (yaklaşık 3 kat) ve çocukluk çağı otizmi (yaklaşık 5 kat)riskinde artış olduğunu göstermektedir. Bugüne kadar elde edilen sınırlı veriler uterusta valproata maruz kalmış çocuklarda dikkat eksikliği/hiperaktivite bozukluğu (DEHB) semptomları gelişme olasılığının daha yüksek olduğunudüşündürmektedir. Östrojen içeren ilaçlarÖstrojen içeren hormonal kontraseptifler dahil östrojen içeren tıbbi ürünler valproatın klerensini arttırabilirler, dolayısıyla valproat serum konsantrasyonlarında bir düşüşe neden oldukları ve potansiyelolarak valproat etkililiğini azalttıkları düşünülmektedir (Bkz. Bölüm 4.4 ve 4.5). Bir kadın gebelik planladığında:Bir kadın gebe kalmayı planladığında, epilepsi yönetiminde deneyimli bir uzman valproat tedavisini tekrar değerlendirmeli ve alternatif tedavi seçeneklerini düşünmelidir. Gebe kalmadan ve doğumkontrolü bırakılmadan önce alternatif tedavi seçeneklerine geçilebilmesi için her türlü çaba sarfedilmelidir (bkz. bölüm 4.4). Böyle bir geçiş mümkün değilse, gebe kalmayı planlayan kadına aileplanlaması hakkında bilinçli karar vermesine destek olmak için valproatın doğmamış çocuk içinrisklerine ilişkin ek tavsiyelerde bulunulmalıdır. Gebelik öncesi ve gebelik sırasında folik asit takviyesi, tüm gebeliklerde meydana gelebilecek nöral tüp defekti riskini azaltabilir. Doğum öncesi:Doğumdan önce anneye özellikle trombosit sayımı, fibrinojen seviyeleri ve koagülasyon zamanı (aktive edilmiş parsiyel tromboplastin zamanı: aPTT) dahil olmak üzere koagülasyon testleriyapılmalıdır. Yeni doğandaki riskler: Gebelik sırasında valproat kullanmış annelerden doğan yenidoğanlarda çok seyrek olarak hemorajik sendrom bildirilmiştir. Bu hemorajik sendrom trombositopeni, hipofibrinojenemive/veya diğer koagülasyon faktörlerinin azalması ile ilişkilidir. Afibrinojenemi de bildirilmiştir veölümcül olabilir. Bununla birlikte, bu sendrom fenobarbital ve enzim indüksiyonu yapan diğer
15/23 ajanlarla tetiklenen vitamin K faktörlerinin azalmasından ayırt edilmelidir. Annedeki normal hemostaz test sonuçları, yenidoğan bebekte hemostaz anormalliklerinin göz ardı edilmesini olasıkılmaz. Bu nedenle yenidoğanda trombosit sayımı, fibrinojen plazma düzeyi, koagülasyon testlerive koagülasyon faktörleri araştırılmalıdır. Anneleri gebeliğin üçüncü trimesterinde valproat kullanmış olan yenidoğanlarda hipoglisemiolguları bildirilmiştir. Anneleri gebelik sırasında valproat kullanmış olan yenidoğanlarda hipotiroidizm olguları bildirilmiştir. Anneleri gebeliğin son trimestrinde valproat kullanmış olan yenidoğanlarda geri çekilme sendromu (özellikle ajitasyon, irritabilite, hipereksitabilite, gerginlik, hiperkinezi, tonusbozuklukları, tremor, konvülsiyonlar ve beslenme sorunları) ortaya çıkabilir. Post-natal izleme/çocukların izlenmesi:Gebelik sırasında valproata maruz kalan çocuklarda nörogelişimsel davranış yakından izlenmeli ve gerektiğinde mümkün olduğunca erken şekilde uygun tedaviye başlanmalıdır Laktasyon dönemiValproat anne sütünde maternal serum düzeyinin %%10'u arasında salgılanmaktadır. Tedavi edilen annelerin emzirdiği yenidoğan ve bebeklerde hematolojik bozukluklar gösterilmiştir (Bkz.Bölüm 4.8).Emzirmenin bebek için yararı ve tedavinin anne için yararı dikkate alınarak emzirmenin kesilmesi ya da valproat tedavisinin kesilmesi/bırakılmasına kararı verilmelidir. Üreme yeteneği/FertiliteValproat kullanan kadınlarda amenore, polikistik over ve testosteron düzeyinde artış bildirilmiştir (Bkz. Bölüm 4.8). Valproat uygulaması erkeklerde fertiliteyi bozabilir (özellikle sperm motilitesindeazalma) (Bkz. Bölüm 4.8). Olgu bildirimleri fertilite disfonksiyonunun tedavi kesildikten sonra geridönüşlü olduğunu göstermektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanan hastalar, özellikle antikonvülsan politerapisi alıyorsa veya sersemlik halini arttırabilecek diğer ilaçlar ile birlikte bu ilacı kullanıyorsa, sersemlik hali yapabileceği riskine karşıuyarılmalıdır. ). 4.8. İstenmeyen etkilerAşağıda sıralanan istenmeyen etkilerin sıklığına ilişkin bilgiler şöyle tanımlanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek >1/10000 ila <1/1000); çok seyrek (<1/10000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). (Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalar: Seyrek: Miyelodisplastik sendrom Kan ve lenf sistemi hastalıkları:Yaygın: Anemi, trombositopeni Genelde sistematik olarak farkedilen ve klinik belirti vermeyen, doza bağlı trombositopeni vakaları bildirilmiştir Trombositopeninin asemptomatik olması durumunda, eğer trombositmiktarı uygun ve epileptik hastalığın kontrolü mümkünse, yalnızca sodyum valproatpozolojisinin azaltılmasıyla, genellikle bu trombositopeninin düzelmesi sağlanabilir.
16/23 Yaygın olmayan: Pansitopeni, lökopeni Seyrek: Kemik iliği aplazisi veya saf kırmızı kan hücresi aplazisi, agranülositoz, makrositik anemi, makrositoz. Endokrin hastalıklar:Yaygın olmayan: Uygunsuz antidiüretik hormon salgılanmasısendromu(IADHS), hiperandrojenizm (hirsutizm, virilizm, akne, erkek tipi alopesi ve/veya androjen artışı). Seyrek: Hipotiroidizm (Bkz. Bölüm 4.6). Metabolizma ve beslenme hastalıkları:Yaygın: Hiponatremi Seyrek: Hiperamoniyemi *(Bkz. Bölüm 4.4), obezite * Sıklıkla Karaciğer fonksiyon testlerinde değişikliğe neden olmayan izole ve orta derecedehiperamoniyemi ortaya çıkabilmektedir. Bu durum tedavinin kesilmesini gerektirmez. Nörolojik semptomların eşlik ettiği hiperamoniyemi (komaya kadar giden) de bildirilmiştir. Bu vakalarda daha ileri tetkiklere başvurulmalıdır (Bkz. Bölüm 4.4). Psikiyatrik hastalıklar:Yaygın: Konfüzyonel durum, halüsinasyonlar, agresyon, * ajitasyon*, dikkat bozukluğu* Seyrek: Anormal davranış*, psikomotor hiperaktivite*, öğrenme bozukluğu* * Bu yan etkiler daha çok pediatrik popülasyonda gözlenir. Sinir sistemi hastalıkları:Çok yaygın: Tremor Yaygın: Ekstrapiramidal bozukluk**, stupor* sedasyon, nöbetler*, konvülsiyon(bu orjinalde yok), bellek bozukluğu, baş ağrısı, nistagmus, baş dönmesi veya baş dönmesi. Yaygın olmayan: Koma*, ensefalopati*, letarji*, geri dönüşümlü parkinsonizm**, ataksi, parestezi. Seyrek: Diplopi, tedavinin kesilmesini takiben birkaç hafta ya da birkaç ay içinde geriye dönebilensinsi ve yavaş başlangıçlı kognitif bozukluklar** (demansın tüm klinik özelliklerini gösterebilen)bildirilmiştir. *Tedavi sırasında bazen geçici komaya/ensefalopatiye kadar gidebilen stupor ve letarji, tek başına veya konvülziyonlarda paradoksal artışla birlikte görülmüştür ve tedavi durdurulduğunda veya dozazaltıldığında, azalmıştır. Bu etkiler genellikle birden fazla ilaçla tedavi sırasında (özelliklefenobarbital veya topiramat) ve valproat dozu birden artırıldığında ortaya çıkar. **Bu semptomlar serebral atrofinin görüntüleme bulguları ile ilişkili olabilir Kulak ve iç kulak hastalıkları:Yaygın: Sağırlık Vasküler hastalıklar:Bilinmiyor: Hemoraji (Bkz. Bölüm 4.4 ve 4.8) Bilinmiyor: Kutanöz vaskülit, özellikle lökositoklastik vaskülit Solunum, göğüs bozuklukları ve mediastinal hastalıklar: Yaygın olmayan: Plevral efüzyon Gastrointestinal hastalıklar:Çok Yaygın: Bulantı Bu belge
17/23 Yaygın: Bazı hastalarda tedavinin ilk günlerinde sıklıkla sindirim sistemine ait yan etkiler (kusma, esas olarak gingival hiperplazi olmak üzere gingival bozukluklar, stomatit, üst karın ağrısı, diyare)görülebilir, bunlar çoğunlukla tedaviyi durdurmaya gerek kalmadan bir kaç gün içinde kendiliğindenortadan kalkar. Yaygın olmayan:Bazen letal olabilen, tedavinin erken kesilmesine ihtiyaç duyulabilecek pankreatit (Bkz. Bölüm 4.4). Hepato-bilier hastalıklar:Yaygın: Karaciğer hastalığı (Bkz. Bölüm 4.4) Deri ve deri altı hastalıkları:Yaygın: geçici ve/veya doza bağlı alopesi, tırnak ve tırnak yatağı bozuklukları Yaygın olmayan: Anjiyoödem, döküntü, saç bozuklukları (saç yapısı anormallikleri, saç rengi değişiklikleri, saç uzama anormallikleri gibi) Seyrek: Toksik epidermal nekroliz, Stevens-Johnson sendromu ve eritema multiforme, DRESS Sendromu (eozinofili ve sistemik semptomların görüldüğü ilaç reaksiyonu) veya aşırı duyarlılıkreaksiyonu Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları:Yaygın olmayan: VALPOMAX ile uzun süre tedavi gören hastalarda kemik mineral yoğunluğunda azalma, osteopeni, osteoporoz ve kırıklar. VALPOMAX'in kemik metabolizmasını etkilememekanizması henüz belirlenememiştir. Seyrek: Sistemik lupus eritematosus (Bkz. Bölüm 4.4), rabdomiyoliz (Bkz. Bölüm 4.4) Böbrek ve idrar yolu hastalıkları:Yaygın:Üriner inkontinans Yaygın olmayan: Renal yetmezlik Seyrek: Enürezis, üriner inkontinans, tubulointerstisyel nefrit, geri dönüşümlü Fanconi sendromu Üreme ile ilgili bozukluklar:Yaygın:Menstrüel düzensizlikler Yaygın olmayan: Amenore Seyrek:Spermatogenez üzerine etki(özellikle sperm motilitesinde azalma) (Bknz. Bölüm 4.6), polikistik over Çok seyrek:Jinekomasti Konjenital vekalıtımsal/genetik hastalıklar:Konjenital malformasyonlar ve nörogelişimsel bozukluklar (Bkz. Bölüm 4.4 ve 4.6) Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:Yaygın olmayan: Hipotermi, şiddetli olmayan periferik ödem Araştırmalar:Yaygın: Kilo artışı* Seyrek: Koagülasyon faktörlerinde azalma (en az birinde), koagülasyon testlerinde anormallik (protrombin zamanında uzama, aktive parsiyel tromboplastin zamanında uzama, trombin zamanındauzama, INR'de uzama gibi) (Bkz. Bölüm. 4.4 ve 4.6), vitamin B8 (biotin) eksikliği/biotinidaz eksikliği.
18/23 *Kilo artışı polikistik over sendromu için bir faktör olduğundan dikkatlice izlenmelidir (Bkz. Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlıkmesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel:0 800 31400 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiAkut, ağır doz aşımının belirtileri; bir dereceye kadar derin olabilen hafif koma hali dahil, muskuler hipotoni, hiporefleksi, miyozis, metabolik asidoz, solunum fonksiyonlarının bozulması,hipotansiyon vedolaşım kollapsı/kardiyovasküler şoktur. Az sayıda serebral ödeme bağlı intrakraniyal hipertansiyon vakası bildirilmiştir. Doz aşımının hastanedeki tedavisi: Alımından 10-12 saat sonrasına kadar yararlı olabilecek gastrik lavaj; etkilidiürezin idamesi; kalp ve solunum fonksiyonlarının takibi. Çok ciddi vakalarda eğer gerekirse renal diyaliz yapılabilir. Bu tip zehirlenmede prognoz genelde olumludur. Ancak, birkaç ölüm raporlanmıştır. Valproat formülasyonundaki sodyum doz aşımında hipernatremiye yol açabilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Antiepileptikler ATC kodu: N03AG01 Etki mekanizması: Valproat etkisini esas olarak merkezi sinir sistemi üzerinde oluşturur. İnsanda birçok değişik nöbet tiplerinde ve hayvanlarda birçok farklı konvülsiyon tiplerinde antikonvülzan etki göstermektedir. Valproatın en olası etki mekanizması beyinde gama amino bütirik asit (GABA) sentezi veya metabolizması üzerine etkiyerek GABA'nın inhibitör etkisinin güçlendirilmesidir. Valproatın etki mekanizmasının, GABA metabolizmasına presinaptik etkiyle ve/veya nöron zarındaki iyon kanallarına doğrudan postsinaptik etkiyle, GABA'nın aracılık ettiği inhibisyonungüçlendirilmesine bağlı olduğu kabul edilmektedir. Farmakodinamik etkiler: Valproat üzerinde yapılan deneysel ve klinik çalışmalar iki tip antikonvülzan etkinin olduğunu öne sürmektedir. Klinik etkililik: Birincisi, valproatın plazma ve beyindeki konsantrasyonlarına bağlı direkt farmakolojik etkidir. İkincisi ise, muhtemelen beyinde bulunan valproatın metabolitlerine, nörotransmiterlerin değişimlerine veya doğrudan membran etkilerine bağlı olduğu gözüken dolaylı etkidir. Bu hipotez genellikle valproatkullanımından sonra artan konsantrasyonlardaki gama - aminobütirik asit (GABA) nedeniyle ortayaatılmıştır.
19/23 Yavaş dalga uykusunun artması sonucunda uyku ara fazının sürekliliği valproat ile azalır.Sodyum valproatın bazı in vitro5.2. Farmakokinetik özelliklerEmilim:- Sodyum valproatın oral ve IV uygulama sonrasındaki biyoyararlanımı %100' e yakındır. - Oral uygulama sonrasında hızla absorbe olur ve sabit plazma yoğunluğuna 3-4 günde ulaşılır.Enjektabl form ile sabit konsantrasyonlara birkaç dakikada ulaşılır ve bu konsantrasyon intravenözinfüzyon ile korunur. Dağılım:- Dağılım hacmi esas olarak kanla ve hareketli hücre dışı sıvılarla sınırlıdır. Valproat BOS ve beyine geçer. - Valproat plazma proteinlerine yüksek oranda bağlanır; Bu bağlanma doza bağlı ve doyurulabilirözelliktedir. - Terapötik etki için gerekli olan minimum serum konsantrasyonu 40-50 mg/l olup aralık 40 mg/l -100 mg/l arasındadır. Eğer daha yüksek plazma seviyelerinin gerekli olduğu tespit edilirse,beklenen faydalara karşı, özellikle doza bağımlı etkiler olmak üzere yan etki oluşma riskideğerlendirilmedir. Bununla beraber, 150 mg/l'nin üstündeki düzeyleri sürdürmek için dozazaltılması gereklidir. Plasenta transferi (Bkz. Bölüm 4.6): Valproat, hayvan türlerinde ve insanlarda plasenta bariyerini geçer: hayvan türlerinde valproat plasentayı insanlarda olduğu gibi aşıyor, insanlarda, çeşitli yayınlar doğumda yenidoğanların göbek kordonundaki valproatkonsantrasyonunu değerlendirmiştir. Göbek kordonundaki valproat serum konsantrasyonu,fetüslerde annelerinkine benzer veya biraz daha yüksek olduğunu göstermiştir. Biyotransformasyon:- Valproatın sitokrom P450 metabolik sisteminde enzim indükleme etkisi bulunmamaktadır. Diğerantiepileptiklerin aksine, kendinin ve diğer ilaçların (örneğin östroprogestojen ve oral antikoagülan)metabolizmasını artırmaz. - Sodyum valproat, glukuronidasyon ve beta-oksidasyon yoluyla metabolize olduktan sonra esasolarak idrarla (% 3'ü değişmeden) atılır. - Diğer tıbbi ürünlerle (örn. primidon, fenitoin, fenobarbital ve karbamazepin gibi) birliktekullanımda, enzim indüksiyonuna bağlı olarak yarılanma ömrü 4-9 saate düşebilir. Eliminasyon:- Yarılanma ömrü yaklaşık 15-17 saattir. - Valproat molekülü diyaliz edilebilir fakat hemodiyaliz sadece valproatın kandaki serbest formunuetkiler (yaklaşık % 10). - Literatürden elde edilen sınırlı verilere dayanarak, valproat ve östrojen içeren ürünlerle eş zamanlıtedavi edilen bazı hastalarda valproat serum seviyelerinde bir düşüşe neden olabilecek yaklaşık % 20oranında bir artış rapor edilmiştir. Bireyler arası değişkenlik not edilmiştir. Bu farmakokinetiketkileşimden kaynaklanan sağlam bir farmakokinetik-farmakodinamik ilişkisi kurmak için yeterli veriyoktur.
20/23 Hastalardaki karakteristik özelliklerPediatrik popülasyon: Yeni doğanlarda ve 18 aydan küçük bebeklerde plazma yarılanma ömrü 10-67 saat arasında değişir. En uzun yarılanma ömrü değerleri doğumdan hemen sonra kaydedilmiştir. 2 aylıktan büyükbebeklerde sonuçlar giderek erişkinlere yaklaşır. Geriyatrik popülasyon: Yaşlılarda sodyum valproatın farmakokinetiği değişiyorsa da klinik önemi sınırlıdır ve dozaj nöbetlerin kontrolüne göre düzenlenmelidir. Gebelik: Gebeliğin üçüncü trimestrinde dağılım hacminin artmasıyla, hepatik ve renal klerens artar ve sabit doz uygulanmasına rağmen serum konsantrasyonlarında düşüş görülebilir. Gebelik döneminde plazma proteinlerine bağlanmada değişiklik olabileceği ve serbest (terapötik olarak aktif) valproat düzeylerinin artabileceği de göz önünde bulundurulmalıdır. Karaciğer bozukluğu olan hastalar: Karaciğer bozukluğu olan hastalarda yarılanma ömrü uzar. Doz aşımı halinde, 30 saatin üzerine çıkan yarılanma ömrü değerleri gözlenmiştir. Böbrek bozukluğu olan hastalar: Böbrek bozukluğu olan hastalarda yarılanma ömrü uzar. 5.3. Klinik öncesi güvenlilik verileriAkut toksisite Valproatla farklı hayvan türlerinde gerçekleştirilen akut toksisite testlerinde saptanan LD50 değerleri, oral uygulama sonrasında 1.200-1.600 mg/kg, intravenöz uygulama sonrasında 750- 950 mg/kgolarak bulunmuştur. Tekrarlanan doz toksisitesi Oral uygulamada toksik olmayan doz, sıçanlarda 150-200 mg/kg/gün (diyetle) ve köpeklerde 90 mg/kg/gün'dür. Bu yüksek dozlarda sıçanlarda ve köpeklerde, testis dejenerasyonu, lenfoid foliküllerdeatrofi ve nörolojik bozukluklar (sedasyon, ataksi, tremor) gözlenmiştir. Mutajenik ve karsinojenik potansiyel In vitroin vİvomutajenisite testlerinin bazıları negatif bulunmuştur.Sıçanlarda ve farelerde yapılan karsinojenisite çalışmaları, tolere edilen maksimum doza yakın dozlarda uygulanan valproatın karsinojenik potansiyelinin olmadığını göstermiştir. Sprague Dawley sıçanlarına ve ICR (HA/ICR) farelerine 2 yıl boyunca oral yoldan 80-170 mg/kg/gün dozunda valproik asit uygulanmıştır. Her iki türde de farklı neoplazmlar gözlenmiştir. Başlıcabulgular, yüksek dozda valproik asit alan erkek sıçanlarda, subkutan fibrosarkomaların insidansındaistatistiksel açıdan anlamlı bir artış ve valproik asit alan erkek farelerde, selim akciğer adenomları içinistatistiksel açıdan anlamlı bir doza-bağlı eğilimdi. Bu bulguların insanlar için önemi bilinmemektedirHayvan çalışmaları, uterus içine valproat maruziyetinin sıçanı ve farelerin işitsel sistemlerinde fizikselve fonksiyonel anormalliklere sonuçlandığını göstermiştir.
21/23 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum hidroksit Lycasin Metil-4-hidroksi benzoat (E218) Propil-4-hidroksi benzoat (E216)Sakkarin sodyumSodyum siklamatSodyum klorürAhududu aromasıŞeftali aromasıSaf su 6.2. GeçimsizliklerYeterli veri yoktur. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklıklarında saklayınız. Işıktan korumak için kutusunda saklayınız. 6.5. Ambalajın niteliği ve içeriği100 ml şurup içeren kahverengi cam şişe ve polisitren piston içeren polietilen doz şırıngası. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerHer kullanımdan sonra doz şırıngası demonte edilip durulanıp kurutulmalıdır. Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi atıkların kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİADEKA İLAÇ SANAYİ ve TİCARET AŞ. 55020 - İlkadım/SAMSUN 8. RUHSAT NUMARASI2021/524
22/23 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ İlk ruhsat tarihi: 22.12.2021 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENİLENME TARİHİ
23/23 |
İlaç BilgileriValpomax 50 Mg/ml Pediatrik ŞurupEtken Maddesi: Sodyum Valproat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.