Fenoterix 100 Mcg Aerosol İnhalasyonu, Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFENOTERİX 100 mcg aerosol inhalasyonu, çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her püskürtmede Fenoterol hidrobromür 100.00 mcg Yardımcı maddeler:Yardımcı maddeler için 6.1 'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için ölçülü dozlu aerosol. Plastik aktivatör takılı dozaj valfli konkav tabanlı metal tüp. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarFENOTERİX; - Özellikle amfizem ile birlikte veya tek başına kronik obstrüktif bronşit gibi geri dönüşümlü hava akımı obstrüksiyonu ile geri dönüşümlü hava yolu obstrüksiyonuolan alerjik ya da alerjik olmayan bronşiyal astımın semptomatik tedavisindeendikedir. NOT: Uzun dönemli tedavi gerekli olursa eşzamanlı olarak antiinflamatuar tedavi de uygulanmalıdır. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklıı ve süresiDozaj hastalıın tipine ve şiddetine göre ayarlanmalıdır. Başka türlü reçete edilmedii takdirde, erişkinler ve 6 yaşından büyük çocuklar için aşaıdaki dozlar önerilir: Özellikle amfizem ile birlikte veya tek başına kronik obstrüktif bronşit gibi geri dönüşümlü hava akımı obstrüksiyonu ile geri dönüşümlü hava yolu obstrüksiyonu olan alerjik ya daalerjik olmayan bronşiyal astımın semptomatik tedavisinde her bir inhalasyon dozu arasındaen az 3 saat olmalıdır. Her uygulamada 1-2 puf olmak (ortalama günde 3 kez 1-2 puf) üzere
1/17kullanılabilir. Toplam günlük doz 8 pufu geçmemelidir ve tek seferde uygulanacak maksimum doz 4 puf olmalıdır. Daha yüksek dozlarda ek bir terapötik yarar beklenmez veciddi advers etki gözlenme olasılıı yüksektir. Uzun dönemli tedavi gerekli olursa eşzamanlı olarak antiinflamatuar tedavi de uygulanmalıdır. Özel tedavi notları Bronşiyal astımda tedavi, hastalıın şiddetine göre kademeli olarak yapılmalıdır. Tedavide başarı, düzenli tıbbi kontroller ile takip edilmelidir. Doktor talimatı olmadan hastanın kendi kendine FENOTERİX dozunu arttırması hasta için tehlikelidir. Hastalıın seyrinin tıbbi deerlendirmesi solunum uzaması ve antienflamatuvar tedavinin terapötik başarısı için, tıbbi talimatlara göre günlük kişisel kontrol tıbbi gözetim açısındanönemlidir. Bu kontroller örnein pik akım ölçer ile yapılır. İnhaler cihazının doru şekilde kullanımı tedavinin başarısı için kritik öneme sahiptir. Tedavi süresi hastalıın tipine, şiddetine ve seyrine balıdır. Tedavi süresi doktor tarafından belirlenir. FENOTERİX'in yanlış kullanımını önlemek için, hasta FENOTERİX kullanımı ile ilgili kapsamlı bir şekilde bilgilendirilmeli ve inhalatörün doru kullanımına yönelik tümtalimatlar verilmelidir. Çocuklar FENOTERİX'i sadece doktor reçetesi ile ve yetişkingözetiminde kullanmalıdır. Eer FENOTERİX 3 günden daha uzun bir süredir kullanılmıyorsa, tekrar kullanmadan önce mutlaka boşlua1 kez püskürtme yapılmalıdır. Uygulama şekliFENOTERİX, sadece inhalasyon yolu ile uygulanır. İnhalasyon sırasında hastalar tercihen oturmalı veya ayakta durmalıdır. İnhalasyon spreyi dik konumda kullanım için tasarlanmıştır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezlii:FENOTERİX'in içeriindeki fenoterolün böbrek yetmezlii olan hastalarda kullanımı ile
2/17ilgili veri bulunmamaktadır. Bu nedenle FENOTERİX böbrek yetmezlii olan hastalara uygulanırken dikkatli olunmalıdır. Karacier yetmezlii:FENOTERİX'in içeriindeki fenoterolün karacier yetmezlii olan hastalarda kullanımı ile ilgili veri bulunmamaktadır. Bu nedenle FENOTERİX karacier yetmezlii olan hastalarauygulanırken dikkatli olunmalıdır. Pediyatrik popülasyon:Aşaıdaki dozaj şekli doktor tarafından başka şekilde tavsiye edilmedikçe 4-6 yaş arası çocuklar için geçerlidir. 6 yaş ve üzeri çocuklarda yetişkin dozu uygulanır. Akut astım atakları ve paroksismal dispne Ani bronşiyal spazmların ve nöbetle ilişkili solunum sıkıntısının akut tedavisi için, 1 ölçülü doz (puf) yeterlidir. Uzun süreli tedavi veya nöbet profilaksisi için günde 4 kez 1 puf uygulanır. Öncelikle, solunum sıkıntısının şiddetine ve sıklıına balı olarak her bir bireysel uygulamada pufunzamanı ve dozu seçilmelidir. Özellikle bronşiyal astım sırasında eşzamanlı olarakantiinflamatuar tedavi uygulanmalıdır. Her bir inhalasyon dozu arasında en az 3 saatolmalıdır. Toplam günlük doz 4 pufu geçmemelidir ve tek seferde uygulanacak maksimumdoz 2 puf olmalıdır. Daha yüksek dozlarda ek bir terapötik yarar beklenmez ve ciddi adversetki gözlenme olasılıı yüksektir. Alerji veya egzersizin indükledii bronkospazmın önlenmesi Egzersiz veya alerjenle temastan en az 10-15 dakika önce 1 puf uygulanmalıdır. 4 yaşından küçük çocuklar için bu kullanım şekli uygun deildir. Geriyatrik popülasyon:Veri bulunmamaktadır. 4.3. KontrendikasyonlarFENOTERİX; Fenoterol hidrobromüre veya tıbbi ürünün içerdii yardımcı maddelerden herhangi birinekarşı aşırı duyarlılıı olan hastalarda, Hipertrofik obstrüktif kardiyomiyopatisi ya da taşiaritmisi olan hastalarda kontrendikedir.
3/174.4. Özel kullanım uyarıları ve önlemleriFENOTERİX, şiddetli kalp hastalıı özellikle yeni geçirilmiş kalp krizi ve koroner arter hastalıı olan, kardiyak glikozidleri kullanan, şiddetli ve tedavi edilmemiş hipertansiyonu,anevrizması, hipertroidizmi, diyabetik metabolik durumu ve feokromasitoması olan hastalardasadece eer çok gerekli ise ve çok dikkatli bir şekilde kullanılmalıdır. Paradoksal BronkospazmDier solunum cihazları gibi, FENOTERİX de hayatı tehdit edebilecek paradoksal bronkospazmaya neden olabilir. Paradoksal bronkospazm meydana gelirse, FENOTERİXderhal kesilmeli ve alternatif tedavi ile deiştirilmelidir. Kardiyovasküler etkilerKardiyovasküler yan etkiler, FENOTERİX dahil olmak üzere sempatomimetikler ile ilişkili olabilir. Beta-agonist ile ilişkili miyokard iskemisinin yer aldıı yayınlar ve pazarda iken degözlenen belirtiler mevcuttur. Şiddetli kalp hastalıı olan (örnein iskemik kalp hastalıı,aritmi veya ciddi kalp yetmezlii) FENOTERİX alan hastalar göüs arısı veya kötüleşenkalp hastalıı belirtileri yaşarlarsa tıbbi yardım almalıdır. Solunum sıkıntısı ve göüs arısıgibi semptomların deerlendirilmesine özel olarak dikkat edilmelidir, çünkü bunlar solunumveya kardiyak kökenli olabilir. HipokalemiBeta2-agonist tedavisi ciddi hipokalemiye neden olabilir. Şiddetli astımda özellikle dikkatli olunması gerekir; çünkü hipokalemi, ksantin türevleri, glukokortikosteroidler ve diüretiklerlebirlikte tedavi edilmesiyle daha da kötüleşebilir. Ek olarak, hipoksi hipokaleminin kalp ritmiüzerindeki etkilerini artırabilir. Hipokalemi, digoksin alan hastalarda aritmi duyarlılıını artırabilir. Bu gibi durumlarda, serum potasyum seviyesi kontrol edilmelidir. Akut Artmış DispneHastalara, akut hızla kötüleşen dispnede acil tıbbi yardım almaları gerektii bildirilmelidir. Sürekli kullanım için özel uyarıBelge DoFENOTERİX gibi P2 -agonistlere olan ihtiyacın artması hastalıın kötüleştiinin bir göstergesidir. Böyle bir durumda tedavi doktor tarafından yeniden gözden geçirilmelidir vegerekirse farklı bir antiinflamatuar tedavi ile kombinasyon yapılmalı ya da mevcut mlama Kodu: lZW56ZW56ZW56M0FyZW56SHY3Q3NRZW56 Belge Takip Adresı:https://www.turkiye.gov:ır/saglıkditck-e6ys4/17antiinflamatuar tedavinin dozu deiştirilmeli ya da tedaviye farklı ilaçlar eklenmelidir. Eer, reçete edilen tedaviye ramen hastada tatmin edici bir iyileşme gözlenmezse ya da hastalıkta ilerleme gözlenirse, kombine olarak kullanılan kortikosteroidler gibiantiinflamatuvar ilaçların veya bronşların genişlemesini salayan teofilinin dozunda deişiklikya da kombinasyon ilacında deişiklik yapılıp yapılmamasıyla ilgili doktor tavsiyesine gerekduyulur. Bu durumlarda acilen tıbbi müdahale uygulanmalıdır. Reçete edilen dozdan daha yüksek bir doz kullanımı tehlikeli olabilir. Bronşiyal astım yüksek doz ve uzun süreli inhalasyon için yüksek doz beta2-agonistleri ile tedavi edildiinde ve anti-enflamatuar tedavi yetersiz olduunda, ölümler de dahil olmaküzere, altta yatan hastalıın ciddi komplikasyon riskinin arttıına dair raporlar artmıştır. Nedensel ilişkileri henüz tanımlanamamıştır. Ancak yetersiz antiinflamatuar tedavinin büyük rolü olduu düşünülmektedir. Diabetes mellitusu olan hastalarda yüksek dozda FENOTERİX kullanımı ile kan şekeri seviyeleri artabilir. Bu hastaların yakından takip edilmesi gerekmektedir. Karacier ve böbrek yetmezlii olan hastalarda fenoterol ile yapılmış farmakokinetik çalışma bulunmamaktadır. Bu nedenle bu hastalara FENOTERİX uygulanırken dikkatli olunmalıdır. Çocuklar bu ilacı sadece bir yetişkinin gözetiminde ve doktorun talimatlarına göre kullanmalıdır. Bu tıbbi ürün az miktarda - her püskürtmede 100 mg'dan daha az - etanol (alkol) içerir. FENOTERİX 'in kullanılması, doping kontrollerinde pozitif sonuçlara neden olabilir. 4.5. Dier tıbbi ürünlerle etkileşim ve dier etkileşim şekilleriDier P2-adrenerjikler, metilksantinler (örn. teofilin), antikolinerjikler ve kortikosteroidler FENOTERİX'in etkisini arttırabilir. FENOTERİX'in dier P2-adrenerjikler, metilksantinler(örn. teofilin) ya da sistemik dolaşıma geçen antikolinerjiklerin (örn. pirenzepin içerenpreparasyonlar) birlikte uygulanması advers reaksiyonları (örn. taşikardi, aritmi) arttırabilir. Beta-2 agonistinin yol açtıı hipokalemi, ksantin türevleri, glukokortikoidler ve diüretiklerle birlikte tedavi edilmesiyle daha da kötüleşebilir. Bu, özellikle ciddi hava yolu tıkanıklıı olan hastalarda göz önünde bulundurulmalıdır. Bu gibi durumlarda, özellikle diüretikler ve digitalis 5/17glikozitler ile birlikte uygulandıında, elektrolitlerin kontrolü gereklidir. FENOTERİX P-blokerler ile birlikte eşzamanlı uygulama esnasında, bronkodilatör etkide potansiyel olarak ciddi bir azalma ortaya çıkabilir ve bronkospazmı tetikleyebilir. FENOTERİX ile eşzamanlı uygulama sırasında antidiyabetik ajanların hipoglisemik etkisi azalabilir. Bununla birlikte bunun genellikle sistemik uygulamada (tabletler veyaenjeksiyon/infüzyon olarak) yaygın olduu için daha yüksek dozlarda olması beklenir. Halotan, metoksifluoran veya enfluran gibi halojenli anestetiklerin FENOTERİX ile eşzamanlı kullanımı, şiddetli aritmi ve kan basıncında azalma riskini arttırabilir. Monoamin oksidaz inhibitörleri veya trisiklik antidepresanlar ile eşzamanlı olarak FENOTERİX kullanımı fenoterolün kardiyovasküler sistem üzerine olan etkilerini arttırır. Diüretikler ve dijitaller ile yüksek dozda uygulanan FENOTERİX hipokalemiye neden olur. Bu nedenle elektrolit dengesinin kontrolü önemlidir. Anestezide halojenli anestetiklerin uygulanması planlanıyorsa, anestezi uygulanmaya başlamasından en az 6 saat önce fenoterol kullanımından kaçınılmalıdır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk dourma potansiyeli bulunan kadınlar/Doum kontrolü (Kontrasepsiyon)Çocuk dourma potansiyeli bulunan kadınlarda fenoterol kullanımıyla ilgili herhangi bir veri yoktur. Çocuk dourma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduukabul edilen doum kontrol yöntemleri kullanmalıdır. Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/doum /ve-veya/ doum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebelik dönemindeki hayvanlar ile yapılan çalışmalarda inhale fenoterol ile embriyoda hasar gözlenmemiş olmasına ramen özellikle de gebeliin ilk trimesterinde FENOTERİXkullanılmadan önce dikkatli bir şekilde yarar-risk deerlendirilmesi yapılmalıdır. Fenoterol plasenta bariyerini geçer. Fenoterolün yeni doan üzerindeki advers etkileri ile ilgili veri 6/17bulunm amaktadı r. İnhalasyon yoluyla uygulanan fenoterolün tokolitik etki göstermesi mümkün deildir ancak bu durum tamamen göz ardı edilemez. FENOTERİX gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiFenoterol anne sütüne geçmektedir. Fenoterolün yenidoan üzerinde istenmeyen etkileri olup olmadıı bilinmemektedir. Fenoterol anne sütüne geçtiinden, laktasyon dönemindeFENOTERİX kullanılmadan önce dikkatli bir şekilde yarar-risk deerlendirilmesiyapılmalıdır. FENOTERİX gerekli olmadıkça laktasyon döneminde kullanılmamalıdır. Üreme yetenei/FertiliteFENOTERİX için dourganlık ile ilgili klinik veriler mevcut deildir. Fenoterol ile yapılan klinik olmayan çalışmalar dourganlık üzerinde herhangi bir olumsuz etki göstermemiştir 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine etkilerine yönelik herhangi bir çalışma yapılmamıştır. Bununla birlikte, hastalara FENOTERİX tedavisi sırasında baş dönmesi gibi yan etkilerininolduu bildirilmelidir. Bu nedenle araç ve makine kullanımı konusunda dikkatli olunmalıdır. 4.8. İstenmeyen etkilerTüm ilaçlar gibi FENOTERİX kullanımı ile istenmeyen etkiler gözlenebilir. İstenmeyen etkilerin görülme sıklıı aşaıda belirtilmektedir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Baışıklık sistemi hastalıklarıBilinmiyor: Aşırı duyarlılık reaksiyonları (örnein, kaşıntı, döküntü, purpura, trombositopeni, yüz ödemi) Metabolizma ve beslenme hastalıklarıYaygın olmayan: Hipokalemi (ayrıca ciddi vakalar)
7/17: Hiperglisemi
Seyrek
Hipokalemi özellikle, ksantin türevleri (öm Teofilin), kortikosteroidler ve / veya diüretiklerle tedavi edilen ciddi bronşiyal astımı olan hastalarda belirgin olabilir. Ek olarak, hipoksi,hipokaleminin kalp ritmi üzerindeki etkilerini de etkileyebilir. Bu durumlarda serumpotasyum kontrolleri önerilir. Kan düzeylerinde insülin, serbest ya asitleri, gliserol ve ketoncisimlerinde artışlar gözlenmiştir. Psikiyatrik hastalıklarYaygın olmayan: Mental bozukluklar, uyarılma Bilinmiyor : Sinirlilik Mental bozukluklar, hipereksitabilite, hiperaktif davranış bozuklukları, uyku bozuklukları ve halüsinasyon olarak kendini gösterir. Bu etkiler özellikle 12 yaşa kadar olan çocuklardagözlenmiştir. Sinir sistemi hastalıklarıYaygın: Tremor, baş dönmesi Bilinmiyor: Baş arısı Kardiyak hastalıklarYaygın olmayan: Aritmi, angina şikayetler, ventriküler ekstrasistoller Bilinmiyor : Taşikardi, taşiaritmi,myokard iskemisi Solunum, göüs bozuklukları ve mediastinal hastalıklarYaygın: Öksürük Yaygın olmayan:, Paradoksikal bronkospazm.( Paradoksikal bronkospazm gözlenirse, tedavi hemen sonlandırılmalıdır.) Bilinmiyor: Lokal tahrişler Gastrointestinal hastalıklarYaygın : Bulantı Yaygın olmayan: Mide ekşimesi, kusma Deri ve deri altı doku hastalıklarıYaygın : Terleme Yaygın olmayan: Kaşıntı 8/17Bilinmiyor : Ürtiker, döküntü gibi deri reaksiyonları Kas-iskelet bozukluklar, ba doku ve kemik hastalıklarıYaygın olmayan: Kas krampları Bilinmiyor : Kas zayıflıı, miyalji Böbrek ve idrar hastalıklarıYaygın olmayan: Miksiyon bozuklukları Dier gözlemlerde yaygın olmayan kan basıncı azalması veya artması görülmüştür Şüpheliadvers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak salar. Salık meslei mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiSemptomlar P2-adrenerjiklerin bilinen istenmeyen etkileri doz aşımına göre deişir. Bunlar; yüzde kızarma, uyuşukluk, baş arısı, taşikardi, çarpıntı, aritmi, şoka balı hipotansiyon, artmış kanbasıncı, huzursuzluk, heyecan, göüs arısı, özellikle parmaklarda olmak üzere tüm vücuttaşiddetli titreme ve ekstrasistoller olabilir. Hiperglisemi, hiperlipidemi ve hiperketonemiye neden olabilir. FENOTERIX onaylı endikasyonları için önerilenden daha yüksek bir dozda kullanıldıında, metabolik asidoz ve hipokalemi gözlenmiştir. Oral intoksikasyonun ardından mide bulantısı ve kusmayı içeren gastrointestinal semptomlar meydana gelebilir. TedaviFenoterix ile tedavi mutlaka durdurdurulmalıdır. Asit-baz dengesinin ve elektrolitlerin izlenmesi göz önünde bulundurulmalıdır.
9/17P -5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Obstrüktif Akcier Hastalıı İlaçları, Selektif Beta-2-Adrenoseptör Agonistleri ATC Kodu: R03AC04 Fenoterol, terapötik doz aralıında P2-reseptörler üzerinde seçici olarak direkt etkili bir sempatomimetik ajandır. Pı-reseptörlerin stimülasyonu, daha yüksek bir doz aralıındagerçekleşir. Fenoterol bronşlardaki ve kan damarlarındaki düz kasların gevşemesini salar. Düz kas sisteminin gevşemesi doza baımlıdır. P-agonistin reseptörüne balanabilmesi için adenilsiklaz sisteminin tetiklenmesi gerekir. Adenil siklaz sistemi aktivasyonu guanozin balayanprotein aracılıı ile gerçekleşir. Artan intraselüler cAMP fosforilasyon proteinini (proteinkinaz A) etkiler ve düz kasların gevşemesini salar. Yüksek dozlarda fenoterol çizgili kaslarada etki eder (Tremor). Bunlara ek olarak fenoterol mast hücrelerinden mediatörsalgılanmasını engeller. Fenoterol {0.6 mg) uygulanmasından sonra mukosiliyer klerensindebir artış tespit edilebilir. Fenoterolün kalp üzerine direkt ve/veya refleks olarak inotropik ve kronotropik etkisi bulunmaktadır. Fenoterolün ya ve glukoz metabolizması (lipoliz, glikojenoliz vehiperglisemi) üzerine etkisi ve iskelet sisteminde potasyum alım artışı ile gözlenen rölatifhipokalemi sadece yüksek dozlarda kullanıldıında gözlenen famakolojik etkilerdir. Dierbeta-adrenerjik ajanlarda olduu gibi, QT süresinin uzaması bildirilmiştir. Fenoterol basınçlıgaz inhalasyonu ve çözelti için bunlar zayıftır ve önerilen dozlardan daha yüksek orandagözlenmiştir. Hasta için önemi kanıtlanmamıştır. Myometriumda yüksek younlukta bulunan P2-reseptörler nedeniyle fenoterol uterus kaslarını gevşetir. Bu etki özellikle hamile bayanların uterusunda gözlenir. Fenoterolüntokoliz için dozu bronkospazmolitik için olandan daha yüksektir. Bu nedenle, istenmeyenetkilerin gözlenme oranı daha yüksektir.
10/17FENOTERİX akut astımda ve pulmoner amfizem olan veya olmayan kronik obstrüktif bronşit gibi geri dönüşünlü hava yolu obstrüksiyonu olan dier durumlarda kullanım içinetkili bir bronkodilatördür. Oral uygulamadan sonra, FENOTERİX birkaç dakika içinde 8 saate kadar bir etki süresine sahiptir. FENOTERİX inhalasyonundan sonra obstrüktif akcier hastalıında bronkodilasyon birkaç dakika içinde gerçekleşir. Bronşiyal dilatasyonun etkisi 3 ila 5 saat sürer. 5.2. Farmakokinetik ÖzelliklerGenel özelliklerFenoterolün farmakokinetii, intravenöz, inhale ve oral uygulamalardan sonra incelenmiştir. FENOTERİX terapötik etkisi solunum yolundaki lokal bir etki ile elde eder. Solunum sonrasıkan seviyelerinin farmakodinamik zaman ve tepki erisi ile korelasyonu mevcut deildir. Emilim:İnhalasyon tekniine balı olarak fenoterolün inhalasyonunun ardından %10-30'u solunum sisteminin alt kısımlarına ulaşır ve uygulanan dozun kalan kısmı solunum yolunun üstkısmında kalır. Bu nedenle inhale edilen fenoterolün bir kısmı gastrointestinal sisteme geçer.FENOTERİX solunmasından sonra fenoterolün mutlak biyoyararlanımı % 18.7'dir. İnhalasyonun ardından absorbsiyon oranı %13'tür. Bu oranın %30'u bifazik profilde hızlı bir şekilde absorbe edilir, yarılanma ömrü 11 dk'dır ve %70'i yavaş absorbe edilir, yarılanmaömrü 120 dk'dır. Oral yolla uygulamanın ardından fenoterolün yaklaşık olarak %60'ı absorbeolur. Emilen kısım, yaklaşık % 1:5'1ik bir oral biyoyararlanıma yol açan youn ilk geçişmetabolizmasınna tabi tutulur: Bu nedenle ilacın yutulmuş bölümünün solumadan sonraplazma konsantrasyonuna katkısı düşüktür. Maksimumplazma konsantrasyonlarına 60 - 120 dakika sonra ulaşılır. Daılım:Fenoterol inhalasyonunun ardından kan seviyeleri ile farmakodinamik zaman erisi arasında bir korelasyon bulunmamaktadır. Plazma proteinlerine balanma oranı %40-55'tir. Fenoterolanne sütüne geçer. Fenoterol vücutta yaygın olarak daılır. lntravenöz uygulamadan sonra sabit durumda daılım hacmi (Vss) 1,9, 2,7 1/kg'dır.
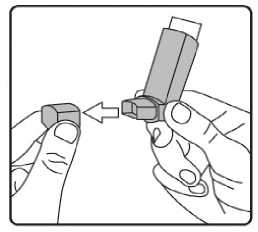
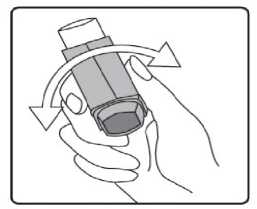
11/17Fenoterolün intravenöz uygulamadan sonra plazmaya verilmesi, 3 bölmeli bir model tarafından yeterince açıklanmıştır. Yarı ömür t ap: 14.3 dak ve ty: 3,2 saattir.Biyotransformasyon:Fenoterol insanlarda sülfatlaşma ve glukuronidasyonla youn şekilde metabolize edilir. Oral uygulamadan sonra, fenoterol, aırlıklı olarak sülfatlaşma ile metabolize edilir. Ana maddeninmetabolik etkisizlii baırsak duvarında başlar. Oral uygulama sonrasında mutlakbiyoyararlanım düşüktür (%1.5 dolayında). Eliminasyon:Biliyer atılımı dahil biyotransformasyon intravenöz uygulamadan sonra 1.1-1.8 L / dk olan ortalama toplam klirensin ana aırlıını (yaklaşık % 85) oluşturur. Fenoterolün renal klerensi(0.27 I / dak), sislemik olarak mevcut bir dozun ortalama toplam klirensinin yaklaşık % 15'inekarşılık gelir. Plazma proteinlerine balı ilacın oranı dikkate alındıında, böbrek klirensininboyutu, glomerüler filtrasyona ek olarak fenoterolün tübüler sekresyonunu gösterir. Oral veintravenöz uygulamadan sonra idrarla salınan toplam radyoaktivite dozu sırasıyla yaklaşık %39 ve % 65'tir, dışkıda salınan toplam radyoaktivite 48 saat içinde dozun % 40.2 ve % 14.8'inioluşturur. Dozun % 0.38'i oral uygulamadan sonra büyük oranda idrarla atılırken, % 15'iintravenöz uygulamadan sonra deişmeden atılır. Ölçülü bir dozaj aerosolü ile solunduktansonra, dozun % 2'si 24 saat içinde renal olarak deişmeden atılır. Fenoterol plasentadan metabolize olmamış bir durumda geçebilir. Fetusta sempatomimetik etkiler oluşabilir. Uzun süreli infüzyonlardan sonra, anne fenoterol konsantrasyonunun %50'sine kadar fetal kanda ölçüm gözlenmiştir. Erken domuş bebeklerde fenoterolelininasyonu yetişkinlerde atılımından önemli ölçüde geç meydana gelir. Fenoterol anne sütüne geçer. Diyabetik metabolizma üzerinde etkisine dair yeterli veri mevcut deildir. Yenidoanlarda ve yaklaşık 20 aya kadar olan bebeklerde, etkisi azalabilir veya olmayabilir. Dorusal/Dorusal olmayan durum:Veri bulunmamaktadır. 5.3. Klinik öncesi güvenlilik verileriAkut toksisite Akut toksisite için hayvanlar üzerinde yapılan araştırmalar herhangi bir özel hassasiyet Belge Do'W56ZW56M0FyZW56SHY3Q3NRZW56 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys12/17Kronik toksisite Kronik toksisite çalışmaları farklı hayvanlar (sıçan, fare, köpek, tavşan) ve farklı uygulama yolları ile gerçekleştirilmiştir. Aşırı yüksek ya da toksik dozlarda miyokard nekrozu tespitedilmiştir. Mutajenik ve tümörojenik potansiyel Fenoterolün in vitro ve in vivo yapılan mutajenite testleri negatif sonuçlanmıştır. Sıçanlara ve farelere fenoterol yüksek dozlarının uzun süreli uygulanması dier P2-sempatomimetiklerdeolduu gibi mezovaryum ve uterusta farklı mitotik aktivitede benign myomlar oluşumunaneden olmuştur. İnsanlar üzerine etkisi bilinmemektedir. Üreme toksisitesi Oral, intravenöz ya da inhalasyon yoluyla hayvanlara uygulanan fenoterol çok yüksek dozlar dışında teratojenik etki göstermemiştir. Sıçanlarda dier embriyotoksik etkiler fenoterolün 7mg/kg/gün'lük oral dozlarında gözlenmeye başlamıştır. Farelerde fenoterolün 38.5mg/kg/gün'lük oral dozlarına kadar embriyotoksik ve teratojenik etkiler gözlenmemiştir.Sıçanlarda tokolitik etkiler 1.75 mg/kg/gün'lük fenoterol dozlarında gözlenmiştir. Fertilite vebüyüyen yavrular etkilenmemiştir. Fenoterolün insanlarda gebelik döneminde kullanımı ile ilgili veriler gebeliin 2. ve 3. dönemi ile sınırlıdır. Fetus ve yenidoanda advers etki saptanmamıştır. Lokal tolerans Fenoterolün inhalasyon yoluyla uygulandıı toksisite çalışmaları, fenoterolün solunum sisteminde lokal olarak iyi tolere edildiini göstermiştir. Buna ek olarak, fenoterolün %0.001-%0.1'lik çözeltilerinin intraarterial, intravenöz, intraoküler ve intranazal uygulanmasınınardından lokal olarak iyi tolere edildii gösterilmiştir. Yapılan bir in vitro çalışmadafenoterolün kan koagülasyonu, hemoliz ya da kırmızı kan hücre direnci üzerine etkisiolmadıı gösterilmiştir. Fenoterolün 20 mg sadece intraoküler fakat epikutan olarak verilmesihafif bir mukozal tahriş göstermiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerSitrik asit (susuz) Etanol(susuz) Belge Do\(HFA)v134av 56shy3Q3nrzw56 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys13/17Saf su 6.2. GeçimsizlikBilinen geçimsizlii yoktur. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklıında saklayınız. Direkt güneş ışıından ve donmaktan koruyunuz. Kullanılmadıı zaman aızlık kapaı sıkıca kapatılmalıdır. Dier inhaler ilaçların çounda olduu gibi aerosol tüpü fazla souk olduunda ilacın terapötik etkisi azalabilir. Aeresol kutusu delinmemeli, boş olsa bile kırılmamalı ve ateşten uzak tutulmalıdır. 6.5. Ambalajın yapısı ve içeriiFENOTERİX 100 mcg aerosol inhaler, 1 veya 3 adet bir toz kapaı donanımlı plastik püskürtücü (aktivatör) içine yerleştirilmiş 200 doz içeren ölçme valfli alüminyum tüp kartonkutuda kullanma talimatı ile birlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmelii ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİWorld Medicine İlaç San ve Tic. A.Ş. Bacılar, İstanbul 8. RUHSAT NUMARASI2021/537 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsatlandırma tarihi: 25.12.2021 Son yenileme tarihi: .. .. .Bu belgeBelge Do10mKÜB'lÜN YENİLEN^METARİHfezW56 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys14/17İnhalasyon spreyinin kullanım talimatı kullanımdan kaçınmak için, hastaya inhalatörün doru kullanımı yönelik tüm talimatlar verilmelidir. lnhalasyonu aşaıdaki talimatlara göre yapınız. lnhalatörün doru kullanımı tedavinin başarısı için belirleyicidir. Uygulama tercihen otururken veya ayakla dururken yapılmalıdır. İnhalasyon spreyinin test edilmesi: İlk kez kullanımdan önce hastalar aızlık kapaını, kapaın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamalı, başparmak aızlıın altındainhalasyon spreyinin tabanında olacak şekilde parmaklar ve başparmak arasında tutulmalı veboşlua 2 defa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır. İnhalasyon spreyi 3 gün veya daha uzun süre kullanılmadıında hastalar aızlık kapaını çıkarmalı, inhalasyon spreyi ile boşlua bir kez sıkım yapılmalıdır. İnhalasyon spreyinizi kullanacaınız zaman oturunuz veya ayakta dik durunuz. 1. İlk resimde gösterildii gibi aızlık kapaını çıkarınız. Aızlıın temiz olduundan emin olmak için içini ve dışını kontrol ediniz. 2. İnhalasyon spreyinizi her kullanımdan önce iyice çalkalayınız. 3. İnhalasyon spreyinizi başparmaınız aızlıın altında, inhalasyon spreyinizin tabanındaolacak şekilde dik tutunuz.
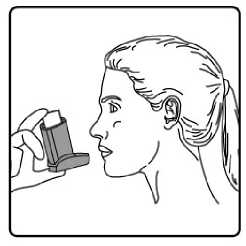
15/17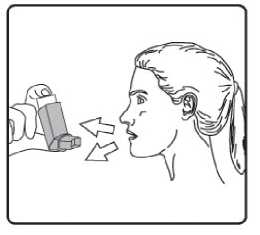
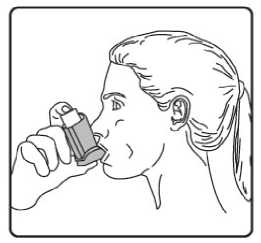
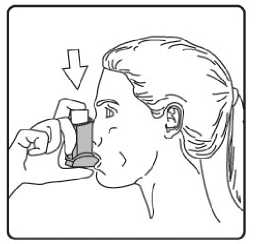
4. Aızlıı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız. 5. Azınızdan yavaş ve derin nefes alınız ve aynı anda bir puf doz boşaltmak için inhalasyonspreyinizin üst kısmına basınız. Şiddetli solunum sıkıntısı nedeniyle derin nefes almakmümkün deil ise önce aız boşluuna 1 puf aerosol püskürtülerek solunumunrahatlatılması daha fazla doru kullanım salanacaktır. 6. Nefesinizi birkaç saniye veya rahatça tutabildiiniz kadar tutunuz ve aızlıı azınızdançıkarıp parmaınızı inhalasyon spreyinizin üst kısmından çekiniz. 7. Her bir puf ilaç alımı arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamaklarıtekrarlayınız. Belge Do&ian&BU«nım4aft\s®nm tozdan k®mmkti£m aızlıın kapamıı ıflem'enkapgitnz.tAızlikkkapaı 16/17doru bir şekilde yerleştirildiinde tam yerine oturacaktır. Eer yerine oturmuyorsa, aızlık kapaını dier yöne çeviriniz. Çok fazla güç uygulamayınız. Hastalar 4, 5 ve 6. basamakları hızlı bir şekilde yapmamalıdır. Hastaların inhalasyon spreyini etkin hale getirmeden hemen önce mümkün olduunca yavaş bir şekilde nefes almayabaşlaması önemlidir. Hastalar aynanın önünde ilk birkaç uygulama için pratik yapmalıdırlar.Eer hastalar inhalasyon spreyinin üstünden veya aızlarının yanından buhar geldiinigörürse, 2. basamaktan itibaren uygulamaya tekrar başlamalıdırlar. inhalasyon spreyinin temizlenmesiİnhalasyon spreyinizi haftada en az bir kez temizleyiniz. 1. Aızlık kapaını çıkarınız. 2. Tüpü plastik gövdeden çıkarmayınız. 3. Kuru bir bez veya kumaş ile aızlıın içini ve dışını ve plastik gövdeyi siliniz. 4. Aızlık kapaını doru bir şekilde yerleştiriniz. Kapaı yerleştirmek için çok fazla güç uygulamayınız. 17/17 |
İlaç BilgileriFenoterix 100 Mcg Aerosol İnhalasyonu, ÇözeltiEtken Maddesi: Fenoterol Hidrobromür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.