Xultophy 100u/ml+3.6mg/ml Sc Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Kalem Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜN ADIXULTOPHY® 100 U/mL+3,6 mg/mL Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Kalem Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:1 mL çözelti, 100 ünite insülin degludek* ve 3,6 mg liraglutid* içerir. *Saccharomyces cerevisiae'de rekombinant DNA teknolojisi ile üretilmiştir.Bir kullanıma hazır kalem, 3 mL çözelti içinde 300 ünite insülin degludek ve 10,8 mg liraglutid içerir. Bir doz adımı, 1 ünite insülin degludek ve 0,036 mg liraglutid içerir. Yardımcı maddeler:Sodyum hidroksit (pH ayarı için) y.m. Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti. Berrak, renksiz, izotonik çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarXULTOPHY®, diyabet tedavisinde kullanılan diğer tıbbi ürünlere ek olarak diyet ve egzersize tamamlayıcı olacak şekilde Tip 2 diabetes mellitus'u yeterince kontrol edilemeyen yetişkinlerintedavisinde endikedir. Kombinasyonlar, glisemik kontrol üzerindeki etkiler ve incelenenpopülasyonlar ile ilgili çalışma sonuçları için bölüm 4.4, 4.5 ve 5.1'e bakınız. 4.2. Pozoloji ve uygulama yöntemiPozoloji/uygulama sıklığı ve süresi:XULTOPHY®, günde bir kez subkütan yolla uygulanmaktadır. XULTOPHY® günün herhangi bir saatinde uygulanabilir; tercihen, her gün aynı saatte uygulanmalıdır. 1 XULTOPHY® dozu, hastanın kişisel ihtiyaçlarına uygun olarak ayarlanmalıdır. Glisemik kontrolün, açlık plazma glukozuna dayanan doz ayarlamalarıyla optimize edilmesiönerilmektedir. Eğer hastanın fiziksel aktivitelerinde artış olursa, olağan diyetinde değişiklik olursa ya da eş zamanlı bir hastalık sırasında dozun ayarlanması gerekebilir. Bir dozunu almayı unutan hastaların bunu fark ettikten sonra dozunu alması ve daha sonra her zamanki gibi günde bir kez doz programına devam etmesi tavsiye edilmektedir. Enjeksiyonlararasında daima en az 8 saatlik bir aralık olmalıdır. Bu, günün aynı saatinde uygulamayapılmasının mümkün olmadığı durumlarda da geçerlidir. XULTOPHY®, doz adımları halinde uygulanmaktadır. Bir doz adımı 1 ünite insülin degludek ve 0,036 mg liraglutid içermektedir. Kullanıma hazır enjeksiyon kalemi, bir doz adımıartışlarla, bir enjeksiyonda 1 ila 50 doz adımı verebilir. XULTOPHY®'ın maksimum günlükdozu 50 doz adımıdır (50 ünite insülin degludek ve 1,8 mg liraglutid). Kalemin üzerindeki dozsayacı, doz adımlarının sayısını göstermektedir. Oral glukoz düşürücü tıbbi ürünlere ek olarakXULTOPHY® için önerilen başlangıç dozu, 10 doz adımıdır (10 ünite insülin degludek ve 0,36 mg liraglutid). XULTOPHY® mevcut oral antidiyabetik tedaviye eklenebilir. XULTOPHY® sülfonilüre tedavisine eklendiğinde, sülfonilüre dozunun düşürülmesi düşünülmelidir (bkz. bölüm 4.4). GLP-1 reseptör agonistinden geçişXULTOPHY® tedavisi başlatılmadan önce, GLP-1 reseptör agonistleriyle yapılan tedavi durdurulmalıdır. Bir GLP-1 reseptör agonistinden geçiş yapıldığı zaman, XULTOPHY® içinönerilen başlangıç dozu 16 doz adımıdır (16 ünite insülin degludek ve 0,6 mg liraglutid) (bkz.bölüm 5.1). Önerilen başlangıç dozu aşılmamalıdır. Eğer bir uzun etkili GLP-1 reseptöragonistinden (örn. haftada bir kez dozlama) geçiş yapılıyorsa, uzatılmış etki düşünülmelidir.XULTOPHY® tedavisi, uzun etkili GLP-1 reseptör agonistinin planlanan bir sonraki dozununalınması gereken anında başlatılmalıdır. Geçiş sırasında ve geçişten sonraki haftalarda yakınglukoz takibi önerilmektedir. Bazal insülin bileşeni içeren herhangi bir insülin rejiminden geçişXULTOPHY® tedavisi başlatılmadan önce, diğer insülin rejimleri ile yapılan tedavi durdurulmalıdır. Bazal insülin bileşeni içeren herhangi bir insülin tedavisinden geçiş yapıldığızaman, XULTOPHY® için önerilen başlangıç dozu 16 doz adımıdır (16 ünite insülin degludekve 0,6 mg liraglutid) (bkz. bölüm 4.4 ve 5.1). Önerilen başlangıç dozu aşılmamalıdır fakat bazıvakalarda hipoglisemiden kaçınmak için azaltılabilir. Geçiş sırasında ve geçişten sonrakihaftalarda yakın glukoz takibi önerilmektedir. Uygulama şekli:XULTOPHY® yalnızca subkütan kullanım içindir. XULTOPHY® intravenöz veya intramüsküler yoldan uygulanmamalıdır. XULTOPHY® subkütan uygulama ile karın, uyluk veya üst kola enjekte edilebilir. Lipodistrofi ve kutanöz amiloidoz riskini azaltmak amacıyla enjeksiyon yerleri aynı bölge içinde sürekli 2 değiştirilmelidir (bkz. bölüm 4.4 ve 4.8). Uygulama ile ilgili ayrıntılı bilgi için, bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:XULTOPHY® hafif, orta derece veya ağır böbrek yetmezliği olan hastalarda kullanılacağı zaman, glukoz monitorizasyonu yoğunlaştırılmalıdır ve insülin dozu, bireysel olarakayarlanmalıdır. Son-dönem böbrek yetmezliği olan hastalarda kullanım için XULTOPHY®önerilmemektedir (bkz. bölüm 5.2). Karaciğer yetmezliği:XULTOPHY® hafif ya da orta derecede karaciğer yetmezliği olan hastalarda kullanılabilir. Glukoz monitorizasyonu yoğunlaştırılmalıdır ve insülin dozu, bireysel olarak ayarlanmalıdır.Liraglutid bileşeninden dolayı, ağır karaciğer yetmezliği bulunan hastalar için XULTOPHY®önerilmemektedir (bkz. bölüm 5.2). Pediatrik popülasyon:XULTOPHY®'ın pediyatrik popülasyonda ilgili kullanımı bulunmamaktadır. Geriyatrik popülasyon (> 65 yaş):XULTOPHY® yaşlı hastalarda kullanılabilir. Glukoz monitorizasyonu yoğunlaştırılmalıdır ve insülin dozu, bireysel olarak ayarlanmalıdır (bkz. bölüm 5.2). Kullanıma hazır kalemin kartuşundan XULTOPHY® bir şırınga ile çekilmemelidir (bkz. bölüm 4.4). Hastalara her zaman yeni bir iğne ucu kullanmaları yönünde talimat verilmelidir. İnsülin kalemi iğne uçlarının tekrar kullanılması, tıkanmış iğne riskini arttırır ve bu da eksik veya aşırıdozlamaya neden olabilir. Tıkanmış iğne durumunda hastalar, kullanma talimatında yer alankullanım kılavuzunda belirtilmiş olan talimatlara uymalıdırlar (bkz. bölüm 6.6). 4.3. KontrendikasyonlarEtkin maddelerden birine ya da her ikisine veya Bölüm 6.1'de yer alan yardımcı maddelerden herhangi birine karşı aşırı duyarlılık. Kendisinde veya aile öyküsünde medüler tiroid karsinomu olan hastalarda veya çoklu endokrin neoplazma sendromu tip 2 olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriXULTOPHY®, Tip 1 diabetes mellitus'lu hastalarda veya diyabetik ketoasidozun tedavisinde kullanılmamalıdır. HipoglisemiXULTOPHY® dozu gerekenden fazla ise hipoglisemi oluşabilir. Öğün atlanması veya planlanmamış ağır fiziksel egzersizler hipoglisemiye neden olabilir. Sülfonilüreylekombinasyonda, sülfonilüre dozunun düşürülmesiyle hipoglisemi riski azaltılabilir. Eş zamanlıböbrek, karaciğer hastalığı ya da adrenal, hipofiz ya da tiroid bezini etkileyen hastalıklar, 3 XULTOPHY® dozunda değişiklik yapılmasını gerektirebilir. Kan glukoz kontrolü çok iyileşen (örn. yoğun tedaviyle) hastaların olağan hipoglisemi uyarı semptomlarında değişim olabilir vebu hastalara bu yönde tavsiye verilmesi gerekmektedir. Olağan hipoglisemi uyarı semptomları(bkz. bölüm 4.8) uzun süreli diyabet hastalarında kaybolabilir. XULTOPHY®'ın uzatılmışetkisi hipogliseminin iyileşmesini geciktirebilir. HiperglisemiYetersiz dozlama ve/veya antidiyabetik tedavinin kesilmesi, hiperglisemiye ve potansiyel olarak hiperozmolar komaya yol açabilir. XULTOPHY® tedavisinin kesilmesi durumunda,alternatif antidiyabetik tedavinin başlatılmasıyla ilgili talimatların izlendiğinden eminolunmalıdır. Ayrıca, başta enfeksiyonlar olmak üzere eş zamanlı hastalıklar, hiperglisemiye yolaçabilir ve böylelikle antidiyabetik tedavi gereksiniminde artışa neden olabilir. Hiperglisemininilk semptomları genellikle saatler veya günler içinde aşamalı olarak ortaya çıkar. Busemptomlar susuzluk, sık idrara çıkma, bulantı, kusma, uyuşukluk, deride kızarıklık ve kuruluk,ağız kuruluğu, iştah kaybı ve ayrıca nefeste aseton kokusudur. Şiddetli hiperglisemi durumlarında, hızlı etkili insülin uygulaması düşünülmelidir. Tedavi edilmeyen hiperglisemi durumları ölümle sonuçlanabilen hiperozmolar koma/diyabetikketoasidoza neden olabilir. Deri ve deri altı doku hastalıklarıHastalara, lipodistrofi ve kutanöz amiloidoz gelişme riskini azaltmak için enjeksiyon bölgesini sürekli rotasyona tabi tutmaları konusunda talimat verilmelidir. Bu reaksiyonların görüldüğübölgelerde insülin enjeksiyonlarını takiben gecikmiş insülin emilimi ve kötüleşmiş glisemikkontrol riski vardır. Enjeksiyon yerinde ani değişiklik yapıp, ciltte etkilenmemiş bir bölgeyeenjeksiyon yapmanın hipoglisemiye neden olduğu bildirilmiştir. Enjeksiyon yerinde etkilenenbir bölgeden etkilenmeyen bir bölgeye değişiklik yapıldıktan sonra kan şekerinin izlenmesiönerilir ve antidiyabetik ilaçların doz ayarlaması düşünülebilir. Pioglitazon ve insülin tıbbi ürünlerinin kombinasyonuÖzellikle kalp yetmezliği gelişimi riski yüksek olan hastalarda, pioglitazon ile insülin tıbbi ürünleri kombinasyon halinde kullanıldığında, kalp yetmezliği vakaları bildirilmiştir.Pioglitazon ve XULTOPHY® kombinasyonu ile tedavi düşünülüyorsa, bu durum göz önündebulundurulmalıdır. Eğer bu kombinasyon kullanılacaksa, hastalar kalp yetmezliği belirti vesemptomları, kilo artışı ve ödem açısından izlenmelidir. Kardiyak semptomlarda herhangi birkötüleşme olduğunda pioglitazon kesilmelidir. Göz bozukluğuXULTOPHY®'ın bir bileşeni olan insülin tedavisinin yoğunlaştırılması ve glisemik kontroldeki ani düzelme, diyabetik retinopatide geçici kötüleşmeye neden olabilir; diğer yandan, glisemikkontrolde uzun süreli düzelme ise diyabetik retinopatinin ilerleme riskini azaltır. Antikor oluşumuXULTOPHY® uygulaması, insülin degludek ve/veya liraglutide karşı antikor oluşumuna yol açabilir. Nadir durumlarda bu antikorların varlığı, hiperglisemi veya hipoglisemiye eğilimindüzeltilmesi için XULTOPHY® dozunun ayarlanmasını gerektirebilir. XULTOPHY®tedavisinin ardından çok az sayıda hasta insülin degludeke spesifik antikorları, insan insüliniyleçapraz etkileşime geçen antikorlar ya da anti-liraglutid antikorları geliştirmiştir. Antikoroluşumu, XULTOPHY®'ın etkililiğinde düşüşle ilişkilendirilmemiştir. 4 Akut pankreatitAkut pankreatit, liraglutid dahil GLP-1 reseptör agonistleri kullanımıyla gözlenmiştir. Hastalar akut pankreatitin karakteristik semptomları ile ilgili bilgilendirilmelidirler. Pankreatitten şüpheleniliyorsa, XULTOPHY® kullanımı durdurulmalıdır; eğer akut pankreatitteşhisi koyulduysa, XULTOPHY®'a tekrar başlanmamalıdır. Tiroid advers olaylarıLiraglutid dahil olmak üzere GLP-1 reseptör agonistleriyle gerçekleştirilen klinik çalışmalarda, özellikle önceden tiroid hastalığı geçirmiş hastalarda, guatr gibi tiroid ile ilgili advers olaylarrapor edilmiştir. Bu nedenle bu hastalarda XULTOPHY® dikkatli kullanılmalıdır. İnflamatuvar bağırsak hastalığı ve diyabetik gastropareziİnflamatuvar bağırsak hastalığı ve diyabetik gastroparezisi olan hastalarda XULTOPHY® ile deneyim bulunmamaktadır. Bu nedenle, bu hastalarda XULTOPHY® kullanımıönerilmemektedir. DehidratasyonXULTOPHY®'ın bir bileşeni olan liraglutid dahil olmak üzere GLP-1 reseptör agonistleriyle yapılan klinik çalışmalarda renal bozukluk ve akut renal yetmezlik dahil olmak üzeredehidratasyon belirti ve semptomları rapor edilmiştir. XULTOPHY® ile tedavi edilen hastalar,gastrointestinal yan etkiler ile ilişkili oluşabilecek potansiyel dehidratasyon riskine karşıuyarılmalı ve sıvı kaybına karşı önlem almaları önerilmelidir. İlaç hatalarından kaçınmaXULTOPHY® ile diğer enjeksiyonluk diyabet tıbbi ürünlerinin yanlışlıkla karıştırılmasını önlemek üzere hastalara, her enjeksiyon öncesinde her zaman enjeksiyon kaleminin etiketinikontrol etmeleri tavsiye edilmelidir. Hastalar, kalemin doz sayacında gösterilen birimleri görsel olarak doğrulamalıdır. Çünkü hastaların kendi kendine enjeksiyon yapabilmeleri için kalem üzerindeki doz sayacınıokuyabilmeleri gerekmektedir. Kör veya görme yeteneği zayıf olan hastalar, görme yeteneğiiyi ve insülin cihazlarını kullanma konusunda eğitim almış kişilerden yardım almalarıkonusunda uyarılmalıdır. Dozlama hatalarından ve potansiyel doz aşımından kaçınmak için, hastalar ve sağlık mesleği mensupları, kullanıma hazır kalemde yer alan kartuştaki tıbbi ürünü ayırmak için asla şırıngakullanmamalıdır. Tıkanmış iğne durumunda hastalar kullanma talimatına eşlik eden kullanım kılavuzunda anlatıldığı şekilde talimatlara uymalıdır (bkz. bölüm 6.6). İncelenmemiş olan popülasyonlar<20 ve >50 ünite bazal insülin dozlarından XULTOPHY®'a geçiş incelenmemiştir. Konjestif kalp yetmezliği NYKD (New York Kalp Derneği) sınıf IV olan hastalarda deneyim bulunmamaktadır ve bu nedenle XULTOPHY®'ın bu hastalarda kullanımı önerilmemektedir. Hipokalemiİnsülin degludek dahil tüm insülin ilaçları, ekstraselülerden intraselüler boşluğa potasyum geçişine neden olarak hipokalemiye yol açar. Tedavi edilmeyen hipokalemi, solunum felcine, 5 ventriküler aritmiye ve ölüme neden olabilir. Hipokalemi riski olan hastalarda (örn. potasyum düşürücü ilaçlar kullanan hastalar, serum potasyum konsantrasyonuna duyarlı ilaçlar alanhastalar) potasyum düzeyleri izlenmelidir. Takip edilebilirlik Biyoteknolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakodinamik etkileşimlerXULTOPHY® ile etkileşim çalışması gerçekleştirilmemiştir. Glukoz metabolizmasını etkileyen birkaç madde bulunmaktadır ve bunlar XULTOPHY® dozunun ayarlanmasını gerektirebilir. Aşağıdaki maddeler XULTOPHY® ihtiyacını azaltabilir: Antidiyabetik tıbbi ürünler, monoamin oksidaz inhibitörleri (MAOİ), beta blokerler, anjiyotensin dönüştürücü enzim (ADE) inhibitörleri, salisilatlar, anabolik steroidler vesülfonamidler. Aşağıdaki maddeler XULTOPHY® ihtiyacını artırabilir: Oral kontraseptifler, tiyazidler, glukokortikoidler, tiroid hormonları, sempatomimetikler, büyüme hormonları ve danazol. Beta blokerler hipoglisemi semptomlarını maskeleyebilirler. Oktreotid/lanreotid, XULTOPHY® ihtiyacını artırabilir ya da azaltabilir. Alkol, XULTOPHY®'ın hipoglisemik etkisini güçlendirebilir ya da düşürebilir. Farmakokinetik etkileşimlerIn vitroveriler, CYP etkileşimi ve proteine bağlanma ile ilgili farmakokinetik ilaç etkileşim potansiyelinin liraglutid ve insülin degludek için düşük olduğunu göstermiştir.Liraglutid ile gastrik boşalmadaki küçük gecikme, eş zamanlı uygulanan oral tıbbi ürünlerin emilimini etkileyebilmektedir. Etkileşim çalışmaları emilimde klinik olarak ilişkili herhangi birgecikme göstermemiştir. Varfarin ve diğer kumarin türevleriHerhangi bir etkileşim çalışması yapılmamıştır. Varfarin gibi çözünürlüğü zayıf veya terapötik indeksi dar olan etkin maddeler ile klinik olarak anlamlı etkileşimler göz ardı edilememektedir.Varfarin veya başka kumarin türevlerini kullanan hastalarda XULTOPHY® tedavisinebaşlandığında daha sık INR (Uluslararası Standartlaştırılmış Oran) takibi önerilmektedir. 6 Parasetamol1000 mg tek dozu takiben liraglutid toplam parasetamol maruziyetini değiştirmemiştir. Parasetamol Cmaks değeri %31 azalmış ve medyan tmaks değeri 15 dakikaya kadar gecikmiştir.Parasetamolün eş zamanlı kullanımında doz ayarlaması gerekmemektedir. Atorvastatin40 mg tek doz atorvastatin uygulamasını takiben liraglutid, toplam atorvastatin maruziyetini klinik olarak anlamlı bir dereceye kadar değiştirmemiştir. Bu nedenle, liraglutid ile birlikteuygulandığında, atorvastatin için doz ayarlaması gerekmemektedir. Liraglutid ile atorvastatinCmaks değeri %38 azalmış ve medyan tmaks değeri 1 ila 3 saate kadar gecikmiştir. Griseofulvin500 mg tek doz griseofulvin uygulamasını takiben liraglutid, toplam griseofulvin maruziyetini değiştirmemiştir. Griseofulvin Cmaks değeri %37 artarken, medyan tmaks değeri değişmemiştir.Düşük çözünürlük ve yüksek geçirgenliğe sahip diğer bileşikler ve Griseofulvin dozununayarlanması gerekmemektedir. DigoksinTek bir doz 1 mg digoksinin liraglutid ile birlikte uygulanması, digoksinin EAA değerinde %16 azalma göstermiştir. Cmaks değeri %31 azalmıştır. Digoksinin medyan tmaks değeri 1 ila 1.5 saatgecikmiştir. Bu sonuçlara göre digoksin dozunda herhangi bir ayarlamaya gerek yoktur. LisinoprilTek bir doz 20 mg lisinoprilin liraglutid ile birlikte uygulanması, lisinoprilin EAA değerinde %15 azalma göstermiştir. Cmaks değeri %27 azalmıştır. Lisinopril medyan tmaks değeri liraglutidile 6 ila 8 saat gecikmiştir. Bu sonuçlara göre lisinopril dozunda herhangi bir ayarlamaya gerekyoktur. Oral kontraseptiflerOral kontraseptif bir ürünün tek doz uygulanmasını takiben liraglutid, etinilöstradiol ve levonorgestrel Cmaks değerlerini sırasıyla %12 ve %13 azaltmıştır. tmaks değerleri, liraglutid ileher iki ürün için 1.5 saat kadar gecikmiştir. Etinilöstradiol veya levonorgestrelin her birinetoplam maruziyet üzerinde klinik olarak anlamlı etki yoktur. Bu nedenle, liraglutid ile beraberuygulandığında, kontraseptif etkide değişiklik olması beklenmemektedir. Özel popülasyonlara ilişkin ek bilgiler:Oral kontraseptiflerden etinilöstradiol ve levonorgestrel ile yapılan çalışma sonuçlarına göre; bu ilaçlar liraglutid ile beraber uygulandığında, kontraseptif etkide değişiklik olmasıbeklenmemektedir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Eğer hasta gebe kalmak istiyorsa veya gebelik oluşursa, XULTOPHY® tedavisi kesilmelidir. 7 Gebelik dönemiXULTOPHY®'ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde insülin degludekle yapılan çalışmalar, gebelik / embriyonal / fetal gelişim/ doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkilerolduğunu göstermemektedir (bkz. bölüm 5.3) Hayvanlar üzerinde liraglutidle yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Eğer hasta gebe kalmak istiyorsa veya gebelik oluşursa, XULTOPHY® tedavisi kesilmelidir. Hastanın hekimine bildirmesi gereklidir. XULTOPHY® gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiLaktasyon döneminde XULTOPHY® kullanımına ilişkin klinik deneyim yoktur. İnsülin degludek ya da liraglutidin insan sütü ile atılıp atılmadığı bilinmemektedir. Yeterli deneyimbulunmaması sebebiyle emzirme döneminde XULTOPHY® kullanılmamalıdır. Sıçanlarda insülin degludek süt ile atılmıştır; sütteki konsantrasyon, plazmadakinden düşük olmuştur. Hayvan çalışmaları liraglutid ve yakın yapısal benzerlikteki metabolitlerinin sütegeçişlerinin düşük olduğunu göstermiştir. Liraglutid ile klinik dışı çalışmalarda, emzirmedönemindeki sıçan yavrularının neonatal gelişiminde tedaviyle ilişkili azalma görülmüştür(bkz. bölüm 5.3). Üreme yeteneği/FertiliteXULTOPHY® ile fertilite ile ilgili klinik deneyim bulunmamaktadır. İnsülin degludek ile gerçekleştirilen hayvan üreme çalışmaları, fertilite üzerinde herhangi bir advers etki ortaya koymamıştır. Canlı implant sayısında hafif azalma dışında, liraglutid ilehayvan çalışmaları fertiliteyle ilgili zararlı etkiler göstermemiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerHastanın konsantre olma ve reaksiyon gösterme becerisi hipogliseminin bir sonucu olarak bozulabilir. Bu durum, bu becerilerin özel önem gösterdiği koşullarda risk oluşturabilir (ör.araba sürme veya makine kullanma). Hastalar araç kullanırken hipoglisemiden kaçınmak için gerekli önlemleri almaları konusunda uyarılmalıdır. Bu durum özellikle hipogliseminin uyarıcı semptomlarını daha az olarak farkeden veya hiç fark edemeyen kişiler için ya da sık sık hipoglisemi atağı geçiren hastalar içinönemlidir. Bu gibi durumlarda araç kullanımının uygunluğu değerlendirilmelidir. 4.8. İstenmeyen etkilerGüvenlilik profilinin özetiXULTOPHY® klinik geliştirme programında, XULTOPHY® ile tedavi edilen yaklaşık 1900 hasta bulunmaktadır. 8 XULTOPHY® tedavisi sırasında en sık bildirilen advers reaksiyon hipoglisemi ve gastrointestinal advers reaksiyonlardır (bkz. aşağıdaki Seçili advers reaksiyonların tanımıbölümü). Advers reaksiyonların tablo halinde listesiXULTOPHY® ile ilişkilendirilen advers reaksiyonlar aşağıda sistem organ sınıfına ve sıklığa göre listelenmiştir. Sıklık kategorileri şu şekilde tanımlanmaktadır: Çok yaygın (>1/10); yaygın(>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çokseyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Tablo 1. Faz 3 kontrollü çalışmalarda bildirilen advers reaksiyonlar
Seçili advers reaksiyonların listesi:HipoglisemiXULTOPHY® dozu, gerektiğinden daha yüksekse hipoglisemi oluşabilir. Şiddetli hipoglisemi, bilinç kaybı ve/veya konvülziyonlara neden olabilir ve beyin fonksiyonlarında geçici ya dakalıcı hasara, hatta ölüme neden olabilir. Hipoglisemi semptomları genellikle birdenbire ortayaçıkar. Bu semptomlar arasında soğuk terleme, soğuk solgun deri, halsizlik, sinirlilik veyatitreme, endişe duygusu, olağan olmayan yorgunluk veya güçsüzlük, konfüzyon, konsantreolmada güçlük, uyuşukluk, aşırı açlık, görme değişiklikleri, baş ağrısı, bulantı ve çarpıntı yeralır. Hipoglisemi sıklıkları için, bkz. bölüm 5.1. 9 Alerjik reaksiyonlarXULTOPHY® kullanımında alerjik reaksiyonlar (ürtiker [XULTOPHY® ile tedavi edilen hastaların %0.3'ü], kızarıklık [%0.7], prürit [%0.5] ve/veya yüzde şişme [%0.2] gibi belirtilerve semptomlarla görülür) bildirilmiştir. Liraglutidin pazarda kullanımı ile hipotansiyon,çarpıntı, dispne ve ödem gibi ilave semptomların eşlik ettiği az sayıda anafilaktik reaksiyonraporlanmıştır. Anafilaktik reaksiyonların yaşamı tehdit etme potansiyeli bulunmaktadır. Gastrointestinal advers reaksiyonlarGastrointestinal advers reaksiyonlar, XULTOPHY® tedavisinin başında daha sık görülebilir ve genellikle tedavi devam ederken birkaç gün ya da hafta içinde yok olmaktadır. Hastaların%7.8'inde bulantı bildirilmiştir ve çoğu hastada geçicidir. Tedavi sırasında herhangi bir noktadaher hafta bulantı bildirilen hastaların oranı %4'ün altındadır. Hastaların sırasıyla %7.5'i ve%3.9'unda diyare ve kusma bildirilmiştir. Bulantı ve diyare sıklığı XULTOPHY® için"Yaygın", liraglutid için "Çok yaygın"dır. Ayrıca, XULTOPHY® ile tedavi edilen hastaların%3.6'sına kadar oranlarda kabızlık, dispepsi, gastrit, abdominal ağrı, gastroözofagal reflühastalığı, abdominal şişkinlik, erüktasyon, flatulans ve iştah kaybı bildirilmiştir. Enjeksiyon bölgesi reaksiyonlarıXULTOPHY® ile tedavi edilen hastaların %2.6'sında enjeksiyon bölgesi reaksiyonları (enjeksiyon bölgesinde hematom, ağrı, hemoraji, eritem, nodüller, şişlik, renk değişikliği,prürit, sıcaklık hissi ve enjeksiyon bölgesinde kitle dahil) ortaya çıkmıştır. Bu reaksiyonlargenellikle hafif ve geçicidir ve normalde, tedavi devam ederken kaybolur. Deri ve deri altı doku hastalıklarıEnjeksiyon bölgesinde lipodistrofi (lipohipertrofi, lipoatrofi dahil) ve kutanöz amiloidoz meydana gelebilir ve lokal insülin absorpsiyonunu geciktirebilir. Belirtilen enjeksiyon alanıiçerisinde enjeksiyon yerinin sürekli olarak değiştirilmesi, bu reaksiyonların gelişme riskiniazaltabilir veya önleyebilir (bkz. bölüm 4.4). Kalp hızında artışXULTOPHY® ile yapılan klinik çalışmalarda, kalp hızında bazala göre dakikada 2 ila 3 atışlık ortalama artış gözlemlenmiştir. LEADER çalışmasında liraglutid (bir XULTOPHY® bileşeni)ile, kalp hızındaki artışın kardiyovasküler olaylar üzerindeki riskine ilişkin uzun süreli kliniketkisi gözlenmemiştir (bkz. bölüm 5.1). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiXULTOPHY® doz aşımıyla ilgili sınırlı veri bulunmaktadır. Hastaya ihtiyacı olandan daha yüksek XULTOPHY® dozu verilmesi durumunda hipoglisemi gelişebilir: Hafif hipoglisemi epizodları oral yoldan glukoz veya şeker içeren diğer ürünler alınarak tedavi edilebilir. Bu nedenle hastanın yanında her zaman şeker içeren ürünlerbulundurması önerilmektedir. 10 Hastanın kendi kendini tedavi edemediği şiddetli hipoglisemi epizodları, eğitimli bir kişi tarafından intramüsküler veya subkütan yolla glukagon verilerek (0.5 - 1 mg) veyabir sağlık mesleği mensubu tarafından intravenöz glukoz uygulanarak tedavi edilebilir.Hasta, glukagon enjeksiyonuna 10-15 dakika içinde yanıt vermezse, glukoz intravenözyolla verilmelidir. Atağın tekrarının önlenmesi amacıyla hastanın bilinci yerinegeldiğinde oral yolla karbonhidrat verilmesi önerilmektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diyabette kullanılan ilaçlar. Enjeksiyon için insülinler ve analoglar, uzun etkili. ATC kodu: A10AE56 Etki mekanizmasıXULTOPHY®, glisemik kontrolü iyileştirmek için birbirini tamamlayan etkiler gösteren insülin degludek ve liraglutid içeren bir kombinasyon ürünüdür. İnsülin degludek, subkütan enjeksiyon sonrasında çözünür çoklu heksamerler oluşturan bazal insülindir, bunun sonucunda insülin degludekin dolaşıma sürekli ve yavaşça emildiği bir depooluşturur, böylelikle insülin etkisinde günden güne düşük değişkenlik gösteren, düz ve stabilglukoz düşürücü etki elde edilir. İnsülin degludek, insan insülin reseptörüne spesifik olarak bağlanır ve insan insülini ile aynı farmakolojik etkileri gösterir. İnsülin degludekin kan glukozunu düşürücü etkisi, insülinin kas ve yağ hücrelerindeki reseptörlere bağlanarak glukoz alınımını kolaylaştırmasına ve buna eş zamanlı olarakkaraciğerden glukoz çıkışını inhibe etmesine bağlıdır. Liraglutid GLP-1 reseptörüne (GLP-1R) bağlanarak aktive eden, insan GLP-1'ine %97 diziliş homolojisi gösteren bir Glukagon Benzeri Peptit-1 (GLP-1) analoğudur. Subkütan uygulamayıtakiben, uzamış etki profili üç mekanizmaya dayanmaktadır: yavaş emilime yol açan birbirinebağlanma, albumine bağlanma ve uzun plazma yarılanma ömrü ile sonuçlanan dipeptidilpeptidaz-IV (DPP-IV) ve nötral endopeptidaz (NEP) enzimlerine karşı daha yüksek enzimatikstabilite. Liraglutid etkisine, GLP-1 reseptörleri ile spesifik bir etkileşim aracılık etmektedir ve bu etki açlık glukozu ve post-prandiyal glukozu düşürerek glisemik kontrolü iyileştirmektedir.Liraglutid glukoza-bağımlı bir şekilde insülin sekresyonunu artırır ve uygunsuz artmış yüksekglukagon seviyelerini de glukoza bağımlı bir şekilde azaltır. Böylece kan glukozu yüksekolduğunda, insülin salımı uyarılır ve glukagon salımı inhibe edilir. Hipoglisemi sırasında isetam tersine liraglutid insülin salımını azaltır, glukagon salımını baskılamaz. Kan glukozunuazaltan mekanizma, ayrıca gastrik boşalmada küçük bir gecikmeye de sebep olur. Liraglutid, açlığın ve enerji alımının azalmasını sağlayan mekanizma ile vücut ağırlığını ve vücut yağ kütlesini azaltır. 11 GLP-1 iştah ve besin alımının fizyolojik bir düzenleyicisidir, ancak etki mekanizması tümüyle netleşmiş değildir. Hayvan çalışmalarında, periferik uygulama sonrası liraglutidin iştahındüzenlendiği spesifik beyin bölgelerine alındığı gösterilmiştir. Bu beyin bölgelerinde liraglutid,GLP-1 reseptörünün (GLP-1R) spesifik aktivasyonu ile spesifik tokluk sinyalinde artışa,spesifik açlık sinyallerinde azalmaya, böylece vücut ağırlığında azalmaya sebep olur. GLP-1 reseptörleri, kalp, damarlar, bağışıklık sistemi ve böbreklerdeki spesifik lokasyonlarda da konumlanmaktadır. Aterosklerotik fare modellerinde, liraglutid aortik plak progresyonunuönlemiştir ve plaktaki enflamasyonu azaltmıştır. Ayrıca liraglutidin, plazma lipidleri üzerine defaydalı etkisi olmuştur. Liraglutid, halihazırda yerleşmiş plakların boyutunu azaltmamıştır. Farmakodinamik etkilerXULTOPHY®'ın farmakodinamik profili stabildir ve etki süresi, insülin degludek ve liraglutidin etki profillerinin günün herhangi bir saatinde yemekle birlikte ya da yemeksizolarak günde bir kez XULTOPHY® uygulanmasını izin veren kombinasyonunu yansıtmaktadır.XULTOPHY® açlık plazma glukoz düzeylerini ve tüm yemeklerden sonraki glukozdüzeylerinin düşük kalmasını sağlayarak glisemik kontrolü iyileştirmektedir. Tek başına ya da pioglitazonla kombinasyon halinde metformin alan kontrolsüz hastalarda yapılan alt çalışmada 4 saatlik bir standart yemek testinde, yemek sonrasındaki glukoz düşüşüteyit edilmiştir. İnsülin degludekle karşılaştırıldığında, XULTOPHY® yemek sonrası plazmaglukozu ekskürsiyonunu (ortalama 4 saatten fazla) belirgin biçimde daha fazla düşürmüştür.Sonuçlar XULTOPHY® ve liraglutid için benzerdir. Klinik etkililik ve güvenlilikXULTOPHY®'ın etkililik ve güvenliliği, daha önce antidiyabetik tedavi almış tip 2 diyabetli gönüllülerin farklı popülasyonlarında 7 randomize, kontrollü, paralel grup faz 3 çalışmasındadeğerlendirilmiştir. Karşılaştırılan tedaviler bazal insülin, GLP-1 RA tedavisi, plasebo ve bazalbolus rejimini içermektedir. Çalışmalar 26 hafta boyunca 199-833 arası XULTOPHY®'arandomize edilen hasta ile yürütülmüştür. Bir çalışma 52 haftaya uzatılmıştır. Tüm çalışmalardabaşlangıç dozu Kısa Ürün Bilgisi'ne göre verilmiş olup, XULTOPHY® için haftada ikititrasyon rejimi kullanılmıştır (bakınız Tablo 2). Karşılaştırılan bazal insülin ürünleri için aynıtitrasyon algoritması kullanılmıştır. Altı çalışmada, XULTOPHY® karşılaştırıldığı ürünlerekıyasla, glikozile hemoglobin A1c (HbA1c) ölçümü ile gösterilen glisemik kontrolde klinik veistatistiksel olarak anlamlı iyileşmeler sağlarken, bir çalışmada her iki tedavi kolunda daHbA1c'nin benzer şekilde azaldığı gösterilmiştir.
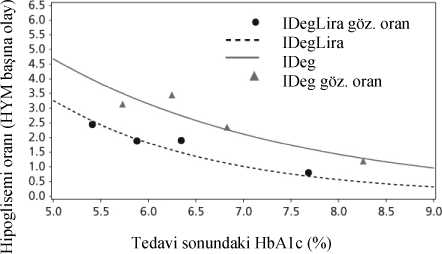
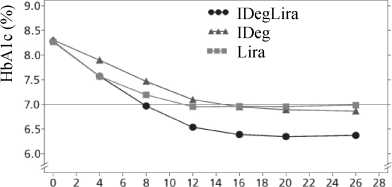
Glisemik kontrol12 Oral glukoz düşürücü tıbbi ürünlere ek olarakXULTOPHY®'ın metformine tek başına veya pioglitazon ile kombinasyon halinde eklendiği 26 haftalık randomize, kontrollü, açık etiketli çalışma, XULTOPHY® ile tedavi edilenhastaların %60.4'ünün, 26 haftalık tedaviden sonra teyit edilmiş hipoglisemi epizodugörülmeden, HbÂ1c <%7 olduğu hedef değerine ulaşmasıyla sonuçlanmıştır. Bu oran, insülindegludekle gözlemlenenden (%40.9, risk oranı 2.28, p<0.0001) belirgin biçimde daha yüksektirve liraglutidle gözlemlenen orana (%57.7, risk oranı 1.13, p=0.3184) benzerdir. Çalışmanıntemel sonuçları Şekil 1 ve Tablo 3'te belirtilmiştir.Teyit edilen hipoglisemi oranları, glisemik kontrolden bağımsız olarak, XULTOPHY®'da insülin degludekten daha düşüktür (bkz. Şekil 1). Bir başka kişinin yardımını gerektiren bir olay olarak tanımlanan şiddetli hipogliseminin hasta yılı başına oranı (hasta yüzdesi), XULTOPHY® için 0.01 (825 hastanın 2'si), insülin degludekiçin 0,01 (412 hastanın 2'si) ve liraglutid için 0.00 (412 hastadan 0'ı) olmuştur. Noktürnalhipoglisemik olayların oranı XULTOPHY® ve insulin degludek tedavisiyle benzerdir. XULTOPHY® ile tedavi edilen hastaların bütününe bakıldığında bu hastalar liraglutid ile tedavi edilen hastalara göre daha az gastrointestinal yan etki yaşamışlardır. Bu, tedavi başlangıcısırasında XULTOPHY® kullanıldığında liraglutidin tek başına kullanılmasına kıyasla,liraglutid bileşeni dozunun daha yavaş artmasından kaynaklanabilir. XULTOPHY®'ın etkililiği ve güvenliliği 52 haftalık tedavi boyunca sürdürülmüştür. Başlangıçtan itibaren 52 hafta boyunca XULTOPHY® ile HbA1c'deki azalma %1.84 olmuşturki, liraglutid ile karşılaştırıldığında %-0.65 tahmini tedavi farkı (p<0.0001) ve insulin degludekile karşılaştırıldığında %-0.46 tahmini tedavi farklılığı olmuştur. XULTOPHY® ve insülin degludek arasındaki -2.80 kg'lık tahmini tedavi farkı (p<0.0001) ile vücut ağırlığı 0.4 kg kadar azalmıştır. Doğrulanmış hipoglisemi oranı, insülin degludek ile karşılaştırıldığındadoğrulanmış hipogliseminin genel riskinde önemli bir azalma sağlayarak, hasta maruziyet yılıbaşına 1.8 vaka olarak kalmıştır.
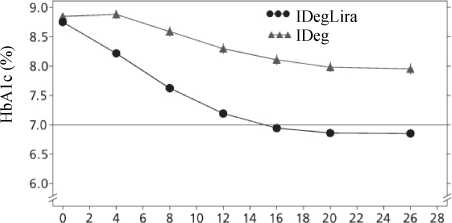
IDegLira=XULTOPHY®, IDeg=insülin degludek, Lira=liraglutid, göz. oran=gözlemlenen oran, HYM=hasta yılı maruziyet Şekil 1. Tek başına ya da pioglitazonla kombinasyon halinde yeterli kontrol sağlanamayan tip 2 diabetes mellitus hastalarda tedavi haftasına göre ortalama HbÂ1c(%) (sol) ve hasta yılı maruziyet başına teyit edilen hipoglisemi oranına göre ortalamaHbA1c(%) (sağ)13 26 haftalık bir randomize, plasebo kontrollü, çift kör bir çalışmada, tek başına ya da metforminle kombinasyon halindeki sülfonilüreye ek olarak XULTOPHY® kullanılmıştır.Çalışmanın önemli sonuçları Şekil 2 ve Tablo 3'te listelenmektedir. 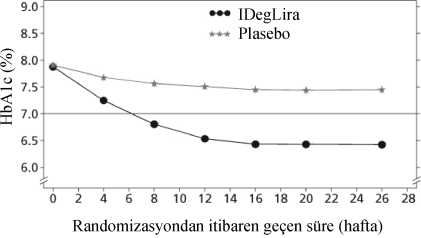 IDegLira=XULT OPHY® Şekil 2. Tek başına ya da metforminle kombinasyon halinde sülfonilüre ile yeterli kontrol sağlanamayan tip 2 diabetes mellitus hastalarında tedavi haftasına göre ortalama HbA1c(%)Şiddetli hipogliseminin hasta yılı maruziyete göre oranı (hasta yüzdesi), XULTOPHY® için 0.02 (288'de 2 hasta), plasebo için 0.00'dır (146'da 0 hasta).
14
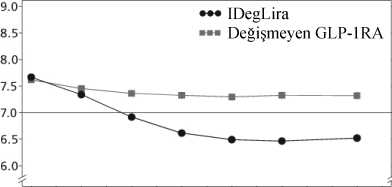
Hem XULTOPHY®, hem de insülin glarjin'in SGLT2i ± OAD'lere eklendiği açık etiketli bir çalışmada XULTOPHY® ve insülin glarjin'in 100 ünite / mL etkililiği ve güvenliliğikarşılaştırıldığında, XULTOPHY® %1.9 düşüşle (% 8.2'den % 6.3'e) glarjin'deki %1.7'likdüşüşe (% 8.4'ten %6.7'ye) kıyasla 26 hafta sonunda ortalama HbA1c düşürmede, %-0.36'lıktedavi farkı ile [-0.50; -0.21] insülin glarjin'e göre üstün bulunmuştur. Başlangıca göre,XULTOPHY® insülin glaıjin ile tedavi edilen hastaların ağırlığındaki ortalama 2.0 kg'lık artışakıyasla -1.92 kg'lık bir tedavi farkı (%95 CI: -2.64; -1.19) ile vücut ağırlığında değişikliğesebep olmamıştır. Şiddetli ya da kan glikozu ile doğrulanmış semptomatik hipoglisemi yaşayan hastaların yüzdesi, XULTOPHY® grubunda %12.9 ve insülin glaıjin grubunda %19.5 (tahmini tedavioranı 0.42 [%95 CI: 0.23; 0.75]) idi. Çalışmanın sonunda ortalama günlük insülin dozu, insülin 15 glarjin ile tedavi edilen hastalar için 54 ünite ve XULTOPHY® ile tedavi edilen hastalar için 36 ünite idi. GLP-1 reseptör agonisti tedavisinden geçişGLP-1 reseptör agonistinden XULTOPHY®'a geçiş, değiştirilmemiş GLP-1 reseptör agonisti tedavisine ( Kısa Ürün Bilgisi'ne göre dozlama) kıyasla 26 haftalık randomize, açık etiketlibir çalışmada incelenmiştir; çalışma, tek başına metforminle (%74.2), pioglitazonlakombinasyon halinde metforminle (%2.5), sülfonilüreyle kombinasyon halinde metforminle(%21.2) ya da pioglitazon ve sülfonilüreyle kombinasyon halinde metforminle (%2.1) GLP 1reseptör agonisti tedavisi altında yeterli kontrol sağlanamayan tip 2 diabetes mellitushastalarında gerçekleştirilmiştir. Çalışmanın önemli sonuçları Şekil 3 ve Tablo 4'te listelenmektedir.
9.08.58.07.57.06.56.0IDegLira=XULTOPHY®, GLP-1 RA=GLP-1 reseptör agonisti Şekil 3. GLP-1 reseptör agonistleriyle yeterli kontrol sağlanamayan tip 2 diabetes mellitus hastalarında tedavi haftasına göre ortalama HbÂ1c (%)Şiddetli hipogliseminin hasta yılı maruziyetine göre oranı (hasta yüzdesi), XULTOPHY® için 0.01 (291'de 1 hasta), GLP-1 reseptör agonistleri için 0.00'dır (199'da 0 hasta).
16
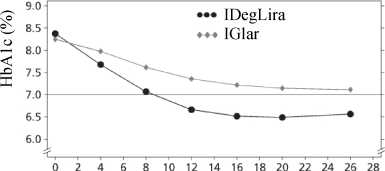
Başlangıç, çalışma sonu ve değişim değerleri, yapılan son gözlemdekilerdir. %95 güven aralıkları '[]' olarak belirtilmiştir. * Teyit edilen hipoglisemi, şiddetli hipoglisemi (başka birinin yardımını gerektiren epizod) ve/veya minör hipoglisemi (plazma glukozu <3.1 mmol/L, semptomlardan bağımsız) olaraktanımlanmaktadır. A XULTOPHY®'ın komparatöre göre üstünlüğünün teyit edildiği bitiş noktaları B p<0.001 Bazal insülin tedavilerinden seçişHastaların insülin glarjinden (100 ünite / mL) XULTOPHY®'a geçişi ya da metformin ve insülin glarjin (20-50 ünite) ile yeterince kontrol edilemeyen hastalarda insülin glarjininyoğunlaştırılması 26 haftalık bir çalışmada çalışılmıştır. Çalışmada izin verilen maksimum dozXULTOPHY® için 50 doz adımı iken, buna karşılık insülin glarjin için maksimum doz yoktu.Karşılaştırmada, XULTOPHY® ile tedavi edilen hastaların %54.3'ü, insülin glarjin ile tedaviedilen hastaların %29.4 ü teyit edilmiş hipoglisemi epizodları görülmeden HbAio <%7 hedefdeğerine ulaşmıştır (risk oranı 3.24, p<0.001) . Çalışmanın önemli sonuçları Şekil 4 ve Tablo 5'te listelenmektedir.
IDegLira=XULTOPHY®, IGlar=insülin glarjin Şekil 4. İnsülin glarjinle yeterli kontrol sağlanamayan tip 2 diabetes mellitus hastalarında tedavi haftasına göre ortalama HbAu (%)
17 Şiddetli hipogliseminin hasta yılı maruziyetine göre oranı (hasta yüzdesi), XULTOPHY® için 0.00 (278'de 0 hasta), insülin glarjin için 0.01'dir (279'da 1 hasta). Noktürnal hipoglisemiolaylarının oranı XULTOPHY® için insülin glarjinle karşılaştırıldığında belirgin biçimde dahadüşüktür (tahmini tedavi oranı 0.17, p<0.001). İkinci bir çalışmada, bazal insülinden XULTOPHY®'a veya insulin degludek'e geçiş, bazal insülin (20-40 ünite) ve metformin ile tek başına veya sülfonilüre/glinidler ile kombinasyonhalinde yeterince kontrol edilemeyen hastalarda 26 haftalık randomize, çift kör bir çalışmadaaraştırılmıştır. Bazal insülin ve sülfonilüre / glinidler randomizasyonda kesilmiştir. İzin verilenmaksimum doz XULTOPHY® için 50 doz adımı ve insülin degludek için 50 ünite olmuştur.XULTOPHY® ile tedavi edilen hastaların %48.7'si HbAic <%7 olan hedef değerine teyitedilmiş hipoglisemi epizodları görülmeden ulaşmıştır; bu oran, insülin degludeklegözlemlenene göre (%15.6) belirgin biçimde daha yüksektir (risk oranı 5.57, p<0.0001).Çalışmanın sonuçları Şekil 5'te ve Tablo 5'te gösterilmiştir.
IDegLira=XULTOPHY®, IDeg=insülin degludek Şekil 5. Bazal insülinle yeterli kontrol sağlanamayan tip 2 diabetes mellitus hastalarında tedavi haftasına göre ortalama HbAu (%)Şiddetli hipogliseminin hasta yılı maruziyetine göre oranı (hasta yüzdesi), XULTOPHY® için 0.01 (199'da 1 hasta), insülin degludek için 0.00'dır (199'da 0 hasta). Noktürnal hipoglisemiolaylarının oranı XULTOPHY® ve insülin degludek tedavilerinde benzerdir.
18
19 B p<0.0001 C p<0.05 D İnsülin glarjin ortalama ön çalışma dozu 32 ünitedir İnsülin glarjin (100 ünite/mL) ve metformin ile kontrolü yetersiz olan tip 2 diabetes mellitus hastaları ile gerçekleştirilen 26 haftalık bir çalışmada, bolus insülin (insülin aspart) ile bazalinsülin (insülin glarjin 100 ünite/mL) kombinasyonu içeren bir bazal-bolus insülin rejimi ilekarşılaştırıldığında XULTOPHY® ile tedavide her iki grupta da HbA1c'de benzer bir düşüşgörülmüştür (her iki grupta da ortalama% 8.2'den %%66-67'sindeHbA1c'de % 7'lik düşüş elde edilmiştir. Başlangıca kıyasla XULTOPHY® ile vücut ağırlığında0.9 kg'lik ortalama bir azalma ve bazal-bolus rejimi ile tedavi edilen hastalarda 2.6 kg'lıkortalama bir artış meydana gelmiştir; tahmini tedavi farklılığı -3.57 kg [95% GA: -4.19; -2.95].Ağır seyreden veya kan glukozu ile doğrulanmış semptomatik hipoglisemi yaşayan hastalarınyüzdesi, XULTOPHY® grubunda % 19.8, bazal-bolus insülin grubunda % 52.6 olmuştur vetahmin edilen oran 0.11 [% 95 GA: 0.08-0.17]'dir. Çalışmanın sonunda günlük toplam insülindozu, bazal-bolus insülin rejimi ile tedavi edilen hastalar için 84 ünite (52 ünite bazal insülinve 32 ünite bolus insülin) ve XULTOPHY® ile tedavi edilen hastalar için 40 ünite olmuştur.Kardiyovasküler güvenlilikXULTOPHY® ile herhangi bir kardiyovasküler sonuç çalışması yapılmamıştır Liraglutid (Victoza® ) Liraglutid'in Diyabetteki Etkisi ve Etkinliği - Kardiyovasküler Sonlanım Sonuçlarının Değerlendirilmesi: LEADER çalışması çok merkezli, plasebo kontrollü, çift-kör bir klinik çalışmadır. 9,340 hasta, kardiyovasküler (CV) risk faktörleri ve HbA1c için standart tedaviye ek olarak liraglutid (4,668)ya da plasebo (4,672) koluna randomize edilmiştir. Çalışma sonunda liraglutid ve plaseboyarandomize katılımcıların sırasıyla %99.7 ve %99.6'sı için vital durum veya primer sonuç bilgisielde edilmiştir. Gözlem süresi minimum 3.5 yıl ve maksimum 5 yıla kadardır. Çalışmapopülasyonuna >65 yaş (n=4,329) ve >75 yaş (n=836) hastalar ile hafif (n=3,907), orta(n=1,934) ve ciddi (n=224) böbrek yetmezliği olan hastalar dahil edilmiştir. Yaş ortalaması 64olup, ortalama BKİ 32.5 kg/m2'dir. Ortalama diyabet süresi 12.8 yıldır. Primer sonlanım noktası, randomizasyondan itibaren herhangi bir majör kardiyovasküler advers olayın ((MACE): CV ölüm, ölümcül olmayan miyokard enfarktüsü veya ölümcülolmayan inme) ilk meydana geldiği zamana dek geçen süredir. Liraglutid plaseboya kıyaslaMACE riskini önlemede anlamlı derecede üstün bulunmuştur.(Şekil 6). 20 Risk Oranı (95% Victoza N Placebo N(%)4668(100)608(13.0)CI)(%)4672(100)694(14.9)Tam Analiz SetiPrimer Sonlanını Noktası - MACE MACE'nin Bileşenleri:Kardiyovasküler Ölüm Ölümcül Olmayan inmeÖlümcül Olmayan Miyokard İnfarktüsüGenişletilmiş MACEGenişletilmiş MACE'deki Ek Bileşenler:Stabil Olmayan Anjina Pektoris (HastaneyeYatış)Koroner Revaskülarizasyon Kalp Yetmezliği (Hastaneye Yatış)Diğer Sekonder Sonlanım Noktaları:Tüm Nedenlere Bağlı Ölüm CV Nedenlere Bağlı Olmayan Ölüm0.87(0.78-0.97)278(6.0)177(3.8) 317(6.8) 1062(22.7)219(4.7)159(3.4)281(6.0)948(20.3)0.78(0.66-0.93)0.89(0.72-1.11)0.88(0.75-1.03)0.88(0.81-0.96)122(2.6)405(8.7) 218(4.7)124(2.7)441(9.4)248(5.3)0.98(0.76-1.26)0.91(0.80-1.04)0.87(0.73-1.05)381(8.2)162(3.5)0.85(0.74-0.97)0.95(0.77-1.18)447(9.6) 169(3.6)0.7 0.80.911.11.2Victoza Lehine Placebo LehineCI: Güven AralığıMACE: Majör Advers Kardiyovasküler Olay %: Olay geçiren hastaların % oranıN: Hasta SayısıŞekil 6. Görülen Kardiyovasküler Olayların Her Biri için Forest Grafiği- Tam Analiz SetiStandart tedaviye eklenen liraglutidle plaseboya kıyasla başlangıçtan 36. aya kadar HbA1c düzeyinde azalma (%-1.16'ya karşı %-0.77; tahmini tedavi farklılığı [TTF] %-0.40 [-0.45; -0.34]) gözlenmiştir. insülin degludek DEVOTE, yüksek kardiyovasküler olay riski altındaki tip 2 diabetes mellitus'lu 7,637 hastada insülin degludek'in kardiyovasküler güvenliliğini insülin glarjin (100 ünite / mL) ilekarşılaştıran, ortalama 2 yıl süreyle devam eden randomize, çift-kör ve olaya-dayalı bir klinikçalışmadır. Primer analiz, randomizasyondan itibaren kardiyovasküler ölüm, ölümcül olmayanmiyokard enfarktüsü veya ölümcül olmayan inme olarak tanımlanan 3 bileşenli majörkardiyovasküler advers olayın (MACE) ilk meydana geldiği zamana dek geçen süredir.Çalışma, insülin degludek'i insülin glarjin'e kıyasla MACE risk oranını, önceden belirlenmiş1.3 risk sınırını dışlamak üzere tasarlanmış bir eşdeğerlilik çalışmasıdır. insülin degludek'ininsülin glarjin ile karşılaştırıldığında kardiyovasküler güvenliliği doğrulanmıştır (HR 0.91[0.78; 1.06]) (Şekil 7). Başlangıçta HbA1c her iki tedavi grubunda da %8.4 bulunmuştur ve 2 yıl sonra HbA1c insülin degludek ve insülin glarjin için de %7.5 olmuştur. 21
İnsülin sekresyonu/beta-hücre fonksiyonuXULTOPHY®, insülin degludek ile karşılaştırıldığında beta-hücre fonksiyonu için homeostaz model değerlendirmesi(HOMA-P)ile ölçüldüğünde beta-hücre fonksiyonunu iyileştirmektedir. Tip 2 diyabetli 260 hastaya uygulanan 52 haftalık tedaviden sonra yapılan bir standart yemek testinde, insülin degludekle karşılaştırıldığında insülin sekresyonunda iyileşmegörülmüştür. 52 haftalık tedaviden daha uzun tedaviye ilişkin veri bulunmamaktadır. Kan basıncıTek başına ya da pioglitazonla kombinasyon halindeki metforminle yeterli kontrol sağlanamayan hastalarda, ortalama sistolik kan basıncı XULTOPHY® ile 1.8 mmHg, insülindegludek ile 0.7 mmHg, liraglutid ile 2.7 mmHg düşmüştür. Tek başına ya da metforminlekombinasyon halinde sülfonilüre ile yeterli kontrol sağlanamayan hastalardaki düşüş,XULTOPHY® ile 3.5 mmHg, plasebo ile 3.2 mmHg'dir. Farklar istatistiksel açıdan anlamlıdeğildir. Bazal insülinle yeterli kontrol sağlanamayan hastalarda gerçekleştirilen üç çalışmada,sistolik kan basıncı XULTOPHY® ile 5.4 mmHg, insülin degludek ile 1.7 mmHg düşmüştür vetahmini tedavi farkı olan -3.71 mmHg istatistiksel açıdan anlamlıdır (p=0.0028); sistolik kanbasıncı XULTOPHY® ile 3.7 mmHg ve insülin glaıjinde 0.2 mmHg düşmüştür ve tahminitedavi farkı olan -3.57 mmHg istatistik açıdan anlamlıdır (p<0.001); sistolik kan basıncıXULTOPHY® ile 4.5 mmHg ve insülin glarjin U100 + insülin aspartta 1.16 mm Hg düşmüştürve tahmini tedavi farkı olan -3.70 mmHg istatistik açıdan anlamlıdır (p=0.0003) 5.2. Farmakokinetik özelliklerGenel özelliklerGenel olarak, ayrı ayrı insülin degludek ve liraglutid enjeksiyonlarıyla karşılaştırıldığında, XULTOPHY® olarak uygulanan insülin degludek ve liraglutidin farmakokinetiği üzerindeklinik açıdan anlamlı bir etki görülmemiştir. Aşağıdaki veriler, tek başına insülin degludek ya da liraglutid uygulamasından elde edildiği belirtilmediği takdirde, XULTOPHY®'ın farmakokinetik özelliklerini yansıtmaktadır. 22 Emilim:İnsülin degludekin toplam maruziyeti, tek başına insülin degludek ve XULTOPHY® uygulamasından sonra eşdeğerdir ancak XULTOPHY® uygulamasında Cmaks değeri %12 dahayüksektir. Liraglutidin toplam maruziyeti, tek başına liraglutid ve XULTOPHY®uygulamasından sonra eşdeğerdir ancak XULTOPHY® uygulamasında Cmaks değeri %23 dahadüşüktür. XULTOPHY® hastaların kan glukozu hedeflerine göre bireysel olarak başlatıldığı vetitrasyon yapıldığı için, bu farkların klinik açıdan anlamlı olduğu düşünülmemektedir. Popülasyon farmakokinetik analizine göre, tam doz aralığında uygulanan XULTOPHY® dozunda insülin degludek ve liraglutid maruziyeti orantısal olarak yükselmektedir. XULTOPHY®'ın farmakokinetik profili günde bir kez dozlama ile tutarlıdır ve insülin degludek ve liraglutidin kararlı durum konsantrasyonuna günlük uygulamanın başlamasından 2-3 günsonra ulaşılmaktadır. Dağılım:İnsülin degludek ve liraglutid plazma proteinlerine geniş ölçüde bağlanmaktadır (sırasıyla >%99 ve >%98). Biyotransformasyon:insülin degludekİnsülin degludekin bozunması insan insülinine benzer; oluşan tüm metabolitleri inaktiftir. LiraglutidSağlıklı gönüllülere tek bir radyoaktif işaretli [3H]-liraglutid dozu uygulamasını takip eden 24 saat boyunca, plazmadaki majör bileşen intakt liraglutid olmuştur. İki minör plazma metabolitisaptanmıştır (toplam plazma radyoaktivite maruziyetinin <%9 ve <%5'i). Liraglutid, majöreliminasyon yolu olarak belirlenen spesifik bir organ olmaksızın büyük proteinlere benzer birmekanizma ile metabolize olur. Eliminasyon:İnsülin degludekin yarı ömrü yaklaşık 25 saattir ve liraglutidin yarı ömrü yaklaşık 13 saattir. Hastalardaki karakteristik özelliklerYaşlı hastalar (> 65 yaş):XULTOPHY® ile tedavi edilen, 83 yaşına kadar yetişkin hastaların dahil olduğu bir popülasyon farmakokinetik veri analizine göre, yaş XULTOPHY®'ın farmakokinetiği üzerinde klinikolarak anlamlı etkiye sahip değildir. Cinsiyet:Popülasyon farmakokinetik analizine göre, cinsiyet XULTOPHY®'ın farmakokinetiği üzerinde klinik olarak anlamlı bir etkiye sahip değildir. 23 Etnik köken:Beyaz, Siyah, Hintli, Asyalı ve Hispanik hastaların dahil olduğu bir popülasyon farmakokinetik analizine göre, etnik köken XULTOPHY®'m farmakokinetiği üzerinde klinikolarak anlamlı bir etkiye sahip değildir.Böbrek yetmezliği:İnsülin degludekSağlıklı gönüllüler ve böbrek yetmezliği olan hastalar arasında insülin degludekin farmakokinetiği açısından fark yoktur. LiraglutidNormal böbrek fonksiyonu olan hastalarla karşılaştırıldığında böbrek yetmezliği olan olgularda liraglutid maruziyeti düşüktür. Liraglutid maruziyeti, hafif (kreatinin klerensi, CrCl 50-80ml/dk), orta (CrCl 30-50 ml/dk) ve şiddetli (CrCl <30 ml/dk) böbrek yetmezliği olan hastalardave diyaliz gerektiren son-dönem böbrek yetmezliği olan hastalarda sırasıyla %33, %14, %27ve %26 oranlarında düşüş göstermiştir. Benzer olarak, 26 haftalık bir klinik çalışmada, tip 2diyabeti ve orta derecede böbrek yetmezliği olan hastaların (CrCL 30-59 ml/dk) liraglutidmaruziyetinin, tip 2 diyabetli ve normal böbrek fonksiyonlu ya da hafif böbrek yetmezliği olanhastaları kapsayan başka bir klinik çalışma ile kıyaslandığında %26 oranında daha düşükolduğu görülmüştür. Karaciğer yetmezliği:İnsülin degludekSağlıklı gönüllüler ve karaciğer yetmezliği olan hastalar arasında insülin degludekin farmakokinetiği açısından fark yoktur. LiraglutidTek-doz çalışmasında, farklı derecelerde karaciğer yetmezliği olan hastalarda liraglutidin farmakokinetiği değerlendirilmiştir. Sağlıklı gönüllülerle karşılaştırıldığında hafif-orta derecekaraciğer yetmezliği olan hastalarda liraglutid maruziyeti %13-23 oranında azalmıştır. Şiddetlikaraciğer yetmezliği olan (Child Pugh skoru >9) hastalarda maruziyet anlamlı derecede dahadüşüktür (%44). Pediyatrik popülasyon:Çocuklarda ve 18 yaşından küçük adölesanlarda XULTOPHY® ile çalışma gerçekleştirilmemiştir. 5.3 Klinik öncesi güvenlilik verileriKlinik geliştirme programını desteklemek amacıyla, insülin degludek/liraglutid klinik dışı geliştirme programı kapsamında, tek bir ilgili tür (Wistar sıçanları) üzerinde 90 güne kadarsürelerde pivot kombinasyon toksisite çalışmaları gerçekleştirilmiştir. Lokal toleranstavşanlarda ve domuzlarda incelenmiştir. Klinik dışı güvenlilik verilerinde, tekrarlayan doz toksisitesi çalışmalarına göre insanlar için güvenlilik endişesi ortaya çıkmamıştır. Tavşanlar ve domuzlarda gerçekleştirilen iki çalışmada görülen lokal doku reaksiyonları, sırasıyla sınırlı ila hafif inflamasyon reaksiyonlarıdır. 24 İnsülin degludek/liraglutid kombinasyonuyla karsinojenez, mutajenez ya da fertikte bozukluğunu inceleme amaçlı çalışma gerçekleştirilmemiştir. Aşağıdaki veriler, insülindegludek ve liraglutidin ayrı olarak incelendiği çalışmalara dayanmaktadır. İnsülin degludekGüvenlilik farmakolojisi, tekrarlayan doz toksisitesi, karsinojenik potansiyel ve üreme toksisitesi çalışmalarına dayanan klinik olmayan veriler insanlar için herhangi bir güvenliliksorunu ortaya koymamıştır. İnsülin degludekin metabolik potensine bağlı mitojenik potansiyelinin oranı insan insülini ile karşılaştırıldığında değişmemiştir. LiraglutidGüvenlilik farmakolojisi, tekrarlayan doz toksisitesi veya genotoksisite üzerine yapılan konvansiyonel çalışmalardan elde edilen klinik dışı veriler insana özel zararların olmadığınıgöstermiştir. Sıçan ve farelerdeki 2-yıllık karsinojenisite çalışmalarında ölümcül olmayan tiroidC-hücreli tümörler görülmüştür. Sıçanlarda, advers etkinin görülmediği düzey (NOAEL)gözlenmemiştir. Bu tümörler 20 ay boyunca tedavi alan maymunlarda görülmemiştir.Kemirgenlerdeki bu bulgulara, kemirgenlerin özellikle duyarlı olduğu, genotoksik olmayan,spesifik GLP-1 reseptörünün aracılık ettiği bir mekanizma sebep olmaktadır. İnsanlar için ilişkimuhtemelen düşüktür ancak tamamen dışlanamaz. Tedaviyle ilişkili başka tümörlerbulunmamıştır. Hayvan çalışmaları liraglutidin doğurganlık üzerine doğrudan zararlı etkileri olduğunu göstermemektedir, ancak en yüksek dozda erken embriyonik ölümler hafifçe artmıştır.Gebeliğin orta döneminde liraglutid dozlaması maternal kilo ve fetal büyümede azalmaylabirlikte benzer etkilerle sıçanların kaburgalarında ve tavşanlarda iskelet değişikliklerine sebepolmaktadır. Sıçanlar liraglutide maruz kaldıklarında neonatal büyüme azalmakta ve bu, yüksekdoz grubunda sütten kesme sonrası dönemde de sürmektedir. Yenidoğan büyümesindekiazalmanın, direkt GLP-1 etkisine bağlı olarak yavrunun süt alımının azalmasından mı, yoksaazalmış kalori alımından kaynaklanan maternal süt üretiminin azalmasından mı kaynaklandığıbilinmemektedir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiGliserol Fenol Çinko asetat Hidroklorik asit (pH ayarı için) Sodyum hidroksit (pH ayarı için) Enjeksiyonluk su 6.2. GeçimsizliklerXULTOPHY®'a ilave edilen maddeler, etkin maddelerin bozunmasına neden olabilir. XULTOPHY®, infüzyon sıvılarına karıştırılmamalıdır. Bu tıbbi ürün başka herhangi bir tıbbi ürünle karıştırılmamalıdır. 25 6.3. Raf ömrü24 ay.İlk kullanımdan sonra6.4. Saklamaya yönelik özel tedbirlerİlk kullanımdan önce:Buzdolabında saklanmalıdır (2°C - 8°C). Dondurucu bölümün uzağında saklanmalıdır. Dondurulmamalıdır. Işıktan korumak için, kalemin kapağı kapalı tutulmalıdır.İlk kullanımdan sonra:30°C ve altında ya da buzdolabında saklanmalıdır (2°C - 8°C). Dondurulmamalıdır. Işıktan korumak için, kalemin kapağı kapalı tutulmalıdır.Tıbbi ürünün ilk kullanımdan sonraki saklama koşulları için bölüm 6.3'e bakınız. 6.5. Ambalajın niteliği ve içeriğiPolipropilen, polikarbonat ve akrilonitril butadiyen stirenden yapılmış, kullanıma hazır, çok dozlu, tek kullanımlık, kullanıma hazır kalem içerisinde piston (halobutil) ve tıpalı(halobutil/poliizopren) kartuş (tip 1 cam) içinde 3 mL çözelti. 1, 3, 5 ve 10'luk çoklu paket (5 kalemlik 2 paket) kullanıma hazır enjeksiyon kalemi içeren ambalaj boyutları. Tüm ambalaj boyutları piyasada mevcut olmayabilir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliği gereklerine uygun olarak imha edilmelidir. Kullanıma hazır kalem, 8 mm uzunluğa ve 32G inceliğe kadar NovoFine®/NovoTwist® iğne uçları ile kullanılmak üzere tasarlanmıştır. Kullanıma hazır kalem sadece bir kişinin kullanımı içindir. Her kullanımdan önce mutlaka yeni bir iğne ucu takılmalıdır. İğne uçları asla yeniden kullanılmamalıdır. Hasta her enjeksiyondan sonra iğne ucunu atmalıdır. Tıkanmış iğne durumunda hastalar kullanma talimatına eşlik eden kullanım kılavuzunda anlatıldığı şekilde talimatlara uymalıdır. Kullanıma yönelik ayrıntılı bilgi için Kullanma Talimatı'na bakınız. 7. RUHSAT SAHİBİ26 Nispetiye Cad. Akmerkez E3 Blok Kat:7 34335 Etiler - İstanbul TürkiyeTel: 0 212 385 40 40Faks: 0 212 282 21 20 8. RUHSAT NUMARASI2018/92 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 19.02.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ27 |
İlaç BilgileriXultophy 100u/ml+3.6mg/ml Sc Enjeksiyonluk Çözelti İçeren Kullanıma Hazır KalemEtken Maddesi: Liraglutid - Insülin Degludek Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.