Eligard 22.5 Mg Enjeksiyonluk Çözelti İçin Sc Toz İçeren Şırınga ve Çözücü İçeren Şırınga Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIELIGARD® 22.5 mg enjeksiyonluk çözelti için s.c. toz içeren şırınga ve çözücü içeren şırınga Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Kullanıma hazır her şırınga 20,87 mg leuprorelin'e eşdeğer miktarda 22,5 mg leuprorelin asetat içerir. Şırınga A: ELIGARD 22.5 mg'ın rekonstitüsyonu için 457 mg steril çözücü içerir. Şırınga B: 29.2 mg leuprorelin asetat içerir. 457 mg çözücü ile karıştırıldıktan sonra 22.5 mg/birim elde edilir. Yardımcı madde(ler):Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti için s.c. toz içeren şırınga ve çözücü içeren şırınga Toz (Şırınga B): Beyaz ila kirli beyaz renkli toz içeren kullanıma hazır şırınga. Çözücü (Şırınga A): Berrak, renksiz ila açık sarı renkli çözücü içeren kullanıma hazır şırınga. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarELIGARD, Hormonal müdahaleye uygun ilerlemiş prostat kanseri tedavisinde Hormonal müdahaleye uygun ve yüksek riskli lokalize ve lokal ileri evre prostatkanserinin radyoterapi ile birlikte kombine tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Erişkin erkek:ELIGARD, üç ayda bir kez derialtı enjeksiyon şeklinde uygulanır. Enjekte edilen solüsyon, üç aylık bir dönem boyunca sürekli leuprorelin asetat salımı sağlayan katı bir depo oluşturur. Kural olarak, ilerlemiş prostat kanserinin ELIGARD ile tedavisi uzun dönemli tedaviyi gerektirmektedir ve remisyon ya da düzelme görüldüğünde bu tedavi kesilmemelidir. ELIGARD, tedaviye verilen yanıtı izlemede uygun deneyime sahip bir sağlık uzmanının gözetiminde uygulanmalıdır. 1 ELIGARD yüksek riskli lokalize ve lokal ileri evre prostat kanserinin radyoterapi ile birlikte kombine tedavisinde neoadjuvan veya adjuvan terapi olarak kullanılabilir. ELIGARD'a verilen yanıt, klinik parametreler yoluyla ve prostat spesifik antijenin (PSA) serum düzeyleri ölçülerek izlenmelidir. Klinik araştırmalarda, testosteron düzeylerininorşiektomi uygulanmamış hastaların büyük bir bölümünde tedavinin ilk 3 günü boyunca arttığıve daha sonra 3-4 hafta içinde tıbbi kastrasyon düzeylerinin altına düştüğü gösterilmiştir.Erişilen kastrasyon düzeyleri, tıbbi ürün tedavisinin sürdürüldüğü dönem boyunca korunmuştur(kastrasyon düzeyi (50 ng/dl) üzerindeki testosteron yükselmeleri <%1). Hasta yanıtınınsuboptimal olması durumunda, serum testosteron düzeylerinin kastrasyon düzeylerine ulaştığıya da bu düzeylerde kaldığı doğrulanmalıdır. Etkililik eksikliğinin sebebi hatalı hazırlama,sulandırma veya uygulama olabileceği için, şüpheli veya bilinen uygulama hataları durumundatestosteron seviyeleri incelenmelidir (Bkz. Bölüm 4.4).Androjen biyosentez inhibitörleri veya androjen reseptör inhibitörleri ile tedaviye uygun, cerrahi kastrasyon yapılmamış, leuprorelin gibi bir GnRH agonisti alan metastatik kastrasyonadirençli prostat kanseri hastalarında GnRH agonisti ile tedaviye devam edilebilir. Uygulama şekli:ELIGARD, sadece bu prosedürlere aşina olan sağlık profesyonelleri tarafından hazırlanmalı, sulandırılmalı ve uygulanmalıdır (Uygulamadan önce tıbbi ürünün sulandırılmasına dairtalimatlar için Bkz. Bölüm 6.6).Eğer ürün düzgün hazırlanmadıysa, uygulanmamalıdır.Diğer benzer ajanlar gibi, karıştırma ve uygulama sürecince eldiven kullanımı önerilmektedir. Kullanıma hazır olarak sunulan iki steril şırınganın içeriği, ELIGARD'ın derialtı enjeksiyon yoluyla uygulanmasından hemen önce karıştırılmalıdır. Deney hayvanı çalışmalarından elde edilen verilere göre intraarteryel ya da intravenöz enjeksiyondan kesinlikle kaçınılmalıdır. Derialtı enjeksiyon yoluyla uygulanan diğer tıbbi ürünlerde olduğu gibi, enjeksiyon yeri periyodik olarak değiştirilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek / Karaciğer yetmezliği:Böbrek veya karaciğer fonksiyon bozukluğu olan hastalarda klinik araştırma yapılmamıştır. Bu nedenle özel bir uyarı bulunmamaktadır. Pediyatrik popülasyon:0-18 yaş arası çocuklarda ELIGARD'ın güvenliliği ve etkililiği ortaya konmamıştır (Bkz. Bölüm 4.3).(Bkz. Bölüm 4.3).Geriyatrik popülasyon:Özel bir uyarı bulunmamaktadır. 4.3 KontrendikasyonlarELIGARD aşağıda belirtilen durumlarda kontrendikedir: 2 Leuprorelin asetata, diğer GnRH agonistlerine ya da yardımcı maddelerden herhangi birinekarşı aşırı duyarlılık halinde Daha önce orşiektomi uygulanmış olan hastalarda (diğer GnRH agonistleri ile olduğu gibi,ELIGARD cerrahi kastrasyon durumunda serum testosteron düzeyinde daha fazla düşüşeneden olmaz) Omurilik kompresyonu bulunan ya da spinal metastaz bulguları olan prostat kanserihastalarında tek başına tedavi olarak uygulanması (Bkz. Bölüm 4.4)4.4 Özel kullanım uyarıları ve önlemleriDoğru sulandırma:Bkz. Bölüm 4.2Bölüm 4.6Androjen deprivasyon tedavisi QT aralığını uzatabilir:QT uzaması geçmişi veya risk faktörü teşkil eden hastalarda ve QT aralığını uzatma ihtimali olan tıbbi ürünleri eşzamanlı kullanan hastalarda (Bkz. Bölüm 4.5)Torsade de pointespotansiyeli dahil olmak üzere fayda riskoranını değerlendirmelidir.Kardiyovasküler hastalıklar:GnRH agonistleri kullanılan erkeklerde, miyokart enfarktüsü, ani kardiyak ölüm ve felç bildirilmiştir. Bildirilen olasılık oranları baz alındığında, risk düşükgörünmektedir ve prostat kanserli hastalarda tedavi belirlenirken kardiyovasküler risk faktörleriile birlikte dikkatle değerlendirilmelidir. GnRH agonistleri alan hastalarda, kardiyovaskülerhastalık gelişmesini düşündüren semptomlar ve işaretler izlenmelidir ve mevcut klinik tedaviyegöre yönetilmelidir.Geçici testosteron artışı:(Bkz. Bölüm 4.8).Tedavi sürdürüldüğünde bu semptomlarıngenellikle azaldığı görülmektedir.Leuprorelin tedavisinden 3 gün önce başlatılan ve tedavinin ilk iki-üç haftası boyunca sürdürülen uygun bir antiandrojenin ilave olarak uygulanması düşünülmelidir. Buuygulamanın, başlangıçta serum testosteron düzeyinde ortaya çıkan artıştan kaynaklanansekelleri önlediği bildirilmiştir. Cerrahi kastrasyonu takiben, ELIGARD erkek hastaların serum testosteron düzeylerinde daha fazla düşüşe yol açmaz. Kemik dansitesi:(Bkz. Bölüm 4.8).Antiandrojen tedavisi, osteoporozdan kaynaklanan kırıkların riskini anlamlı ölçüde artırmaktadır. Bu konu hakkında yalnızca sınırlı veriler mevcuttur. 22 aylık farmakolojikandrojen baskılama tedavisini takiben hastaların %5'inde, 5 ila 10 yıllık tedaviden sonra 3 hastaların %4'ünde osteoporozdan kaynaklanan kırıklar gözlenmiştir. Osteoporozdan kaynaklanan kırık riski, genellikle patolojik kırıklara kıyasla daha yüksektir. Uzun süreli testosteron eksikliği dışında, ileri yaş, sigara içme ve alkollü içki tüketimi, obezite ve yetersiz egzersiz de osteoporoz gelişimini etkileyebilir. Pitüiter apopleksi: Pazarlama sonrası izlemlerde, GnRH agonistlerinin uygulanmasından sonra, çoğunluğu birinci dozdan sonraki 2 hafta içinde, bazıları da birinci saat içinde meydana gelenseyrek hipofizer apopleksi (hipofiz bezi enfarktüsüne sekonder klinik sendrom) olgularıbildirilmişir. Bu olgularda, hipofizer apopleksi ani baş ağrısı, kusma, görmede değişimler,oftalmopleji, değişen mental durum ve bazen kardiyovasküler kollaps şeklinde ortaya çıkmıştır.Acil tıbbi müdahale gerekmektedir.Hiperglisemi ve diyabet:GnRH analogları ile tedavi edilen erkeklerde, hiperglisemi ve diyabet gelişimi riskinde artış bildirilmiştir. Hiperglisemi, diabetes mellitus gelişmesine veya diyabetlihastalarda glisemik kontrolün kötüleşmesine sebep olabilir. Bir GnRH agonisti ile tedavi edilenhastalarda, kan glukoz değeri ve/veya glikozile hemoglobin (HbA1c) periyodik olarakizlenmeli ve hiperglisemi veya diyabet için hali hazırda uygulanan tedavi ile birlikte kontroledilmelidir.Konvülsiyonlar: Pazarlama sonrası raporlarda, predispozan faktör öyküsü olan ya da olmayan leuprorelin asetat tedavisi gören hastalarda konvülsiyon olduğu gözlenmiştir. Konvülsiyonlargüncel klinik pratiğe göre yönetilmelidir.Diğer Durumlar4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriELIGARD ile farmakokinetik ilaç-ilaç etkileşimi araştırmaları yapılmamıştır. Leuprorelin asetat ile diğer tıbbi ürünler arasında herhangi bir etkileşime ilişkin bildirim mevcut değildir. Androjen deprivasyon tedavisi QT aralığını uzatabileceği için, QT aralığını uzattığı bilinen tıbbi ürünler veya Torsade de pointes 'i(Bkz. Bölüm 4.4).Özel popülasyonlara ilişkin ek bilgiler:Herhangi bir etkileşim çalışması bulunmamaktadır. Pediyatrik popülasyon:Herhangi bir etkileşim çalışması bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi : X 4 Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (kontrasepsiyon)ELIGARD kadınlarda kontrendike olduğundan uygulanamaz. Gebelik dönemiELIGARD kadınlarda kontrendike olduğundan uygulanamaz. ELIGARD gebelik döneminde kontrendikedir. Risk özeti Hayvan çalışmalarındaki bulgular ve etki mekanizması baz alındığında, ELIGARD gebe bir kadına uygulandığında fetüste hasara yol açabilir. Gebe kadınlarda, ilaçla ilişkili risk hakkındabilgi sağlayacak bir veri mevcut değildir. ELIGARD tedavisi ile ortaya çıkan, beklenenhormonal değişiklikler gebelik kaybı riskini arttırmaktadır. Hayvan gelişim ve üremeçalışmalarında, sıçanlarda gestasyon boyunca leuprorelin asetat uygulanmasından sonra majörfetal anomaliler gözlenmiştir. Gebe hastalara ve üreme potansiyeli olan kadınlara fetüsüzerindeki potansiyel risk anlatılmalıdır. Hayvan verileri Hayvan gelişim ve üreme çalışmalarında, gestasyon boyunca leuprorelin asetat uygulanmasından sonra maj ör fetal anomallikler gözlenmiştir. Sıçanlarda ve tavşanlarda artmışfetal mortalite ve fetüsün ağırlığında düşüş gözlenmiştir. Fetal mortalitenin etkileri, bu ilacınyol açtığı hormonal seviyedeki değişikliklerin beklenen sonuçlarıdır. Laktasyon dönemiELIGARD kadınlarda kontrendike olduğundan uygulanamaz. ELIGARD'ın güvenliliği ve etkililiği kadınlarda kanıtlanmamıştır. ELIGARD'ın anne sütünde bulunması, emzirilen çocuk üzerindeki etkileri veya süt üretimi üzerindeki etkileri hakkındabilgi bulunmamaktadır. Birçok ilaç anne sütüne geçtiği için ve emzirilen çocukta ELIGARD'ınciddi advers reaksiyon potansiyeli sebebiyle, ilacın anne için önemi göz önünde bulundurarak,emzirmeyi bırakma veya ilacı bırakma kararı alınmalıdır. Üreme yeteneği/FertiliteLeuprorelin asetat, doğal olarak ortaya çıkan gonadotropin salgılatıcı hormon (GnRH)'un sentetik bir nonapeptid agonistidir ve sürekli olarak uygulandığında hipofizer gonadotropinsekresyonunu inhibe eder ve erkeklerde testiküler steroidogenezi baskılar. Sonuç olarak üremeyeteneği geri dönüşlü olarak etkilenir. Etki mekanizması sebebiyle, ELIGARD üretme potansiyeli olan erkeklerde fertiliteyi olumsuz etkileyebilir. 4.7 Araç ve makine kullanımı üzerindeki etkilerELIGARD'ın araç ve makine kullanma yeteneği üzerindeki etkilerine ilişkin araştırmalar yapılmamıştır. Tedavinin olası yan etkileri olan ya da altta yatan hastalıktan kaynaklanan bitkinlik, baş dönmesi ve görme bozuklukları, araç ve makine kullanma yeteneğinin bozulmasına neden 5 olabilir. Bu nedenle hastalar araç ve makine kullanırken dikkatli olmaları konusunda uyarılmalıdır. 4.8 İstenmeyen etkilerELIGARD ile görülen advers reaksiyonlar, yani bazı hormon düzeylerindeki artış ve düşüşler, temel olarak leuprorelin asetatın spesifik farmakolojik etkisine bağlıdır. En sık bildirilen adversreaksiyonlar sıcak basması, bulantı, bitkinlik ve yorgunluk ile enjeksiyon yerindeki geçici lokaliritasyondur. Hafif veya orta sıcak basmaları hastaların yaklaşık %58'inde ortaya çıkmaktadır. İlerlemiş prostat karsinomu olan hastalarda ELIGARD ile yürütülen klinik çalışmalar sırasında aşağıdaki advers reaksiyonlar bildirilmiştir. Aşağıdaki advers reaksiyonlar MedDRA sistem-organ sınıfı ve sıklığına göre şu yaklaşımla rapor edilmiştir: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor) ELIGARD ile yapılan klinik araştırmalarda bildirilen advers reaksiyonlar:Enfeksiyonlar ve enfestasyonlarYaygın :Nazofarenjit Yaygın olmayan : İdrar yolu enfeksiyonu, lokal deri enfeksiyonu Kan ve lenf sistemi hastalıklarıYaygın : Hematolojik değişiklikler (kırmızı kan hücresi sayısı ve hematokritte azalma), anemi (hemoglobinde azalma) Metabolizma ve beslenme hastalıklarıYaygın olmayan : Diabetes mellitusta kötüleşme Psikiyatrik hastalıklarıYaygın olmayan :Anormal rüyalar, depresyon, azalmış libido Sinir sistemi hastalıklarıYaygın olmayan : Sersemlik hali, baş ağrısı, hipoestezi, insomnia, tat alma bozukluğu, koku alma bozukluğu, vertigo Seyrek: Anormal istemsiz hareketler Kardiyak hastalıklarıBilinmiyor : QT uzaması (Bkz. Bölüm 4.4)Vasküler hastalıklarÇok yaygın :Sıcak basması Yaygın olmayan :Hipertansiyon, hipotansiyon Seyrek :Senkop, kollaps Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan :Rinore, dispne Bilinmiyor :İnterstisyel akciğer hastalığı 6 Gastrointestinal hastalıklarYaygın : Bulantı, diyare, gastroenterit/kolit Yaygın olmayan : Konstipasyon, ağız kuruluğu, dispepsi, kusma Seyrek :Şişkinlik, geğirme Deri ve deri altı doku hastalıklarıÇok yaygın :Ekimozlar, eritem Yaygın :Pruritus, gece terlemeleri Yaygın olmayan : Ciltte ıslaklık, terlemede artış Seyrek : Alopesi, deri döküntüsü Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın : Artralji, ekstremite ağrısı, miyalji, rigor, zayıflık Yaygın olmayan :Sırt ağrısı, kas krampları Böbrek ve idrar yolu hastalıklarıYaygın : Seyrek idrara çıkma, idrar yapmada güçlük, dizüri, noktüri, oligüri Yaygın olmayan : Mesane spazmı, hematüri, idrara çıkma sıklığında artış, üriner retansiyon Üreme sistemi ve meme hastalıklarıYaygın : Meme hassasiyeti, testiküler atrofi, testis ağrısı, infertilite, meme hipertrofisi, ereksiyon bozukluğu, penis boyutunda azalma Yaygın olmayan: Jinekomasti, impotans, testiküler bozukluk Seyrek : Meme ağrısı Genel bozukluklar veÇok yaygın Yaygın Yaygın olmayan Seyrek Çok seyrek uygulama bölgesine ilişkin hastalıkları: Yorgunluk, enjeksiyon yerinde yanma, enjeksiyon yerinde parestezi : Bitkinlik, enjeksiyon yerinde ağrı, enjeksiyon yerinde morarma,enjeksiyon yerinde iğne batmaları,: Enjeksiyon yerinde kaşıntı enjeksiyon yerinde endürasyon, letarji, ağrı, ateş : Enjeksiyon yerinde ülserasyon : Enjeksiyon yerinde nekroz AraştırmalarYaygın : Kan kreatinin fosfokinaz artışı, uzamış koagülasyon zamanı Yaygın olmayan : Alanin aminotransferazda artış, kan trigliseridlerinde artış, uzamış protrombin zamanı, kilo artışı Leuprorelin asetat tedavisi ile genellikle ortaya çıktığı bildirilmiş olan diğer advers reaksiyonlar şunlardır; periferik ödem, pulmoner embolizm, palpitasyonlar, miyalji, kas zayıflığı, derihasasiyetinde değişiklik, titreme, döküntü, amnezi ve görme bozuklukları. Bu sınıftakiürünlerin uzun süreli kullanımı ile kas atrofisi gözlenmiştir. Önceden mevcut hipofiz apopleksisinde infarkt hem kısa hem uzun etkili GnRH agonistleri ile tedavi sonrasında seyrek olarak raporlanmıştır. Trombositopeni ve lökopeni de seyrek olarakraporlanan advers reaksiyonlar arasındadır. Glukoz toleransında değişiklikler bildirilmiştir. 7 GnRH agonist analoğunun uygulanmasından sonra konvülsiyonlar bildirilmiştir. (Bölüm 4.4.)ELIGARD enjeksiyonundan sonra bildirilen lokal advers olaylar, derialtı enjeksiyon yoluyla uygulanan benzer ürünlerle ilişkili olarak sıklıkla bildirilen tipik olaylardır. Genel olarak, derialtı enjeksiyonu takiben ortaya çıkan bu lokalize advers olaylar hafiftir ve kısa süreli olarak tanımlanmıştır. GnRH agonist analoğunun uygulanmasından sonra nadiren anaflaktik/anaflaktoid reaksiyonlar bildirilmiştir. Kemik yoğunluğundaki değişikliklerTıbbi literatürde, orşiektomi uygulanan ya da GnRH analogu ile tedavi edilen erkek hastalarda kemik dansitesinin azaldığı bildirilmiştir. Leuprorelin ile uzun dönemli tedavide, osteoporozbelirtilerinde artış gözlenebilmesi beklenebilecek bir durumdur. Osteoporoza bağlı kırıkriskindeki artış konusunda (bkz. Bölüm 4.4.Hastalığın belirti ve semptomlarının alevlenmesiLeuprorelin asetat ile tedavi, ilk birkaç hafta boyunca hastalığın bulgu ve belirtilerinin alevlenmesine neden olabilmektedir. Vertebra metastazları ve/veya üriner obstrüksiyon ya dahematüri gibi sorunların şiddetlenmesi durumunda, zayıflık ve/veya alt ekstremitelerdeparestezi gibi nörolojik sorunlar ya da üriner semptomlarda kötüye gidiş ortaya çıkabilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr4.9 Doz aşımı ve tedavisiELIGARD'ın kötüye kullanılma potansiyeli yoktur ve bu nedenle bilinçli doz aşımı beklenmez. Klinik pratikte leuprorelin asetat ile gerçekleşmiş kötüye ilaç kullanımı veya doz aşımına dairbir bildirim bulunmamaktadır. Ancak ilaca fazla maruz kalımın gerçekleşmesi durumunda, hastanın izlenmesi ve semptomatik destekleyici tedavi uygulanması önerilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grubu: Gonadotropin salıcı hormon analogları ATC kodu: L02AE02. Leuprorelin asetat, doğal olarak üretilen gonadotropin salgılatıcı hormon (GnRH)'un sentetik bir nonapeptid agonistidir. Sürekli olarak uygulandığında hipofizer gonadotropin sekresyonunuinhibe eder ve erkeklerde testiküler steroidogenezi baskılar. Bu etki, tıbbi ürün tedavisininbırakılmasından sonra geri dönüşlüdür. Ancak bu agonist, doğal hormona kıyasla daha büyük 8 bir potense sahiptir ve testosteron düzeylerinin düzelmesine kadar geçen süre hastadan hastaya değişkenlik gösterebilir. Leuprorelin asetatın uygulanması ilk olarak dolaşımdaki luteinleştirici hormon (LH) ve folikül stimüle edici hormon (FSH) düzeylerinde bir artışla sonuçlanır ve bu da erkeklerdeki gonadalsteroidler, testosteron ve dihidrotestosteron düzeylerinde geçici bir artışa yol açar. Leuprorelinasetatın sürekli olarak uygulanması, LH ve FSH düzeylerinde bir düşüşe neden olur. Erkeklerdetestosteron kastrasyon eşiğinden (<50 ng/dL) daha düşük bir düzeye inmektedir. Bu düşüşler,tedavinin başlangıcından sonra üç ila beş hafta içinde ortaya çıkmaktadır. Altıncı aydakiortalama testosteron düzeyleri 10,1 (± 0,7) ng/dL olarak saptanmıştır ve bu, bilateralorşiektomiyi takiben elde edilen düzeylerle karşılaştırılabilir bulunmuştur. Pivotal klinikaraştırmada 22,5 mg'lık tam doz leuprorelin uygulanan bir hasta dışında tüm hastalarda 5haftada, %99'unda 28.güne kadar kastrasyon düzeylerine ulaşılmıştır. Hastaların büyük birçoğunluğunda gözlenen testosteron düzeyleri 20 ng/dL'nin altında kalmıştır, ancak bu düşükdüzeylerin tam yararı henüz saptanmamıştır. PSA düzeyleri altı ayda %98 oranında düşüşgöstermiştir. Uzun dönemli araştırmalar, tedavinin sürdürülmesinin, yedi yıla varan bir dönem boyunca ve tahminen süresiz olarak kastrasyon düzeyinin altında testosteron sağladığını göstermiştir. Klinik çalışma programı sırasında tümör boyutu direkt olarak ölçülmemiştir, ancak ELIGARD için ortalama PSA'da elde edilen %98'lik bir azalma ile dolaylı olarak yararlı bir tümöryanıtının var olduğu saptanmıştır. Lokal ileri evre prostat kanseri olan 970 hasta (ağırlıklı olarak T2c-T4 ve biraz da T1c-T2b patolojik bölgesel nodal hastalığı olanlar) üzerine yapılmış bir faz 3 randomize klinikçalışmada, hastaların 483'ü radyoterapi ile birlikte kısa dönem (6 ay) ve 487'si uzun dönem (3yıl) androjen supresyon tedavisi almıştır. Kısa dönem ve uzun dönem supresyon tedavisi alanhastalar arasında GnRH agonisti (triptorelin veya goserelin) ile birlikte eş zamanlı ve adjuvantedavi sonuçları non-inferiorite açısından karşılaştırılmıştır. 5-yıllık genel mortalite kısa dönemve uzun dönem hastalarında sırasıyla %19 ve %15,2 olarak saptanmıştır. Üst seviye %95,71güven aralığı (GA) 1,79 veya çift yönlü %95,71 GA 1,09-1,85 (non-inferiorite için P=0,65)olan Tehlike Oranı=1,42 değerinde, radyoterapi artı 3 yıllık androjen deprivasyonu sağlayantedavi alanlara kıyasla radyoterapi ile birlikte 6 aylık androjen deprivasyonu sağlayan tedaviyialanlarda daha düşük sağkalım sağladığı gösterilmiştir. Uzun dönem ve kısa dönem tedavialanların 5-yıllık genel sağkalımı değerleri sırasıyla %84,8 ve %81 olarak saptanmıştır. QLQ-C30 ile ölçülen genel yaşam kalitesi değerlerinde ise iki grup arasında anlamlı fark saptanmıştır(P=0,37). Sonuçlarda lokal ileri evre tümörleri olan hastalar ağırlıktadır. Yüksek riskli lokalize prostat kanserindeki endikasyon kanıtları leuprorelin asetatın da dahil olduğu GnRH analogları ile birlikte radyoterapi yapılmış olan çalışmaların sonuçlarınadayanmaktadır. Yayınlanmış olan 5 çalışmanın klinik verileri analiz edilmiştir (EORTC 22863,RTOG 85-31, RTOG 92-02, RTOG 8610, ve D'Amico ve ark., JAMA, 2004). Bu çalışmalarınhepsinde GnRH analogları ile birlikte radyoterapi verilmesinin yararı gösterilmiştir.Yayınlanmış olan çalışmalarda lokal ileri evre prostat kanserli ve yüksek risk lokalize prostatkanserli hastalar için endikasyonlarda net ayırt edici noktalar tespit edilememiştir. Klinik veriler, radyoterapiyi takiben 3 yıllık androjen deprivasyonu sağlayan tedavinin radyoterapi sonrası 6 aylık androjen deprivasyonu sağlayan tedaviye kıyasla daha tercihedilebilir olduğunu göstermektedir. 9 Androjen deprivasyonu sağlayan tedavi önerilen süresi tıbbi kılavuzlarda radyoterapi alan T3-T4 hastalar için 2-3 yıl'dır. 5.2 Farmakokinetik özelliklerGenel özelliklerEmilimİlerlemiş prostat karsinomu hastalarında, ilk enjeksiyonu takiben ortalama serum leuprorelin konsantrasyonları, enjeksiyondan 4,6 saat sonra 127 ng/mL'ye (C maks) ulaşmaktadır. Her birenjeksiyonu takiben ortaya çıkan ilk artıştan sonra (her bir dozdan sonraki 3-84 günler arasındaplato fazı), serum konsantrasyonları nispeten sabit kalmaktadır (0,2-2 ng/mL). Tekrarlanan dozuygulamalarında birikim olduğuna dair herhangi bir kanıta saptanmamıştır. DağılımSağlıklı erkek gönüllülere uygulanan intravenöz bolus enjeksiyonu takiben leuprorelinin ortalama kararlı durum dağılım hacmi 27 litre olarak saptanmıştır. İn vitroolarak insan plazmaproteinlerine bağlanma oranı %43 ila %49 arasında değişmektedir.BiyotransformasyonELIGARD ile hiçbir ilaç metabolizması çalışması yapılmamıştır. EliminasyonSağlıklı erkek gönüllülerde, intravenöz yolla bolus şeklinde uygulanan 1 mg'lık leuprorelin asetat dozunun ortalama sistemik klerensinin 8,34 L/saat ve çift kompartmanlı bir model temelalınarak terminal eliminasyon yarılanma ömrünün ise yaklaşık 3 saat olduğu gösterilmiştir. ELIGARD ile eliminiasyon çalışmaları yapılmamıştır. Doğrusallık /doğrusal olmayan durumEnjekte edilen ELIGARD ürününün etkin maddesi leuprorelin'in farmakokinetik salım profili yavaş salımlı bir polimer formülasyonu özellikleri nedeniyle zaman içinde doğrusal değildir.Her bir ELIGARD dozaj formülasyonu doğrusal olmayan bir salım karakteristiğine sahiptir. 5.3 Klinik öncesi güvenlilik verileriLeuprorelin asetat ile yapılan klinik öncesi araştırmalarda, bilinen farmakolojik özelliklerine dayanarak, her iki cinsiyette de üreme sistemi üzerinde beklenen etkiler elde edilmiştir. Buetkilerin tedavinin kesilmesinden ve uygun bir rejenerasyon döneminden sonra normaledöndüğü gösterilmiştir. Leuprorelin asetat teratojenisite göstermemiştir. Tavşanlarda,leuprorelin asetatın üreme sistemi üzerindeki farmakolojik etkileriyle tutarlı olarak,embriyotoksisite/letalite gözlenmiştir. Karsinojenisite araştırmaları 24 ay süresince sıçanlar ve fareler üzerinde yapılmıştır. Sıçanlarda, 0,6 ila 4 mg/kg/gün şeklindeki dozların derialtı yoluyla uygulanmasından sonra,hipofiz apopleksisinde dozla bağlantılı bir artış gözlenmiştir. Farelerde bu tip bir etkigözlenmemiştir. Leuprorelin asetat ve ilgili üç aylık ürün ELIGARD, in vitroin vivoolarak yürütülen bir dizi analizde mutajenik bulunmamıştır.10 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiÇözücü (Şırınga A) : 75:25 Poli (DL-laktik-ko-glikolit) N-metil-2-pirolidon Toz (Şırınga B) : Bulunmamaktadır 6.2 GeçimsizliklerŞırınga B'de bulunan leuprorelin, yalnızca şırınga A'daki çözücü ile karıştırılmalı ve diğer tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrüAçılmamış ambalaj: 24 ay. Ürün buzdolabından çıkarıldıktan sonra orijinal ambalajında oda sıcaklığında (25 °C'nin altında) dört haftaya kadar saklanabilir. Tablalardan birinin açılmasını takiben, toz ve çözücü hemen kullanıma hazırlanmalı ve hastaya verilmelidir. Steril çözücü ile kullanıma hazırlanan ürün, mikrobiyolojik açıdan ve çözeltinin viskozitesinin zamanla artması sebebiyle derhal uygulanmalıdır. Sadece tek kullanımlıktır. 6.4 Saklamaya yönelik özel tedbirlerBuzdolabında (2°C-8°C arasındaki sıcaklıklarda) ve nemden korumak amacıyla orijinal ambalajında saklayınız. Bu ürün, enjeksiyondan önce oda sıcaklığında olmalıdır. Kullanılmadan yaklaşık 30 dakika önce buzdolabından çıkarılmalıdır. Buzdolabından çıkarıldıktan sonra bu ürün, orijinalambalajında oda sıcaklığında (25 °C'nin altında) dört haftaya kadar saklanabilir. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. 6.5 Ambalajın niteliği ve içeriğiİki kullanıma hazır şırınga vardır; biri toz içeren siklik olefin kopolimer şırınga (Şırınga B) ve diğeri çözücü içeren polipropilen şırınga (Şırınga A) İki şırınga birlikte bir karışım sistemimeydana getirir. Şırınga A termoplastik kauçuk pistona sahiptir ve polietilen veya polipropilen Luer Lock kapakla kapatılmıştır. Şırınga B'nin enjektör ucu kabı bromobütil kauçuktan oluşmaktadır veiki piston ucu klorobutil kauçuktan imal edilmiştir. Bir kit, karton kutu içinde iki adet ısıyla şekillendirilmiş tabladan oluşmaktadır. Bir tabla, kullanıma hazır polipropilen Şırınga A, büyük piston ve nem tutucu poşet içerir. Diğer tabla, 11 kullanıma hazır siklik olefin kopolimer Şırınga B, bir adet steril iğne ve bir adet silikon nem tutucu poşet içerir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. Kullanıma hazırlama: Ürünü, kullanımdan yaklaşık 30 dakika önce buzdolabından çıkararak oda sıcaklığına gelmesini bekleyiniz.İlk olarak hastayı enjeksiyon için hazırlayınız, ardından aşağıdaki talimatları uygulayarak ürünün hazırlığını yapınız. Ürün doğru şekilde sulandırılmadığı takdirdeklinik etkililik görülmeyebilir.Eğer ürün uygun teknik kullanılarak hazırlanmadıysa, ürünün hatalı sulandırılması sebebiyle olabilecek klinik etkililik eksikliğinden dolayı ürün hastaya uygulanmamalıdır.Diğer benzer ajanlar gibi, karıştırma ve uygulama sürecince eldiven kullanımı önerilmektedir. Adım 1:Her iki tablayı açın (folyoyu, küçük bir baloncuk ile belirginleştirilmiş köşeden yırtın) ve içindekileri (Şırınga A (Şekil 1.1) ve Şırınga B'yi (Şekil 1.2) içeren iki tabla) temiz bir alanaboşaltın Nem çekici torbaları atın.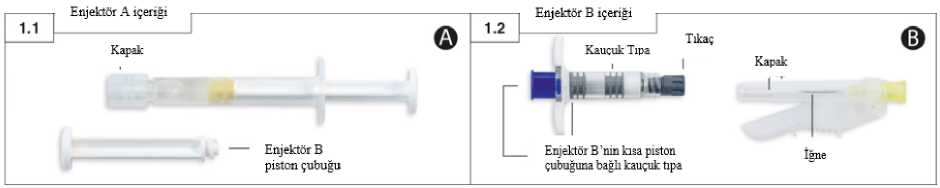
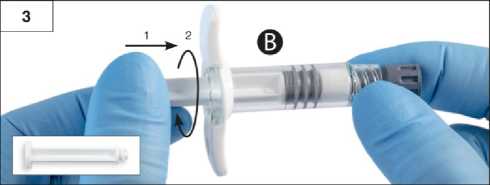
Adım 2:çekin. İki tıpayı çevirerek açmaya çalışmayınİki tıpa da takılı iken ürünükarıştırmaya çalışmayın!ÇekinAdım 3:Şırınga B beyaz piston çubuğunu, Şırınga B'de kalan gri tıpaya nazikçe sıkın (Şekil 3).12 Adım 4:Şırınga B'de gri renkli kauçuk kapağı çıkarın ve enjektörü bırakın (Şekil 4).ÇekinAdım 5:Sıvı sızmaması için Şırınga A'yı dikey konumda tutun ve Şırınga A'dan şeffaf kapağı çevirerek çıkarın (Şekil 5).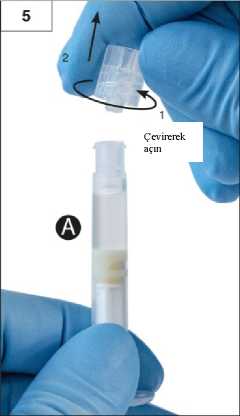
Adım6:Aşırı sıkmayın.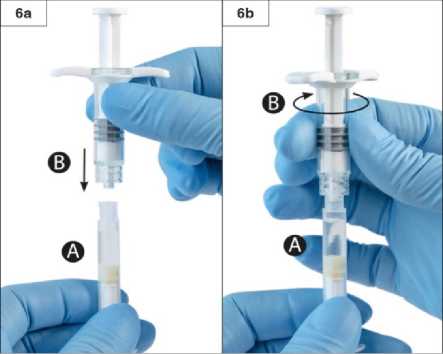
13 Adım7:Bağlanan üniteyi ters çevirin ve Şırınga A'nın sıvı içeriğini tozu (leuprorelin asetat) içeren Şırınga B'ye enjekte ederken Şırınga B altta olacak şekilde enjektörleri dikey şekildetutmaya devam edin (Şekil 7).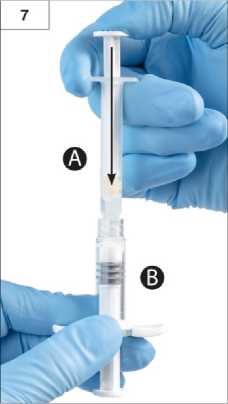
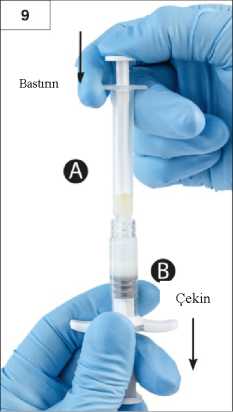
Adım 8:Tamamen karıştığında viskoz çözelti renksiz ila beyaz veya açık sarı (beyaz ila açık sarının tonları dahil) renk alacaktır.Önemli: Ürün zaman geçtikçe daha viskoz bir hale geldiğinden, karıştırdıktan sonra hemen bir sonraki adıma geçiniz. Karıştırılmış ürünü soğutucuya koymayın.Lütfen dikkat: Ürün, anlatıldığı şekilde karıştırılmalıdır; çalkalama işlemi ürünün yeterince karışmasını SAĞLAMAZ. Adım 9:Şırınga B altta olacak şekilde enjektörleri dikey konumda tutun. Enjektörler güvenli şekilde birleşmiş kalmalıdır. Şırınga A pistonuna bastırarak ve Şırınga B pistonunu hafifçeçekerek, karıştırılmış ürünün tamamını Şırınga B'ye (kısa, geniş enjektör) çekin (Şekil 9).14 Adım 10:Şırınga A pistonunu bastırmaya devam ederken Şırınga A'yı çevirerek çıkarın (Şekil 10). Ürünün sızmadığından emin olun; aksi halde iğne, takıldığında tam olarak sabitlenmez.Lütfen dikkat: Formülasyonda bir tane büyük veya birkaç tane küçük hava kabarcığı kalabilir, bu kabul edilebilir bir durumdur. Ürün kaybolacağından lütfen bu aşamada Şırınga B'dekihava kabarcıklarını püskürtmeyin!Adım 11: Şırınga B'yi dik konumda tutun ve ürün kaybını engellemek için beyaz pistonu arkadandestekleyin. Arka kağıt etiketini soyarak güvenlik iğnesi paketini açın ve güvenlik iğnesini çıkartın.Hareketli güvenlik kalkanından çıkarmayınız. Enjektörü tutarak güvenlik iğnesini Şırınga B'ye sabitleyin ve iğne sabitlenene kadarsaat yönünde yaklaşık üç çeyrek tur hafifçe döndürün. (Şekil 11) İğne başlığında meydana gelecek herhangi bir çatlak enjeksiyon esnasında sızıntıya neden olabileceğinden dolayı iğne gereğinden fazla sıkmayın. 15 İğne başlığının çatlaması, hasar görmesi veya herhangi bir sızıntı olması halinde ürün kullanılmamalıdır. Hasarlı iğne yenisi ile değiştirilmemeli ve ürün enjekte edilmemelidir. Tümürün güvenli bir şekilde imha edilmelidir. İğne başlığının hasar görmesi halinde yeni bir ikame ürün kullanılmalıdır. Adım 12:Önemli: Uygulamadan önce güvenlik iğnesi mekanizmasını çalıştırmayın.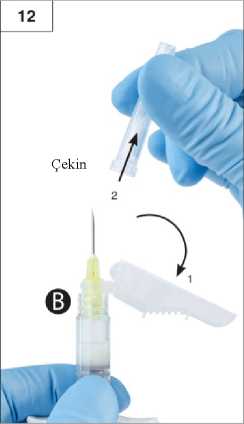
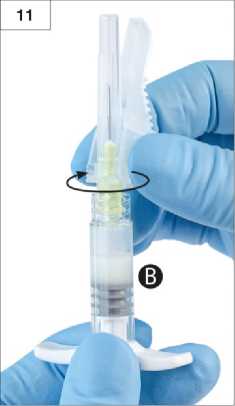
Adım 13:Uygulama öncesinde, Şırınga B'deki büyük hava kabarcıklarını püskürtün. Güvenlik kalkanını iğneden uzaktayken ürünü subkutan yolla uygulayın. Şırınga B'deki ürününtamamının enjekte edildiğinden emin olun.Adım 14:Enjeksiyonun ardından, aşağıda listelenen aktivasyon yöntemlerinden birini kullanarak güvenlik kalkanını kilitleyin.16 1. Düz zemin üzerinde kapatmaİğneyi kapatmak ve güvenlik kalkanını kilitlemek için güvenlik kalkanını, düz tarafı aşağı gelecek şekilde düz bir yüzeye bastırın (Şekil 14.1a ve b). Kilitlendiğini, elinizle ve çıkan "klik" sesi ile kontrol edin. Kilitli konum iğne ucunu tamamen kapatacaktır (Şekil 14.1b). 14.1a14.1b2. Parmağınızla kapatmaParmağınızı güvenlik kalkanının üzerine koyun (Şekil 14.2a), iğne ucunu kapatın ve güvenlik kalkanını kilitleyin. Kilitlendiğini, elinizle ve çıkan "klik" sesi ile kontrol edin. Kilitli konum iğne ucunu tamamen kapatacaktır (Şekil 14.2b). 14.2b14.2aAdım 15: Güvenlik kalkanı kilitlendiğinde, derhal iğneyi ve enjektörü, onaylı bir tıbbi atık kutusuna atın.17 7. RUHSAT SAHİBİRecordati İlaç San. ve Tic. A.Ş. Ç.O.S.B. Karaağaç Mah. Atatürk Cad. No:36 Kapaklı / TEKİRDAĞ Tel: 0 282 999 16 00Faks: 0 282 999 16 61 8. RUHSAT NUMARASI2022/127 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 19.03.2022 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENİLENME TARİHİ18 |
İlaç BilgileriEligard 22.5 Mg Enjeksiyonluk Çözelti İçin Sc Toz İçeren Şırınga ve Çözücü İçeren ŞırıngaEtken Maddesi: Leuprorelin Asetat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.